通用型抗CD22嵌合抗原受体工程化的免疫细胞的制作方法
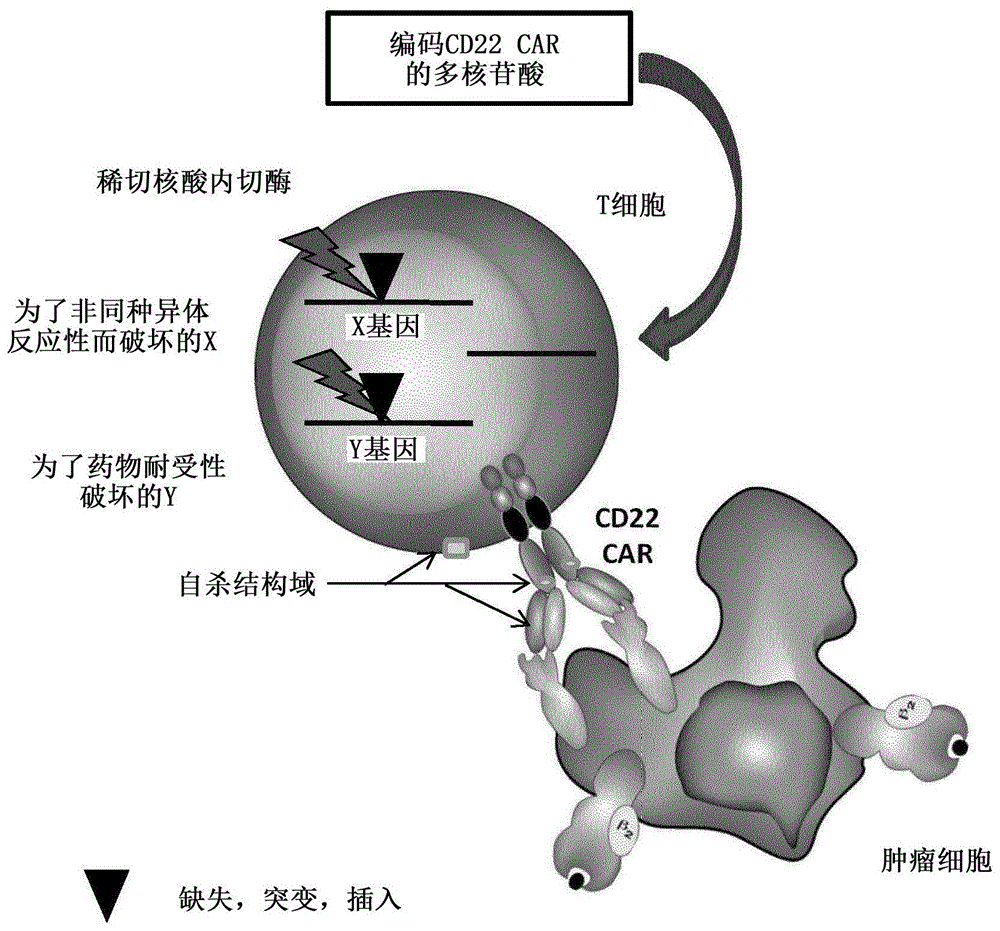
本发明总体上涉及免疫治疗领域,更具体地,涉及对cd22特异的通用型嵌合抗原受体t细胞(ucart22)和工程化所述细胞的方法,该对cd22特异的通用型嵌合抗原受体t细胞(ucart22)是包含至少一个经编辑的基因和对分化簇22(cd22)特异的嵌合抗原受体(car)(carcd22)的工程化人原代免疫细胞,所述经编辑的基因优选是编码tcr亚基的基因或cd52基因。本发明进一步涉及ucart22在可能是或可能不是细胞初始供体(“同种异体(allogenic)”或“自体”cd22car工程化人原代免疫细胞)的患者中作为用于复发的难治性血液癌症的治疗的应用。根据本发明的表达cd22的细胞对于免疫治疗、特别是针对侵袭性或复发的癌症是特别有效和安全的。
背景技术:
:2000年,在美国,血液癌症(非霍奇金淋巴瘤、白血病)预计死亡人数超过45,000人(greenlee等人,cacancerj.clin.,50:7-33(2000))。2014年公布的数字相似,并且尽管在治疗方面如化疗中取得了进展,但此类癌症的预后基本不变。(ekmai,ubertsch,jdürig,ckunz,mhaenel,iwblau,mmunder,ajauch,bschurich,thielscher,mmerz,bhuegle-doerr,aseckinger,dhose,jhillengass,msraab,kneben,h-wlindemann,mzeis,cgerecke,ighschmidt-wolf,kweisel,cscheid,hsalwender和hgoldschmidt.phaseiiitrialofbortezomib,cyclophosphamideanddexamethasone(vcd)versusbortezomib,doxorubicinanddexamethasone(pad)innewlydiagnosedmyeloma.leukemia(硼替佐米、环磷酰胺和地塞米松(vcd)与硼替佐米、阿霉素和地塞米松(pad)在新诊断的骨髓瘤、白血病中的iii期试验)(2015年3月19日)|doi:10.1038/leu.2015.80.)在针对这些血液癌症的新的研究性疗法中,独特的是通过嵌合抗原受体(car)的基因转移对具有细胞裂解能力的细胞如t细胞进行的遗传修饰(jena,dotti等,2010)。car是由与单个分子中或形成多聚体的多个跨膜结构域中的一个或多个胞内信号转导结构域相关的靶向部分组成的合成受体。在特定的car中,结合部分由来自单链抗体(scfv)的抗原结合结构域组成,包含由接头连接的单克隆抗体的可变片段。基于受体或配体结构域的结合部分也被成功地用于制备car。添加来自t细胞受体(tcr)的共刺激分子的信号转导结构域,以及特定的跨膜和铰链结构域用于形成第二代和第三代car,获得在人类中成功的治疗试验。在这些研究中,来自患血液(“液态”)癌症患者的t细胞被重新定向针对表达例如cd19或cd22的恶性细胞(june等,2011;haso等,2013)并重新注射到相同患者中。(hasow,leedw,shahnn,stetler-stevensonm,yuancm,pastanih,dimitrovds,morganra,fitzgeralddj,barrettdm,wayneas,mackallcl,orentasrj.anti-cd22-chimericantigenreceptorstargetingb-cellprecursoracutelymphoblasticleukemia.blood.2013feb14;121(7):1165-74.doi:10.1182/blood-2012-06-438002.epub2012dec14)。允许来自一个个体的免疫细胞在重新注射到同一个体(通常患有癌症)之前进行工程化的方法不是很适合用于可能在与时间赛跑的侵袭形式的肿瘤。此外,这种方法在免疫系统发生改变的患者中可能是有问题的或不确定的。为了缓解这一问题,最近实施了使用表达car的所谓“同种异体(allogeneic)”t细胞(也称为通用型或“现成”t细胞)的免疫疗法,第一批接受这种细胞治疗的两名患者在治疗后约两年仍处于缓解期。尽管如此,这种疗法仍有一些方面有待改进,如存在抗t细胞药物时的有效性、抗逃逸肿瘤细胞的有效性、持久性、控制手段等。事实上,似乎通过下调car识别的表面抗原的表达,癌细胞可能逃避治疗并存活下来,尽管在接受治疗的患者中仍然存在重新定向的免疫。此外,在用自体或同种异体t细胞治疗的患者中观察到的、有时是致命的主要不良反应是细胞因子释放综合征。因此,仍然需要为这些疾病、特别是对血液癌症的侵袭性或难治性/复发的形式开发有效和安全的治疗。技术实现要素:在此,发明人开发了一种包括具有至少trac基因的缺失的工程化的原代人类t细胞的新的有效治疗(“ucart22”),被赋予靶向cd22的嵌合抗原受体和安全标记,允许在体内控制所述细胞数量从而控制所述细胞的活性。在包括具有至少trac基因的缺失的工程化的原代人类t细胞的新的有效治疗(“ucart22”)中,考虑在cd52、dck、β2微球蛋白基因中的至少一个另外的缺失。这些新的ucart22对于患有cd22介导的病理的患者的过继性转移特别有效,无论所述患者是否为免疫细胞的初始供体,并且无论所述患者是否已经接受影响免疫的治疗。本发明的ucart22细胞对通常用于治疗cd22介导的病理学的至少一种化学或抗体药物如campath和/或嘌呤核苷酸类似物(pna)具有耐受性。本发明的ucart22细胞在以杀死多于80%的细胞的剂量使用的所述药物的存在下能够存活并具有活性。已观察到工程化分离的原代免疫细胞ucart22显著且出乎意料的临床优势,包括低细胞因子释放、无或非常轻微的移植物抗宿主病,以及对血液癌症细胞的难治性复发形式的显著活性。将在本研究中披露其他优点。本研究提供:1、一种工程化的人t细胞受体敲除(tcrko)细胞(ucart22),具有对cd22特异的嵌合抗原受体(car),安全开关,优选地在细胞表面表达,所述抗cd22car(cd22car)包含:i)至少一个胞外结构域,包含:-来自cd8α的铰链结构域,-对cd22特异的抗原结合结构域,可选地是前导序列,ii)来自cd8α的跨膜结构域,以及iii)胞内信号转导结构域,所述cd22car具有与seqidn°15具有至少80%同一性的多肽序列,所述安全开关包括:-由肽2a暂时连接到cd22car的rqr8,或者-连接到cd22car的至少两个利妥昔单抗mab特异性表位,优选位于vh与铰链结构域之间,或者3个利妥昔单抗mab特异性表位或3个利妥昔单抗mab特异性表位和qben-10mab特异性表位。2.根据实施方式1的ucart22,其中与seqidn°11具有至少80%同一性的多核苷酸序列被插入到基因组中,并且还包含在seqidn°18内具有插入、缺失或突变的经失活的trac基因,在细胞表面具有通过流式细胞术测量的不可检测水平的t细胞受体(tcr),以及通过引导序列技术测量的不可检测水平的位点外(offsite)事件。根据实施方式2的ucart22,其中,所述抗cd22car优选插入到trac基因中,优选具有seqidn°18。3.根据实施方式1至2中任一项的ucart22,包含选自dck基因、b2m基因、cd52基因的另一个失活基因,优选是cd52基因。4.根据实施方式1至3中任一项所述的ucart22,其中至少一个另外的基因是失活的,所述基因选自编码以下各项的基因:芳香烃受体(ahr)、转化生长因子β受体(tgfβ受体)、白细胞介素10受体(il-10r)、程序性细胞死亡蛋白1,它们的组合。5.根据实施方式1至4中任一项所述的ucart22,其中编码β2微球蛋白(b2m)的基因是失活的。6.根据实施方式1至5中任一项所述的ucart22,其中编码芳香烃受体(ahr)的基因是失活的。7.根据实施方式1至6中任一项所述的ucart22,其中编码转化生长因子β受体(tgfβ受体)的基因是失活的。8.根据实施方式1至7中任一项所述的ucart22,其中编码白细胞介素10受体(il-10r)的基因是失活的。9.根据实施方式1至8中任一项所述的ucart22,其中编码程序性细胞死亡蛋白1(pd1)的基因是失活的。5.根据实施方式1至4中任一项所述的ucart22,包含对选自以下各项的下列肿瘤相关表面抗原中的任一项特异的另外的scfv:cd19、cd20、cd30、主要组织相容性复合物(mhc)分子、免疫球蛋白(ig)、cd3、cd5、cd34、cd79,优选cd79b、cd138、b7-1(cd80)、bcma(cd269、tnfrsf17)、flt-3或pax5,优选cd19。6.根据实施方式1至5中任一项所述的ucart22,其中所述cd22car还包含对cd19特异的抗原结合结构域,或者其中所述ucart22还包含cd19car,优选与seqidn°25或seqidn°26具有至少80%同一性的cd19car。7.根据实施方式1至5中任一项所述的ucart22,其中所述抗cd22car是单链car或多链car。8.根据实施方式5或6中任一项所述的ucart22,其中所述抗cd19car是单链car或多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd19特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd20特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd30特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对主要组织相容性复合物(mhc)分子特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对免疫球蛋白(ig)特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd3特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd5特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd34特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd79、优选cd79b特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd138特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd80特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对bcma(cd269)特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对tnfrsf17特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对flt-3特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd19特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd79a或cd79b特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd20特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd30特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对主要组织相容性复合物(mhc)分子特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对免疫球蛋白(ig)特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd3特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd5特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd34特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd138特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd80特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对bcma(cd269)特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对tnfrsf17特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对flt-3特异的另外的scfv的多链car。9.一种ucart细胞的群体,包含根据实施方式1至8中任一项所述的ucart22。10.根据实施方式9所述的ucart细胞的群体,包含ucart19,优选在细胞表面表达包含seqidn°25或seqidn°26的序列的抗cd19car的ucart19。11.一种试剂盒,包含ucart22和ucart19,用于在需要其的患者中连续地(至少一次)、或者伴随地、或者连续地(至少一次)随后伴随地给予。12.根据实施方式11所述的试剂盒,其中首先使用ucart19至少一次、两次、三次、四次或若干次,随后单独的或与ucart19一起使用ucart22。13.根据实施方式11或12所述的试剂盒,其中首先使用ucart22至少一次、两次、三次、四次或若干次,随后单独或与ucart22一起使用ucart19。14.根据实施方式11至13中任一项所述的试剂盒,还包含在ucart之前给予的淋巴细胞耗竭(lymphodepletion)的治疗。15.根据实施方式11至14中任一项所述的试剂盒,其中淋巴细胞耗竭是用氟达拉滨和环磷酰胺实现的,优选在第-6天至第-2天25mg/m2i.v.×5个剂量氟达拉滨并在第-5天60mg/kgi.v.1个剂量环磷酰胺。16.根据实施方式11至15中任一项所述的试剂盒,包含至少一个定向针对选自cd79a、cd79b、cd20、cd30、cd52、cd40、cd80、cd86、cd74、vegf的癌症抗原的其他ucart细胞。17.一种药物组合物,包含根据实施方式1至8中任一项所述的ucart22或包含根据的实施方式9或10的所述ucart22的细胞群体以及药学上可接受的赋形剂。18.根据实施方式17所述的药物组合物,还包含苔藓抑素,优选苔藓抑素1。19.根据实施方式17或18所述的药物组合物或者根据实施方式11至16中任一项所述的试剂盒,其作为用于预防或治疗患有cd22+介导的癌症或cd22+介导的炎症性疾病的患者的药物的应用。20.根据实施方式17或18中任一项所述的药物组合物或根据实施方式11至16中任一项所述的试剂盒,其作为用于预防或治疗患有cd19+介导的癌症或cd19+介导的炎症性疾病的患者的药物的应用。21.根据实施方式17或18中任一项所述的药物组合物或根据实施方式11至16中任一项所述的试剂盒,其作为用于预防或治疗患有cd19+cd22+介导的癌症或cd19+cd22+介导的炎症性疾病的患者的药物的应用。22.根据实施方式17或18中任一项所述的药物组合物或根据实施方式11至16中任一项所述的试剂盒,其用于根据实施方式19或21中任一项使用,其中治疗患者包括给予所述药物组合物至少两次(再给药)以避免癌症的复发性/难治性发展的步骤。23.根据实施方式17至18中任一项所述的药物组合物或根据实施方式11至16中任一项所述的试剂盒,其根据实施方式19或21中任一项使用,用于治疗选自以下各项的cd22介导的血液癌症:淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、白血病、多发性骨髓瘤、b细胞慢性淋巴细胞性白血病、毛细胞白血病、急性淋巴细胞性白血病(all)和伯基特氏淋巴瘤、急性淋巴细胞性癌症、急性骨髓性白血病,优选选自以下各项的表达cd22的血液癌症:淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、白血病、多发性骨髓瘤、b细胞慢性淋巴细胞性白血病、毛细胞白血病、急性淋巴细胞性白血病(all)和伯基特氏淋巴瘤、急性淋巴细胞性癌症、急性骨髓性白血病,更优选复发的难治性的表达cd22的血液癌症,甚至更优选所述cd22相关的血液癌症的侵袭形式。24.根据实施方式17至18中任一项所述的药物组合物或根据实施方式11至16中任一项所述的试剂盒,其根据实施方式20或21中任一项使用,用于治疗选自以下各项的cd19介导的血液癌症:淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、白血病、多发性骨髓瘤、b细胞慢性淋巴细胞性白血病、毛细胞白血病、急性淋巴细胞性白血病(all)和伯基特氏淋巴瘤、急性淋巴细胞性癌症、急性骨髓性白血病,优选选自以下各项的表达cd19的血液癌症:淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、白血病、多发性骨髓瘤、b细胞慢性淋巴细胞性白血病、毛细胞白血病、急性淋巴细胞性白血病(all)和伯基特氏淋巴瘤、急性淋巴细胞性癌症、急性骨髓性白血病,更优选复发的难治性的表达cd19的血液癌症,甚至更优选所述cd19相关的血液癌症的侵袭形式。25.根据实施方式17至18中任一项所述的药物组合物或根据实施方式11至16中任一项所述的试剂盒,其根据实施方式19至22中任一项使用,用于治疗复发的或难治性的表达b的all,优选作为小儿适应症。26.根据实施方式17至18中任一项所述的药物组合物或根据实施方式11至16中任一项所述的试剂盒,其根据实施方式19至25中任一项使用,其中治疗患者包括在患者中以允许使所述ucart22与至少一种特异性mab接触的剂量给予至少一种单克隆抗体(mab),优选qben10和/或利妥昔单抗。针对cd22car的实施方式本发明提供抗cd22car,包含选自以下各项的铰链结构域:fcriiiα、cd8α、igg1、igg4和pd1,优选选自cd8α或igg4。上述的抗cd22car,其中对cd22特异的scfv包含由接头l1、优选包含1-3个“ggggs”基序、更优选一个“ggggs”基序相互连接的vh和vl。根据上述各项中的任一项的抗cd22car,其中所述对cd22特异的scfv是通过选自来自fcriiiα、cd8α、igg1、优选来自cd8α的铰链的铰链连接到跨膜结构域的。根据上述各项中的任一项的抗cd22car,包含胞内结构域,所述胞内结构域包含cd3ζ信号转导结构域和4-1bb信号转导结构域。如上所述的中的任一项的抗cd22car,其中抗cd22car包含至少一个优选两个、三个或四个单克隆抗体(mab)特异的表位,优选插入到对cd22特异的scfv的接头l和/或铰链中的两个。如上所述的中的任一项的抗cd22car,其中mab特异性表位是选自以下各项的多肽:cpysnpslc、nsellslindmpitndqkklmsnn、cqfdlstrrlkc、cqynlssralkc、cvwqrwqksyvc、cvwqrwqksyvc、sfvlnwyrmspsnqtdklaafpedr、sgtylcgaislapkaqike、elptqgtfsnvstnvspakpttta、elptqgtfsnvstnvspakpttta、gqndtsqtssps,优选elptqgtfsnvstnvspakpttta和/或cpysnpslc(seqidn°19)。本发明提供编码根据上述各项中的任一种抗cd22car的多核苷酸或者与编码抗cd22car的所述多核苷酸具有至少80%同一性的多核苷酸,包含根据上述多核苷酸中的任一种的载体。如本文下文所公开的,将所述ucart22中的其他基因特别是dck基因、b2m基因、cd52基因进行编辑。所提供的ucart其中提供了如上所述的ucart22,并且对至少一个另外的基因进行编辑或工程化,所述基因选自编码以下各项的基因:芳香烃受体(ahr)、转化生长因子β受体(tgfβ受体)、白细胞介素10受体(il-10r)、程序性细胞死亡蛋白1、它们的组合。其中如上所述的ucart22和至少一个另外的基因包含失活其活力和/或表达的突变、缺失或插入,所述基因选自编码以下各项的基因:芳香烃受体(ahr)、转化生长因子β受体(tgfβ受体)、白细胞介素10受体(il-10r)、程序性细胞死亡蛋白1、它们的组合。其中如上所述的ucart22和至少一个另外的基因包含失活其活力和/或表达的突变、缺失或插入,所述基因选自编码以下各项的基因:芳香烃受体(ahr)、转化生长因子β受体(tgfβ受体)、白细胞介素10受体(il-10r)、它们的组合。其中如上所述的ucart22和至少一个另外的基因包含失活其活力和/或表达的突变、缺失或插入,所述基因选自编码以下各项的基因:转化生长因子β受体(tgfβ受体)、白细胞介素10受体(il-10r)、程序性细胞死亡蛋白1、它们的组合。其中如上所述的ucart22和至少一个另外的基因包含失活其活力和/或表达的突变、缺失或插入,所述基因选自编码以下各项的基因:芳香烃受体(ahr)、白细胞介素10受体(il-10r)、程序性细胞死亡蛋白1、它们的组合。其中如上所述的ucart22和至少一个另外的基因包含失活其活力和/或表达的突变、缺失或插入,所述基因选自编码以下各项的基因:芳香烃受体(ahr)、转化生长因子β受体(tgfβ受体)、程序性细胞死亡蛋白1、它们的组合。表9中描述了所述car可以插入其中的基因。表9:在本发明的cd22car工程化的t细胞中,根据本发明可以被失活的编码免疫检验点蛋白的基因的列表以加粗显示的是在本发明的ucart中优选失活的基因如上所述的ucart22,包含根据上述各项中的任一项的抗cd22car(ucart22)和插入到基因组中(插入到cd25基因中)的编码所述抗cd22car(ucart22)的多核苷酸。根据上述各项中的任一项的ucart22,其中抗cd22car是单链car或多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对选自以下肿瘤相关表面抗原中的任一项特异的另外的scfv的单链car:cd19、cd20、cd30、主要组织相容性复合物(mhc)分子、免疫球蛋白(ig)、cd3、cd5、cd34、cd79,优选cd79b、cd138、b7-1(cd80)、bcma(cd269、tnfrsf17)、flt-3或pax5,优选cd19。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd19特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,表达抗cd22car和抗cd19car,优选seqidn°94或seqidn°95的抗cd22car和抗cd19car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd20特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd30特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对主要组织相容性复合物(mhc)分子特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对免疫球蛋白(ig)特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd3特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd5特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd34特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd79、优选cd79b特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd138特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd80特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对bcma(cd269)特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对tnfrsf17特异的另外的scfv的单链cara。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对flt-3特异的另外的scfv的单链car。根据上述各项中的任一项的ucart22,其中抗cd22car是多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd19特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd79a或cd79b特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd19特异的另外的scfv的多链(mc)car。根据上述各项中的任一项的ucart22表达抗cd22mccar和抗cd19car,优选是seqidn°94或seqidn°95的抗cd22mccar和抗cd19car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd20特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd30特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对主要组织相容性复合物(mhc)分子特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对免疫球蛋白(ig)特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd3特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd5特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd34特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd138特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对cd80特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对bcma(cd269)特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对tnfrsf17特异的另外的scfv的多链car。根据上述各项中的任一项的ucart22,其中抗cd22car是包含对flt-3特异的另外的scfv的多链car。包含根据上述各项中的任一项的ucart22的细胞群体。包含根据上述各项中的任一项的ucart22的细胞群体,其中表达所述抗cd22car的细胞还在细胞表面表达抗cd19car,优选所述抗cd19car包含seqidn°25或seqidn°26的序列。一种cd22cart细胞(ucart22),可选与蛋白激酶c抑制剂如苔藓抑素1组合作为本发明的药物组合物,在治疗cll、all、多发性骨髓瘤(mm)、母细胞性浆细胞样树突状细胞肿瘤(bpdcn)方面特别有用,特别是难治性/复发的all、难治性/复发的cll和/或这些疾病的侵袭形式,更优选难治性或复发的b-all。来源于m971的cd22cart细胞(ucart22)可选地与蛋白激酶c抑制剂如苔藓抑素1组合作为本发明的药物组合物在在治疗cll、all、多发性骨髓瘤(mm)、母细胞性浆细胞样树突状细胞肿瘤(bpdcn)方面特别有用,特别是难治性/复发的all、难治性/复发的cll和/或这些疾病的侵袭形式,更优选难治性或复发的b-all。本发明的工程化的免疫细胞不仅表现出对恶性细胞的高水平体内活性,较少的细胞因子释放,而且其数量和活性也受到控制,从而为免疫治疗提供了安全和有效的方法。本发明提供工程化的人t细胞受体敲除(tcrko)细胞,其具有对cd22特异的嵌合抗原受体(cd22car)(ucart22),对cd22特异的嵌合抗原受体(cd22car)优选在细胞表面表达,其中所述cd22car包含:i)至少一个胞外结构域,包含:-来自cd8α的铰链结构域,-对cd22特异的抗原结合结构域,可选地是前导序列,ii)来自cd8α的跨膜结构域,以及iii)胞内信号转导结构域。所述ucart22包含至少一个另外的经编辑的基因,优选是在cd52基因中的缺失。本发明还提供如上所述的ucartcd22,其中抗原结合结构域包含来源于m917抗体(m971)的对cd22特异的scfv,优选所述scfv包含选自来自seqidn°12、seqidn°13、seqidn°14和seqidn°15的序列,更优选来自seqidn°15的序列。在一个实施方式中,本发明还提供工程化的人t细胞受体敲除(tcrko)细胞(ucart22),其具有对cd22特异的嵌合抗原受体(cd22car),优选在细胞表面表达的对cd22特异的嵌合抗原受体(cd22car),其中所述cd22car包含:i)至少一个胞外结构域,包含:-来自cd8α的铰链结构域,-对cd22特异的抗原结合结构域,可选地是前导序列,ii)来自cd8α的跨膜结构域,以及iii)胞内信号转导结构域。所述ucart22包含至少一个另外的经编辑的基因,优选是在cd52基因中的缺失。并且其中抗原结合结构域包含对cd22的远端部分特异的scfv,所述car具有seqidn°20。根据上文的ucartcd22包含以下序列:qvqlqqsgpglvkpsqtlsltcaisgdsvssnsaawnwirqspsrglewlgrtyyrskwyndyavsvksritinpdtsknqfslqlnsvtpedtavyycarevtgdledafdiwgqgtmvtvss和diqmtqspsslsasvgdrvtitcrasqtiwsylnwyqqrpgkapnlliyaasslqsgvpsrfsgrgsgtdftltisslqaedfatyycqqsysipqtfgqgtkleik或者与所述序列中的每一个具有80至99%的同源性(homology)。本发明还提供如上文所述的包含seqidn°15的多肽和安全开关的ucart22,所述安全开关包括:-由肽2a暂时连接到cd22car的rqr8,或者-连接到cd22car的至少两个利妥昔单抗mab特异性表位,优选3个利妥昔单抗mab特异性表位,并且更优选3个利妥昔单抗mab特异性表位和qben-10mab特异性表位。[使得能够分选和/或耗竭具有所述cd22car的免疫细胞]本发明还提供如上所述的ucart22,包含至少一个另外的经编辑的基因,优选是cd52基因或者dck基因中的缺失,或者β2微球蛋白基因或ctiia基因中的缺失,甚至更优选是cd52基因中的缺失,和/或hif-1α基因中的插入,产生对低氧的耐性。本发明提供如上所述的包含cd52基因中的缺失的ucart22,与阿仑单抗组合。本发明还提供如上所述的ucart22,其中所述cd22car是在低氧(少于5%o2、优选少于1%o2的低o2浓度)下表达的。本发明还提供如上文所述包含多核苷酸的ucart22,该多核苷酸编码包含cd22car和安全开关的多肽。在优选的实施方式中,本发明提供如上所述的ucart22,其在相同基因中、优选在trac基因中包含seqidn°22和seqidn°18的多核苷酸。本发明还提供如上所述的包含多核苷酸的ucart22,该多核苷酸编码包含cd22car和安全开关的多肽。在优选的实施方式中,本发明提供如上所述的ucart22,其在相同基因中、优选在trac基因中包含seqidn°20和seqidn°18的多核苷酸。本发明提供包含如上所述的ucart22的细胞群体。本发明提供药物组合物,包含如上所述的ucart22或者细胞群体以及药学上可接受的赋形剂,所述细胞群体包含如上所述的任一种所述ucart22。在特定实施方式中,提供一种药物组合物,包含根据本发明的ucart22或者包含与ucartcd19组合的所述ucart22的细胞群体以及药学上可接受的赋形剂。ucart19和ucart22可以在相同时间、伴随地或以ucart19或ucart22先而连续地给予,作为患者癌细胞中cd19和cd22表达水平的函数。在特定实施方式中,提供一种药物组合物,包含ucart22/19或ucart19/22(双特异性car单链或多链car或表达cd19car和cd22car两者的细胞)和药学上可接受的赋形剂。本发明提供如上所述的药物组合物,还包含苔藓抑素家族的化合物,优选苔藓抑素1。本发明提供治疗有效量的如上所述的ucart22或含有如上所述的ucart22的药物组合物,用于作为治疗患者的药物,。本发明提供治疗有效量的如上所述的ucart22或者如上所述的药物组合物,用于作为治疗患者的药物,其中治疗患者包括给予至少两次(再给药)所述治疗有效量的ucartcd22或所述药物组合物,用于避免复发。在特定实施方式中,本发明提供如上所述的任一种的ucartcd22或者如上所述的任一种的药物组合物,用于作为治疗患者的药物,其中治疗患者包括给予如上所述的ucartcd22或如上所述的药物组合物至少两次,用于避免复发。本发明提供治疗有效量的如上所述的ucart22或者如上所述的药物组合物,用于作为如上所述治疗患者的药物,用于治疗cd22相关疾病,优选cd22相关的b细胞恶性肿瘤(例如,cd22相关的血液癌症)。在特定实施方式中,本发明提供:治疗有效量的如上所述的ucart22或如上所述的药物组合物,用于作为治疗血液癌症的药物,如选自以下各项的血液癌症:淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、白血病、多发性骨髓瘤、b细胞慢性淋巴细胞性白血病、毛细胞白血病、急性淋巴细胞性白血病(all)和伯基特氏淋巴瘤、急性淋巴细胞性癌症、急性骨髓性白血病,优选表达cd22的血液癌症,更优选复发的难治性的表达cd22的血液癌症,甚至更优选所述cd22相关的血液癌症的侵袭形式。优选地,ucart22用于治疗患有复发的难治性b-all的患者。本发明提供治疗有效量的如上所述的ucart22或者如上所述的药物组合物,用于作为治疗患者的药物,其中所述患者患有选自以下各项的癌症:腺泡型横纹肌肉瘤,膀胱癌(例如,膀胱肿瘤),骨癌,脑癌(例如,髓母细胞瘤),乳腺癌,肛门、肛管或肛门直肠癌,眼部癌症,肝内胆管癌,关节癌症,颈部癌症,胆囊癌症,胸膜癌症,鼻癌,鼻腔癌症,中耳癌症,口腔癌症,外阴癌症,慢性淋巴细胞性白血病,慢性骨髓性癌症,结肠癌症,食管癌症,宫颈癌症,纤维肉瘤,胃肠道类肿瘤,头颈部癌(例如头颈部鳞状细胞癌),下咽部癌,肾脏癌(kidneycancer),喉癌,肝癌,肺癌(例如,非小细胞肺癌),恶性间皮瘤,肥大细胞瘤,黑色素瘤,鼻咽癌,卵巢癌,胰腺癌,腹膜癌,大网膜癌,肠系膜癌,咽癌,前列腺癌,直肠癌,肾癌(renalcancer),皮肤癌,小肠癌,软组织癌,实体瘤,胃癌,睾丸癌,甲状腺癌,输尿管癌。本发明提供:1.一种工程化的人t细胞受体敲除(tcrko)细胞(ucart22),其具有优选地在细胞表面表达的对cd22特异的嵌合抗原受体(car),其中所述抗cd22car包含:i)至少一个胞外结构域,包含:-来自cd8α的铰链结构域,-对cd22特异的抗原结合结构域,可选地是前导序列,ii)来自cd8α的跨膜结构域,以及iii)胞内信号转导结构域。所述ucart22包含至少一个另外的经编辑的基因,优选cd52失活基因、dck失活基因、β2微球蛋白失活基因或插入的hif-1α基因。2.根据1所述的ucartcd22,其中抗原结合结构域包含对cd22特异的scfv,所述scfv来源于m971抗体(m971),优选所述scfv包含选自seqidn°12、seqidn°13、seqidn°14或seqidn°15的序列、更优选来自seqidn°15的序列。3.根据1至2中任一项所述的ucart22,包含seqidn°15的多肽和安全开关,所述安全开关包括:-由肽2a暂时连接到cd22car的rqr8,-连接到cd22car的至少两个利妥昔单抗mab特异性表位,优选3个利妥昔单抗mab特异性表位,更优选3个利妥昔单抗mab特异性表位和qben-10mab特异性表位[使得能够分选和/或耗竭具有所述cd22car的免疫细胞]。4.根据1至3中任一项所述的ucart22,包含cd52失活基因,甚至更优选cd52失活基因和hif-1α插入基因,赋予对阿仑单抗和低氧的耐受。5.根据1至4中任一项所述的ucart22,其中所述抗cd22car在低o2浓度(<5%o2)下在细胞表面表达。6.根据1至5中任一项所述的ucart22,包含多核苷酸,该多核苷酸编码包含1至5中的抗cd22car的多肽。如上所述的中的任一项的ucart22,包含细胞表面的抗cd22car,插入到trac基因中的编码所述抗cd22car的多核苷酸,插入到cd25基因组序列的编码il-12的外源多核苷酸序列、b2m基因组序列或pd1基因组序列中。如上所述的中的任一项的ucart22,包含细胞表面的抗cd22car,插入到trac基因中的编码所述抗cd22car的多核苷酸,插入到cd25基因组序列或pd1基因组序列中的编码il-12的外源多核苷酸序列,并且还包含选自il-10r受体、tgfβ受体、tim-3、lag-3的基因组ko基因(见上文表9)。7、根据1至6中任一项所述的ucart22,还包含seqidn°22的多核苷酸,优选在相同trac基因中包含seqidn°18和seqidn°22的序列。8、一种细胞群体,包含根据1至7中任一项的所述ucart22。9、一种药物组合物,包含根据1至7中任一项所述的ucart22或者根据8所述的包含所述ucart22的细胞群体以及药学上可接受的赋形剂。10、根据9所述的药物组合物,还包含苔藓抑素,优选苔藓抑素1。11、治疗有效量的根据1至7中任一项所述的ucart22或者根据9或10所述的药物组合物,用于作为治疗患者的药物的应用。12、治疗有效量的根据1至7中任一项所述的ucart22或者根据9或10所述的药物组合物,用于根据11所述的作为治疗患者的药物的应用,其中治疗患者包括给予至少两次(再给药)所述治疗有效量的ucartcd22或所述药物组合物,用于避免复发。13、治疗有效量的根据1至7中任一项所述的ucart22或者根据9或10所述的药物组合物,用于根据11或12所述的作为治疗患者的药物的应用,用于治疗cd22相关疾病,优选cd22相关的b细胞恶性肿瘤。14、治疗有效量的根据1至7中任一项所述的ucart22或者根据9或10所述的药物组合物,用于根据11至13中任一项所述的作为治疗患者的药物的应用,用于治疗选自以下各项的血液癌症:淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、白血病、多发性骨髓瘤、b细胞慢性淋巴细胞性白血病、毛细胞白血病、急性淋巴细胞性白血病(all)和伯基特氏淋巴瘤、急性淋巴细胞性癌症、急性骨髓性白血病,优选表达cd22的血液癌症,更优选复发的难治性的表达cd22的血液癌症,甚至更优选所述cd22相关的血液癌症的侵袭形式。15、治疗有效量的根据1至7中任一项所述的ucart22或者根据9或10所述的药物组合物,用于根据11至13中任一项所述的作为治疗患者的药物的应用,用于治疗复发的和/或难治性cd22阳性b-all。16、治疗有效量的根据1至7中任一项所述的ucart22或者根据9或10所述的药物组合物,用于根据11至13中任一项所述的作为治疗患者的药物的应用,其中所述患者患有癌症,优选是cd22+细胞介导的癌症,选自以下各项:腺泡型横纹肌肉瘤,膀胱癌症(例如,膀胱癌),骨癌,脑癌(例如,髓母细胞瘤),乳腺癌,肛门、肛管或肛门直肠癌,眼部癌症,肝内胆管癌,关节癌症,颈部癌症,胆囊癌症,胸膜癌症,鼻癌,鼻腔癌症,中耳癌症,口腔癌症,外阴癌症,慢性淋巴细胞性白血病,慢性骨髓性癌症,结肠癌症,食管癌症,宫颈癌症,纤维肉瘤,胃肠道类肿瘤,头颈部癌(例如头颈部鳞状细胞癌),下咽部癌,肾脏癌,喉癌,肝癌,肺癌(例如,非小细胞肺癌),恶性间皮瘤,肥大细胞瘤,黑色素瘤,鼻咽癌,卵巢癌,胰腺癌,腹膜癌,大网膜癌,肠系膜癌,咽癌,前列腺癌,直肠癌,肾癌,皮肤癌,小肠癌,软组织癌,实体瘤,胃癌,睾丸癌,甲状腺癌,输尿管癌,优选肝癌和肺癌。附图说明图1:根据本发明的工程化的免疫细胞的示意图图1中所示的工程化的免疫细胞可以是本发明的具有编码car的多核苷酸的t细胞。对该t细胞进一步工程化以便更好并且更安全地植入到患者体内。x或y是可以突变、缺失和/或具有插入的经编辑的基因。例如,表达t细胞受体(tcr)成分(例如,tcrα或者tcrβ)的基因可以缺失或者可以包含插入,y可以是与t细胞对免疫抑制药物的敏感性有关的基因,如dck(关于对嘌呤核苷酸类似物的耐受性)或cd52(关于坎帕斯(campath))或hprt(关于6-硫鸟嘌呤)。图2:单链和多链cd22car的示意图图2图示了本发明的cd22car,包含对cd22特异的scfv,可选地包含安全开关、来自cd8α的铰链和跨膜结构域、来自4-1bb和cd3ζ的胞内结构域,可选地赋予对低氧耐受的结构域。图3:本发明包含安全开关的cd22car构建体的实例至少一个利妥昔单抗(r)mab特异性表位(黑框)、优选3个利妥昔单抗mab特异性表位、并且更优选3个利妥昔单抗mab特异性表位和qben-10(q)mab特异性表位(灰框)被插入cd22car中。可以将r在vh与vl结构域(或者vl和vh结构域)之间插入到scfv中,和/或插入到铰链中。图4:多核苷酸编码的多肽的实例图4代表多肽的一个实例,它将被切割使得会在细胞表面表达安全开关(rqr8)和cd22car。r=cd20模拟表位(由利妥昔单抗结合),q=cd34表位(被qbend10结合)图5:ucart22的脱粒活性在存在与cd22阴性sup-t1细胞对比的cd22阳性nalm-16细胞的情况下,与未转导(nt)或转导有靶向cd22的远端部分的car的t细胞(scfv-v2)的脱粒活性对比的ucart22(针对cd22的近端结构域的scfv-v1)的脱粒活性。图6:ucart22的细胞毒性活性在存在与cd22阴性sup-t1细胞对比的cd22阳性nalm-16细胞的情况下,与未转导(nt)或转导有靶向cd22远端的car的t细胞(scfv-v2)的细胞毒性活性对比的ucart22(针对cd22的近端结构域的scfv-v1)的细胞毒性活性。图7:ucart22的干扰素γ生产图8:在对照细胞、ucart22(针对cd22的近端结构域的scfv-v1)或cart22(无trac缺失)存在下的小鼠的存活情况。图9:使用talen将基因插入到trac的一般策略。具体实施方式除非在此特别定义,否则所使用的所有技术和科学术语具有与基因治疗、生物化学、遗传学、免疫学和分子生物学领域的技术人员通常理解的相同含义。所有类似或等同于本文所述的方法和材料可用于本发明的实践或测试,其中合适的方法和材料在本文进行了描述。所有出版物、专利申请、专利以及其他参考文献以其整体通过引用并入本文。如有冲突,以本说明书(包括定义)为准。此外,除非另有规定,否则材料、方法和实例仅为说明性的而无意于限制。除非另有说明,本发明的实施将采用本领域技术范围内的细胞生物学、细胞培养、分子生物学、转基因生物学、微生物学、重组dna和免疫学的常规技术。这些技术在文献中有充分的阐释。参见,例如,currentprotocolsinmolecularbiology(frederickm.ausubel,2000,wileyandsoninc,libraryofcongress,usa);molecularcloning:alaboratorymanual,thirdedition,(sambrooketal,2001,coldspringharbor,newyork:coldspringharborlaboratorypress);oligonucleotidesynthesis(m.j.gaited.,1984);mullisetal.u.s.pat.no.4,683,195;nucleicacidhybridization(b.d.harries&s.j.higginseds.1984);transcriptionandtranslation(b.d.hames&s.j.higginseds.1984);cultureofanimalcells(r.i.freshney,alanr.liss,inc.,1987);immobilizedcellsandenzymes(irlpress,1986);b.perbal,apracticalguidetomolecularcloning(1984);theseries,methodsinenzymology(j.abelsonandm.simon,eds.-in-chief,academicpress,inc.,newyork),specifically,vols.154and155(wuetal.eds.)andvol.185,"geneexpressiontechnology"(d.goeddel,ed.);genetransfervectorsformammaliancells(j.h.millerandm.p.caloseds.,1987,coldspringharborlaboratory);immunochemicalmethodsincellandmolecularbiology(mayerandwalker,eds.,academicpress,london,1987);handbookofexperimentalimmunology,volumesi-iv(d.m.weirandc.c.blackwell,eds.,1986);以及manipulatingthemouseembryo,(coldspringharborlaboratorypress,coldspringharbor,n.y.,1986)。cd22特异性嵌合抗原受体本发明涉及抗cd22嵌合抗原受体的新设计(car或cd22car或抗cd22car),其是能够与cd22特别是cd22的近端结构域结合的嵌合抗原受体。本发明的cd22特异性嵌合抗原受体包含胞外结构域、跨膜结构域和胞内结构域,胞外结构域包含胞外配体结合结构域和铰链,可选地自杀结构域,胞内结构域包含信号转导结构域。在细胞表面表达的本发明的cd22包含胞外结构域,该胞外结构域包含胞外配体结合结构域。如本文所使用的,术语“胞外配体结合结构域”定义为能够结合cd22的至少一个表位的寡肽或多肽。优选地,胞外配体结合结构域将能够至少部分地与细胞表面分子(其与cd22相互作用)并与另一个细胞表面抗原或另一个膜结合抗原相互作用,或者与cd22直接相互作用,或者与人cd22相互作用,更准确地与人cd22的近端区域(从第243位氨基酸至第687位氨基酸)直接相互作用。在一个实施方式中,本发明的cd22car包含胞外结构域,该胞外结构域包含能够与cd22的近端区域(从第243位氨基酸至第687位氨基酸)和cd22的远端部分(从第20位氨基酸至第425位氨基酸)相互作用的胞外配体结合结构域。在本发明中,cd22的全长胞外结构域为从第20位氨基酸至第687位氨基酸,cd22的膜近端结构域为从第243位氨基酸至第687位氨基酸,cd22的膜远端结构域为从第20位氨基酸至第425位氨基酸。在一个实施方式中,可以选择细胞外配体结合结构域来识别特定形式(糖基化)的cd22,该特定形式的cd22用作与特定疾病状态相关的细胞表面标志物。在优选的实施方式中,所述细胞外配体结合结构域包含至少一个单链抗体片段(scfv),该单链抗体片段包括由接头特别是柔性接头连接的靶标抗原特异性单克隆抗cd22抗体的轻(vl)和重(vh)可变片段。所述vl和vh优选来自下表2中的抗体m971。它们优选由包含例如序列seqidno.10的柔性接头连接在一起。为了本发明的目的,根据本发明将使用噬菌体显示方法先前鉴定并表征的完整的人抗cd22抗体、m971抗体(m971)的特定部分(xiaox,hom,zhuz,pastani,dimitrovds.identificationandcharacterizationoffullyhumananti-cd22monoclonalantibodies.mabs.2009;1(3):297-303)组合到特定序列中,以产生新的cd22car。另见wo2014065961,其通过引用合并于此。本发明的优选的实施方式提供了包含抗原结合结构域的car,该抗原结合结构域包含具有下表1所示的以下各部分的m971抗原结合结构域的单链可变片段(scfv),由具有下表1所示的以下各部分的m971抗原结合结构域的单链可变片段(scfv)组成,或者基本由具有下表1所示的以下各部分的m971抗原结合结构域的单链可变片段(scfv)组成。表1:cd22car中不同结构域的序列表2:不同cd22scfvvh和vl的序列表3:结构v-1的cd22表4:结构v-3的car在优选的实施方式中,本发明的cd22car包含seqidn°15的序列。在优选的实施方式中,本发明的cd22car包含seqidn°23的序列。本发明的cd22car的序列包含信号肽、来自cd8α的tm结构域以及来自m971的位于vh与vl结构域之间接头。scfv在本发明中,scfv是对cd22特异的免疫球蛋白或免疫球蛋白的一部分的重链(vh结构域)和轻链(vl结构域)的可变区与10-25个氨基酸短接头肽(优选是seqidn°10)连接的融合蛋白。在优选的实施方式中,所述car优选包含胞外配体结合结构域,该胞外配体结合结构域包含表现出与氨基酸序列seqidn°12至少90%、95%、96%、97%、98%、99%或100%同一性的多肽序列。在优选的实施方式中,所述car优选包含胞外配体结合结构域,该胞外配体结合结构域包含表现出与氨基酸序列seqidn°13至少90%、95%、96%、97%、98%、99%或100%同一性的多肽序列。在优选的实施方式中,所述car优选包含胞外配体结合结构域,该胞外配体结合结构域包含表现出与氨基酸序列seqidn°12至少90%、95%、96%、97%、98%、99%或100%同一性的多肽序列以及表现出与选自由seqidno.13组成的组的氨基酸序列至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的多肽序列。铰链胞外结构域可以还包含位于所述胞外配体结合结构域与所述跨膜结构域之间的铰链区。如本文所使用的,术语“铰链区”通常是指用于将跨膜结构域连接到胞外配体结合结构域的任何寡肽或多肽。特别地,铰链区被用于为胞外配体结合结构域提供更多的灵活性和可及性。铰链区可以包含最高达300个氨基酸,优选10至100个氨基酸,更优选10至50个氨基酸。铰链区可以来源于天然存在的分子的全部或部分,如来源于cd8或cd4的胞外区的全部或部分,或者来源于抗体恒定区的全部或部分。可替代地,铰链区可以是与天然存在的铰链序列相对应的合成序列,或者可以是完全合成的铰链序列。在优选的实施方式中,所述铰链结构域包含人cd8α链、fcriiiα受体或igg1的一部分,分别参见本说明书的seqidn°4、seqidn°5和seqidn°6,在更优选的实施方式中,铰链多肽表现出与seqidn°4至少90%、95%、97&、99%或100%的序列同一性,甚至更优选表现出与seqidn°4100%的序列同一性。来自igg4或来自pd1的铰链是本发明的一部分并且公开在wo2016120216中,并且可以用于构建体本发明的cd22car。本发明的cd22car锚定于细胞的膜上。因此,此cd22car还包含跨膜结构域。适当的跨膜结构域的区别特征包含在细胞的表面表达的能力以及相互作用以指导免疫细胞对预定靶标细胞的细胞反应,上述细胞在本发明中优选是免疫细胞,特别是淋巴细胞细胞或自然杀伤(nk)细胞。跨膜结构域可以来源于天然或合成的来源。跨膜结构域可以来源于任何膜结合蛋白或跨膜蛋白。作为非限制性实例,跨膜多肽可以是t细胞受体的亚基如α、β或δ,构成cd3复合物的多肽,il2受体p55(α链)、p75(β链)或链,fc受体特别是fc受体iii或cd蛋白的亚基链。可选地,跨膜结构域可以是合成的,并且可以包含主要是疏水的残基如亮氨酸和缬氨酸。在优选的实施方式中,所述跨膜结构域来源于人cd8α链(例如,np_001139345.1)。本发明的cd22car通常还包含跨膜结构域(tm),特别是显示出与seqidn°6或seqidn°7的多肽同一性的来自cd8α的跨膜结构域。优选地,本发明的car包含显示出与seqidn°6的多肽至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的tm。本发明的cd22car通常还包含显示出与seqidn°6的多肽同一性的来自cd8α的跨膜结构域(tm)。优选地,本发明的car包含显示出与seqidn°6的多肽至少70%,优选至少80%,更优选至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的tm。本发明的cd22car包含胞内结构域,该胞内结构域包含信号转导结构域或胞内信号结构域。本发明的cd22car的信号转导结构域或胞内信号结构域负责在胞外配体结合结构域与靶标结合之后的胞内信号转导,引起免疫细胞活化和免疫应答(对靶标细胞的细胞裂解活性)。换句话说,信号转导结构域负责表达car的免疫细胞的至少一个正常效应因子功能的活化。例如,t细胞的效应因子功能可以是细胞裂解活性或辅助活性包括细胞因子的分泌。因此,术语“信号转导结构域”是指蛋白中转导效应因子信号功能信号和指导细胞执行特定功能的部分。本发明的cd22car中信号转导结构域的优选实例可以是t细胞受体和协同作用启动信号转导随后抗原受体配合的辅助受体的胞质序列,以及这些序列的任何衍生物或变体和具有相同功能能力的任何合成序列。信号转导结构域包含两类不同的胞质信号转导序列,一类是启动抗原依赖性的一级活化的序列,另一类是在不依赖抗原的方式中作用以提供二级或共刺激信号的序列。一级胞质信号转导序列可以包含已知作为itam的免疫受体酪氨酸基活化基序的信号转导基序。itam是用作syk/zap70类酪氨酸激酶结合位点的发现于多种受体胞浆内尾部、定义明确的信号转导基序。本发明中所用的itam的实例可以包括来源于tcrζ、fcrγ、fcrβ、fcrε、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b和cd66d的那些作为非限制性实例。在优选的实施方式中,car的信号转导结构域可以包含cd3ζ信号转导结构域,该cd3ζ信号转导结构域具有与选自由seqidn°9构成组的氨基酸序列至少70%,优选至少80%,更优选至少90%、95%、97%、99%或100%的序列同一性的氨基酸序列。可选地,所述cd3ζ信号转导结构域包含显示出与seqidn°9至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的多肽序列。在更优选的实施方式中,cd22car的信号转导结构域由seqidn°9的cd3ζ信号转导结构域组成,并且不包括来自人cd28信号转导结构域的任何序列。在特定实施方式中,本发明的car的信号转导结构域包含共刺激信号分子。共刺激信号分子是抗原受体或其有效免疫应答所需的配体之外的细胞表面分子。“共刺激配体”是指抗原递呈细胞上特异性结合t细胞上关联性公共刺激分子从而提供信号的分子,除了由例如tcr/cd3复合物与肽荷载的mhc分子结合提供的一级信号之外,该信号介导t细胞应答,包括但不限于增殖活化、分化等。共刺激配体可以包括但不限于cd7,b7-1(cd80),b7-2(cd86),pd-l1,pd-l2,4-1bbl,ox40l,可诱导共刺激配体(icos-l),细胞间黏附分子(icam,cd30l,cd40,cd70,cd83,hla-g,mica,m1cb,hvem,淋巴毒素β受体,3/tr6,ilt3,ilt4,结合toll配体受体的激动剂或抗体以及特异性结合b7-h3的配体。共刺激配体还包含除其他外,特异性结合递呈在t细胞上的共刺激分子的抗体,如但不限于cd27、4-1bb、ox40、cd30、cd40、pd1、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、ltght、nkg2c、b7-h3、特异性结合cd83的配体。“共刺激分子”是指t细胞上特异性结合共刺激配体从而介导细胞的共刺激应答(如但不限于增殖)的关联性结合伴侣。共刺激分子包括但不限于mhci类分子,btla和toll配体受体。共刺激分子的实例包括于cd27、cd8、4-1bb(cd137)、ox40、cd30、cd40、pd1、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、ltght、nkg2c、b7-h3和特异性结合cd83的配体。在优选的实施方式中,本发明的car的信号转导结构域包含由4-1bb(genbank:aaa53133)的片段组成的共刺激信号分子的一部分。特别是,本发明的car的信号转导结构域包含氨基酸序列,该氨基酸序列包含与选自由seqidn°8组成的组的氨基酸序列至少70%,优选至少80%,更优选至少90%、95%、97%、99%或100%的序列同一性。在更优选的实施方式中,本发明的car的信号转导结构域不包含来自cd28(np_006130.1)的序列。在甚至更优选的实施方式中,本发明的所有实施方式不包含来自cd28(np_006130.1)的序列。在更优选的实施方式中,本发明的cd22car的信号转导结构域包含共刺激信号分子4-1bb(genbank:aaa53133)的一部分,不包含来自cd28(np_006130.1)的序列。本发明提供cd22特异性嵌合抗原受体(cd22car),包含:胞外结构域,包含:-对cd22特异的结合结构域,优选对人cd22特异的结合结构域,更优选对人cd22特异的所述结合结构域是单链可变片段(scfv),-铰链,优选来自cd8α-跨膜结构域,优选来自cd8α-胞内结构域,包含:来自人4-1bb的共刺激信号分子,以及包含人cd3ζ信号转导结构域的胞内信号转导结构域。在优选的实施方式中,本发明的cd22car没有来自cd28的序列。在优选的实施方式中,本发明的cd22car不含任何来自cd28的序列并且包含来自cd8α的前导序列、tm结构域和铰链,优选没有来自cd28的序列并且包含来自cd8α的seqidn°1的前导序列、seqidn°6的tm结构域和seqidn°4的铰链。在一个实施方式中,本发明的cd22car包含来自人cd8α的前导序列(seqidn°1)或者具有与seqidn°1至少95%同一性的前导序列。在另一个实施方式中,本发明的cd22car包含seqidn°2的前导序列或者具有与seqidn°2至少95%同一性的前导序列。在一个实施方式中,本发明提供cd22特异性嵌合抗原受体(cd22car),包含:-对cd22特异的结合结构域,优选对人cd22特异的结合结构域,更优选所述对人cd22特异的结合结构域是单链可变片段(scfv),甚至更优选包含来自m971的vh和vl,-来自人cd8α的铰链-来自人cd8α的跨膜结构域-来自人4-1bb的共刺激信号分子-包含人cd3ζ信号转导结构域的胞内信号转导结构域。在一个实施方式中,本发明提供cd22特异性嵌合抗原受体(cd22car),包含:-对cd22特异的结合结构域,优选对人cd22特异的结合结构域,更优选对人cd22特异的所述结合结构域是单链可变片段(scfv),甚至更优选包含来自m971的vh和vl,-来自人fcriiiα的铰链-来自人cd8α的跨膜结构域-来自人4-1bb的共刺激信号分子-包含人cd3ζ信号转导结构域的胞内信号转导结构域。本发明还提供cd22特异性嵌合抗原受体(cd22car),包含:-对cd22特异的结合结构域,优选对人cd22特异的结合结构域,更优选对人cd22特异的所述结合结构域是单链可变片段(scfv),甚至更优选包含来自m971的vh和vl,-来自人igg1的铰链-来自人cd8α的跨膜结构域-来自人4-1bb的共刺激信号分子-包含人cd3ζ信号转导结构域的胞内信号转导结构域。最后三个实施方式包含具有seqidn°1或seqidn°2,优选seqidn°1的信号肽的cd22car。更优选地,所述cd22car没有来自cd28的序列。本发明的scfv来源于对cd22特异的抗体,它包含由接头与vl结构域分开的vh结构域,所述vh和/或vl结构域有助于与cd22的结合。在优选的实施方式中,本发明的ucart22包含来自m971抗体的scfv,其中vh与vl之间具有gs4接头,vl与cd8α铰链之间具有2r。在本发明中,scfv是对cd22特异的免疫球蛋白——m971的seqidn°12的重链(vh结构域)和seqidn°13轻链(vl结构域)的可变区用接头肽、优选是seqidn°10的接头连接的融合蛋白。在一个实施方式中,本发明的所述scfv还包含前导序列(或信号肽),优选所述前导序列连接到vh结构域。其中所述前导序列连接到vl结构域的实施方式是本发明的一部分。在一个实施方式中,vh结构域连接到铰链,在另一个实施方式中,vl结构域连接到所述铰链。本发明提供scfv,所述scfv连接到具有不同长度的铰链,优选来自cd8α、igg1或fcriiiα(见图2)的铰链,更优选来自cd8α的铰链。优选地,本发明提供cd22car,包含:-信号肽,例如seqidn°2的信号肽或来自cd8αseqidn°1的信号肽。-(scfv),包含由接头与vl结构域分开的vh结构域,所述vh和vl以及接头有助于与cd22的结合,-来自人cd8α链的铰链或者来自人igg1的铰链或来自人fcriiiα的铰链,优选来自cd8α。-来自cd8α的跨膜结构域(tm)-来自人4-1bb的共刺激信号分子-包含cd3ζ信号转导结构域的胞内信号转导结构域。本发明的cd22car中的一种由以下组成:-前导序列(例如,cd8α前导序列或cd8α信号肽)-抗cd22scfv,包含vh、接头和vl,或者vl、接头和vh,所述vh和vl来源于m971·cd8α铰链·cd8αtm·来自4-1bb的共刺激信号分子·胞内cd3ζ信号转导结构域。本发明的cd22car中的一种连续包含:-cd8α信号肽,在细胞表面表达之后可移除,-由qben10识别的表位和由利妥昔单抗识别的表位,-抗cd22scfv,包含vh、接头和vl,所述vh和vl来自m971由利妥昔单抗识别的两个连续表位,·cd8α铰链·cd8αtm·来自4-1bb的共刺激信号分子·胞内cd3ζ信号转导结构域本发明的cd22car中的一种连续包含:-cd8α信号肽,在细胞表面表达之后可移除,-由qben10识别的表位和由利妥昔单抗识别的表位,-抗cd22scfv,包含vh、接头和vl,所述vh和vl来源于m971由利妥昔单抗识别的两个连续表位,·cd8αtm·来自4-1bb的共刺激信号分子·胞内cd3ζ信号转导结构域本发明的cd22car中的一种连续包含:-cd8α信号肽,在细胞表面表达之后可移除,-抗cd22scfv,包含vh、接头和vl,所述vh和vl来自m971由利妥昔单抗识别的两个连续表位,·cd8α铰链·cd8αtm·来自4-1bb的共刺激信号分子·胞内cd3ζ信号转导结构域本发明的cd22car中的一种连续包含:-cd8α信号肽,在细胞表面表达之后可移除,-抗cd22scfv,包含vh、接头和vl,所述vh和vl来自m971由利妥昔单抗识别的两个连续表位,·cd8αtm·来自4-1bb的共刺激信号分子·胞内cd3ζ信号转导结构域本发明的cd22car中的一种连续包含:-cd8α信号肽,在细胞表面表达之后可移除,-抗cd22scfv,包含vh、接头和vl,所述vh和vl来自m971,抗cd19scfv由利妥昔单抗识别的两个连续表位,·cd8α铰链·cd8αtm·来自4-1bb的共刺激信号分子·胞内cd3ζ信号转导结构域本发明的cd22car中的一种连续包含:-cd8α信号肽,在细胞表面表达之后可移除,-抗cd22scfv,包含vh、接头和vl,所述vh和vl来自m971,抗cd19scfv由利妥昔单抗识别的两个连续表位,·cd8αtm·来自4-1bb的共刺激信号分子·胞内cd3ζ信号转导结构域本发明的cd22car中的一种连续包含:-cd8α信号肽,在细胞表面表达之后可移除,-抗cd19scfv和抗cd22scfv,包含vh、接头和vl,所述vh和vl来自m971由利妥昔单抗识别的两个连续表位,·cd8α铰链·cd8αtm·来自4-1bb的共刺激信号分子·胞内cd3ζ信号转导结构域本发明的cd22car中的一种连续包含:-cd8α信号肽,在细胞表面表达之后可移除,-抗cd19scfv和抗cd22scfv,包含vh、接头和vl,所述vh和vl来自m971,由利妥昔单抗识别的两个连续表位,·cd8αtm·来自4-1bb的共刺激信号分子·胞内cd3ζ信号转导结构域。接头–scfv本发明的接头可以是例如五肽(ggggs)n或者(g4s)n或(gly4ser)n的多聚体,其中n=1至4,优选n=3,十八聚体ggssrssssggggsgggg(andris-widhopfetal.,2011)和二十聚体(g4s)4(schaeferetal.,2010)。本发明的接头可以包括具有附加功能的序列,例如表位标签(sblattero&bradbury,2000naturebiotechnology18,75-80),至少在seqidn°20的序列上,优选由接头分开的通常在特定的抗体序列背景下改善本发明的scfv性能的2个序列。在其他接头中,合适于本发明的是十五聚体肽接头(rgrgrgrgrsrgggs)(zhihongshen,hepingyan,yingzhang,raymondl.mernaugh,andxiangqunzeng(2008),analchem.80(6):1910–1917)。在优选的实施方式中,将m971的vh连接到vl序列(或者将vl连接到vh序列)的接头是式(g4s)n的接头,其中n为1-3,优选为n=3的序列(g4s)3(seqidn°10)。在一个实施方式中,本发明提供:cd22car,包含:-seqidn°1的人cd8α前导序列(cd8α前导序列或cd8α信号肽)-抗cd22scfv,包含seqidn°12的vh、seqidn°10的接头和seqidn°13的vlseqidn°4的人cd8α铰链,·seqidn°6的人cd8αtm·seqidn°8的来自4-1bb的共刺激信号分子·seqidn°9的胞内cd3ζ信号转导结构域。在一个实施方式中,本发明还提供:cd22car,包含:-seqidn°1的人cd8α前导序列(cd8α前导序列或cd8α信号肽)-抗cd22scfv,包含seqidn°12的vh、seqidn°10的接头和seqidn°13的vlseqidn°3的人fcγriiiα铰链,·seqidn°6的人cd8αtm·seqidn°8的来自4-1bb的共刺激信号分子·seqidn°9的胞内cd3ζ信号转导结构域。在一个实施方式中,本发明提供:cd22car,包含:-seqidn°1的人cd8α前导序列(cd8α前导序列或cd8α信号肽)-抗cd22scfv,包含seqidn°13的vl、seqidn°10的接头和seqidn°12的vhseqidn°3的人fcγriiiα铰链,·seqidn°6的人cd8αtm·seqidn°8的来自4-1bb的共刺激信号分子·seqidn°9的胞内cd3ζ信号转导结构域。在一个实施方式中,本发明提供:cd22car,包含:-seqidn°1的人cd8α前导序列(cd8α前导序列或cd8α信号肽)-抗cd22scfv,包含seqidn°13的vl、seqidn°10的接头和seqidn°12的vhseqidn°4的人cdaα铰链,·seqidn°6的人cd8αtm·seqidn°8的来自4-1bb的共刺激信号分子·seqidn°9的胞内cd3ζ信号转导结构域。在一个实施方式中,本发明提供cd22特异性嵌合抗原受体(cd22car),包含:-信号肽,其与seqidn°1或seqidn°2的多肽具有至少80%,优选至少90%、95%、97%、99%或100%的序列同一性;优选该信号肽与seqidn°1的多肽具有至少80%,优选至少90%、95%、97%、99%或100%的序列同一性。-由接头与vl结构域分开的vh结构域,所述vh和vl有助于与cd22的结合;所述接头与seqidn°10的多肽具有至少90%、95%、97%、99%或100%的序列同一性。所述vh结构域与seqidn°12的多肽具有至少90%、95%、97%、99%或100%的序列同一性。所述vl结构域与seqidn°13的多肽具有至少90%、95%、97%、99%或100%的序列同一性。-来源于人cd8α链的铰链,其具有与seqidn°4的多肽具有至少80%,更优选至少80%、90%、95%、97%、99%或100%的序列同一性的氨基酸序列。-来源于人cd8α的跨膜结构域,其具有与seqidn°6的多肽具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性的氨基酸序列。-来源于人4-1bb的共刺激信号分子(或4-1bb胞内结构域),其具有与选自由seqidn°8组成的组的氨基酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%、99%或100%的序列同一性的氨基酸序列。-包含cd3ζ信号转导结构域的胞内信号转导结构域,其具有与选自由seqidn°9组成的组的氨基酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%、99%或100%的序列同一性的氨基酸序列。在优选的实施方式中,本发明的cd22特异性嵌合抗原受体(cd22car)不包含来自人cd28特别是来自人cd28内部信号转导结构域的任何序列。在更优选的实施方式中,本发明的cd22特异性嵌合抗原受体(cd22car)不包含来自人cd28特别是来自人cd28内部信号转导结构域的任何序列并且还包含来自cd8α的信号肽,优选与对cd22特异的scfv的vh结构域融合。在一个实施方式中,本发明提供seqidn°15的cd22car。在一个实施方式中,本发明提供cd22car,该cd22car具有与seqidn°15的多肽具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性的氨基酸序列。在一个实施方式中,本发明提供cd22car,该cd22car具有与seqidn°22的多肽具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性的氨基酸序列。本发明的cd22car包含以下序列:v1-m971(fcγriiiα-cd8αtm-41bb.ic-cd3ζ.ic)malpvtallplalllhaarpqvqlqqsgpglvkpsqtlsltcaisgdsvssnsaawnwirqspsrglewlgrtyyrskwyndyavsvksritinpdtsknqfslqlnsvtpedtavyycarevtgdledafdiwgqgtmvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqtiwsylnwyqqrpgkapnlliyaasslqsgvpsrfsgrgsgtdftltisslqaedfatyycqqsysipqtfgqgtkleikglavstissffppgyqiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr(seqidn°14)。v3-m971(cd8α-cd8αtm-41bb.ic-cd3ζ.ic)malpvtallplalllhaarpqvqlqqsgpglvkpsqtlsltcaisgdsvssnsaawnwirqspsrglewlgrtyyrskwyndyavsvksritinpdtsknqfslqlnsvtpedtavyycarevtgdledafdiwgqgtmvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqtiwsylnwyqqrpgkapnlliyaasslqsgvpsrfsgrgsgtdftltisslqaedfatyycqqsysipqtfgqgtkleiktttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr(seqidn°15)。在优选的实施方式中,本发明的cd22car包含以下序列。malpvtallplalllhaarpqvqlqqsgpglvkpsqtlsltcaisgdsvssnsaawnwirqspsrglewlgrtyyrskwyndyavsvksritinpdtsknqfslqlnsvtpedtavyycarevtgdledafdiwgqgtmvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqtiwsylnwyqqrpgkapnlliyaasslqsgvpsrfsgrgsgtdftltisslqaedfatyycqqsysipqtfgqgtkleiktttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr(seqidn°15)。具有来自seqidn°2的信号肽、来自cd8α的tm结构域以及vh与vl结构域之间的接头的cd22car的序列:m971v1m971v3在一个实施方式中,本发明提供以下序列:qvqlqqsgpglvkpsqtlsltcaisgdsvssnsaawnwirqspsrglewlgrtyyrskwyndyavsvksritinpdtsknqfslqlnsvtpedtavyycarevtgdledafdiwgqgtmvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqtiwsylnwyqqrpgkapnlliyaasslqsgvpsrfsgrgsgtdftltisslqaedfatyycqqsysipqtfgqgtkleiktttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapayqqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr。在该cd22car中,缺少信号肽。在一个实施方式中,本发明的ucart22,包含seqidn°20的序列:atggctctgcccgtcaccgctctgctgctgccactggccctgctgctgcacgcagcaagaccacaggtgcagctgcagcagagcggccctggcctggtgaagccaagccagacactgtccctgacctgcgccatcagcggcgattccgtgagctccaactccgccgcctggaattggatcaggcagtccccttctcggggcctggagtggctgggaaggacatactatcggtctaagtggtacaacgattatgccgtgtctgtgaagagcagaatcacaatcaaccctgacacctccaagaatcagttctctctgcagctgaatagcgtgacaccagaggacaccgccgtgtactattgcgccagggaggtgaccggcgacctggaggatgcctttgacatctggggccagggcacaatggtgaccgtgtctagcggaggaggaggatccggaggaggaggatctggcggcggcggcagcgatatccagatg(seqidn°20)。在一个实施方式中,本发明的ucart22,包含seqidn°22的序列。在优选的实施方式中,本发明的ucart22,包含seqidn°22的序列,该seqidn°22的序列插入到人trac基因(如人第14号染色体的trac基因—nc_000014.9)中并在细胞表面表达对cd22的近端部分特异的抗cd22car。在更优选的实施方式中,本发明的ucart22,包含seqidn°20的序列,该seqidn°22的序列插入到人trac基因(如人第14号染色体的trac基因—nc_000014.9)中并在细胞表面表达对cd22的远端部分特异的抗cd22car。在一方面,本发明的cd22car的抗cd22结合结构域是对cd22的远端部分特异的抗cd22结合结构域。ha22-car因此,本发明提供具有以下序列的cd22car:优选地,本发明的ucart22包括序列:在本发明的ucart22中,对cd22的远端部分特异的抗cd22结合结构域可以单独表达或与对cd22的近端部分特异的抗cd22结合结构域一起表达。在一方面,本发明的cd22car的抗cd22结合结构域是经优化的抗cd22结合结构域。如本文所使用的,“经优化的”抗体(或scfv)是指是嵌合免疫球蛋白、免疫球蛋白链或其片段(如fv、fab、fab’、f(ab')2或抗体的其他抗原结合子序列)的抗体(或scfv)形式。优选地,抗体是人免疫球蛋白(受体抗体),其中来自互补决定区(cdr)的残基被来自cdr的残基取代,以达到所需的特异性、亲和力和容量。供体cdr可能经受很少的氨基酸变化,氨基酸变化可以显著影响或改变本发明的cd22car的结合特性。事实上,本发明所提供的其中之一是与表达cd22的细胞的结合(和细胞裂解能力)得到维持,但是亲和力被改变以降低应答强度(细胞因子释放)的cd22car。氨基酸修饰通常是保守的修饰,包括所述car的所述抗体片段和/或所述car分子其他部分的任一项中的氨基酸取代、添加和缺失。可以通过本领域已知的标准技术将修饰引入抗体、抗体片段或本发明的car分子其他部分的任一项中,如定点突变、pcr介导的突变或通过采用优化的种系序列。一般来说,优化后的car将包含至少一个、通常是两个可变结构域的基本全部,其中全部或基本全部的cdr区域对应于原始的人类免疫球蛋白。保守氨基酸取代是指氨基酸残基被具有类似侧链的氨基酸残基取代的取代。本领域已经定义了具有类似侧链的氨基酸残基家族。这些家族包括具有碱性侧链的氨基酸(例如,赖氨酸、精氨酸、组氨酸),具有酸性侧链的氨基酸(例如,天冬氨酸、谷氨酸),具有不带电极性侧链的氨基酸(例如,甘氨酸、天冬氨酸、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸),具有非极性侧链的氨基酸(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、蛋氨酸)、具有β支链的氨基酸(例如,苏氨酸、缬氨酸、异亮氨酸)和具有芳香侧链的氨基酸(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,本发明的car内的一个或多个氨基酸残基可以被来自相同侧链家族的其他氨基酸残基所取代,可以使用本文所描述的功能试验测试改变的car。在优选的实施方式中,本发明提供cd22car,其与seqidn°15的多肽的氨基酸序列相比具有保守序列修饰(或者氨基酸序列改变)。在优选的实施方式中,本发明提供cd22car,其与seqidn°15的多肽的氨基酸序列相比具有2个氨基酸改变。在优选的实施方式中,本发明提供cd22car,其与seqidn°15的多肽的氨基酸序列相比具有3个氨基酸改变。在优选的实施方式中,本发明提供cd22car,其与seqidn°15的多肽的氨基酸序列相比具有4个氨基酸改变。在优选的实施方式中,本发明提供cd22car,其与seqidn°15的多肽的氨基酸序列相比具有5个氨基酸改变,可选包含seqidn°20的至少一个序列。在更优选的实施方式中,本发明提供cd22car,其与seqidn°15的多肽的氨基酸序列相比具有5个氨基酸改变且seqidn°15中至少一个cdr是保守的。在更优选的实施方式中,本发明提供cd22car,其与seqidn°15的多肽的氨基酸序列相比具有1至15个氨基酸改变且seqidn°15中至少一个cdr是保守的。在优选的实施方式中,本发明的cd22car序列通过与野生型cd22car相比改变1、2、3、4、5、6、7、8、9或10个氨基酸而被修饰以减少hama(人抗小鼠应答),而不影响所述car与其靶标(cd22)的结合能力。在优选的实施方式中,本发明提供cd22car,其具有与野生型(野生型是m971)相比具有至少一个氨基酸改变的氨基酸序列,所述至少一个氨基酸改变不影响或者提高所述cd22car在原代t细胞中的结合/或活性。结合特性可以使用最初在mitchellho、satoshinagata和irapastan中描述的适应性技术来修改。isolationofanti-cd22fvwithhighaffinitybyfvdisplayonhumancellspnas2006103(25)9637-9642;publishedaheadofprintjune8,2006,doi:10.1073/pnas.0603653103,其通过引用并入本文。这些经优化的scfv还带有至少一个相当于突变pro-91–thr-92(pt)gly-91–ala-92和val-91–phe-92的突变。在一个实施方式中,本发明提供抗cd22car,包含:-胞外结构域,包含:信号肽包含来自单克隆抗cd22抗体的vh结构域和vl结构域的可选优化的配体结合结构域,其具有以下中的一种:pro-91–thr-92(pt)、gly-91–ala-92、val-91–phe-92突变或等效方式,铰链,包含cd8α铰链-cd8α跨膜结构域和-包含cd3ζ信号转导结构域和来自4-1bb的共刺激结构域的胞质结构域。在优选的实施方式中,本发明提供如上所述的抗cd22car,其中所述单克隆抗cd22抗体来自cdr中具有热点的m971抗体。优选地,以下pro-91–thr-92(pt)、gly-91–ala-92,、val-91–phe-92突变中的一个。在更优选的实施方式中,本发明提供包含抗cd22car的分离的工程化的(tcr和dckko)免疫t细胞,包含:·胞外结构域,包含:信号肽,包含来自单克隆抗cd22抗体的vh结构域和vl结构域的配体结合结构域,其具有以下中的至少一个:pro-91–thr-92、gly-91–ala-92突变;val-91–phe-92突变,铰链,包含cd8α铰链-cd8α跨膜结构域,和-包含cd3ζ信号转导结构域和来自4-1bb的共刺激结构域的胞质结构域。在更优选的实施方式中,本发明提供包含抗cd22car的分离的工程化的(tcr和cd52ko)免疫t细胞,包含:·胞外结构域,包含:信号肽,包含来自单克隆抗cd22抗体的vh结构域和vl结构域的配体结合结构域,其具有以下中的至少一个:pro-91–thr-92、gly-91–ala-92突变;val-91–phe-92突变,铰链,包含cd8α铰链-cd8α跨膜结构域和-包含cd3ζ信号转导结构域和来自4-1bb的共刺激结构域的胞质结构域。在更优选的实施方式中,本发明提供包含抗cd22car的分离的工程化的(tcr、cd52和dckko)免疫t细胞,包含:·胞外结构域,包含:信号肽,包含来自单克隆抗cd22抗体的vh结构域和vl结构域的配体结合结构域,其具有以下中的至少一个:pro-91–thr-92、gly-91–ala-92突变;val-91–phe-92突变,铰链,包含cd8α铰链-cd8α跨膜结构域和-包含cd3ζ信号转导结构域和来自4-1bb的共刺激结构域的胞质结构域。在一方面,car22可以与至少一个、优选两个、更优选三个单克隆抗体(mab)特异的表位共表达在细胞表面,所述mab特异的表位可以与cd8的跨膜结构域融合。在一个实施方式中,所述mab特异的表位是利妥昔单抗识别的表位,和/或来自qben10的表位,并且与cd22car共表达的肽是rqr8。在另一个实施方式中,可以将至少一个、优选两个、更优选三个单克隆抗体(mab)特异表位插入到对cd22特异的scfv的接头l(将vh结合到vl)和/或cd22car的铰链中。分子抗体(mab)特异表位可以是以下单克隆抗体特异性识别的mab特异性表位中的一种:替伊莫单抗、莫罗单抗-cd3、托西莫单抗、阿昔单抗、巴利昔单抗、本妥昔单抗、西妥昔单抗、英夫利昔单抗、利妥昔单抗、阿仑单抗、贝伐珠单抗、赛妥珠单抗、达利珠单抗、依库珠单抗、依法利珠单抗、吉妥珠单抗、那他珠单抗、奥马珠单抗、帕利珠单抗、雷珠单抗、托珠单抗、曲妥珠单抗、维多珠单抗(vedolizumab)、阿达木单抗、贝利木单抗、康纳单抗(canakinumab)、地诺单抗、戈利木单抗、易普利姆玛、奥法木单抗、帕尼单抗、qbend-10和乌司奴单抗,优选利妥昔单抗(r)和/或qbend-10。表位特异mab可以用于表达cd22的免疫细胞的体外细胞分选和/或体内细胞耗竭。在特定实施方式中,本发明的cd22car的胞外结合结构域可以包含以下序列中的一种:v1-l1-v2-(l)x-表位1-(l)x-;v1-l1-v2-(l)x-表位1-(l)x-表位2-(l)x-;v1-l1-v2-(l)x-表位1-(l)x-表位2-(l)x-表位3-(l)x-;(l)x-表位1-(l)x-v1-l1-v2;(l)x-表位1-(l)x-表位2-(l)x-v1-l1-v2;表位1-(l)x-表位2-(l)x-表位3-(l)x-v1-l1-v2;(l)x-表位1-(l)x-v1-l1-v2-(l)x-表位2-(l)x;(l)x-表位1-(l)x-v1-l1-v2-(l)x-表位2-(l)x-表位3-(l)x-;(l)x-表位1-(l)x-v1-l1-v2-(l)x-表位2-(l)x-表位3-(l)x-表位4-(l)x-;(l)x-表位1-(l)x-表位2-(l)x-v1-l1-v2-(l)x-表位3-(l)x-;(l)x-表位1-(l)x-表位2-(l)x-v1-l1-v2-(l)x-表位3-(l)x-表位4-(l)x-;v1-(l)x-表位1-(l)x-v2;v1-(l)x-表位1-(l)x-v2-(l)x-表位2-(l)x;v1-(l)x-表位1-(l)x-v2-(l)x-表位2-(l)x-表位3-(l)x;v1-(l)x-表位1-(l)x-v2-(l)x-表位2-(l)x-表位3-(l)x-表位4-(l)x;(l)x-表位1-(l)x-v1-(l)x-表位2-(l)x-v2;或者,(l)x-表位1-(l)x-v1-(l)x-表位2-(l)x-v2-(l)x-表位3-(l)x;其中,v1是vl,优选具有seqidn°12,v2是vh,优选具有seqidn°13,或者v1是vh,而v2是vl;l1是适合于将vh链连接到vl链的接头,优选seqidn°10l是包含甘氨酸和丝氨酸残基的接头,胞外结合结构域中l的每次出现都可以与相同胞外结合结构域中l的其他出现相同或不同,并且x是0或1,x每次出现都是相互独立地选择;且,表位1、表位2和表位3是mab特异性表位,并且可以是相同的或不同的。在一个实施方式中,胞外结合结构域包含以下序列中的一种:v1-l1-v2-l-表位1;v1-l1-v2-l-表位1-l;v1-l1-v2-l-表位1-l-表位2;v1-l1-v2-l-表位1-l-表位2-l;v1-l1-v2-l-表位1-l-表位2-l-表位3;v1-l1-v2-l-表位1-l-表位2-l-表位3-l;v1-l1-v2-表位1;v1-l1-v2-表位1-l;v1-l1-v2-表位1-l-表位2;v1-l1-v2-表位1-l-表位2-l;v1-l1-v2-表位1-l-表位2-l-表位3;v1-l1-v2-表位1-l-表位2-l-表位3-l;表位1-v1-l1-v2;表位1-l-v1-l1-v2;l-表位1-v1-l1-v2;l-表位1-l-v1-l1-v2;表位1-l-表位2-v1-l1-v2;表位1-l-表位2-l-v1-l1-v2;l-表位1-l-表位2-v1-l1-v2;l-表位1-l-表位2-l-v1-l1-v2;表位1-l-表位2-l-表位3-v1-l1-v2;表位1-l-表位2-l-表位3-l-v1-l1-v2;l-表位1-l-表位2-l-表位3-v1-l1-v2;l-表位1-l-表位2-l-表位3-l-v1-l1-v2;v1-l-表位1-l-v2;l-表位1-l-v1-l-表位2-l-v2;v1-l-表位1-l-v2-l-表位2-l;v1-l-表位1-l-v2-l-表位2-l-表位3;v1-l-表位1-l-v2-l-表位2-表位3;v1-l-表位1-l-v2-l-表位2-l-表位3-表位4;l-表位1-l-v1-l-表位2-l-v2-l-表位3-l;表位1-l-v1-l-表位2-l-v2-l-表位3-l;l-表位1-l-v1-l-表位2-l-v2-l-表位3;l-表位1-l-v1-l1-v2-l-表位2-l;l-表位1-l-v1-l1-v2-l-表位2-l-表位3;l-表位1-l-v1-l1-v2-l-表位2-表位3或表位1-l-v1-l1-v2-l-表位2-l-表位3-表位4;其中v1是vl而v2是vh;或者v1是vh而v2是vl;并且vh和vl是来自m971的经优化的vh和vl。l1是适合于将vh链连接到vl链的任何接头;l是包含甘氨酸和丝氨酸残基的接头,胞外结合结构域中l的每次出现都可以与相同胞外结合结构域中l的其他出现相同或不同,并且表位1、表位2和表位3是mab特异性表位,并且可以是相同的或不同的。l1是包含甘氨酸和/或丝氨酸的接头,优选地,l1是包含氨基酸序列(gly-gly-gly-ser)n或(gly-gly-gly-gly-ser)n的接头,其中n是1、2、3、4或5,或者接头包含氨基酸序列(gly4ser)4或(gly4ser)3。类似地,l是包含甘氨酸和/或丝氨酸的接头,优选地,l是具有选自以下各项的氨基酸序列的接头:sgg、ggs、sggs、ssggs、gggg、sgggg、ggggs、sggggs、gggggs、sgggggs、sggggg、gsggggs、gggggggs、sggggggg、sgggggggs和sggggsggggs,优选l是sgggg、ggggs或sggggs。在优选的实施方式中,表位1、表位2、表位3和表位4独立选自由以下各项特异性识别的mab特异性表位:替伊莫单抗、莫罗单抗-cd3、托西莫单抗、阿昔单抗、巴利昔单抗、本妥昔单抗、西妥昔单抗、英夫利昔单抗、利妥昔单抗、阿仑单抗、贝伐珠单抗、赛妥珠单抗、达利珠单抗、依库珠单抗、依法利珠单抗、吉妥珠单抗、那他珠单抗、奥马珠单抗、帕利珠单抗、雷珠单抗、托珠单抗、曲妥珠单抗、维多珠单抗(vedolizumab)、阿达木单抗、贝利木单抗、康纳单抗(canakinumab)、地诺单抗、戈利木单抗、易普利姆玛、奥法木单抗、帕尼单抗、qbend-10和乌司奴单抗,优选利妥昔单抗(r)和/或qbend-10,优选表位1、表位2、表位3和表位4由利妥昔单抗或qbend-10识别。表位1、表位2、表位3和表位4是被以下各项特异性识别的mab特异性表位:因此mab特异性表位可以包含选自以下各项的一个多肽:cpysnpslc,nsellslindmpitndqkklmsnn,cqfdlstrrlkc,cqynlssralkc,cvwqrwqksyvc,cvwqrwqksyvc,sfvlnwyrmspsnqtdklaafpedr,sgtylcgaislapkaqike,elptqgtfsnvstnvspakpttta,elptqgtfsnvstnvspakpttta,gqndtsqtssps。在优选的实施方式中,mab特异性表位是具有elptqgtfsnvstnvspakpttta和/或cpysnpslc(seqidn°19)氨基酸序列的mab特异性表位。在更优选的实施方式中,本发明的cd22car包含3个具有cpysnpslc(r)氨基酸序列的mab特异性表位和一个具有elptqgtfsnvstnvspakpttta(q)氨基酸序列的表位。在甚至更优选的实施方式中,本发明的cd22car包含2个位于紧接vl之后、铰链nt部分、具有cpysnpslc(r)氨基酸序列的mab特异性表位。在一方面,可以将与利妥昔单抗结合的至少一个序列(r)和/或与qbend10结合的序列(q)插入到接头ggggsggggsggggs和/或先前wo2016120216中所描述的铰链中。在特定实施方式中,本发明的cd22car是单链car(sccar)。在特定实施方式中,本发明的单链cd22car包含来自m971的scfv和至少一个其他结合结构域,优选对cd22的远端部分特异,可替代地对另一种b细胞抗原特异,特别是在b细胞恶性肿瘤表达的情况下,如cd34、cd10、cd79a、cd20、igd、cd5、cd23、cd19、stat5、cd3、cd30、bcma。在特定实施方式中,本发明的cd22car是多链car(mccar)。多链cd22car是本发明的一部分,并且可以按照wo2014039523中所详细描述的来产生,wo2014039523通过引用合并入本文。在特定实施方式中,免疫球蛋白的vh结构域和vl结构域或者对cd22特异的免疫球蛋白的一部分可以由多链car中两个不同且分离(非共价结合)的链来携带。在多链形式中,本发明的cd22car包含至少两个、优选三个跨膜结构域(相互之间无共价结合),其中至少一个跨膜结构域包含本发明的对cd22特异的scfv。在特定实施方式中,优选来自m971的对cd22特异的免疫球蛋白的vh结构域和vl结构域可以由多链car的一条链来携带。图2提供了本发明的sccd22car和mccd22car的实例。在特定实施方式中,对cd22特异的免疫球蛋白的vh结构域和vl结构域(优选来自m971)可以由多链car的一条链来携带,而对cd22特异的另一种免疫球蛋白的vh结构域和vl结构域可以由多链car的另一条链来携带。通常在癌细胞中观察到靶标抗原的下调或突变,从而产生抗原丢失逃逸变体。因此,为了抵消肿瘤逃逸并使免疫细胞对靶标更具特异性,根据本发明的cd22特异性car可以包含另一个胞外配体结合结构域,以同时结合靶标中的其他元件,从而增强免疫细胞的活化和功能。在一个实施方式中,胞外配体结合结构域可以串联设置在同一跨膜多肽上,并且可选地可由接头分开。在另一个实施方式中,可以将所述不同的胞外配体结合结构域放置在组成多链car的不同跨膜多肽上。在另一个实施方式中,本发明涉及包含不同的胞外配体结合结构域的car群,每个都对cd22具有特异性。在一个实施方式中,对cd22特异的胞外结合结构域和第二胞外结合结构域在同一sccar上。在另一个实施方式中,对cd22特异的胞外结合结构域和第二胞外结合结构域在同一mccar上,并且属于所述mccar的相同或两个不同且非共价结合的跨膜结构域。其他第二胞外结合结构域可以是与病理细胞上cd22相关(共表达,甚至是暂时表达)的抗原特异性结合的任何胞外结合结构域,例如cd34、cd10、cd79a、cd20、igd、cd5、cd23、cd19、stat5、cd3、cd30、bcma、pax5、cd19、cd20、cd30、糖鞘脂、主要组织相容性复合物(mhc)分子、ig、cd3、cd34、cd79优选cd79a、cd138、b7-1(cd80)、b7-2(cd86)、主要组织相容性复合物(mhc)分子、bcma(cd269、tnfrsf17)或flt-3、pax5。本发明还提供:相关的cd22car核酸,cd22car重组表达载体,工程化的tcrko细胞(优选包含至少另一个具有cd22car的经编辑的基因的t细胞),具有cd22car的所述tcrko细胞的群体以及与cd22car、蛋白质、表达载体、表达本发明的所述cd22car的工程化的tcrkocd52ko细胞有关的药物组合物。本发明提供以下目的:本发明的cd22car相关的核酸,重组表达载体,包含至少另一个经编辑的基因(选自赋予对低氧的耐受性的基因、赋予对阿仑单抗的耐受性的基因、赋予对蛋白酶抑制剂例如硼替佐米的耐受性的基因,赋予对pna(dck)的耐受性的基因)并具有cd22car的工程化的tcrko细胞,以及相关的核酸,包含如下至少另一个经编辑的基因并具有所述cd22car的工程化的tcrko细胞的群体,以及包含相同目的作为药物的药物组合物。多核苷酸,载体:本发明涉及编码根据本发明的上述cd22car的多核苷酸,载体。多核苷酸可以包含在表达盒或表达载体中(例如用于导入细菌宿主细胞的质粒,或用于转染昆虫宿主细胞的病毒载体如杆状病毒载体,或用于导入哺乳动物优选人类宿主细胞的质粒或病毒载体如慢病毒或腺相关病毒。在一个特定的实施方式中,不同的核酸序列可以包含在一个多核苷酸或载体中,该多核苷酸或载体包含编码核糖体跳跃序列的核酸序列,如编码2a肽的序列。在小核糖核酸病毒的甲状旁腺病毒亚组中鉴定出的2a肽导致核糖体从一个密码子“跳跃”到下一个密码子,而在密码子编码的两个氨基酸之间未形成肽键(请参阅:donnellyandelliott2001;atkins,willsetal.2007;doronina,wuetal.2008)。因此,本发明提供如图4所示的载体,其编码由肽2a连接的rqr8和抗cd22car。“密码子”是指mrna(或dna分子的有义链)上被核糖体翻译成一个氨基酸残基的三个核苷酸。因此,当多肽被在框内(inframe)的2a寡肽序列分开时,可以从mrna内的单个连续的开放阅读框合成两个多肽。这种核糖体跳跃机制在本领域中是众所周知的,并且已知由几种载体用于表达由单个信使rna编码的若干种蛋白质。允许本发明的cd22car在细胞中表达的载体是本发明的另一个目的。在优选的实施方式中,所述载体允许瞬时表达本发明的cd22car。在更优选的实施方式中,所述载体通过将编码所述cd22car的序列插入细胞基因组而允许本发明的cd22car的组成性和稳定表达。本发明的cd22car的表达和/或表达本发明的cd22car的细胞的存活情况可以使用如r.kuhn,f.schwenk,m.aguet,k.rajewsky.induciblegenetargetinginmice.science8september1995:vol.269no.5229pp.1427-1429doi:10.1126/science.7660125和引用文献中描述的在诱导型启动子控制下的基因来控制。在一个实施方式中,提供了一种cd22car,其中胞外结构域包含位于m971scfv结构域与来自人cd8α的铰链之间的seqidn°19(cpysnpslc)的至少两个cd20模拟表位。文献专利wo2016120216a1公开了制备这种结构的方法,通过引用并入本文。在一个实施方式中,本发明提供了一种载体,包含选自seqidn°22的编码cd22car的序列。为了将跨膜多肽导入宿主细胞的分泌途径,在多核苷酸序列或载体序列中提供了分泌信号序列(也称为前导序列,前原序列或前序列)。分泌信号序列可操作地连接到跨膜核酸序列,即,两个序列在正确的阅读框中连接并定位成将新合成的多肽引导到宿主细胞的分泌途径中。分泌信号序列通常位于编码目的多肽的核酸序列的5'端,尽管某些分泌信号序列可以位于目的核酸序列中的其他位置(参见:例如,welch等人,5,037,743号美国专利;holland等,5,143,830号美国专利)。在优选的实施方式中,信号肽包含氨基酸序列seqidn°1和seqidn°2。在更优选的实施方式中,本发明的car的信号肽包含来自人cd8α的seqidn°1的氨基酸序列。本领域技术人员将认识到,鉴于遗传密码的简并性,在这些多核苷酸分子之间可能存在相当大的序列变异。优选地,本发明的核酸序列被密码子优化以在哺乳动物细胞中表达,优选地在人细胞中表达。密码子优化是指在目标序列中将某一特定物种的高表达基因中通常稀有的密码子由在该物种的高表达基因中通常常见的密码子进行交换,例如编码氨基酸的密码子作为交换的密码子。工程化具有cd22car的免疫细胞的方法:本发明包括制备用于免疫疗法的免疫细胞的方法,包括将编码本发明的cd22car之一的多核苷酸或载体离体引入所述免疫细胞,优选如前文所述具有seqidn°1。在优选的实施方式中,考虑到在免疫细胞中稳定表达,所述多核苷酸被包含在载体中。根据另外的实施方式,所述方法进一步包括遗传修饰所述细胞以使其更适合于过继转移和/或与影响所述免疫细胞存活的药物一起使用的步骤,特别是单独用于移植(也称为同种异体移植或同种移植)或与免疫细胞对其产生耐受性的药物组合使用。在后一种情况下,工程化的细胞可以首先从供体中分离出来,与细胞对其产生耐受性的药物一起重新注入同一供体中。对于对基因进行编辑而言,此处意味着修饰基因或使基因失活,例如突变基因,缺失基因,在基因中插入序列,对所述基因(包括基因的启动子)的甲基化进行修饰等等,在pa201670503中描述的方法通过引用并入本文并且在以下示例中示出。macleodetal.,integrationofacd19carintothetcralphachainlocusstreamlinesproductionofallogeneicgene-editedcartcells,moleculartherapy(2017),http://dx.doi.org/10.1016/j.ymthe.2017.02.005中描述的方法通过引用并入本文,也是本发明中所用方法的可能的替代方案,用于通过过度表达hif-1a制备tcrkocd22car或具有对低氧的耐受性的cd22car的细胞。本发明的方法基于细胞同源性定向修复(hdr)机制来在trac基因(编码tcr的tcrα亚基)中“敲入”cd22car,从而产生更有效的产物。先前已在t细胞中使用与crispr/cas9配对的短寡核苷酸对具有外源dna序列的hdr进行了描述。其他研究表明,腺相关病毒(aav)载体可以与位点特异性核酸酶crispr/cas9或megatal结合用作模板,以通过hdr实现基因插入。在本发明中,提供了一种结合腺相关病毒(aav)载体和talen将car插入tcr基因的新方法。在ucart22中,aav6载体可以在使用基因如trac基因(编码α亚基或tcr的基因)或pct/ep2017/076798中公开的任何基因的特异性talen进行基因编辑后使用。因为talen对dna序列是特异性的并且允许将序列整合入基因(优选trac基因),所以本发明还提供工程化的免疫细胞,包含编码car(优选如上所述的由所用的talen确定的位于trac基因的精确区域中的cd22car)的序列。由于talen特异性,所述工程化的免疫细胞的trac基因中的序列是独特的。因此,本发明提供一种工程化的免疫细胞,包含以下序列;(yyy)n-zzz-(xxx)m其中n为=1至至少10m为=1至100,优选m为>100,代表待整合序列的碱基对的数目,其中zzz编码自切割肽,例如2a肽,与trac编码序列在框内,y是a或t或g或c并且侧接(flanking)或包含由talen靶向的trac基因的序列,talen包含至少ttgtcccacagatatc,优选ttgtcccacagatatccag,(xxx)n是a或t或g或c以及待插入trac基因的外源序列的一部分,优选为编码car的序列,更优选为编码cd22car的序列。在一个实施方式中,缺失trac基因,并在trac启动子的控制下表达插入的基因。另外的或替代的序列,例如ires内部核糖体进入位点;可以介于talen靶标与xxx之间。在本发明中,talen靶标是seqidn°21而carcd22是seqidn°22。在一个实施方式中,由所述talen切割的序列是agaaccctgaccctg。取决于插入序列,在本发明的工程化的细胞中,序列agaaccctgaccctg可以是至少部分保守的(参见图9)。本发明提供了一种工程化的免疫细胞,包含含有seqidn°22的trac基因。本发明提供一种工程化的免疫细胞,包含插入trac基因中(优选在基因座agaaccctgaccctg的任何地方)的编码对cd19特异的car的序列或对cd22特异的car的序列。因此,在特定的实施方式中,本发明的工程化的免疫细胞包含两种不同的编码car的序列并表达所述两种不同的car。在细胞表面,不可检测水平的tcr。因此,在特定的实施方式中,本发明的工程化的免疫细胞包含两种不同的编码car的序列并表达所述两种不同的car。在细胞表面,不可检测水平的tcr和mhci类。本发明的工程化的免疫细胞包含在其基因组trac基因中的编码cd22的序列(优选为seqidn°22),以及其中插入了编码对cd19特异的car的另一外源基因的另一基因组序列。本发明的工程化的免疫细胞包含在其基因组trac基因中的编码cd22的序列(优选为seqidn°22),以及其中插入了编码对cd34特异的car的另一外源基因的另一基因组序列。本发明的工程化的免疫细胞包含在其基因组trac基因中的编码cd22的序列(优选为seqidn°22),以及其中插入了编码对cd79a特异的car的另一外源基因的另一基因组序列。本发明的工程化的免疫细胞包含在其基因组trac基因中的编码cd22的序列(优选为seqidn°22),以及其中插入了编码对cd79b特异的car的另一外源基因的另一基因组序列。本发明的工程化的免疫细胞包含在其基因组trac基因中的编码cd22的序列(优选为seqidn°22),以及其中插入了编码对cd10特异的car的另一外源基因的另一基因组序列。本发明的工程化的免疫细胞包含在其基因组trac基因中的编码cd22的序列(优选为seqidn°22),以及其中插入了编码对igd特异的car的另一外源基因的另一基因组序列。本发明的工程化的免疫细胞包含在其基因组trac基因中的编码cd22的序列(优选为seqidn°22),以及其中插入了编码对cd5特异的car的另一外源基因的另一基因组序列。本发明的工程化的免疫细胞包含在其基因组trac基因中的编码cd22的序列(优选为seqidn°22),以及其中插入了编码对cd23特异的car的另一外源基因的另一基因组序列。本发明的工程化的免疫细胞包含在其基因组trac基因中的编码cd22的序列(优选为seqidn°22),以及其中插入了编码对cd30特异的car的另一外源基因的另一基因组序列。本发明的工程化的免疫细胞包含在其基因组trac基因中的编码cd22的序列(优选为seqidn°22),以及其中插入了编码对bcma特异的car的另一外源基因的另一基因组序列。本发明的工程化的免疫细胞包含在其基因组trac基因中的编码cd22的序列(优选为seqidn°22),以及其中插入了编码对flt3特异的car的另一外源基因的另一基因组序列。本发明的工程化的免疫细胞包含在其基因组trac基因中的编码cd22的序列(优选为seqidn°22),以及其中插入了编码对cd138特异的car的另一外源基因的另一基因组序列。本发明的工程化的免疫细胞包含在其基因组trac基因中的编码cd22的序列(优选为seqidn°22),以及其中插入了编码对cd80特异的car的另一外源基因的另一基因组序列。本发明的工程化的免疫细胞包含在其基因组trac基因中的编码cd22的序列(优选为seqidn°22),以及其中插入了编码对cd86特异的car的另一外源基因的另一基因组序列。其中插入了编码第二car的另一外源基因的另一基因组序列可以是pct/ep2017/076798或wo2017069958a2中公开的任何基因。可以将编码car的其他外源基因与自切割肽和cd22car序列(优选seqidn°)在框内地插入到trac基因,或插入编码pct/ep2017/076798中所描述的蛋白质的另一基因,或选自pd1(uniprotq15116)、ctla4(uniprotp16410)、ppp2ca(uniprotp67775)、ppp2cb(uniprotp62714)、ptpn6(uniprotp29350)、ptpn22(uniprotq9y2r2)、lag3(uniprotp18627)、havcr2(0q7z6a9)、cd160(uniproto95971)、tigit(uniprotq495a1)、cd96(uniprotp40200)、crtam(uniproto95727)、lair1(uniprotq6gtx8)、siglec7(uniprotq9y286)、siglec9(uniprotq9y336)、uniproto14763)、tnfrsf10a(uniproto00220)、casp8(uniprotq14790)、casp10(uniprotq92851)、casp3(uniprotp42574)、casp6(uniprotp55212)、casp7(uniprotp55210)、fadd(uniprotq13158)、fas(uniprotp25445)、tgfbrii(uniprotp37173)、tgfrbri(uniprotq15582)、smad2(uniprotq15796)、smad3(uniprotp84022)、smad4(uniprotq13485)、(uniprotb7zsb5)、ski(uniprotp12755)、skil(uniprotp12757)、tgif1(uniprotq15583)、il10ra(uniprotq13651)、il10rb(uniprotq08334)、hmox2(uniprotp30519)、il6r(uniprotp08887)、il6st(uniprotp40189)、eif2ak4(uniprotq9p2k8)、csk(uniprotp41240)、pag1(uniprotq9y3p8)、sit1(uniprotq9y3p8)、foxp3(uniprotq9bzs1)、prdm1(uniprotq60636)、batf(uniprotq165q02108)、gucy1b2(uniprotq8bxh3)和gucy1b3(uniprotq02153)。ucart22中优选的编辑(ko)基因是nfrsf10b(uniproto14763)、tnfrsf10a(uniproto00220)、il10ra(uniprotq13651)、il10rb(uniprotq08334)、tgfbrii(uniprotp37173)、tgfrbri(uniprotq15582)、pd1(uniprotq15116)、ctla4(uniprotp16410)、lag3(uniprotp18627)、havcr2(uniprotq8tdq0)、tigit(uniprotq495a1)。优选地,其中插入了第二car的基因是选自表a中所述的任一种的在t细胞活化期间活跃的基因组基因:表a或者在如pct/ep2017/076798或表aa中所公开的安全港基因座中表aa:zfp640锌指蛋白640loc100038422未表征的loc100038422zfp600锌指蛋白600serpinb3a丝氨酸(或半胱氨酸)肽酶抑制剂,进化枝b(卵清蛋白),成员3atas2r106味觉受体,2型,成员106magea3黑色素瘤抗原,a家族,3omt2a卵母细胞成熟,αcpxcr1cpx染色体区,候选基因1hsf3热休克转录因子3pbsnprobasinsbp精胺结合蛋白wfdc6bwap四-二硫化物核心结构域6bmeiob具有ob结构域的减数分裂特异性dnm3os动力蛋白3,相反链skint11上皮内t细胞的选择与维持11其中可以插入第二car的另一个基因可以是选自以下的编码表b中的蛋白质中的任一种的基因:表b可以使用用于插入cd22car或本文公开的另一基因的aav载体、优选aav6载体、甚至更优选aav6/2载体来制备ucart22。可以使用特异性核酸内切酶在遗传编辑基因如trac基因(编码α亚基或tcr的基因)或pct/ep2017/076798中公开的任何基因后使用aav载体。过继细胞转移是将细胞转移到患者体内。这些细胞可能来自患者本人,随后在转移回之前(自体转移)发生了改变,或者它们可能来自另一个体。细胞最常见地是来源于免疫系统,目的是将改善的免疫功能和特性与细胞一起转移回至患者。转移自体细胞或来自患者的细胞可最大程度地减少移植物抗宿主疾病(gvhd)或者组织或器官排斥。类似地,转移tcr缺陷的t细胞cd22cart细胞可使gvhd最小化。传输tcr缺陷的mhci缺陷的cd22cart将gvhd和hvgd降至最低。在一个实施方式中,遗传修饰(工程化)所述免疫细胞的步骤发生在将编码本发明的cd22car之一的多核苷酸或载体引入所述细胞的步骤之前。根据第一方面,可以使免疫细胞减少同种异体性,例如通过失活至少一个表达如wo2013/176915中所述的t细胞受体(tcr)中的一种或多种成分的基因,其可以与如wo2008102199或wo2015136001或wo2016201047中描述的使编码或调节hla表达的基因(例如β2m基因)失活相结合,它们全部通过引用并入本文。因此,显著降低了移植物抗宿主综合征的风险和移植物排斥的风险。根据另一方面,可以对本发明的免疫细胞进行进一步遗传工程化,以提高工程化的免疫细胞对免疫抑制药物或化学疗法的耐受性,如wo201575195所公开的,上述免疫抑制药物或化学疗法被用作治疗cd22阳性恶性细胞的标准护理,wo201575195通过引用并入本文。对campath(阿仑单抗)的耐受性在一个优选的实施方式中,可以失活以便为t细胞赋予药物耐受性的基因是糖皮质激素受体(gr)和cd52。对基因进行失活以使细胞对这些治疗产生耐受性,并使它们比患者自身的不具有特异性cd22car的t细胞具有竞争优势。使用tale核酸酶或crisprcas9系统对本发明的工程化的免疫细胞中的cd52和trac基因进行失活。在一个更优选的实施方式中,可以失活以为t细胞赋予药物耐受性的基因是具有cd22car的tcrko免疫t细胞中的cd52。在一个优选的实施方式中,可以失活以为t细胞赋予药物耐受性的基因是糖皮质激素受体(gr)。还可以抑制或降低cd3基因的表达来赋予对teplizumab的耐受性,teplizumab是另一种免疫抑制药物。根据本发明,还可以抑制或降低hprt的表达来赋予对6-硫鸟嘌呤的耐受性,6-硫鸟嘌呤是化学疗法中常用的细胞抑制剂,特别是用于治疗急性淋巴细胞性白血病。通过缺失人脱氧胞苷激酶(dck)基因对嘌呤核苷酸类似物的耐受性。在一个优选的实施方式中,可以失活以为t细胞赋予药物耐受性的基因是人脱氧胞苷激酶(dck)基因。该酶是脱氧核糖核苷脱氧胞苷(dc)、脱氧鸟苷(dg)和脱氧腺苷(da)磷酸化所必需的。嘌呤核苷酸类似物(pna)通过dck代谢为单磷酸、二磷酸和三磷酸pna。它们的三磷酸盐形式,特别是氯法拉滨三磷酸盐与atp竞争用于dna合成,充当促凋亡剂,并且是参与三核苷酸生成的核糖核苷酸还原酶(rnr)的有效抑制剂。在本发明的工程化的免疫细胞中dck基因的失活是由tale核酸酶或crispr/cas9系统介导的。为了实现该目标,设计了若干对dcktale核酸酶,在多核苷酸水平上组装并通过测序进行验证。pct/ep2014/075317中描述了根据本发明可以使用的tale核酸酶对的实例。本发明的工程化的免疫细胞中的这种dck失活赋予了对嘌呤核苷类似物(pna)例如氯法拉滨和氟达拉滨的耐受性。在另一个优选的实施方式中,本发明的工程化的免疫细胞中dck失活与trac基因的失活相结合,使得这些双重敲除(ko)(tcr或tracko和dckko)的细胞既对药物如氯法拉滨的耐受又具有更少的同种异体性。在另一个优选的实施方式中,本发明的工程化的免疫细胞中cd52失活与trac基因失活相结合,使得这些双重敲除(ko)(tcr或tracko和cd52ko)的细胞既对药物如campath(阿仑单抗)耐受又具有更少的同种异体性。该双重特征对于治疗目的特别有用,允许“现成的”同种异体细胞(ucart22)结合化疗进行免疫疗法治疗需要治疗的癌症患者。该双重ko失活dck/trac或cd52/trac可以同时或顺序地进行。pct/ep2014/075317描述了在本发明中获得成功的tale核酸酶dck/trac对的一个实例,特别是2个基因座中的靶序列(dck和trac)。文献pct/ep2014/075317全文引入本文。本发明提供了表达seqidno.15的cd22car的原代t细胞,其中,通过缺失使cd52和trac基因失活,以将它们用于治疗cll、all,优选它们的侵袭性、复发的难治性形式,可选地在淋巴耗竭的患者中,更优选复发的难治形式的b-all。根据本发明的另一个方面,可以通过使编码蛋白质的基因失活来进一步操纵免疫细胞,使其更活跃或有限消耗,这些蛋白质充当起t细胞活化的调节剂作用的“免疫检查点”,例如pdcd1或ctla-4。表9中列出了可以减少或抑制表达的基因实例。本发明还提供表达seqidn°15的cd22car的原代t细胞,其中缺失cd52、trac和dck基因。在另一个实施方式中,本发明还提供了表达使得对低氧产生耐受的cd22car的原代t细胞。本发明还提供了表达seqidn°15的cd22car的原代t细胞,其中缺失了cd52、trac和dck基因,并插入了hif-1a的序列以使细胞对低氧耐受。对低氧耐受的工程化的细胞在特定的实施方式中,对本发明的cd22cart细胞的表达和细胞裂解活性被维持,或者对在低氧条件下(低氧)(将正常氧条件下20%的o2与1-5%的o2相比)诱导的cd22cart细胞的表达和活性被维持,并且当嵌入组织中时所述细胞仍会靶向并破坏癌症细胞。wo2013123061或juillerat,a.etal.anoxygensensitiveself-decisionmakingengineeredcart-cellsci.rep.7,39833;doi:10.1038/srep39833(2017)中描述了t细胞中低氧可诱导car的实例,两者通过引用合并入本文:构建体了对驱动cd22car表达的oxitf具有特异性的合成启动子。oxitf是设计用于活化编码cd22car的合成遗传元件。一旦遇到肿瘤(产生低氧)后,工程化的t细胞可以“检测”到氧水平的下降(与血液中o2的平均水平相比)并触发cd22car的表达。cd22car的细胞表面暴露使得能够识别低氧条件下的肿瘤抗原,这最终通过所述cd22car中存在的活化和共刺激结构域触发t细胞的活化和增殖。最终,表达肿瘤抗原的细胞被本发明的ucart22裂解。在本发明中,免疫细胞还可以经工程化以通过使以下因子中的至少一种、优选所有过表达:oct3、oct4、sox2、klf4和c-myc,或编辑hif-1a因子来使得在低氧条件下(低氧浓度是1-5%)保持有效。在本发明中,成功构建体并测试了表达氧敏感的cd22单链car的工程化的细胞和表达对低氧耐受的cd22car的工程化的细胞。由于cd22主要在表达cd22的b细胞恶性肿瘤上表达,b恶性肿瘤是“液态”肿瘤,因此与实体瘤相反,它不产生低氧,因此,预期对低氧耐受的cd22car工程化的免疫细胞不会比对患者的b-all低氧不耐受的cd22car工程化的免疫细胞更有效。实际上,到达在组织中成簇或归巢的巢状癌细胞的本发明的ucart22能够裂解这些细胞。可以对本发明的ucart22中的其他基因进行编辑,例如表5中的所列的那些:表5:根据本发明在本发明的cd22car工程化的t细胞中可以失活的编码免疫检查点蛋白的基因列表本发明提供表达seqidn°15的cd22car的分离的工程化免疫t细胞,其中dck和/或cd52和trac基因是经编辑的,即通过缺失而失活,以将它们用于治疗cll、all,优选它们在淋巴耗竭的患者中的侵袭性、复发的难治性形式。本发明提供表达seqidn°15的cd22car的分离的工程化免疫t细胞,其中b2m和trac基因是经编辑的,即通过缺失而失活,以将它们用于治疗cll、all,优选它们在淋巴耗竭的患者中的侵袭性、复发的难治性形式。本发明提供表达seqidn°15的cd22car的分离的工程化免疫t细胞,其中trac和il-10r基因是经编辑的,即通过缺失而失活,以将它们用于治疗cll、all,优选它们在淋巴耗竭的患者中的侵袭性、复发的难治性形式。本发明提供表达cd22car的工程化免疫t细胞(ucart22),包含缺陷的tcrα基因(从而损害tcr在细胞表面的表达)、b2m缺陷基因(从而损害mhci类分子在细胞表面上的表达)以及tgfβ受体ko基因。本发明提供表达cd22car的工程化免疫t细胞(ucart22),包含缺陷的tcrα基因(从而损害tcr在细胞表面的表达)、b2m缺陷基因(从而损害mhci类分子在细胞表面上的表达)以及il-10受体ko基因。本发明提供表达cd22car的工程化免疫t细胞(ucart22),包含缺陷的tcrα基因(从而损害tcr在细胞表面的表达)、b2m缺陷基因(从而损害mhci类分子在细胞表面上的表达)以及ahrko基因。本发明提供表达cd22car的工程化免疫t细胞(ucart22),包含缺陷的tcrα基因(从而损害tcr在细胞表面的表达)、b2m缺陷基因(从而损害mhci类分子在细胞表面上的表达)以及pd1ko基因。本发明提供表达cd22car的工程化免疫t细胞(ucart22),包含缺陷的tcrα基因(从而损害tcr在细胞表面的表达)、b2m缺陷基因(从而损害mhci类分子在细胞表面上的表达)以及lag-3ko基因。本发明提供表达cd22car的工程化免疫t细胞(ucart22),包含缺陷的tcrα基因(从而损害tcr在细胞表面的表达)、b2m缺陷基因(从而损害mhci类分子在细胞表面上的表达)以及tim-3ko基因。本发明提供分离的表达seqidno.15的cd22car的工程化免疫t细胞,其中,其中cd52和trac基因通过缺失而失活,以将它们用于治疗淋巴耗竭患者的b-all的复发难治形式。在优选的实施方式中,对免疫细胞进行工程化的方法涉及将编码特异性稀切核酸内切酶的多核苷酸特别是mrna导入所述t细胞,以通过dna切割选择性地使如上所述的那些基因失活。在更优选的实施方式中,所述稀切核酸内切酶是tale核酸酶或cas9核酸内切酶。迄今为止,相对于其他类型的稀切核酸内切酶,tal核酸酶已被证明具有更高的特异性和切割效率,这使其成为了首选的核酸内切酶,并且优选用于大规模生成工程化的免疫细胞且具有恒定的转化率。递送方式上述不同的方法涉及将本发明的cd22car引入细胞。作为非限制性实例,可以通过本发明的一种质粒载体将所述cd22car作为编码的转基因而引入。本发明的编码cd22car的所述质粒载体还可以含有选择标记,其用于鉴定和/或选择接受所述载体的细胞。其他地方例如在wo2013126720或wo2015121454中描述了允许将根据本发明的cd22car引入到分离的免疫细胞中随后表达的方法,wo2013126720和wo2015121454通过引用整体并入本文。由于将编码多肽的多核苷酸引入到细胞中,可以在细胞中原位合成与本发明的cd22car对应的多肽。或者,可以在细胞外生成所述多肽,随后引入到细胞中。将多核苷酸构建体引入细胞的方法是本领域已知的,并且包括作为非限制性实例的稳定转化方法,其中多核苷酸构建体被整合到细胞的基因组中;瞬时转化方法,其中多核苷酸构建体不被整合到细胞的基因组中;以及,病毒介导的方法。所述多核苷酸可通过例如重组病毒载体(例如,逆转录病毒,如慢病毒、腺病毒、腺相关病毒)、脂质体等导入细胞。例如,瞬时转化方法包括例如显微注射、电穿孔或粒子轰击。考虑到在细胞中表达,所述多核苷酸可以包含在载体中,更具体地在质粒或病毒中。在优选的实施方式中,将所述编码cd22car的多核苷酸插入aav6载体并引入到给定基因中。其他地方例如wo2013126720中描述了制备允许将本发明的cd22car引入分离的t细胞中并随后表达的方法,wo2013126720通过引用并入本文。工程化的免疫细胞(ucart)具有cd22car的工程化的免疫细胞(ucart22)是本发明的另一个目的。优选地,所述免疫细胞是分离的免疫细胞,更优选为分离的免疫t细胞,更优选为分离的原代免疫t细胞。ucart22是作为药物而提供的,因此提供治疗有效量的ucart22作为药物。根据本发明的“原代免疫细胞”是指“源自组织例如血液样品或外周血单核细胞(pbmc)的细胞,其可以在培养中传代数次,最终在使用前冷冻,与转化的或癌性细胞相比,所述免疫细胞的分裂能力有限(raulf-heimsothm.tcell-primaryculturefromperipheralblood.methodsmolmed.2008;138:17-30.doi:10.1007/978-1-59745-366-0)。根据本发明的免疫细胞优选是免疫t细胞或nk细胞。因此,根据本发明的工程化的免疫细胞是从血液样品中分离的,是原代细胞且来源于选自以下并经过进一步工程化的免疫t细胞:炎性t淋巴细胞、细胞毒性t淋巴细胞、调节性t淋巴细胞或辅助性t淋巴细胞、自然杀伤t细胞,优选来源于细胞毒性t淋巴细胞。工程化意味着对原代免疫细胞进行修饰,使其具有cd22car并且至少一个基因是经编辑的,优选对所述细胞进行修饰使得其具有cd22car且既不表达tcr也不会在存在嘌呤核苷酸类似物的情况下死亡。换句话说,工程化的免疫细胞是指tcrko的分离免疫t细胞,包含至少一个其他经编辑的基因,表达cd22car。在特定实施方式中,工程化是指对原代免疫细胞进行修饰使得其具有cd22car,优选对所述细胞进行修饰使得其具有cd22car并且在嘌呤核苷酸类似物的存在下(1-5微摩尔/升)或阿仑单抗的存在下(50微克/毫升)下不会死亡。(valtonetal.,moleculartherapyvol.23no.9,1507–1518sep.2015)优选地,所述t细胞具有seqidn°15的cd22car。更优选地,所述t细胞具有seqidn°15的cd22car并且包含seqidn°22的至少一个序列。更优选地,所述t细胞具有seqidn°15的cd22car并且包含seqidn°22的至少一个序列以及序列的至少一部分。更优选地,所述t细胞具有包括seqidn°20的至少一个序列的seqidn°18的cd22car。本发明提供表达本发明的cd22car并且对表达cd22的细胞表现出ctl和/或脱粒活性的原代免疫t细胞。本发明还提供表达本发明的cd22car的原代t细胞,用于裂解表达cd22的细胞,特别是裂解表达cd22的癌性细胞。优选地,被具有seqidno.16的cd22car的t细胞靶向的细胞在治疗复发的/难治性/侵袭性all或cll方面是有效的。本发明还涉及易于通过工程化细胞的所述方法而获得的分离细胞或细胞系。特别地,所述分离细胞包含至少一种如上所述的本发明的cd22car。在另一个实施方式中,所述分离细胞包含一组car,每个car包含不同的胞外配体结合结构域。特别地,所述分离细胞包含编码car的外源多核苷酸序列。本发明的遗传修饰的免疫细胞被活化并且可以独立于抗原结合机制而增殖。在本发明的范围内还包括根据先前描述的任何一种方法获得的分离免疫细胞,优选分离免疫t细胞(t细胞),更优选工程化的分离免疫t细胞。所述免疫细胞是指功能上参与先天和/或适应性免疫应答的启动和/或执行的造血起源细胞。根据本发明的所述免疫细胞可以源自干细胞。干细胞可以是成年干细胞,非人类胚胎干细胞,更特别地是非人类干细胞,脐带血干细胞,祖细胞,骨髓干细胞,诱导多能干细胞,全能干细胞或造血干细胞。代表性的人类细胞是cd34+细胞。所述分离细胞还可以是树突细胞,杀伤性树突细胞,肥大细胞,nk细胞,b细胞或选自由炎性t淋巴细胞、细胞毒性t淋巴细胞、调节性t淋巴细胞或辅助性t淋巴细胞组成的组的t细胞。在另一个实施方式中,所述细胞可以来源于cd4+t淋巴细胞和cd8+t淋巴细胞。在对本发明的细胞进行扩增和遗传修饰之前,可以通过多种非限制性方法从受试者获得细胞来源。可从许多非限制性来源获得细胞,包括外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、组织、腹水、胸腔积液、脾组织和癌症。在本发明的某些实施方式中,可以使用本领域技术人员可及且已知的任何数量的t细胞系。在另一个实施方式中,所述细胞可以来自健康的供体、诊断有癌症的患者或诊断为感染的患者。在另一个实施方式中,所述细胞是呈现不同表型特征的混合细胞群体的一部分。在本发明的范围内还包括根据所述方法从工程化t细胞获得的细胞系。耐受免疫抑制治疗并且易于通过先前方法获得的修饰细胞包括在本发明的范围内。作为优选的实施方式,本发明提供具有如上所述的本发明的cd22car的t细胞或t细胞群体,它们不表达功能性tcr并且对cd22阳性细胞具有反应性,以便用于将它们过继转移给患者。作为更优选的实施方式,本发明提供具有如上所述的cd22car的t细胞或t细胞群体,其不表达功能性tcr并且被制成耐受化疗,特别是耐受嘌呤核苷酸类似物(pna)。根据本发明的优选的实施方式,将具有cd22car的免疫细胞工程化成对化疗药物特别是嘌呤核苷酸类似物(pna)具有耐受性,使其适于结合过继免疫疗法和化学疗法进行癌症治疗。嘌呤核苷酸类似物进入许多癌症治疗的化疗组合物中。它被用作针对白血病或淋巴瘤的标准治疗方法。最广泛使用的pna是单独或组合使用的氯法拉滨、氟达拉滨和阿糖胞苷。pna被具有脱氧胞苷激酶(dck)活性的酶[ec2.7.1.74]代谢为单磷酸、二磷酸和三磷酸pna。它们的三磷酸酯形式,特别是氯洛法拉滨三磷酸酯与atp竞争用于dna合成,充当促凋亡剂,并且是参与三核苷酸生产的核糖核苷酸还原酶(rnr)的有效抑制剂。因此,本发明包括离体生产免疫细胞、优选不表达tcr的原代t细胞的方法,它们对嘌呤类似物药物具有耐受性并且可以靶向cd22阳性恶性细胞。用于制备根据本发明的ucart22的方法也可以是在wo2013176915或wo2014191128中公开的方法,它们通过引用整体并入本文。一种制备ucart22的方法,包括以下步骤:(a)提供来自供体的免疫细胞,优选分离的t细胞或分离的t细胞群体,(b)将编码特异靶向以下基因的稀切核酸内切酶的核酸序列引入到所述免疫细胞(优选通过转染或转导)-表达具有脱氧胞苷激酶活性的酶的基因(dck–ec2.7.1.74),特别是人脱氧胞苷激酶基因(ncbi基因id:1633),和/或-编码tcrα亚基和/或β亚基之一、优选α亚基的基因,和/或-编码人cd52的基因(c)将所述核酸内切酶表达到所述免疫细胞中以获得所述基因的靶向失活;(d)扩增步骤c)中获得的工程化的免疫细胞,可选地在嘌呤类似物药物的存在下进行;(e)将本发明的cd22car、优选seqidn°15的cd22car引入所述免疫细胞。一种制备ucart22的方法,包括以下步骤:(a)提供来自供体的免疫细胞,优选分离的t细胞或分离的t细胞群体,(b)将编码特异靶向以下基因的稀切核酸内切酶的核酸序列引入到所述免疫细胞(优选通过转染或转导)-表达具有脱氧胞苷激酶活性的酶的基因(dck–ec2.7.1.74),特别是人脱氧胞苷激酶基因(ncbi基因id:1633)和/或-编码tcrα亚基和/或β亚基之一、优选α亚基的基因-编码人β2免疫球蛋白(b2m)的基因(c)将所述核酸内切酶表达到所述免疫细胞中以获得所述基因的靶向失活;(d)扩增步骤c)中获得的工程化的免疫细胞,可选地在嘌呤类似物药物的存在下进行;(e)将本发明的car、优选cd22car、更优选seqidn°15的cd22car单独地或与cd19car组合地引入到所述免疫细胞。在优选的实施方式中,本发明包括离体生产免疫细胞、优选不表达tcr的原代t细胞的方法,其对嘌呤类似物药物具有耐受性并且可以靶向cd22阳性恶性细胞。所述方法包括以下步骤:·提供来自供体的免疫细胞,优选分离的t细胞(或分离的t细胞群体),·将本发明的cd22car、优选选自seqidn°15的cd22car引入到所述免疫细胞。·扩增步骤b)中获得的工程化的免疫细胞(d)将编码特异靶向以下各项的稀切核酸内切酶的核酸序列引入到所述免疫细胞(通过转染或转导)表达具有脱氧胞苷激酶活性的酶的基因(dck–ec2.7.1.74),特别是人脱氧胞苷激酶基因(ncbi基因id:1633),和/或编码tcrα亚基或β亚基中的一个的基因,e)将所述核酸内切酶表达到所述免疫细胞中以获得所述基因的靶向失活;f)扩增步骤e)中获得的工程化的免疫细胞,可选地在嘌呤类似物药物的存在下。离体生产免疫细胞、优选不表达tcr的原代t细胞(其对嘌呤类似物药物具有耐受性并且可以靶向cd22阳性恶性细胞)的方法可选地包括另一个步骤,该步骤将编码特异性靶向表9中所列基因之一的稀切核酸内切酶的核酸序列引入所述免疫细胞(通过转染或转导),所列基因中优选pd1、cd279,更优选pdcd1(pd1,cd279)或ctla4(cd152)。本申请发明人已经通过使用核酸酶特别是tal核酸酶将dck基因表达失活(缺失)介导入细胞中,成功地构建体了对嘌呤核苷酸类似物更特别是对氯法拉滨和/或氟达拉滨具有耐受性的表达cd22car的原代t细胞(dck-ko)。使用编码定向针对dck基因的特异性tal核酸酶的mrna转染t细胞,优选通过使用如wo2013176915中所述的电穿孔,诱导了对药物的显著耐受性,同时保持了t细胞对带有cd22的细胞的细胞毒活性。本申请还提供tcr-ko,cd22car(优选seqidn°15的)原代t细胞(其脱氧胞苷激酶的表达已被抑制或失活(dck-ko)),用于治疗白血病或淋巴瘤,优选它们的侵袭性、耐受性、复发形式,更优选b-all。根据本发明的优选的实施方式,具有cd22car的免疫细胞工程化成对化疗药物特别是阿仑单抗(campath)具有耐受性,使得它们适于结合过继免疫疗法和化疗进行癌症治疗。阿仑单抗被用于许多癌症的治疗。它被用作针对白血病或淋巴瘤的标准疗法,特别是在治疗慢性淋巴细胞性白血病(cll)、皮肤t细胞淋巴瘤(ctcl)和t细胞淋巴瘤。它以商品名campath、mabcampath和campath-1h闻名。它也用于骨髓移植、肾脏移植和胰岛细胞移植的某些调理方案中。它是结合cd52的单克隆抗体,cd52是存在于成熟淋巴细胞表面的蛋白质,但不在这些淋巴细胞从中所衍生而来的干细胞上。用阿仑单抗治疗后,这些带有cd52的淋巴细胞被靶向破坏。阿仑单抗也用作cll的第二线治疗。经美国食品和药物管理局批准适用于接受过烷化剂治疗和氟达拉滨治疗失败的cll患者。因此,本发明包括一种离体生产ucart22从而不表达tcr(其对阿仑单抗有耐受性)的方法。制备ucart22cd52ko的方法包括以下步骤:(a)提供来自供体的免疫细胞,优选分离的t细胞或分离的t细胞群体,(b)将编码特异性靶向以下各项的稀切核酸内切酶的核酸序列引入所述免疫细胞(优选通过转染或转导)-编码tcrα亚基和/或β亚基之一、优选α亚基的基因-编码cd52的基因,(c)将所述核酸内切酶表达到所述免疫细胞中以获得所述基因的靶向失活;(d)扩增步骤c)中获得的工程化的免疫细胞,可选地在阿仑单抗存在的情况下进行,(e)将本发明的cd22car(优选为seqidn°15的cd22car)导入所述免疫细胞。在优选的实施方式中,本发明包括离体生产免疫细胞、优选不表达tcr的原代t细胞的方法,它们对阿仑单抗有耐受性并且可以靶向cd22阳性恶性细胞。所述方法包括以下步骤:·提供来自供体的免疫细胞,优选分离的t细胞(或分离的t细胞群体)·将本发明的cd22car、优选seqidn°15的cd22car引入到所述免疫细胞。c)扩增步骤b)中获得的工程化的免疫细胞d)将编码特异靶向以下基因的稀切核酸内切酶的核酸序列引入到所述免疫细胞(通过转染或转导)表达cd52的基因以及表达tcrα亚基或β亚基其中之一的基因,e)将所述核酸内切酶表达到所述免疫细胞中以获得所述基因的靶向失活;f)扩增步骤e)中获得的工程化的免疫细胞,可选地在嘌呤类似物药物的存在下进行。在一个实施方式中,制备ucart22的方法包括以下步骤:(a)提供来自供体的免疫细胞,优选分离的t细胞或分离的t细胞群体,(b)将以下各项引入所述免疫细胞(优选通过转染或转导)-编码稀切核酸内切酶的核酸序列,该稀切核酸内切酶特异靶向编码tcrα亚基和/或β亚基之一、优选α亚基的基因,以及-编码待插入序列、优选编码hif-1α的核酸,(c)将所述核酸内切酶表达到所述免疫细胞中以获得所述待插入序列的靶向插入;(d)扩增步骤c)中获得的工程化的免疫细胞,可选地在低o2浓度(5%o2,优选1%o2)存在的情况下进行,(e)将本发明的cd22car(优选为seqidn°15的cd22car)导入所述免疫细胞。在优选的实施方式中,本发明包括离体生产免疫细胞、优选不表达tcr的原代t细胞的方法,它们对低氧有耐受性并且可以靶向cd22阳性恶性细胞。所述方法包括以下步骤:·提供来自供体的免疫细胞,优选分离的t细胞(或分离的t细胞群体)·将本发明的cd22car、优选seqidn°15的cd22car引入到所述免疫细胞。c)扩增步骤b)中获得的工程化的免疫细胞d)将以下各项引入到所述免疫细胞(优选通过转染或转导)-编码稀切核酸内切酶的核酸序列,该稀切核酸内切酶特异靶向编码tcrα亚基和/或β亚基之一、优选α亚基的基因,以及-编码待插入序列、优选编码hif-1α的核酸,e)将所述核酸内切酶表达到所述免疫细胞中以获得所述基因的靶向失活;f)扩增步骤e)中获得的工程化的免疫细胞,可选地在低o2浓度(5%o2,优选1%o2)存在的情况下进行。离体生产免疫细胞、优选不表达tcr的原代t细胞(其对嘌呤类似物药物、阿仑单抗或低氧具有耐受性并且可以靶向cd22阳性恶性细胞)的方法可选地包含另一个步骤,该步骤将编码特异性靶向表9中所列基因之一的稀切核酸内切酶的核酸序列引入所述免疫细胞(通过转染或转导),所列基因中优选pd1、cd279,更优选pdcd1(pd1,cd279)和ctla4(cd152)。本申请发明人已经通过使用核酸酶特别是tal核酸酶将dck基因表达失活(缺失)介导入细胞中,成功地构建体了对嘌呤核苷酸类似物更特别地是对氯法拉滨和/或氟达拉滨具有耐受性的表达cd22car的原代t细胞(dck-ko)。使用编码定向针对dck基因的特异性tal核酸酶的mrna转染t细胞,优选通过使用如wo2013176915中所述的电穿孔,诱导了对药物的显著耐受性,同时保持了t细胞对带有cd22的细胞的细胞毒活性。如所述的,本申请发明人使用特异性talen将相同的方法应用于对人cd52进行缺失。本申请还提供tcrko,cd22car(优选是seqidn°15的cd22car)原代t细胞,其脱氧胞苷激酶的表达已被抑制或失活(dck-ko),用于治疗白血病或淋巴瘤,优选它们的侵袭性、耐受的、复发的形式,更优选复发的b-all。此类细胞是“通用型”t细胞(或ucart)。在一个实施方式中,本申请提供一种cd22car(优选为seqidn°15的cd22car)原代t细胞,其脱氧胞苷激酶的表达已被抑制或失活(dck-ko),用于治疗白血病或淋巴瘤,优选它们的侵袭性、耐受的、复发的形式,更优选自体转移后复发的b-all。在一个实施方式中,本申请提供了一种cd22car(优选为seqidn°15的cd22car)原代t细胞,其cd52的表达已被抑制或失活(cd52-ko),用于治疗白血病或淋巴瘤,优选其侵袭性、耐受的、复发的形式,更优选自体转移后复发的b-all。在一个实施方式中,本申请提供一种cd22car(优选为seqidn°15的cd22car)原代t细胞,其通过在不敲除tcr的情况下将编码序列插入trac序列中而增加了hif-1α的表达。用于治疗白血病或淋巴瘤,优选它们的侵袭性、耐受的、复发的形式,更优选自体转移后复发的b-all。在一个实施方式中,本申请提供cd22car(优选为seqidn°15的cd22car)原代t细胞,其脱氧胞苷激酶和cd52的表达已被抑制或失活(dck和cd52ko),用于治疗白血病或淋巴瘤,优选它们的侵袭性、耐受、复发的形式,更优选自体转移后复发的b-all。在一个实施方式中,本申请提供一种cd22car(优选为seqidn°15的cd22car)原代t细胞,其脱氧胞苷激酶和cd52的表达已被抑制或失活(dck和cd52ko),而hif-1α的表达通过在不敲除tcr的情况下将hif1α编码序列插入trac序列中而得到增加,用于治疗白血病或淋巴瘤,优选它们的侵袭性、耐受的、复发的形式,更优选自体转移后复发的b-all。离体生产免疫细胞、优选不表达tcr的原代t细胞(其对嘌呤类似物药物和/或阿仑单抗和/或低氧具有耐受性并且可以靶向cd22阳性恶性细胞)的方法可选地包含另一个步骤,该步骤将编码特异性靶向表9中所列基因之一的稀切核酸内切酶的核酸序列引入所述免疫细胞(通过转染或转导),所列基因中优选pd1、cd279,并且更优选pdcd1(pd1,cd279)或ctla4(cd152)。本申请发明人通过使用核酸酶、特别是tal核酸酶,通过将dck基因表达失活(缺失)介导入细胞中,已经成功地产生了对嘌呤核苷酸类似物更特别地是对氯法拉滨和/或氟达拉滨具有耐受性的表达cd22car的原代t细胞(dck-ko)。本申请发明人通过使用核酸酶、特别是tal核酸酶,通过将hif-1α基因靶向插入到细胞中,已经成功地产生了对低氧具有耐受性的表达cd22car的原代t细胞。使用编码定向针对dck基因的特异性tal核酸酶的mrna转染t细胞,优选通过使用如wo2013176915中所述的电穿孔,诱导了对药物的显著耐受性,同时保持了t细胞对带有cd22的细胞的细胞毒活性。本申请还提供tcrko、cd22car(优选seqidno15的cd22car)原代t细胞,其对低氧具有耐受性,用于治疗白血病或淋巴瘤,优选它们的侵袭性、耐受的、复发的形式,更优选b-all。t细胞的活化和扩增无论在t细胞遗传修饰之前还是之后,即使本发明的遗传修饰的免疫细胞独立于抗原结合机制被活化和增殖,本发明的免疫细胞、特别是t细胞还可以使用以下文献中所描述的方法进行活化和扩增,例如,美国专利6,352,694号、6534055号、6905680号、6692964号、5858358号、6887466号、6905681号、7144575号、7067318号、7172869号、7232566号、7175843号、5883223号、6905874号、6797514号、6867041号和美国专利申请公开20060121005号。t细胞可以在体外或体内扩增。通常,通过与刺激t细胞表面上的cd3tcr复合物和共刺激分子的试剂接触产生t细胞的活化信号来扩增本发明的t细胞。例如,化学物质如钙离子载体a23187、佛波醇12-肉豆蔻酸酯13-乙酸酯(pma)或促有丝凝集素如植物血凝素(pha)可用于产生t细胞的活化信号。作为非限制性实例,可以如通过与抗cd3抗体或其抗原结合片段或固定在表面的抗cd2抗体接触,或通过与蛋白激酶c活化剂(例如苔藓抑素)连同钙离子载体接触,在体外刺激t细胞群体。为了共刺激t细胞表面上的辅助分子,使用与辅助分子结合的配体。例如,可以在适合于刺激t细胞增殖的条件下,使t细胞群体与抗cd3抗体和抗cd28抗体接触。适用于t细胞培养的条件包括适当的培养基(例如,最低必需培养基或rpmi培养基1640或x-vivo5(lonza)),其中可以含有增殖和存活所需的因子,包括的血清(例如,胎牛血清或人血清),白细胞介素2(il-2),胰岛素,ifn-g,il-4,il-7,gm-csf,-10,-2,il-15,tgfp和tnf-或本领域技术人员已知的其他任何用于细胞生长的添加剂。用于细胞生长的其他添加剂包括但不限于:表面活性剂,血浆制品和还原剂如n-乙酰基半胱氨酸和2-巯基乙醇。培养基可以包括rpmi1640,a1m-v,dmem,mem,a-mem,f-12,x-vivo1和x-vivo20,optimizer,添加有氨基酸、丙酮酸钠和维生素,无血清或补充有适当量的血清(或血浆)或一组确定的激素和/或量足以使t细胞生长和扩增的细胞因子。抗生素(例如,青霉素和链霉素)仅在实验培养物中含有,而在待注入受试者体内的细胞培养物中不含。将靶标细胞在支持生长所必需的条件下被维持培养,例如,适当的温度(例如,37℃)和大气(例如,空气加5%co2)。暴露于不同刺激次数的t细胞可能表现出不同的特征。在另一个特定的实施方式中,可以通过与组织或细胞共培养来扩增所述细胞。还可以将所述细胞在体内(例如,在将所述细胞给予至受试者后,在受试者的血液中)进行扩增。药物组合物包含本发明的表达cd22car(优选seqidn°15的cd22car)的工程化的(tcr和dckko)或(trac和cd52ko)的免疫t细胞和药学上可接受的媒介物的药物组合物是本发明的另一个目的。在另一个实施方式中,本发明提供一种组合物,包含本发明的ucart22(上述实施方式中的任一项)与苔藓抑素化合物家族的化合物,优选苔藓抑素1。苔藓抑素是来自于苔藓虫总合草苔虫(bugulaneritina)的一组大环内酯类。苔藓抑素1的结构于20世纪80年代确定。迄今为止,已分离出20种不同的苔藓抑素。另外,确定的苔藓抑素类似物被称为“bryolog”。苔藓抑素是蛋白激酶c的有效调节剂。(wender,paula.,jeremyl.baryza,chade.bennett,f.christopherbi,staceye.brenner,michaelo.clarke,joshuac.horan,cindykan,emmanuelblaiselippa,peterg.nell,and,andtimm.turner.thepracticalsynthesisofanovelandhighlypotentanalogueofbryostatin.journaloftheamericanchemicalsociety2002124(46),13648-13649doi:10.1021/ja027509+)通过引用并入本文的wo2001040214a1或ep2737904a2、wo1997034598中描述了适用于本发明的ucart22组合使用的苔藓抑素化合物的实例以及制备这些化合物的方法。先前在“varterasianml1,mohammadrm,shurafams,hulburdk,pembertonpa,rodriguezdh,spadoniv,eilenderds,murgoa,walln,danm,al-katibam.phaseiitrialofbryostatin1inpatientswithrelapsedlow-gradenon-hodgkin'slymphomaandchroniclymphocyticleukemia.clincancerres.2000mar;6(3):825-8”中描述了可以与本发明的ucart22组合使用的剂量的苔藓抑素1的实例。提供表达本发明的cd22car(优选seqidn°15的cd22car)的工程化的(trac和dckko或trac和cd52ko)的免疫t细胞[ucart22]或包含所述ucart22的药物组合物作为药物。表达本发明的cd22car(优选seqidn°15的cd22car)的工程化的(trac和dckko或trac和cd52ko)免疫t细胞[ucart22]用于治疗癌症或减轻炎症是本发明另一个目的。表达本发明的cd22car(优选seqidno15的cd22car)的经工程化(trac和dckko或trac和cd52ko)的免疫t细胞[ucart22]用于治疗all、cll、cll或all的难治性复发侵袭性形式是本发明的另一个目的。提供表达本发明的cd22car(优选seqidno15的cd22car)的工程化的(trac和dckko或trac和cd52ko)免疫t细胞[ucart22],用于治疗cd19复发的癌症,优选cd19复发的b-all。在另一个实施方式中,提供对低氧耐受的表达本发明的cd22car(优选seqidn°15的cd22car)的经工程化(trac和dckko或trac和cd52ko)的免疫t细胞[ucart22]或包含所述ucart22的药物组合物作为药物。在另一个实施方式中,对低氧耐受的表达本发明的cd22car(优选seqidn°15的cd22car)的经工程化(trac和dckko或trac和cd52ko)的免疫t细胞[ucart22]用于治疗癌症或减轻炎症是本发明的另一个目的。在另一个实施方式中,对低氧耐受的表达本发明的cd22car(优选seqidn°15的cd22car)的经工程化(trac和dckko或trac和cd52ko)的免疫t细胞[ucart22]用于治疗all、cll、cll或all的难治性复发侵袭形式是本发明的另一个目的。在另一个实施方式中,对低氧耐受的表达本发明的cd22car(优选seqidn°15的cd22car)的经工程化(trac和dckko或trac和cd52ko)的免疫t细胞[ucart22]用于治疗治疗cd19复发的癌症、优选cd19复发的b-all是本发明的另一个目的。在另一个实施方式中,通过本发明的不同方法获得的分离细胞或衍生自所述分离细胞的细胞系可以用作药物。在另一个实施方式中,所述药物可用于治疗癌症,特别是用于在有此需要其的患者中治疗b细胞淋巴瘤和白血病。在另一个实施方式中,根据本发明的所述分离细胞或衍生自所述分离细胞的细胞系可用于制备用于在有此需要其的患者中治疗癌症的药物。本发明包括工程化细胞的自体转移。在那种情况下,将细胞从一个供体(人类供体)分离出来,进行工程化,随后转移到有此需要的最初供体中。在此特定的实施方式中,可以将细胞工程化成例如对药物如阿仑单抗(campath)和/或pna的具有耐受性并且可选地对低氧具有耐受性。治疗应用术语“癌症”是指以一种或几种类型的细胞不受控制的生长为特征的疾病。本文描述了癌症的实例,其包括但不限于液体肿瘤或血液癌症。根据本发明的血液癌症可以选自淋巴瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、白血病、多发性骨髓瘤、b型慢性淋巴细胞性白血病、毛细胞白血病、急性淋巴细胞性白血病(all)和伯基特氏淋巴瘤、急性淋巴细胞性癌症急性骨髓性性白血病,优选表达cd22的血液癌症,更优选复发的或难治性表达cd22的血液癌症,甚至更优选所述cd22相关的血液癌症的侵袭性形式。在优选的实施方式中,复发的或难治性表达cd22的血液癌症是复发的和/或难治性表达cd22或cd22阳性的b-all。因此,提供治疗有效量的根据上述任何一个实施方式的ucart22或治疗有效量的如上所述的药物组合物,用作对患有复发的和/或难治性的表达cd22或cd22阳性的b-all的患者进行治疗的药物。在另一个实施方式中,提供治疗有效量的根据上述任何一个实施方式的ucart22或治疗有效量的如上所述的药物组合物,用作对患有选自以下各项的cd22阳性血液癌症的患者进行治疗的药物:白血病和淋巴瘤,毛细胞白血病,急性淋巴细胞性白血病、急性淋巴细胞性白血病(all)、急性髓性白血病、慢性淋巴细胞性白血病、b细胞慢性淋巴细胞性白血病、慢性髓样癌,霍奇金淋巴瘤,非霍奇金淋巴瘤和伯基特氏淋巴瘤中的任一种,多发性骨髓瘤。在另一个实施方式中,提供治疗有效量的根据上述任何一个实施方式的ucart22或治疗有效量的如上所述的药物组合物,用作对患有选自以下各项的cd22阳性癌症的患者进行治疗的药物:腺泡型横纹肌肉瘤,膀胱癌症(例如,膀胱癌),骨癌,脑癌(例如,髓母细胞瘤),乳腺癌,肛门、肛管或肛门直肠癌,眼部癌症,肝内胆管癌,关节癌症,颈部癌症,胆囊癌症,胸膜癌症,鼻癌,鼻腔癌症,中耳癌症,口腔癌症,外阴癌症,慢性淋巴细胞性白血病,慢性骨髓性癌症,结肠癌症,食管癌症,宫颈癌症,纤维肉瘤,胃肠道类肿瘤,头颈部癌(例如头颈部鳞状细胞癌),下咽部癌,肾脏癌,喉癌,肝癌,肺癌(例如,非小细胞肺癌),恶性间皮瘤,肥大细胞瘤,黑色素瘤,鼻咽癌,卵巢癌,胰腺癌,腹膜癌,大网膜癌,肠系膜癌,咽癌,前列腺癌,直肠癌,肾癌,皮肤癌,小肠癌,软组织癌,实体瘤,胃癌,睾丸癌,甲状腺癌,输尿管癌。本文描述了cd22介导的癌症的其他实例,包括但不限于肝癌、肺癌(例如,非小细胞肺癌),卵巢癌,胰腺癌,甲状腺癌和尿路上皮癌。在特定实施方式中,本发明的目的是提供对这些癌症的侵袭性形式的治疗,侵袭性形式被定义为比这类癌症在人群中的一般生长速度快至少2倍。在一个实施方式中,本发明的目的是用于在治疗的加速阶段进行白血病的治疗。在特定实施方式中,本发明的目的是提供对难治性/复发的弥漫性大b细胞非霍奇金淋巴瘤-乳腺癌的肺转移-由慢性淋巴细胞性白血病与膀胱癌和前列腺癌组成的三重癌症的治疗。优选地,癌症是血液系统恶性肿瘤(例如,白血病或淋巴瘤,包括但不限于霍奇金淋巴瘤、非霍奇金淋巴瘤、慢性淋巴细胞性白血病、急性淋巴细胞性癌症、急性髓性白血病、b细胞慢性淋巴细胞性白血病、毛细胞白血病、急性淋巴细胞性白血病(all)和伯基特氏淋巴瘤)。更优选地,癌症以cd22的表达为特征,更优选地,癌症以癌性细胞的cd22表达为特征,甚至更优选地以癌细胞的cd22过表达为特征。在一个实施方式中,所述癌细胞是复发的难治性cd19阴性癌细胞。在一个实施方式中,所述癌细胞是复发的难治性的表达cd22的癌细胞。在优选的实施方式中,所述癌细胞是复发的难治性cd19阴性cd22阳性表达的b-all。b细胞all包括:·早期前体b(早期pre-b)all(也称为pro-ball)·普通all·pre-ball·成熟b细胞all,也被称为伯基特白血病或儿童中的非霍奇金淋巴瘤。如本文所用,术语“与cd22的表达有关的疾病”包括但不限于与cd22的表达有关的疾病或与表达cd22的细胞的活性关联的病症,表达cd22的细胞包括各种癌症(例如,表达cd22的b-all)的肿瘤细胞。裂解引起的细胞破坏是本发明的cd22cart细胞籍由对表达cd22的细胞起作用(减少或消除肿瘤,促进宿主的免疫细胞向肿瘤部位的浸润以及增强/扩展抗肿瘤应答)的机制之一。在另一方面,本发明依赖于对有此需要其的患者进行治疗的方法,所述方法包括以下步骤中的至少一个:·提供本发明的ucart22·将所述经转化的免疫细胞给予至所述患者,在一个实施方式中,本发明的所述ucart22细胞可以经受强有力的体内t细胞扩增,并且可以在宿主中驻留延长的时间量。在另一方面,本发明提供了用于治疗有此需要其的患者的方法,所述方法包括以下步骤中的至少一个:·调理患有癌症的患者·提供本发明的ucart22·将所述转化的免疫细胞给予于所述患者,调理包括淋巴耗竭,或任何合适的调理,本领域技术人员、也优选医生,会识别用于治愈所述患者的决定因素。在优选的实施方式中,所述方法进一步包括骨髓移植的步骤。在一个实施方式中,本发明的所述ucart22细胞可以经受强有力的体内t细胞扩增,并且可以在宿主中驻留延长的时间量。所述治疗可以是改善的、治愈的或预防的。它可以是自体免疫疗法的一部分,也可以是同种异体免疫疗法治疗的一部分。自体是指用于治疗患者的细胞、细胞系或细胞群体均来自所述患者或源自人类白细胞抗原(hla)相容的供体。同种异体是指用于治疗患者的细胞或细胞群体不是源自所述患者而是源自供体。在一个实施方式中,使用抗cd20(利妥昔单抗)和/或qben10治疗来控制本发明的所述t细胞在宿主中的存活。受试者本发明的组合物和方法可以用于治疗已被表征为具有表达cd22的病理细胞或组织或疑似具有表达cd22的病理细胞或组织的受试者。例如,受益于根据本发明的治疗的受试者包括患有b-all或cll、难治性b-all、复发的b-all的受试者。在优选的实施方式中,患者是患有ball、复发的ball、难治性ball的儿童(儿科适应症)。利用根据本发明的工程化的免疫细胞的治疗可以与一种或多种针对癌症的疗法组合,选自抗体疗法、化学疗法、细胞因子疗法、树突状细胞疗法、基因疗法、激素疗法、激光疗法和放射线疗法。。因此,本发明提供包含治疗有效量的ucart22的药物组合物,用于治疗患有ball、复发的ball、难治性ball的儿童。本发明还提供包含ucart22和药学上可接受的赋形剂的药物组合物,用于治疗患有b-all、复发的b-all、难治性b-all的儿童。在优选的实施方式中,包含本发明的ucart22和苔藓抑素家族化合物(优选苔抑抑素-1)以及药学上可接受的赋形剂的药物组合物,用于治疗患有b-all、复发的b-all、难治性b-all的儿童。根据本发明的优选的实施方式,所述治疗可以给予接受免疫抑制治疗(调理治疗)的患者,更优选为接受淋巴耗竭的患者。实际上,本发明优选依赖于细胞或细胞群体,它们由于编码用于此类免疫抑制剂的受体的基因的失活而对至少一种免疫抑制剂具有耐受性。在这方面,免疫抑制疗法或淋巴耗竭应有助于患者体内本发明t细胞的选择和扩增以及cd22癌性细胞的破坏。根据本发明的细胞或细胞群体的给予可以任何方便的方式进行,包括通过气雾吸入、注射、摄食、输血、植入或移植。本文所述的组合物可通过静脉内或淋巴内注射或腹膜内、皮下、皮内、癌症内、结节内、髓内、肌内给予于患者。在一个实施方式中,本发明的细胞组合物优选通过静脉内注射给予。细胞或细胞群体的给予可包括每千克体重给予104-109个细胞,优选每千克体重105-106个细胞,包括这些范围内所有整数值的细胞数。可以一种或多种剂量将细胞或细胞群体进行给予,优选若干次连续剂量(再给药)以避免逃逸(复发的细胞)。在另一个实施方式中,所述有效量的细胞以单剂量或多剂量给予。在另一个实施方式中,将所述有效量的细胞以单剂量或按剂量给予。在另一实施方式中,将所述有效量的细胞在一段时间内以多于一次剂量地地给予给予时间在医师的判断范围内,并取决于患者的临床状况。细胞或细胞群体可以从任何来源获得,例如血库或供体。当个体需求变化时,在本领域技术范围内确定特定疾病或病症的给定细胞类型的有效量的最佳范围。有效量是指提供治疗或预防益处的量。给予的剂量将取决于接受者的年龄,健康状况和体重,同时进行的治疗的种类(如果有的话),治疗的频率和所需效果的性质。当前的ucart22被设计为有效的,但并不活跃并限制了细胞因子风暴。在患者反应过度的情况下,本发明可以与用于预防细胞因子风暴的适当药物例如抗il-6药物组合。在另一个实施方式中,将所述有效量的细胞或包含那些细胞的组合物进行肠胃外给予。所述给予可以是静脉内给予。所述给予可以通过在癌症内注射直接进行。在本发明的某些实施方式中,将细胞与多种相关治疗方式(例如,之前、同时或之后)一起给予于患者,包括但不限于利药物,剂的疗法如抗病毒治疗、西多福韦和白细胞介素2,阿糖胞苷(也称为ara-c)或用于ms患者的那他珠单抗疗法或用于牛皮癣患者的依法利他单抗疗法或用于pml患者的其他疗法。在其他实施方式中,本发明的t细胞可以与以下组合地使用:化学疗法,辐射,免疫抑制剂,例如环孢菌素,硫唑嘌呤,甲氨蝶呤,霉酚酸酯和fk506,抗体或其他免疫消融剂例如campath,阿仑单抗,抗cd3抗体或其他抗体疗法,细胞毒素,氟达立滨,环孢菌素,fk506,雷帕霉素,霉酚酸(mycoplienolicacid),类固醇,fr901228,细胞因子和放射线。这些药物抑制钙依赖性磷酸酶钙神经素(环孢霉素和fk506)或抑制对生长因子诱导的信号转导很重要的p70s6激酶(雷帕霉素)(henderson,naya等.1991;liu,albers等.1992;bierer,hollander等.1993)。在其他实施方式中,将本发明的细胞组合物与骨髓移植、t细胞消融疗法结合(例如,在之前,同时或之后)给予于患者,其中t细胞消融疗法使用任何化学治疗剂如氟达拉滨、外束放射疗法(xrt)、环磷酰胺或抗体如okt3或campath。在另一个实施方式中,在b细胞消融治疗(例如与cd20反应的药剂,例如美罗华(rituxan)或qben10)后给予本发明的细胞组合物。例如,在一个实施方式中,受试者可以接受高剂量化学治疗随后外周血细胞移植的标准治疗。在某些实施方式中,在移植后,受试者接受扩增的本发明的免疫细胞的输注。在另一个实施方式中,在手术之前或之后给予扩增的细胞。在另一个实施方式中,移植后,受试者接受与cd20反应的药剂,例如美罗华或ritiximab,优选与cd22和cd20反应的药剂。其他定义-本文中根据一个字母的代码命名多肽序列中的氨基酸残基,其中,例如,q表示gln或谷氨酰胺残基,r表示arg或精氨酸残基,d表示asp或天冬氨酸残基。-氨基酸取代是指一个氨基酸残基被另一个氨基酸取代,例如肽序列中的谷氨酰胺残基被精氨酸残基取代是氨基酸取代。-核苷酸命名如下:一个字母的代码用于指定核苷的碱基:a为腺嘌呤,t为胸腺嘧啶,c为胞嘧啶,g为鸟嘌呤。对于简并核苷酸,r代表g或a(嘌呤核苷酸),k代表g或t,s代表g或c,w代表a或t,m代表a或c,y代表t或c(嘧啶核苷酸),d代表g、a或t,v代表g、a或c,b代表g、t或c,h代表a、t或c,n代表g、a、t或c。-本文所用的,“核酸”或“多核苷酸”是指核苷酸和/或多核苷酸,例如脱氧核糖核酸(dna)或核糖核酸(rna),寡核苷酸,通过聚合酶链反应(pcr)产生的片段,以及通过连接、剪切、核酸内切酶作用和核酸外切酶作用中的任何一种产生片段。核酸分子可以由天然存在的核苷酸的单体(例如dna和rna)或天然存在的核苷酸的类似物(例如天然存在的核苷酸的对映体形式)或两者的组合组成。修饰的核苷酸可以在糖部分和/或嘧啶或嘌呤碱基部分中具有改变。糖修饰包括例如用卤素、烷基、胺和叠氮基取代一个或多个羟基,或者糖可以被官能化为醚或酯。此外,整个糖部分可以被空间和电子上相似的结构代替,例如氮杂糖和碳环糖类似物。碱基中修饰的实例包括烷基化的嘌呤和嘧啶,酰化的嘌呤或嘧啶,或其他众所周知的杂环取代基。核酸单体可通过磷酸二酯键或此类连接的类似物连接。核酸可以是单链或双链的。-嵌合抗原受体(car)是指结合针对靶标细胞上存在的组分的结合结构域的分子,例如基于抗体的对所需抗原(例如,肿瘤抗原)的特异性与活化t细胞受体的细胞内产生嵌合蛋白,该嵌合蛋白表现出特异性的抗靶标细胞免疫活性。通常,car由与t细胞抗原受体复合物ζ链(scfvfc:ζ)的胞内信号传导结构域融合的胞外单链抗体(scfvfc)组成,并且具有在t细胞中表达时根据单克隆抗体的特异性重定向抗原识别的能力。用于本发明的car的一个实例是针对cd22抗原的car,并且可以包括作为非限制性实例的氨基酸序列:seqidn°15至seqidn°18,优选为seqidn°16或18,更优选为seqidn°16。-术语“核酸内切酶”是指能够催化dna或rna分子(优选dna分子)内核酸之间的键水解(裂解)的任何野生型或变体酶。核酸内切酶不会不受序列影响地切割dna或rna与其序列有关,而是在特定的多核苷酸序列(进一步称为“靶序列”或“靶位点”)处识别和切割dna或rna分子。当通常具有长度大于12个碱基对(bp)、更优选地14-55bp的多核苷酸识别位点时,内切核酸酶可以被分类为稀切核酸内切酶。稀切核酸内切酶通过在确定的基因座诱导dna双链断裂(dsb)来显著提高hr(perrin,buckle等.1993;rouet,smih等.1994;choulika,perrin等.1995;pingoud和silva2007)。稀切核酸内切酶可以是例如归巢核酸内切酶(paques和duchateau2007),是由工程化的锌指结构域与限制酶例如foki的催化结构域融合而成的嵌合的锌指核酸酶(zfn)(porteus和carroll2005),来自crispr系统的cas9核酸内切酶(gasiunas,barrangou等.2012;jinek,chylinski等.2012;cong,ran等.2013;mali,yang等.2013)或化学内切核酸酶(eisenschmidt,lanio等.2005;arimondo,thomas等.2006)。在化学内切核酸酶中,化学或肽切割酶与核酸聚合物或与另一种dna结合识别特定靶序列,从而将切割活性靶向到特定序列。化学内切核酸酶还包括合成的核酸酶,例如邻菲咯啉的结合物,dna切割分子和三链形成寡核苷酸(tfo),已知它们可以结合特定的dna序列(kalish和glazer2005)。此类化学核酸内切酶包含在根据本发明的术语“核酸内切酶”中。-“tale核酸酶”(talen)意指由通常源自转录活化因子样效应物(tale)的核酸结合结构域和一个核酸酶催化域组成切割核酸靶序列的融合蛋白。催化域优选是核酸酶结构域,更优选具有核酸内切酶活性的结构域,例如i-tevi、cole7、nuca和fok-1。在特定实施方式中,tale结构域可以与大范围核酸酶融合,例如i-crei和i-onui或其功能变体。在更优选的实施方式中,所述核酸酶是单体tale核酸酶。单体tale核酸酶是不需要二聚化以进行特异性识别和切割的tale核酸酶,例如wo2012138927中所述的工程化的tal重复序列与i-tevi的催化结构域的融合体。转录活化子如效应物(tale)来自细菌物种中黄单胞菌属的蛋白质,包含多个重复序列,每个重复序列在位置12和13上包含特异于核酸靶向序列中每个核苷酸碱基的两个残基(rvd)。具有相似的模块化碱基对碱基核酸结合特性(mbbbd)的结合结构域也可以源自申请人最近在不同细菌物种中发现的新模块化蛋白质。新的模块化蛋白具有比tal重复序列显示更多序列变异性的优势。优选地,与识别不同核苷酸相关的rvd为:识别c的hd,识别t的ng,识别a的ni,识别g或a的nn,识别a、c、g或t的ns,识别t的hg,识别t的ig,识别g的nk,识别c的ha,识别c的nd,识别c的hi,识别g的hn,识别g的na,识别g或a的sn,识别t的yg,识别a的tl,识别a或g的vt和识别a的sw。在另一实施方式中,可以将关键的第12和13位氨基酸突变为其他氨基酸残基,以便调节其对核苷酸a、t、c和g的特异性,特别是增强该特异性。tale核酸酶已经被描述并用于刺激基因靶向和基因修饰(boch,scholze等.2009;moscou和bogdanove2009;christian,cermak等.2010;li,huang等.2011)。定制的tal核酸酶可以商品名talentm商购获得(cellectis,8ruedelacroixjarry,75013paris,france)。根据本发明的稀切核酸内切酶也可以是cas9核酸内切酶、锌指核酸内切酶、megatal核酸内切酶。已经基于来自ii型原核crispr(成簇的、规律间隔的短回文重复序列)适应性免疫系统(参见综述(sorek,lawrence等.2013))的rna引导的cas9核酸酶开发出了基因组工程化工具(gasiunas,barrangou等.2012;jinek,chylinski等.2012;cong,ranetal.2013;mali,yangetal.2013)。crispr关联(cas)系统最早发现于细菌中,用于抵御病毒或质粒的外源dna。crispr介导的基因组工程化首先通过选择通常以短序列基序(称为前间隔子相邻基序(pam))为侧接的靶序列进行。选择靶序列之后,对与该靶序列互补的特异性crrna进行工程化。crisprii型系统中所需的反式活化crrna(tracrrna)与crrna配对并与提供的cas9蛋白结合。cas9充当分子锚,促进tracrna与crna的碱基配对(deltcheva,chylinski等.2011)。在这种三元复合物中,二元的tracrrna:crrna结构充当引导rna,将核酸内切酶cas9导向同源靶序列。通过扫描靶序列确定靶序列与crrna之间的同源性来启动借助cas9-tracrrna:crrna复合物的靶识别。除靶序列-crrna的互补性外,dna靶向还要求存在与前间隔子相邻的短基序(前间隔子相邻基序-pam)。在二元rna与靶序列之间配对之后,cas9随后在pam基序上游3个碱基处引入平端的双链断裂(garneau,dupuis等.2010)。稀切核酸内切酶可以是归巢核酸内切酶,也称为大范围核酸酶。这样的归巢核酸内切酶是本领域众所周知的(stoddard2005)。归巢核酸内切酶识别dna靶序列并产生单链或双链断裂。归巢核酸内切酶是高度特异的,识别长度为12至45个碱基对(bp)、通常长度为14至40bp的dna靶位点。根据本发明的归巢核酸内切酶可以例如对应于laglidadg核酸内切酶、hnh核酸内切酶或giy-yig核酸内切酶。根据本发明的优选的归巢核酸内切酶可以是i-crei变种。-“递送载体”是指可以在本发明中用于将本发明所需的试剂/化学物质和分子(蛋白质或核酸)与细胞接触(即“接触”)或递送入细胞或亚细胞区室内(即“引入”)的任何递送载体。它包括但不限于脂质体递送载体、病毒递送载体、药物递送载体、化学载体、聚合物载体、脂质复合物、复合物、树枝状分子、微泡(超声造影剂)、纳米颗粒、乳剂或其他合适的转移载体。这些递送载体允许递送分子、化学物质、大分子(基因,蛋白质),或其他载体如质粒、diatos开发的肽。在这些情况下,递送载体是分子载体。“递送载体”也意指进行转染的递送方法。-术语“载体”是指能够将与其连接的另一核酸进行转运的核酸分子。本发明中的“载体”包括但不限于病毒载体、质粒、rna载体或者线性或环状dna或rna分子,该线性或环状dna或rna分子可以由染色体、非染色体、半合成或合成核酸组成。优选的载体是那些能够自主复制的载体(游离载体)和/或将与它们连接的核酸进行表达的载体(表达载体)。本领域技术人员已知且可商购获得大量合适的载体。病毒载体包括:逆转录病毒,腺病毒,细小病毒(例如,腺相关病毒,特别是aav6),冠状病毒,负链rna病毒如正粘病毒(例如,流感病毒),弹状病毒(例如,狂犬病和水泡性口炎病毒),副粘病毒(例如,麻疹和仙台病毒),正链rna病毒(例如,小核糖核酸病毒和甲型病毒)以及包括腺病毒、疱疹病毒(例如,单纯疱疹病毒1型和2型,爱泼斯坦-巴尔(epstein-barr)病毒,巨细胞病毒)在内的双链dna病毒和痘病毒(例如,牛痘、鸡痘和金丝雀痘病毒)。其他病毒包括例如诺瓦克病毒、披膜病毒、黄病毒、呼肠孤病毒、乳多空病毒、嗜肝dna病毒和肝炎病毒。逆转录病毒的例子包括:禽白血病-肉瘤病毒,哺乳动物c型、b型病毒、d型病毒,htlv-blv组,慢病毒,牛泡沫病毒(coffin,j.m.,retroviridae:thevirusesandtheirreplication,infundamentalvirology,thirdedition,b.n.fields,etal.,eds.,lippincott-ravenpublishers,philadelphia,1996)。-“慢病毒载体”是指基于hiv的慢病毒载体,由于其相对较大的包装能力、降低的免疫原性以及它们高效稳定地转导多种不同细胞类型的能力,因此在基因传递方面非常有前途。慢病毒载体通常是在将三个(包装、包膜和转移)或更多质粒瞬时转染到生产细胞后产生的。像hiv一样,慢病毒载体通过病毒表面糖蛋白与细胞表面受体的相互作用进入靶标细胞。进入时,病毒rna经历逆转录,这是由病毒逆转录酶复合体介导的。逆转录产物是双链线性病毒dna,它是感染细胞的dna中进行病毒整合的底物。“整合型慢病毒载体(或lv)”是指能够整合靶标细胞基因组的作为非限制性实例的此类载体。相反,“非整合型慢病毒载体(或nilv)”是指不通过病毒整合酶的作用整合靶标细胞基因组的有效基因递送载体。-递送载体和载体可以与任何细胞通透化技术例如声穿孔或电穿孔或这些技术的衍生方式相关联或组合。-细胞是指用于体外培养的任何真核生物活细胞、原代细胞和来源于这些生物细胞系。-“原代细胞”是指直接从活体组织(即,活检材料)中获取并为在体外生长而建立的细胞,与连续致瘤或人工永生化细胞系相比,它们经历了很少的群倍增,因此更能代表它们所来源的组织的主要功能成分和特征。作为非限制性实例,细胞系可以选自由以下细胞组成的组:cho-k1细胞,hek293细胞,caco2细胞,u2-os细胞,nih3t3细胞,nso细胞,sp2细胞,cho-s细胞,dg44细胞,k-562细胞,u-937细胞,mrc5细胞,imr90细胞,jurkat细胞,hepg2细胞,hela细胞,ht-1080细胞,hct-116细胞,hu-h7细胞,huvec细胞,molt4细胞。所有这些细胞系都可以通过本发明的方法进行修饰,以提供细胞系模型来产生、表达、定量、检测、研究感兴趣的基因或蛋白质。这些模型也可以用于筛选研究和生产以及如作为非限制性实例的化学、生物燃料、治疗学和农学等各个领域中感兴趣的生物活性分子。-“突变”旨在多核苷酸(cdna,基因)或多肽序列中替换、缺失、插入最高达1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、40、50或更多核苷酸/氨基酸。突变可影响基因的编码序列或其调控序列。它还可能影响基因组序列的结构或编码的mrna的结构/稳定性。-“变体”是指通过在母体分子的氨基酸序列中突变或置换至少一个残基获得的重复变体、变体、dna结合变体、tale核酸酶变体、多肽变体。-“功能变体”是指蛋白质或蛋白质结构域的催化活性突变体;此类突变体具有与其母体蛋白质或蛋白质结构域相比相同的活性,或其他特性,或较高或较低的活性。-“同一性”是指两个核酸分子或多肽之间的序列同一性。同一性可以通过比较每个序列中为了比对而对齐的位置来确定。可以通过比较每个序列中可以比较的目的进行比对的位置来确定同一性。当比较的序列中的一个位置被相同碱基占据时,则分子在该位置具有同一性。核酸或氨基酸序列之间相似性或同一性的程度是核酸序列共有的位置上相同或匹配核苷酸的数目的函数。各种比对算法和/或程序可用于计算两个序列之间的同一性,包括fasta或blast,它们可作为gcg序列分析软件包(威斯康星大学,麦迪逊,威斯康星州)的一部分来使用,并且可以使用例如默认设置。例如,可以预期与本文描述的特定多肽具有至少70%、85%、90%、95%、98%或99%同一性并且优选地表现出基本上相同的功能的多肽,以及编码这种多肽的多核苷酸。除非另有说明,相似性评分将是基于blosum62的使用的。当使用blastp时,相似性百分比是基于blastp阳性评分的,而序列同一性百分比则是基于blastp同一性评分的。blastp“同一性”显示相同的高得分序列对中总残基的数量和分数;blastp“正”表示比对得分具有正值且彼此相似的残基的数量和分数。本公开可以预期和包含与本文所公开的氨基酸序列具有这些同一性或相似性程度或相似性的任何中间同一性程度的氨基酸序列。类似多肽的多核苷酸序列是用遗传密码推导出来的,可以通过常规方法获得,特别是用遗传密码反向翻译其氨基酸序列。-“信号转导结构域”或“共刺激配体”是指抗原呈递细胞上特异性结合t细胞上的同源共刺激分子从而提供信号的分子,该信号是在除由例如tcr/cd复合物与负载有肽mhc分子结合而提供的主要信号之外介导t细胞应答的信号,细胞应答包括但不限于增殖活化、分化等。共刺激配体可以包括但不限于cd7、b7-1(cd80)、b7-2(cd86)、pd-l1、pd-l2、4-1bbl、ox40l、诱导型共刺激配体(icos-l)、细胞间粘附分子(icam、cd30l、cd40、cd70、cd83、hla-g、mica、m1cb、hvem、淋巴毒素β受体、3/tr6、ilt3、ilt4、与toll配体受体结合的激动剂或抗体以及与b7-h3特异性结合的配体。cd28被排除于此清单。共刺激配体还包括特别与t细胞上存在的共刺激分子特异性结合的抗体,所述共刺激分子例如但不限于cd27、4-ibb、ox40、cd30、cd40、pd1、icos、淋巴细胞功能相关的抗原1(lfa-1)、cd2、cd7、ltght、nkg2c、b7-h3、与cd83特异性结合的配体。“共刺激分子”是指t细胞上与共刺激配体特异性结合从而介导细胞的共刺激应答(例如但不限于增殖)的同源结合伴侣。共刺激分子包括但不限于mhci类分子、btla和toll配体受体。本文所用的“共刺激信号”是指与初级信号例如tcr/cd3连接组合导致t细胞增殖和/或关键分子的上调或下调的信号。本文所用术语“胞外配体结合结构域”定义为能够结合配体的寡肽或多肽。优选地,该结构域将能够与细胞表面分子相互作用。例如,可以对胞外配体结合结构域进行选择以识别用作与特定疾病状态相关的靶标细胞上的细胞表面标志物的配体。因此,可以用作配体的细胞表面标志物的实例包括与病毒、细菌和寄生虫感染,自身免疫性疾病和癌细胞相关的那些配体。本文所用的术语“受试者”或“患者”包括动物界的所有成员,包括非人类灵长类动物和人类,优选人类。在一个实施方式中,患者是患有侵袭性或难治性或复发的all、或者侵袭性或难治性或复发的cll的患者。哺乳动物是哺乳动物类的任何温血脊椎动物,优选人类。“自杀结构域或开关”或“安全开关”是指被分子、蛋白质、化学物质、抗体为了免疫选择表达细胞并最终控制其功能和存活而识别的结构域,通常是细胞表面结构域。上述对本发明的书面描述提供制造和使用本发明的方式和过程,使得本领域技术人员能够制造和使用本发明,特别是所附权利要求的主题,权利要求构成了原始描述的一部分。在本文中说明数值限制或范围的情况下,包括端点。同样,数值限制或范围内的所有值和子范围都将被明确包括在内,就好像已明确写出一样。给出以上描述是为了使本领域技术人员能够制造和使用本发明,并且在特定应用及其要求的背景下提供的。对优选实施例的各种修改对于本领域技术人员而言将是显而易见的,并且在不脱离本发明的精神和范围的情况下,本文中定义的一般原理可以应用于其他实施例和应用。因此,本发明无意限制于所示的实施例,而是与本文公开的原理和特征一致的最宽范围相一致。一般方法car的筛选和选择原代t细胞培养使用ficoll梯度密度培养基从由efs(法国巴黎,etablissementdusang)提供的血沉棕黄层样品中纯化t细胞。将pbmc层进行了回收。在补充了20ng/ml的人il-2、5%的人和dynabeads的人t活化剂cd3/cd28的x-vivotm-15培养基(lonza)中活化t细胞,磁珠:细胞比例为1:1(lifetechnologies)。carmrna转染在t细胞纯化和活化后的第4天或第11天进行编码每种car构建体的carmrna的转染。细胞被立即稀释在x-vivotm-15中培养基中并在37℃与5%co2下孵育。电穿孔2小时后以20ng/ml加入il-2。t细胞转导如前所述,将编码cd22car的载体引入t细胞。使用由与鼠igg1fc片段融合在一起的人cd22蛋白(整个蛋白,cd22的远端部分或cd22的近端部分)的胞外结构域组成的重组蛋白进行t细胞表面的car检测。用靶向该蛋白小鼠fc部分的pe偶联二抗(jacksonimmunoresearch)检测该蛋白与car分子的结合,并通过流式细胞仪进行分析。原代t细胞中特定基因的失活可以在使用相应设计的核酸内切酶如tal核酸内切酶、可选的crisprcas9核酸内切酶将cd22car引入细胞之前优选之后,在原代t细胞中进行特定基因的失活。至少一个基因被失活,一个、两个或三个基因可以一步或几个连续的步骤被失活。在优选的实施方式中,两个基因是失活的,优选是tcrα基因和缺失赋予对选自以下各项的药物耐受的基因:嘌呤核苷酸类似物、阿仑单抗、铂(顺铂或卡铂)、抗拓扑异构酶i(伊立替康)、抗拓扑异构酶ii(依托泊苷)、甲氨蝶呤(叶酸类似物),优选嘌呤核苷酸类似物、阿仑单抗。通常,对异二聚体核酸酶、特别是靶向由靶基因内的间隔子分开的两个长序列(称为半靶)的tale核酸酶进行设计和生产。可以将每种tale核酸酶构建体克隆在合适的哺乳动物表达载体中。可以从在启动子下游携带编码序列的质粒合成编码切割目标基因组序列的tale核酸酶的mrna。使用经抗cd3/cd28涂覆的磁珠预活化的经纯化的t细胞,并用编码两个半tale核酸酶的2个mrna中的每一个进行转染。可用可溶性抗cd28将细胞再活化来测量细胞在不同时间的增殖,并检测活化标记cd25以评估细胞的活化状态。脱粒试验(cd107a动员)将细胞与等量的表达各种水平的目标蛋白质(cd22)的细胞一起在96孔板中孵育。将共培养物在37℃和5%co2的条件下维持培养6小时。通过在共培养开始时添加荧光抗cd107a抗体以及抗cd49d、抗cd28在细胞刺激过程中进行cd107a染色,1x莫能菌素溶液作为对照。孵育6小时后,用可固定的生存力染料和荧光染料偶联的抗cd8将细胞染色,并通过流式细胞仪进行分析。脱粒活性确定为cd8+/cd107a+细胞的百分比,并且是确定cd8+细胞之间cd107a染色的平均荧光强度信号(mfi)来进行的。mrna转染后24小时进行脱粒测定。干扰素γ释放试验mrna转染24h后,将表达cd22car的t细胞与表达各种水平的靶蛋白的细胞系一起于37℃孵育24小时。回收上清液,并通过elisa试验在细胞培养上清液中进行ifnγ检测。细胞毒性试验将细胞与靶标细胞(表达不同水平的cd22)或(阴性对照)细胞一起孵育。在将靶标细胞和对照细胞与car+t细胞共培养之前,先用荧光胞内染料(cfse或celltraceviolet)将它们进行标记。将共培养物在37℃下孵育4小时。在该孵育期之后,将细胞用可固定的生存力染料标记并通过流式细胞术分析。确定每个细胞群体(靶标细胞或阴性对照细胞)的活力,计算特异性细胞裂解的百分比。mrna转染后48h进行细胞毒性试验。抗肿瘤小鼠模型将肿瘤细胞(来自患者的cd22ball)或表达靶标蛋白的萤光素酶细胞植入免疫缺陷小鼠的侧腹。随后,将细胞植入小鼠大脑。连续移植到更多代的小鼠中继续维持体内异种移植细胞系。可选地,小鼠在注射car+t细胞之前/或同时接受抗癌治疗(阿仑单抗和/或flu)。随后用不同剂量的待测car+t细胞或者用不表达cd22car的t细胞iv注射小鼠(注射肿瘤细胞系后2天或7天)。在注射t细胞当天(d0),t细胞注射之后第7、14、21、28和40天确定生物发光信号,以便追踪不同动物中的肿瘤进展。i期剂量递增研究,以评估同种异体cd22cart(ucart22)在患有复发的或难治性或mrd+cd22+b细胞急性淋巴细胞性白血病(b-all)的患者中的安全性、扩增和持久性。背景与基本原理在目前的多药化疗方案中,>80%的儿童急性淋巴细胞性白血病(all)和大约40%的成人all可以长期生存。(1)进一步加强化疗尚未证明是有效的。(2)过去几年中,我们对all的生物学的认识有了显著的进步,这为“靶向治疗”提供了机会。(3,4)复发的/难治性all仍然是具有挑战性的疾病。复发后疗法将在30-40%的5年os仅为10%左右的患者中导致第二次cr(cr2)。在迄今为止最大的复发的成人all患者报告中,fielding及其同事分析了在mrcukallxii/ecoge2993试验中接受治疗的复发的成人all患者的结局。(5)在1508名可评估的患者中,有1372名(91%)获得cr1,其中609名(44%的cr1患者)在中位生存期11个月复发了。复发患者的5年os仅为7%。复发患者的中位生存期os为5.5个月。tavernier及其同事报告了法国lala-94试验中治疗的421例首次复发的all患者的结局。(6)在44%的患者中获得了cr2,其中位dfs为5.2个月,中位os为6.3个月。oriol和同事报告了在4项连续的pethema试验中首次复发的263例all患者的结局。(7)在45%的患者中达到了cr2,这一比率与法国lala试验相似。复发后中位os为4.5个月,5年os为10%。cd22表达在>90%的all患者中发生,并且是有效的治疗靶标。细胞疗法例如嵌合抗原受体(car)t细胞疗法正越来越多地被用于治疗患有血液系统恶性肿瘤的患者。(8-16)在复发的急性淋巴细胞性白血病(all)患者中,用自体cd19cart细胞报告了很高的完全应答率(80-90%)。(12)类似地,在经受自体cd19cart治疗的复发的慢性淋巴细胞性白血病(cll)患者中获得40-50%的应答率。(9)本研究评估了针对患有复发的和/或难治性cd22b-all的患者中的cd22的同种异体cart细胞。目标主要目标评估同种异体cd22cart的安全性和耐受度(tolerability),并确定最大耐受剂量(mtd)次要目标确定同种异体cd22cart的效果确定gvhd的发生率探索性目标确定注入的cart细胞的扩增、表型、运输和持久性纳入标准1.复发的或难治性cd22阳性all(对于扩增期:允许患有mrd+疾病的患者)2.≥2岁的患者3.ecog性能状态≤24.正常器官功能包括胆红素≤2mg/dl,alt/ast<3xuln和肌酐≤2mg/dl5.左心室射血分数(lvef)≥40%排除标准1.患者怀孕或哺乳2.具有不受控制的活动性感染患者3.孤立的髓外复发(即,睾丸、cns)4.已知活跃的cns白血病。注意:具有cns疾病病史并且已得到有效治疗的患者,只要在招募前cns症状缓解>4周,即可获得资格5.活动性乙型肝炎或活动性丙型肝炎6.hiv感染7.需要全身性类固醇治疗的活动性gvhd。类固醇替代疗法可以接受。8.在cd22cart输注后的4周内接受了dli9.cd22cart输注后60天内的allo-sct研究内容这是i期的研究。此试验分为两期。剂量递增和剂量扩大。患者接受淋巴耗竭化疗后接受cd22同种异体cart。剂量递增:在标准的3x3设计中研究四个剂量水平。总共招募了9-18名患者。一旦确定了r2pd水平,就起始剂量扩大。随后,总共招募20名患者(10名r/rall;10名mrd+post-sct)。总样本量:29-38位患者第二项研究将在cd19+cd22+b-all患者中比较针对cd22的同种异体cart细胞与针对cd22和cd19(2种形式)的同种异体cart细胞进行了比较。目标主要目标评估同种异体cd19+cd22cart的安全性和耐受度,并确定最大耐受剂量(mtd)次要目标确定同种异体cd22cart的效果确定gvhd的发生率探索性目标确定注入的cart细胞的扩增、表型、运输和持久性纳入标准1.复发的或难治性cd22阳性all(对于扩张期:允许患有mrd+疾病的患者)2.≥2岁的患者3.ecog性能状态≤24.正常器官功能包括胆红素≤2mg/dl、alt/ast<3xuln和肌酐≤2mg/dl5.左心室射血分数(lvef)≥40%排除标准1.患者怀孕或哺乳2.不受控制的活动性感染患者3.孤立的髓外复发(即睾丸,cns)4.已知的活跃cns白血病。注意:有cns疾病病史且已得到有效治疗的患者,只要在招募前cns症状缓解>4周,即可获得资格即可获得资格5.活动性乙型肝炎或活动性丙型肝炎6.hiv感染7.需要全身性类固醇治疗的活动性gvhd。类固醇替代疗法可以接受。8.在cd22cart输注后的4周内接受了dli9.cd22cart输注后60天内的allo-sct研究内容这是i期研究。此试验分为两期。剂量递增和剂量扩大。患者接受淋巴耗竭化疗后接受cd22同种异体cart。剂量递增:在标准的3x3设计中研究四个剂量水平。总共招募9-18名患者。一旦确定了r2pd水平,就起始剂量扩大。随后,总共招募20名患者(10r/rall;sct后10mrd+)。总样本量:29-38位患者参考文献1.inabah,greavesm,mullighancg.acutelymphoblasticleukaemia.lancet.2013;381(9881):1943-55.2.faderls,thomasda,o′briens,ravandif,garcia-manerog,borthakurg,etal.augmentedhyper-cvadbasedondose-intensifiedvincristine,dexamethasone,andasparaginaseinadultacutelymphoblasticleukemiasalvagetherapy.clinlymphomamyelomaleuk.2011;11(1):54-9.3.mullighancg.genomesequencingoflymphoidmalignancies.blood.2013;122(24):3899-907.4.mullighancg.genomiccharacterizationofchildhoodacutelymphoblasticleukemia.seminhematol.2013;50(4):314-24.5.fieldingak,richardssm,choprar,lazarushm,litzowmr,buckg,etal.outcomeof609adultsafterrelapseofacutelymphoblasticleukemia(all);anmrcukall12/ecog2993study.blood.2007;109(3):944-50.6.taverniere,boironjm,huguetf,bradstockk,veyn,kovacsovicst,etal.outcomeoftreatmentafterfirstrelapseinadultswithacutelymphoblasticleukemiainitiallytreatedbythelala-94trial.leukemia:officialjournaloftheleukemiasocietyofamerica,leukemiaresearchfund,u.k.2007;21(9):1907-14.7.oriola,vivess,hemandez-rivasjm,tormom,herasi,rivasc,etal.outcomeafterrelapseofacutelymphoblasticleukemiainadultpatientsincludedinfourconsecutiverisk-adaptedtrialsbythepethemastudygroup.haematologica.2010;95(4):589-96.8.kochenderferjn,wilsonwh,janikje,dudleyme,stetler-stevensonm,feldmansa,etal.eradicationofb-lineagecellsandregressionoflymphomainapatienttreatedwithautologoustcellsgeneticallyengineeredtorecognizecd19.blood.2010;116(20):4099-102.9.porterdl,levinebl,kalosm,bagga,junech.chimericantigenreceptor-modifiedtcellsinchroniclymphoidleukemia.nengljmed.2011;365(8):725-33.10.brentjensrj,davilaml,rivierel,parkj,wangx,cowelllg,etal.cd19-targetedtcellsrapidlyinducemolecularremissionsinadultswithchemotherapy-refractoryacutelymphoblasticleukemia.scitranslmed.2013;5(177):177ra38.11.gruppsa,kalosm,barrettd,aplencr,porterdl,rheingoldsr,etal.chimericantigenreceptor-modifiedtcellsforacutelymphoidleukemia.nengljmed.2013;368(16):1509-18.12.maudesl,teacheydt,porterdl,gruppsa.cd19-targetedchimericantigenreceptort-celltherapyforacutelymphoblasticleukemia.blood.2015;125(26):4017-23.13.parkjh,geyermb,brentjensrj.cd19-targetedcart-celltherapeuticsforhematologicmalignancies:interpretingclinicaloutcomestodate.blood.2016;127(26):3312-20.14.leedw,kochenderferjn,stetler-stevensonm,cuiyk,delbrookc,feldmansa,etal.tcellsexpressingcd19chimericantigenreceptorsforacutelymphoblasticleukaemiainchildrenandyoungadults:aphase1dose-escalationtrial.lancet.2015;385(9967):517-28.15.kochenderferjn,dudleyme,kassimsh,somervillerp,carpenterro,stetler-stevensonm,etal.chemotherapy-refractorydiffuselargeb-celllymphomaandindolentb-cellmalignanciescanbeeffectivelytreatedwithautologoustcellsexpressingananti-cd19chimericantigenreceptor.jclinoncol.2015;33(6):540-9.16.kebriaeip,singhh,hulsmh,figliolamj,bassettr,olivaress,etal.phaseitrialsusingsleepingbeautytogeneratecd19-specificcartcells.jclininvest.2016;126(9):3363-76.实施例实施例1:表达cd22car的tcrα失活细胞的增殖。设计并生产了靶向t细胞受体α恒定链区域(trac)基因中由15bp间隔子隔开的两个17bp长序列(称为半靶)的异二聚体tale核酸酶。表6中列出的半tale核酸酶的重复序列可识别每一个半靶标。表6:靶向tcrα基因的tal核酸酶用限制性酶切消化将每个tale核酸酶构建体亚克隆在t7启动子的控制下的哺乳动物表达载体中。从携带在t7启动子下游编码序列的质粒合成编码切割trac基因组序列的tale核酸酶的mrna。将用抗cd3/cd28涂覆的磁珠预活化72小时的经纯化的t细胞用编码两个半个trac_t01tale核酸酶的2个mrna中的每一个进行转染。转染后48小时后,分别用编码本发明的cd22car之一的载体转导来自同一供体的不同组的t细胞。转导2天后,用抗cd3磁珠纯化cd3neg细胞,转导5天后用可溶性抗cd28(5μg/ml)再活化细胞。再活化后通过每周计数2次细胞跟踪观察细胞增殖最高达30天。表达cd22car的tcrα失活细胞中的增殖与未失活细胞的增殖相当,特别是在用抗cd28再活化时有所增加。talenmrna的多重转染在活化的t细胞中转染编码tractalen(左和右)的mrna和编码对b2m基因特异的talen对的mrna,并随后用编码对cd22特异的car或对cd19特异的car或两者都有的外源多核苷酸进行转导。双重kotrac和b2m或cd56基因表达了不可检测水平的tcr和mhci或tcr和cd56。纯化后,对细胞再次进行转导。实施例2:cd22car-t开发靶向cd22的工程化cart细胞,用于治疗难治性、复发的或侵袭性all或cll。cd22car:(图2)作为m971和对cd22亲和力降低而选择性高的m971变体的构建体使用不同的scfv设计和制备cd22car。m971scfv源自971抗体(hasow1,leedw,shahnn,stetler-stevensonm,yuancm,pastanih,dimitrovds,morganra,fitzgeralddj,barrettdm,wayneas,mackallcl,orentasrj.anti-cd22-chimericantigenreceptorstargetingb-cellprecursoracutelymphoblasticleukemia.blood.2013feb14;121(7):1165-74.doi:10.1182/blood-2012-06-438002.epub2012dec14)构建体具有4-1bb共刺激结构域、cd3ζ活化域、cd8α跨膜结构域和铰链cd8α铰链(seqidno:15)的car架构(图2)。该构建体包含对应于seq-idn°14的fcγriiiα铰链。将构建体插入载体中,用于稳定表达和筛选所设计的car。cd22car为m971–v3car(seqidno.22);和seqidn°24。还可以针对cd22结合以及all和cll、优选它们的难治性复发的和侵袭性的形式的治疗优化序列。car表达通过抗cd3cd28涂覆的磁珠和il-2活化5天后,将cd22car引入原代kotcrt细胞中。通过流式细胞术评估car的表达。所有car均表达在细胞表面。针对cd22+转化细胞系和来自患者的难治或复发cd22+ball的活性。为了测试抗cd22car的功能性,使用了表达cd22的b细胞,使用all细胞系reh、sem、nalm6-gl、kopn8、daudi、raji和k562(实验详情参见haso等,2013,2013;blood:121(7):1165–1174)。难治性或复发的cd22+ball来自患者。如预期的那样,所有表达cd22的细胞都被阳性染色和被本发明的来自m971的cd22car靶向,与cd22car(来自ha22的scfv2)一样。脱粒试验为了验证cd22car构建体,在具有表达本发明cd22car的t细胞的靶标细胞上进行脱粒试验。通过流式细胞术评估cart脱粒情况。读数是与靶标细胞孵育5小时后t细胞质膜上的cd107a的表达。结果表明,与针对cd22的远端部分(seqid20)scfv-2的cd22cart细胞相比,carm971-(scfv-1)脱粒更重要。(图5)。细胞毒性试验用本发明的表达cd22car的t细胞在这些相同的靶标细胞上进行了细胞毒性试验。与表达针对cd22的远端部分的scfv的细胞(scfv2)相比,cd22car显示出本发明的ucart22对cd22细胞的强特异性裂解(图6)。干扰素γ试验ucart22(针对cd22的近端结构域的scfv-v1)的γ干扰素产生与未转导(nt)或用靶向cd22远端部分的car(scfv-v2)转导的t细胞相比,cd22阳性nalm-16细胞存在下的细胞与cd22阴性sup-t1细胞相比(图7)。小鼠存活情况与对照细胞相比,存在ucart22(针对cd22的近端结构域的scfv-v1)或cart22(无trac失活)的情况下,小鼠的存活率得到了改善(图8)。对低氧和/或药物的耐受性与未工程化细胞敏感性细胞相比,本发明的工程化细胞ucart22在存在阿仑单抗(50微克/ml)或pna(flu)的情况下没有受到显著影响(存活和ctl活性),所述非工程化细胞敏感性细胞在细胞培养物加入药物后48小时或在低氧条件(低于5%,优选低于1%o2)培养后死亡。在低氧条件(<5%或<1%)下进行的测试产生了相似的结果,并证实hif-1a表达增加的ucart22可以存活,表达cd22car并且在低氧条件下是活性的。在经campath(50微克/ml)处理的小鼠中获得了相似的结果(存活率,ctl活性),证实ucart22对药物的耐受性。表明了本发明的ucart22细胞有可能触及嵌套在组织中的癌细胞或触及体内形成簇的癌细胞,因为“恢复”或“逃避”ucart22治疗的癌细胞数量要比使用不耐o2的ucart22治疗的小鼠中少得多(约15%)。因此,似乎由液体肿瘤引起的局部低氧可能阻止免疫细胞攻击它们。进行实验以确定是否可以在需要时消除ucart22细胞(图3和图4)。与单独的细胞相比,利妥昔单抗和ucart处理的小鼠肿瘤细胞的荧光强度增加表明,利妥昔单抗在小鼠中引起ucart的显著降低。获得的临床首批数据表明,ucart细胞在体内和体外均显著减少了复发的和难治性all,无或非常轻度(1级)的gvhd,并且轻度至没有不受控制的细胞因子风暴。这种治疗的“毒性”低于自体cd22cart,并且在患者中可以使用利妥昔单抗和/或qben10进行控制。细胞在人体内的驻留足够长以维持活性(超过一个月),并且可以使用qben10进行耗竭。制备的cd22car多肽序列的实例成阅读框的序列对应于优选的vh和vl序列。如上所述,可以交换(swap)vh和vl(在热点中修饰)以提高car效率·v1-m972(fcγriiiα-cd8αtm-41bb.ic-cd3ζ.ic)(对照不是本发明的一部分)·v3-m972(cd8α-cd8αtm-41bb.ic-cd3ζ.ic)(对照不是本发明的一部分)·v1-m971(fcγriiiα-cd8αtm-41bb.ic-cd3ζ.ic)·v3-m971(cd8α-cd8αtm-41bb.ic-cd3ζ.ic)结果所选择用于在ucart22中制备的car构建体包含m971抗人cd22scfv(描述于haso等,2013)、cd8α铰链(可选的)和跨膜结构域,以及由4-1bb共刺激结构域和cd3ζ信号转导结构域组成的胞质尾区(图3)。另一个car构建体依次包含m971抗人cd22scfv序列、两个针对利妥昔单抗的结合结构域(cd20)、cd8α铰链和跨膜结构域以及由4-1bb共刺激结构域和cd3ζ信号转导结构域组成的胞质尾区(图3)。一种可选的car构建体依次包含针对利妥昔单抗的结合结构域(cd20)、针对q-ben10的结合结构域(cd34)、m971抗人cd22scfv、两个针对利妥昔单抗的结合结构域(cd20)、cd8α铰链和跨膜结构域以及由4-1bb共刺激结构域和cd3ζ信号转导结构域组成的胞质尾区(图3)。在ucart22中,重组的第三代自失活(sin)慢病毒载体(rlv)用于生成在人ef1α启动子的控制下表达抗cd22car和rqr8耗竭机制的t细胞(图4)。源自hiv的重组慢病毒载体具有遗传稳定性,尚未显示出归因于该载体的病理后果的证据(chang和sadelain,2007;wang等,2009)。另外,用rlv转导t细胞的条件是已知的,与保留t细胞的功能特性相容。在ucart22中,可以在对基因例如trac基因(编码α亚基或tcr的基因)或pct/ep2017/076798中公开的任何基因进行遗传编辑后,使用aav6载体(图9)。还制备了包含另外的cd19scfv(在cd22scfv之前或之后)的本发明的抗cd22car构建体的变体,以及多链cd22car,多链cd22、cd19car(图2)并将其插入慢病毒载体腺相关病毒6(aav6)载体,使得制备了下文所述待插入trac基因或cd25基因或β2微球蛋白基因中的cd22car构建体或cd19car构建体(car序列位于序列5'和3'侧接,使得使用特异性tal-蛋白-fok-1(talen)特异性切割所述基因后能够同源重组到trac基因、cd25基因或β2微球蛋白基因。制备了另外包含tgfβ受体ko基因、il-10受体ko基因、ahrko基因、pd1ko基因、lag-3ko基因、tim-3ko基因或其组合的ucart22。制备了每个ucart22另外包含tgfβ受体ko基因或il-10受体ko基因或芳基烃受体(ahr)ko基因或pd1ko基因或lag-3ko基因或tim-3ko基因的实例。为了测试耗竭cd19+cd22+癌细胞的效果,制备了先前在“molecularremissionofinfantb-allafterinfusionofuniversaltalengene-editedcartcells.waseemqasim,etal.,2017.sciencetranslationalmedicine25jan2017)”中描述的且还包含自杀基因的抗cd19构建体,该自杀基因不同于cd22所携带的自杀基因(如wo2016120216a1中所述)。在本研究中,与单种细胞单独地测量了以下各成分的细胞裂解活性1)ucart19+ucart22的组合(两个单链car),与单独的单种细胞相比(均为5x106个细胞),2)表达双特异性抗cd22抗cd19car的tcr阴性细胞,(双特异性单链car),与单独的单种细胞相比(均为5x106个细胞),3)或同时包含cd22scfv和cd19scfv或cd19cd22scfv的多链car。表达rqr8、r2cd22car或qr3cd22car以赋予对利妥昔单抗/利妥昔单抗和qben10的敏感性已设计出驱动cd22car表达的慢病毒载体盒,来共表达rqr8(通过2a肽接头)。rqr8是可以在与ucart22给予相关的不可控制的不良事件中有效活化的耗竭配体。rqr8是136个氨基酸的人工细胞表面蛋白,组合了来自人cd34的抗体结合表位(被qbend-10抗体识别)和人cd20(philip等,2014)。构建体中存在的cd20表位由利妥昔单抗识别,因此可以通过利妥昔单抗和/或qben10存在下的补体介导的细胞杀伤(cdc)和抗体依赖性细胞介导的细胞毒性(adcc)缺失表达rqr8的细胞。在其他实验中,制备了抗cd22car的构建体,包含2个由利妥昔单抗识别的表位(r)(r2cd22car:两个由利妥昔单抗识别的表位,插入在紧邻scfv之后和紧邻铰链之前,或者代替铰链以便与具有铰链的整个结构相比缩短胞外结构域)或“qr3”qr3cd22car(q:由qben10识别的表位,q-r,在vh-接头-vlrr铰链tm-41bb-cd3ζ之前的n端),并针对表达各种水平cd22的细胞进行测试。敲除trac基因以限制ucart22的同种异体反应同种异体过继免疫治疗方法的潜在局限性在于,通过供体和受体之间供体细胞的tcrαβ复合体识别mhc的差异可能导致供体t细胞活化/增殖以及移植物抗宿主病(gvhd)的发展。tcrαβ由α和β亚基组成,tcrα由单个基因编码,tcrβ由两个同源基因编码。将ucart22细胞遗传修饰成特异性破坏t细胞受体α恒定(trac)基因。trac基因的失活阻止了tcrαβ复合物在细胞表面表达,从而消除了tcr介导的组织相容性抗原的识别,这种识别会导致gvhd。在ucart22制造过程结束时,按照释放标准,剩余的tcrαβ+细胞将被耗竭,确保最终产品中tcrαβ+细胞的残留水平≤3.0%。cd52基因敲除以赋予对阿仑单抗的耐受性将ucart22工程化成为cd52-和cd52+细胞的混合物,使得能在给予ucart22之前在淋巴耗竭方案中潜在地使用阿仑单抗。阿仑单抗是与人cd52结合的单克隆抗体。因此,ucart22的cd52-部分对阿仑单抗具有耐受性。技术用于破坏trac和cd52基因。在ucart22的生产过程中,使用电穿孔系统将trac和cd52作为信使核糖核酸(mrna)引入细胞。这种瞬时表达允许在被细胞降解之前执行有效的靶向基因敲除。这种方法可以预防与输注给患者的细胞中核酸酶长期表达相关的潜在风险。b2m基因敲除以限制ucart22的同种异体反应性技术用于破坏trac和b2m基因。在ucart22的生产过程中,使用电穿孔系统将trac和b2m作为信使核糖核酸(mrna)引入细胞中。这种瞬时表达允许在被细胞降解之前执行有效的靶向基因敲除。实施例非临床研究(药理和毒理学)中使用的t细胞来源在非临床研究中使用的细胞产物的描述总结于表。表c用于体外和体内临床前研究的工程化t细胞。dko:双重ko,ko:敲除,rlv:重组慢病毒载体mhci:主要组织相容性复合物i类b2m:β2微球蛋白总结ucart22的活化是由抗cd22嵌合抗原受体(cd22car)与cd22抗原之间的接触驱动的,导致通过t细胞介导的细胞毒性和可能的促炎性细胞因子的产生破坏cd22+b-all细胞。在开发其他ucart产品(ucart19和ucart123)期间进行的概念验证研究证明,ucart细胞(tcrαβ缺陷的cart细胞)与未基因编辑的cart细胞(tcrαβ阳性cart细胞)在体外和nsg小鼠的异种移植模型体内和一样活跃(poirot等,2015)。与tcrαβ阳性的cd22cart细胞相比,针对tcrαβ缺陷的cd22cart细胞和tcrαβ缺陷mhci缺陷的cd22cart细胞而证实了这一点。ucart22非临床开发期间进行的体外药理研究总结于表2。研究证明:-通过cd22抗原依赖性细胞毒性和细胞因子分泌试验的ucart22的抗肿瘤活性。针对b-all细胞系和原代b-all样品进行活性试验。-有效的介导的trac和cd52基因失活。-有效的介导的trac和β2微球蛋白基因失活。-该cd52-t细胞对阿仑单抗具有耐受性。-使用利妥昔单抗有效清除rqr8+细胞或r2cd22car+细胞。表d:体外药理研究列表。cdc=补体依赖性细胞毒性,pha=植物血凝素。体内药理研究(总结于表)证明了:-使用b-all细胞系,ucart22针对免疫缺陷小鼠的肿瘤异种移植物的体内抗肿瘤活性。已针对b-all细胞系证实gmp条件下生产的ucart22的体内活性。-使用b-all细胞系,ucart22/19针对免疫缺陷小鼠的肿瘤异种移植物的体内抗肿瘤活性提高。gmp条件下生产的ucart22/19和19/22对b-all细胞系的体内活性。-利妥昔单抗在正常免疫小鼠模型中清除rqr8+细胞的能力。表e体内研究列表为了证明ucart22细胞的活性,针对肿瘤细胞系和原代b-all细胞进行了car驱动的细胞毒性和细胞因子分泌试验。通过细胞毒性试验评估ucart22活性针对b-all细胞系的细胞毒活性评估了ucart22对来自儿童或成人b-all患者的几种肿瘤细胞系的潜在细胞毒性(表f)。结果显示,mhh-call-4、mutz-5、semk2、pall-2、lax2、ball-1、nalm-6和rs4;11均为表达不同水平cd22的cd22+细胞系。两种不表达cd22的急性髓系白血病(aml)细胞系(oci-aml2和molm13)用作阴性对照。表f:细胞系的特征。通过检测cd22+靶标细胞与ucart22细胞共培养后的存活力来评估ucart22对cd22+细胞的特异性细胞毒性。未转导(car-)trac和cd52双重kot细胞用作对照来计算ucart22对靶cd22+b-all细胞的特异性细胞裂解百分比。结果显示出ucart22细胞对一组cd22+b-all肿瘤细胞系的细胞毒活性。ucart22显示出针对所有表达cd22的细胞系的特异性细胞裂解活性,即使在最低水平也是如此。对原代b-all样品的细胞毒活性证实了ucart22对几种原代b-all样品的细胞毒活性。原代样品的特征列于表g。仅有胚细胞(blast)大于50%的患者样本被用于共孵育研究,19个样本中它占14个。表g临床前研究中评估的所有原代样本。nd:未确定还评估了除pt1外的所有原代b-all样本中的cd22和cd19表达水平。11个cd22表面表达高于cd22对照,并且4个b-all患者样品显示出cd22表面表达在发现于b-all细胞系的范围内(>1000个cd22分子/细胞)。除两个复发样本外,高度表达cd22(>60%)的也表达了cd19。使用与细胞系相同的方法,证实了针对8个b-all患者样品的ctl活性(大于10%的特异性细胞裂解)。针对b-all细胞系和原代b-all样品的细胞因子分泌试验使用biolegendlegendplex13细胞因子测定法评估与几种细胞系或b-all患者样品共同孵育的ucart22细胞的干扰素γ(ifnγ)和其他细胞因子的释放。发现在b-all细胞与ucart22或对照t细胞(ntddko)之间共同孵育25小时后,在所有被检测的细胞因子(il-2,il-4,il-5,il-6,il-9,il-10,il-13,il-17a,il-17f,il-21、il-22和肿瘤坏死因子α(tnf-α))中,分泌到培养基中的ifnγ浓度最高。当ucart22与b-all细胞系和原代b-all样品共同孵育时,观察到高水平的干扰素γ分泌。体外辅助研究诱导的trac、b2m和cd52基因失活在同源同种异体环境中使用ucart22的能力取决于防止tcrαβ、mhcci在细胞表面表达,清除tcr介导的组织相容性抗原识别(这种识别可能导致gvhd和宿主cd8+细胞的攻击)的能力。为了有效地从细胞表面清除tcrαβ和mhcci,使用了介导的基因编辑来失活trac和β2微球蛋白基因(b2m)基因。此外,在ucart22的生产过程中使用了另一种来使cd52基因失活,从而允许在淋巴耗竭的调理方案中使用阿仑单抗。在特定环境中,在ucart22的生产过程中使用了来失活β2微球蛋白基因(b2m),以改变主要的组织相容性i类(mhci类)分子的表达并防止宿主t细胞的排斥。trac、cd52、b2m基因破坏的分子分析为了在分子水平上证明trac和cd52基因的靶向修饰,从用gmp级trac和cd52mrna或trac和b2mmrna电穿孔的t细胞中分离了基因组脱氧核糖核酸(dna),并纯化了tcrαβ-细胞mhcci-。通过聚合酶链反应(pcr)扩增trac、b2m和cd52切割位点附近的区域,并通过下一代测序技术(ngs,illumina)进行分析。在对照样品中,在电穿孔mrna之前(第6天),取出细胞进行了相同的分析。该分析表明,尽管第6天的对照细胞在trac和cd52基因座上未显示出任何修饰,但在经处理的t细胞中检测到了较高的修饰频率(表)。表h在trac和cd52和b2m基因座进行切割后,非同源末端连接(nhej)的百分比。通过ngs确定来自3个不同批次的经处理的t细胞中的百分比。所有批次的mrna电穿孔前均取样了对照细胞。表h对序列的进一步分析表明,诱导的修饰位于靶位点附近的小区域,这些修饰的93-97%为缺失。这些缺失通常很小,平均有97%是小于150bp的缺失,有81%是小于50bp的缺失。证明ucart22中trac基因破坏的功能试验为了证明tcrαβ的功能失活,分析了植物血凝素(pha)介导的tcr刺激后,ucart22细胞表达活化标志物如cd25和cd69的能力。使用所有gmp原料进行的ucart22,在tcrαβ+细胞耗竭之前(trac)或之后(ucart22)回收了t细胞。在24小时内,用0.5μg/mlpha将细胞再活化。通过流式细胞术检测活化标志物(cd25和cd69)的表达。尽管对照的trac细胞(65.2%tcrαβ-)上调cd25和cd69,但在ucart22细胞(98.9%tcrαβ-)上未观察到上调,证实了ucart22中不存在tcrαβ受体。cd52-ucart22细胞对阿仑单抗的耐受性在淋巴耗竭方案中使用抗cd52单克隆抗体—阿仑单抗的能力取决于从ucart22细胞的细胞表面对cd52糖蛋白的有效清除,以防止它们被阿仑单抗清除。因此,使用cd52将ucart22工程化成是cd52+和cd52-细胞的混合物。在制造过程结束时对开发批次的ucart22进行的流式细胞仪分析表明,平均72%的t细胞(cd45+/cd4+或cd8+细胞)是cd52-(范围是62.3-76.5%,n=6)。为了证明cd52-细胞对阿仑单抗具有耐受性,进行了补体依赖性细胞毒性(cdc)试验。将含有介导的cd52基因失活的人t细胞用50μg/ml的大鼠抗cd52抗体(治疗性抗体阿仑单抗源自该大鼠抗cd52抗体)或大鼠免疫球蛋白g(igg)作为对照进行处理,在有或没有兔补体的情况下在37℃下放置2小时,随后通过流式细胞术分析其活力和cd52表达。结果表明,在存在阿仑单抗的情况下,通过补体依赖性细胞毒性可特异性清除不含cd52基因失活的细胞。对宿主cd8+t细胞的耐受性mhci类缺陷的ucart22细胞对cd8+t细胞介导的破坏耐受。尽管干扰素γ(ifn-γ)处理显著诱导了β2微球蛋白的表达,促进了cd8+t细胞介导的对对照ucart22的杀伤。证明利妥昔单抗治疗后ucart22的有效耗竭ucart22是同种异体t细胞,因此应在患者免疫系统恢复后进行清除。此外,ucart22工程化成可共表达cd22car和rqr8,rqr8是短的膜蛋白,可提供两个与利妥昔单抗(rtx)结合的表位,利妥昔单抗是对人cd20特异的治疗性单克隆抗体。因此,rqr8提供了通过给予利妥昔单抗来耗竭ucart22的可能性。研究了用rtx处理后通过补体依赖性细胞毒性(cdc)清除ucart22细胞的能力。将冷冻的ucart22(来自5个不同的开发批次)解冻,并与rajicd22+细胞以1:0.25的比例共培养3天。在此再活化期后,进行了cdc试验(在存在或不存在小兔补体(brc)的情况下,将细胞与rtx(100μg/ml)孵育2小时)。结果表明,在rtx和补体同时存在下,体外有效清除了约85%的car+细胞。rtx的另一种作用机制是抗体依赖性细胞介导的细胞毒性(adcc),通过该机制可以实现rqr8+细胞的耗竭(seidel等,2013)。在这种情况下,免疫系统的效应细胞(主要是自然杀伤细胞-nk细胞)可以主动裂解膜表面抗原已被特异性抗体结合的靶标细胞。补充实验已由ucl的martinpule发表(philipetal.,2014),证明了cdc和adcc在体外有效介导的对rqr8+t(用编码rqr8和gfp的双顺反子逆转录病毒载体(sfg.rqr8.ires.egfp)转导并用miltenyiqbend10磁珠选择的原代人t细胞)细胞的清除。时间进程和rtx剂量滴定证明,rtx浓度在25μg/ml及以上时cdc非常有效,其中30分钟内会发生细胞杀伤。同样,证明了adcc介导的对rqr8+t细胞的敏感性。体内研究选择动物物种/模型的理由由于ucart22对人的特异性,标准的免疫正常动物模型中的研究由于异种免疫反应快速靶向和清除人ucart22细胞而不适用。因此,可以设想两种方法来建立ucart22活性的体内模型:同基因动物模型和免疫缺陷动物中的人肿瘤异种移植模型。同基因动物模型方法会涉及针对模型生物的ucart22物种特定版本的重建/重开发,随后评估该物种特异的ucart22替代产品植入同基因宿主时的功能特性。由于各个car的性质差异很大,并且由于免疫功能、生理学和遗传学的物种特异性差异极大地损害了ucart22在人体中活性的推断,因此该方法被认为是不相关的。选择免疫缺陷鼠异种移植模型是因为它允许ucart22和人肿瘤cd22+细胞(b-all细胞系或原代样品)的移植。该动物模型已广泛用于评估cart细胞疗法的体内活性。尽管这些模型中靶/脱靶细胞毒性(on-target/off-tumorcytotoxicity)和脱靶细胞毒性方面具有与上述免疫正常模型相同的局限性,并且完全清除了mhc错配的任何作用,但它们已被证明对评价car的体内抗肿瘤功效是非常有用的。他们已经成为了评估cart细胞产品体内活性的事实标准(例如,参见许多已发表的文章中的carpenito等,2009;gade等,2005;gill等,2014;hudecek等,2010;kenderian等,2015;mardiros等,2013;zhou等,2013)。它们已经证明能够区分不同car的相对抗肿瘤活性,突出了它们捕获和半定量读出有用的人体内t细胞功能的能力(例如,参见milone等,2009)。因此,已经将人cd22+肿瘤细胞移植到免疫缺陷小鼠(nsg小鼠)中,随后给予ucart22,并将癌症负荷和存活时间的系列评估作为抗肿瘤活性的指标。选定的肿瘤模型关于肿瘤异种移植,已经针对daudi细胞、cd22+b-all细胞系(ccl-213,atcc)评估了ucart22的体内活性。该细胞系修饰成了通过慢病毒载体(amsbiolvp438-pbs)进行转导来表达萤火虫荧光素酶(和gfp),以便通过体内成像(daudi-luc-gfp细胞)追踪癌症负荷。选定的小鼠品系体内非临床研究中使用的小鼠品系为:1.高度免疫缺陷的nsg小鼠(nod.cg-prkdcscidii2rgtm1wjl/szj;jackson株系#5557),缺乏成熟的t细胞、b细胞和功能性nk细胞,用于证明抗肿瘤活性。2.免疫正常的小鼠模型(c57bl/6xbalb/c(f1)小鼠),用于证明rqr8耗竭或r2cd22car机制的效果。分析方法使用以下方法评估了ucart22的体内活性:-相对于对照组(对于具有表达荧光素酶的细胞系的异种移植模型),处理后小鼠的生物发光测量,-临床体征-小鼠的整体存活率。给予途径在动物中给予ucart22的途径是静脉内注射(单次不分剂量)。在人类中,还将ucart19和ucart22进行静脉注射(不分剂量),单独地一次两次或者三次或四次,或者按以下顺序一个接一个:1922192219或22192219或19/2219/22。ucart22体内抗肿瘤活性的证明在植入了daudi-luc-gfp人肿瘤细胞的免疫缺陷小鼠中利用多个开发批次的ucart22而证实了ucart22活性。图8示出了该研究的实例。此外,正在进行一项验证性研究,用于评估gmp批次的ucart22的体内活性。简而言之,在第7天向nsg小鼠静脉内注射0.5x106个daudi-luc-gfp细胞,并在第0天用ucart22进行处理(静脉注射,2剂:3x106和10x106个ucart22细胞/小鼠,每组5只小鼠)或未经处理(注射载体)。注射针对trac和cd52的双重ko未转导t细胞(ntddko)作为对照。根据文献中用于证明其他cd22cart细胞在体内具有抗肿瘤活性的car+t细胞的剂量(haso等,2013)确定给予的ucart22剂量。如体内成像所示,ucart22处理导致了肿瘤细胞的清除,延长了生存期,所有治疗小鼠均在研究结束时(ucart22处理后80天)存活。这些结果证明了ucart22的抗肿瘤活性。cd52-细胞在体内对阿仑单抗耐受,cd52-car+t细胞在存在阿仑单抗的情况下表现出体内活性在开发ucart19(另一种含有相同trac/cd52双重敲除的ucart产品)的过程中进行的研究证明,cd52-t细胞在体内对阿仑单抗具有耐受性(poirot等,2015)。另外,在nsg小鼠的肿瘤异种移植模型中证明了存在阿仑单抗的情况下ucart19细胞的活性。所有接受肿瘤细胞但未接受ucart19细胞的小鼠均表现出肿瘤进展,导致注射13天后被处死。在接受肿瘤和ucart19细胞的7只小鼠中,有5只在第13天肿瘤完全得到了控制,而在其余两只小鼠中,观察到部分应答。相反,在未输注ucart19细胞的情况下观察到阿仑单抗处理仅延迟了肿瘤的进展(6/6只小鼠)。在用阿仑单抗联合ucart19细胞处理的小鼠中,如通过输注13天后从骨髓获得的细胞悬液的光度法或流式细胞术所评估的,从骨髓中清除了肿瘤细胞。总之,在输注ucart19细胞前2天接受了阿仑单抗处理的小鼠,证明了在存在阿仑单抗的情况下ucart19细胞在体内的抗肿瘤功效。此外,第13天的脾脏植入物数据显示cd52-t-细胞在体内对阿仑单抗具有耐受性。体内利妥昔单抗诱导rqr8+细胞有效耗竭的证明先前已在体外证实了rqr8+ucart22对rtx耗竭的敏感性。此外,martinpule的研究小组已经证明了,使用重新工程化到小鼠igg2a的rtx(功能相当于人igg1)(mrtx-igg2a),rtx能清除免疫正常的小鼠模型中的rqr8+细胞(philip等,2014)。通过将rtx的结合部分转移至鼠fc,使该抗体适合用于鼠类系统,从而以接近rtx与人fc受体结合的亲和力与鼠fc受体结合。该研究是使用免疫正常的单倍体过继转移模型进行,其中将rqr8转导的c57bl/6脾细胞转移至受非致死照射的c57bl/6xbalb/c杂交(f1)受体。该模型使得能够通过同种异体刺激在所有淋巴组织中维持良好的植入水平,而且还保留内源性的淋巴细胞。在第1天,在进行5gyx射线辐照预处理后4小时后,将来自c57bl/6小鼠的1.5x106个rqr8+供体脾细胞(使用编码rqr8-2a-gd2car构建体的逆转录病毒转导并使用miltenyicd34磁珠纯化的脾细胞)静脉注射到f1小鼠(c57bl/6xbalb/c)中。在第7天,通过流式细胞术证实了供体细胞在外周血中的植入。将小鼠用变构rtx(ritux-migg2a150μg,第7、10和12天通过尾静脉静脉注射)或pbs处理3次。每个队列有5只小鼠。在第14天处死动物,用于对脾、骨髓、血液和淋巴结进行流式细胞术分析。在经rtx处理的小鼠中,利妥昔单抗-migg2a对小鼠治疗后6小时内,在脾脏、骨髓和血液中分别观察到50%、60%和70%的rqr8+细胞耗竭。还利用ucart19产品中使用的抗cd19car进行了相同的研究。ucart19也是同种异体工程化的cart细胞产品,含有与ucart22相同的rqr8构建体。再给药这项研究评估了单次或多次注射ucart22的抗肿瘤活性。表达cd22的b-all肿瘤细胞系(表达高水平cd22的daudi)。为了表达gfp和萤火虫荧光素酶,用慢病毒载体转导细胞。在第7天通过尾静脉将肿瘤细胞(0.5x106daudi-luc-gfp)静脉内注射至nsg小鼠(nod.cg-prkdcscidii2rgtm1wjl/szj,株系005557,jacksonlaboratory)。在第0天,根据在第-1天测量的生物发光信号和体重将小鼠随机分为11组,每组6只小鼠。给予1、2或3次ucart22处理(以1或3百万个car+细胞/小鼠)。在第0+/-10天+/-20天向小鼠静脉注射ucart22。ucart22的抗肿瘤活性是通过在第1、7、14、21、28和35天进行生物发光成像跟踪观察肿瘤负荷、观察小鼠的临床体征和存活率来评估的。daudi模型,以1x06个ucart22g细胞/小鼠进行处理与用1x106个ucart22处理一次的小鼠相比,用1x106个ucart22处理了2次或3次的小鼠表现出更好的肿瘤进展控制和更长的生存期(3剂的60天存活率为80%,1剂为0%)。在一项实验中,在第30天将ucart19静脉内注射给小鼠。在这些还活着的小鼠中,第90天癌细胞的水平低于检测到的水平。总结ucart22的活性已在体外和体内针对b-all细胞系以及在体外针对原代b-all样品得到了证实。ucart22是同种异体t细胞,因此应在患者免疫系统恢复后进行清除。此外,ucart22工程化成可共表达cd22car和rqr8,rqr8是短的膜蛋白,可提供两个与利妥昔单抗(rtx)结合的表位。因此,rqr8提供了一种通过在发生不受控制的ucart22相关毒性事件(例如,细胞因子释放综合征(crs)或gvhd)时或allo-hsct之前给予利妥昔单抗来耗竭rqr8+ucart22的方法。使用免疫功能正常的小鼠模型和利妥昔单抗的变体版本,用cdc和adcc分析法证实了体外清除rqr8+细胞的有效性。此外,使用免疫功能正常的小鼠模型和利妥昔单抗的变体版本,在血液、脾脏、骨髓和淋巴结中证实了利妥昔单抗诱导的rqr8+细胞清除的效率。使用在tcr缺陷mhcci缺陷的t细胞中表达的r2或qr3抗cd22car获得了相似的结果。在体外和体内证实了cd52-细胞对阿仑单抗的耐受性,从而允许阿仑单抗在淋巴耗竭方案中的潜在用途。最后,使用在tcr缺陷mhcci缺陷的t细胞中表达的r2-抗cd22car观察到对cd8+t细胞介导的破坏的耐受性。为评估各种风险而进行的其他研究总结于表i和表j,并在以下各节中详细介绍。表i进行的体外毒理学研究列表。表j体内毒理学研究清单。在开发前述ucart产品期间,在免疫缺陷小鼠中评估了gvhd的潜在风险。这种动物模型允许人t细胞的有效植入,并且先前已证明在输注了人pbmc或t细胞后会持续产生异种gvhd(ali等,2012;schroeder和dipersio,2011)。cd22car的脱靶活性通过符合glp的组织杂交反应性研究来评估cd22car的cd22特异性,显示cd22car的scfv组分与人体组织之间没有显著的意外脱靶结合,retrogenix筛选正在进行中。此外,已发表的有关用m971衍生的cart细胞治疗的患者的临床数据表明没有脱靶毒性(fry等,2017)。由于cd22在正常b细胞上表达,因此只要ucart22持续存在,就可以预期由于ucart22的靶上/脱靶活性引起的b细胞发育不全的风险。ucart22car的gvhducart22产品的基本安全特征是ucart22介导gvh反应的可能性是否已因trac基因的破坏和tcrαβ-细胞的纯化而消除。在体内临床前研究中开发前述ucart产品(ucart19和ucart123)期间评估了该风险。在所有输注了未修饰t细胞nsg小鼠中均观察到了gvhd征象,其中发现在最高剂量下更为严重,但在输注了ucart的小鼠中未观察到与处理相关的变化。到目前为止,在临床上,14位接受ucart19治疗的患者中,有4位出现了轻度至中度的皮肤gvhd(1级3个和2级1个)(qasim等,2017),r.benjaminetw.qasim在2017年ash会议上提交了数据,这些gvhd无需全身治疗即可控制。crs已经鉴别出了与免疫疗法产品管理和潜在疾病相关的其他潜在安全风险:输液相关反应、细胞因子释放综合征(crs)、肿瘤溶解综合征,感染和神经毒性。crs是免疫疗法中特别是cart细胞试验中常见的不良事件。在自体抗cd19cart细胞临床试验中,观察到的细胞因子释放强度是几个参数组合的结果,例如注射的cart细胞的剂量,car(4-1bb/cd28)信号转导结构域,cart细胞增殖的水平以及给予当天患者的肿瘤负荷。在与最近发表的模型(taraseviciute,a.,kean,l.,&jensen,m.c.(2016)。creationofthefirstnon-humanprimatemodelthatfaithfullyrecapitulateschimericantigenreceptor(car)tcell-mediatedcytokinereleasesyndrome(crs)andneurologictoxicityfollowingbcell-directedcar-tcelltherapy.blood,128(22),651.accessedmarch28,2018。恢复自http://www.bloodjournal.org/content/128/22/651)相近的模型中对这些风险进行了体内评估。推荐用于fih研究的起始剂量由于动物模型的相关性有限、产品的生物动力性质以及发生作用的免疫适应机制,临床剂量确定的标准方法不可用于基于cart细胞的免疫疗法。因此,起始临床剂量的选择主要是基于以下方面:(i)先前在人体内给予cart细胞获得的经验(关于自体cart细胞的文献);(ii)伦敦大学学院(ucl)和伦敦国王学院(kcl)用ucart19正在进行中的临床研究中治疗的爱心病例和患者(参考(qasim等,2017)以及r.benjamin和w.qasim在2017年的ash会议上的报告)以及(iii)目前在其他b-all自体car研究中研究或批准的剂量。该方法在临床部分中进行了描述。临床研究的初步结果表明,在用ucart22治疗的患者中,两种试验中肿瘤肿团块均大大萎缩(>80%)。此外,数据表明,即使短暂但有效的治疗(从两次剂量开始)也可以中断并摆脱恶性b细胞(150天时73%得到缓解),特别是在再给药和/或使用ucart22和19之后。序列表<110>塞勒克提斯公司(cellectissa)<120>通用型抗cd22嵌合抗原受体工程化的免疫细胞<130>p81701376pct00<150>pa201770239<151>2017-03-31<150>pa201770240<151>2017-03-31<150>pa201770542<151>2017-06-30<150>pct/ep2017/076800<151>2017-10-19<160>26<210>1<211>21<212>prt<213>智人(homosapiens)<220><223>cd8α信号肽<400>1metalaleuprovalthralaleuleuleuproleualaleuleuleu151015hisalaalaargpro20<210>2<211>20<212>prt<213>智人(homosapiens)<220><223>信号肽<400>2metgluthraspthrleuleuleutrpvalleuleuleutrpvalpro151015glyserthrgly20<210>3<211>16<212>prt<213>智人(homosapiens)<220><223>fcgriiia铰链<400>3glyleualavalserthrileserserphepheproproglytyrgln151015<210>4<211>45<212>prt<213>智人(homosapiens)<220><223>cd8α铰链<400>4thrthrthrproalaproargproprothrproalaprothrileala151015serglnproleuserleuargproglualacysargproalaalagly202530glyalavalhisthrargglyleuaspphealacysasp354045<210>5<211>231<212>prt<213>智人(homosapiens)<220><223>igg1铰链<400>5gluprolysserproasplysthrhisthrcysproprocysproala151015proprovalalaglyproservalpheleupheproprolysprolys202530aspthrleumetilealaargthrprogluvalthrcysvalvalval354045aspvalserhisgluaspprogluvallyspheasntrptyrvalasp505560glyvalgluvalhisasnalalysthrlysproargglugluglntyr65707580asnserthrtyrargvalvalservalleuthrvalleuhisglnasp859095trpleuasnglylysglutyrlyscyslysvalserasnlysalaleu100105110proalaproileglulysthrileserlysalalysglyglnproarg115120125gluproglnvaltyrthrleuproproserargaspgluleuthrlys130135140asnglnvalserleuthrcysleuvallysglyphetyrproserasp145150155160ilealavalglutrpgluserasnglyglnprogluasnasntyrlys165170175thrthrproprovalleuaspseraspglyserphepheleutyrser180185190lysleuthrvalasplysserargtrpglnglnglyasnvalpheser195200205cysservalmethisglualaleuhisasnhistyrthrglnlysser210215220leuserleuserproglylys225230<210>6<211>24<212>prt<213>智人(homosapiens)<220><223>cd8α跨膜结构域<400>6iletyriletrpalaproleualaglythrcysglyvalleuleuleu151015serleuvalilethrleutyrcys20<210>7<211>27<212>prt<213>智人(homosapiens)<220><223>41bb跨膜结构域<400>7ileileserphepheleualaleuthrserthralaleuleupheleu151015leuphepheleuthrleuargpheservalval2025<210>8<211>42<212>prt<213>智人(homosapiens)<220><223>4-1bb的片段(残基214-255)<400>8lysargglyarglyslysleuleutyrilephelysglnprophemet151015argprovalglnthrthrglnglugluaspglycyssercysargphe202530proglugluglugluglyglycysgluleu3540<210>9<211>112<212>prt<213>智人(homosapiens)<220><223>t细胞表面糖蛋白cd3ζ链的片段<400>9argvallyspheserargseralaaspalaproalatyrglnglngly151015glnasnglnleutyrasngluleuasnleuglyargarggluglutyr202530aspvalleuasplysargargglyargaspproglumetglyglylys354045proargarglysasnproglngluglyleutyrasngluleuglnlys505560asplysmetalaglualatyrsergluileglymetlysglygluarg65707580argargglylysglyhisaspglyleutyrglnglyleuserthrala859095thrlysaspthrtyraspalaleuhismetglnalaleuproproarg100105110<210>10<211>15<212>prt<213>人工序列(artificialsequence)<220><223>g4sx3接头序列<400>10glyglyglyglyserglyglyglyglyserglyglyglyglyser151015<210>11<211>1532<212>dna<213>智人(homosapiens)<220><223>ucart22<400>11tgatcctcttgtcccacagatatccagaaccctgaccctgccgtgtaccagctgagagaa60tggctctgcccgtcaccgctctgctgctgccactggccctgctgctgcacgcagcaagac120cacaggtgcagctgcagcagagcggccctggcctggtgaagccaagccagacactgtccc180tgacctgcgccatcagcggcgattccgtgagctccaactccgccgcctggaattggatca240ggcagtccccttctcggggcctggagtggctgggaaggacatactatcggtctaagtggt300acaacgattatgccgtgtctgtgaagagcagaatcacaatcaaccctgacacctccaaga360atcagttctctctgcagctgaatagcgtgacaccagaggacaccgccgtgtactattgcg420ccagggaggtgaccggcgacctggaggatgcctttgacatctggggccagggcacaatgg480tgaccgtgtctagcggaggaggaggatccggaggaggaggatctggcggcggcggcagcg540atatccagatgacacagtccccatcctctctgagcgcctccgtgggcgacagagtgacaa600tcacctgtagggcctcccagaccatctggtcttacctgaactggtatcagcagaggcccg660gcaaggcccctaatctgctgatctacgcagcaagctccctgcagagcggagtgccatcca720gattctctggcaggggctccggcacagacttcaccctgaccatctctagcctgcaggccg780aggacttcgccacctactattgccagcagtcttatagcatcccccagacatttggccagg840gcaccaagctggagatcaagaccacaaccccagcaccaaggccacctacacctgcaccaa900ccatcgcctctcagcccctgagcctgagacctgaggcatgtaggccagcagcaggaggag960cagtccatacaaggggtctggattttgcatgcgacatctacatctgggcacctctggcag1020gaacatgtggcgtgctcctgctcagcctggtcatcaccctgtactgcaagagaggcagga1080agaagctgctgtatatcttcaagcagcccttcatgcgccccgtgcagacaacccaggagg1140aggatggctgctcctgtaggttcccagaagaggaggagggaggatgtgagctgcgcgtga1200agttttcccggtctgccgacgcacctgcataccagcagggccagaaccagctgtataacg1260agctgaatctgggccggagagaggagtacgatgtgctggacaagaggcgcggcagagatc1320cagagatgggcggcaagccccggagaaagaaccctcaggagggcctgtacaatgagctgc1380agaaggataagatggccgaggcctattctgagatcggcatgaagggagagaggcgccggg1440gcaagggacacgacggactgtaccagggactgagcacagccaccaaggatacctatgacg1500ccctgcatatgcaggcactgcctccaaggtga1532<210>12<211>124<212>prt<213>人工序列(artificialsequence)<220><223>971-重链<400>12glnvalglnleuglnglnserglyproglyleuvallysprosergln151015thrleuserleuthrcysalaileserglyaspservalserserasn202530seralaalatrpasntrpileargglnserproserargglyleuglu354045trpleuglyargthrtyrtyrargserlystrptyrasnasptyrala505560valservallysserargilethrileasnproaspthrserlysasn65707580glnpheserleuglnleuasnservalthrprogluaspthralaval859095tyrtyrcysalaarggluvalthrglyaspleugluaspalapheasp100105110iletrpglyglnglythrmetvalthrvalserser115120<210>13<211>107<212>prt<213>人工序列(artificialsequence)<220><223>971-轻链<400>13aspileglnmetthrglnserproserserleuseralaservalgly151015aspargvalthrilethrcysargalaserglnthriletrpsertyr202530leuasntrptyrglnglnargproglylysalaproasnleuleuile354045tyralaalaserserleuglnserglyvalproserargphesergly505560argglyserglythraspphethrleuthrileserserleuglnala65707580gluaspphealathrtyrtyrcysglnglnsertyrserileprogln859095thrpheglyglnglythrlysleugluilelys100105<210>14<211>464<212>prt<213>人工序列(artificialsequence)<220><223>971-v1多肽car序列<400>14glnvalglnleuglnglnserglyglyglyleuvallysproglyala151015serleulysleusercysvalthrserglyphethrphearglysphe202530glymetsertrpvalargglnthrserasplysargleuglutrpval354045alaserileserthrglyglytyrasnthrtyrtyrseraspasnval505560lysglyargphethrileserarggluasnalalysasnthrleutyr65707580leuglnmetserserleulyssergluaspthralaleutyrtyrcys859095thrargglytyrserserthrsertyralametasptyrtrpglygln100105110glythrthrvalthrvalglyglyglyglyserglyglyglyglyser115120125glyglyglyglyseraspilegluleuthrglnserproalaserleu130135140servalalathrglyglulysvalthrileargcysmetthrserthr145150155160aspileaspaspaspmetasntrptyrglnglnlysproglyglupro165170175prolyspheleuilesergluglyasnthrleuargproglyvalpro180185190serargpheserserserglythrglythraspphevalphethrile195200205gluasnthrleusergluaspvalglyasptyrtyrcysleuglnser210215220pheasnvalproleuthrpheglyaspglythrlysleuglulysala225230235240leuthrthrthrproalaproargproprothrproalaprothrile245250255alaserglnproleuserleuargproglualacysargproalaala260265270glyglyalavalhisthrargglyleuaspphealacysaspiletyr275280285iletrpalaproleualaglythrcysglyvalleuleuleuserleu290295300valilethrleutyrcyslysargglyarglyslysleuleutyrile305310315320phelysglnprophemetargprovalglnthrthrglnglugluasp325330335glycyssercysargpheproglugluglugluglyglycysgluleu340345350argvallyspheserargseralaaspalaproalatyrglnglngly355360365glnasnglnleutyrasngluleuasnleuglyargarggluglutyr370375380aspvalleuasplysargargglyargaspproglumetglyglylys385390395400proargarglysasnproglngluglyleutyrasngluleuglnlys405410415asplysmetalaglualatyrsergluileglymetlysglygluarg420425430argargglylysglyhisaspglyleutyrglnglyleuserthrala435440445thrlysaspthrtyraspalaleuhismetglnalaleuproproarg450455460<210>15<211>650<212>prt<213>人工序列(artificialsequence)<220><223>971-v3多肽car序列<400>15glnvalglnleuglnglnserglyglyglyleuvallysproglyala151015serleulysleusercysvalthrserglyphethrphearglysphe202530glymetsertrpvalargglnthrserasplysargleuglutrpval354045alaserileserthrglyglytyrasnthrtyrtyrseraspasnval505560lysglyargphethrileserarggluasnalalysasnthrleutyr65707580leuglnmetserserleulyssergluaspthralaleutyrtyrcys859095thrargglytyrserserthrsertyralametasptyrtrpglygln100105110glythrthrvalthrvalglyglyglyglyserglyglyglyglyser115120125glyglyglyglyseraspilegluleuthrglnserproalaserleu130135140servalalathrglyglulysvalthrileargcysmetthrserthr145150155160aspileaspaspaspmetasntrptyrglnglnlysproglyglupro165170175prolyspheleuilesergluglyasnthrleuargproglyvalpro180185190serargpheserserserglythrglythraspphevalphethrile195200205gluasnthrleusergluaspvalglyasptyrtyrcysleuglnser210215220pheasnvalproleuthrpheglyaspglythrlysleuglulysala225230235240leugluprolysserproasplysthrhisthrcysproprocyspro245250255alaproprovalalaglyproservalpheleupheproprolyspro260265270lysaspthrleumetilealaargthrprogluvalthrcysvalval275280285valaspvalserhisgluaspprogluvallyspheasntrptyrval290295300aspglyvalgluvalhisasnalalysthrlysproarggluglugln305310315320tyrasnserthrtyrargvalvalservalleuthrvalleuhisgln325330335asptrpleuasnglylysglutyrlyscyslysvalserasnlysala340345350leuproalaproileglulysthrileserlysalalysglyglnpro355360365arggluproglnvaltyrthrleuproproserargaspgluleuthr370375380lysasnglnvalserleuthrcysleuvallysglyphetyrproser385390395400aspilealavalglutrpgluserasnglyglnprogluasnasntyr405410415lysthrthrproprovalleuaspseraspglyserphepheleutyr420425430serlysleuthrvalasplysserargtrpglnglnglyasnvalphe435440445sercysservalmethisglualaleuhisasnhistyrthrglnlys450455460serleuserleuserproglylysiletyriletrpalaproleuala465470475480glythrcysglyvalleuleuleuserleuvalilethrleutyrcys485490495lysargglyarglyslysleuleutyrilephelysglnprophemet500505510argprovalglnthrthrglnglugluaspglycyssercysargphe515520525proglugluglugluglyglycysgluleuargvallyspheserarg530535540seralaaspalaproalatyrglnglnglyglnasnglnleutyrasn545550555560gluleuasnleuglyargarggluglutyraspvalleuasplysarg565570575argglyargaspproglumetglyglylysproargarglysasnpro580585590glngluglyleutyrasngluleuglnlysasplysmetalagluala595600605tyrsergluileglymetlysglygluargargargglylysglyhis610615620aspglyleutyrglnglyleuserthralathrlysaspthrtyrasp625630635640alaleuhismetglnalaleuproproarg645650<210>16<211>530<212>prt<213>人工序列(artificialsequence)<220><223>tal结合结构域trac_t01-l<400>16leuthrproglnglnvalvalalailealaserasnglyglyglylys151015glnalaleugluthrvalglnargleuleuprovalleucysglnala202530hisglyleuthrproglnglnvalvalalailealaserasnasngly354045glylysglnalaleugluthrvalglnargleuleuprovalleucys505560glnalahisglyleuthrproglnglnvalvalalailealaserasn65707580glyglyglylysglnalaleugluthrvalglnargleuleuproval859095leucysglnalahisglyleuthrprogluglnvalvalalaileala100105110serhisaspglyglylysglnalaleugluthrvalglnargleuleu115120125provalleucysglnalahisglyleuthrprogluglnvalvalala130135140ilealaserhisaspglyglylysglnalaleugluthrvalglnarg145150155160leuleuprovalleucysglnalahisglyleuthrprogluglnval165170175valalailealaserhisaspglyglylysglnalaleugluthrval180185190glnargleuleuprovalleucysglnalahisglyleuthrproglu195200205glnvalvalalailealaserasnileglyglylysglnalaleuglu210215220thrvalglnalaleuleuprovalleucysglnalahisglyleuthr225230235240progluglnvalvalalailealaserhisaspglyglylysglnala245250255leugluthrvalglnargleuleuprovalleucysglnalahisgly260265270leuthrprogluglnvalvalalailealaserasnileglyglylys275280285glnalaleugluthrvalglnalaleuleuprovalleucysglnala290295300hisglyleuthrproglnglnvalvalalailealaserasnasngly305310315320glylysglnalaleugluthrvalglnargleuleuprovalleucys325330335glnalahisglyleuthrprogluglnvalvalalailealaserasn340345350ileglyglylysglnalaleugluthrvalglnalaleuleuproval355360365leucysglnalahisglyleuthrproglnglnvalvalalaileala370375380serasnglyglyglylysglnalaleugluthrvalglnargleuleu385390395400provalleucysglnalahisglyleuthrprogluglnvalvalala405410415ilealaserasnileglyglylysglnalaleugluthrvalglnala420425430leuleuprovalleucysglnalahisglyleuthrproglnglnval435440445valalailealaserasnglyglyglylysglnalaleugluthrval450455460glnargleuleuprovalleucysglnalahisglyleuthrproglu465470475480glnvalvalalailealaserhisaspglyglylysglnalaleuglu485490495thrvalglnargleuleuprovalleucysglnalahisglyleuthr500505510proglnglnvalvalalailealaserasnglyglyglyargproala515520525leuglu530<210>17<211>530<212>prt<213>人工序列(artificialsequence)<220><223>tal结合结构域trac_t01-r<400>17leuthrprogluglnvalvalalailealaserhisaspglyglylys151015glnalaleugluthrvalglnargleuleuprovalleucysglnala202530hisglyleuthrproglnglnvalvalalailealaserasnglygly354045glylysglnalaleugluthrvalglnargleuleuprovalleucys505560glnalahisglyleuthrprogluglnvalvalalailealaserhis65707580aspglyglylysglnalaleugluthrvalglnargleuleuproval859095leucysglnalahisglyleuthrprogluglnvalvalalaileala100105110serasnileglyglylysglnalaleugluthrvalglnalaleuleu115120125provalleucysglnalahisglyleuthrproglnglnvalvalala130135140ilealaserasnasnglyglylysglnalaleugluthrvalglnarg145150155160leuleuprovalleucysglnalahisglyleuthrprogluglnval165170175valalailealaserhisaspglyglylysglnalaleugluthrval180185190glnargleuleuprovalleucysglnalahisglyleuthrprogln195200205glnvalvalalailealaserasnglyglyglylysglnalaleuglu210215220thrvalglnargleuleuprovalleucysglnalahisglyleuthr225230235240proglnglnvalvalalailealaserasnasnglyglylysglnala245250255leugluthrvalglnargleuleuprovalleucysglnalahisgly260265270leuthrproglnglnvalvalalailealaserasnasnglyglylys275280285glnalaleugluthrvalglnargleuleuprovalleucysglnala290295300hisglyleuthrproglnglnvalvalalailealaserasnglygly305310315320glylysglnalaleugluthrvalglnargleuleuprovalleucys325330335glnalahisglyleuthrprogluglnvalvalalailealaserasn340345350ileglyglylysglnalaleugluthrvalglnalaleuleuproval355360365leucysglnalahisglyleuthrprogluglnvalvalalaileala370375380serhisaspglyglylysglnalaleugluthrvalglnargleuleu385390395400provalleucysglnalahisglyleuthrprogluglnvalvalala405410415ilealaserasnileglyglylysglnalaleugluthrvalglnala420425430leuleuprovalleucysglnalahisglyleuthrprogluglnval435440445valalailealaserhisaspglyglylysglnalaleugluthrval450455460glnargleuleuprovalleucysglnalahisglyleuthrprogln465470475480glnvalvalalailealaserasnasnglyglylysglnalaleuglu485490495thrvalglnargleuleuprovalleucysglnalahisglyleuthr500505510proglnglnvalvalalailealaserasnglyglyglyargproala515520525leuglu530<210>18<211>49<212>dna<213>人工序列(artificialsequence)<220><223>靶标talentrac_t01<400>18ttgtcccacagatatccagaaccctgaccctgccgtgtaccagctgaga49<210>19<211>9<212>prt<213>人工序列(artificialsequence)<220><223>cd20抗原的模拟表位<400>19cysprotyrserasnproserleucys15<210>20<211>1473<212>dna<213>人工序列(artificialsequence)<220><223>car11dis16<400>20atggctctgcccgtcaccgctctgctgctgccactggccctgctgctgcacgcagcaaga60ccacaggtgcagctgcagcagagcggccctggcctggtgaagccaagccagacactgtcc120ctgacctgcgccatcagcggcgattccgtgagctccaactccgccgcctggaattggatc180aggcagtccccttctcggggcctggagtggctgggaaggacatactatcggtctaagtgg240tacaacgattatgccgtgtctgtgaagagcagaatcacaatcaaccctgacacctccaag300aatcagttctctctgcagctgaatagcgtgacaccagaggacaccgccgtgtactattgc360gccagggaggtgaccggcgacctggaggatgcctttgacatctggggccagggcacaatg420gtgaccgtgtctagcggaggaggaggatccggaggaggaggatctggcggcggcggcagc480gatatccagatgacacagtccccatcctctctgagcgcctccgtgggcgacagagtgaca540atcacctgtagggcctcccagaccatctggtcttacctgaactggtatcagcagaggccc600ggcaaggcccctaatctgctgatctacgcagcaagctccctgcagagcggagtgccatcc660agattctctggcaggggctccggcacagacttcaccctgaccatctctagcctgcaggcc720gaggacttcgccacctactattgccagcagtcttatagcatcccccagacatttggccag780ggcaccaagctggagatcaagaccacaaccccagcaccaaggccacctacacctgcacca840accatcgcctctcagcccctgagcctgagacctgaggcatgtaggccagcagcaggagga900gcagtccatacaaggggtctggattttgcatgcgacatctacatctgggcacctctggca960ggaacatgtggcgtgctcctgctcagcctggtcatcaccctgtactgcaagagaggcagg1020aagaagctgctgtatatcttcaagcagcccttcatgcgccccgtgcagacaacccaggag1080gaggatggctgctcctgtaggttcccagaagaggaggagggaggatgtgagctgcgcgtg1140aagttttcccggtctgccgacgcacctgcataccagcagggccagaaccagctgtataac1200gagctgaatctgggccggagagaggagtacgatgtgctggacaagaggcgcggcagagat1260ccagagatgggcggcaagccccggagaaagaaccctcaggagggcctgtacaatgagctg1320cagaaggataagatggccgaggcctattctgagatcggcatgaagggagagaggcgccgg1380ggcaagggacacgacggactgtaccagggactgagcacagccaccaaggatacctatgac1440gccctgcatatgcaggcactgcctccaaggtga1473<210>21<211>59<212>dna<213>人工序列(artificialsequence)<220><223>靶标talen(r)<400>21tgatcctcttgtcccacagatatccagaaccctgaccctgccgtgtaccagctgagaga59<210>22<211>1473<212>dna<213>人工序列(artificialsequence)<220><223>971-v3多核苷酸car序列<400>22atggctctgcccgtcaccgctctgctgctgccactggccctgctgctgcacgcagcaaga60ccacaggtgcagctgcagcagagcggccctggcctggtgaagccaagccagacactgtcc120ctgacctgcgccatcagcggcgattccgtgagctccaactccgccgcctggaattggatc180aggcagtccccttctcggggcctggagtggctgggaaggacatactatcggtctaagtgg240tacaacgattatgccgtgtctgtgaagagcagaatcacaatcaaccctgacacctccaag300aatcagttctctctgcagctgaatagcgtgacaccagaggacaccgccgtgtactattgc360gccagggaggtgaccggcgacctggaggatgcctttgacatctggggccagggcacaatg420gtgaccgtgtctagcggaggaggaggatccggaggaggaggatctggcggcggcggcagc480gatatccagatgacacagtccccatcctctctgagcgcctccgtgggcgacagagtgaca540atcacctgtagggcctcccagaccatctggtcttacctgaactggtatcagcagaggccc600ggcaaggcccctaatctgctgatctacgcagcaagctccctgcagagcggagtgccatcc660agattctctggcaggggctccggcacagacttcaccctgaccatctctagcctgcaggcc720gaggacttcgccacctactattgccagcagtcttatagcatcccccagacatttggccag780ggcaccaagctggagatcaagaccacaaccccagcaccaaggccacctacacctgcacca840accatcgcctctcagcccctgagcctgagacctgaggcatgtaggccagcagcaggagga900gcagtccatacaaggggtctggattttgcatgcgacatctacatctgggcacctctggca960ggaacatgtggcgtgctcctgctcagcctggtcatcaccctgtactgcaagagaggcagg1020aagaagctgctgtatatcttcaagcagcccttcatgcgccccgtgcagacaacccaggag1080gaggatggctgctcctgtaggttcccagaagaggaggagggaggatgtgagctgcgcgtg1140aagttttcccggtctgccgacgcacctgcataccagcagggccagaaccagctgtataac1200gagctgaatctgggccggagagaggagtacgatgtgctggacaagaggcgcggcagagat1260ccagagatgggcggcaagccccggagaaagaaccctcaggagggcctgtacaatgagctg1320cagaaggataagatggccgaggcctattctgagatcggcatgaagggagagaggcgccgg1380ggcaagggacacgacggactgtaccagggactgagcacagccaccaaggatacctatgac1440gccctgcatatgcaggcactgcctccaaggtga1473<210>23<211>489<212>prt<213>人工序列(artificialsequence)<220><223>car远端cd22<400>23metalaleuprovalthralaleuleuleuproleualaleuleuleu151015hisalaalaargprogluvalglnleuvalgluserglyglyglyleu202530vallysproglyglyserleulysleusercysalaalaserglyphe354045alapheseriletyraspmetsertrpvalargglnthrproglulys505560argleuglutrpvalalatyrileserserglyglyglythrtyrtyr65707580proaspthrvallysglyargphethrileserargaspasnalalys859095asnthrleutyrleuglnmetserserleulyssergluaspthrala100105110mettyrtyrcysalaarghisserglytyrglythrhistrpglyval115120125leuphealatyrtrpglyglnglythrleuvalthrvalseralagly130135140glyglyglyserglyglyglyglyserglyglyglyglyseraspile145150155160glnmetthrglnthrthrserserleuseralaserleuglyasparg165170175valthrilesercysargalaserglnaspileserasntyrleuasn180185190trptyrglnglnlysproaspglythrvallysleuleuiletyrtyr195200205thrserileleuhisserglyvalproserargpheserglysergly210215220serglythrasptyrserleuthrileserasnleugluglngluasp225230235240phealathrtyrphecysglnglnglyasnthrleuprotrpthrphe245250255glyglyglythrlysleugluilelysalathrthrthrproalapro260265270argproprothrproalaprothrilealaserglnproleuserleu275280285argproglualacysargproalaalaglyglyalavalhisthrarg290295300glyleuaspphealacysaspiletyriletrpalaproleualagly305310315320thrcysglyvalleuleuleuserleuvalilethrleutyrcyslys325330335argglyarglyslysleuleutyrilephelysglnprophemetarg340345350provalglnthrthrglnglugluaspglycyssercysargphepro355360365glugluglugluglyglycysgluleuargvallyspheserargser370375380alaaspalaproalatyrglnglnglyglnasnglnleutyrasnglu385390395400leuasnleuglyargarggluglutyraspvalleuasplysargarg405410415glyargaspproglumetglyglylysproargarglysasnprogln420425430gluglyleutyrasngluleuglnlysasplysmetalaglualatyr435440445sergluileglymetlysglygluargargargglylysglyhisasp450455460glyleutyrglnglyleuserthralathrlysaspthrtyraspala465470475480leuhismetglnalaleuproproarg485<210>24<211>1470<212>dna<213>人工序列(artificialsequence)<220><223>car远端cd22<400>24atggctctgcccgtcaccgctctgctgctgccactggccctgctgctgcacgcagcaagg60cctgaggtgcagctggtggaatccggaggaggcctggtgaagcctggcggctctctgaag120ctgagctgtgccgcctccggcttcgccttttccatctacgacatgtcttgggtgaggcag180accccagagaagcgcctggagtgggtggcctatatcagctccggcggcggcacctactat240cccgacacagtgaagggccggttcaccatctctagagataacgccaagaatacactgtac300ctgcagatgtctagcctgaagagcgaggataccgccatgtactattgcgcaaggcactcc360ggatacggaacacactggggcgtgctgtttgcctattggggccagggcaccctggtgaca420gtgagcgccggaggaggaggaagcggcggaggaggctccggcggcggcggctctgacatc480cagatgacccagaccacatcctctctgagcgcctccctgggcgacagggtgacaatctct540tgtagagccagccaggatatctccaactacctgaattggtatcagcagaagcctgatggc600accgtgaagctgctgatctactatacatctatcctgcacagcggagtgccatcccggttc660tctggaagcggatccggaaccgactactctctgacaatcagcaacctggagcaggaggat720ttcgccacctatttttgccagcagggcaataccctgccttggacatttggcggcggcaca780aagctggagatcaaggccaccacaacccctgcaccaaggccaccaacaccagcacctacc840atcgcatctcagcctctgagcctgagaccagaggcatgtaggccagcagcaggaggagca900gtgcacacaaggggactggattttgcctgtgatatctacatctgggcacctctggcagga960acatgtggcgtgctcctgctcagcctggtcatcaccctgtactgcaagagaggcaggaag1020aagctgctgtatatcttcaagcagcccttcatgagacccgtgcagacaacccaggaggag1080gacggctgctcctgtaggttcccagaagaggaggagggaggatgtgagctgcgcgtgaag1140ttttcccggtctgccgatgcacctgcataccagcagggacagaatcagctgtataacgag1200ctgaatctgggccggagagaggagtacgacgtgctggataagaggaggggaagggaccca1260gagatgggaggcaagcctcggagaaagaacccacaggagggcctgtacaatgagctgcag1320aaggacaagatggccgaggcctattctgagatcggcatgaagggagagaggcgccggggc1380aagggacacgatggcctgtaccagggcctgtccacagccaccaaggacacctatgatgcc1440ctgcatatgcaggcactgcctccaaggtga1470<210>25<211>495<212>prt<213>人工序列(artificialsequence)<220><223>人工序列的描述:合成多肽<220><223>4g7-car版本1<400>25metalaleuprovalthralaleuleuleuproleualaleuleuleu151015hisalaalaargprogluvalglnleuglnglnserglyprogluleu202530ilelysproglyalaservallysmetsercyslysalaserglytyr354045thrphethrsertyrvalmethistrpvallysglnlysproglygln505560glyleuglutrpileglytyrileasnprotyrasnaspglythrlys65707580tyrasnglulysphelysglylysalathrleuthrserasplysser859095serserthralatyrmetgluleuserserleuthrsergluaspser100105110alavaltyrtyrcysalaargglythrtyrtyrtyrglyserargval115120125pheasptyrtrpglyglnglythrthrleuthrvalserserglygly130135140glyglyserglyglyglyglyserglyglyglyglyseraspileval145150155160metthrglnalaalaproserileprovalthrproglygluserval165170175serilesercysargserserlysserleuleuasnserasnglyasn180185190thrtyrleutyrtrppheleuglnargproglyglnserproglnleu195200205leuiletyrargmetserasnleualaserglyvalproaspargphe210215220serglyserglyserglythralaphethrleuargileserargval225230235240glualagluaspvalglyvaltyrtyrcysmetglnhisleuglutyr245250255prophethrpheglyalaglythrlysleugluleulysargalaasp260265270thrthrthrproalaproargproprothrproalaprothrileala275280285serglnproleuserleuargproglualacysargproalaalagly290295300glyalavalhisthrargglyleuaspphealacysaspiletyrile305310315320trpalaproleualaglythrcysglyvalleuleuleuserleuval325330335ilethrleutyrcyslysargglyarglyslysleuleutyrilephe340345350lysglnprophemetargprovalglnthrthrglnglugluaspgly355360365cyssercysargpheproglugluglugluglyglycysgluleuarg370375380vallyspheserargseralaaspalaproalatyrglnglnglygln385390395400asnglnleutyrasngluleuasnleuglyargarggluglutyrasp405410415valleuasplysargargglyargaspproglumetglyglylyspro420425430argarglysasnproglngluglyleutyrasngluleuglnlysasp435440445lysmetalaglualatyrsergluileglymetlysglygluargarg450455460argglylysglyhisaspglyleutyrglnglyleuserthralathr465470475480lysaspthrtyraspalaleuhismetglnalaleuproproarg485490495<210>26<211>495<212>prt<213>人工序列(artificialsequence)<220><223>人工序列的描述:合成多肽<220><223>4g7-car版本2<400>26metgluthraspthrleuleuleutrpvalleuleuleutrpvalpro151015glyserthrglygluvalglnleuglnglnserglyprogluleuile202530lysproglyalaservallysmetsercyslysalaserglytyrthr354045phethrsertyrvalmethistrpvallysglnlysproglyglngly505560leuglutrpileglytyrileasnprotyrasnaspglythrlystyr65707580asnglulysphelysglylysalathrleuthrserasplysserser859095serthralatyrmetgluleuserserleuthrsergluaspserala100105110valtyrtyrcysalaargglythrtyrtyrtyrglyserargvalphe115120125asptyrtrpglyglnglythrthrleuthrvalserserglyglygly130135140glyserglyglyglyglyserglyglyglyglyseraspilevalmet145150155160thrglnalaalaproserileprovalthrproglygluservalser165170175ilesercysargserserlysserleuleuasnserasnglyasnthr180185190tyrleutyrtrppheleuglnargproglyglnserproglnleuleu195200205iletyrargmetserasnleualaserglyvalproaspargpheser210215220glyserglyserglythralaphethrleuargileserargvalglu225230235240alagluaspvalglyvaltyrtyrcysmetglnhisleuglutyrpro245250255phethrpheglyalaglythrlysleugluleulysargserasppro260265270thrthrthrproalaproargproprothrproalaprothrileala275280285serglnproleuserleuargproglualacysargproalaalagly290295300glyalavalhisthrargglyleuaspphealacysaspiletyrile305310315320trpalaproleualaglythrcysglyvalleuleuleuserleuval325330335ilethrleutyrcyslysargglyarglyslysleuleutyrilephe340345350lysglnprophemetargprovalglnthrthrglnglugluaspgly355360365cyssercysargpheproglugluglugluglyglycysgluleuarg370375380vallyspheserargseralaaspalaproalatyrglnglnglygln385390395400asnglnleutyrasngluleuasnleuglyargarggluglutyrasp405410415valleuasplysargargglyargaspproglumetglyglylyspro420425430argarglysasnproglngluglyleutyrasngluleuglnlysasp435440445lysmetalaglualatyrsergluileglymetlysglygluargarg450455460argglylysglyhisaspglyleutyrglnglyleuserthralathr465470475480lysaspthrtyraspalaleuhismetglnalaleuproproarg485490495当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1