口服生物利用度高的聚乙二醇化干扰素λ及其制备方法与流程
本发明涉及医药学,即传染病和药理学,以及制药工业和生物技术,旨在生产聚乙二醇化干扰素λ,因为它具有抗肝炎病毒的抗病毒活性和较高的口服生物利用度,因此可用于治疗病毒性肝炎,可确保药物在肝脏中的高浓度,从而避免全身循环,减少全身副作用并提高对治疗的依从性。
背景技术:
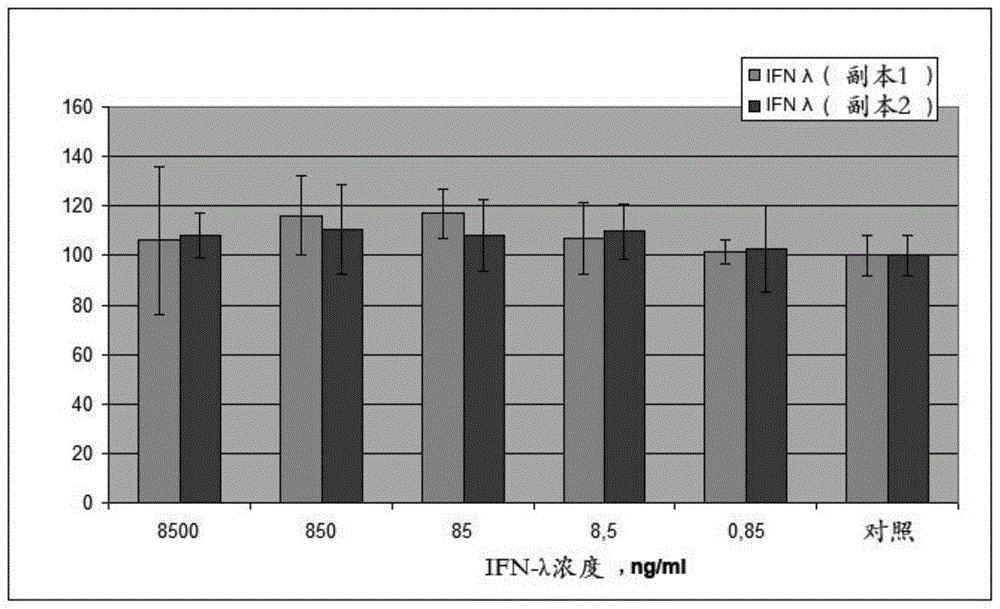
:干扰素λ(ifn-λ)构成第三类干扰素家族,它包括四个成员:ifn-λ1,ifn-λ2,ifn-λ3和ifn-λ4,也分别称为il-29,il-28a,il-28b和ifn-λ4[1,2,3]。这些ifn-λ属于细胞激素家族,其功能类似于第一类干扰素家族(ifn-α和/或ifn-β),但与后者明显不同:首先,这些ifn-λ主要作用于持续暴露于人体和病原微生物的上皮细胞;其次,由于更具针对性的信号转导,这些ifn-λ具有显著的治疗益处,从而消除了许多限制ifn-α和ifn-β临床应用的副作用。此外,这些ifn-λ对免疫系统的先天性和适应性分支具有免疫调节作用,与ifn-α和ifn-β的免疫调节作用部分重合[4,5,6,7]。2006年首次检测到ifn-λ在体内对第二型单纯疱疹病毒的抗病毒活性[8]。在动物模型中的进一步研究表明,外源ifn-λ的抗病毒活性可媲美于干扰素-α和干扰素-β的作用对抗如下病毒,呼吸道合胞体病毒、轮状病毒、口蹄疫病毒、鼠诺如病毒、西尼罗河热病毒、1型单纯疱疹病毒、流感病毒、人偏肺病毒、冠状病毒、牛痘病毒、乙型肝炎病毒、鼠类肺炎病毒[1,9,10,11,12,13,14,15,16]。还发现,在活体内ifn-λ的抗病毒活性对于抵抗感染呼吸道、胃肠道和泌尿生殖道以及肝脏的上皮细胞的病毒更为明显[13]。这引起了对ifn-λ作为病毒性肝炎潜在治疗剂的兴趣[17,18]。病毒性肝炎在国际范围内严重威胁着公共卫生,并给世界所有地区的人民带来沉重负担。2016年,世界卫生组织通过了《2016-2021年全球病毒性肝炎卫生部门战略》,其中指出病毒性肝炎夺走了许多人的生命,并对当地社区和卫生系统造成了重大伤害。它每年造成约140万人死于急性感染,还包括与肝炎有关的癌症和肝硬化,这与艾滋病毒(hiv)和结核病的死亡率相当。其中,约47%的死亡是由乙型肝炎病毒引起的,48%是由丙型肝炎病毒引起的,其余的是由甲型肝炎和戊型肝炎病毒引起的。病毒性肝炎正日益成为hiv携带者死亡的原因。大约有290万人感染hiv并混合感染了丙型肝炎病毒,有260万人混合感染了乙型肝炎病毒。在全球范围内,约有2.4亿人长期感染乙型肝炎病毒,有1.3-1.5亿人患有丙型肝炎病毒。考虑到它们对公共卫生的高度重要性,该策略旨在与所有五种肝炎病毒(甲,乙,丙,丁和戊)以及首先是乙和丙肝炎病毒对抗。关于慢性乙型和丙型病毒性肝炎的治疗,世界卫生组织(who)总部支持采取向更简单、更安全的口服治疗方案过渡的公共卫生方法[19]。尽管更新的“世界卫生组织慢性丙型肝炎感染者筛查、护理和治疗指南”中的新指南建议使用直接作用的抗病毒方案,但仍然建议将索非布韦/聚乙二醇化干扰素与利巴韦林的组合使用作为特殊人群的替代治疗选择[20]。聚乙二醇化干扰素可在七天内提供稳定水平的血清干扰素。聚乙二醇化干扰素-α2b(美国schering-plow公司的)[21]、聚乙二醇化干扰素-α2a(瑞士罗氏的)[22]和ce-聚乙二醇化干扰素-α2b(俄罗斯biocad公司的)[23]是已知的。这些药物的主要缺点是:-每周皮下注射,治疗持续时间为12周或更长时间,大大降低了对治疗的依从性;-以流感类综合症、关节痛、情绪低落、腹泻、情绪低落、幻觉、皮疹、过敏、血系统疾病、脱发等形式出现的常见治疗的副作用,这也降低了对治疗的依从性[24,25];-在30%的患者中中和药物的抗病毒活性的抗体的形成,伴随着对重组干扰素的耐药性的发展[26]。因此,迫切需要针对包括丙型肝炎在内的病毒性肝炎的新的治疗和预防药物,这些药物将具有高效率和最小的副作用。该疾病高效治疗的一种选择是使用基于干扰素λ的药物,因为这些ifn-λ的表达模式更为有限,并且主要在肝细胞中表达。这些ifn-λ在肝脏中具有与ifn-α相当的抗病毒活性,但副作用较少,这为ifn-λ在治疗肝病毒感染或包括病毒性肝炎在内包括丙型肝炎和乙型病毒性肝炎的肝脏疾病的治疗中创造了背景[27]。在技术本质上最接近所要求保护的药物的是聚乙二醇化干扰素λ基药物,用于治疗和预防丙型肝炎,其在专利[28]中有所描述。迄今为止,它是世界上用于临床研究的唯一基于聚乙二醇化干扰素λ的药物,并已知被“百时美施贵宝”公司作为bms-914143药物。该药物的主要缺点是需要每周肠胃外给药,当建议的疗程为12周或更长时间时,会在给药部位引起疼痛、发红、浮肿、渗血甚至坏死,这无法满足治疗的要求。此外,全身用药还伴有常见并发症:发烧、过敏和过敏性反应。与要求保护的制备方法最接近的是专利[29]中所述的方法,该方法包括,将生物活性物质,例如干扰素,溶解在水溶性药理学上可接受的聚合物的溶液中,该溶液的浓度为大于10%到饱和溶液浓度,并且用电离辐射辐照反应混合物。该方法的缺点是在电离辐射的作用下,生物活性物质与聚合物之间不可控制地形成共价键,这可以通过阻断活性中心以及蛋白质分子结构的不可逆变化来降低干扰素的比活度。所述发明这组所达到的技术效果是扩大了可用于治疗由肝炎病毒引起的传染病的药物的范围,该药物可与肠胃外药物以外的其他给药途径一起使用,并提高对肝硬化患者的依从性,也提供了该药物的制备方法。技术实现要素:所宣称的技术效果由下述药物实现,该药物代表具有针对肝炎病毒的抗病毒活性的聚乙二醇化干扰素λ(以下称为peg-ifn-λ),其中所述药物的口服生物利用度至少为10%,并且所述药物通过以1-5mrad剂量的电离辐射照射分子量为约400至约5,000da的聚乙二醇溶液而获得,将所得溶液与干扰素λ溶液混合,将所得的混合物冷冻并冷却至-10℃或更低的温度,用电离辐射以0.1-0.5mrad的剂量照射冷冻的和冷却的混合物。peg-ifn-λ的抗病毒活性由于在“hcv(hcvcc)克隆jfh1/人肝癌细胞huh7.5”系统中进行了实验研究,因此揭示了该药物的抗病毒特性。迄今为止,该系统是最合适的,并已在美国fda和欧洲共同体采用,用于在临床前阶段对药物的抗hcv活性进行特定评估。peg-ifn-λ的抗病毒活性的评估使用了从1999年在日本暴发性肝炎患者血清中分离出的hcv菌株培养进行的。基于该菌株,获得了全长hcv复制子并将其克隆到质粒中,该复制子证明了人类肝癌细胞huh-7转染后基因组rna的复制率异常高,并且在培养基中产生了感染性病毒体[30,31]。所得的hcvcc感染性培养病毒被命名为克隆jfh1(基因型2a)。接下来,获得了huh-7细胞衍生物,命名为huh-7.5,具有较高的感染潜力,并能够持续感染jfh-1克隆hcv[32]。huh-7.5细胞的高介电常数归因于其中rig-1基因的突变。该基因的产物被病毒dsrna激活,并参与了细胞的干扰素介导抗病毒保护的诱导[33]。抗病毒活性的评价通过聚合酶链反应(以下称为pcr)的方法实时进行,并通过免疫组织化学进行。为了检测hcv,使用了抗核心病毒蛋白(fda,美国)的6g7小鼠单克隆抗体。peg-ifn-λ的测试浓度范围为0.0085-8500ng/ml培养基。实验方案包括三个连续的阶段:1)细胞huh7.5peg-ifn-λ单层的预孵化;2)在没有peg-ifn-λ的情况下用jfh1病毒感染huh7.5细胞;3)对应于预孵化剂量使用peg-ifn-λ间隔为10倍的稀释液孵化。研究表明,peg-ifn-λ的50%抑制剂量在0.0085-0.085ng/ml的浓度范围内,而在0.085ng/ml的浓度时,peg-ifn-λ对hcv在人肝癌细胞中繁殖的抑制作用已接近80%。(表1)。表1根据实时pcr结果,peg-ifn-λ对丙型肝炎病毒繁殖的抑制水平同时,对peg-ifn-λ对人肝癌细胞huh7.5的细胞毒活性的分析表明,即使是peg-ifn-λ剂量为8,500ng/ml,比有效抗病毒剂量高一百万倍,对huh7.5细胞没有任何细胞毒性作用(图1)。用于研究的细胞毒性测量方法基于线粒体脱氢酶转化水溶性的能力,2,3-双-(2-甲氧基-4-硝基-5-磺基苯基)-2h-四唑-5-羧苯胺(xtt试剂,美国sigma-aldrich公司)到甲臜,其中,后者在细胞内结晶。使用吩嗪硫酸盐(pms)溶解甲臜和随后的光度法可以使溶液光密度变化与活细胞数量变化准确相关。peg-ifn-λ的生物利用度peg-ifn-λ的生物利用度研究是根据“进行药物的临床前研究指南”[34]在12-14周龄时体重至少为180g的远系实验大鼠进行的。根据sop“实验室动物的护理和使用”和适用的国际标准对动物进行护理和操作。一次以2.6μg/kg的剂量将peg-ifn-λ以ifn-λ的形式在胃内或静脉注射给动物。在通过静脉内或胃内给药后0-24小时内测定血清ifn-λ浓度;然后在胃内给药后的相同时间内,并测定大鼠心脏、网膜、肝、肾、横纹肌和脑组织中的ifn-λ浓度。使用酶免疫法(elisa)定量测定生物对象(血清、动物的器官和组织)中的ifn-λ。实验表明,静脉内给药后血清中ifn-λ的浓度在给药后2分钟内达到最大值,达到30947.83±1968.67pg/ml。胃内给药后,血清中ifn-λ的浓度在给药后4小时达到最大值,达到1167.61±115.76pg/ml。胃内给药后大鼠组织中ifn-λ的最大浓度为:肝脏(给药后2小时)为1239.04±125.11pg/g,肾脏(给药后4小时内)为975.29±109.23pg/g,在心脏(给药后2小时)为488.11±81.53pg/g,在横纹肌中(给药后8小时)为392.92±37.78pg/g。在脑和网膜中,ifn-λ的浓度低于测定所用方法的阈值(2pg/mg)。使用模型外的统计矩方法[35]和梯形方法[36,37]计算药代动力学参数表明,在胃内给药时,观察到在大鼠肝脏中ifn-λ的最大半衰期、最大浓度和最小消除度分别为10.11h、1.24ng/g和0.07h-1(表2)。表2以2.6μg/kg的剂量(以ifn-λ表示)对大鼠单次静脉注射和胃内给药后,peg-ifn-λ在大鼠的血清,器官和组织中的药代动力学参数peg-ifn-λ的绝对生物利用度(f)由下式计算:其中,auce/v是血管外给药后药代动力学曲线下的面积;auci/v是静脉内给药后药代动力学曲线下的面积;di/v是静脉内给药的剂量水平;de/v是血管外给药的剂量水平。静脉内和胃内给药给予大鼠的peg-ifn-λ剂量相同,静脉内给药的药代动力学曲线下面积为37.96ng×h/ml,血管外给药途径的药代动力学曲线下面积为7.96ng×h/ml;因此,口服peg-ifn-λ的绝对生物利用度为20.97%。peg-ifn-λ的组织生物利用度通过下式计算:ft=auct/aucp,其中,auct是该物质在组织中的药代动力学曲线下的面积;aucp是血清药代动力学曲线下的面积。由于在胃内给药后会发生治疗剂直接吸收到门静脉的事实,因此在肝脏中观察到最大的组织生物利用度为0.31;肾脏的组织生物利用度为0.20;在横纹肌中为0.13;在心脏为0.10。同时,peg-ifn-λ实际上不渗透到脑中并且不积聚在脂肪组织中。建议的药物与原型之间的区别以及技术效果如下:-要求保护的药物对肝炎病毒具有抗病毒活性。关于抑制人肝癌细胞中hcv繁殖的研究表明,peg-ifn-λ的浓度范围为0.0085-0.085ng/ml时为50%抑制率,而浓度为0.085ng/ml的peg-ifn-λ导致hcv繁殖抑率接近80%;-所要求保护的药物不具有细胞毒性的活性:即使是peg-ifn-λ8500ng/ml的剂量,也就是有效抗病毒剂量的一百万倍,对人肝癌细胞培养物huh7也没有细胞毒性作用。-当口服施用时,所要求保护的药物的绝对生物利用度为至少10%:以2.6μg/kg的剂量向大鼠单次胃内施用后,以ifn-λ表示的peg-ifn-λ的绝对生物利用度为20.97%。这使得使用peg-ifn-λ药物的口服给药途径成为可能,从而消除了肠胃外给药途径常见的副作用,并提高了患者对治疗的依从性。-在以2.6μg/kg的剂量向大鼠单次胃内给药后,表示为ifn-λ的peg-ifn-λ的最大组织生物利用度、ifn-λ的最大浓度和ifn-λ的最大半衰期在肝脏中观察到的量分别为0.31、1239.04±125.11pg/g和10.11h。这是由于peg-ifn-λ直接吸收到门静脉中,并证实了所要求保护的药物对肝脏的“靶向”作用,从而减少了肠胃外给药途径常见的全身性副作用。-与通过ifn-λ的化学聚乙二醇化获得的原型不同,要求保护的药物是用电离辐射照射初始组分时,通过ifn-λ的聚乙二醇化而获得,这大大简化了生产工艺方案,从而降低了最终产品的成本,因为它消除了中间技术阶段进行多阶段有机合成并大量损失目标蛋白物质,以及随后从未进入反应的组分和过度改性的反应产物中纯化所需的活性分子。在制备具有对肝炎病毒的抗病毒活性和至少10%的口服生物利用度的聚乙二醇化干扰素λ的方法中,也获得了所要求保护的技术结果,该方法包括制备分子量为约400至约5,000da的聚乙二醇和干扰素λ的溶液,将制备的溶液冷冻和冷却至-10℃或更低的温度,随后用0.1-0.5mrad的剂量的电离辐射辐照冷冻的和冷却的溶液,其中聚乙二醇和干扰素λ溶液的制备通过将干扰素λ的溶液和聚乙二醇的溶液混合来进行,并且在混合之前,以1-5mrad的剂量用电离辐射照射聚乙二醇的溶液。作为分子量为约400至约5,000da的聚乙二醇,使用通过任何已知方法获得的聚乙二醇,例如由俄罗斯的ooo“zavodsyntanolov”生产的聚乙二醇。提供纯净水或盐水溶液以保持溶液的ph值维持在随后保存蛋白质所需的限定范围内,最好是6.0-7.9,作为制备聚乙二醇溶液的溶剂,例如磷酸盐-盐水缓冲液(nah2po4为10mmol/l,nacl为150mmol/l,ph=7.4),并且所得溶液中peg的浓度为0.20-0.50g/ml。peg溶液以液体层的厚度不超过5-8mm的方式转移到聚乙烯袋或管中,并密封。作为容器,可以使用可透过电离辐射并同时抵抗其影响的任何其他包装。剂量为1-5mrad的加速电子束用于电离辐射。在初步实验中确定peg的分子量和电离辐射的剂量,该实验是用0.25-10mrad的剂量电离辐射处理分子量为约400至约20,000da的peg水溶液,用蒸发光散射检测器和色谱-质谱联用的凝胶渗透高效液相色谱法进一步分析辐照后的peg样品。目前,已知用高剂量的电离辐射辐照peg水溶液会导致分子间交联和水凝胶的形成,而不管其分子量如何。特别地,对于分子量为1,500da的4%peg水溶液,当辐射的吸收剂量达到12-14mrad时,检测到形成水凝胶的能力。同时,当在低剂量和低浓度的聚合物下在水溶液中辐照时,低分子量peg具有分子内交联的能力,从而导致了聚合物线圈的合成,即所谓的纳米凝胶[38]。在实验过程中,发现在暴露于电离辐射中时peg分子会发生结构变化,取决于其分子量和辐射剂量,表现出交联度不同的特征。当分子量为10,000da及更高的peg溶液被辐照时,即使最小吸收剂量为0.25mrad,也会观察到peg分子的显著聚集,和超大质量106-107da的超分子结构形成。当以1-5mrad的剂量辐照分子量为约400至约5,000da的peg溶液时,观察到分子内相互作用特征不会导致明显的预胶凝和超分子缔合物的形成,这决定了这类聚合物的选择,因为在这些条件下,peg降低了在低能量花费下分子内交联的显著能力,同时形成了聚合物基质,其以后需要掺入蛋白质。通过任何已知方法获得的天然或重组干扰素λ被用作ifn-λ。为了制备ifn-λ溶液,使用纯净水或盐水缓冲液被用作溶剂,将溶液的ph值保持在蛋白质保存所需的限定范围内,优选6.0-7.9,例如磷酸盐-盐缓冲液(nah2po410mmol/l,nacl150mmol/l,ph=7.4)。所得溶液中干扰素λ的浓度为0.25mg/ml或更高,优选0.9mg/ml,但应足以使与peg溶液混合时,最终混合物中ifn-λ的浓度为0.2-0.8mg/ml。也可以使用制造商生产的ifn-λ溶液,例如俄罗斯zao《scphb》生产的干扰素λ1溶液。接下来,制备经辐照的peg溶液和ifn-λ溶液的混合物。为了提供均匀的混合,有必要使用溶液形式的ifn-λ,因为当溶解时,干燥的ifn-λ需要充分混合,从而改变peg溶液的粘度和结构。为了制备ifn-λ和peg溶液的混合物,选择ifn-λ溶液和预辐照的peg溶液的量,使得在混合溶液之后,所得混合物中ifn-λ的浓度范围为0.2-0.8mg/ml,聚乙二醇的浓度范围为8-12mg/ml,而水或盐水溶液可将溶液的ph值维持在蛋白质保存所需的限定范围内,最好为6.0-7.9,作为溶剂。通过实验确定最佳的ifn-λ和peg浓度,以实现蛋白质的最高保存和稳定性,并维持相对于蛋白质物质含量的重量而言所需的过量聚合物,因为在辐射辐照期间,过量的peg分子首先面临自由基的主要攻击,从而有助于增强蛋白质分子的保存性。将所得混合物以液体层的厚度不超过5-8mm的方式转移到聚乙烯袋或管中,并密封。可以使用可透过电离辐射并同时抵抗其影响的任何其他包装作为容器。将包装好的混合物冷冻并冷却至-10℃,其中所述混合物在冷冻前进行可以以任何可用方式脱气。之后,以电离辐射线照射冷冻的和冷却的混合物,其中将0.1-0.5mrad剂量的加速电子束用作电离辐射线。为了减少自由基作用的负面影响,在冷冻状态下辐照混合物是必要的:通过辐照混合物,可以达到根据反相高效液相色谱和sds聚丙烯酰胺凝胶电泳,ifn-λ的存留达到69%,而在不冷冻的情况下辐照相同混合物,即使最小剂量为0.25mrad,所使用的方法也仅显示出ifn-λ的残留量。在封装和冷冻之前对溶液混合物进行脱气还可以使ifn-λ的存留提高到73-76%。这可以通过以下事实解释:在聚合物溶液中,在电离辐射的作用下自由基的形成过程是在溶解的空气氧的参与下进行的,而脱气则降低了溶液中的氧含量。脱气混合物和未处理混合物中蛋白质与聚合物-蛋白质轭合物的结合程度值略有不同(分别为n=1.14和n=1.22),这意味着化学结合到干扰素λ上的peg的比例约为其总量的0.4%。研究样品中的大部分peg与蛋白质分子发生非共价可逆相互作用,并形成超分子复合物。辐照后,将目标产品冷冻保存或除霜,并在必要时使用灭菌过滤进行进一步纯化,然后,为了便于存储,将其无菌分配到无菌包装中,例如玻璃小瓶。所要求保护的方法与原型和技术结果之间的区别在于所要求保护的方法:-使用分子量为约400至约5,000da的聚乙二醇溶液,将其在与干扰素λ溶液混合之前进行电离辐射照射。当这种情况发生时,聚乙二醇分子内部会出现结构变化,这种变化与分子量的增加无关,而是导致蛋白质掺入所必需的聚合物基质的形成。-通过将干扰素λ溶液和聚乙二醇溶液混合来制备聚乙二醇和干扰素λ的溶液。这样可以避免溶解干的干扰素λ与所需的peg溶液的强烈混合,并且同时保留了干扰素λ的有效聚乙二醇化所需的peg溶液的粘度和结构。-干扰素λ的特性以其口服生物利用度至少为10%的方式被改进。同时,干扰素λ和聚乙二醇之间不形成共价键,这实际上可以避免干扰素λ的性质不受控制的变化,并且可以使用任何可用的干扰素作为干扰素λ。具体实施方式通过以下具体实施方式的实施例说明本发明。实施例1.peg-ifn-λ的制备将15.00ml的纯净水添加到20.00g的peg-1500中(由ooo“zavodsynthanolov”制造,俄罗斯)。将混合物在磁力搅拌器上搅拌直至聚乙二醇完全溶解,然后将混合物的体积调节至50.00ml。将peg-1500浓度为0.40g/ml的所得溶液以液层厚度不超过5-8mm的方式转移到聚乙烯袋中,并密封。将封装好的peg-1500溶液在电子加速器илу-10(эу-75)中以2.0mrad剂量进行电离辐射。将80.00ml干扰素λ1浓度为0.86mg/ml的干扰素λ1溶液(zao“scphb”,俄罗斯)与3.45mlpeg-1500的辐照后溶液混合,用磷酸盐盐水缓冲液(nah2po410mmol/l,nacl150mmol/l,ph=7.4)调节所得混合物的体积至138.00ml,并充分混合。接下来,使用真空泵和平底烧瓶对所得溶液进行脱气。在30-40分钟内将空气从烧瓶中抽空至10-50mmhg的压力。然后将脱气后的溶液置于聚乙烯袋中,使水平位置的液层厚度不超过5-8毫米,将袋密封并在冰箱中冷冻至-20℃达12小时,然后在电子加速器илу-10(эу-75)中以0.25mrad的剂量进行电离辐射。辐照后,将装有peg-ifn-λ1的包装融化,使用“stericup”真空灭菌系统(merckmillipore)进行灭菌过滤,然后分配到无菌玻璃瓶中并密封。实施例2.peg-ifn-λ的细胞毒性活性的研究在实施例1中获得的peg-ifn-λ1的细胞毒性活性是通过在人肝癌细胞培养物中huh7.5测定的,peg-ifn-λ1的浓度范围为0.85-8500ng/ml(以ifn-λ1表示)。通过微量方法在96孔板(“greiner”)上用2,3-双-(2-甲氧基-4-硝基-5磺基苯基)-2h-四唑-5-羧苯胺(xtt试剂,美国sigma-aldrich公司)。该方法基于线粒体脱氢酶的能力将水溶性xtt转化为甲臜,甲臜在细胞内结晶。使用吩嗪硫酸盐(pms)溶解甲臜和随后的光度法可以使溶液的光密度变化与活细胞数量变化准确相关。评估了用不同浓度下重复两次的细胞蛋白处理过的huh7.5的特定细胞死亡相对于未处理(对照,100%存活)。结果如图1所示。实施例3.peg-ifn-λ的抗病毒活性的研究使用jfh1克隆/huh-7.5细胞的模型对实施例1中获得的peg-ifn-λ1的抗病毒活性的评估,该模型是目前公认的用于评估包括干扰素在内的药物的病毒活性的系统。使用transcriptaidtm试剂盒将pjfh1puc质粒的线性化dna用作hcv全长感染性rna转录的模板,以t7rna聚合酶(fermentas,拉脱维亚)进行高效转录。通过使用mirusbiomir2250rna转染试剂盒(mirus,美国)将合成的rna转染到人肝癌细胞huh7.5中,从而获得了丙型肝炎病毒(jfh1)。根据实时pcr(“амплисенсhcv-монитор-fl”测试系统,ils,莫斯科)的结果,转染细胞经过8代后,病毒对培养基的最大产量达1.37×106拷贝的rna/ml。接下来,将含病毒的培养液在带截止过滤器amiconultra-15离心过滤器单元(100kda)(美国密理博)集中过滤,而另外4个子通路被在huh7.5细胞上执行以传获得jfh1的病毒原种。通过免疫组织化学法测定感染性病灶(以下称为phi),将原种滴定在huh7.5细胞的单层上。为此,将生长在96孔板上的单层huh7.5细胞用jfh1原种的间隔为10倍的稀释液感染,孵化72小时,用1xpbs洗涤,用异丙醇固定,用抗核心6g7蛋白的6g7单克隆抗体和与辣根过氧化物酶偶联的第二抗体处理。用aec色原(3-氨基-9-乙基咔唑,sigma)对被感染细胞的病灶进行染色,然后用过氧化物酶将其氧化形成不溶的红色沉淀。使用“axiovert”40cflzeiss显微镜进行病灶扫描。hcv的滴度约为2×104phi/ml。将所得原种分装成1.5μl等分试样,并保存在-80℃下,直到用于确定peg-ifn-λ1的抗病毒活性为止。为了通过实时pcr评估peg-ifn-λ1的抗病毒活性,将生长在24孔板上的单层huh7.5细胞与0.085–8500ng/ml范围内10倍间隔的peg-ifn-λ1稀释液一起孵化,在培养基中于37℃放置12小时。然后除去含有peg-ifn-λ1的培养基,并用相同剂量的jfh1病毒(来自包装的冷冻原种)每孔4.37×106拷贝rna(细胞对照除外)感染细胞,每剂3孔的peg-ifn-λ1。在没有peg-ifn-λ1的情况下在37℃下进行病毒吸附2小时,然后除去病毒,并将具有相应稀释度的peg-ifn-λ1的培养基再次添加至孔中。将平板在37℃的二氧化碳培养箱中孵化2天,然后按如下方法制备感染细胞和对照细胞的溶菌产物:-用tbs缓冲液(150mmnacl,50mmtris,ph7.6)洗涤细胞单层3次;-用100μl/孔的溶菌缓冲液(150mmnacl,50mmtris,ph7.6,1%tritonx-100)和蛋白酶抑制剂混合物(aebsf、抑肽酶、氨肽酶抑制剂、e-64、edta、亮抑酶肽)(美国sigma),转移至微量离心管中,在冰上放置10分钟,然后冷冻;-将溶菌物冷冻并解冻三遍;-将得到的混合物以14,000rpm的离心速率、4℃的温度离心30分钟;-将上清液分成100μl等分试样,并使用“амплисенсhcv-монитор-fl”测试系统实时进行pcr。pcr结果示于表3。表3根据实时pcr结果,peg-ifn-λ1对丙型肝炎病毒繁殖的抑制水平*-非感染细胞huh7.5的溶菌液,阴性对照(空白);**-被病毒感染但未用ifn-λ1处理的huh7.5细胞的溶菌液,(阳性对照,100%感染)。peg-ifn-λ1的抗病毒作用评估也可以通过免疫组织化学方法,如前所述,在0.0085-8.5000ng/ml的peg-ifn-λ1浓度范围内,对单层huh7.5细胞进行感染病灶计数。分析结果显示在图2中,其中可以看到peg-ifn-λ10.0085ng/ml的剂量抑制病毒繁殖25%,其后10倍0.085ng/ml的剂量已经到达了75%,因此50%抑制的剂量在peg-ifn-λ10,0085-0,085ng/ml的浓度范围内。实施例4.peg-ifn-λ的生物利用度的研究根据“进行药物的临床前研究的指南”对实施例1中获得的peg-ifn-λ1的生物利用度进行研究[34]。作为测试系统,使用在12-14周龄时体重至少为180g的远系实验大鼠。它们是从sriph&rm实验生物学模型部门获得的,该部门以联邦国家预算科学机构“俄罗斯科学院的托木斯克国家研究医学中心”的e.d.goldberg命名(可提供兽医证书);按照sop“实验室动物的护理”和当前有效的国际标准(《动物福利法》,《实验室动物的护理和使用指南》)对动物进行护理和操作。以2.6μg/kg的剂量将表达为ifn-λ1的peg-ifn-λ1胃内地或静脉内地施用于动物。在单次胃内施用peg-ifn-λ1后测定大鼠血清,以及大鼠心脏、大网膜、肝脏、肾脏、横纹肌和脑组织中在给药前和给药后0.25、0.5、1、2、4、8、16和24小时的ifn-λ1的浓度;其中单次静脉内给药后:在给药前和给药后0.03、0.17、0.33、0.5、0.75、1和2小时测定血清中浓度。在每个时间点采用6只动物。初步样品制备如下:血清。杀死动物后从心脏腔中取血。为了从细胞因子的凝块中分离出血清,用玻璃棒将收集的血液沿管壁旋转,在37℃下孵化30分钟,在冰箱中放置1小时,然后以3,000rpm离心10分钟。将分离的血清收集在塑料管中,并在-18至-20℃的温度下冷冻。作为零点(给药之前),使用以类似方式获得的6只完整动物的血清样品。肝、脑、心脏、骨骼(横纹)肌肉、肾脏、网膜和小肠的组织。为了测量器官和组织中的ifn-λ1,将一定重量的组织(约1g)冷冻并融化两次,在研钵中小心研磨,并在蒸馏水中制备20%匀浆。将所得的悬浮液在振荡器上振荡10分钟。之后,将试管以3,000rpm离心10分钟。将上清液转移至干净的试管中并用于分析。作为零点(给药前),使用以类似方式获得的6只完整动物的肝、脑、心脏、骨骼肌、肾脏和网膜组织的样品。使用人类il-29铂酶联免疫测定(elisa)盒(“本德医疗系统有限公司”,奥地利,货号:bms2049),通过酶免疫测定(elisa)方法对生物体(血液、动物的器官和组织)中的ifn-λ1进行定量测定。该人类il-29铂酶联免疫测定盒根据制造商的说明,被设计用于在浓度范围为2-1,000pg/ml的培养的上清液、血清、血浆和其他生物样品中确定人类ifn-λ1的浓度。将结果记录在免疫酶反应分析仪аифр-01“униплан”(zao“pikon”,俄罗斯)上,其中波长为450nm。在表4中给出了在一次胃内施用peg-ifn-λ1后测定大鼠的血清和器官中的ifn-λ1浓度的结果。表4给出了定量测定ifn-λ1浓度的数据。由于浓度低于2pg/ml,并且使用人类il-29铂酶联免疫测定盒进行酶免疫测定(elisa)未能检出,因此没有定量测定大脑和网膜中ifn-λ1的浓度数据。表5显示了单次静脉内施用2.6μg/kg剂量的peg-ifn-λ1后测定大鼠血清中ifn-λ1浓度的结果。基于获得的数据的药代动力学参数的计算是使用模型外统计矩方法[39]和梯形方法[40,41]进行的。计算结果列于表4。表4以2.6μg/kg的剂量(表示为ifn-λ1)单次胃内施用peg-ifn-λ1后,大鼠的血清、器官和组织中ifn-λ1的浓度表5以注射剂量为2.6μg/kg(表示为ifn-λ1)单次静脉注射的peg-ifn-λ1后,大鼠血清中ifn-λ1的浓度时间,小时ifn-λ1在血清的浓度,pg/ml0.000.00±0.000.0330947.83±1968.670.1724314.77±2362.670.3321547.21±1828.170.5018502.97±2143.130.7514786.24±1323.601.0011187.96±1057.212.006495.04±1062.71文献参考1.马丁·e·佩雷斯,m·魏斯,f·迪亚兹·圣·塞贡多,j·m·帕凯科,j·阿茨特,m·j·格鲁伯曼和t·德·洛斯·桑托斯;《iii型干扰素显著延迟并降低牛口蹄疫发生的严重性》[病毒学杂志]2012年第86卷第8期第4477-4487页。2.l·奥尔加·奥尔森,b·马奇莫,w·唐,r·m·法伊弗,h·帕克,h·迪肯希德,d·赫哥特,p·波特·吉尔,a·马弥,i·科勒,陈·s,n·布兰德,m·塔尔瓦,刘·l,f·谢赫,j·阿斯特博世科,h·l·伯恩威斯克,b·r·埃德林,c·d·豪厄尔,t·r·摩根,d·l·托马斯,b·黎曼,r·p唐纳利,t·r·奥布赖恩;《产生新干扰素基因ifnl4的ifnl3(il28b)上游变异体与丙型肝炎病毒清除率受损有关》[自然-遗传学]2013年第45卷第2期第164-171页。3.t·r·奥布赖恩,l·奥尔加·奥尔森,r·p·唐纳利;《ifn-λ4:干扰素lambda家族的矛盾新成员》[干扰素和细胞因子研究杂志]2014年第34卷第11期第829-838页。4.s·s·格里戈良;《干扰素λ(3型干扰素)和病毒感染》干扰素-2011[科学文章集],莫斯科,2012年,512章第63-72页。5.r·k·德宾,s·v·肯高和j·e·德宾;《干扰素在粘膜表面的诱导和功能》[先天免疫杂志]2013年第255卷第25-39页。6.p·埃尔芒和t·米盖尔思;《病毒感染情况下的干扰素-λ:产生,反应和治疗意义》[先天免疫杂志]2014年第6卷第563-574页。7.t·马哈拉科威,p·赫尔南德斯,k·格伦克,a·蒂芬巴赫和p·丝戴海利;《白细胞衍生的ifn-a/b和上皮ifn-1构成了限制肠病毒的分隔性粘膜防御系统感染》[病原学]2015年第11卷,文章no.e1004782。8.n·安卡拉,h·韦斯特,c·巴特霍尔迪,k·埃里克松,a·r·汤姆森,s·r·帕卢丹;《lambda干扰素(fn-lambda)一种iiiifn,由病毒和ifn诱导,在体内对选定的病毒感染表现出强大的抗病毒活性》[病毒学杂志]2006年第80卷第9期第4501-4509页。9.m·莫尔多瓦,e·诺伊格鲍尔,v·迪特,b·耶森,t·里格尔,v·法尔科内,f·索格罗斯,s·埃尔,d·迈尔,g·科赫等;《lambda干扰素使呼吸道和胃肠道上皮细胞抵抗病毒感染》[病毒学杂志]2010年第84卷第5670-5677页。10.j·波特,t·马哈科娃,m·莫尔多瓦,c·u·迪尔,t·米盖尔思,s·斯托金,p·丝戴海利,m·w·霍尔夫;《ifn-λ决定了肠上皮的抗病毒宿主防御》[美国国家科学院院刊]2011年第108卷19期第7944-7949页。11.b·海因策,s·弗雷,m·莫尔多瓦,a·施密特·咖弗拉,s·埃尔,u·j·巴克霍尔兹,p·l·柯林斯,p·丝戴海利,c·d·肯门普;《小鼠肺炎病毒的非结构蛋白ns1和ns2都是体内干扰素i和iii型应答的抑制剂》[病毒学杂志]2011年5月第85卷9期第4071-4084页;doi:10.1128/jvi.01365-10;公布日期:2011年2月9日。12.t·j·尼斯,m·t·鲍德里奇,b·t·麦昆,j·m.·诺曼,h·m·拉泽尔,m·阿莫莫夫,m·s·戴蒙德,h·w·维珍;《干扰素-λ在缺乏适应性免疫的情况下可治愈鼠源性诺如病毒的持续感染》[自然]2015年第347卷第6219期第269-273页。13.h·m.·拉齐尔,b·p·丹尼尔斯,a·k·平托,黄·a·c,s·c·维克,s.·e·柯南道尔,m·加莱,r·s·克莱因和m·s·戴蒙德;《干扰素-1通过加强血脑屏障来限制西尼罗河病毒的神经入侵》[科学·转化医学]2015年第7卷第284页59行。14.a·撒特,s·j·德维托,b·利什蒂,k·l·莫斯曼,a·a·阿什卡尔;《il-15在tlr介导的针对生殖器hsv-2感染的先天抗病毒免疫中的关键作用》[免疫细胞生物学]2011年第89卷第6期第663-669页。15.n·w·巴特利特,k·布蒂吉格,s·v·科滕科,g·l·史密斯;《在痘病毒感染模型中,鼠干扰素λ(iii型干扰素)在体内表现出强大的抗病毒活性》[普通病毒学杂志]2005年第86卷第1589-1596页。16.n·e·宝丽亚凯蒂,楚·e·n,c·r·博伦,s·h·克莱恩斯坦,m·d·罗本科;《lambda和α干扰素通过共同的分子机制抑制乙型肝炎病毒复制,但具有不同的体内活性》[病毒学]2010年第401卷第2期第197-206页。17.r·p·唐奈,h·狄更斯思特和t·r·欧布赖恩;《干扰素λ和慢性丙型肝炎病毒感染的治疗》[免疫学动态]2011年第32卷第443-450页。18.c·n·海耶斯,今村·m,h·艾卡塔和茶山·k;《il28b和hcv的遗传学对感染和治疗的反应》[胃肠道肝细胞文摘]2012年第9卷第406-417页。19.《2016-2021年全球卫生部门关于病毒性肝炎的战略,致力于消除病毒性肝炎》[世界卫生组织]瑞士日内瓦,2016年第56页。20.《世界卫生组织更新指南》中关于慢性丙型肝炎感染者的筛查,护理和治疗的新建议。分析参考。世界卫生组织,瑞士日内瓦,2016年第12页。21.专利us5951974,мпкa61p43/00,a61p35/02,a61k47/34,a61p1/16,c07k1/08,c07k14/56,a61p35/00,a61k38/21,c07k1/113,a61p31/12,a61k47/48,a61k38/00,发布日期:1999年9月14日。22.专利ер0809996,мпкc07k1/10,c07k14/56,a61p35/00,a61p37/02,a61k31/00,a61p31/00,a61p3/12,a61k31/745,c07k14/52,c07k14/555,c07k1/113,a61k47/48,a61k38/21,a61p37/00,c07k17/08,a61p31/04,发布日期:1997年3月12日。23.专利ru2447083,мпкc07k14/56,a61k38/21,a61k47/48,a61p37/00,a61p35/00,a61p31/12,公开日期:2012年10月4日。24.s·b·帕滕;《治疗多发性硬化症患者的干扰素诱发的抑郁症的最佳方法是什么?》[神经科学杂志]2001年第26卷第66页。25.r·j·威尔斯;《干扰素的临床药代动力学》[临床药物动力学]1990年第19卷第5期第390-399页。26.o·普鲁默,u·斯特里坎,f·波尔佐尔;《治疗诱导的干扰素(ifn)-α抗体:体外抗病毒和抗增殖ifn-α活性的差异中和》[干扰素研究]1991年第11卷第265页。27.a·j·缪尔,s·阿罗拉,g·埃弗森,r·弗利斯,j·乔治,r·加里布,s·c·戈登,t·格雷,s·格林布姆,t·哈萨尼等;《emerge研究小组peginterferonlambda-1a用于治疗慢性hcv感染的随机2b期研究》[欧洲肝病学会]2014年第61卷第1238-1246页。28.专利ru2496514,мпкa61k38/21,a61k38/20,a61p31/20,公开日期:2013年10月27日。29.专利2409669,мпкc12n11/08,c12n11/10,a61k38/00,a61k38/43,公开日期2012年5月27日。30.t·卡托,t·戴特,村山·a等;《丙型肝炎病毒的细胞培养和感染系统》[自然实验手册]2006年第1卷第5期第2334-2339页。31.n·卡托,k·莫里,k·亚伯等;《使用新型人肝癌细胞系,可有效复制丙型肝炎病毒》[病毒研究]2009年第146卷第41-50页。32.k·j·布莱,j·a·科布登,c·m·赖斯;《亚基因组和基因组丙型肝炎病毒rna复制的高度允许细胞系》[病毒学方法杂志]2002年第76卷第24期第13001-13014页。33.r·索磷布韦和t·皮奇曼;《高效的丙型肝炎病毒细胞培养系统:宿主细胞产生什么变化》[美国科学院院报]2005年第102卷第28期第9739-9740页。34.《进行药物临床前研究的指南》第一部分。格里夫和k,2013年第944页。35.v·k·皮奥托夫斯基;《药代动力学的统计矩和独立于模型的参数的方法》[药理学和毒理学]1986年第5期第118-125页。36.n·n·卡尔基利先科,v·v·霍龙科,s·a·士古耶娃,v·n·卡尔基利先科;《药代动力学》顿河畔罗斯托夫,2001年第383页。37.i·米罗什尼子;《药代动力学基础知识》“geotar-med”出版社,2002年第188页。38.j·m·罗西克,i·简克,s·卡德鲁博夫斯基,m·科茨基,久川·p,p·斯塔卡,p·乌兰斯基;《用于生物医学应用的水凝胶的辐射形成》[用于生物医学应用的聚合物的辐射合成和改性协调研究项目的最终结果]1996-2000-2002第5-48页。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1