非烧蚀性光子器件及相关方法与流程
相关申请的交叉引用
本申请要求于2017年8月30日提交的题为“non-ablativephotonicdevicesandrelatedmethods(非烧蚀性光子器件及相关方法)”的美国临时专利申请号62/552,299的优选权,其全部内容通过引用结合在本文中。
本公开涉及非烧蚀性光子器件以及将光子治疗传递至病理组织的相关方法。
背景技术:
光能(例如电磁光谱中从约400nm至约14μm的可见光和红外光)可用于治疗人类患者或其他动物体的多种病理组织。在一些情况下,光治疗可以是侵入性的和/或包括可以烧蚀组织的聚焦的脉冲光能(例如具有高峰值辐照度和高峰值能量)。烧蚀治疗可能潜在地伤害病理组织周围的健康组织。在其他情况下,光治疗可以是侵入性的和/或包括高平均辐照度,其可能潜在地使组织(即,病理组织和健康组织)碳化。迫切需要精确地控制光能剂量和组织吸收光能所产生的热能,以实现安全有效的治疗效果。
技术实现要素:
大体上,本公开涉及用于光源(例如激光器)的光子器件(例如光传递组件),该光源用于将非聚焦的、受控的光子治疗传递至哺乳动物的病理组织。这种光子器件有利地设计成非侵入性的,因此可以用于直接进入身体的某些区域,例如皮肤或各种体腔。所述光子器件是非烧蚀性器件,使得所述器件可以传递光能来治疗组织,而不会使组织蒸发、使组织爆炸、烧伤组织、使组织碳化或以其他方式去除或腐蚀组织。该光子器件设计和构造成将可见和红外波长范围内的光能辐射到人类患者或其他动物身上,以通过加热病理组织来破坏该病理组织。光子器件可以产生均匀的辐照轮廓,其特征是强度基本恒定,使得可以充分、均匀且温和地治疗(例如加热)被光能照射的病理组织。这种光子器件包括套管和固定至套管远端的导热元件(例如杆)。导热元件由可以直接暴露于组织和体液、可以将光能从光源传递至组织、并且可以将来自于组织的热能传导至套管的材料制成。导热元件的形状(例如圆柱形)根据热流的热力学是最优的,使得可以将最大的光能传递至病理组织的表面而不烧蚀组织。因此,可以在病理组织的任何给定深度处传递最大的光能,以导致光热坏死来破坏病理组织。
有利地,光子器件还可以将光能传递至病理区域(例如肿瘤或其他病理组织)中的纳米颗粒或其他颗粒,以提供光子治疗。例如,纳米颗粒被设计成优先在病理组织中积累,并且选择性地吸收用于传递至病理组织的光子治疗的波长。纳米颗粒可以选择性被光能加热,并且可以有利地破坏病理组织而不伤害周围的健康组织。在一些实施例中,光子器件可以将光子治疗直接传递至病理组织(例如在没有纳米颗粒的情况下)。
一方面,一种非烧蚀性光子器件包括套管、第一光学元件和第二光学元件,该第一光学元件定位在套管的近端附近,并且构造成产生具有基本均匀的辐照度轮廓的光能,该第二光学元件与套管的远端热接触。第二光学元件构造成将从第一光学元件发出的光能传输至位于第二光学元件远端的病理组织,并且构造成将来自于病理组织的热能传导至套管。
实施例可以包括以下特征中的一个或多个。
在一些实施例中,第一光学元件是光纤。
在某些实施例中,第二光学元件是波导。
在一些实施例中,第二光学元件是圆柱形蓝宝石杆。
在某些实施例中,非烧蚀性光子器件包括产生光能的激光器。
在一些实施例中,非烧蚀性光子器件包括产生光能的发光二极管(led)。
在某些实施例中,基本均匀的辐照度轮廓具有非圆形的横截面形状。
在一些实施例中,基本均匀的辐照度轮廓具有六边形横截面形状或正方形横截面形状。
在某些实施例中,基本均匀的辐照度轮廓被传输至第二光学元件的远端表面。
在一些实施例中,第一光学元件在套管的近端附近终止。
在某些实施例中,非烧蚀性光子器件还包括一个或多个透镜,该透镜在第一光学元件和第二光学元件之间位于套管中,并且构造成将激光束引导远离套管的内表面,以限制套管中的反射损耗。
在一些实施例中,第一光学元件向远端延伸到套管的内腔中。
另一方面,一种光传递组件包括多个非烧蚀性光子器件。
另一方面,一种将光能传递至病理组织的方法包括从套管中的第一光学元件发射光能、从套管中的光能产生基本均匀的辐照度轮廓、将从第一光学元件发出的光能通过与套管的远端热接触的第二光学元件传输至病理组织而不烧蚀病理组织、以及将来自于病理组织的热能通过第二光学元件传导至套管。
实施例可以包括以下特征中的一个或多个。
在一些实施例中,第一光学元件是光纤。
在某些实施例中,第二光学元件是波导。
在一些实施例中,第二光学元件是圆柱形蓝宝石杆。
在某些实施例中,该方法还包括用激光器产生光能。
在一些实施例中,该方法还包括用发光二极管(led)产生光能。
在一些实施例中,基本均匀的辐照度轮廓具有非圆形横截面形状。
在某些实施例中,基本均匀的辐照度轮廓具有六边形横截面形状或正方形横截面形状。
在一些实施例中,该方法还包括将基本均匀的辐照度轮廓传输至第二光学元件的远端表面。
在某些实施例中,该方法还包括通过在第一光学元件和第二光学元件之间位于套管中的一个或多个透镜将光能引导远离套管的内表面,以限制套管中的反射损耗。
在一些实施例中,该方法还包括将光能通过第二光学元件传输至与病理组织结合的纳米颗粒。
在一些实施例中,该方法还包括从布置在第一套管附近的第二套管中的第三光学元件发射光能、从第二套管中的光能产生第二基本均匀的辐照度轮廓、将从第三光学元件发出的光能通过与第二套管的远端热接触的第四光学元件传输至病理组织,以使第一和第二基本均匀的辐照度轮廓在病理组织的表面下方重叠而不烧蚀病理组织、以及将来自于病理组织的热能通过第四光学元件传导至第二套管。
其他方面、特征和优点将从说明书、附图和权利要求中显而易见。
附图说明
本专利或专利申请公开包含至少一个彩色附图。uspto将应要求和所支付的相关费用,提供带有彩色附图的本专利或专利申请公开的副本。
图1是光子器件的纵向剖视图。
图2是图1的光子器件的套管和透射性元件的透视图。
图3是图1的光子器件的端视图,示出了居中的光源。
图4是光子器件的端视图,示出了偏心的光源。
图5是图4的光子器件的透射性元件的远端表面在距该远端表面的不同距离处采集的一组图像。
图6是光子器件的包括容纳在套管中的成像透镜的部分的剖视图。
图7是图6的光子器件的套管的一部分的透视图。
图8是传输通过包括透镜组件的光子器件的光学元件的光束的顺序光线轨迹的局部示意图。
图9是图8的顺序光线轨迹的完整示意图,包括沿着光纤光缆组件的路径。
图10是与图8和9的光线轨迹和光学设计构型相关的图像,举例说明了使用六边形芯光纤的适当设计和充分对准(例如近中心对准),并且在沿着套管的远端区域定位的导热元件的远端表面处传递均匀的辐照度。
图11是沿着套管的远端区域定位的导热元件的远端表面和位于距该远端表面几毫米处的光辐照度轮廓的图像。
图12是图11的光辐照度轮廓的放大图,该图省略了套管。
图13是离开套管的光束的辐照度分布的光束强度轮廓,其对应于图10所示的图像。
图14是示出次优的、不均匀的辐照度的光束强度轮廓,其可能不足以用于光子治疗。
图15是示出次优的、不均匀的辐照度的光束强度轮廓,其可能不足以用于光子治疗。
图16是示出使用本文描述的光子器件的方法的流程图。
图17是多个光子器件的剖视图,该光子器件彼此相邻布置,以在病理组织的表面下方的一定深度处传递重叠光束。
具体实施方式
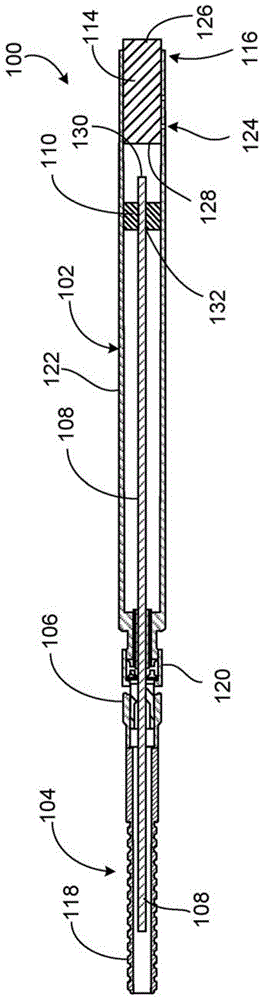
图1示出了示例性光子器件100的剖视图,该光子器件100设计成将光子治疗(例如电磁辐射或光能)传递至人类或另一动物(例如狗或猫)的病理组织。示例性病理组织包括肿瘤(例如黑素瘤)、病变、溃疡、细菌感染的组织(例如耐甲氧西林的金黄色葡萄球菌(mrsa))和其他病理区域。光子器件100是非烧蚀性光传递组件,其构造成根据各种参数,例如光能的波长、皮肤或其他外部组织处的辐照度、皮肤或其他外部组织处的表面温度以及治疗或暴露时间,将光子治疗传递至病理组织附近(例如与之相结合、定位在其上或其中)的粒子(例如纳米颗粒),和将光子治疗直接传递至病理组织。
在所描述的实施例中,光子器件100包括套管102和光纤光缆组件104。光纤光缆组件104包括脊形外部管状壳体118、光纤108和凸形连接器106,该光纤108从管状壳体118伸出,并且向远端延伸到套管102中,该凸形连接器106使管状壳体118的远端与凹形连接器120相接合,该凹形连接器120构成套管102的近端。光子器件100还包括光纤支撑构件110和光学透明的导热元件114(例如用作波导的透射性杆元件),该光纤支撑构件110在套管102中布置在光纤108周围,该导热元件114固定成与套管102的远端区域116热接触。
可以调节光纤108的输出端130(例如远端)与透射性元件114的近端表面128之间的距离。管状壳体118保护光纤108,并且允许光纤108弯曲,以灵活地操作套管102。在一些实施例中,管状壳体118和其中的光纤108具有在约10mm至约100mm的范围内的弯曲半径。管状壳体118和凸形连接器106典型地具有约1m至约5m(例如约3m)的装配长度。管状壳体118典型地具有约1mm至约10mm(例如约3mm)的内径,并且典型地具有小于约10mm的外径。管状壳体118典型地由一种或多种材料制成,包括不锈钢。凸形连接器和凹形连接器120可以是超小型a版(sma)连接器或适合于该应用的其他类型连接器(例如st连接器)。
参考图1和图2,套管102允许从光纤108的输出端130发出的光穿过光学透明的透射性元件114到达用于光子治疗的病理组织的表面。套管102具有围绕光纤108的输出端130的主要部分122(例如在凹形连接器120和远端区域116之间的中央部分)。套管102还沿着远端区域116限定了四个孔124,该孔124为导热粘合剂物质提供了储存部,该导热粘合剂物质可以用于将透射性元件114附装至套管102,如将在下面更详细地讨论的那样。孔124典型地具有约0.5mm至约3.0mm(例如约1.0mm)的直径。套管102典型地由一种或多种材料制成,该材料可以有效地反射和散射光、使光束的反射损耗(例如以及相关的能量损耗)最小化、和散发通过透射性元件114从病理组织的表面传递出的热量。这种示例性材料包括不锈钢和无氧铜。
足以容纳光纤108的套管102的长度还提供了光子器件100的可操纵性(例如提高了使用光子器件100的便利性),增加了套管102的散热表面,最小化或防止了内部反射损耗,并且避免了对特殊涂层的需要,原本需要该特殊涂层来实现将从光纤108发出的光能有效地耦合到病理组织。根据所要治疗的病理组织的面积和/或体积,套管102的主要部分122的选定长度、内径和壁厚可以改变。在光子器件100的所描述的示例实施例中(例如,该光子器件100可以用于光子烧蚀直径小于2-3cm且深度为1-2cm的癌性肿瘤),主要部分122的长度约为120mm、内径约为7mm、壁厚约为2mm。套管102可以采用各种尺寸和比例,只要套管102足够长以容纳透射性元件114的长度、其尺寸实际上确定成可操纵并且其尺寸适当地确定成实现足够的热管理。在一些实施例中,套管102的内表面的特征可以在于控制粗糙化以使透射性元件114的远端表面126处的光强度分布均匀。
透射性元件114由一种或多种材料制成,该材料传递在约400nm至约14μm范围内的光波长(例如包括可见光能和近红外(nir)光能)、足以用作热导体、并且散发过多的热量,以防止发出的光能烧伤病理组织。可以制成透射性元件114的示例性材料包括蓝宝石、金刚石、氟化钙和硫系玻璃。例如,蓝宝石可以有效地传递nir范围内的最大约12μm的光波长。透射性元件114将从光纤108发出的光能传递通过套管102的远端区域116,以将光能传递至病理组织。透射性元件114还根据由透射性元件114和套管102之间的接触产生的热梯度,将在病理组织处产生的热能传递至套管102的较冷的材料。这种热梯度大体上取决于一些参数,包括透射性元件114的结构形式、透射性元件114的材料特性以及透射性元件114相对于套管102的布置。热能被安全地从套管102辐射或传导到其他导热表面(例如光纤108的金属护套)。
在一些实施例中,透射性元件114涂覆(例如钎焊)有金属化物质(例如银、金或无氧铜),以使透射性元件114与套管102之间的热接触最大化。在一些实施例中,透射性元件114未涂覆有这种金属化物质。例如,透射性元件114可以用导热粘合剂物质(例如环氧物质)粘合到套管102的内表面。在一些实施例中,透射性元件114可以在没有粘合剂物质的情况下,通过压配合附装到套管102的内表面,以改善透射性元件114与套管102之间的表面接触,从而改善散热。
透射性元件114是圆柱形结构,其具有小于1的纵横比,以实现从透射性元件114的远端表面126到套管102的最优热传递。例如,透射性元件114典型地具有约45mm至约55mm(例如约50mm)的长度和约5.9mm至约6.1mm(例如约6.0mm)的直径。在一些实施例中,透射性元件114沿着远端表面126具有精细的、均匀的漫射器抛光,并且沿着近端表面128具有40/60的划痕和麻点品质。漫射器抛光可以改善通过透射性元件114的光强度分布的均匀性,从而消除热点,并且使病理组织的表面(即与透射性元件114的远端表面126接触的表面)处的热量沉积和分布更加均匀。划痕和麻点抛光可以消除或显著减小近端表面128中的大凹坑或划痕,它们会影响从光纤108到病理组织的光传播效率以及病理组织表面处的光强度分布,该光强度分布理想地具有完全均匀的强度。在一些实施例中,均匀的漫射器抛光与划痕和麻点抛光可以位于透射性元件114的相对侧。在一些实施例中,透射性元件114可以不包括漫射器抛光与划痕和麻点抛光中的任一个或两个。
在一些实施例中,透射性元件114的远端表面126和近端表面128中的任一个或两个可以涂覆有对适当的光波长的抗反射(ar)涂层,以使从光纤108发出的激光的反射最小化。在一些实施例中,透射性元件114的远端表面126可以涂覆有材料(例如金刚石),该材料既改善了与病理组织的热接触,又改善了从病理区域到透射性元件114的热传递,而使对通过透射性元件114的光能传输的影响最小化或不产生影响。另外,在一些实施例中,透射性元件114延伸超过套管102的远端区域116约1.0mm至约3.0mm(例如约2.0mm),以限制在套管108和病理组织之间。
仍然参考图1和图2,光纤108耦合至光源(未示出),传输从光源发出的光能,并且向透射性元件114发射光能。光纤108典型地由一种或多种材料制成,该材料包括熔融石英和熔融二氧化硅。在一些实施例中,光源是激光器。在这种实施例中,光纤108可以具有0.22的数值孔径(na),并且设计成产生均匀强度光束轮廓。例如,光纤108可以产生具有圆形横截面形状、六边形横截面形状、正方形横截面形状或任何其他适当的均匀强度形状的均匀强度光束轮廓。在光子器件100的操作期间,被治疗的病理组织的温度随着光源被激活的时间而增加,而套管102、管104和凸形连接器106的导热表面散发从病理组织的表面通过透射性元件114传递的热量。因此,病理组织的表面处的温度随着时间基本保持恒定。
光纤108向远端延伸至套管102的主要部分122中,使得所发出的光的光束面积为透射性元件114的远端表面126的面积的约60%至约80%。例如,光纤108的输出端130典型地与透射性元件114的近端表面128间隔约0.1cm至约1.0cm的距离。在光纤108具有0.22的na和8mm的净孔径的示例性实施例中,光纤108的输出端130可以与透射性元件114的近端表面128间隔约3mm。光纤支撑构件110限定了中心纵向开口132,该中心纵向开口132在套管102中支撑光纤108并使其居中。可以使用粘合剂物质(例如环氧物质)将光纤支撑构件110附装至套管102的内表面。可以制成光纤支撑构件110的示例性材料包括聚乳酸(pla)、不锈钢和聚四氟乙烯(ptfe)。光纤支撑构件110可以实现为索环、垫圈、中空的圆柱体或其他类似的结构。
图3和图4分别示出了光子器件100(例如包括粘合到套管102的光纤支撑构件110)和另一光子器件180(例如可见激光器)的端视图,该光子器件180的结构和功能与光子器件100相似,除了光子器件180不包括光纤支撑构件110之外。因此,光子器件180包括光子器件100的其他部件。在图4中可以清楚地看到省略光纤支撑构件110的偏心效果。例如,在没有光纤支撑构件110提供居中的情况下,尽管光纤108有刚度,但是光纤108以偏离轴线(例如偏离中心)的取向(例如远离套管102的轴线高至约3mm)延伸到套管102中。位于透射性元件114的远端表面126处、与远端表面126相距约10mm的第一距离处和与远端表面126相距约20mm的第二距离处的探测器产生图5所示的图像,图5示出了光纤108的输出端130在光子器件180的套管102中的偏离轴线的位置。
结构和/或功能与光子器件100相似的光子器件的其他实施例是可能的。例如,尽管已经将光子器件100描述和图示成具有光纤108向远端延伸到套管102中的构型,但是在一些实施例中,功能与光子器件100相似的光子器件可以包括一种或多种不同的特征或构型,例如将光能中继到蓝宝石杆的远端表面(例如,由此完全消除套管中的内部反射损耗)的成像透镜,或者例如缺失光纤108,整体用位于距蓝宝石杆适当距离处的套管中的光源(例如发光二极管(led))代替。
例如,图6示出了光子器件200(例如非烧蚀性激光器)的包括透镜组件240的部分的内部侧视图,该透镜组件240用于将来自于光纤(未示出)的输出端(例如远端)的光能成像(例如中继)到病理组织的表面(例如位于透射性元件114的远端表面126处),而不在套管202的表面处产生反射损耗。像光子器件100一样,光子器件200设计成向将光子治疗传递至哺乳动物的病理组织。即,光子器件200可以将光子治疗传递至结合到病理组织的颗粒,或者将光子治疗直接传递至病理组织。光子器件200包括光子器件100的套管202和透射性元件114。光子器件200还包括光纤光缆组件(未示出),其包括管状壳体118、光纤108和凸形连接器106,该光纤光缆组件与光子器件100的光纤光缆组件104相似,除了与光纤光缆组件104相比,光纤108不向远端延伸超过凸形连接器106之外。这种构型允许光纤108插入并终止于构成套管202的近端的凹形连接器220中(例如,与在套管202的主要部分222中向远端延伸相反)。图7示出一部分套管202的透视图。套管202在结构和功能上与光子器件100的套管102基本相似,除了套管202包括端口206之外,该端口206有助于透镜组件240与套管202的装配,如将在下面更详细讨论的那样。
再次参考图6,在所述实施例中,透镜组件240包括圆柱形的支撑基部242、近端透镜244、远端透镜246和在套管202中将透镜244、246固定在固定位置处的间隔件248。例如,可以用适当的粘结剂(例如适当的环氧粘合剂)将透镜244、246结合到间隔件248的内表面。圆柱形支撑基部242将从光纤108发出的光能传递至近端透镜244,并且限定光纤108的输出端130和近端透镜244之间的距离。圆柱形支撑基部242可以具有约20mm至约400mm(例如约120mm)的长度,并且可以由一种或多种材料制成,该材料包括不锈钢、无氧铜、铝和其他材料。
光纤108的输出端130(未示出)通过由凸形连接器106(未示出)和凹形连接器220提供的sma连接器设计相对于透镜242固定在适当的位置。在光子器件200的示例性实施例中,透射性元件114不包括端表面126、128的精细的漫射器抛光和40/60划痕和麻点品质来实现均匀的光强度轮廓。相反地,透镜组件240设计成将由光纤耦合的光源产生的均匀光强度轮廓中继到透射性元件114的远端表面126。可以根据需要使用透镜组件240的设计参数(例如透镜焦距、透镜之间的间隔等)来调整光束的形状和/或在病理组织表面处的强度分布,以使光子治疗的有效性最大化(例如,以产生具有显著均匀的强度分布的矩形光束形状)。
透镜244、246沿着套管202的焦距和位置适合于将光纤的远端成像到透射性元件114的远端表面126上。透镜244、246典型地包括抗反射(ar)涂层,以减少反射损耗。间隔件248可以由树脂或者一种或多种其他材料制成。间隔件248可以通过布置在套管202的端口260中的紧固件(例如固定螺钉)相对于套管202固定在适当的位置。
在光子器件200中包括透镜244、246有助于在病理组织的表面处调整光束轮廓的尺寸和形状,从而将均匀的强度分布传递至病理组织。例如,与没有这种透镜的类似器件相比,包括透镜244、246增加了离开光纤并且中继至病理表面的光能的传输效率。透镜244、246还允许发出的激光束穿透病理组织,到达比用常规器件可以治疗的深度(例如高至约6mm)更大的深度(例如比用常规器件可以治疗的深度大高至约2cm),而不烧蚀通过将光纤成像到病理组织上而使光子器件200所指向的病理组织的表面。由于产生了均匀的热分布,因此可以施加更大的功率而不烧蚀病理组织,从而可以将充分的光子能量传递至病理组织的更大深度处。以这种方式,光子器件200可以将光子治疗传递至病理组织,以从下至上破坏病理组织而不烧蚀表面,从而影响病理区域中的热梯度。在一些实现中,可以将约1w至约15w范围内的功率输入到光子器件200。
图8和9分别示出了示例性光学设计和示例性光线轨迹250的局部示意图(例如不包括沿着光纤光缆组件的路径)和完整示意图(例如包括沿着光纤光缆组件的路径)。光线轨迹250示出了传输通过光子器件300的光源,该光子器件300的构造和功能与图5的光子器件200基本相似,除了光子器件300包括产生均匀的六边形光强度分布轮廓的光纤之外。例如,光子器件300包括光子器件200的多个部件(例如套管202、透镜组件240和透射性元件114),其中一些未在图8和图9中示出。光子器件300的光纤具有0.22的na和约600μm的横截面宽度(例如芯直径)。透镜组件240(图8和图9所示的透镜244、246)将光纤的远端处(即位于近端透镜244附近)的强度轮廓分布成像到透射性元件114的远端表面126上。可以在如图9中的位置252、254所示的距透射性元件114多种距离处获取透射性元件114的远端表面126的图像。
图10示出了在关于图8和图9描述的光子器件300的透射性元件114的远端表面126上产生的六边形均匀强度分布的横截面形状的图像262。图11和12示出了在与不同的光子器件的透射性元件114的远端表面126间隔开的平面上产生的光强度分布的图像264、266,其分别产生正方形和圆形的横截面形状。这种光子器件的结构和功能与光子器件300基本相似,除了该器件分别包括具有与图像264、266相关的正方形和圆形的横截面形状的光纤之外。图像262、264、266的偏离中心位置可能是由套管202和间隔件248之间的松弛(例如失去公差)引起。
图13示出了由采用六边形横截面形状的生成光纤和适当设计的成像光学器件(例如透镜244、246)的光子器件300产生的光轮廓268的测量强度分布。与均匀的强度分布268相比,如图14所示,常规光纤(即没有任何光强度均化)或来自于任何光纤的不充分漫射或均化光线产生不均匀的强度轮廓,例如不均匀的强度轮廓270,其沿着激光束的中心达到峰值,并且随着与激光束中心的距离而减小。在其他示例中,这种常规光纤可能产生不均匀的强度轮廓,例如图15所示的不均匀的强度轮廓272,其表现出高强度区域。高斯强度轮廓的高强度中心区域或未充分漫射的光束的高峰值辐照度区域可能很容易具有局部强度(例如,峰值辐照度是光束的平均强度的辐照度的许多倍,该平均强度定义为光束的总功率除以光束面积),这可能导致对病理组织的加热不均匀。
相反,均匀强度的光分布具有以基本恒定的强度为特征的基本相等的峰值和平均辐照度,使得由光辐照的病理组织可以被均匀地治疗。光轮廓268的基本恒定的辐照度导致对病理组织的温和、均匀的加热。以这种方式,可以避免高强度峰值辐照度区域使病理组织碳化,而常规器件被有意地设计成使组织碳化。以这种方式,可以通过优化的治疗充分地治疗由光子器件300照射的整个表面区域。
光子器件100、200、300是可以将光子治疗传递至可进入的病理组织的非侵入性器件。这种可进入的病理组织可以位于皮肤上或体腔中(例如口腔和阴道腔中)。示例性病理组织包括人和狗的黑色素瘤和肥大细胞癌、猫的纤维肉瘤,以及一般而言,可以通过低温或通过手术切除治疗的类型的非侵入性或最小可见性的可进入病理组织。在光子器件100、200、300的操作中,可以用一定剂量的纳米颗粒来治疗病理组织(例如通过静脉注射全身性地治疗,或在肿瘤或其主要血供处局部地治疗),使得纳米颗粒在病理组织上和/或内部积累到所需浓度,并且在癌组织中会优先这样,因为这些癌组织高度血管化。在约12小时至约36小时的预定等待时间——以允许纳米颗粒扩散到病理组织中——之后,光子器件100、200、300可以定位成与病理组织的表面接触,并且控制(例如监测病理组织的表面温度)成向病理部位传递具有约2w/cm2至约20w/cm2的连续传递剂量的808nm激光能量达约5分钟的持续时间。传递激光剂量导致将纳米颗粒加热到约45℃至约55℃范围内的温度,其中,这种加热优先破坏病理组织而不伤害周围的健康组织。
图16示出了用于将光子治疗传递至病理区域的示例性过程400。在一些实现中,该方法包括从套管中的第一光学元件发出光能(402)。在一些实现中,该方法还包括从套管中的光能产生基本均匀的辐照度轮廓(404)。在一些实现中,该方法还包括将从第一光学元件发出的光能通过与套管的远端热接触的第二光学元件传递至病理组织,而不烧蚀病理组织(406)。在一些实现中,该方法还包括将来自于病理组织的热能通过第二光学元件传导至套管(408)。
已经描述了多个实施例。然而,应当理解,在不背离本公开的精神和范围的情况下,可以进行各种修改。例如,尽管已经将光子器件100、200、300描述和图示成包括透射性元件114,但是在一些实施例中,功能与光子器件100、200、300中的任一个相似的光子器件可以不包括杆,而使用主动冷却窗。在一些实现中,这种光子器件可以更有效(例如可以向套管组件发射电磁能输入的较高部分)。
尽管已经将光子器件100、200、300的部件描述和图示成包括某些尺寸、形状和材料配方,但是在一些实施例中,结构和功能与光子器件100、200、300中的任一个相似的光子器件可以包括一个或多个具有不同尺寸、形状和/或材料配方的部件。
在一些实现中,光子器件100、200、300中的任一个可以与其他形式的电磁能结合使用。例如,同时向病理组织施加光子能量和由直流电或交流电、直流电或脉冲电流或射频产生的电磁场,将减少在病理组织上产生所需治疗效果所需的光子能量。因此,这种组合将增强光子能量将产生所需效果的深度和/或减小病理组织表面处所需的光子能量的强度。
在一些实现中,将光子器件100、200、300中的任一个与适当选择的材料——该材料优化了透射性元件114和病理组织的表面之间的能量传递(例如水、超声凝胶等)——结合使用可以在表面之间产生更紧密的接触,并且使由于透射性元件114的材料与病理组织之间的折射率失配而导致的光子能量损失最小化。另外,通过消除透射性元件114与病理组织之间的气隙,这种材料可以用于更有效地将热量从病理组织耦合到透射性元件114,以通过套管进行辐射和/或传导散发。在一些实施例中,可以附加地向该材料加入镇痛剂(例如利多卡因),以使患者的不适最小化。
在一些实现中,将光子器件100、200、300中的任一个与冷却源(例如冷空气鼓风机、热电主动冷却套管表面等)结合使用,可以使能够传递至病理组织的光子能量最大化,而不使组织碳化。
在一些实现中,光子器件100、200、300可以用于将光子治疗直接传递至病理组织(例如没有纳米颗粒)。在一些实现中,单个光子器件100、200、300可以在沿着病理组织的不同位置顺序操作,直到治疗病理组织的全部区域。
在其他情况下,多个光子器件100、200、300可以彼此相邻放置,并且并行(例如同时)操作,以治疗大区域的病理组织。例如,图17示出多个光子器件500(例如实现为光子器件100、200、300中的任一个),它们彼此相邻布置,以将多个光束501传递到病理组织。光子器件500接收输入光,并且使用一个或多个光学元件580(例如实现为光纤108或透镜244、246)来格式化输入光。尽管光束501在透射性元件514的远端表面处(例如在套管502的输出端处)不重叠,但是光束501在组织的表面503下方一定深度处重叠。这种重叠将在组织的表面503下方的目标区域处产生比单个光子器件单独能够产生的热量更大的热量。因此,在一些实施例中,套管502的远端结构可以是尖锐的,使得光子器件500的远端可以插入组织中,以在组织的任何深度处产生任何期望的热轮廓。
在一些实施例中,可以主动冷却光子器件100、200、300中的任一个或结构和功能与光子器件100、200、300中的任一个相似的光子器件的套管,以增加在病理组织处的辐照度,而不受透射性元件的热特性或周围环境限制,从而可以控制套管可以散发的最大热量。例如,可以使用冷却水、热电冷却技术、热管和相变材料中的一种或多种来主动冷却套管。
- 还没有人留言评论。精彩留言会获得点赞!