粉末鼻腔给药制剂的制作方法
本发明涉及一种粉末鼻腔给药制剂,其含有对治疗老年男性性腺功能减退综合征(loh综合征)有效的睾酮等甾体激素类。
背景技术:
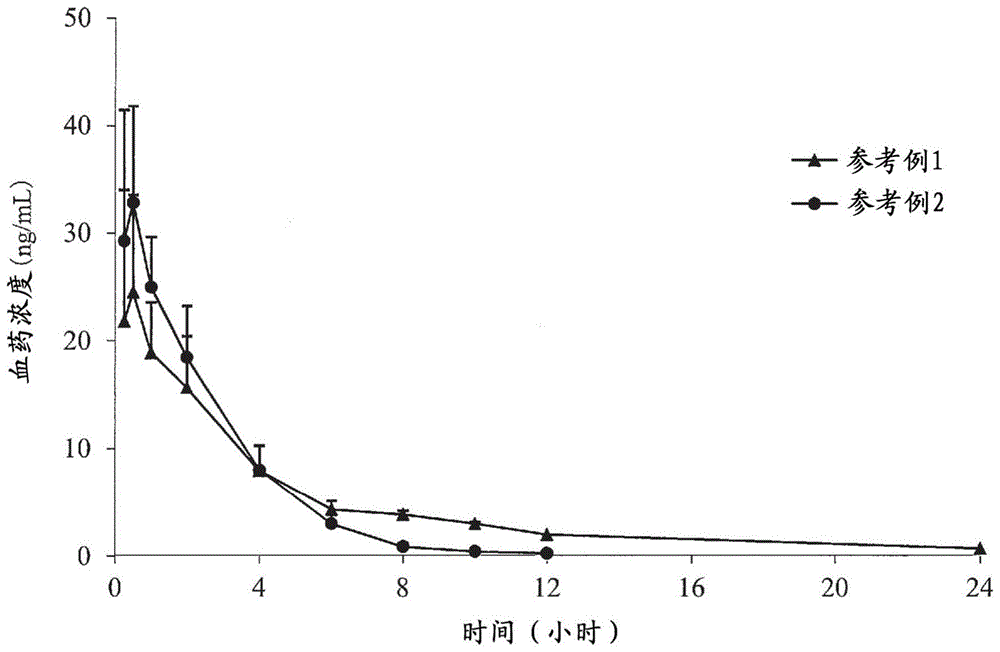
:老年男性性腺功能减退综合征(loh综合征)呈现认知障碍、睡眠障碍和内脏脂肪增加等各种症状和体征,由于loh综合征与血中睾酮浓度降低有关,因此认为补充睾酮(17β-羟基-3-氧代-4-雄烯)是有效的。以往的睾酮补充疗法用制剂主要是注射剂和透皮制剂。作为这些制剂的问题点,对于注射剂来说,给药部位产生疼痛并且需要到医院去施用,国外的植入剂也有同样的缺点。另外,对于透皮制剂来说,存在以下问题:对接触了涂布部位的家族成员等的污染、产生皮炎和/或二氢睾酮(dht)增加。在任一种方法下,由于给药后睾酮浓度立即升高至非生理浓度,因此可能产生各种副作用。另外,对于以睾酮为有效成分的滴鼻剂(液体制剂)来说,为了利用作为经粘膜吸收的特征的速效性,尝试了减小睾酮的粒径以改善体内吸收的方法。日本特开平11-130659号公报(专利文献1)公开了一种水性混悬药物组合物,其含有作为有效量的药物的睾酮、以及作为助悬剂的约0.05~5%w/w的结晶纤维素·羧甲基纤维素钠(avicelrc),其中,药物颗粒的形状为粒径10nm~10μm的球形,其物理稳定性得到改善。在实施例中,使用0.1~3μm的睾酮。但是,对于含有这种小粒径睾酮的液体制剂来说,虽然生物体内的吸收得到改善,但是在睾酮补充疗法中被美国食品药品管理局(fda)视为标准的睾酮的最高血药浓度(cmax)超过15ng/ml。例如,在美国对用于睾酮补充疗法的药物“aveed”也设定了相同的标准。进而,睾酮的平均血药浓度(cavg)超过被视为成年男性的血浆睾酮水平(正常范围)的2.01~7.5ng/ml(日本泌尿器学会杂志95:751-760,2004),担心发生意外的副作用。尤其是血中睾酮浓度的急剧上升会导致随后血中睾酮浓度的急剧下降,据说还会引起多血症、前列腺特异性抗原(psa)上升、尿潴留、男子乳腺发育和睡眠呼吸暂停等副作用。另一方面,日本特表2012-526726号(专利文献2)公开了一种含有治疗剂的可吸入的干粉药物制剂,其中,所述治疗剂中的至少一部分以游离碱形式存在,所述治疗剂包含粒度分布为约5~250μm的颗粒。在该文献中,作为发明的课题,记载了能够设计可吸入药物制剂以使药代动力学特征更符合临床要求的必要性。具体地,该文献中记载了通过在偏头痛患者中引起血药浓度的早期高峰来快速缓解初期症状、以及经时维持高的血药浓度来防止复发。在实施例中,作为鼻腔用干粉制剂,制备了作为偏头痛治疗药的舒马普坦或佐米曲普坦的干粉制剂(粒度为15μm的游离碱单品,粒度为15μm的游离碱和粒度为38~100μm的游离碱的混合品)。另外,在实施例中,评价了格拉司琼干粉制剂的味道,但是未公开格拉司琼的粒度。进而,该文献公开了干粉制剂可以不具有载体或者可以是载体和任选一种以上赋形剂与治疗剂的混合物。该文献例示了大量的载体和赋形剂,但是在实施例中没有提及载体和赋形剂。另外,日本特开平9-291025号公报(专利文献3)公开了一种粉末鼻腔给药组合物,其包含药物、羟丙基纤维素等具有吸水性和凝胶形成性的基剂、和结晶纤维素等具有吸水性和水难溶性的基剂。该文献的目的是改善药物的吸收性,并增加水溶性药物、脂溶性高的药物以外的药物、或非肽和/或蛋白质性药物的最高血药浓度。关于所述药物的粒径,该文献公开了优选90重量%以上的颗粒的粒径为10~350μm,但是实施例中的粒径是不清楚的。在实施例中,作为上述药物,使用了作为消炎甾体的丙酸倍氯米松、作为止吐药的甲氧氯普胺、作为促黄体生成肽激素的醋酸亮丙瑞林、作为肽激素的鲑降钙素。如上所述,在现有技术中,如专利文献1所示,目前,以减小睾酮的粒径为前提,从各种观点出发研究了睾酮补充疗法用药物的开发,但还未尝试通过调节睾酮的粒径而将血浆睾酮水平控制在正常范围(特别是对于粉末滴鼻制剂)。现有技术文献专利文献专利文献1:日本特开平11-130659号公报(权利要求1和6,实施例3)专利文献2:日本特表2012-526726号公报(权利要求1,段落[0002]、[0003]、[0131]~[0134]、[0156]、[0178],实施例)专利文献3:日本特开平9-291025号公报(权利要求1,段落[0019]、[0022]、[0048],实施例)技术实现要素:发明要解决的课题因此,本发明的目的是提供一种粉末鼻腔给药制剂,其可以在将睾酮等甾体激素类的血药浓度长时间控制在特定范围内。本发明的另一目的是提供一种粉末鼻腔给药制剂,其可以抑制血药浓度的急剧上升并减少给药频率和副作用。本发明的再一目的是提供一种粉末鼻腔给药制剂,其可以将睾酮的最高血药浓度(cmax)控制在成年男性的血浆睾酮水平,并且可以将睾酮的平均血药浓度(cavg)调节在成年男性的血浆睾酮水平。解决课题的手段本发明人等为了实现上述课题,进行了深入研究,结果发现,通过将作为粉末鼻腔给药制剂的有效成分的粒状载体激素类的平均粒径调节至50~300μm,可将睾酮等甾体激素类的血药浓度长期控制在特定范围,至此完成了本发明。即,本发明的粉末鼻腔给药制剂含有平均粒径为50~300μm的粒状甾体激素类作为有效成分。上述粉末鼻腔给药制剂还可以含有水溶性高分子(特别是具有羟烷基的纤维素等水溶性多糖类)。上述水溶性高分子可以不含结晶纤维素或羧甲基纤维素钠。上述水溶性高分子可以是粒状。上述甾体激素类可以包含(或者由)雄激素(特别是睾酮和/或其衍生物)形成。上述水溶性高分子的比例相对于1重量份的上述粒状甾体激素类,可以为约1~50重量份。上述粉末鼻腔给药制剂可以是将甾体激素类的最高血药浓度(cmax)调节至15ng/ml以下的粉末鼻腔给药制剂。粉末鼻腔给药制剂也可以是将甾体激素类的平均血药浓度(cavg)调节至2~7.5ng/ml的粉末鼻腔给药制剂。发明效果在本发明中,由于作为粉末鼻腔给药制剂的有效成分的粒状甾体激素类的平均粒径被调整为50~300μm,因此,可将睾酮等甾体激素类的血药浓度长期控制在特定范围内。因此,可抑制血药浓度的急剧上升以及减少给药频率和副作用,例如,每日2次给药也可以减少副作用。特别地,通过组合作为甾体激素类的睾酮和特定的水溶性高分子,可以将睾酮的最高血药浓度(cmax)控制在15ng/ml以下,并且可以将甾体激素类的平均血药浓度(cavg)控制在2~7.5ng/ml。附图说明[图1]图1是示出参考例1和2得到的各粉末鼻腔给药制剂的血浆睾酮浓度的经时变化的图。[图2]图2是示出实施例1~2和参考例3得到的各粉末鼻腔给药制剂的血浆睾酮浓度的经时变化的图。[图3]图3是示出实施例3~5和参考例4得到的各粉末鼻腔给药制剂的血浆睾酮浓度的经时变化的图。[图4]图4是示出实施例6~8得到的各粉末鼻腔给药制剂的血浆睾酮浓度的经时变化的图。[图5]图5是示出实施例9~12得到的粉末鼻腔给药制剂的血浆睾酮浓度的经时变化的图。[图6]图6是示出实施例13~15得到的粉末鼻腔给药制剂的血浆睾酮浓度的经时变化的图。[图7]图7是示出实施例16~21得到的粉末鼻腔给药制剂的血浆睾酮浓度的经时变化的图。[图8]图8是示出实施例22~27得到的粉末鼻腔给药制剂的血浆睾酮浓度的经时变化的图。具体实施方式[有效成分]本发明的粉末鼻腔给药制剂包含平均粒径为50~300μm的粒状甾体激素类作为有效成分(药理或生理活性成分)。甾体激素类大致分为雄激素(雄性激素)、雌激素(雌性激素)和肾上腺皮质激素。作为雄激素,例如可举出:睾酮、睾酮衍生物[例如,甲基睾酮等c1-4烷基睾酮;乙酸睾酮、丙酸睾酮、异己酸睾酮、庚酸睾酮、癸酸睾酮、十一烷酸睾酮等睾酮的c1-18链烷酸酯;丁基己酸睾酮(丁环甲酸睾酮)等睾酮的环烷酸酯;二氢睾酮(dht);和脱氢表雄酮(dhea)等、以及屈他雄酮。作为雌激素,例如可举出:雌二醇、雌三醇、雌酮、磷雌酚等雌激素(卵泡激素),孕酮、炔诺酮、孕烷二醇等孕激素(黄体激素)等。作为肾上腺皮质激素,例如可举出:磷酸地塞米松、醋酸氟氢可的松、甲泼尼龙琥珀酸钠、磷酸氢化可的松等。这些甾体激素类可以单独使用或组合使用2种以上。其中,优选甾体激素类(特别是雄激素),特别优选睾酮或其衍生物(特别是睾酮)。粒状甾体激素类的形状只要是粒状(或粉状),就没有特别限定,既可以是各向同性形状(例如,球状或略球状、立方体状等),也可以是各向异性形状(例如,椭圆体状、多面体状、长方体状、纤维状、不确定形状等)。本发明中,由于粒状甾体激素类具有特定的平均粒径,并且粒径被调整在规定范围内,因此可以将甾体激素类的血药浓度长期控制在特定范围。甾体激素类的体积平均粒径(d50)为50~300μm即可,可以优选为约70~250μm,更优选为约100~230μm(例如为约150~200μm)。从抑制血药浓度的急剧上升并减少给药频率和副作用的观点考虑,甾体激素类的体积平均粒径例如可以为约50~200μm,优选约80~150μm,更优选约90~130μm(特别是约100~120μm)。如果平均粒径过大,则粉末鼻腔给药制剂中的甾体激素类的最高血药浓度(cmax)变低。如果平均粒径过小,则粉末鼻腔给药制剂中的甾体激素类的平均血药浓度(cavg)变低。予以说明,在本说明书和权利要求书中,在粒状甾体激素类的形状为各向异性形状的情况下,各颗粒的粒径是指长径和短径的平均值。甾体激素类的粒径分布(粒度分布)的幅度优选越窄越好,累积频率为90%的粒径(d90)为约100~300μm,优选为约120~280μm,更优选为约150~250μm(特别是约200~240μm)。制备粒径分布的幅度窄的甾体激素类的方法(控制粒径的方法)利用常规的粉体处理装置即可。例如,可以使用市售的表面改性处理装置(hosokawamicron公司制“nobiltanob-mini”)等来制备均匀的粒子。在本说明书和权利要求书中,粒状甾体激素类的体积平均粒径和粒径分布可以使用激光衍射式粒度测定装置来测定,具体而言,可以根据后述的实施例中记载的方法来测定。有效成分除了含有上述粒状甾体激素类以外还可以含有其他有效成分。作为其他有效成分,只要是具有药理作用的有效成分,就没有特别限定,例如可举出胰腺循环激素类、前列腺素类、甾体类、皮质激素类、甲状腺激素类和生长激素类等其他激素类等。有效成分中的粒状甾体激素类的比例例如可以为50重量%以上,优选为80重量%以上,更优选为90重量%以上,也可以为100重量%(有效成分仅为粒状甾体激素类)。[水溶性高分子]本发明的粉末鼻腔给药制剂除了上述有效成分以外还含有水溶性高分子。在本发明中,通过组合具有上述粒径的有效成分和水溶性高分子,可进一步有效地调节甾体激素类的血药浓度。水溶性高分子可以包含水溶性合成高分子、水溶性多糖类等。水溶性合成高分子和水溶性多糖类可以分别单独使用,也可以组合使用。作为水溶性合成高分子,例如可举出:聚乙烯吡咯烷酮(pvp)、kollidon(乙烯基吡咯烷酮-乙酸乙烯酯共聚物)等共聚维酮、聚乙烯醇(pva)、羧乙烯基聚合物、聚丙烯酸系聚合物、聚乙二醇等。这些水溶性合成高分子可以单独使用或组合使用2种以上。水溶性多糖类可以为药理学或生理学上可接受的多糖类。作为多糖类,例如可举出:预胶化淀粉、部分预胶化淀粉、羧甲基淀粉钠等可溶性淀粉;甲基纤维素(mc)、羧甲基纤维素(羧甲纤维素或cmc)、羧甲基纤维素钠(cmc-na)、羧甲基纤维素钙、羟乙基纤维素(hec)、羟丙基纤维素(hpc)、羟丙甲基纤维素(hpmc)等纤维素醚类;纤维素邻苯二甲酸酯、羟丙甲基纤维素邻苯二甲酸酯等纤维素酯;甲壳质、壳聚糖、茁霉多糖等同聚多糖类;阿拉伯树胶、黄原胶、刺槐豆胶、黄蓍胶、海藻酸钠等杂多糖类等。这些水溶性多糖类可以单独使用或组合使用2种以上。在这些水溶性高分子中,优选可与水形成凝胶而易于粘附在鼻腔粘膜上的水溶性高分子。例如,优选上述例示的水溶性合成高分子、水溶性多糖类。具体地,优选水溶性多糖类(mc、cmc、cmc-na、hec、hpc、hpmc等),特别优选具有羟烷基(特别是羟丙基)的纤维素(hec、hpc等羟基c2-4烷基纤维素、hpmc等羟基c2-4烷基c1-4烷基纤维素等)。其中,当组合羟烷基纤维素(特别是羟丙基纤维素等羟基c2-3烷基纤维素)与具有上述粒径的粒状甾体激素类(特别是睾酮)时,可以有效地调节平均血药浓度(cavg),因此可以兼顾最高血药浓度(cmax)的过度上升的抑制和平均血药浓度(cavg)的调节。水溶性多糖类中的具有羟烷基的纤维素(例如,羟丙基纤维素、羟丙甲基纤维素等具有羟丙基的纤维素)的比例例如可以为50重量%以上,优选80重量%以上,更优选90重量%以上,也可以为100重量%(有效成分仅为甾体激素类)。在本发明中,多糖类可以不含结晶纤维素。水溶性高分子(特别是羟丙基纤维素等水溶性多糖类)的粘度例如在20℃的2重量%水溶液中例如为约2~10000mpa·s,优选约10~8000mpa·s(例如,约100~7000mpa·s),更优选约120~5000mpa·s(特别是约150~4000mpa·s)。上述粘度可以根据用途来选择,例如可以为约50~1000mpa·s(特别是约100~500mpa·s)。在操作性重要的情况下等,粘度例如可以为约500~5000mpa·s(特别是约1000~4000mpa·s)。当粘度过低时,水溶性高分子的操作性可能降低。在本说明书和权利要求书中,粘度可以通过毛细管粘度计法或旋转粘度计法来测量。水溶性高分子(特别是羟丙基纤维素等水溶性多糖类)的数均分子量(mn)可以使用gpc(凝胶渗透色谱法)测量,按聚苯乙烯换算,例如可以为约100,000~5,000,000,优选为约300,000~2,000,000,更优选为约500,000~1,500,000。上述分子量可以根据用途来选择,例如可以为约500,000~1,000,000(特别是约600,000~800,000)。在操作性重要的情况下等,上述分子量例如可以为约700,000~1,500,000(特别是约800,000~1,000,000)。水溶性高分子的形状没有特别限定,例如,既可以是与上述粒子甾体激素类相独立的形状的粒状,也可以是与甾体激素类复合化的形状(例如,覆盖上述甾体激素类表面的形状或粘附在表面的形状等),也可以是与和粒状复合化的形状的组合。其中,优选粒状。粒状水溶性高分子的形状没有特别限定,既可以是各向同性形状(例如,球状或略球状、立方体状等),也可以是各向异性形状(例如,椭圆体状、多面体状、长方体状、纤维状、不确定形状等)。其中,优选各向同性形状或与各向同性形状相近的形状,长径与短径的比例例如为100倍以下,优选为10倍以下,更优选为5倍以下(特别是3倍以下)。粒状水溶性高分子(特别是羟丙基纤维素等水溶性多糖类)的体积平均粒径(d50)例如可以为约10~500μm,优选约30~300μm,更优选约40~200μm(特别是约50~150μm)。另外,粒状水溶性高分子的平均粒径相对于粒状甾体激素类的平均粒径,例如可以为约0.1~10倍,优选为约0.2~5倍(例如,约0.3~1倍),更优选为约0.4~0.8倍(特别是约0.5~0.7倍)。粒状水溶性高分子的平均粒径过大时,可能难以与粒状激素类均匀混合,粒状水溶性高分子的平均粒径过小时,可能难以与粒状激素类均匀混合。对于粒状水溶性高分子的体积平均粒径的测定方法来说,可以通过与粒状甾体激素类的平均粒径相同的方法测定。水溶性高分子的比例相对于1重量份的粒状甾体激素类,例如为约1~50重量份,优选约3~30重量份,更优选约4~20重量份。(特别是约4~15重量份)。当水溶性高分子的比例过低时,可能无法有效地调节平均血药浓度(cavg)。[其他成分]本发明的粉末鼻腔给药制剂除了含有上述有效成分和水溶性高分子以外,还可以含有赋形剂。作为赋形剂,例如可举出:乳糖、白糖或精制糖、葡萄糖、蔗糖、甘露糖醇、山梨糖醇、木糖醇等糖类或糖醇类;微晶纤维素等。这些赋形剂可以单独使用或组合使用2种以上。赋形剂相对于100重量份的粒状甾体激素类的比例例如为约0.1~100重量份,优选约1~50重量份,更优选约3~30重量份。本发明的粉末鼻腔给药制剂根据需要还可以含有其他成分。作为其他成分,可以为药理学或生理学上可接受的成分,例如可举出:粘合剂(例如,玉米淀粉、糊精等淀粉;结晶纤维素(也包括微晶纤维素)、乙基纤维素(ec)等纤维素类;聚乳酸等合成高分子等)、崩解剂(例如碳酸钙、交联羧甲基纤维素钠、交联聚乙烯吡咯烷酮等),润滑剂、崩解助剂、抗氧化剂、稳定剂、防腐剂或保存剂、杀菌剂或抗菌剂、抗静电剂、矫味剂或掩蔽剂、着色剂、除臭剂或香料、清凉剂、消泡剂等。这些其他成分可以单独使用或组合使用2种以上。相对于100重量份的粒状甾体激素类,其他成分的比例例如为约0.1~100重量份,优选约1~50重量份,更优选约3~30重量份。[粉末鼻腔给药制剂的特征]本发明的粉末鼻腔给药制剂为含有上述粒状甾体激素类的粉末(颗粒)的形式即可。当与水溶性高分子组合的情况下,制剂可以是其中水溶性高分子与粒状甾体激素类复合的复合颗粒,也可以是粒状甾体激素类和粒状水溶性高分子的混合物,还可以是上述复合颗粒与粒状甾体激素类和粒状水溶性高分子的混合物。复合颗粒的制造方法可以利用常规的造粒方法,造粒方法可以是干式造粒法(例如,干式粉碎造粒法、压缩成型造粒法等)、湿式造粒法(例如,挤出造粒法、翻滚造粒法、流化床造粒法、混合·搅拌造粒法、喷雾干燥造粒法、振动造粒法等)的任一种。其中,广泛使用湿式造粒法等。造粒物还可以根据需进行粉碎和/或整粒。复合颗粒的体积平均粒径(d50)例如可以为约100~500μm,优选约120~300μm,更优选约150~250μm。对于复合粒子的体积平均粒径的测定方法来说,可以通过与粒状甾体激素类的平均粒径相同的方法来测定。粒状甾体激素类和粒状水溶性高分子的制造方法可以分别为上述干式造粒法和上述湿式造粒法的任一种。在上述造粒法中,从简便性等的观点考虑,可广泛使用干式粉碎造粒法。对于粉碎,可以使用喷雾器(例如,样品磨、锤式磨等)、销棒粉碎机、气流粉碎机、球磨机等通常用于药物粉碎的粉碎机。作为混合物的混合方法,可以使用常规的方法,例如,可以使用v形混合机、容器混合机等容器旋转式混合机,螺带式混合器、高速混合器等容器固定型混合机等来混合。本发明的粉末鼻腔给药制剂优选为粒状甾体激素类和粒状水溶性高分子的混合物。在该混合物中,粒状甾体激素类和粒状水溶性高分子优选均匀混合。本发明的粉末鼻腔给药制剂可以抑制甾体激素类(特别是睾酮)的最高血药浓度(cmax)的过度上升,最高血药浓度(cmax)例如可以为25ng/ml以下,优选为18ng/ml以下,更优选为15ng/ml以下(特别是7.5ng/ml以下)。本发明的粉末鼻腔给药制剂还可以抑制甾体激素类(特别是睾酮)的血药浓度的变动(平均血药浓度(cavg))。例如,本发明的粉末鼻腔给药制剂可以将平均血药浓度(cavg)维持在1~10ng/ml,优选2~7.5ng/ml,更优选2.5~7ng/ml的范围。另外,可以将血药浓度的变动的抑制维持12小时以上。由于本发明粉末鼻腔给药制剂的甾体激素类的血药浓度的变动小,因此甾体激素类(特别是睾酮)到达最高血药浓度(cmax)的时间(tmax)也延迟,例如,tmax可以为0.1小时以上(例如0.1~3小时),优选为0.3小时以上,更优选为0.5小时以上(特别是0.8小时以上)。由于本发明粉末鼻腔给药制剂的甾体激素类的血药浓度的变动小,因此甾体激素类(特别是睾酮)的消除半衰期(t1/2)也长,其中消除半衰期(t1/2)是指血药浓度达到最高血药浓度(cmax)的一半所需的时间。例如,t1/2可以为2小时以上(例如2~10小时),优选为3小时以上,更优选为5小时以上(特别是6小时以上)。本发明的粉末鼻腔给药制剂还可以调节(控制)甾体激素类(特别是睾酮)的平均血药浓度(cavg)。例如,本发明的粉末鼻腔给药制剂可以将甾体激素类(特别是睾酮)的平均血药浓度(cavg)调节(控制)至3~10ng/ml(这是fda给出的睾酮补充疗法临床试验的终点)。本发明粉末鼻腔给药制剂的血中平均滞留时间(mrt0-∞)也长。例如,本发明粉末鼻腔给药制剂的血中平均滞留时间(mrt0-∞)可以为3小时以上(例如,约3~20小时),也可以为例如4小时以上,优选5小时以上,更优选6小时以上(特别是7小时以上)。在本说明书和权利要求书中,最高血药浓度(cmax),到达最高血药浓度的时间(tmax)、消除半衰期(t1/2)、平均血药浓度(cavg)和血中平均滞留时间(mrt0-∞)可以通过后述实施例中所述的方法来评价。本发明的粉末鼻腔给药制剂抑制最高血药浓度(cmax)的过度上升并且副作用小,因此安全性高。因此,可安全地施用于人类和非人类动物,通常是哺乳动物(例如,人、兔子、狗、猫、牛、马、猪、猴子等)。本发明的粉末鼻腔给药制剂为粉末状即可,也可以是散剂、细粒剂、颗粒剂、喷雾剂、气雾剂等。给药方法为喷雾等向鼻腔给药的方法即可,没有特殊限定,可根据制剂的种类来选择。给药次数没有特别限定,例如可以1日1次,也可以根据需要1日多次(例如,1日2~3次),由于可抑制最高血药浓度(cmax)的过度上升,血浆睾酮浓度可以稳定地维持12小时,因此给药频率可以为1日2次。给药量可以根据给药对象的种类、年龄、体重和状况(例如,一般状况、病状、并发症的有无等)、给药时间、剂型、给药方法等来选择。例如,对人的给药量(1日用量)例如为约0.01~50mg/天,优选约0.05~30mg/天(例如约0.1~20mg/天),更优选约0.5~15mg/天(特别是约1~10mg/天)。实施例以下,基于实施例更详细地说明本发明,但本发明不限定于这些实施例。予以说明,所使用的原料的详情和平均粒径的测定方法如下所述。[原料]睾酮a:东京化成工业(株)制的睾酮,体积平均粒径(d50)123μm睾酮b:sigma-aldrich公司制的睾酮,体积平均粒径(d50)184μm睾酮c:拜耳公司制的睾酮,体积平均粒径(d50)273μm羟丙基纤维素h:日本曹达(株)制的“hpc-h”,体积平均粒径(d50)80~110μm,粘度(2重量%水溶液,20℃)1000~4000mpa·s,分子量(gpc法)91万羟丙基纤维素m:日本曹达(株)制的“hpc-m”,粘度(2重量%水溶液,20℃)150~400mpa·s,分子量(gpc法)70万羟丙基纤维素l:日本曹达(株)制的“hpc-l”,粘度(2重量%水溶液,20℃)6~10mpa·s,分子量(gpc法)14万结晶纤维素:旭化成化学(株)制的“ceolusph-f20jp”预糊化淀粉:旭化成化学(株)制的“mx-1”,粘度(2重量%水溶液,25℃)70mpa·s羧乙烯基聚合物:lubrizol公司制的“974p”,粘度(2重量%,ph7.5)29.4万~39.4万mpa·s,分子量50万~500万海藻酸钠:(株)kimica制的“i-8”,粘度(1重量%水溶液,20℃)800~900mpa·s,分子量100万~400万羟丙甲基纤维素:信越化学工业(株)制“90sh-15000sr”,粘度(2重量%水溶液,20℃)1.5万mpa·s,分子量1万~20万聚乙烯基吡咯烷酮:basf公司制的“k-90”,粘度(10w/v%水溶液,20℃)300~700mpa·s,分子量36万黄原胶:三晶(株)制的“cg-f”,粘度(1重量%水溶液,添加1重量%kcl)1200~1600mpa·s,分子量200万~5000万聚乙二醇:三洋化成工业(株)制“6000”,粘度(500g/l水溶液,25℃)200~400mpa·s,分子量7300~9300聚乙烯醇:日本合成化学工业(株)制的“eg-18”,粘度(4重量%水溶液)18.3mpa·s,分子量为3万~11万。壳聚糖:(株)kimica制的“f”,粘度(0.5重量%水溶液,20℃)5~20mpa·s,分子量1万~100万羧甲基纤维素钠:第一工业制药(株)制的“pr-s”,粘度(2重量%水溶液,25℃)20~40mpa·s,分子量6000~3万刺槐豆胶:(株)kimica制的“rl-200z”,粘度(在85℃下溶解的水溶液)3000~4000mpa·s,分子量30万共聚维酮:basf公司制的“va64”,粘度(5重量%水溶液,25℃)5mpa·s,分子量5万乳糖:乳糖水合物,dfepharma公司制[粒径的测量方法]使用激光衍射式粒度测定装置(malvern公司制的“mastersizer3000”),通过干式分散法(单位)来测定。参考例1和2(1)制剂配方参考例1和2的制剂配方示于以下表1中。[表1]成分参考例1参考例2睾酮a5mg5mg羟丙基纤维素h5mg-结晶纤维素-5mg(2)制剂化方法将睾酮a在乳钵中粉碎后,加入羟丙基纤维素h或结晶纤维素并混合,将所得混合物填充到筒状装置中,制成给药制剂。予以说明,筒状装置是将装入有脊髓穿刺针(terumo(株)制的terumo脊髓穿刺针(注册商标))的针头保护器(塑料制)的尖端用锉刀磨平的装置,在所有的实施例中,都将该容器与氧气喷雾罐(物理化学实验用气体)连接以喷雾制剂。(3)药代动力学评价向老年雌性狗(3只)的单侧鼻腔内插入约1cm填充有制剂的筒状装置,向鼻腔单次给药(睾酮的给药量:5mg)。在鼻腔给药后的0.25、0.5、1、2、4、6、8、10、12和24小时,使用23g注射针和经肝素处理的注射筒采血。每个时间点的采血量为约1ml。将采集的血液离心分离(15000rpm,2分钟,4℃)后,采取血浆,将其在冰箱(-20℃以下)中冷冻保存至测定时为止。在以下分析条件下测量血浆睾酮浓度。(hplc条件)hplc:prominence系列((株)岛津制作所制)色谱柱:scherzosm-c18(2.0mmi.d.×50mm,3μm,imtakt公司制)流动相a:0.1体积%的乙酸水溶液流动相b:乙腈柱温:40℃自动进样器内的温度:室温流量:0.3ml/分钟注入量:10μl梯度条件:示于以下表2[表2]时间(分钟)0455.17.5流动相a(%)703507070流动相b(%)30651003030(ms条件)ms/ms:3200qtrap((株)absciex制)离子化方法:esi法(电喷雾电离)离子极性:正极测量离子:示于以下表3。[表3]将得到的血浆睾酮浓度通过药代动力学分析软件(phoenixwinnonlin6.4版,certara合同会社制)进行分析,以计算最高血药浓度(cmax)、血药浓度的定量值为定量下限值以上的最终测量时间点为止的浓度-时间曲线下面积(auc0-t)、外推至无限大的血药浓度-时间曲线下面积(auc0-∞)、到达最高血药浓度的时间(tmax),消除半衰期(t1/2)、血中平均滞留时间(mrt0-∞)。将评价所得给药制剂的药代动力学参数的结果示于以下表4。血浆睾酮浓度的经时变化示于图1。[表4]由表4和图1的结果可知,使用羟丙基纤维素作为糖类的制剂与使用结晶纤维素的制剂相比,可降低最高血药浓度(cmax),延长消除半衰期(t1/2)和血中平均滞留时间(mrt0-∞),因此可长期维持血浆睾酮浓度。实施例1~2和参考例3(1)制剂配方实施例1~2和参考例3的制剂配方示于以下表5。[表5]成分(平均粒径)实施例1实施例2参考例3睾酮b分极品(184μm)2mg--睾酮b分极品(90.4μm)-2mg-睾酮b粉碎品(16.2μm)--2mg羟丙基纤维素h18mg18mg18mg(2)制剂化方法向睾酮b的分级品或其粉碎品(将睾酮b通过筛分分级后测量了体积平均粒径的分级品:体积平均粒径184μm的实施例1、体积平均粒径90.4μm的实施例2,以及将睾酮b在乳钵中粉碎后测量了体积平均粒径的粉碎品:体积平均粒径16.2μm的参考例3)中加入羟丙基纤维素h并混合,将所得混合物填充入筒状装置中,制成给药制剂。(3)药代动力学评价向老年雌性狗(3只)的单侧鼻腔内插入约1cm填充有制剂的筒状装置,向鼻腔单次给药(睾酮的给药量:2mg)。在鼻腔给药后的0.25、0.5、1、2、4、6、8、10、12和24小时,使用23g注射针和注射筒采血。每个时间点的采血量为约1ml。将采集的血液立即转移到装有肝素钠的真空采血管中,轻轻搅拌。离心分离(3000rpm,10分钟,4℃)后,采取血浆,将其冷冻保存至分析时为止。在以下分析条件下测量血浆睾酮浓度。(hplc条件)hplc:nexerax2((株)岛津制作所制)色谱柱:kinetex2.6μmevoc18(4.6mmi.d.×150mm,2.6μm,phenomenex公司制)流动相a:0.05体积%的乙酸水溶液流动相b:甲醇柱温:45℃样品室温度:10℃注入量:10μl梯度条件:示于以下表6。[表6]时间(分钟)流动相a(%)流动相b(%)流量(ml/分钟)0.0042580.90.5042580.911.5037630.911.60↓↓0.912.00199↓12.501991.313.501991.313.5142581.315.5042581.315.5142580.916.0042580.9(ms条件)ms/ms:qtrap6500((株)absciex制)离子化方法:esi法离子极性:正极测量离子:示于以下表7[表7]将得到的血浆睾酮浓度通过药代动力学分析软件(phoenixwinnonlin6.4版,certara合同会社制)进行分析,以计算最高血药浓度(cmax)、给药后12小时为止的血药浓度-时间曲线下面积(auc0-12hr)、血药浓度的定量值为定量下限值以上的最终测定时间点为止的浓度-时间曲线下面积(auc0-t)、外推至无限大的血药浓度-时间曲线下面积(auc0-∞)、到达最高血药浓度的时间(tmax),消除半衰期(t1/2)、血中平均滞留时间(mrt0-∞)。将评价所得给药制剂的药代动力学参数的结果示于以下表8,血浆睾酮浓度的经时变化示于图2。[表8]由表8和图2的结果可知,使用小于50μm的睾酮的参考例3的最高血药浓度(cmax)超过了fda的标准(即15ng/ml),与此相比,使用粒径大的睾酮的实施例1~2的最高血药浓度(cmax)维持在fda的标准15ng/ml以下。另外,与参考例3相比,实施例1~2的最高血药浓度(cmax)低,血药浓度半衰期(t1/2)和血中平均滞留时间(mrt0-∞)大幅延长,因此每日给药2次即可,这使得药物依从性得到改善。另外,关于平均血药浓度(cavg),在假设每日给药2次(每12小时给药1次)的情况下,按照auc(0-12hr)/12计算,结果如表9所示,实施例1~2的平均血药浓度(cavg)落入正常范围2.01~7.5ng/ml。[表9]实施例3~5和参考例4(1)制剂配方实施例3~5和参考例4的制剂配方示于以下表10中。[表10]成分(平均粒径)实施例3实施例4实施例5参考例4睾酮c(分级273μm)2mg---睾酮c分级品(131μm)-2mg--睾酮c分级品(70.4μm)--2mg-睾酮c粉碎品(16.2μm)---2mg乳糖18mg18mg18mg18mg(2)制剂化方法向睾酮c的分级品或其粉碎品(将睾酮c通过筛分分级后测量了体积平均粒径的分级品:体积平均粒径273μm的实施例3、体积平均粒径131μm的实施例4、体积平均粒径70.4μm的实施例5,以及将睾酮c在乳钵中粉碎后测量了体积平均粒径的粉碎品:体积平均粒径16.2μm的参考例4)中加入乳糖并混合,将所得混合物填充入筒状装置中,制成给药制剂。(3)药代动力学评价向老年雄性狗(8只)的单侧鼻腔内插入约1cm填充有制剂的筒状装置,向鼻腔单次给药(睾酮的给药量:2mg)。在鼻腔给药后的0.25、0.5、1、2、4、6、8、10和24小时,使用23g注射针和注射筒采血。每个时间点的采血量为约1ml。将采集的血液立即转移到装有肝素钠的真空采血管中,轻轻搅拌。离心分离(3000rpm,10分钟,4℃)后,采取血浆,将其冷冻保存至分析时为止。在以下分析条件下测量血浆睾酮浓度。(hplc条件)hplc:2795(waters公司制)色谱柱:chromolithperformancerp-18e(3.0mmi.d.×100mm,merck公司制)流动相a:0.005mol/l醋酸铵溶液流动相b:甲醇柱温:45℃样品室温度:10℃注入量:10μl梯度条件:示于以下表11。[表11]时间(分钟)流动相a(%)流动相b(%)流量(ml/分钟)曲线(curve)0.0040600.4011.0040600.4014.0020800.4066.0010900.4066.505950.90118.5040600.4011(ms条件)ms/ms:quattroultima(waters公司制)离子化方法:esi法离子极性:正极测量离子:示于以下表12[表12]将得到的血浆睾酮浓度通过药代动力学分析软件(phoenixwinnonlin7.0版,certara合同会社制)进行分析,以计算最高血药浓度(cmax)、给药后10小时为止的血药浓度-时间曲线下面积(auc0-10hr)、外推至无限大的血药浓度-时间曲线下面积(auc0-∞)、到达最高血药浓度的时间(tmax),消除半衰期(t1/2)、血中平均滞留时间(mrt0-10hr和mrt0-∞)。另外,关于平均血药浓度(cavg),在假设每日给药2次(每10小时给药1次)的情况下,按照auc(0-10hr)/10计算。将评价所得给药制剂的药代动力学参数的结果示于以下表13,血浆睾酮浓度的经时变化示于图3。予以说明,测定值是指测定狗只数的平均值和标准偏差(下同)。[表13]由表13和图3的结果可知,使用小于50μm的睾酮的参考例4的最高血药浓度(cmax)超过了fda的标准15ng/ml,与此相比,使用粒径大的睾酮的实施例3~5的最高血药浓度(cmax)维持在fda的标准15ng/ml以下。实施例6~8(1)制剂配方实施例6~8的制剂配方示于以下表14。[表14]成分(平均粒径)实施例6实施例7实施例8睾酮c分级品(114μm)2mg2mg2mg羟丙基纤维素h18mg--羟丙基纤维素m-18mg-羟丙基纤维素l--18mg(2)制剂化方法向睾酮c的分级品(将睾酮c通过筛分分级后测量了体积平均粒径的分级品:体积平均粒径114μm)中加入羟丙基纤维素并混合,将所得混合物填充入筒状装置中,制成给药制剂。(3)药代动力学评价向老年雄性狗(8只)的单侧鼻腔内插入约1cm填充有制剂的筒状装置,向鼻腔单次给药(睾酮的给药量:2mg)。在鼻腔给药后的0.25、0.5、1、2、4、6、8、10和24小时,使用23g注射针和注射筒采血。每个时间点的采血量为约1ml。将采集的血液立即转移到装有肝素钠的真空采血管中,轻轻搅拌。离心分离(3000rpm,10分钟,4℃)后,采取血浆,将其冷冻保存至分析时为止。在以下分析条件下测量血浆睾酮浓度。(hplc条件)hplc:2795(waters公司制)色谱柱:chromolithperformancerp-18e(3.0mmi.d.×100mm,merck公司制)流动相a:0.005mol/l醋酸铵水溶液流动相b:甲醇柱温:45℃样品室温度:10℃注入量:10μl梯度条件:示于以下表15[表15](ms条件)ms/ms:quattroultima(waters公司制)离子化方法:esi法离子极性:正极测量离子:示于以下表16[表16]将得到的血浆睾酮浓度通过药代动力学分析软件(phoenixwinnonlin7.0版,certara合同会社制)进行分析,以计算最高血药浓度(cmax)、给药后10小时为止的血药浓度-时间曲线下面积(auc0-10hr)、外推至无限大的血药浓度-时间曲线下面积(auc0-∞)、到达最高血药浓度的时间(tmax),消除半衰期(t1/2)、血中平均滞留时间(mrt0-10hr和mrt0-∞)。另外,关于平均血药浓度(cavg),在假设每日给药2次(每10小时给药1次)的情况下,按照auc(0-10hr)/10计算。将评价所得给药制剂的药代动力学参数的结果示于以下表17,血浆睾酮浓度的经时变化示于图4。[表17]由表17和图4的结果可知,组合体积平均粒径114μm的睾酮和水溶性高分子的实施例6~8的最高血药浓度(cmax)均维持在fda的标准15ng/ml以下,并且平均血药浓度(cavg)也落在2.01~7.5ng/ml的范围。实施例9~12(1)制剂配方实施例9~12的制剂配方示于以下表18。[表18]成分(平均粒径)实施例9实施例10实施例11实施例12睾酮c分级品(114μm)2mg2mg2mg2mg羟丙基纤维素m2mg6mg10mg14mg乳糖16mg12mg8mg4mg(2)制剂化方法向睾酮c的分级品(将睾酮c通过筛分分级后测量了平均粒径的分级品:平均粒径114μm)中加入羟丙基纤维素m和乳糖并混合,将所得混合物填充入筒状装置中,制成给药制剂。(3)药代动力学评价向老年雄性狗(7只)的单侧鼻腔内插入约1cm填充有制剂的筒状装置,向鼻腔单次给药(睾酮的给药量:2mg)。在鼻腔给药后的0.25、0.5、1、2、4、6、8、10和24小时,使用23g注射针和经肝素处理的注射筒采血。每个时间点的采血量为约1ml。将采集的血液立即转移到装有肝素钠的真空采血管中,轻轻搅拌。离心分离(3000rpm,10分钟,4℃)后,采取血浆,将其冷冻保存至分析时为止。在以下分析条件下测量血浆睾酮浓度。(hplc条件)hplc:2795(waters公司制)色谱柱:chromolithperformancerp-18e(3.0mmi.d.×100mm,merck公司制)流动相a:0.005mol/l醋酸铵溶液流动相b:甲醇柱温:45℃样品室温度:10℃注入量:10μl梯度条件:示于以下表19。[表19](ms条件)ms/ms:quattroultima(waters公司制)离子化方法:esi法离子极性:正极测量离子:示于以下表20。[表20]将得到的血浆睾酮浓度通过药代动力学分析软件(phoenixwinnonlin7.0版,certara合同会社制)进行分析,以计算最高血药浓度(cmax)、给药后10小时为止的血药浓度-时间曲线下面积(auc0-10hr)、外推至无限大的血药浓度-时间曲线下面积(auc0-∞)、到达最高血药浓度的时间(tmax),消除半衰期(t1/2)、血中平均滞留时间(mrt0-10hr和mrt0-∞)。另外,关于平均血药浓度(cavg),在假设每日给药2次(每10小时给药1次)的情况下,按照auc(0-10hr)/10计算。将评价所得给药制剂的药代动力学参数的结果示于以下表21,血浆睾酮浓度的经时变化示于图5。[表21]由表21和图5的结果可知,任意配合量下的实施例的最高血药浓度(cmax)均维持在fda的标准15ng/ml以下,并且平均血药浓度(cavg)也落在2.01~7.5ng/ml的范围内。实施例13~15(1)制剂配方实施例13~15的制剂配方示于以下表22。[表22]成分(平均粒径)实施例13实施例14实施例15睾酮c分级品(114μm)2mg2mg2mg羟丙基纤维素m8mg--羟丙基纤维素h-8mg8mg乳糖--10mg(2)制剂化方法向睾酮c的分级品(将睾酮c通过筛分分级后测量了平均粒径的分级品:平均粒径114μm)中按照表22所示的比例加入羟丙基纤维素和乳糖并混合,将所得混合物填充入筒状装置中,制成给药制剂。(3)药代动力学评价向老年雄性狗(7只)的单侧鼻腔内插入约1cm填充有制剂的筒状装置,向鼻腔单次给药(睾酮的给药量:2mg)。在鼻腔给药后的0.25、0.5、1、2、4、6、8、10和24小时,使用23g注射针和注射筒采血。每个时间点的采血量为约1ml。将采集的血液立即转移到装有肝素钠的真空采血管中,轻轻搅拌。离心分离(3000rpm,10分钟,4℃)后,采取血浆,将其冷冻保存至分析时为止。在以下分析条件下测量血浆睾酮浓度。(hplc条件)hplc:2795(waters公司制)色谱柱:chromolithperformancerp-18e(3.0mmi.d.×100mm,merck公司制)流动相a:0.005mol/l醋酸铵溶液流动相b:甲醇柱温:45℃样品室温度:10℃注入量:10μl梯度条件:示于以下表23。[表23](ms条件)ms/ms:quattroultima(waters公司制)离子化方法:esi法离子极性:正极测量离子:示于以下表24。[表24]将得到的血浆睾酮浓度通过药代动力学分析软件(phoenixwinnonlin7.0版,certara合同会社制)进行分析,以计算最高血药浓度(cmax)、给药后10小时为止的血药浓度-时间曲线下面积(auc0-10hr)、外推至无限大的血药浓度-时间曲线下面积(auc0-∞)、到达最高血药浓度的时间(tmax),消除半衰期(t1/2)、血中平均滞留时间(mrt0-10hr和mrt0-∞)。另外,关于平均血药浓度(cavg),在假设每日给药2次(每10小时给药1次)的情况下,按照auc(0-10hr)/10计算。将评价所得给药制剂的药代动力学参数的结果示于以下表25,血浆睾酮浓度的经时变化示于图6。[表25]由表25和图6的结果可知,所有实施例的最高血药浓度(cmax)均维持在fda的标准15ng/ml以下,并且平均血药浓度(cavg)也落在2.01~7.5ng/ml的范围内。实施例16~21(1)制剂配方实施例16~21的制剂配方示于以下表26。[表26](2)制剂化方法向睾酮c的分级品(将睾酮c通过筛分分级后测量了平均粒径的分级品:平均粒径114μm)2mg中加入表26所示的各种水溶性高分子8mg并混合,将所得混合物填充入筒状装置中,制成给药制剂。(3)药代动力学评价向老年雄性狗(7只)的单侧鼻腔内插入约1cm填充有制剂的筒状装置,向鼻腔单次给药(睾酮的给药量:2mg)。在鼻腔给药后的0.25、0.5、1、2、4、6、8、10和24小时,使用23g注射针和注射筒采血。每个时间点的采血量为约1ml。将采集的血液立即转移到装有肝素钠的真空采血管中,轻轻搅拌。离心分离(3000rpm,10分钟,4℃)后,采取血浆,将其冷冻保存至分析时为止。在以下分析条件下测量血浆睾酮浓度。(hplc条件)hplc:2795(waters公司制)色谱柱:chromolithperformancerp-18e(3.0mmi.d.×100mm,merck公司制)流动相a:0.005mol/l醋酸铵溶液流动相b:甲醇柱温:45℃样品室温度:10℃注入量:10μl梯度条件:示于以下表27。[表27]时间(分钟)流动相a(%)流动相b(%)流量(ml/分钟)曲线(curve)0.0040600.4011.0040600.4014.0020800.4066.0010900.4066.505950.90118.5040600.4011(ms条件)ms/ms:quattroultima(waters公司制)离子化方法:esi法离子极性:正极测量离子:示于以下表28。[表28]将得到的血浆睾酮浓度通过药代动力学分析软件(phoenixwinnonlin7.0版,certara合同会社制)进行分析,以计算最高血药浓度(cmax)、给药后10小时为止的血药浓度-时间曲线下面积(auc0-10hr)、外推至无限大的血药浓度-时间曲线下面积(auc0-∞)、到达最高血药浓度的时间(tmax),消除半衰期(t1/2)、血中平均滞留时间(mrt0-10hr和mrt0-∞)。另外,关于平均血药浓度(cavg),在假设每日给药2次(每10小时给药1次)的情况下,按照auc(0-10hr)/10计算。将评价所得给药制剂的药代动力学参数的结果示于以下表29,血浆睾酮浓度的经时变化示于图7。[表29]由表29和图7的结果可知,所有实施例的最高血药浓度(cmax)均维持在fda的标准15ng/ml以下,并且平均血药浓度(cavg)也落在2.01~7.5ng/ml的范围内。实施例22~27(1)制剂配方实施例22~27的制剂配方示于以下表30。[表30](2)制剂化方法向睾酮c的粉碎品(将睾酮c在乳钵中粉碎后测量了体积平均粒径的分级品:体积平均粒径114μm)2mg中加入表30所示的各种水溶性高分子8mg并混合,将所得混合物填充入筒状装置中,制成给药制剂。(3)药代动力学评价向老年雄性狗(7只)的单侧鼻腔内插入约1cm填充有制剂的筒状装置,向鼻腔单次给药(睾酮的给药量:2mg)。在鼻腔给药后的0.25、0.5、1、2、4、6、8、10和24小时,使用23g注射针和注射筒采血。每个时间点的采血量为约1ml。将采集的血液立即转移到装有肝素钠的真空采血管中,轻轻搅拌。离心分离(3000rpm,10分钟,4℃)后,采取血浆,将其冷冻保存至分析时为止。在以下分析条件下测量血浆睾酮浓度。(hplc条件)hplc:2795(waters公司制)色谱柱:chromolithperformancerp-18e(3.0mmi.d.×100mm,merck公司制)流动相a:0.005mol/l醋酸铵溶液流动相b:甲醇柱温:45℃样品室温度:10℃注入量:10μl梯度条件:示于以下表31。[表31]时间(分钟)流动相a(%)流动相b(%)流量(ml/分钟)曲线(curve)0.0040600.4011.0040600.4014.0020800.4066.0010900.4066.505950.90118.5040600.4011(ms条件)ms/ms:quattroultima(waters公司制)离子化方法:esi法离子极性:正极测量离子:示于以下表32。[表32]将得到的血浆睾酮浓度通过药代动力学分析软件(phoenixwinnonlin7.0版,certara合同会社制)进行分析,以计算最高血药浓度(cmax)、给药后10小时为止的血药浓度-时间曲线下面积(auc0-10hr)、外推至无限大的血药浓度-时间曲线下面积(auc0-∞)、到达最高血药浓度的时间(tmax),消除半衰期(t1/2)、血中平均滞留时间(mrt0-10hr和mrt0-∞)。另外,关于平均血药浓度(cavg),在假设每日给药2次(每10小时给药1次)的情况下,按照auc(0-10hr)/10计算。将评价所得给药制剂的药代动力学参数的结果示于以下表33,血浆睾酮浓度的经时变化示于图8。[表33]由表33和图8的结果可知,这些实施例的最高血药浓度(cmax)均维持在fda的标准15ng/ml以下,并且实施例22~26的平均血药浓度(cavg)也落在2.01~7.5ng/ml的范围内。另一方面,实施例27的平均血药浓度(cavg)小于2.01ng/ml,这可能是因为水溶性高分子的粘度低。产业实用性本发明的粉末鼻腔给药制剂可以用作利用甾体激素类的各种治疗剂(loh综合征治疗药、抗癌剂、更年期疾病的治疗药、骨质疏松症的治疗药、慢性肾脏疾病的治疗药、不孕症的治疗药、月经失调的治疗药、避孕药、功能性子宫出血的治疗药、子宫内膜异位症的治疗药等),特别地,当甾体激素类为睾酮时,可有效地用作loh综合征治疗药。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1