核壳结构纤维素基益生菌微胶囊及其制备方法与流程
本发明涉及高分子材料领域,具有涉及核壳结构纤维素基益生菌微胶囊及其制备方法。
背景技术:
益生菌能有效调节肠道微生物菌群并对人类的各种疾病如炎症性肠病、肥胖、糖尿病等有显著疗效,其作为健康改良剂的应用逐渐增加。而周围环境如加工、储藏、人体消化道等严重影响益生菌活性,导致益生菌到达肠道的活菌数大大减少。微胶囊技术保护益生菌是目前国内外研究的热点,且被认为是最为高效和经济的保护益生菌活性的方法之一,它可以降低外界环境对益生菌细胞的损伤,使益生菌在加工、保存及穿过胃肠道时得到保护,提高存活率。
微胶囊技术一般是指将固体、气体、液体等微小物质,利用天然或合成的高分子材料进行涂层,通常将微胶囊外部的包埋材料称为“壁材”,把包裹在微胶囊内部的物质称作“芯材”。目前,常用的益生菌微胶囊壁材有凝胶多糖(淀粉、海藻酸盐、果胶、卡拉胶、壳聚糖等)、蛋白质(大豆蛋白、乳清蛋白、明胶等)、脂类和脂肪(植物油、石蜡等)。但有研究表明,单一的海藻酸钠作为壁材对益生菌的保护作用不明显,而壳聚糖对益生菌有一定的抑菌作用,用单一的壳聚糖包埋益生菌并不能显著提高益生菌的活性。
纤维素是自然界中分布最广、含量最多、可再生的环境友好型天然高分子化合物。目前,纤维素广泛应用于造纸、纺织、食品等领域。但是纤维素不溶于普通溶剂且表面基团单一,限制了其作为ph响应性益生菌包埋材料的应用。目前,海藻酸钠、淀粉、蛋白质等是常见的益生菌包埋材料,但是这几种壁材在益生菌包埋上有存在一定的不足,如海藻酸钠的不稳定性极大的限制了它的应用。因此,挖掘新型益生菌递送材料,利用微胶囊技术将足量益生菌递送至肠道已经成为研究热点。
技术实现要素:
本发明所要解决的技术问题是针对上述现有技术存在的不足而提供一种核壳结构纤维素基益生菌微胶囊及其制备方法,益生菌主要分布在微胶囊内核中,实现益生菌的可控量负载,且具有良好的益生菌缓释性能,实现对益生菌的有效保护与肠道靶向释放。
本方案为解决上述所提出的问题所采用的技术方案为:
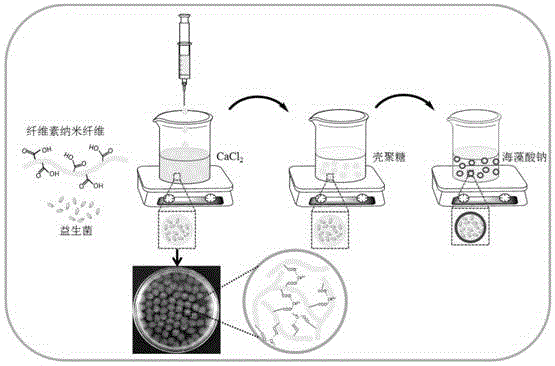
核壳结构纤维素基益生菌微胶囊,该微胶囊内核由纤维素纳米纤维(cnf)与益生菌混合物在ca2+交联作用下制备而成,再以水溶性壳聚糖和海藻酸钠为涂层,利用层层自组装技术制备得到核壳结构纤维素纳米纤维/壳聚糖/海藻酸钠益生菌微胶囊,即为核壳结构纤维素基益生菌微胶囊。
按上述方案,所述核壳结构纤维素基微胶囊的平均粒径为2~5mm。
按上述方案,所述水溶性壳聚糖的脱乙酰度大于85%。
按上述方案,纤维素纳米纤维是纤维素通过tempo(2,2,6,6-四甲基哌啶-氮-氧化物)媒介氧化体系制备得到表面富含羧基的纳米纤维素,表面羧基含量为0.1~1.6mmol/g。其中,所述纤维素的α-纤维素含量为70~90%。
本发明同时提供一种上述核壳结构纤维素基益生菌微胶囊的制备方法,主要步骤如下:
1)纤维素纳米纤维溶液与益生菌菌泥共混制备成共混溶液;
2)将步骤1)所得共混溶液滴加到cacl2溶液中进行交联,得到负载益生菌的纤维素纳米纤维内核;
3)将步骤2)所得负载益生菌的纤维素纳米纤维内核浸泡于水溶性壳聚糖溶液中进行涂覆,得到外层包覆壳聚糖的纤维素基益生菌微胶囊;
4)将步骤3)所得纤维素基载菌微胶囊浸泡于海藻酸钠溶液中进行二次涂覆,得到外层涂覆海藻酸钠与壳聚糖的核壳结构纤维素基益生菌微胶囊。
按上述方案,步骤1)中,纤维素纳米纤维溶液的浓度为0.8~3wt.%;益生菌菌泥通过离心益生菌菌液制备得到,益生菌菌液的浓度为1.0×1010~1.0×107cfu/ml。纤维素纳米纤维溶液与益生菌菌液的体积比为(1~9):1,一般通过涡旋仪混合均匀。其中,离心速度通常是3000~6000rpm,时间通常为3~10min。
按上述方案,步骤2)中,纤维素纳米纤维内核交联过程在cacl2溶液中进行,其中ca2+离子的浓度为0.5~5wt.%。
按上述方案,步骤2)中,共混溶液滴加的速度是10ml/h~30ml/h。
按上述方案,步骤3)中,水溶性壳聚糖溶液浓度为0.1~2wt.%,纤维素纳米纤维内核在水溶性壳聚糖溶液中浸泡时间为2~5min。
按上述方案,步骤4)中,海藻酸钠溶液浓度为0.1~2wt.%,步骤3)所得纤维素基载菌微胶囊在海藻酸钠溶液中浸泡时间为2~5min。
本发明所述负载益生菌的核壳结构纤维素基微胶囊在益生菌如植物乳杆菌、保加利亚乳杆菌、嗜热链球菌等的负载和/或肠道递送等方面广泛应用。
与现有技术相比,本发明的有益效果是:
(1)本发明选用tempo媒介氧化体系制备表面富含羧基且电荷量可控的的纤维素纳米纤维,纤维素纳米纤维溶液与益生菌混合物以ca2+为交联剂,采用离子交联法制备得到纤维素纳米纤维益生菌微胶囊的内核,再以水溶性壳聚糖和海藻酸钠做涂层,利用层层自组装技术制备得到核壳结构纤维素纳米纤维基益生菌微胶囊,其平均粒径为2~5mm。该方案拓展了益生菌微胶囊的构建方法,以纤维素纳米纤维作为益生菌载体构建微胶囊内核,制备过程温和,并可实现益生菌的可控量负载与肠道有效递送。其中,纤维素纳米纤维对益生菌有良好的负载作用,且可作为单一载体有效递送益生菌至肠道,实现对益生菌的保护;之后再以低浓度水溶性壳聚糖与海藻酸钠溶液做涂层,制备微胶囊外壳,相比于单一的纤维素纳米纤维载体,核壳结构微胶囊可有效避免载菌纤维素纳米纤维内核直接接触胃液,避免益生菌活性损失;且具备核壳结构的微胶囊呈现出良好的缓释性能,可确保递送足够量菌体至肠道,确保足够量益生菌在肠道发挥其生理功能。
(2)本发明所述核壳结构纤维素基益生菌微胶囊突破传统意义上微胶囊“芯材”的定义,以低浓度纤维素纳米纤维为材料负载益生菌,构建微胶囊内核即“芯材”,再涂覆壳聚糖与海藻酸钠,形成高度稳定的聚电解质复合外层,可有效避免壳聚糖对益生菌的损伤并改善单一海藻酸钠对益生菌保护效果不明显等问题。
(3)本发明所述的核壳结构纤维素基益生菌微胶囊,采用低浓度水溶性壳聚糖溶液与低浓度海藻酸钠溶液即可得到明显的核壳结构及有效的保护效果,为纤维素作为益生菌包埋和递送材料提供了新的解决方案,且属环境友好材料,可广泛应用于功能因子肠道递送领域。
(4)本发明采用tempo媒介氧化体系氧化纤维素制备得到纤维素纳米纤维,具有强亲水性及在低固体含量下形成高粘度分散体的能力,并赋予纤维素ph响应性,可生物降解,具有良好的生物相容性,且制备得到的纤维素纳米纤维表面电荷可控,且易分解。
附图说明
图1中,负载益生菌的核壳结构纤维素基微胶囊制备流程及微胶囊的宏观形貌示意图;
图2中,a,b,c分别代表实施例1~3所得负载益生菌的核壳结构纤维素基微胶囊的扫描电镜图;
图3中,cnfm,cnfm-chi,cnfm-chi-alg分别代表实施例1~3所得负载益生菌的核壳结构纤维素基微胶囊在模拟肠道中益生菌释放曲线。
具体实施方式
为了更好地理解本发明所解决的技术问题、技术方案及技术效果,以下结合实施例和附图,对本发明的内容进一步详细说明,但不应理解为对本发明的限制。
下述实施例中,所用纤维素纳米纤维均由α-纤维素含量为86%的桉木纤维素经tempo媒介氧化体系制备而成,纤维素纳米纤维表面羧基含量为1.43±0.09mmol/g。
实施例
纤维素纳米纤维/壳聚糖/海藻酸钠益生菌微胶囊,其是由纤维素纳米纤维与益生菌共混溶液,在ca2+为交联剂作用下,采用离子交联法制备得到纤维素纳米纤维益生菌微胶囊,再以脱乙酰度大于85%的水溶性壳聚糖和海藻酸钠做涂层,利用层层自组装技术制备得到核壳结构纤维素纳米纤维/壳聚糖/海藻酸钠益生菌微胶囊,平均粒径5mm,呈现出明显的核壳结构。控制益生菌载菌量为~1.0×107cfu,有效递送量为1.2×106cfu/ml。
上述纤维素纳米纤维/壳聚糖/海藻酸钠益生菌微胶囊的制备方法,具体步骤如下:
1)植物乳杆菌菌液(1ml,1×107cfu/ml)经离心(4000rpm,10min)获得的植物乳杆菌菌泥,然后与1mlcnf(1.2wt.%)溶液温和混合,得到共混溶液;
2)在磁力搅拌下,将该共混溶液以20ml/h的滴加速度逐滴滴加至2wt.%cacl2溶液(50ml)中制备纤维素纳米纤维益生菌微胶囊;
3)将微胶囊转移至0.5wt.%壳聚糖水溶液(50ml)中,温和的搅拌2min(即浸泡时间)后,将微胶囊取出并转移至无菌去离子水中清洗2min;
4)将步骤3)所得清洗过的微胶囊转移至0.5wt.%海藻酸钠溶液(50ml)中,温和搅拌2min(即浸泡时间),进行涂覆,得到纤维素纳米纤维/壳聚糖/海藻酸钠益生菌微胶囊,即为核壳结构纤维素基益生菌微胶囊,标记为cnfm-chi-alg。
对比例1
纤维素纳米纤维益生菌微胶囊,其是由纤维素纳米纤维与益生菌共混溶液,在ca2+为交联剂作用下,采用离子交联法制备得到纤维素纳米纤维益生菌微胶囊,平均粒径2mm,控制益生菌载菌量为~1.0×107cfu,有效递送量为5.2×105cfu/ml。
上述载菌纤维素纳米纤维微胶囊的制备方法,具体步骤如下:
1)植物乳杆菌菌液(1ml,1×107cfu/ml)经离心(4000rpm,10min)获得的植物乳杆菌菌泥,然后与1mlcnf(1.2wt.%)溶液温和混合,得到共混溶液;
2)在磁力搅拌下,将该共混溶液以20ml/h的滴加速度逐滴滴加至2wt.%cacl2溶液(50ml)中,制备得到纤维素纳米纤维益生菌微胶囊,标记为cnfm。
对比例2
纤维素纳米纤维/壳聚糖益生菌微胶囊,其是由纤维素纳米纤维与益生菌共混溶液,在ca2+为交联剂作用下,采用离子交联法制备得到纤维素纳米纤维益生菌微胶囊,再以脱乙酰度大于85%的水溶性壳聚糖做涂层,利用层层自组装技术制备得到核壳结构纤维素纳米纤维/壳聚糖益生菌微胶囊,平均粒径3mm,呈现出明显的核壳结构。控制益生菌载菌量为~1.0×107cfu,但对益生菌无保护效果。
上述纤维素纳米纤维/壳聚糖益生菌微胶囊的制备方法,具体步骤如下:
1)植物乳杆菌菌液(1ml,1×107cfu/ml)经离心(4000rpm,10min)获得的植物乳杆菌菌泥,然后与1mlcnf(1.2wt.%)溶液温和混合,得到共混溶液;
2)在磁力搅拌下,将该共混溶液以20ml/h的滴加速度逐滴滴加至2wt.%cacl2溶液(50ml)中制备纤维素纳米纤维益生菌微胶囊;
3)将步骤(2)所得微胶囊转移至0.5wt.%壳聚糖水溶液(50ml)中,温和地搅拌2min(即浸泡时间)后,将微胶囊取出并转移至无菌去离子水中清洗2min,得到纤维素纳米纤维/壳聚糖益生菌微胶囊,标记为cnfm-chi。
如图2所示,对比例2与实施例所得的纤维素基微胶囊均呈现出明显的核壳结构,说明通过层层自组装技术,成功构建得到核壳结构纤维素基益生菌微胶囊。
验证纤维素基益生菌微胶囊对益生菌的肠道递送功能,将载菌微胶囊在模拟胃液中浸泡2小时后转移至模拟肠液中进行释放试验。图3为对比例1-2与实施例所得纤维素基益生菌微胶囊在模拟肠道中的释放曲线,三者的负载情况不尽相同。在前30min,cnfm的释放量为1.6×105cfu/ml,远高于cnfm-chi-alg的释放量7.1×104cfu/ml,之后cnfm与cnfm-chi-alg都呈现了逐渐释放的趋势,相比前30min,cnfm中植物乳杆菌释放速度逐渐减缓,在300min时达到最大释放量,为5.2×105cfu/ml,而cnfm-chi-alg的最大释放量达到1.2×106cfu/ml。相比二者,cnfm-chi对益生菌没有明显的保护效果。因此,纤维素纳米纤维微胶囊及涂覆壳聚糖与海藻酸钠的纤维素基益生菌微胶囊可有效保护益生菌到达肠道。
以上所述仅是本发明的优选实施方式,应当指出,对于本领域的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干改进和变换,这些都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!