环孢素A在和热疗联合应用治疗宫颈癌的药物中的应用的制作方法
本发明涉及环孢素a在和热疗联合应用治疗宫颈癌的药物中的应用,属于医药领域。
背景技术:
宫颈癌是最常见的女性生殖道恶性肿瘤之一。尽管国内预防宫颈癌的疫苗已经上市,但由于价格昂贵、周期较长、远期效果未知等原因,目前国内宫颈癌的发病率仍然呈上升趋势,居高不下。每年宫颈癌新发病例和死亡人数已超过全球的1/4,其发病率和死亡率位于中国妇科恶性肿瘤的第一位,且宫颈癌的发病年龄趋于年轻化。
目前宫颈癌患者的治疗仍以手术、放疗、新辅助化疗等综合治疗为主,但术后复发率高、肿瘤恶性程度增强,化疗副作用严重、效果不好,且易出现耐药性,严重影响患者的生存及生活质量,病人的5年生存率仅为66%。因此,寻找宫颈癌新的治疗靶点和途径,是患者和临床医护人员的迫切需求。
热疗是除化疗和放疗之外有效辅助肿瘤治疗的方法之一。肿瘤热疗的原理是利用物理方法将组织加热到能杀灭肿瘤细胞的温度,达到既破坏肿瘤细胞又不损伤正常组织(正常组织细胞的温度安全界限为45℃±1℃)的一种方法。细胞在受到加热、放射线、感染等刺激时,会产生的一种保守的防御机制——热休克反应(heatshockresponse,hsr),hsr的主要特点是热休克因子(hsf1)激活后诱导热休克蛋白(heatshockprotein,hsp)的表达。hsp帮助细胞内蛋白质的正确折叠与复性,阻止蛋白质聚集变性并降解错误折叠的蛋白质,维持细胞内蛋白质的平衡,从而提高细胞的生存能力,保护机体免受应激因素损害。但在肿瘤组织内,hsf1和hsp的高表达不仅促进肿瘤细胞增殖,并且抑制其凋亡。因此,hsp有可能被开发为全新广谱的肿瘤标记物,hsf1及hsp也已成为抗肿瘤治疗的有效靶点。
由于肿瘤细胞对热的敏感性较高,因此热疗不但对肿瘤细胞有直接的细胞毒效应,还可以增强化疗、放疗的疗效,提高机体的免疫力,抑制肿瘤的转移。热疗产生的hsp可以增加体内免疫细胞对肿瘤细胞的识别能力,hsp本身作为免疫调节剂,可有效产生先天和后天免疫反应。同时,hsf1作为热休克反应的主要调控因子,不仅增加正常细胞应激状态下的生存能力,还调控多种肿瘤细胞的增殖、浸润与恶化,并且也与衰老、神经变性性疾病密切相关。因此,热疗和化疗、放疗的联合应用可以提高肿瘤细胞对药物的敏感性,显著提高病人生活质量。
环孢素a(cyclosporina,cysa)是1971年瑞士sandoz公司从真菌(tolypocladiuminflatumgams)分离提取出来的一种天然的由11个氨基酸组成的环状多肽。1976年borel等人首先发表了环孢素a具有强免疫抑制作用的报道。1978年剑桥大学的研究者在进行动物实验后开始将其应用于临床肾移植,接着用于肝、心、肺、胰腺、骨髓等器官的移植,疗效显著,明显提高病人的生存率。1983年美国食品药物管理局(fda)批准其正式注册上市。自此临床器官移植进入了一个新的“环孢素时代”。1984年cysa进入我国,形成了"环孢素a+硫唑嘌呤+激素"的三联免疫抑制方案,大大提高了移植存活率,同时也使移植术后急性排斥反应的发生率大幅下降。目前有关环孢素的研究进展主要在以下三个方面:
1、环孢素a主要用于器官或组织移植后排异反应的防治和自身免疫性疾病的治疗。cysa所产生的经典细胞内信号转导通路是其与t细胞的胞内受体亲环素(cyclophilin)结合形成复合物,抑制钙/钙调蛋白对神经钙调节磷酸酶的活化,进而阻断t细胞活化核因子(nfat)通路,最终抑制t细胞活化,发挥免疫抑制效应。
2、环孢素a在肿瘤细胞中发挥着抑制肿瘤细胞生长和诱导肿瘤细胞凋亡的双重生物学效应。手术或术后辅以化疗抑制是全球公认的各种癌症的标准疗法,但是,肿瘤固有和后天获得的多药耐药性(multidrugresistance,mdr)是化疗药物对癌症的治疗难以达到满意的治疗效果的主要原因。cysa作为第一代mdr逆转剂,联合其他多种化疗药物已取得良好的抗肿瘤效果,从而延长了患者的生命。
3、随着研究的深入,研究者发现环孢素a还具有抑制线粒体通透性转换孔的作用。cysa通过与线粒体内部的cyclophilind结合,阻断cyclophilind与线粒体内膜的结合,从而抑制线粒体通透性转换孔的开放程度。
综上所述,cysa的药理作用可能远远超过人们目前的认识,其在对于宫颈癌细胞和肿瘤的作用未见报道。
技术实现要素:
有鉴于此,本发明以子宫颈癌hela细胞为研究材料,对hela细胞进行环孢素a和热疗联合应用,通过进一步研究对各种hsp诱导的抑制作用、对hsf1磷酸化的影响、对hsf1的转录活性的作用和对肿瘤细胞的杀伤能力等内容,探讨cysa和热疗联合应用抑制肿瘤细胞生长的分子机制,明确cysa和热应激联合应用通过调节hsf1活性及抑制热休克蛋白的表达来诱导肿瘤细胞凋亡的机理。最终发现,环孢素a具有增加宫颈癌细胞对热疗敏感性的新生物学作用,从而进一步为肿瘤,尤其是多药耐药性肿瘤的临床治疗新方案的设计提供理论基础。
和热疗联合应用治疗宫颈癌的药物,其成分包括环孢素a以及一种或多种药学上可接受的药物赋形剂,药物赋形剂为助溶剂、乳化剂、增溶剂、渗透压调节剂、润滑剂、防腐剂和抗氧化剂中的一种或多种。
本发明治疗宫颈癌的药物中含有环孢素a,环孢素a具有抑制线粒体通透性转换孔的作用,通过与线粒体内部的亲环蛋白d结合,阻断亲环蛋白d与线粒体内膜的结合,从而抑制线粒体通透性转换孔的开放程度。
当细胞受到加热或蛋白毒性药物处理时,线粒体中的单链dna结合蛋白(ssbp1)从线粒体中渗漏出来之后,借助hsf1转运到细胞核内,在细胞核内,hsf1-ssbp1转录复合体不仅可以诱导细胞质与核的hsp(hsp70等)的产生,还可诱导线粒体中的hsp(hsp60、hsp10),最后维持线粒体的膜电位以提高细胞的生存率。在ssbp1从线粒体转运到细胞核的过程中,当细胞经过环孢素a和热应激处理时,由线粒体转运到细胞核内的ssbp1明显减少,是因为环孢素a和热应激的联合处理直接影响hsf1的转录活性,抑制热休克蛋白的表达,从而诱导癌细胞的凋亡。
本发明具有以下优点:
(1)服用方式简单且药效较好,随着环孢素a作用时间的延长及浓度的增加,hela细胞的增殖抑制及凋亡诱导作用增强;
(2)环孢素a和热应激的联合处理直接影响hsf1的转录活性,抑制热休克蛋白的表达,从而诱导癌细胞的凋亡,且不会对机体的其它机能造成任何损害;
(3)成本低廉,适合大规模生产。
附图说明
图1为实施例1中台盼蓝染色法检测cysa与热疗联合处理对人子宫颈癌hela细胞存活率的影响图;
图2为实施例2中mtt法检测cysa与热疗联合处理对人子宫颈癌hela细胞活力的影响图;
图3为实施例3中westernblot检测cysa与热疗联合处理对人子宫颈癌hela细胞凋亡调控蛋白表达的影响图;
图4为实施例3中westernblot检测cysa与热疗联合处理对凋亡调控蛋白bax和bcl-2表达比值的的柱状统计图;
图5为实施例3中westernblot检测cysa与热疗联合处理对凋亡调控蛋白cleavedcaspase-3表达的柱状统计图;
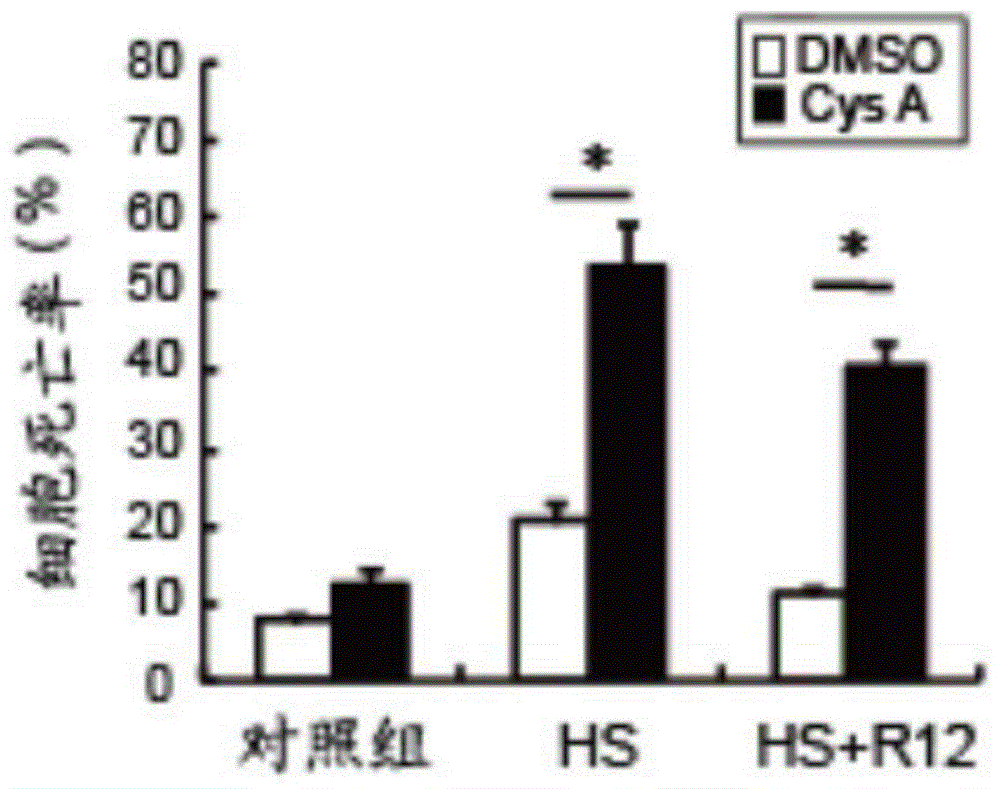
图6为实施例4中流式细胞术检测cysa与热疗联合处理对人子宫颈癌hela细胞凋亡率的影响图;
图7为实施例4中流式细胞术检测cysa与热疗联合处理对人子宫颈癌hela细胞凋亡率的柱状统计图。
具体实施方式
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
台盼蓝染色法检测cysa与热疗联合处理对人子宫颈癌hela细胞存活率的影响
实验原理
台盼蓝染料不能透过活细胞正常、完整的细胞膜,因此活细胞不着色。但死亡细胞的细胞膜通透性增加,可使染料通过细胞膜进入细胞内,使死细胞着色呈现蓝色。台盼蓝染色是最常用的检测细胞存活率的实验方法。
实验仪器与材料
细胞培养箱(thermofisher),台盼蓝染料(thermofisher),显微镜(bio-tec),胎牛血清(biologicalindustries),dmem(高糖)培养基(gibco),环孢素a(mce),6cm细胞培养皿(nest),hela细胞系(中科院上海细胞所),电热恒温水槽(dk-8d型)。
实验步骤
将hela细胞以约1.5×106个/皿的密度接种于6cm细胞培养皿,在37℃,5%co2,含10%胎牛血清的dmem高糖培养液的细胞培养箱中培养。当细胞密度达到70-80%时,加入不同用量的cysa作用于hela细胞2h,以经dmso处理的细胞为阴性对照组。将细胞用封口膜封口后放入45℃的电热恒温水浴箱加热,维持加热时间60min,继续放置37℃,5%co2细胞培养箱中培养12h。
用蛋白胰酶消化细胞后,用15ml离心管收集细胞。将收集的细胞4℃,1000-2000g离心1min。弃上清,用1mlpbs重悬细胞。吸取100μl重悬的细胞到1.5ml离心管内,加入100μl台盼蓝染色液,轻轻混匀,染色3min。吸取少量染色的细胞,用血细胞计数板计数。每个细胞样品至少数500个细胞,数出蓝色细胞和细胞总数,计算hela细胞存活率,结果如图1所示。
细胞存活率按下式计算:(细胞总数-蓝色细胞数)/细胞总数×100%;数据统计以均数±标准差(x±s)表示,采用t检验。
由图1可知,随着cysa用量的增加,hela细胞的存活率逐渐降低。结果说明cysa与热疗联合处理可以显著降低宫颈癌细胞的存活率。
实施例2
mtt法检测cysa与热疗联合处理对人子宫颈癌hela细胞活力的影响
实验原理
检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2h-四氮唑溴盐(mtt)还原为水不溶性的蓝紫色结晶甲瓒(formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(dmso)能溶解细胞中的甲瓒,用酶标仪在490nm波长处测定其光吸收值,mtt结晶形成的量与细胞数成正比。根据测得的吸光度值(od值),来判断活细胞数量,od值越大,细胞活性越强。mtt法是一种快速,简便的能够半自动化定量分析细胞增殖及药物细胞毒作用的方法。
实验仪器与材料
细胞培养箱(thermofisher),elx-800酶标仪(bio-tec),胎牛血清(biologicalindustries),dmem(高糖)培养基(gibco),mtt(sigma),dmso(amresco),环孢素a(mce),96孔细胞培养板(nest),hela细胞系(中科院上海细胞所),电热恒温水槽(dk-8d型)。
实验步骤
将hela细胞以约10000个/孔的密度接种于96孔板,在37℃,5%co2,含10%胎牛血清的dmem高糖培养液的细胞培养箱中培养。当细胞密度达到70-80%时,加入不同用量的cysa作用于hela细胞2h,以经dmso处理的细胞为阴性对照组,每种细胞设三个复孔。将细胞用封口膜封口后放入45℃的电热恒温水浴箱加热,维持加热时间60min,继续放置37℃,5%co2细胞培养箱中培养12h。
每孔加入含终浓度5mg/mlmtt培养液100μl,继续培养4h后吸去培养液,每孔加入dmso溶液100μl,吸打溶解紫色结晶,置于振荡培养箱中震荡培养10分钟,到结晶紫充分溶解,酶标仪490nm处测定吸光度,计算细胞增殖抑制率,结果如图2所示。
细胞增殖抑制率按下式计算:(1-细胞存活率=1-实验组od值/空白对照组od值)×100%;数据统计以均数±标准差(x±s)表示,采用t检验。
由图2可知,随着cysa用量的增加,hela细胞的增殖抑制作用增强。结果说明cysa与热疗联合处理可以显著降低宫颈癌细胞的生存率。
实施例3
westernblot检测cysa与热疗联合处理对人子宫颈癌hela细胞凋亡调控蛋白表达的影响
实验原理
westernblot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。sds-page可对蛋白质样品进行分离,转移到固相载体——例如聚偏二氟乙烯膜(pvdf)上。固相载体可以吸附蛋白质,并保持电泳分离的多肽类型及其生物学活性不变。转移后的pvdf膜就称为一个印迹(blot),用蛋白溶液(如5%脱脂奶粉溶液)处理,封闭pvdf膜上的疏水结合位点。用目标蛋白的抗体(一抗)处理pvdf膜——只有待研究的蛋白质才能与一抗特异结合形成抗原抗体复合物,这样清洗除去未结合的一抗后,只有在目标蛋白的位置上结合着一抗。用一抗处理过的pvdf膜再用标记的二抗处理,二抗是指一抗的抗体,如一抗是从鼠中获得的,则二抗就是抗鼠igg的抗体。处理后,带有标记的二抗与一抗结合形成抗体复合物可以指示一抗的位置,即是待研究的蛋白质的位置。
实验仪器与材料
细胞培养箱(thermofisher),基础电泳仪电源(bio-rad),电泳仪(六一),转印槽(bio-rad),胎牛血清(biologicalindustries),dmem(高糖)培养基(gibco),dmso(amresco),环孢素a(mce),6cm细胞培养皿(nest),hela细胞系(中科院上海细胞所),电热恒温水槽(dk-8d型),pvdf膜(rocheappliedscience),bax(50599-2-ig,proteintech),bcl-2(12789-1-ap,proteintech),cleavedcaspase-3(9661,cst)和β-actin(20536-1-ap,proteintech),兔二抗gtanti-rb/hrp(kirkegard&perrylaboratories)。
实验步骤
将hela细胞以约1.0×106个/皿的密度接种于6cm细胞培养皿,在37℃,5%co2,含10%胎牛血清的dmem高糖培养液中培养。当细胞密度达到70-80%时,加入不同用量的cysa作用于hela细胞2h,以经dmso处理的细胞为阴性对照组,每种细胞设三个复孔。将细胞用封口膜封口后放入45℃的电热恒温水浴箱加热,维持加热时间60min,继续放置37℃,5%co2细胞培养箱中培养12h。
收集人子宫颈癌hela细胞后提取总蛋白,进行十二烷基磺酸钠-聚丙烯酰胺(sds-page)电泳分离,然后转印蛋白至聚偏二氟乙烯(pvdf)膜上,5%脱脂奶粉封闭1h后,4℃孵育一抗过夜,检测细胞周期调控相关蛋白bax、bcl-2和cleavedcaspase-3的变化情况,采用β-actin作为内参,以tbst漂洗后加入二抗常温孵育1h后,再经tbst洗涤3次,最后使用化学发光剂ecl发光液显色,在化学发光成像系统中显影,结果如图3-5。
由图3-5可知,cysa与热疗联合处理可显著增高细胞促凋亡蛋白bax、和cleavedcaspase-3的表达,并降低凋亡抑制蛋白bcl-2的表达。以上结果证明,cysa与热疗联合处理能够通过诱导凋亡相关蛋白的表达来抑制宫颈癌细胞的增殖。
实施例4
流式细胞术检测cysa与热疗联合处理对人子宫颈癌hela细胞凋亡率的影响
实验原理
细胞凋亡是指细胞为维持内环境的稳定,有基因控制的细胞自主、有序的死亡模式。细胞凋亡是细胞的一种基本生物学现象,在生物体的进化、内环境的稳定及抑制肿瘤增殖、恶化等过程中起着重要作用。细胞凋亡是一件主动过程,涉及一系列基因的激活、表达及调控等作用,如bcl-2家族、caspase家族、抑癌基因p53等。
annexinv-fitc细胞凋亡检测试剂盒是用fitc标记的重组人annexinv来检测细胞凋亡时出现在细胞膜表面的磷脂酰丝氨酸的一种细胞凋亡试剂盒。annexinv是一类广泛分布于真核细胞细胞浆内钙离子依赖的磷脂结合蛋白,参与细胞内的信号转导。annexinv选择性结合磷脂酰丝氨酸(phosphatidylserin,ps)。ps主要分布于细胞膜内侧,即与细胞浆相邻的一侧。在细胞发生凋亡的早期,不同类型的细胞都会把ps外翻到细胞表面,即细胞膜外侧。ps暴露到细胞表面后会促进凝血和炎症反应。而annexinv和外翻到细胞表面的ps结合后,可以阻断ps的促凝血和促炎症反应活性。用带有绿色荧光的荧光探针fitc标记的annexinv,即annexinv-fitc,就可以用流式细胞仪或荧光显微镜方便而直接地检测到ps的外翻这一细胞凋亡的重要特征。碘化丙啶(propidiumiodide,pi)是一种核酸染料。它不能透过完整的细胞膜,但可以染色坏色细胞或凋亡晚期丧失细胞膜完整性的细胞,呈现红色荧光。对于坏死细胞,由于细胞膜的完整性已经丧失,annexinv-fitc可以进入到细胞浆内,与位于细胞膜内测的ps结合,从而也使坏死细胞呈现绿色荧光。因此将annexinv与pi匹配使用,可将处于不同凋亡时期的细胞区分开来。
实验仪器与材料
细胞培养箱(thermofisher),流式细胞仪facscalibur(bd),annexinv-fitc细胞凋亡检测试剂盒(annexinv-fitcapoptosisdetectionkit)(bd),rnasea(solarbio),胎牛血清(biologicalindustries),dmem(高糖)培养基(gibco),dmso(amresco),环孢素a(mce),6cm细胞培养皿(nest),hela细胞系(中科院上海细胞所),电热恒温水槽(dk-8d型)。
实验步骤
将hela细胞以约1.0×106个/板的密度接种于6cm细胞培养皿,在37℃,5%co2,含10%胎牛血清的dmem高糖培养液中培养。当细胞密度达到70-80%时,加入不同用量的cysa作用于hela细胞2h,以经dmso处理的细胞为阴性对照组,每种细胞设三个复孔。将细胞用封口膜封口后放入45℃的电热恒温水浴箱加热,维持加热时间60min,继续放置37℃,5%co2细胞培养箱中培养12h。
流式细胞仪检测细胞周期分布情况:收集培养皿中全部hela细胞,包括贴壁的活细胞及漂浮的死细胞,4℃条件下1500rpm离心5min,再将hela细胞用pbs轻柔洗涤2-3次,并进行细胞计数,4℃1500rpm离心5min,弃上清液后收集1-5×105个细胞。加入500μlbindingbuffer重悬细胞。加入5μlannexinv-fitc混匀后,加入10μlpropidiumiodide混匀,室温避光反应5-15min。在1h内用流式细胞仪检测,annexinv-fitc荧光信号通过fl1通道检测,propidiumiodide荧光信号通过fl2或fl3通道检测。每次检测时同时设置annexinv-fitc单阳性管、propidiumiodide(pi)单阳性管,用于确定荧光补偿数值及十字象限门的位置。染色后的细胞悬液用滤网过滤并收集至流式细胞仪检测管,启动流式细胞仪进行检测时,每例标本至少要检测10,000个细胞,获得数据后由系统自带的cellquest软件并结合另一流式细胞仪分析软件flowjo计算分析细胞凋亡分布情况,并绘制细胞凋亡分布图,结果如图6-7所示。
由图6-7可知,cysa与热疗联合处理后,细胞早期和晚期凋亡均显著增加。试验结果说明,cysa与热疗联合处理能显著诱导宫颈癌细胞凋亡。
- 还没有人留言评论。精彩留言会获得点赞!