使用甲基纳曲酮口服组合物治疗和预防阿片类诱发型便秘的方法与流程
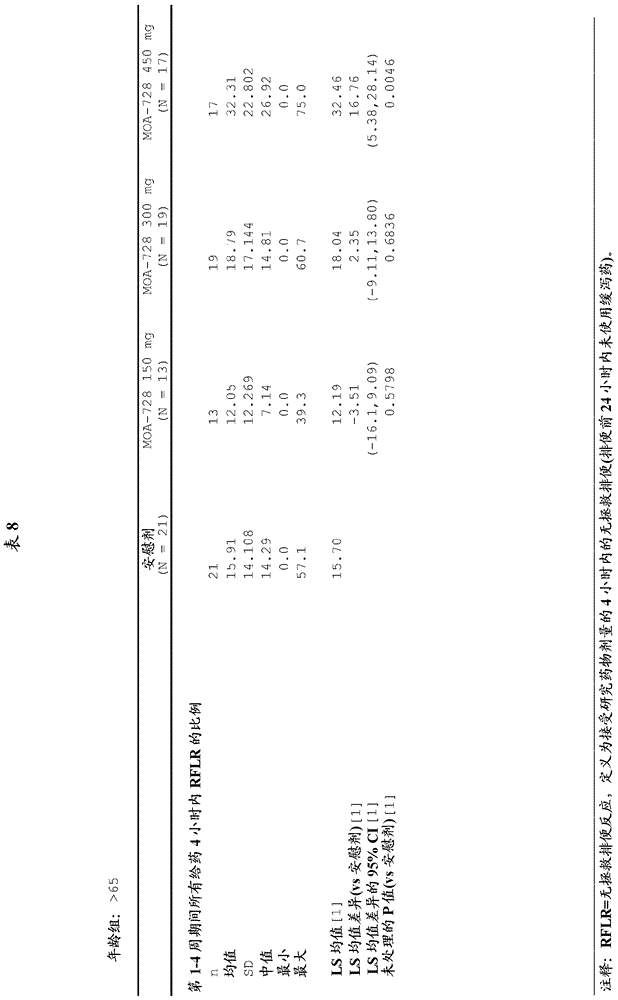
相关申请本申请要求于2011年12月19日申请的美国临时申请号61/577654的权益,所述申请的全部内容都通过引用结合到本文中。背景阿片类广泛用于治疗疼痛患者。这样的患者包括晚期癌症和其它晚期疾病的患者,以及慢性非恶性疼痛和急性非恶性疼痛的患者。阿片类是麻醉药品,其激活位于中枢神经系统的阿片类受体以减轻疼痛。然而,阿片类也与中枢神经系统之外的受体反应,产生副作用,包括便秘、恶心、呕吐、尿潴留和严重瘙痒。值得注意的是阿片类在胃肠(gi)道中的作用,在其中这些药物抑制胃排空和肠管中的蠕动,从而降低肠内运输速率并引起便秘。由于这些不希望的副作用(这些副作用可使患者虚弱,并且常常使患者拒绝使用阿片类镇痛药),所以阿片类在治疗疼痛中的使用经常受到限制。除了外源性阿片类诱发的副作用之外,研究表明,内源性阿片类和阿片类受体也可影响胃肠(gi)道,并且可以参与肠道活动和液体的粘膜运输的正常调节。因此,内源性阿片类和/或受体活性的异常生理水平也可导致肠功能障碍。例如,已经经历手术过程(特别是腹部手术)的患者,常常患有特定的肠功能障碍,被称为术后肠梗阻,这可能由天然的阿片类水平的波动所引起。类似地,最近生育的女性通常患有产后肠梗阻,这可能由类似的天然阿片类水平的波动(由于分娩应激造成)所引起。与术后或产后肠梗阻相关的胃肠功能障碍可以典型地持续3至5天,一些严重的病例持续超过一周。手术之后将阿片类给予患者以治疗疼痛(现在这几乎是普遍的惯例)可加重肠功能障碍,由此延迟正常肠功能的恢复,延长住院时间以及增加医疗护理成本。阿片类受体拮抗剂如纳洛酮、纳曲酮和纳美芬,已经被研究作为拮抗阿片类的不良外周副作用的一种方式。然而,这些试剂不仅作用于外周阿片类受体,而且作用于中枢神经系统的阿片类受体,有时逆转阿片类的有益且期望的镇痛作用,或引起阿片类戒断的症状。用于控制阿片类诱发的副作用的优选办法包括给予不容易穿过血脑屏障的外周作用的阿片类受体拮抗剂。自从1970年代晚期以来,已经研究了外周μ阿片类受体拮抗剂甲基纳曲酮。它已经被用于患者以降低阿片类诱发的副作用,如便秘、瘙痒、恶心和尿潴留(参见例如,美国专利5,972,954、5,102,887、4,861,781和4,719,215;以及yuan等人,drugandalcoholdependence1998,52,161)。在这些研究中最经常使用的甲基纳曲酮的剂型是用于静脉注射的甲基纳曲酮的溶液。概述本文给出的是通过给予甲基纳曲酮口服组合物来治疗或预防阿片类诱发型便秘的方法。本发明至少部分地基于对所述治疗特别敏感的患者和所述口服组合物的最佳剂量的鉴定,以治疗或预防阿片类诱发型便秘,并且还尽可能地降低与所述治疗相关的不良事件发生率。因此,本文给出的是治疗患有阿片类诱发型便秘的患者的方法,包括口服给予所述患者包含式(i)的盐的药物组合物:其中a-是两亲性药学上可接受的赋形剂的阴离子,其中所述药物组合物的给予导致无拯救排便(rescuefreebowelmovement);由此治疗所述患者。另一方面,本文提供的是预防患者以免患有阿片类诱发型便秘的方法,包括口服给予所述患者包含式(i)的盐的药物组合物:其中a-是两亲性药学上可接受的赋形剂的阴离子,由此预防所述患者以免患有阿片类诱发型便秘。在一个实施方案中,a-是十二烷基(月桂基)硫酸钠。在另一个实施方案中,所述药物组合物包含第一种盐和第二种盐的组合,所述第一种盐包含甲基纳曲酮和溴离子,所述第二种盐包含甲基纳曲酮和十二烷基(月桂基)硫酸钠。在另一个实施方案中,所述药物组合物包含大约150mg甲基纳曲酮或其盐。在另一个实施方案中,所述药物组合物进一步包含选自以下的至少一种试剂:碳酸氢钠、微晶纤维素、交聚维酮、聚山梨酯80、脱水乙二胺四乙酸二钠钙(edetatecalciumdisodiumdehydrate)、硅化微晶纤维素、滑石粉、胶态二氧化硅、硬脂酸镁及其组合。在另一个实施方案中,所述药物组合物是片剂。在一个实施方案中,所述方法包括口服给予大约150mg甲基纳曲酮或其盐。在一个相关实施方案中,以包含大约150mg甲基纳曲酮的一个片剂给予所述大约150mg甲基纳曲酮。在一个实施方案中,所述方法包括口服给予大约300mg甲基纳曲酮或其盐。在一个相关实施方案中,以每片包含大约150mg甲基纳曲酮的两个片剂给予所述大约300mg甲基纳曲酮。在一个实施方案中,所述方法包括口服给予大约450mg甲基纳曲酮或其盐。在一个实施方案中,以每片包含大约150mg甲基纳曲酮的三个片剂给予所述大约450mg甲基纳曲酮。在一个实施方案中,所述患者患有慢性非恶性疼痛。在另一个实施方案中,在给予所述药物组合物之前,所述患者已经患有慢性非恶性疼痛至少2个月。在一个实施方案中,在给予所述药物组合物之前,所述患者已经接受阿片类治疗。在一个相关实施方案中,所述患者已经接受阿片类治疗至少一个月。在另一个实施方案中,所述患者已经接受包括每天至少50mg口服吗啡当量的阿片类治疗至少14天。在一个实施方案中,所述患者将在小于1、2、3或4周内开始阿片类治疗。在一个实施方案中,所述患者已经患有阿片类诱发型便秘至少30天。在另一个实施方案中,所述患者在至少连续4周内已经经历每周少于3次无拯救排便。在一个实施方案中,所述患者已经经历排便费力。在另一个实施方案中,所述患者已经经历排便不尽。在一个实施方案中,所述患者已经经历了对于至少25%的无拯救排便为布里斯托尔粪便量表(bristolstoolformscale)1或2型。在一个实施方案中,所述方法在给予所述药物组合物4小时内导致无拯救排便。在另一个实施方案中,与给予所述药物组合物之前的每周无拯救排便次数相比,所述方法导致每周增加了至少一次无拯救排便。在另一个实施方案中,所述方法导致每周增加了至少2、3、4或5次无拯救排便。在另一个实施方案中,所述方法导致对于每天给予所述药物组合物的前4周的每一周,每周增加了至少一次无拯救排便。在另一个实施方案中,所述患者在每天给予所述药物组合物的前4周的每一周经历了至少3次无拯救排便;和与给予所述药物组合物之前的每周无拯救排便次数相比,对于每天给药的前4周的至少3周,所述患者经历了每周增加至少一次无拯救排便。另一方面,本文提供的是在患有阿片类诱发型便秘的患者中引起无拯救排便的方法,包括口服给予所述患者包含式(i)的盐的药物组合物:其中a-是两亲性药学上可接受的赋形剂的阴离子,由此引起无拯救排便。在一个实施方案中,所述方法在给药4小时内引起无拯救排便。另一方面,本文提供的是增加患者经历的无拯救排便次数的方法,包括口服给予所述患者包含式(i)的盐的药物组合物:其中a-是两亲性药学上可接受的赋形剂的阴离子,由此增加所述患者经历的无拯救排便次数。在一个实施方案中,在至少4周内,每天至少一次地给予所述患者所述药物组合物。在另一个实施方案中,所述患者经历了在4周中的至少3周内增加了至少一次无拯救排便和其中所述患者在4周中的每一周内经历了至少3次无拯救排便。在一个实施方案中,与给药之前所述患者经历的无拯救排便次数相比,无拯救排便次数在4周中的每一周都增加。另一方面,本文提供的是本文公开的药物组合物在治疗患有阿片类诱发型便秘的患者中的疗效评价方法,包括口服给予所述患者包含式(i)的盐的药物组合物:其中a-是两亲性药学上可接受的赋形剂的阴离子,其中以下的至少一项表明了所述药物组合物的疗效:(i)在给予所述药物组合物4小时内的无拯救排便;(ii)与每天给予所述药物组合物之前的每周无拯救排便次数相比,每天给予所述药物组合物时的每周无拯救排便次数增加;或(iii)在每天给药的前4周的至少3周内,与给予所述药物组合物之前的每周无拯救排便次数相比,每天给予所述药物组合物时的每周无拯救排便次数增加;和对于每天给药的前4周,每周至少3次无拯救排便。另一方面,本文提供的是用于治疗患有阿片类诱发型便秘的患者的方法,包括鉴定所述患者是否:(i)患有慢性非恶性疼痛;(ii)已经患有慢性非恶性疼痛至少2个月;(iii)已经接受阿片类治疗;(iv)已经接受阿片类治疗至少一个月;(v)已经接受包括每天至少50mg口服吗啡当量的阿片类治疗至少14天;(vi)患有阿片类诱发型便秘;(vii)已经患有阿片类诱发型便秘至少30天;(viii)已经具有每周少于3次无拯救排便至少连续4周;(ix)已经经历了排便费力;(x)已经经历了排便不尽;(xi)已经经历了对于至少25%的无拯救排便为布里斯托尔粪便量表1或2型;(xii)在开始阿片类治疗之前没有慢性便秘史;或(xiii)(i)-(xii)的任意组合;和口服给予所述患者包含式(i)的盐的药物组合物:其中a-是两亲性药学上可接受的赋形剂的阴离子,其中所述患者表现出(i)-(x)中的任一项。另一方面,本文提供的是降低与阿片类诱发型便秘治疗相关的不良事件发生率的方法,包括口服给予所述患者包含式(i)的盐的药物组合物:i其中a-是两亲性药学上可接受的赋形剂的阴离子,其中与不含两亲性药学上可接受的赋形剂的阴离子的药物组合物相比,所述药物组合物降低不良事件发生率。在一个实施方案中,a-是十二烷基(月桂基)硫酸钠。在另一个实施方案中,所述药物组合物包含第一种盐和第二种盐的组合,所述第一种盐包含甲基纳曲酮和溴离子,所述第二种盐包含甲基纳曲酮和十二烷基(月桂基)硫酸钠。在一个实施方案中,所述药物组合物包含大约150mg甲基纳曲酮或其盐。在另一个实施方案中,所述药物组合物进一步包含选自以下的至少一种试剂:碳酸氢钠、微晶纤维素、交聚维酮、聚山梨酯80、脱水乙二胺四乙酸二钠钙、硅化微晶纤维素、滑石粉、胶态二氧化硅、硬脂酸镁及其组合。在另一个实施方案中,所述药物组合物是片剂。在一个实施方案中,所述方法包括口服给予大约150mg甲基纳曲酮或其盐。在一个相关实施方案中,以包含大约150mg甲基纳曲酮的一个片剂给予所述大约150mg甲基纳曲酮。在一个实施方案中,所述方法包括口服给予大约300mg甲基纳曲酮或其盐。在一个相关实施方案中,以每片包含大约150mg甲基纳曲酮的两个片剂给予所述大约300mg甲基纳曲酮。在一个实施方案中,所述方法包括口服给予大约450mg甲基纳曲酮或其盐。在一个实施方案中,以每片包含大约150mg甲基纳曲酮的三个片剂给予所述大约450mg甲基纳曲酮。另一方面,本文提供的是治疗患有阿片类诱发型便秘的患者的方法,包括以下步骤:(a)口服给予所述患者包含大约150mg甲基纳曲酮或其盐和十二烷基(月桂基)硫酸钠的药物组合物;(b)确定所述组合物是否治疗所述患者,其中选自(i)-(iii)的至少一种反应表明所述组合物治疗所述患者:(i)在给予所述药物组合物4小时内的无拯救排便;(ii)与每天给予所述药物组合物之前的每周无拯救排便次数相比,每天给予所述药物组合物时的每周无拯救排便次数增加;或(iii)在每天给药的前4周的至少3周中,与给予所述药物组合物之前的每周无拯救排便次数相比,每天给予所述药物组合物时的每周无拯救排便次数增加;和对于每天给药的前4周,每周至少3次无拯救排便;(c)如果步骤(a)之后所述患者未表现出选自(b)(i)-(iii)的反应,则口服给予包含300mg或450mg甲基纳曲酮或其盐和十二烷基(月桂基)硫酸钠的药物组合物。另一方面,本文提供的是治疗患有阿片类诱发型便秘的患者的方法,包括口服给予包含甲基纳曲酮或其盐的药物组合物,其中所述药物组合物包含式(i)的盐:其中a-是两亲性药学上可接受的赋形剂的阴离子,其中所述组合物提供范围为大约300mg至大约400mg甲基纳曲酮或其盐的剂量;其中(i)所述方法导致在给予所述药物组合物4小时内的无拯救排便;和(ii)以每天给药,结果可持续至少4周。在一个实施方案中,所述方法进一步提供所述患者(i)在每天给予所述药物组合物的4周的至少3周,每周至少3次无拯救排便;和(ii)与给予所述药物组合物之前的每周无拯救排便次数相比,所述患者经历了每周增加至少一次无拯救排便。另一方面,本文提供的是在患者中增加mntx及其代谢物的生物利用度的方法,包括将mntx口服给予患者。在一个实施方案中,口服给予mntx1-7天。在一个实施方案中,口服给予mntx1-28天。在一个实施方案中,与经由皮下注射给予较少量的mntx的患者的auc和cmax相比,在患者中的一种或多种mntx及其代谢物的auc和cmax是增加的。在一个实施方案中,对于mntx、m2、m4或m5中的一种或多种,与经由皮下注射给予较少量的mntx的患者相比,经口服给予的mntx具有较高的积累值(accumulationvalue)。在一个实施方案中,对于mntx,口服给药后的积累值包含大约1.20。在一个实施方案中,对于m2,口服给药后的积累值包含大约1.30。在一个实施方案中,对于m4,口服给药后的积累值包含大约1.62。在一个实施方案中,对于m5,口服给药后的积累值包含大约1.76。在一个实施方案中,口服给药后的积累值包含:对于mntx大约1.20,对于m2为大约1.30,对于m4为大约1.62和对于m5为大约1.76。另一方面,本文提供的是增加mntx的生物利用度的方法,包括在不伴随食物时将mntx给予有需要的患者。在一个实施方案中,每天一次经口服给予mntx450mg。在一个实施方案中,以3x150mg片剂给予mntx。在一个实施方案中,在所述患者的上一餐之后至少大约10小时给予mntx。在一个实施方案中,所述患者被确认为在10小时内未进餐。在一个实施方案中,在所述患者的下一餐之前至少大约4小时给予mntx。在一个实施方案中,指示所述患者在给予mntx之前至少大约10小时和之后大约4小时避免高脂肪和/或高热量饮食。在一个实施方案中,伴随食物的给药显著地延迟mntx吸收。在一个实施方案中,与伴随食物时服用mntx相比,在不伴随食物时服用mntx增加了系统吸收达二分之一至四分之三。在一个实施方案中,与伴随食物时服用mntx相比,在不伴随食物时服用mntx降低了tmax大约35%至60%。在一个实施方案中,与伴随食物时服用mntx相比,在不伴随食物时服用mntx增加了cmax达1至3倍。在一个实施方案中,与伴随食物时服用mntx相比,在不伴随食物时服用mntx增加了auc达1至3倍。另一方面,本文提供的是增加mntx的排便效果的方法,包括在不伴随食物时将mntx给予有需要的患者。在一个实施方案中,每天一次经口服给予450mgmntx。在一个实施方案中,以3x150mg片剂给予mntx。在一个实施方案中,在所述患者的上一餐之后至少大约10小时给予mntx。在一个实施方案中,在所述患者的下一餐之前至少大约4小时给予mntx。在一个实施方案中,指示所述患者在给予mntx之前至少大约10小时和之后大约4小时避免高脂肪和/或高热量饮食。在一个实施方案中,所述患者被确认为在10小时内未进餐。附图简述图1显示了与mntx3356制剂相比,依照实施例1,在给予研究药物(mntx3201)的前4周内的所有剂量的4小时内,每个患者的无拯救排便的平均比例。图2显示了与mntx3356制剂相比,依照实施例1,在第一剂研究药物(mntx3201)之后至无拯救排便的时间的卡普兰-迈耶曲线。图3显示了与3200a3-2201-us口服irtab、3200a3-2202-ww口服ircap、和3200a3-200-ww口服胶囊剂相比,依照实施例1,在给予研究药物(mntx3201)的前4周内的所有剂量的4小时内,每个患者的无拯救排便的平均比例。图4a、4b和4c显示了分别与3200a3-2201-us口服irtab(图4a)、3200a3-2202-ww口服ircap(图4b)和3200a3-200-ww口服胶囊剂(图4a)的每一种相比,依照实施例1,在第一剂研究药物(mntx3201)之后至无拯救排便的时间的卡普兰-迈耶曲线。图5(表1)提供了对于如实施例1所示纳入研究中的患者而言,对患者的处置概述,例如无资格、违反方案等。图6(表2)提供了如实施例1所示纳入研究中的所有患者的人口统计资料。图7(表3)提供了纳入研究中的所有患者的基线疾病特征。具体地讲,图7提供了患者所经历的非恶性慢性疼痛的性质、每个患者的每周无拯救排便的平均次数、和具有每周少于3次无拯救排便的患者的平均数量。图8(表4)提供了主要疗效终点的相关数据,即在如实施例1所示研究的前4周期间所有剂量的4小时内每个患者的无拯救排便的平均比例。图9(表5)提供了男性患者特异性的主要疗效终点的相关数据,即在如实施例1所示研究的前4周期间所有剂量的4小时内每个男性患者的无拯救排便的平均比例。图10(表6)提供了女性患者特异性的主要疗效终点的相关数据,即在如实施例1所示研究的前4周期间所有剂量的4小时内每个女性患者的无拯救排便的平均比例。图11(表7)提供了65岁或以下的患者特异性的主要疗效终点的相关数据,即在如实施例1所示研究的前4周期间所有剂量的4小时内65岁或以下的每个患者的无拯救排便的平均比例。图12(表8)提供了超过65岁的患者特异性的主要疗效终点的相关数据,即在如实施例1所示研究的前4周期间所有剂量的4小时内超过65岁的每个患者的无拯救排便的平均比例。图13(表9)提供了体重小于86kg的患者特异性的主要疗效终点的相关数据,即在如实施例1所示研究的前4周期间所有剂量的4小时内体重小于86kg的每个患者的无拯救排便的平均比例。图14(表10)提供了体重为86kg或以上的患者特异性的主要疗效终点的相关数据,即在如实施例1所示研究的前4周期间所有剂量的4小时内体重为86kg或以上的每个患者的无拯救排便的平均比例。图15(表11)提供了每周具有少于3次无拯救排便的患者特异性的主要疗效终点的相关数据,即在如实施例1所示研究的前4周期间所有剂量的4小时内每周具有少于3次无拯救排便的每个患者的无拯救排便的平均比例。图16(表12)提供了每周具有3次或以上的无拯救排便的患者特异性的主要疗效终点的相关数据,即在如实施例1所示研究的前4周期间所有剂量的4小时内每周具有3次或以上的无拯救排便的每个患者的无拯救排便的平均比例。图17(表13)提供了布里斯托尔粪便量表评分小于3的患者特异性的主要疗效终点的相关数据,即在如实施例1所示研究的前4周期间所有剂量的4小时内,布里斯托尔粪便量表评分小于3的每个患者的无拯救排便的平均比例。图18(表14)提供了一个关键次要疗效终点的相关数据,即在如实施例1所示研究的前4周,每周无拯救排便次数自基线的变化。图19(表15)提供了另一个关键次要疗效终点的相关数据,即对研究药物有反应的患者比例,其中有反应定义为对于实施例1所示研究的4周中的每一周,每周具有至少3次无拯救排便,以及对于所述研究的前4周中的至少3周,比基线增加至少一次无拯救排便。图20(表16)提供了次要疗效终点的相关数据,即如实施例1所示的第一剂研究药物的4小时内无拯救排便的患者比例。图21(表17)概述了实施例1中所示的所有患者中发生的不良事件。图22(表18)概述了实施例1中所示的所有患者中发生的按照系统器官分类的严重不良事件。图23(表19)概述了实施例1中所示的所有患者中发生的按照系统器官分类的不良事件。图24(表20)概述了如实施例中所示的临床上重要的ecg结果。图25是甲基纳曲酮(mntx)在人体内的代谢途径示意图。图26是显示在禁食和喂食条件下给予单次口服450mg(3x150mg)片剂后的mntx平均血浆浓度与时间概况的图。图27是显示在给予单次口服150mg、300mg或450mg片剂和单次皮下12mg注射后的平均mntx血浆浓度与时间概况的图。药代动力学群体以半对数标度给出。本发明某些实施方案的详述本文给出的是通过给予甲基纳曲酮口服制剂来治疗阿片类诱发型便秘的方法的鉴定,所述制剂为例如包含甲基纳曲酮的盐的制剂,其包含两亲性药学上可接受的赋形剂的阴离子。此外,本文给出的是在患者中每天口服给予150mg、300mg或450mg甲基纳曲酮(例如包含溴化甲基纳曲酮和十二烷基(月桂基)硫酸钠的组合物)有效治疗或预防阿片类诱发型便秘而不引起不良事件的鉴定。除非本文另有说明,否则本文所用的科技术语将具有本领域普通技术人员通常理解的含义。这些术语的含义和范围应当是清楚的,然而,在任何可能的含糊的情况下,本文提供的定义采用超过任何词典或外来定义的先例。此外,除非上下文另有需要,否则单数术语将包括复数,复数术语将包括单数。在本申请中,“或”的使用是指“和/或”,除非另有说明。此外,术语“包括”以及该术语的其它形式例如“包含”的使用并非限制性的。定义如本文所用的术语“便秘”,是指患者排便频率低或排便过程痛苦和/或困难的病况。经历便秘的患者通常排便费力和/或排便后有排便不尽感。在一个具体的实施方案中,便秘是指经历每周平均小于三(3)次无拯救排便(rfbm)的患者,其中“无拯救排便(rescuefreebowelmovement)”是指粪便的通过和排泄,或排便。如本文所用,术语“阿片类诱发型便秘”(oic)是指患有阿片类治疗所致的便秘的患者。例如,患者可患有用以下阿片类治疗所致的阿片类诱发型便秘:阿芬太尼、阿尼利定、阿西马朵林、布马佐辛、丁丙诺啡(burprenorphine)、布托啡诺、可待因、地佐辛、二乙酰吗啡(海洛因)、二氢可待因、地芬诺酯、非多托秦、芬太尼、funaltrexamine、氢可酮、氢化吗啡酮、左洛啡烷、左醋美沙朵、左啡诺、洛哌丁胺、度冷丁(哌替啶)、美沙酮、吗啡、吗啡-6-葡萄糖醛酸苷、纳布酚、烯丙吗啡、鸦片(opium)、氧可酮、羟吗啡酮、喷他佐辛、丙吡胺、丙氧酚、瑞芬太尼(remifentanyl)、舒芬太尼、痛立定、曲美布汀和/或曲马多。如本文所用,甲基纳曲酮口服组合物的“有效量”是指治疗或预防阿片类诱发型便秘的一种或多种症状所需的水平。在某些实施方案中,“有效量”至少是甲基纳曲酮口服组合物的最小量,该量足以治疗或预防如本文中定义的阿片类诱发型便秘的一种或多种症状。在某些实施方案中,涉及甲基纳曲酮、其盐或甲基纳曲酮或其盐的组合物的量的“有效量”,是指足以在患者中实现无拯救排便的甲基纳曲酮、其盐或甲基纳曲酮或其盐的组合物的量。如本文所用的术语“治疗”是指部分或完全地减轻阿片类诱发型便秘或阿片类诱发型便秘的一种或多种症状、抑制它们、延迟它们的发作、降低它们的发病率、改善和/或缓解它们。如本文所用的术语“单位剂型”是指适合用于待治疗患者的甲基纳曲酮的组合物或制剂的物理离散单位。然而,应该理解的是,提供的制剂的总的日用量由主治医师在可靠的医学判断范围内决定。对于任何具体患者的特定有效剂量水平将取决于多种因素,包括阿片类诱发型便秘的严重程度;组合物的性质和活性;所使用的特定制剂;患者的年龄、体重、总体健康情况、性别和饮食;所使用的特定活性剂的给予时间和排泄速率;治疗持续时间;与所使用的特定化合物组合或同时使用的药物和/或额外的治疗;以及医学领域众所周知的类似因素。如本文所用,术语“非恶性疼痛”是指源自非恶性来源(例如癌症)的疼痛。如本文所用的术语“患者(subject)”,是指哺乳动物,包括人和动物患者,如家养动物(如马、狗、猫等)和实验动物(如小鼠、大鼠、狗、黑猩猩、猿等)。在具体的实施方案中,所述患者是人。如本文所用的术语“患有”是指已经诊断患者具有或怀疑具有的一种或更多种病况,尤其是阿片类诱发型便秘。如本文所用的描述分子的术语“两亲性”是指分子的双重的疏水和亲水的特性。典型地,两亲性分子具有与非极性的不溶于水的基团(如烃)连接的极性的水溶性基团(如,磷酸根、羧酸根、硫酸根)。术语两亲性(amphiphilic)与两性(amphipathic)同义。两亲性分子的实例包括十二烷基(月桂基)硫酸钠、脂肪酸、磷脂和胆汁酸。两亲性分子可以是不带电荷的、阳离子型或阴离子型。如本文所用,术语“亲脂性”是指化合物与脂肪、脂质、油或非极性溶剂缔合或溶解于其中的能力。亲脂性和疏水性可用于描述分子溶解于脂肪、油、脂质和非极性溶剂中的相同趋势。甲基纳曲酮组合物在具体的实施方案中,本文给出的方法包括给予包含甲基纳曲酮和两亲性药学上可接受的赋形剂的离子对的甲基纳曲酮口服组合物。例如,用于本文给出的方法的组合物可以是下式的甲基纳曲酮的盐:其中甲基纳曲酮是所述盐的阳离子,a-是两亲性药学上可接受的赋形剂的阴离子,如国际公布号wo2011/112816所述,其全部公开内容都通过引用结合到本文中。在某些实施方案中,甲基纳曲酮是(r)-n-甲基纳曲酮,一种外周作用的µ阿片类受体拮抗剂,如上式所示。可以理解,(r)-n-甲基纳曲酮阳离子和两亲性药学上可接受的赋形剂的阴离子可以作为离子对存在于组合物中,或者可以作为与其它抗衡离子(例如溴离子和钠)配对的单独的盐或其混合物存在。供口服给药用的组合物进一步包括两亲性药学上可接受的赋形剂的阴离子(a-)。两亲性药学上可接受的赋形剂增加了所述组合物的亲脂性,由此允许通过胃肠(gi)道中未搅拌的扩散层的运输增加,导致通过生物膜的渗透增加。在某些实施方案中,赋形剂增加了药物的亲脂性。在某些实施方案中,两亲性药学上可接受的赋形剂可包括硫酸根、磺酸根、硝酸根、亚硝酸根、磷酸根或膦酸根部分。在一个实施方案中,药学上可接受的赋形剂包含(-oso3-)基团。在某些实施方案中,所述阴离子是丁基硫酸根、戊基硫酸根、己基硫酸根、庚基硫酸根、辛基硫酸根、壬基硫酸根、癸基硫酸根、十一烷基硫酸根、十二烷基硫酸根、十三烷基硫酸根、十四烷基硫酸根、十五烷基硫酸根、十六烷基硫酸根、十七烷基硫酸根、十八烷基硫酸根、二十烷基硫酸根、二十二烷基硫酸根、二十四烷基硫酸根、二十六烷基硫酸根、二十八烷基硫酸根和三十烷基硫酸根。在某些实施方案中,a-是布朗斯台德酸(brønstedacid)的阴离子。示例性的布朗斯台德酸包括卤化氢、羧酸、磺酸、硫酸和磷酸。在某些实施方案中,a-是氯离子、溴离子、碘离子、氟离子、硫酸根、硫酸氢根、酒石酸根、硝酸根、柠檬酸根、酒石酸氢根、碳酸根、磷酸根、苹果酸根、马来酸根、富马酸根、磺酸根、甲磺酸根、甲酸根、羧酸根、硫酸根、甲基硫酸根或琥珀酸根。在某些实施方案中,a-是三氟乙酸根。在某些实施方案中,组合物中的甲基纳曲酮可以具有与其缔合的多个阴离子(例如溴离子和十二烷基(月桂基)硫酸根)。在某些实施方案中,a-是溴离子,使得组合物及其制剂包含溴化(r)-n-甲基纳曲酮。溴化(r)-n-甲基纳曲酮,也称为“mntx”,描述于国际pct专利申请公布号wo2006/12789,其通过引用结合到本文中。溴化(r)-n-甲基纳曲酮的化学名称是溴化(r)-n-(环丙基甲基)甲基去羟吗啡酮(noroxymorphonemethobromide)。溴化(r)-n-甲基纳曲酮的分子式为c21h26no4br,分子量为436.36g/mol。溴化(r)-n-甲基纳曲酮具有以下结构:溴化(r)-n-甲基纳曲酮其中所述化合物关于四价氮是(r)构型。在本文给出的某些实施方案中,关于氨,至少大约99.6%、99.7%、99.8%、99.85%、99.9%或99.95%的化合物是(r)构型。与存在于样品中的溴化(s)-n-甲基纳曲酮的量相比,测定存在于同一样品中的溴化(r)-n-甲基纳曲酮的量的方法详细描述于wo2006/127899,其通过引用结合到本文中。在其它实施方案中,甲基纳曲酮含有0.15%、0.10%或更少的溴化(s)-n-甲基纳曲酮。在某些实施方案中,a-是酸性两亲性药学上可接受的赋形剂。在某些实施方案中,所述药学上可接受的赋形剂的pka为大约3或更少。在某些实施方案中,所述药学上可接受的赋形剂的pka为大约2或更少。在某些实施方案中,所述药学上可接受的赋形剂的pka介于大约1至大约2之间。在某些实施方案中,所述药学上可接受的赋形剂的pka为大约1或更少。在某些实施方案中,供口服给药用的组合物是片剂制剂。在某些实施方案中,供口服给药用的组合物是胶囊剂制剂。用于这样的组合物和制剂中的甲基纳曲酮可以呈多种形式的任一种。例如,适用于本发明组合物和制剂的甲基纳曲酮的形式包括药学上可接受的盐、前体药物、多晶型物(即晶体形式)、共晶体、水合物、溶剂化物等。甲基纳曲酮的任何形式都可以用于所述组合物或制剂中,但该形式应当允许与两亲性药学上可接受的赋形剂离子配对。在某些实施方案中,甲基纳曲酮离子对是在室温下为固体的盐。在某些实施方案中,所述组合物是药物组合物。一般而言,供口服给药用的制剂包含甲基纳曲酮、如上所述的两亲性药学上可接受的赋形剂和崩解剂,和进一步任选包含一种或多种其它组分,例如粘合剂、载体、螯合剂、抗氧化剂、填充剂、润滑剂、润湿剂或其组合,正如国际公布号wo2011/112816所示,其全部公开内容都通过引用结合到本文中。在一个具体的实施方案中,供口服给药用的组合物,例如药物组合物,包含溴化甲基纳曲酮和十二烷基(月桂基)硫酸钠(也称为sds或sls)。在某些实施方案中,所述组合物进一步包括碳酸氢钠作为崩解剂。可掺入如上给出的另外的赋形剂,包括但不限于以下的至少一种:微晶纤维素、交聚维酮、聚山梨酯80、脱水乙二胺四乙酸二钠钙、硅化微晶纤维素、滑石粉、胶态二氧化硅和硬脂酸镁。在一个实施方案中,供口服给药用的组合物包含以下的每一种:溴化甲基纳曲酮、月桂基硫酸钠、碳酸氢钠、微晶纤维素、交聚维酮、聚山梨酯80、脱水乙二胺四乙酸二钠钙、硅化微晶纤维素、滑石粉、胶态二氧化硅和硬脂酸镁。可以按照国际公布号wo2011/112816所述,产生如本文所述地使用的组合物及其制剂,所述文献的全部内容都通过引用结合到本文中。另外,可以按照本文的实施例2-4所述,产生组合物及其制剂。选择进行治疗的患者在某些方面,本文给出了选择用甲基纳曲酮口服组合物治疗的患有阿片类诱发型便秘的某些患者并随后给予口服组合物。如本文定义,患有阿片类诱发型便秘的患者是指患有因阿片类活性(例如外源阿片类治疗或内源阿片类活性)所致的便秘的患者。“便秘”是指患者排便频率低或排便过程痛苦和/或困难的病况。经历便秘的患者通常具有硬或块状粪便、排便费力和/或排便后有排便不尽感。在一个具体的实施方案中,便秘是指例如在最后连续4周内经历了每周平均小于三(3)次无拯救排便(rfbms)的患者,其中“无拯救排便”是指粪便的通过和排泄,或排便。在某些实施方案中,所述患者在开始阿片类治疗之前没有慢性便秘史。正在接受阿片类治疗、近期已接受阿片类治疗或准备接受阿片类治疗的患者,可以接受甲基纳曲酮口服组合物。在一个实施方案中,在筛选期,患者正在接受阿片类治疗方案和已经接受这类方案至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、65、70、75、80、85、90、95或100天。在一个具体的实施方案中,患者已经服用阿片类至少一个月。在另一个实施方案中,在筛选期,患者将要在筛选后开始阿片类治疗方案至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、65、70、75、80、85、90、95或100天。在再一个实施方案中,在筛选期,患者在筛选前已停止阿片类治疗方案小于1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、65、70、75、80、85、90、95或100天。患者可以为了各种目的而接受阿片类方案。例如,患者可以是癌症患者或手术接受者、免疫抑制或免疫妥协患者(包括hiv感染患者)、具有晚期医学疾病的患者、终末期疾病患者、神经病患者、类风湿性关节炎患者、骨关节炎患者、慢性背痛(packpain)患者、脊髓损伤患者、慢性腹痛患者、慢性胰脏疼痛患者、盆骨会阴疼痛患者、纤维肌痛患者、慢性疲劳综合征患者、偏头痛或紧张性头痛患者、血液透析患者或镰状细胞贫血患者。在不同的实施方案中,患者正在接受阿片类以减轻疼痛。在一个具体的实施方案中,患者正在接受阿片类以减轻慢性非恶性疼痛。如本文所用,术语“非恶性疼痛”是指源自非恶性来源例如癌症的疼痛。在具体的实施方案中,非恶性疼痛包括背痛、宫颈痛、颈痛、纤维肌痛、下肢疼痛(lowextremitypain)、髋部疼痛、偏头痛、头痛、神经性疼痛或骨关节炎。如本文所用,术语“慢性”是指持续较长时间的病况。在不同的实施方案中,慢性可以指持续至少1、2、3或4周的病况。或者,慢性可以指持续至少1、2、3、4、5、6、7、8、9、10、11、12、18、24、30或36个月的病况。在一个具体的实施方案中,患者正在接受阿片类以减轻持续至少2个月的慢性非恶性疼痛。在不同的实施方案中,患者可以是正在接受阿片类治疗,所述阿片类治疗包括但不限于:阿芬太尼、阿尼利定、阿西马朵林、布马佐辛、丁丙诺啡(burprenorphine)、布托啡诺、可待因、地佐辛、二乙酰吗啡(海洛因)、二氢可待因、地芬诺酯、非多托秦、芬太尼、funaltrexamine、氢可酮、氢化吗啡酮、左洛啡烷、左醋美沙朵、左啡诺、洛哌丁胺、度冷丁(哌替啶)、美沙酮、吗啡、吗啡-6-葡萄糖醛酸苷、纳布酚、烯丙吗啡、鸦片(opium)、氧可酮、羟吗啡酮、喷他佐辛、丙吡胺、丙氧酚、瑞芬太尼(remifentanyl)、舒芬太尼、痛立定、曲美布汀和/或曲马多。在不同的实施方案中,所述患者正在接受日用量至少10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290或300mg口服吗啡当量。在一个具体的实施方案中,患者正在接受至少50mg口服吗啡当量。口服吗啡当量的计算是本领域众所周知的。表a提供了已知阿片类的吗啡口服当量表。表a:吗啡口服当量表药物途径单位吗啡当量因子,以mg计阿芬太尼ivmeg0.6可待因pomg0.3可待因控释片pomg0.3fioricet和可待因胶囊剂pomg0.3panadeinefortepomg0.3非那根和可待因pomg0.3泰诺w/可待因2号pomg0.3泰诺w/可待因3号pomg0.3泰诺和可待因pomg0.3德美罗immg1.25德美罗ivmg1.25德美罗pomg0.2多瑞吉tdmeg/hr3.6芬太尼ivmeg0.6芬太尼ivmg600芬太尼pomeg0.076柠檬酸芬太尼pomg75柠檬酸芬太尼pomeg0.076芬太尼tdmeg/hr3.6对乙酰氨基酚w/酒石酸氢氢可酮pomg1.8扑热息痛和氢可酮pomg1.8海可待pomg1.8氢可酮pomg1.8lorcetpomg1.8lortabpomg1.8tussionexpomg1.8维柯丁pomg1.8维柯丁espomg1.8vicoprofenpomg1.8zydonepomg1.8氢吗啡醇ivmg40氢吗啡醇pomg8氢化吗啡控释片pomg8氢化吗啡酮pomg8盐酸氢化吗啡酮pomg8美沙酮pomg3盐酸美沙酮pomg3美沙酮(methadose)pomg3吗啡ivmg6吗啡pomg1盐酸吗啡pomg1硫酸吗啡pomg1硫酸吗啡控释片pomg1msirpomg1msirprmg1oramorphpomg1statexpomg1对乙酰氨基酚w/氧可酮pomg2endonepomg2oxycocetpomg2氧可酮pomg2盐酸氧可酮pomg2percocetpomg2盐酸羟氢可待酮pomg2tyloxpomg2羟吗啡酮ivmg60羟吗啡酮pomg3盐酸羟吗啡酮pomg3丙氧酚(darvocet)pomg0.234丙氧酚-n(darvocet-n)pomg0.15达尔丰pomg0.234达尔丰-npomg0.15丙氧酚(propoxyphene)pomg0.234瑞芬太尼ivmeg0.6roxicetpomg2舒芬太尼ivmg6000舒芬太尼ivmeg6曲马多pomg0.2盐酸曲马多pomg0.2曲马多(tramal)pomg0.2ultracetpomg0.2他喷他多pomg0.33foleykm.thetreatmentofcancerpain.nengljmed.1985jul,313(2):84-95患者的阿片类治疗方案可以通过任何给药途径。例如,患者可以经口服、透皮、静脉内或皮下接受阿片类。剂量和给药可视需要将组合物和制剂给予患者以提供有效量的甲基纳曲酮。如上定义,“有效量”的化合物或药学上可接受的组合物可以获得所需要的治疗和/或预防效果。在某些实施方案中,“有效量”至少是化合物或包含化合物的组合物的最小量,该量足以治疗或预防如本文中定义的阿片类诱发型便秘的一种或多种症状。在某些实施方案中,术语“有效量”,当与甲基纳曲酮、其盐或者甲基纳曲酮或其盐的组合物的量结合使用时,是指足以在患者中实现无拯救排便的甲基纳曲酮、其盐或者甲基纳曲酮或其盐的组合物的量。在某些实施方案中,甲基纳曲酮口服组合物在给予患者大约24小时内、在大约12小时内、在大约8小时内、在大约5小时内、在大约4小时内、在大约3小时内、在大约2小时内或在大约1小时内足以在所述患者中实现无拯救排便。在一个具体的实施方案中,甲基纳曲酮口服组合物在给予患者大约4小时内足以实现无拯救排便。在某些实施方案中,甲基纳曲酮口服组合物对于所有给予的剂量的至少100%、99%、至少95%、至少90%、至少85%、至少80%、至少75%或至少50%在给予患者大约4小时内足以实现无拯救排便。在某些实施方案中,甲基纳曲酮口服组合物在给予的前1、2、3、4、5、6、7、8、9或10周期间在4小时内足以实现无拯救排便。在一个具体的实施方案中,甲基纳曲酮口服组合物对于所有给予的剂量在给予的前4周期间在给予患者大约4小时内足以实现无拯救排便。可以通过患者经历的无拯救排便次数的增加进一步评价本文给出的口服组合物在治疗阿片类诱发型便秘中的疗效。例如,在某些实施方案中,甲基纳曲酮口服组合物足以增加患者经历的每周无拯救排便次数至少1、2、3、4、5、6、7、8、9或10次。在具体的实施方案中,甲基纳曲酮口服组合物足以增加患者经历的每周无拯救排便次数至少1次。在另一个实施方案中,甲基纳曲酮口服组合物足以增加患者经历的每周无拯救排便次数至少2次。在又一实施方案中,甲基纳曲酮口服组合物足以增加患者经历的每周无拯救排便次数至少3次。在某些实施方案中,甲基纳曲酮口服组合物在给予的前1、2、3、4、5、6、7、8、9或10周期间足以增加患者经历的每周无拯救排便次数。在一个具体的实施方案中,甲基纳曲酮口服组合物在给予的前4周期间足以增加患者经历的每周无拯救排便次数至少1次。在另一个具体的实施方案中,甲基纳曲酮口服组合物足以增加每周无拯救排便次数每周至少1至至少3次。在还一个实施方案中,甲基纳曲酮口服组合物在给药后的前4周的至少3周足以增加每周无拯救排便次数每周至少1至至少3次。可以使用本领域技术人员可得到的评价便秘治疗的多种评价工具,进一步评价本文给出的口服组合物的疗效。在一个具体的实施方案中,通过患者便秘自评(patientassessmentofconstipation,pac)问卷,评价甲基纳曲酮口服组合物的疗效。pac由以下两个附属问卷组成:pac-症状(sym)和pac-生活质量(qol)问卷。pac-sym为12项调查,其测定跨越以下三个部分的便秘症状的严重程度:粪便症状、直肠症状和腹部症状。pac-sym量表主要用于评价慢性便秘。pac-sym量表进一步描述于frank等人.scandjgastroenterol(1999)34(9):870-877和slappendel等人.europeanjournalofpain(2006)10(3):209-217,其全部内容通过引用结合到本文中。pac-qol是28项调查,其测量跨越以下4个部分的便秘特异性的生活质量:担心和关注、躯体不适、心理不适和满意度。pac-qol量表进一步描述于marquis等人.sjg(2005)40:540-551,其全部公开内容通过引用结合到本文中。备选地或组合地,通过欧洲生活质量五维(europeanqualityoflife-5dimensions,eq-5d)分析来评价甲基纳曲酮口服组合物的疗效。eq-5d是5项标准化手段,用作患者报告结果(pro)的度量。可适用于宽范围的健康状况和治疗,该手段提供了健康状况的简单描述性特征和单一指数值。eq-5d手段进一步描述于dolanp.medicalcare(1997)35:1095-1108,rabinr.ann.med.(2001)33(5):537-543和shaw等人.medicalcare(2005)43:203-220,其各自的全部内容通过引用结合到本文中。备选地或组合地,通过工作生产力和活动受损一般健康(workproductivityandactivityimpairmentgeneralhealth)v2.0(wpai:gh)问卷来评价甲基纳曲酮口服组合物的疗效。wpai:gh是量化因健康问题而损失的工作时间和生产力的损失的6项问卷。wpai:gh得到4类评分:缺勤(错过工作时间)、“出勤”(工作损失/降低工作效力)、工作生产力损失(总体工作损失/缺勤加出勤)和活动受损。wpai:gh问卷进一步描述于reilly等人.pharmacoeconomics(1993)4(5):353-365,其全部内容通过引用结合到本文中。备选地或组合地,通过临床总体印象变化(globalclinicalimpressionofchange,gcic)量表评价甲基纳曲酮口服组合物的疗效。gcic是7点等级量表,该量表设计用于在研究药物时评价患者和临床医生对患者排便状态变化的印象。量表范围从1(很差)至7(很好)。由患者和临床医生在每天给药结束时和治疗结束时完成该量表。在某些实施方案中,口服给予患者甲基纳曲酮组合物每天至少一次。在某些实施方案中,给予患者甲基纳曲酮口服组合物每天至少1、2、3、4或5次。在一个具体的实施方案中,给予患者甲基纳曲酮口服组合物每天3次。在不同的实施方案中,每天口服给予患者150mg甲基纳曲酮或其盐。例如,每天可给予患者包含150mg甲基纳曲酮或其盐的片剂。在另一个实施方案中,每天口服给予患者300mg甲基纳曲酮或其盐。例如,每天可给予患者2片,每片包含150mg甲基纳曲酮或其盐。在又一个实施方案中,每天口服给予患者450mg甲基纳曲酮或其盐。例如,每天可给予患者3片,每片包含150mg甲基纳曲酮或其盐。不良事件本文给出的方法可以至少部分地断定给予甲基纳曲酮口服组合物(例如150mg、300mg或450mg,每天至少一次,例如每天3次)足以治疗阿片类诱发型便秘而不引起不良事件的鉴定。口服给予甲基纳曲酮所致的示例性不良事件在实施例1中给出。本发明还提供了用本文所述的甲基纳曲酮口服制剂治疗患者的方法,与用先前的不包含两亲性药学上可接受的赋形剂的阴离子(尤其是十二烷基(月桂基)硫酸钠)的甲基纳曲酮口服制剂(例如甲基纳曲酮的肠溶包衣的口服制剂或甲基纳曲酮的其它口服制剂)所观察到的不良事件率相比,其降低了不良事件发生率。因此,实施例1中给出的数据证明了给予本文所述的甲基纳曲酮口服制剂的方法比给予先前描述的不包含两亲性药学上可接受的赋形剂的阴离子(尤其是十二烷基(月桂基)硫酸钠)的甲基纳曲酮口服制剂(例如甲基纳曲酮的肠溶包衣的口服制剂或甲基纳曲酮的其它口服制剂)的方法更安全。经过必要的变更,本文给出的各方面的所有特征适用于所有其它方面。本申请全文引用的所有参考文献、专利、待审的专利申请和公布的专利的内容通过引用明确结合到本文中。实施例实施例1:口服甲基纳曲酮在阿片类诱发型便秘治疗中的疗效和剂量研究目的主要目的本研究的主要目的是在具有阿片类诱发型便秘(oic)的慢性非恶性疼痛患者中评价口服甲基纳曲酮(om)相对于安慰剂剂而言的安全性和疗效。次要目的本研究的次要目的是在具有oic的慢性非恶性疼痛患者中确定om给药方案。研究设计在大约802个慢性非恶性疼痛患者中进行了治疗oic的om的3期、多中心、随机、双盲、安慰剂对照、平行组研究。有资格的患者签署知情同意表(icf)并进入14-天筛选期(±2天),在此期间评价便秘的客观证据并用作纳入的基础。筛选期间因使用阿片类所致的便秘:便秘定义为每周平均<3次无拯救排便(rfbm)(排便前24小时内未用缓泻药),其伴随以下的一项或多项(根据患者日记报告):a.对于至少25%的无拯救排便为布里斯托尔粪便量表1或2型。b.在至少25%的无拯救排便期间排便费力。c.在至少25%的无拯救排便后有排便不尽感。首先按照1:1:1:1的分配比例,将在基线访问(第一天)时仍然符合条件的患者随机分派到om片剂制剂150mg、300mg、450mg或安慰剂中的任一。要求患者每天服用3片,早上空腹(早餐前)进行。指示患者吞咽完整的片剂,切勿咀嚼、分开或压碎片剂,并在摄取任何食物前等待至少半小时。患者参加研究最多达84天。前28天每天给药一次;剩余的56天视需要给药(prn)。在整个12周期间(84天)一直保持双盲给药。84天治疗期后是治疗后14天的随访期(±2天)。继续纳入,直到总共大约802个患者都被随机化和给药。研究的进行将研究分为筛选期(持续时间为14天[±2天])、双盲每天给药期(持续时间为28天)、双盲prn给药期(持续时间为56天)和随访(治疗后14天的随访[±2天])。a.研究的进行-筛选期筛选期为给药前的14天期间(±2天)。在收到患者签名和签有日期的书面icf后,在参与研究前评价他们的资格状态。对于本研究目的而言,筛选失败定义为已签署知情同意表但未接受任何研究药物的任何患者。在筛选开始时停止所有缓泻药治疗,在整个筛选期和双盲期中仅使用研究允许的拯救缓泻药(rescuelaxatives)。b.研究的进行-双盲期在基线访问时,患者被随机分派到om或安慰剂。在基线访问(第一天)时满足所有入选标准和非排除标准的患者接受研究药物。所有剂量都在早上的早餐前服用[在基线访问时给予的第一次剂量可以在中午(12:00pm)后服用]并指示患者在摄取任何食物前等待至少半小时。患者参加研究最多达84天:前28天每天双盲给药一次;剩余的56天双盲prn给药。c.研究的进行-治疗结束当患者完成或停止研究时,在第84天或在早期结束访问时进行所有评价。该评价包括以下:生命体征测定、用于实验室检验的标本采集、体格检查、血清妊娠测定(如果合适的话)、ae的记录和核对、伴随的阿片类、非阿片类治疗、oows、sows、疼痛强度量表、生活质量和便秘症状评价、临床总体印象变化(gcic)和患者报告的日记信息和顺从性的综述。d.研究的进行–随访完成12周(84天)双盲期的患者返回,进行84天后14天(±2天)的随访,以评价患者的总体安全性状态。调查计划-总体研究设计和原理、对照组的选择和检测合适性本3期研究的主要疗效终点是在给药的前4周期间所有剂量的4小时内每个患者的无拯救排便反应的平均比例。关键次要疗效终点按照层级顺序为:1.在1至4周期间每周rfbm次数自基线的变化。2.在1至4周期间对研究药物的反应(反应者/非反应者),其中反应者定义为对于前4周的至少3周,具有≥3次rfbm/周和比基线增加至少1次rfbm/周。治疗组的选择所评价的活性口服甲基纳曲酮(om)剂量包括150、300和450mg,并且是安慰剂-对照设计的组成部分,以评价om的安全性和疗效。安慰剂对照设计(允许盲试、随机化并包括接受无效治疗的一组)控制了并非来自研究药物的药理作用的潜在影响。这些影响包括与以下有关的安全性发现:基础条件、自发变化(病况的自然史和趋均数回归)、患者或研究者的预期、试验中存在的影响、其它治疗的使用、以及诊断或评价的主观因素。为了这些原因,安慰剂对照设计是伦理上可接受的并符合worldmedicalassociationgeneralassembly,washington,2002阐述的赫尔辛基宣言(declarationofhelsinki)。研究标准仅满足资格标准的患者才被纳入研究中。仅当患者在基线访问时满足入选标准时,才允许他们继续留在研究中。如果患者在筛选访问时满足任一排除标准,则将其排除在研究之外。如果患者在基线访问时满足任一排除标准,则将其排除在研究之外。筛选对来源和crf进行并证实资格评价,以确保存在所需的入选标准和不存在所有排除标准。在筛选访问时,要求符合研究资格的患者返回,进行第一天访问。疗效的评价为了评价疗效,使用患者报告的信息,包括排便日期和时间、布里斯托尔粪便量表、排便费力量表、完全排尽感量表和使用研究药物和拯救缓泻药的记录。主要疗效终点主要疗效终点是在给药的前4周期间所有剂量的4小时内每个患者的无拯救排便反应的平均比例。次要疗效终点两个关键次要疗效终点按照层级顺序为:1.在给药的整个前4周(28天),每周rfbm次数自基线的变化。2.在1至4周期间对研究药物的反应(反应者/非反应者),其中反应者定义为对于前4周的至少3周,具有≥3次rfbm/周和比基线增加至少1次rfbm/周。其它次要疗效终点其它终点包括:•达到每周至少3次rfbm的患者比例•在禁食状态下,在第一剂研究药物的4小时内的无拯救排便反应的患者比例•第一剂后至第一次rfbm的时间,设限在24小时或第二剂的时间,无论哪个在禁食状态下先发生•在整个12周治疗期对研究药物的反应(反应者/非反应者),其中反应者为对于≥75%的周,具有≥3次rfbm/周和比基线增加至少1次rfbm/周•在1、2、3、4、6、8和24小时内导致任何rfbm的剂量百分率安全性评价在所有诊所访问中,监测患者的伴随治疗(包括使用阿片类和拯救缓泻药)的不良事件(ae)、严重不良事件(sae)和生命体征测定。在研究期间按照预定时间间隔进行生命体征、体格检查(包括直肠检查)、实验室评价、血清/尿妊娠测定、ecg、客观阿片类撤药量表(oows)、主观阿片类撤药量表(sows)和疼痛强度量表。心电图在研究访问和评价时间表中设计的访问中,在患者休息至少5分钟后得到标准12-线ecg。调查人员负责综述、解释和保留报告的硬拷贝。在正常或非临床上重要的筛选ecg后的任何时间点的临床上重要的异常都记为不良事件,如下定义。患者报告的结果通过pac-sym、pac-qol、eq-5d、wpai:gh和gcic(由临床医生执行),测定自我给予pro终点,这些评价量化患者的便秘症状、便秘相关的生活质量、总体生活质量、排便状态的变化和对工作能力的干扰程度。疼痛强度量表使用疼痛强度量表的数字等级来记录疼痛的度量。该量表是范围从0(无)至10(最坏的疼痛可能性)的11点等级量表,是患者评价工具,患者应当根据在完成量表前的24小时期间所经历的疼痛完成评价。布里斯托尔粪便量表每次排便都使用布里斯托尔粪便量表来记录粪便稠度和排便费力的度量。布里斯托尔粪便量表是粪便样品特征分级的7-点量表。范围从1型(分散的硬块,象坚果一样(难以通过))至7型(水样,无固体小块,完全是液体)。布里斯托尔粪便量表被认为是粪便稠度或形状的一般性度量。排便费力量表对于每次排便,使用排便费力量表记录排便费力的度量。该量表是排便费力的量的分级(无至非常严重)的5-点量表,是患者评价工具,患者对于每次排便都完成该评价。完全排尽感量表对于每次排便,使用完全排尽感量表记录完全排尽感的度量。该量表是患者评价工具,患者对于每次排便都完成该评价。患者报告的结果(pro)pro是为了研究患者的便秘症状的经历和便秘对生活质量和工作生产力的影响的目的。进行每项工作以维持公平的评价。调查人员不影响患者的自我评价。患者便秘自评(pac):pac由以下两个附属问卷组成:pac-症状(sym)和pac-生活质量(qol)。pac-sym是12项调查,其测定跨越粪便症状、直肠症状和腹部症状3个部分的便秘症状的严重程度。pac-sym量表主要用于评价慢性便秘。pac-qol是28项调查,其测定跨越以下4个部分的便秘特异性的生活质量:担心和关注、躯体不适、心理不适和满意度。欧洲生活质量五维(eq-5d):eq-5d是5项标准化手段,用作pro的度量。可适用于宽范围的健康状况和治疗,它提供了健康状况的简单描述性特征和单一指数值。工作生产力和活动受损一般健康v2.0(wpai:gh):wpai:gh是量化因健康问题而损失的工作时间和生产力的6项问卷。wpai:gh得到4类评分:缺勤(错过工作时间)、“出勤”(工作损失/降低工作效力)、工作生产力损失(总体工作损失/误工加出勤)和活动受损。临床总体印象变化(gcic):gcic是7点等级量表,该量表设计用于在研究药物时评价患者和临床医生对患者排便状态变化的印象。量表范围从1(很差)至7(很好)。由患者和临床医生在每天给药结束时(访问4)和治疗结束时(访问7)完成该量表。以含有150mg片剂的活性研究药物和/或安慰剂的泡眼包装卡的形式提供研究药物。每一卡具有21片研究药物片剂,是7天研究治疗的用量。一次服用3片。数据分析终点和评价主要:在给药的前4周期间所有剂量的4小时内每个患者的无拯救排便反应的平均比例次要:1.在给药的整个前4周(28天),每周rfbm次数自基线的变化。2.在1至4周期间对研究药物的反应(反应者/非反应者),其中反应者定义为对于前4周的至少3周,具有≥3次rfbm/周和比基线增加至少1次rfbm/周。其它次要:•达到每周至少3次rfbm的患者比例•在禁食状态下,在第一剂研究药物的4小时内的无拯救排便反应的患者比例•第一剂后到第一次rfbm的时间,设限在24小时或第二剂的时间,无论哪个在禁食状态下先发生•在整个12周治疗期对研究药物的反应(反应者/非反应者),其中反应者为对于≥75%的周,具有≥3次rfbm/周和比基线增加至少1次rfbm/周•在1、2、3、4、6、8和24小时内导致任何rfbm的剂量百分率•每周rfbm率≥3和每周rfbm率比基线增加至少1次的患者比例•每周rfbm率比基线增加至少1次的患者比例•每周bm(排便)率•有质量的rfbm的每周次数(即布里斯托尔粪便量表:3和4型为“理想的粪便”)•完全rfbm(crfbm)的每周次数,即具有完全排尽感的rfbm•rfbm的布里斯托尔粪便量表的平均数•rfbm的排便费力量表的平均数•rfbm的布里斯托尔粪便量表改进≥1水平的患者比例•rfbm的排便费力量表改进≥1水平的患者比例•布里斯托尔粪便量表3或4型的rfbm的平均百分率•分类为腹泻或水样便的rfbm的平均百分率•具有任何腹泻或水样rfbm(布里斯托尔粪便量表6或7型)的患者比例•排便费力量表评分为0或1(无或轻度)的rfbm的平均百分率•具有完全排尽感的rfbm的平均百分率•自第一剂给药至第一次rfbm的时间•自第一剂给药至第一次bm的时间•先前mntx使用的反应•pac-sym•pac-qol•eq-5d•wpai:gh•gcic安全性评价•生命体征•拯救治疗(recuemedication)的使用•伴随的治疗•不良事件,包括严重不良事件•ecg•体格检查•实验室评价患者报告的结果(pro)通过pac-sym、pac-qol、eq-5d、wpai:gh和gcic测定pro。这些评价量化患者的便秘症状、便秘相关的生活质量、总体生活质量、排便状态的变化和对工作能力的干扰程度。计算总的量表评分和相关的次级量表(subscale)以及它们各自自基线的变化。结果患者将803个患者纳入研究中。如图5(表1)所示,在接受安慰剂的201个患者中,有186个患者完成了研究。在接受每天150mg口服甲基纳曲酮的201个患者中,有187个患者完成了研究。在接受每天300mg口服甲基纳曲酮的201个患者中,有189个患者完成了研究。最后,在接受每天450mg口服甲基纳曲酮的200个患者中,有179个患者完成了研究。图6(表2)提供了纳入研究中的所有患者的统计资料,包括年龄、性别、种族、民族、身高、体重和体重指数。图7(表3)提供了纳入研究中的所有患者的基线疾病特征。具体地讲,图7提供了患者所经历的非恶性慢性疼痛的种类,包括例如背痛、关节/四肢疼痛、关节炎、神经的/神经性疼痛或纤维肌痛。图7进一步提供了(i)每个患者的平均每周无拯救排便次数,(ii)每周少于3次无拯救排便的患者平均数,(iii)在无拯救排便期间经历排便费力的患者百分率;(iv)在至少25%的无拯救排便期间经历排便费力的患者百分率;(v)在无拯救排便后经历排便不尽感的患者百分率;(vi)在至少25%的无拯救排便后经历排便不尽感的患者百分率;(vii)在无拯救排便期间经历布里斯托尔粪便量表1或2型的患者百分率;和(vii)在至少25%的无拯救排便期间经历布里斯托尔粪便量表1或2型的患者百分率。主要疗效终点结果证明了对于每种测试剂量(即150mg、300mg和450mg甲基纳曲酮)的甲基纳曲酮口服组合物的疗效。所述疗效通过主要疗效终点的论证来证明,所述主要疗效终点即在给药的前4周期间所有剂量的4小时内每个患者的无拯救排便的平均比例。图8(表4)概述了主要疗效终点,即在实施例1给出的研究的前4周期间所有剂量的4小时内每个患者的无拯救排便的平均比例的结果。图9-17(表5-13)进一步概述了主要疗效终点的结果,其中按照患者的统计资料或阿片类诱发型便秘的严重程度将所述结果分类。具体地讲,图9和10(表5和6)提供了分别对于男性和女性患者的结果,表明对于男性和女性两者的疗效。图11(表7)证明了对于65岁或以下患者的疗效,而图12(表8)证明了对于大于65岁患者的疗效。图13和14(表9和10)提供了分别对于小于86kg的患者和大于或等于86kg的患者的结果,其每个分类都表现出对于主要疗效终点的疗效。研究进一步证明了在白人患者中的疗效,如主要疗效终点所证明。图16(表11)证实了对于每周少于3次无拯救排便的患者的主要疗效。最后,图17(表13)证实了对于布里斯托尔粪便量表评分小于3的患者的主要疗效。次要疗效终点结果进一步证明了对于每种测试剂量(即150mg、300mg和450mg甲基纳曲酮)的甲基纳曲酮口服组合物的疗效,如包括以下的次要疗效终点的确认所证明:(a)在研究的1-4周期间,每周无拯救排便次数自基线的变化(参见图18;表14);和(b)对研究药物的反应,定义为对于研究的前4周的每一周而言具有每周至少3次无拯救排便,并且对于研究的前4周的至少3周比基线增加至少一次无拯救排便(参见图19;表15)。此外,另一个次要终点进一步证实了研究药物的疗效,如图20(表16)所示,其给出了第一剂研究药物的4小时内无拯救排便的患者比例。不良事件结果进一步证明了剂量150mg、300mg和450mg的研究药物不导致不良事件,如图21(所有不良事件)、图22(按照系统器官分类组织的严重不良事件)和图23(按照系统器官分类组织的不良事件)的各图所示。最后,图24(表20)概述了临床上重要的心电图结果,如实施例1所示。实施例2:溴化甲基纳曲酮片剂的制备可以按照国际pct专利申请公布号wo2006/127899中详述的方法制备溴化甲基纳曲酮。使用药学上可接受的赋形剂制备含有甲基纳曲酮的制剂。制备含有甲基纳曲酮的球体。使用常规技术,自球体制备片剂。片剂在10分钟内溶解。按照以下通用方法所述,通过湿法造粒工艺,再通过挤出和滚圆,制备球体。将溴化甲基纳曲酮和药学上可接受的赋形剂在水溶液中混合。加水,直到得到适于挤出的湿团块。使湿团块通过挤出机,并将挤出物在滚圆机中滚圆。将所得球体在流化床干燥机上干燥并过筛。将未包衣球体贮存在合适容器中。实施例3:口服给予的甲基纳曲酮的临床药代动力学本文给出的是临床药代动力学研究,研究c以及研究a和b。研究a调查了在皮下给予12mg甲基纳曲酮后的甲基纳曲酮(mntx)及其代谢物(m2:硫酸甲基纳曲酮;m4:6α-甲基纳曲醇;和m5:6β-甲基纳曲醇)的单剂量和多剂量的药代动力学。在研究b中,在20分钟短期静脉内输注24mg甲基纳曲酮(mntx)后,检查甲基纳曲酮(mntx)及其代谢物(m2、m4和m5)的单剂量和多剂量的药代动力学。在研究c中,在两个阶段中研究了甲基纳曲酮(mntx)及其3种代谢物(m2、m4和m5)的药代动力学:1)在mntx450mgpox7天后的mntx和3种代谢物(m2、m4和m5)的单剂量和多剂量的药代动力学,和2)单次口服给予450mgmntx(未包衣的和薄膜包衣的150-mgmntx片剂)后的相对mntx生物利用度。另外,表征了mntx的尿清除。药代动力学参数包括如下定义的cmax、auct、aucinf、tmax、t1/2、%re24、积累因子(r)以及代谢物/母体药物之比。r=积累因子(基于auc0-24(ng.h/ml):第7天aucauc0-24/第1天auc0-24代谢物-母体药物之比(基于ng.h/ml)(%)=100*(代谢物auc24/mntxauc24)注意:在iv给药后,aucinf替代aucauc0-24用于r和代谢物-母体药物之比的计算。结果概述于表21和22。表21:研究c的甲基纳曲酮(mntx)及其代谢物的单剂量和多剂量的药代动力学[平均值(sd)];与所记录的研究a和b比较1:数据来自研究b,经短时输注给予24mg的研究。2:数据来自研究a,经sc.给予12mg的研究。*调和平均数(调和sd)%re=经肾途径排泄的%剂量,r=第7天的auc0-24/第1天的auc0-24,%re24=24小时内尿中排泄的%口服剂量。表21和22表明,在口服和皮下给予后,mntx易于吸收,在口服给药和皮下给药后分别2h和0.25h观察到最大mntx血浆浓度。在尿中回收到小于4%的口服给予剂量,为未转化的mntx,明显低于iv给药后在尿中回收到的31.5%-49.6%(yuan等人.2005jclinpharm45:538-546)。交叉研究aucinf比较表明,mntx片剂的绝对生物利用度为4.24%(相对于iv输注)和3.7%生物利用度(相对于sc注射),而后面的多剂量给药导致这些值稍微增加(更高aucinf),相对于sc和iv多剂量给药为4.8%和5.8%。相对于短期输注,皮下mntx注射导致高生物利用度(112%)。mntx口服给药导致大量代谢,导致形成硫酸甲基纳曲酮(m2)和立体特异性羟基化,形成6α-甲基纳曲醇(m4)和6β-甲基纳曲醇(m5),其中发现m4是代谢物形成的有利途径。已报道代谢酶akrc1c、sult2a1和sult1e1酶负责将mntx代谢为m2、m4和m5(图25)。对于口服、sc或iv途径,在第1天至第7天之间,对于mntx和m2,未观察到平均cmax和tmax的明显差异。这些结果表明,多次口服剂量给予后观察到的积累程度(r)和达到表观稳定状态,是因为增加的auc值和减少的消除,由第7天药代动力学观察到的增加的aucinf和延迟的消除t1/2证明了这一点。皮下给药后,mntx及其代谢物的cmax和aucinf在第1-7天之间类似,而口服给予mntx片剂后在第7天观察到mntx及其代谢物的auc和cmax显著增加。与皮下给药后的r值(对于mntx为1.05,对于m2为1.13,对于m4为1.25和对于m5为1.42)相比,口服剂量后的更高的积累因子(r)值(对于mntx为1.20,对于m2为1.30,对于m4为1.62和对于m5为1.76)证明了多剂量口服给予后mntx及其代谢物有更高积累。与皮下给药后较低的代谢物-mntx之比(对于m2为29.30%,对于m4为18.75%,和对于m5为8.72%)相比,口服给予mntx后,对于所有3种代谢物而言,代谢物与mntx之比更大:对于m2为81.0%,对于m4为54.21%,和对于m5为29.78%。在研究c中,使用甲基纳曲酮血浆药代动力学和90%ci方法评价了2种甲基纳曲酮制剂(膜衣片剂和未包衣片剂)的相对生物利用度。表23所示的平均血浆浓度-时间概况和结果表明,薄膜包衣的甲基纳曲酮片剂导致lsm(最小二乘均值)比率介于90-105%之间。对于mntx制剂,患者内的变异性介于29-36%之间。表23:2种甲基纳曲酮(450mg)片剂的相对生物利用度实施例4:伴随或不伴随食物的口服给予甲基纳曲酮的临床药代动力学mntx的口服吸收是有限的。在大鼠中口服给药后,估计mntx生物利用度小于1%,与处于稳定的美沙酮维持的患者中的皮下制剂相比,mntx肠溶包衣片剂和肠溶包衣颗粒-填充的胶囊剂的相对口服生物利用度分别为2.27%和2.43%。mntx片剂的药代动力学在个体中是高度变异的,很可能是口服给予后的低吸收和低系统暴露的结果。先前已调查了食物对以即释(ir)片剂和ir胶囊剂制剂形式制备的mntx的影响。高脂肪饮食后,mntx的平均cmax减少了33%(对于ir胶囊剂制剂)和大约45%(对于ir片剂制剂);auc0-∞减少了11%(对于ir胶囊剂制剂)和超过30%(对于ir片剂制剂)。食物没有显著改变中位tmax和末端t½。在2项人体研究中调查了在口服150mg离子对制剂中的mntx的药代动力学。在处于稳定的美沙酮维持治疗的患者中进行了一项两部分研究。在第一部分中,患者接受单次150mg剂量的mntx离子对片剂;在第二部分中,在与不使用离子对技术的单剂量mntxir片剂相比的交叉设计中,他们接受相同的离子对片剂剂量。用研究药物治疗之前,先进行过夜禁食≥10小时。对于离子对片剂,在研究的第一部分中,平均cmax为42.8ng/ml,中位tmax为1小时,平均auc0-∞为180hr·ng/ml;在研究的第二部分中,平均cmax为41.5ng/ml,中位tmax为2小时,平均auc0-∞为176.8hr·ng/ml。消除t½是可变的,在第一部分中的平均值为18.2小时,在第二部分中的平均值为25.5小时。一项单独的研究评价了在慢性非恶性疼痛患者中口服mntx的药代动力学和药效动力学。在禁食2小时和10小时后,将mntx150mg片剂离子对制剂与不使用离子对技术的mntx150mgir片剂制剂进行比较。mntx150mg片剂离子对制剂(10小时禁食)的结果如下:在300mg(2x150mg片剂)和450mg(3x150mg片剂),平均cmax分别为32.5和54.7ng/ml,auc0-∞分别为156hr·ng/ml和223hr·ng/ml。本文给出的是单剂量、2-期交叉研究,以评价标准高脂肪早餐对单次口服剂量的450mg(3×150mg片剂)mntx的药代动力学的影响。该研究具有2个方面(arm)和2个给药期。将32个患者纳入本研究中。将患者以1:1的比例随机分到方面1(禁食,然后喂食)或方面2(喂食,然后禁食)。随机化按照性别分层。每个患者接受单剂量mntx450mg(给予3×150mg片剂)以及高脂肪饮食(mntx喂食),和在禁食后接受所述单剂量mntx(mntx禁食)。禁食/喂食研究期之间间隔7天。在第1天随机确定第1天和第8天的禁食/喂食或喂食/禁食的顺序。对于禁食治疗,在监督过夜禁食至少10小时后,将单次450mg(3×150mg)口服剂量的mntx片剂给予患者。在给药后至少4小时不允许进食任何食物。对于喂食治疗,在过夜禁食至少10小时后,将标准高脂肪早餐给予患者。当患者开始进食后30分钟,将单次450mg(3×150mg)口服剂量的mntx片剂给予所述患者。在给药后至少4小时不允许进食任何食物。自0至14天将患者留在临床研究单位(cru)内并让他们在第15天出院,结束他们对研究的参与。在高脂肪饮食或禁食后第1天和第8天给予患者单次口服剂量的mntx片剂(450mg)如下:(a)高脂肪(高热量)早餐后给予mntx450mg(口服3×150mg片剂),或(b)禁食后给予mntx450mg(口服3×150mg片剂)。在高脂肪/高热量饮食后(mntx喂食)和在禁食后(mntx禁食),患者立即接受单剂量mntx450mg(口服给予3×150mg片剂)。7天的清除期将禁食/喂食交替期间隔开来。在第1天随机确定第1天和第8天的禁食/喂食或喂食/禁食的顺序。患者禁食过夜至少10小时,然后给予高脂肪饮食以及单剂量研究药物(mntx喂食);或禁食过夜至少10小时,然后给予单剂量研究药物(mntx禁食)。将患者随机分到2种给予顺序中的1种;给予顺序是根据标准交叉设计而定。清除期的长度决定了给药的时间安排,清除期计算为在人体内观察到的口服mntx的近似t½的7倍。在第1天和第8天给予每个剂量以及240ml室温的饮用水,并指示患者喝掉所有的水。在给药后至少4小时不允许进食任何食物,除了给药前后1小时之外,允许视需要而喝水。给药后大约4小时,可以重新开始正常的饮食时间表。高脂肪/高热量饮食包括的脂肪含量占饮食总热量(大约800至1000总热量)的大约50%。要求接受mntx喂食治疗方案的患者在早餐前禁食至少10小时,然后在给药前30分钟开始食用特别规定的早餐。高脂肪高热量早餐由以下组成:●两片烤面包,每一片有½块黄油。●黄油炸的两个蛋。●两条培根。●4盎司(113g)炸薯饼。●8盎司(240ml)全脂奶。计划的饮食含量如下:●脂肪=500-600卡,50%。●蛋白=150卡。●碳水化合物=250卡。●总热量=800至1000卡。研究期间所接受的实际饮食含量符合fda对食物影响研究的指南,总共包括972卡:540卡来自脂肪,299卡来自碳水化合物,和125卡来自蛋白质。除了以上指出的例外之外,维持正常饮食时间表和食物。使用包括高效液相色谱和串联四极质谱检测在内的经验证的分析程序,测定mntx的血浆浓度。在第1天给药前(在给药前大约1小时),和在第1天和第8天的每次给药后的0.25、0.5、1、2、4、6、8、10、12、16、24、36、48、72、96、120、144和168小时获取用于测定血浆中的mntx浓度的血液样品。测定和计算的药代动力学参数包括如下:在禁食和喂食条件下单次口服450mg剂量之后的平均mntx血浆浓度-时间概况示于表24。mntx药代动力学参数–食物的影响当与在禁食状态中给药相比时,在喂食状态中给予口服mntx导致较低的mntx血浆浓度(表24和表25)。在喂食患者中的cmax的算术平均值为在禁食患者中所测的大约四分之一(28%)(分别为12.91ng/ml和45.55ng/ml)。对于系统暴露,经auclast和auc0-∞测定,喂食患者比禁食患者低大约50%。auc0-∞的平均值,在喂食状态中为169.0ng.h/ml,在禁食状态中为364.3ng.h/ml。与禁食状态相比,在喂食状态中的中位tmax被延迟(分别为2.0hr和4.0hr)。在喂食状态下的口服清除率(cl/f)几乎是禁食状态下的2倍。在喂食和禁食状态下的末端速率常数相似(各自为λz=0.04h-1),表明当伴随或不伴随食物给药时mntx的末端t½相似(各自为大约17h)。表24:mntx450mg的平均(±sd)血浆药代动力学参数:食物影响表25给出当在禁食(参考)和喂食(测试)条件下给予时,单剂量mntx450mg的生物等效性的统计学评价结果。对于cmax、auclast和auc0-∞,禁食与喂食之比的90%ci是在80%至125%的可接受的生物等效性范围之外,表明在喂食和禁食条件下的非生物等效性。与喂食患者相比,禁食患者的系统暴露参数(cmax、auclast和auc0-∞)更高。表25:mntx450mg的cmax和auc之比和90%ci:单剂量禁食与单剂量喂食当与在禁食条件下mntx给药相比时,在喂食条件下将单次450mg剂量的mntx给予健康受试者,导致系统暴露明显降低。auclast和auc0-∞比率两者都是非生物等效性的(禁食与喂食之比的90%ci在80%至125%的范围之外)并且在禁食中的这两个参数是喂食患者的大约2倍。同样,喂食状态下的口服清除率值几乎是禁食状态下的2倍。另外,在喂食和禁食状态的mntxcmax并非生物等效的(例如,几何平均值之比=273.6%;90%ci=222.6%至336.3%)。在喂食患者中的cmax的算术平均值为在禁食患者中所测的大约四分之一(28%)(分别为12.91ng/ml和45.55ng/ml)。与禁食状态相比,在喂食状态中的中位tmax被延迟(分别为2.0hr和4.0hr)。在喂食和禁食条件下的末端速率常数相似(各自为λz=0.04h-1),这与表明当伴随或不伴随食物给药时mntx的末端t½相似(各自为大约17h)的数据是一致的。32个患者中有5个(16%)在研究期间经历了至少1次teae。4个患者在禁食给予期期间具有teae,3个患者在喂食给予期期间具有teae。最频繁经历的teae为头痛(2个患者,6%)。调查人员认为所有teae都是轻度的。调查人员不认为teae与mntx相关。没有死亡、sae或teae导致研究终止。在研究期间观察到患者的实验室检验结果的微小变化。无实验室检验结果被调查人员认为是teae。在该试验中未观察到mntx对心脏安全性参数或生命体征的明显影响。其它研究结果表明,口服给予的mntx药代动力学的特点是低生物利用度,gi道之外的有限的组织分布(包括有限的中枢神经系统暴露)和低血浆蛋白结合。峰值血浆浓度和auc看来随剂量增加而增加。在该研究中观察到的高脂肪饮食对单次450-mg口服剂量的mntx的药代动力学的影响与先前用其它mntx口服制剂(ir片剂和胶囊剂)所观察到的是一致的。在先前的研究中,禁食增加了mntx的系统吸收大约25%。在本研究中,食物的存在显著地延迟了mntx吸收(例如,tmax增加),并减少了mntx系统暴露大约二分之一到四分之三(经auc和cmax检测)。禁食和喂食状态的口服mntx并非生物等效的。在3期研究中\第一剂研究药物之后,与未禁食患者相比,在禁食患者中还增加了mntx的排便效果。该结果表明mntx治疗功效与系统吸收程度相关。尽管禁食增加了对mntx的系统暴露,但在喂食和禁食条件之间teae的发生率却相似。单剂量mntx450mg是良好耐受的;5个患者报告了teae,所有患者在强度上都是轻度的。实施例5:与皮下给予甲基纳曲酮相比,口服给予甲基纳曲酮的临床药代动力学本文中评价的mntx的口服剂量水平和制剂与口服mntx片剂的3期研究中的那些是相同的,除了mntx片剂上的非功能性包衣之外。该非功能性包衣是由无活性成分聚乙烯醇、聚乙二醇和二氧化钛组成。在单独的研究中比较了3期研究中使用的未包衣片剂和本研究中使用的包衣片剂的药代动力学。本研究经设计用于评价口服给予150、300和450mgmntx剂量与12mg皮下(sc)注射mntx的相对生物利用度。还计划了口服mntx片剂的单剂量的药代动力学特征,用于本研究中的评价。本研究的目的是评价150、300和450mg单次口服剂量的mntx片剂与12mg单次sc剂量的mntx的相对生物利用度,并表征在健康受试者中单次口服剂量给予之后mntx片剂的药代动力学。本文给出的是随机的、开放标签的交叉研究,由6个给予顺序组成,每个具有2个给予期;给予期间隔7天。所有患者自第-1天至第14天都住在临床研究单位内并让他们在第15天出院,结束他们对研究的参与。在第1天和第8天接受研究药物之前,患者经历过夜禁食至少10小时,其分别在第0天和第7天开始。在这两个给予期中,患者接受单次口服剂量的mntx片剂(150、300或450mg)或单次sc注射mntx(12mg)。以交替方式进行给药(例如,在一次访问时给予片剂,在另一次访问时给予sc注射)。对于每个患者,通过随机安排确定口服甲基纳曲酮剂量强度(150mg、300mg,或450mg)和给予顺序(第1天:口服片剂;第8天:sc注射vs交替给药顺序)。给予每个口服剂量以及240ml室温的饮用水。指示患者喝掉所有的水并告诉他们吞咽完整的片剂(例如不要咀嚼、分开或压碎它们)。在第1天给药前(大约1小时前),和在第1天和第8天的给药后的0.25、0.5、1、2、4、6、8、10、12、16、24、36、48、72、96、120、144和168小时采集血液样品用于药代动力学分析。每一片剂含有150mg活性药物成分mntx。另外,每一片剂含有以下无活性成分:胶态二氧化硅、交聚维酮、乙二胺四乙酸二钠钙二水合物(edetatedisodiumcalciumdihydrate)、硬脂酸镁、微晶纤维素、聚山梨酯80、硅化微晶纤维素、碳酸氢钠、月桂基硫酸钠和滑石粉。每一注射管含有12mg活性药物成分mntx/0.6ml溶液(即20mg/ml溶液)。所述制剂还含有以下无活性成分:乙二胺四乙酸二钠钙、氯化钠、盐酸甘氨酸和氢氧化钠。在本研究中,纳入的所有48个患者在2个研究期的每一个中都接受研究药物并被包括在安全性和药代动力学分析中。在12mgsc注射后15分钟观察到mntx的平均cmax,然后血浆浓度在给予后的最初期间内快速下降(表26;缩略语:po=经口服,sc=皮下)。始于给予后大约4小时并持续到给予后至少72小时,对于300mg和450mg剂量,口服mntx给予后,相对于sc注射而言有更大的mntx平均血浆浓度,但对于150mg口服剂量却不如此。与口服mntx相比,scmntx的单剂量药代动力学参数表明,在scmntx12mg后的cmax是口服mntx150、300和450mg的4至13倍,tmax是口服mntx150、300和450mg的1/8至1/6,t½比口服mntx150、300和450mg短5至7小时(表26)。在口服剂量中,通过cmax和auc测定的mntx的系统暴露基本遵循线性、剂量依赖性趋势(表26)。平均auc和cmax值随着单次口服剂量的mntx片剂从150mg增加至450mg而增加;分别在mntx150mg和mntx450mg时,cmax从13.2增加至39.9ng/ml,auc0-∞从106.9增加至373.3ng•h/ml。中位tmax值是恒定的,范围为给药后大约1.5-2.0小时。口服给药组的平均cl/f值也是相似的。当口服mntx剂量分别从150mg增加至450mg时,平均t½从14.0小时略微增加至16.6小时。在sc注射给药后(中位tmax=15分钟)比在任何口服研究药物给予后(中位tmax范围为1.5-2.0小时)cmax发生得更快(表26)。系统暴露参数(cmax和auc)的比较表明,scmntx12mg后的平均cmax是每一口服mntx剂量后的至少4倍;然而,在scmntx12mg后的平均auc0-∞比口服mntx300mg仅高出16%并且比口服mntx450mg低28%(表26)。scmntx12mg后的平均cmax值为174.0ng/ml,相比之下,口服mntx300mg和450mg后分别为26.2和39.9ng/ml;scmntx12mg后的平均auc0-∞值为269.1,相比之下,口服mntx300mg和450mg后分别为231.2和373.3ng•h/ml。此外,与scmntx12mg和口服mntx450mg、300mg或150mg中观察到的cmax和auc中的差异一致的是,sc后的mntx消除比口服给药后更快(表26)。将scmntx12mg与口服mntx450mg相比,mntx清除率(cl/f)更快,为45698.7比1664001.3ml/h,而t½值更短,为9.2比16.6小时。表26:口服mntx(150、300和450mg)和皮下mntx(12mg)的单剂量药代动力学参数口服mntx450mg导致cmax为scmntx12mg的cmax的大约20%,auc0-∞为scmntx12mg的auc0-∞的大约123%;口服片剂(测试)与sc注射(参考)的几何平均值之比为20.0%(对于cmax)和123.2%(对于auc0-∞)(表27)。对于cmax的90%置信区间的下限(4.3%)完全低于80%,对于auc0-∞的90%置信区间的上限(150.7%)大于125%,表明通过80%至125%法则,这两个参数并非生物等效的。另外,口服mntx300mg和150mg后的cmax值分别为scmntx12mg后的cmax的大约13%和6%,而这些口服剂量后的auc0-∞值分别为scmntx12mg后的auc0-∞的大约75%和36%(表27中的几何平均值之比)。cmax和auc0-∞几何平均值之比的90%置信区间表明,通过80%至125%法则,300mg和150mg口服剂量与scmntx12mg的非生物等效性(90%置信区间的下限为<80%)。将口服mntx450mg与scmntx12mg的算术平均auc0-∞值相比,口服mntx相对于scmntx的生物利用度为3.7%(标准化至以mg/kg计的剂量[假设平均为81kg体重,根据患者平均统计资料],根据以下计算:373.3ng•h/ml/[450mg/81kg]÷269.1ng•h/ml/[12mg/81kg]×100)。对于300mg和150mg剂量,口服mntx相对于scmntx的剂量标准化的生物利用度分别为3.4%和3.2%。表27:口服mntx与scmntx系统暴露参数的几何平均值之比和90%置信区间(药代动力学群体)在口服剂量中,通过cmax和auc测定的mntx的系统暴露基本遵循线性、剂量依赖性趋势。平均auc和cmax值随着单次口服剂量的mntx片剂从150mg增加至450mg而增加;分别在mntx150mg和mntx450mg剂量时,cmax从13.2增加至39.9ng/ml,auc0-∞从106.9增加至373.3ng•h/ml。在12mgscmntx注射给予后(中位tmax=15分钟)比在任何口服研究药物给予后(中位tmax范围为1.5-2.0小时)cmax发生得更快。系统暴露参数(cmax和auc)的比较表明,在scmntx12mg后的平均cmax是每一口服mntx剂量后的4至13倍;然而,在scmntx12mg后的平均auc0-∞比口服mntx300mg仅高出16%并且比口服mntx450mg低28%。scmntx12mg后的平均cmax值为174.0ng/ml,相比之下,口服mntx300mg和450mg后分别为26.2和39.9ng/ml;scmntx12mg后的平均auc0-∞值为269.1,相比之下,口服mntx300mg和450mg后分别为231.2和373.3ng•h/ml。口服mntx片剂(测试)相对于scmntx注射(参考)的几何平均值之比的计算表明,口服mntx450mg剂量的cmax为12mgscmntx注射所观察到的cmax的大约20%,口服mntx450mg剂量的auc0-∞为12mgscmntx注射所观察的auc0-∞的大约123%。另外,口服mntx300mg和150mg后的cmax值分别为scmntx12mg后的cmax的大约13%和6%,而这些口服剂量后的auc0-∞值分别为scmntx12mg后的auc0-∞的大约75%和36%。与12mgscmntx注射和口服mntx450mg、300mg或150mg剂量中观察到的cmax和auc中的差异一致的是,sc注射后的mntx消除比口服给药后更快:将12mgscmntx注射与口服mntx450mg剂量相比,mntx清除率(cl/f)更快,为45698.7比1664001.3ml/h,而t½值更短,为9.2比16.6小时。将口服mntx450mg、300mg或150mg剂量与12mgscmntx注射的算术平均auc0-∞值相比,口服mntx相对于scmntx注射的剂量标准化的生物利用度分别为3.7%、3.4%和3.2%。这是1期、随机的、开放标签的交叉研究,由6个给予顺序组成,每个具有2个给予期。在这两个给予期中,患者接受单次口服剂量的mntx片剂(150、300或450mg)或单次sc注射的mntx(12mg)。以交替方式进行给药(例如,在一次访问时给予片剂,在另一次访问时给予sc注射)。纳入48个患者,有47个患者(97.9%)完成了研究;一个患者在这两个研究期中接受研究药物后因个人原因而终止。患者按照随机安排而接受研究药物;具体地讲,16个患者各自接受单次口服剂量的150、300和450mgmntx片剂,所有48个患者都接受单次12mgsc注射mntx。与口服mntx相比,scmntx的单剂量药代动力学参数表明,在scmntx12mg后的cmax是口服mntx150、300和450mg后的4至13倍,tmax是口服mntx150、300和450mg后的1/8至1/6,t½比口服mntx150、300和450mg后的短5至7小时。在口服剂量中,通过cmax和auc(auclast和auc0–∞两者)测定的mntx的系统暴露基本遵循线性、剂量依赖性趋势。系统暴露参数(cmax和auc)的比较表明,在scmntx12mg后的平均cmax是每一口服mntx剂量后的至少4倍;然而,在scmntx12mg后的平均auc0-∞比口服mntx300mg仅高出16%并且比口服mntx450mg低28%。与口服mntx150mg、300mg或450mg后的tmax(分别为2、1.5和2小时)相比,在scmntx12mg后的tmax更短(15分钟)。此外,与在cmax和auc中观察到的差异一致的是,与口服mntx450mg相比,scmntx12mg的t½值更短,为9.2比16.6小时(在口服mntx300mg和150mg后t1/2分别为14.2和14.0小时)。在健康成人中的近期研究以及在非癌症疼痛和oic患者和处于稳定的美沙酮维持的患者中的先期研究中也研究了口服mntx150mg片剂(离子对)制剂的单剂量药代动力学。口服mntx的单剂量药代动力学参数在本研究和这些其它研究中普遍是相似的,尽管当与在非癌症疼痛和oic患者和处于稳定的美沙酮维持的患者中的先期研究相比时,在本研究和健康成人的近期研究中在cmax和auc中有某些数量上的差异。在处于稳定的美沙酮维持的患者的药代动力学研究中,将经sc注射的甲基纳曲酮与口服给予的mntx进行比较。在本研究中的口服mntx制剂不同于先前的研究,其中口服制剂是在胶囊剂中的肠溶包衣的颗粒剂和肠溶包衣片剂。尽管因为不同的口服mntx制剂而难以比较本研究和先前的研究,但是sc给予和口服给予之间的可比较的药代动力学特性在各研究中是相似的。具体地讲,如在本研究中,与口服给药相比,在sc给药后的tmax更短,cmax更高,t1/2更短;而sc给予和口服给予的auc值的差异比起cmax、tmax和t1/2的差异更不明显。在先前研究中,相对于sc注射的剂量标准化的口服生物利用度为2.43%(对于肠溶包衣胶囊剂)和2.27%(对于肠溶包衣片剂),相比之下,在本研究中为3.7%(对于口服片剂(离子对)制剂)。在该2期交叉研究中,口服剂量的150、300和450mgmntx片剂和12mgmntxsc注射在健康志愿者中是良好耐受的,所述健康志愿者接受3种口服剂量的mntx片剂中的一种以及sc注射mntx。本领域技术人员将会容易地确定本发明的基本特征,并理解先前的描述和实施例对实践所提供的本发明是说明性的。本领域技术人员能够确定仅使用常规实验,对于本文描述的本发明的具体实施方案可以进行本文给出的细节的许多改动而不偏离本发明的精神和范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1