大黄酚在制备预防和/或治疗胰岛素抵抗的产品中的应用的制作方法
[0001]
本发明涉及大黄酚的用途领域,特别是涉及大黄酚在制备预防和/ 或治疗胰岛素抵抗的产品中的应用。
背景技术:
[0002]
大黄属于蓼科多年生植物,是大黄属多种植物合称,最早记载于《神农本草经》,“荡涤肠胃,通利水谷,调中化食”,是胃肠积滞症候的常用药。
[0003]
大黄化学成分包括蒽醌类、吡喃酮类、苯丁酮类、萘苷类、酰基糖苷类、二苯乙烯类、鞣质前体及鞣质等,其中蒽醌类成分是大黄酚,学名chrysophanol,是大黄中的主要活性成分。
[0004]
目前研究发现大黄酚对多种细菌有抗菌作用,能止咳、促进肠管运动、促使神经兴奋和肌肉麻痹,对小鼠黑色素瘤也有明显的抑制作用,但其在降血糖方面的研究未见报道。
技术实现要素:
[0005]
本发明主要解决的技术问题是提供大黄酚在制备预防和/或治疗胰岛素抵抗的产品中的应用,证明大黄酚确有降血糖、改善胰岛素抵抗作用。
[0006]
为解决上述技术问题,本发明采用的一个技术方案是:
[0007]
提供大黄酚、大黄酚在药学上可接受的水合物、大黄酚在药学上可接受的盐和大黄酚衍生物中的至少一种,在制备预防和/或治疗胰岛素抵抗的产品中的应用。
[0008]
进一步地,所述产品为预防和/或治疗糖尿病、高血压、高血脂、心血管疾病、代谢综合征中的至少一种的产品。
[0009]
更进一步地,所述产品为胰岛素增敏剂。
[0010]
所述胰岛素增敏剂,是指增强人体对胰岛素敏感性,促进胰岛素充分利用的物质。
[0011]
在本发明的具体实施方式中,通过大黄酚处理处于胰岛素抵抗状态的细胞后,细胞对胰岛素的敏感性明显增强,显著提高了胰岛素刺激下的葡萄糖摄取能力,说明大黄酚能增加细胞对胰岛素的敏感性,从而有效降低血糖,确有改善胰岛素抵抗的作用。
[0012]
更进一步地,所述产品为akt激动剂。
[0013]
所述akt激动剂,也称akt活化剂,是指能激活akt的磷酸化的物质。
[0014]
akt是胰岛素信号通路中的主要效应激酶,其丝氨酸473位点磷酸化是其发挥激酶活性所必须的,活化的akt可以通过调节包括gsk3在内的一系列下游分子增加糖原的生成,同时磷酸化foxo1使其出核失活,从而抑制糖异生基因葡萄糖-6-磷酸酶及磷酸烯醇式丙酮酸羧激酶的表达及糖异生,最终降低血糖。
[0015]
本发明还提供了大黄酚、大黄酚在药学上可接受的水合物、大黄酚在药学上可接受的盐、和大黄酚衍生物中的至少一种,在制备促进外周组织增加葡萄糖利用的产品中的应用。
[0016]
进一步地,所述产品为提高骨骼肌细胞对葡萄糖的摄取能力的产品。
[0017]
本发明还提供了大黄酚、大黄酚在药学上可接受的水合物、大黄酚在药学上可接受的盐和大黄酚衍生物中的至少一种,在制备胰岛素增敏剂中的应用。
[0018]
本发明还提供了大黄酚、大黄酚在药学上可接受的水合物、大黄酚在药学上可接受的盐和大黄酚衍生物中的至少一种,在制备具有降血糖作用的产品中的用途。
[0019]
本发明还提供了一种akt激动剂,是以大黄酚为主要成分。
[0020]
本发明还提供了一种降血糖药物,是以大黄酚为主要成分。
[0021]
本发明的有益效果是:
[0022]
(1)本发明通过试验证明大黄酚具有促进骨骼肌细胞对葡萄糖的摄取能力从而改善骨骼肌的胰岛素敏感性,可用于制备提高骨骼肌细胞对葡萄糖的摄取能力的产品。
[0023]
(2)本发明通过试验证明大黄酚可促进改善细胞胰岛素抵抗状态,增加细胞对胰岛素的敏感性,可用于制备胰岛素增敏剂等预防和/或治疗胰岛素抵抗的产品。
[0024]
(3)本发明通过试验证明大黄酚可激活akt信号通路改善c2c12 胰岛素抵抗状态,增加细胞对葡萄糖的摄取能力,从而达到降血糖的效果,可用于制备akt激动剂等降血糖产品。
附图说明
[0025]
图1是(a)大黄酚结构式;(b)大黄酚对c2c12细胞活力的影响;
[0026]
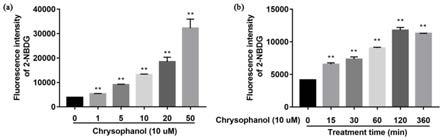
图2是(a)不同浓度大黄酚对c2c12细胞葡萄糖摄取能力的影响; (b)大黄酚在不同时间对c2c12细胞葡萄糖摄取能力的影响;
[0027]
图3是大黄酚改善c2c12细胞胰岛素抵抗状态。
具体实施方式
[0028]
下面结合附图对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0029]
实施例1
[0030]
一、大黄酚对c2c12细胞活力的影响(mtt法)
[0031]
mtt溶液配制:称取25.0mg mtt粉末,用5ml pbs充分溶解,配制成浓度为5mg/ml,分装后避光,于-20℃保存。
[0032]
试验方法:将c2c12成肌细胞接种至96孔培养板,每孔0.5
×
104个细胞(100μl培养液),用含10%胎牛血清的dmem培养液培养12h 至细胞完全汇合,用含10%胎牛血清培养基配制的浓度分别为0、1、10、 20、50、100μm的大黄酚(chrysophanol)处理细胞24小时,每个浓度设置3个复孔,每孔200μl。孵育完成后每孔加入10μl新鲜配制的终浓度为5mg/ml mtt溶液继续培养4h后,吸除培养孔中的液体终止反应,每孔加入100μl dmso,平板震荡器上充分振摇10min,使结晶充分溶解,立即在酶标仪上测定吸光度,检测波长为490nm。按以下午公式计算细胞存活率。
[0033]
细胞存活率(%)=(药物组od/空白组od)
×
100%
[0034]
本实验通过mtt法测定大黄酚对c2c12细胞活力的影响。mtt法测定细胞活力的原理是根据活细胞线粒体中具有高活性的琥珀酸脱氢酶,可将黄色的mtt还原为不溶性的蓝
紫色结晶,并且在一定细胞数范围内结晶形成的量与细胞数成正比,而死细胞无此功能。dmso能溶解细胞中的结晶,并且在490nm处有最大吸收值,因此用酶标仪在490nm 波长下测定其光吸收值,可间接反映活细胞数量,由此可以推断出细胞的存活率。该方法广泛应用于肿瘤放射敏感性测定、细胞毒性实验以及大规模的抗肿瘤药物筛选等。该实验中,分别用浓度为0,1,10,20, 50,100μm的大黄酚处理c2c12细胞24小时,每个浓度设置4个重复,实验结果如图1所示。从图1可以看出,在20μm以内大黄酚对c2c12 细胞活力基本没有影响,细胞活力均在90%以上;当大黄酚浓度提高到 50~100μm时对细胞活力有一定抑制,但细胞活力仍在70%以上。
[0035]
二、大黄酚对c2c12细胞摄取葡萄糖能力的影响(2-nbdg摄取法)
[0036]
本试验例主要从药物作用浓度和作用时间两个方面研究大黄酚对 c2c12细胞葡萄糖摄取能力的而影响。
[0037]
①
将c2c12细胞以3
×
104个/ml接种至6孔板中培养24小时,移去培养液,分别用0,1,5,10,50μm大黄酚处理细胞24小时。改用含有10μm 2-nbdg的无糖dmem孵育1小时,dpbs洗2遍洗去多余探针,1ml dpbs悬浮细胞,转入1.5ml离心管1000rpm离心5 min,弃上清,300μl dpbs重悬细胞,fitc通道流式检测荧光强度。
[0038]
②
将c2c12细胞以3
×
104个/ml接种至6孔板中培养24小时,移去培养液,分别用浓度为10μm的大黄酚处理细胞0,15,30,60,120, 360min。改用含有10μm 2-nbdg的无糖dmem孵育1小时,dpbs 洗2遍洗去多余探针,1ml dpbs悬浮细胞,转入1.5ml离心管1000rpm 离心5min,弃上清,300μl dpbs重悬细胞,fitc通道流式检测荧光强度。
[0039]
三、大黄酚改善c2c12细胞胰岛素抵抗状态
[0040]
细胞处理方法:将c2c12细胞以3
×
104个/ml接种至6孔板中培养12小时,分为对照组和实验组,实验组用500μm油酸(oa)处理细胞24小时使c2c12细胞处于胰岛素抵抗状态,实验组中又分为模型组和大黄酚处理组,大黄酚处理组在oa处理的同时加入大黄酚(10, 20μm)共同孵育24小时。孵育完成后改用100nm的胰岛素刺激细胞 1小时,然后进行各项指标的测定。
[0041]
2-nbdg摄取实验:细胞处理完成后,改用含有10μm 2-nbdg的无糖dmem孵育1小时,dpbs洗2遍洗去多余探针,1ml dpbs悬浮细胞,转入1.5ml离心管1000rpm离心5min,弃上清,300μl dpbs 重悬细胞,fitc通道流式检测荧光强度。
[0042]
western blot检测akt磷酸化水平:
[0043]
①
主要试剂配制:
[0044]
电泳缓冲液(5
×
):准确称取tris 7.58g,glycine 46.90g,sds 2.50 g,加少量的去离子水并不断搅拌使其完全溶解,然后定容至500ml,室温保存即可。电泳缓冲液(1
×
):量取20ml的电泳缓冲液(5
×
)加入480ml的去离子水即配制成1
×
的电泳液。
[0045]
转膜液(10
×
):准确称取tris 15.15g,glycine 72.00g,加少量的去离子水并不断搅拌使其完全溶解,然后用容量瓶定容至500ml,室温保存即可。
[0046]1×
转膜液:用量筒量取70ml的转膜液(10
×
),然后加入140ml甲醇和490ml的去离子水(按转膜液(10
×
):甲醇:去离子水=1:2:7的比例),即配制成1
×
转膜液。
[0047]
tbs(10
×
):准确称取tris 12.12g,nacl 40.04g,加少量的水至完全溶解,定容至500ml,用ph计测定ph值并用浓盐酸调至ph7.5,室温保存即可。
[0048]1×
tbst:以tbs(10
×
):去离子水:吐温20=1:9:1
‰
的比例配制 1
×
tbst。
[0049]
10%过硫酸铵(ap):准确称取ap 40.0mg,加入400μl的去离子水,翻转摇晃至完全溶解,4℃保存备用。
[0050]
5%封闭液(bsa):准确称取bsa或脱脂奶粉1.00g,加入20ml 的1
×
tbst液,翻转摇晃,至完全溶解,室温保存即可。
[0051]5×
sds上样缓冲液:准确称取0.5mol/l tris-hcl(ph 6.8)2.5ml,二硫叔糖醇(dtt)0.39g,sds 0.50g,甘油2.5ml,溴酚兰25.0mg,不断搅拌使其充分混匀,分装于1.5ml的无菌离心管中,4℃保存即可。
[0052]
②
细胞总蛋白的提取:
[0053]
a.细胞培养完成后,取出培养板,弃去孔内培养液,用pbs洗2 遍,置于冰浴上,每孔加入100μl蛋白裂解液(ripa)(用前数分钟向细胞裂解液中1:100加入pmsf,终浓度1mm)。
[0054]
b.细胞裂解约10min后,先用细胞刮子刮下细胞,吸到1.5ml离心管中,(可用超声破碎仪破碎3-5次),然后4℃,12000rpm,15-20min离心,取上清转移到新的离心管中进行蛋白定量或-80℃保存。
[0055]
③
蛋白浓度的测定:
[0056]
蛋白含量的测定采用bca法,操作按照方法按照试剂盒说明书进行:
[0057]
a.蛋白标准液的配制:30mg bsa加1.2ml蛋白标准配置液配成 25mg/ml,-20℃保存。使用前用蛋白标准配制液稀释至0.5mg/ml。
[0058]
b.工作液的配制:试剂a:试剂b=50:1混匀,24h内稳定。
[0059]
c.将蛋白标准工作液分别取0,1,2,4,8,12,16,20ul加入 96孔板,用pbs或生理盐水补足20μl。加入适当体积(1-2μl)样品至96孔板,加pbs补至20μl。各孔加入200μl bca工作液,37℃震荡孵育30min,562nm测定od值。尽量保持od值在0.1-1之间。标准曲线:y=ax+b,x:蛋白浓度;y:od值。
[0060]
表1蛋白定量表
[0061][0062]
注:一个泳道上的蛋白上样量20-30μg,总体积相同,终浓度一致。
[0063]
d.加5
×
loading buffer与蛋白样品1:4混匀后,100℃水浴10min(缠上封口膜,防止弹开),4℃保存。
[0064]
④
sds-page电泳
[0065]
a.制胶:洗净玻璃板和梳子,晾干,玻璃板对齐后放入夹子中卡紧,正确地组装制胶装置,操作前往玻璃板中间灌水,检查是否漏液。根据目的蛋白的分子量按照表3-4选择所需的分离胶浓度,该部分实验的目的蛋白分子量均在20-80kda,所以所需分离胶浓度为10%,按表3-5 配好胶,混匀,用5ml移液枪沿着制胶板缓慢加入制胶板防止产生气泡,然后用水或异丙醇压胶赶走气泡,室温放置30min,等分离胶完全凝固(30min),倒掉上层的水或
异丙醇。然后按照表3-6配制5%的浓缩胶,加入到分离胶的上层,垂直加入梳子,室温凝固30min以上,轻轻拔掉梳子。
[0066]
表2不同浓度的sds-page分离胶的最佳分离范围
[0067][0068]
表3 10%sds-page分离胶配制表
[0069][0070]
表4 5%sds-page浓缩胶配制表
[0071]
[0072][0073]
b.上样与电泳:待浓缩胶凝固好后,连同玻璃板一起安装到电泳槽中,加入电泳缓冲液准备上样。将微量移液枪插入到加样孔中,缓慢加入样品,每个泳道20-50μg总蛋白或100ng纯蛋白。当加入不同处理组的蛋白样品时,枪头需要用电泳缓冲液洗涤,以免造成交叉污染。其中,第一个泳道加入5μl的预染marker,再用1
×
蛋白上样缓冲液补齐至和其他孔相同的上样体积,样品两侧的及空置的泳道用等体积的1
×
loading buffer上样。上样完成后需要尽快进行电泳,80v浓缩30min,然后120v 进行电泳,直至前沿跑至分离胶下沿时,停止电泳。
[0074]
⑤
转膜
[0075]
a.pvdf膜提前用甲醇浸泡1min,用1
×
转膜液浸泡10min。
[0076]
b.取出胶,上下左右裁去多余的胶,从黑板到白板一次是滤纸-胶
-ꢀ
膜-滤纸,赶除气泡,夹上夹子,黑对黑,白对白放入转膜槽中。
[0077]
c.转膜一般采用恒流的方法,根据目的蛋白分子量大小选择转膜电流和转膜时间。
[0078]
⑥
封闭
[0079]
转膜结束后,将pvdf用含5%脱脂奶粉的tbst室温摇床封闭1 小时进行封闭。
[0080]
⑦
孵育抗体
[0081]
一抗用含5%bsa或5%脱脂奶粉的tbst稀释(1:1000)(具体稀释倍数参见抗体说明书),封闭结束后,将pvdf膜与稀释好的一抗于 4℃孵育过夜。孵育结束后,用tbst洗膜5次,每次10min。
[0082]
二抗用含5%脱脂奶粉(1:2000)的tbst稀释,一抗孵育完成后,用相应的hrp标记的二抗室温孵育2h,用tbst洗膜5次,每次10min。
[0083]
8显影
[0084]
ecl法检测法,1:1配制显影液,现用现配,每张膜大约加显影液 100-200μl。
[0085]
图3中(a)显示,100nm胰岛素刺激正常c2c12细胞1小时后,细胞对葡萄糖摄取能力显著提高;500μm oa处理c2c12细胞24小时,细胞对胰岛素的敏感性下降,与正常组中胰岛素处理组相比差异显著,说明 oa引起c2c12细胞产生胰岛素,模型建立成功;大黄酚处理组中,10 μm和20μm的大黄酚均能改善c2c12细胞胰岛素抵抗状态,显著提高胰岛素刺激下的葡萄糖摄取能力,与oa单独处理组相比差异显著,说明大黄酚具有改善oa引起的c2c12细胞
胰岛素抵抗状态。
[0086]
图3中(b)结果显示,c2c12细胞内pakt的表达水平的变化与其对葡萄糖摄取能力的变化基本一致,说明大黄酚可能通过激活akt信号通路改善c2c12胰岛素抵抗状态,增加细胞对葡萄糖的摄取能力,从而达到降血糖的效果。
[0087]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1