一种芬苯达唑在制备抗肿瘤药物中的应用的制作方法
本发明属于生物医药领域,具体涉及一种芬苯达唑在制备抗肿瘤药物中的应用。
背景技术:
肿瘤是引起人类死亡的主要原因之一,其发病率与致死率总体呈逐年上升的趋势。在我国,随着城市化进程的加快,肺癌的发病率和死亡率在恶性肿瘤中长期居于首位。虽然关于肺癌的研究取得了很多进展,包括筛查和治疗方面,但肺癌患者的总体生存率仍然较低,肿瘤复发率目前仍保持不变。肺癌复杂的发病机制、治疗拮抗的发生、高发的复发转移且抗肿瘤治疗毒副作用大、精准性差等因素均是导致总体治疗效果不佳的重要原因。因此,开发新型的抗肿瘤药物是控制肺癌进展的重要方向。
芬苯达唑,是苯并咪唑类驱虫剂,分子式为c15h13n3o2s,结构如式(i)所示。研究表明,其对胃肠道寄生虫的成虫及幼虫都有高度驱虫活性,并有极强的杀虫卵作用。芬苯达唑的驱虫机制可能与扰乱微管形成,破坏动力微管,诱导胚胎发育停滞有关。同时,有报道称芬苯达唑还能参与许多细胞的代谢组学,干扰这些细胞的糖脂代谢。
技术实现要素:
本发明提供了一种芬苯达唑在药物制备中的应用,实验结果表明,芬苯达唑具有一定的抗肿瘤效果,可以作为一种潜在的抗肿瘤药物。
一种芬苯达唑在药物制备中的应用,所述的药物为抗肿瘤药物。
作为优选,所述的抗肿瘤药物用于治疗肺癌。
作为优选,所述的肿瘤细胞为肺癌细胞pc9、肺癌细胞h460或肺癌细胞a549。
作为优选,所述的抗肿瘤药物包括活性组分;
所述的活性组分由芬苯达唑和姜黄素组成。
作为优选,所述的姜黄素与所述的芬苯达唑的摩尔比为5~10:0.25~0.75。
作为进一步优选,所述的姜黄素与所述的芬苯达唑的摩尔比为5:0.25~0.5,在该摩尔比范围之内,两者具有较强的协同作用,能够显著增加抗癌效果。
作为优选,所述的抗肿瘤药物用于抑制肺癌细胞的增殖,限制肺癌细胞集落的形成。
作为优选,所述的抗肿瘤药物用于诱导肺癌细胞g2/m期阻滞
作为优选,所述的抗肿瘤药物用于诱导肺癌细胞发生细胞凋亡。
同现有技术相比,本发明的有益效果体现在:
(1)本发明开发了芬苯达唑新的抗癌用途,尤其是作用于肺癌;
(2)本发明通过芬苯达唑与现有抗肺癌药物姜黄素的联用,两者之间可以产生强协同作用,提高抗癌效果,降低药物用量。
附图说明
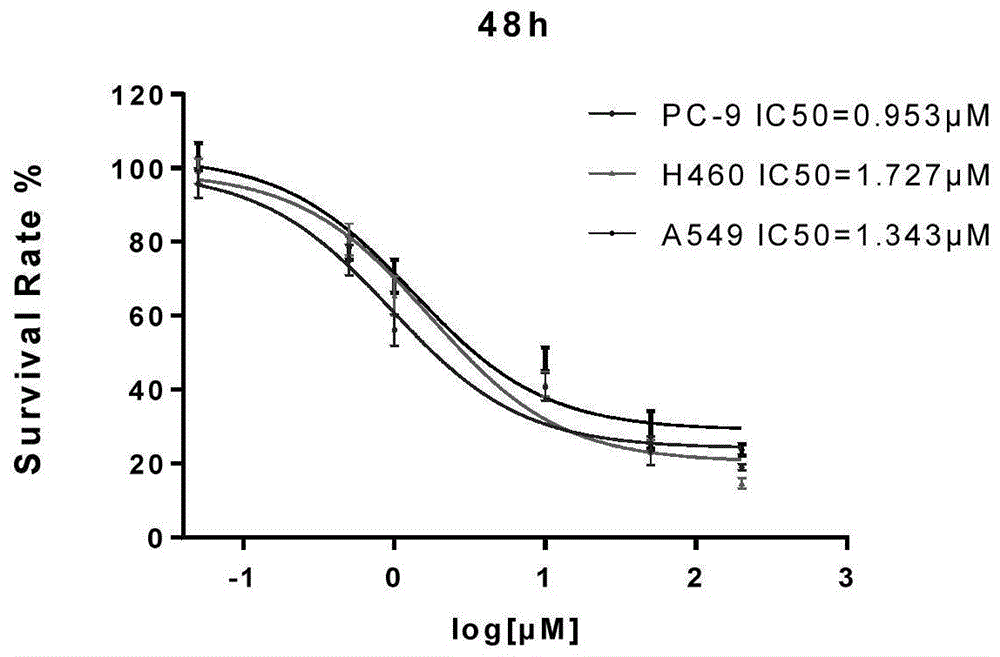
图1为实施例1中mtt实验中芬苯达唑对肺癌细胞增殖的抑制作用;
图2为实施例1中集落形成实验中芬苯达唑对肺癌细胞集落形成的抑制作用;
图3为实施例2中芬苯达唑肺癌细胞g2/m期阻滞的影响;
图4为实施例3中芬苯达唑诱导pc-9、h460和a549细胞凋亡的具体活性的结果图;
图5为实施例3中芬苯达唑诱导肺癌细胞核固缩,核碎裂,引起细胞凋亡的结果图;
图6为实施例4中芬苯达唑与姜黄素协同抑制pc-9细胞的结果;
图7为实施例4中芬苯达唑与姜黄素协同抑制h460细胞的结果;
图8为实施例4中芬苯达唑与姜黄素协同抑制a549细胞的结果。
具体实施方式
下面结合具体实施例对本发明做进一步的描述。
实施例1细胞增殖和集落形成实验
通过mtt实验进行肿瘤细胞增殖实验,分析芬苯达唑对细胞增殖的影响。在96孔板中按3000个/孔铺入细胞,待细胞贴壁后加入不同药物浓度(0.05-200μm)的芬苯达唑,药物作用48h后加入25μl/孔mtt溶液(5mg/ml)。继续孵育4小时后终止培养,小心吸弃孔内培养上清液。每孔加150uldmso溶解结晶物。用酶联免疫监测仪在490nm波长上测定各孔光吸收值,计算ic50值,结果如图1所示。结果显示:药物作用48h后能够剂量依赖性地抑制肺癌细胞株的增殖,其中pc9的ic50最低,药物最敏感。
肿瘤细胞能够无限增殖形成细胞集落,通过集落形成实验,我们可以了解药物对细胞增殖的影响。在6孔板中按1000个/孔将细胞均匀铺入,待细胞贴壁后加入一系列浓度的药物,作用24h后撤去药物,加入新鲜培养基继续培养,待细胞形成肉眼可见的集落,用4%多聚甲醛固定之后用结晶紫染色,比较各孔间集落的大小和数量,结果见图2。结果显示,芬苯达唑能浓度依赖性地限制肿瘤细胞集落形成。
实施例2
细胞周期是一个受严密调控的有序发生的事件,基因组dna完成复制,随后基因组均等地分裂成两个相似的细胞。细胞周期可分为四期:g1,s,g2和m期。当细胞接收到信号说现在不利于分裂,或者时机不成熟,细胞就会在细胞周期的checkpoint停下来,进行检查。当时机成熟时,就继续分裂。当检查发现出现无法修复的错误时,细胞就会启动凋亡程序。在6孔板中均匀铺入细胞,待细胞贴壁后加入不同浓度的芬苯达唑(0.5-2μm),作用24h后收集细胞,加入预冷的75%乙醇-20℃固定。之后离心收集细胞,以1ml的pbs洗细胞一次,加入500ul溴化乙锭(pi)避光孵育10分钟后流式细胞仪上机检测细胞的周期分布,结果见图3。结果表明,芬苯达唑能诱导肺癌细胞g2/m期阻滞。
实施例3
将肺癌细胞均匀铺入6孔板中,不同浓度的芬苯达唑(0.5-2μm)作用48h后,利用annexinv-fitc/pi双染法在流式细胞仪上检测芬苯达唑诱导肺癌细胞凋亡的效果。发现芬苯达唑作用48h后能够剂量依赖性的诱导pc-9、h460和a549细胞产生凋亡,结果见图4。图4的结果表明芬苯达唑能显著诱导肺癌细胞发生细胞凋亡。
利用hoechst33258凋亡染色试剂盒染细胞核,通过观察细胞核的荧光染色情况判断细胞核形变程度,从而反映细胞凋亡的情况。发现不同浓度的芬苯达唑作用pc-9和h460细胞24h后,其细胞核发生核固缩核碎裂等凋亡表征,显示为高荧光强度或碎裂的荧光小点,表明细胞发生凋亡(图5)。
实施例4芬苯达唑与姜黄素的协同试验
在96孔板中按3000个/孔铺入细胞,待细胞贴壁后加入不同药物浓度的芬苯达唑,姜黄素单药或两者的联合(溶剂为dmso),药物作用48h后加入25ul/孔mtt溶液(5mg/ml)。继续孵育4小时后终止培养,小心吸弃孔内培养上清液。每孔加150uldmso溶解结晶物。用酶联免疫监测仪在490nm波长上测定各孔光吸收值,计算联合系数(ci),结果见图6-图8。图6-图8中的横坐标药物浓度单位为μm,溶剂为dmso;纵坐标为存活率。
根据ci值可以判断两者之间的相互作用,当0.9≤ci≤1.1,表示两者为叠加作用;当0.8≤ci<0.9,表示两者为低度协同作用;当0.6≤ci<0.8,表示两者为中度协同作用;当0.4≤ci<0.6,两者为高度协同作用;当0.2≤ci<0.4,两者为强协同作用。
结果显示,当采用不同浓度的芬苯达唑(fen)与姜黄素(cu)进行联合处理时,表现出不同的协同作用。
针对pc-9细胞,5μm的姜黄素与0.25μm的芬苯达唑组合,药物联合指数为0.360,两者为强协同作用;5μm的姜黄素与0.5μm、0.75μm的芬苯达唑组合,药物联合指数为0.429和0.569,两者为高度协同作用;10μm的姜黄素与0.25μm、0.5μm和0.75μm的芬苯达唑组合,药物联合指数分别为0.471、0.552和0.541,两者为高度协同作用。
针对h460细胞,5μm的姜黄素与0.25μm的芬苯达唑组合,药物联合指数为0.417,两者为高度协同作用;其他比例的组合,也都基本为协同作用。
针对a549细胞,5μm的姜黄素与0.25μm、0.5μm的芬苯达唑组合,药物联合指数分别为0.523和0.537,两者为高度协同作用;其他比例的组合,也都基本为协同作用。
由此可见,芬苯达唑与姜黄素有协同作用,两药联合能降低药物起效的浓度,明显抑制肺癌细胞增殖。
- 还没有人留言评论。精彩留言会获得点赞!