一种槲皮素与抗菌药物的联合应用的制作方法
本发明涉及一种抗菌药物领域,尤其涉及一种槲皮素与抗菌药物的联合应用。
背景技术:
抗菌药物在减少动物的疾病和死亡方面发挥了重要作用,它的发现和应用对人类和动物健康做出了重大贡献。然而,随着抗菌药物在全球范围内的频繁大量使用,细菌耐药性越来越严重,“超级细菌”的出现也成为世界难题,时刻威胁着生命的健康。而新的抗菌药物研制目前成本高且周期长,而联合用药作为一个解决细菌耐药性的问题具有十分大的潜力。
技术实现要素:
本发明的目的在于提供一种能够抑制细菌生长,同时槲皮素具有同抗菌药物协同抗大肠杆菌的作用,抗菌药物在更低剂量下抑制致病菌的生长,增强了抗菌药物的抗菌效力,并且可以减少细菌耐药性的产生,提高了抗细菌感染效果、减少抗菌药物的使用剂量,使得该复方或者该组合能够在预防及治疗细菌感染性疾病中得到应用的槲皮素与抗菌药物的联合应用。
本发明是通过如下措施实现的:
一种槲皮素与抗菌药物的联合应用,其特征在于,槲皮素与抗菌药物联合用药能够产生协同抗菌效力,降低抗菌药物的最低抑菌脓毒和最低杀菌浓度,在制备新药和提高抗菌药物临床效果中的应用。
本发明的具体特点还有:
所述菌为革兰氏阴性菌,优选的,以致病性的大肠杆菌和标准大肠杆菌为代表。
所述抗菌药物为四环素、金霉素、土霉素、多西环素中任一种;
优选的,所述抗菌药物还可以是氧氟沙星、诺氟沙星、环丙沙星、氟苯尼考、头孢喹肟、头孢噻呋中任一种。
所述抗菌药物的制备方法为:
s1、取槲皮素与抗菌药物,将槲皮素与抗菌药物分别使用溶解剂进行溶解;
s2、将步骤s1中溶解后的槲皮素与抗菌药物按照等体积比混合,得到混合溶液;
s3、将步骤s2得到的混合溶液孵育,孵育温度为30℃-38℃,培养时间为14h-36h。
所述步骤s1中的槲皮素与抗菌药物浓度均不大于槲皮素与抗菌药物单独作用时浓度的1/4。
所述溶解剂为二甲基亚砜或无菌水。
所述槲皮素的浓度为0.25μg/ml~4096μg/ml,所述抗菌药物的浓度为0.25μg/ml~4096μg/ml。
本发明的有益效果为:本组合联合用药能够抑制细菌生长,同时槲皮素具有同抗菌药物协同抗大肠杆菌的作用,抗菌药物在更低剂量下抑制致病菌的生长,增强了抗菌药物的抗菌效力,并且可以减少细菌耐药性的产生,提高了抗细菌感染效果、减少抗菌药物的使用剂量,使得该复方或者该组合能够在预防及治疗细菌感染性疾病中得到应用。
附图说明
图1为实验一中槲皮素联合四环素治疗小鼠感染模型的疗效。
图2为实验二中杀菌曲线图。
图3为实验二中细菌细胞膜通透性试验图。
图4为实验二中四环素抗性和敏感性大肠杆菌的积累释放图。
图5为实验二中使用扫描电镜观察大肠杆菌的形态学变化图。
图6为实验二中槲皮素、四环素、四环素和槲皮素联合处理后的大肠杆菌耐药基因的表达情况。
具体实施方式
为能清楚说明本方案的技术特点,下面通过具体实施方式,对本方案进行阐述。
一种槲皮素与抗菌药物的联合应用,其特征在于,槲皮素与抗菌药物联合用药能够产生协同抗菌效力,降低抗菌药物的最低抑菌脓毒和最低杀菌浓度,在制备新药和提高抗菌药物临床效果中的应用。
所述菌为革兰氏阴性菌,优选的,以致病性的大肠杆菌和标准大肠杆菌为代表。
抗菌药物为四环素、金霉素、土霉素、多西环素中任一种;
优选的,抗菌药物还可以是氧氟沙星、诺氟沙星、环丙沙星、氟苯尼考、头孢喹肟、头孢噻呋中任一种。
抗菌药物的制备方法为:
s1、取槲皮素与抗菌药物,将槲皮素与抗菌药物分别使用溶解剂进行溶解;
s2、将步骤s1中溶解后的槲皮素与抗菌药物按照等体积比混合,得到混合溶液;
s3、将步骤s2得到的混合溶液孵育,孵育温度为30℃-38℃,培养时间为14h-36h。
步骤s1中的槲皮素与抗菌药物浓度均不大于槲皮素与抗菌药物单独作用时浓度的1/4。
溶解剂为二甲基亚砜或无菌水。
槲皮素的浓度为0.25μg/ml~4096μg/ml,抗菌药物的浓度为0.25μg/ml~4096μg/ml
本发明药物的发明人其槲皮素与抗菌药物的联合应用方面,进行了一系列实验研究,确定了制备本发明药物的联合应用,使其与现有技术相比具有明显的突出疗效优势,并通过下述实验数据得出,在本发明中,四环素浓度大于256μg/ml才对大肠杆菌全部产生抗菌作用,槲皮素浓度高于1024μg/ml才对耐药菌产生抗菌作用。当两者联合后,其药物浓度降低倍数不小于4。联合体系在低剂量下即产生显著的抗菌效果。
实验一、槲皮素与抗菌药物的联合应用药效实验研究
一、体外抑菌实验
1.1、最低抑菌浓度(minimuminhibitoryconcentration,mic)实验
将本发明提供的抗菌药物和槲皮素以二倍梯度稀释配制成多份样品液,分别加入等量不同来源的大肠杆菌菌液中,密封,在37℃培养16-18h,肉眼观察培养物最低无细菌生长者,即为抗菌药物或者中药单体的mic(μg/ml)值。
1.2微量棋盘稀释法
采用微量棋盘稀释法检测抗菌药物和槲皮素联合应用时对不同菌株(大肠杆菌atcc25922、gzp8-8、gzp10-8、12a4、12e5、gzp13-4、ⅱ-119和ⅱ-cx53)的协同作用。在分别测定单一药物对于各细菌的mic值的基础上,确定抗菌药物的稀释梯度。其中,单一药物的最低药物浓度为其mic值的1/64倍(即mic×1/32),最高浓度为其mic值的8倍(即mic×4),在此范围内进行依次倍比稀释。两种测试物的稀释分别在96孔板的横列和纵列方向上进行,这样可以得到不同浓度组合的两种抗菌药物的混合液。接种细菌终浓度为105cfu/ml,每孔终体积为200μl。无菌mh肉汤培养基作为阴性对照,相同浓度和体积的上样菌液作为阳性对照。将96孔板置于30-37℃恒温培养箱内孵育14h-24h后观察结果。过夜培养后,记录无细菌生长的两种抗菌药物的mic值。
根据美国临床实验室标准委员会(nationalcommitteeforclinicallaboratorystandards,nccls)制定的标准,通过计算部分抑菌浓度指数(fractionalinhibitoryconcentration,fic)判断两种抗菌药物联合作用的结果。fic=(联合用药时抗菌素的mic值/单独抗菌素的mic值)+(联合用药槲皮素的mic值/单独槲皮素的mic值)。判断标准为:fic指数<0.5,为协同作用;0.5<fic指数≤1,为相加作用;1<fic指数≤2,为无关作用;fic指数>2,为拮抗作用。
协同增效抗菌的中西复方组合的筛选结果如表1-3所示。可以看出,优选的,当槲皮素和四环素联合应用时能够降低不同大肠杆菌的耐药性,包括atcc25922、gzp10-8、gzp8-8、12a4、12e5、gzp13-4、ii-119、ii-cx53,fic值分别为0.5、0.094、0.375、0.375、0.5、0.125、0.5;其结果对临床应用槲皮素联合四环素共同抑菌具有一定的指导意义。
表110种抗菌药物抗大肠杆菌的mic值
as-敏感,i-中介,r-耐药
表2槲皮素抗大肠杆菌的mic值
表3联合用药后的fic值
协同作用:fic值≤0.5;相加作用:0.5>fic值≤1.0;无关作用:1>fic值≤2;b没有检测。
1.3体内抗菌活性试验
将小鼠腹腔注射最低致死量(mld)浓度菌悬液给各组小鼠(除正常组外)腹腔注射造成感染,分别为本发明的槲皮素和四环素组(96mg/kg.bm+50mg/kg.bm)、四环素组(96mg/kg.bm)、槲皮素组(50mg/kg.bm)、阳性对照粘菌素组(7.5mg/kg.bm)和模型组。出现典型临床症状后,于感染后1h给予一次药物治疗,20g小鼠灌胃0.4ml,连续灌胃3天。之后每天2次观察。
观察记录感染后根据实验要求观察动物的食欲、活动情况以及病情变化。死亡时及时解剖,肉眼观察体表有无病变皮肤组织及淋巴结有无水肿、出血及肿大等病变。统计感染后72h天内动物死亡情况记录死亡例数及死亡时间,第7天处死所有动物,取出小鼠的肺、肝、回肠和空肠。
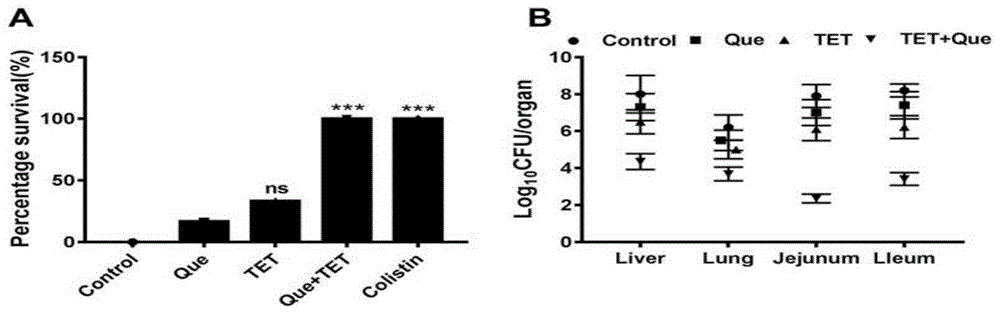
实验结果如图1,在存活率方面:阳性组和组合物组与模型组以及单独用药相比,差异均有统计学意义(p<0.01);本发明的组合物提高了大肠杆菌感染小鼠的保护作用。
1.4细菌定植率
将不同处理方式的小鼠的器官取出,准确称量0.1g匀浆,连续稀释,并在麦康凯琼脂上铺板,在37℃温育24小时后计数细菌数。
图1中,a)que和tet的组合在治疗体内模型中的感染方面是有效的。ns表示无显着性,*p<0.05,**p<0.01,***p<0.001,通过非参数对数秩检验确定。b)组合que与tet对小鼠不同器官中细菌存活的影响。*p<0.05,**p<0.01,***p<0.001。
二、结论
综上所述,本发明得到了一组减少细菌耐药的中西复方组合,槲皮素可以显著减少大肠杆菌对四环素类药物的耐药性,包括atcc25922、gzp10-8、gzp8-8、12a4、12e5、gzp13-4、ii-119、ii-cx53,fic值均小于0.5,其次,通过体内试验可得,联合用药后小鼠的存活率明显提高。因此,tet和que的组合使用可能具有潜在的使用价值。
三、抑菌实验
参见表4-7,采用抗菌药物和槲皮素联合、以及抗菌药物与槲皮素单独使用对不同菌株(大肠杆菌atcc25922、gzp8-8、gzp10-8、12a4、12e5、gzp13-4、ⅱ-119和ⅱ-cx53)的作用。
表4四环素和槲皮素单用或者联用对大肠杆菌的作用
表5土霉素和槲皮素单用或者联用对大肠杆菌的作用
表6金霉素和槲皮素单用或者联用对大肠杆菌的作用
表7多西霉素和槲皮素单用或者联用对大肠杆菌的作用
实验二、槲皮素与抗菌药物的联合应用研究实验
一、体外杀菌曲线的测定
1.1、随机挑选已知的mic的一株耐药的大肠杆菌和一株标准菌株,制备菌液,制备装有5mlmh培养基的试管若干,每管分别含浓度为0mic、0.5mic四环素或者槲皮素、0.5mic的四环素和槲皮素,每个试管加入制备好的0.5麦氏法蓝标准菌液25μl,37℃培养。分别于第0、4、8、16、24h取样涡旋震荡,按1:1的比例(100μl:100μl)加入样品和培养基,菌落计数并绘制杀菌曲线。
1.2膜通透性试验
碘化丙啶(pi)测定:大肠杆菌在m9培养基中培养至对数生长期,10000g离心收集菌体,pbs洗涤两次后调整至od600为0.8左右,加入不同的浓度的抗菌药物、槲皮素、四环素和槲皮素处理1个小时后,离心取上清液进行测定。加入终浓度为10nm的碘化丙啶,于37℃避光孵育30min。用多功能酶标仪m5测定激发波长470nm,发射波长490-750nm的荧光值。碱性磷酸酶(alp)测定:使用碧云天的碱性磷酸酶检测试剂盒对bacaucin-1处理后胞外的碱性磷酸酶含量进行测定。大肠杆菌过夜培养后离心,pbs重悬后,加入不同的浓度槲皮素和四环素处理1个小时后,离心取上清液进行测定。在96孔板中加入显示底物50μl和样品50μl。而后用枪头轻轻吹打混匀,37℃孵育30min后每孔加入100μl反应终止液停止反应。使用多功能酶标仪m5测定其在405nm的吸光值。β-半乳糖苷酶测定:将已活化的大肠杆菌按1∶100比例接种于50ml含有5%乳糖的lb液体培养基(含有不同的药物:槲皮素、四环素、两药联合)中,于37℃、180r/min振荡培养至对数期。用0.05mol/lpbs(ph7.4)代替0.85%nacl溶液洗涤2次,重悬至菌体浓度为1×108cfu/ml,取100μl各时间段的上清液与400μl0.05mol/lonpg混合,于37℃水浴反应40min后,加入500μl0.5mol/lna2co3终止反应。在420nm处测定a值,设置无菌水对照组,实验重复3次。按以下公式计算β-半乳糖苷酶活力单位。β-半乳糖苷酶活力单位(u/ml)=a420×2.778。细菌内atp的测定采用atp试剂盒(索莱宝),根据说明书的步骤操作。其中pi和β-半乳糖苷酶检测细胞内膜通透性,alp检测细菌细胞膜间质的通透性,而atp则是为细胞提供能量的源泉。
1.3扫描电镜
对于液体培养基中的菌体,可取培养液8000rpm离心3-5min,弃上清,加入2.5%戊二醛固定2h,ph7.2磷酸盐缓冲液清洗,加入蒸馏水稀释,充分混合后用移液枪取溶液滴一滴于小块盖玻片上,吸附2min,用滤纸吸去多余溶液,1%锇酸熏蒸固定样品2h,粘样,镀金膜,既可进行扫面电镜观察。
1.4抗菌药物累积试验
如euna等人所述测定累积的四环素。大肠杆菌在具有1/2mic槲皮素的mh肉汤中生长过夜至对数晚期。将样品(1ml)离心,用ph8的100mmtris/hcl缓冲液洗涤,并重悬于1ml10mmtris/hcl缓冲液(ph8)中。将细菌在存在或不存在que下培养并加入四环素15分钟,并用5mhcl(1ml)破坏沉淀物。煮沸10分钟后,将四环素定量转化为无水四环素。将冷却的样品离心以除去细胞碎片。测量在400nm激发和520nm发射时上清液中含有的无水四环素的吸光度。
1.5耐药基因的检测
将菌液在lb琼脂上划板,培养12-18h,按照rna提取试剂盒以及反转录试剂盒说明书提取rna。
二、实验结果与分析
2.1、杀菌曲线的结果
参见图2,细菌在浓度为联合用药条件下生长受到了抑制,杀菌曲线结果可得,与对照相比,用1/2mic的tet和槲皮素同时处理12a4和atcc25922时,细菌的存活率降低8倍(图2)。因此,当与que组合使用时,tet在低浓度的mic下实现杀菌活性(图2)。通过体外杀菌试验研究了que和tet的治疗效果。结果表明,两种药物的组合在体外优于单一药物。
图2中,四环素耐药菌(a,12a4)和四环素敏感菌(b,atcc25922)。细菌在1/2mic四环素(耐药菌株为128μg/ml,敏感菌株为2μg/ml)存在下生长,有或没有槲皮素128μg/ml(相当于1/2mic)。符号:○,控制;■,四环素(1/2mic);▲,槲皮素为128μg/ml(1/2mic);▼,四环素(1/2mic)加上128μg/ml的que,误差表示标准偏差。
2.2、膜通透性和抗菌药物累积结果
为了进一步评估该机制,我们由图3可以观察到由于碘化丙啶(pi)摄取和tet中的dna结合以及槲皮素剂量依赖性方式导致的荧光强度的增加(图3c)。此外,我们通过测试细菌内组分的释放来证实细胞膜的完整性。结果表明,tet和槲皮素的组合可以增加细胞内容物的释放,例如碱性磷酸酶(alp),β-半乳糖苷酶(图3b,a)和atp(图3d)。此外,在槲皮素存在下,细菌中抗菌药物的浓度显着增加(图4),并且通过扫描电镜还观察到细菌的性状变形甚至破裂(图5)。所以,当四环素和槲皮素联合应用时,大肠杆菌的细胞膜通透性升高,并且四环素进入细菌内的量增加,两者具有协同作用可能是由于改变生物细胞膜的通透性来发挥作用的。
图3中当四环素与槲皮素组合使用时,破坏细菌细胞膜并诱导细胞死亡。a),b)c),d)分别代表如β-半乳糖苷酶(a),碱性磷酸酶(alp,b),atp合成减少(d)和碘化丙啶(pi,c)。ns指无显着性,*p<0.05,**p<0.01,***p<0.001。
图4中,将细菌悬浮液与四环素(100μg/ml)一起一式三份孵育15分钟,有或没有槲皮素孵育(128μg/ml)。从左到右,条形代表在耐药菌在四环素存在下,耐药菌在que和四环素存在下,tet易感细菌在四环素或者四环素和槲皮素联合条件下。误差棒表示标准偏差。***p<0.001。
图5中a)代表对照,b)细菌在que中,c)细菌在tet,d)四环素(1/2mic)加上que在128μg/ml。
2.3、耐药基因的测定结果
通过二代测序得到12a4携带tet(b),tet(m),tet(s),12e5携带tet(a),ii-cx53含有tet(a),gzp08-8含有tet(a),tet(m),tet(s)等耐四环素的基因。由图6可以得到,当四环素和槲皮素联合应用时比单独应用四环素以及槲皮素的耐药基因表达量没有明显的降低。tet(a)和tet(b)基因是控制外排泵的,tet(m)和tet(s)则是跟核糖体蛋白有关,所以我们判断,槲皮素和四环素的协同作用可能和其耐药基因的表达降低无关。
三、结论
通过以上试验结果表明,四环素和槲皮素联合使用对大肠杆菌的膜通透性增加,细菌内容物的释放也增加,并且细菌在联合用药条件下出现明显的变形,而且四环素在细菌体内的累积也在增加。但是,控制外排泵和核糖体蛋白的四环素耐药基因的表达量降低不明显,说明槲皮素和四环素联用通过增加膜通透性增加细菌体内抗菌药物的浓度从而起到协同作用。
本发明未经描述的技术特征可以通过或采用现有技术实现,在此不再赘述,当然,上述说明并非是对本发明的限制,本发明也并不仅限于上述举例,本技术领域的普通技术人员在本发明的实质范围内所做出的变化、改型、添加或替换,也应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!