三叶因子3及三叶因子3表达促进剂在制备预防治疗肝损伤药物中的应用的制作方法
本发明属于生物医学治疗领域,具体涉及三叶因子3(tff3)基因在制备预防和治疗酒精性脂肪性肝炎、病毒性肝炎、药物性肝损伤、酒精性肝病等造成的肝损伤的药物中的用途。
背景技术:
肝脏是腹腔内最大的实质性器官,担负人体的重要生理功能。肝损伤为多种肝脏疾病的病变结果,其中代谢性、病毒性、酒精性、物理性、化学性、环境性等导致的肝损伤为目前严重的多发疾病。肝脏损害持续,可致细胞弥漫性变性和坏死、肝纤维化出现,肝脏肿胀、渗出和充血,如不及时治疗,可造成肝硬化、肝衰竭、甚至肝癌等终末期肝脏病。我国每年有近28万人死于肝硬化、肝癌等肝脏相关的疾病,给社会带来极大负担。
研究发现,炎症因子和氧化应激是肝损伤中的重要机制。持续病毒感染和内毒素血症是单核/巨噬细胞分泌tnf-α和il-1β的强刺激剂,tnf-α除可诱导肝脏schwartzman反应和免疫病理反应外,尚可直接介导肝细胞凋亡,il-1β可增加肝细胞对tnf-α的敏感性,加重tnf-α介导的肝损害。肝损伤时细胞色素p4502e1(cytochromep4502e1,cyp2e1)增加促进氧自由基产生,可氧化细胞内脂质和蛋白,导致肝细胞结构与功能的破坏。丙二醛(malondialdehyde,mda)是脂质过氧化产物,其增高与脂质过氧化物清除剂减少有关,其中最主要的是超氧化物歧化酶(superoxidedismutase,sod)。sod的功能不足导致自由基清除障碍,是细胞损伤的重要原因之一。
目前临床上针对各种肝病,除病因治疗,多同时进行减轻肝损伤的保肝降酶治疗,以改善其临床症状,减慢疾病进展。保肝药是指具有肝脏保护功能、促进肝细胞再生、增强肝脏解毒功能、提高机体免疫力等功效的药物,其种类繁多,但常用的保肝药大致可以分为解毒类、促肝细胞再生类、促进能量代谢类、利胆类、中草药及其提取物等。随着医药科技的飞速发展,尽管治疗肝损伤的药物已经研究报道很多,但是一些研究表明,有些抗肝损伤的药物还会不可避免的产生生物毒性,对生命造成危险,况且靶向性给药也不强。研究开发具有良好治疗作用的肝损伤药物是非常迫切。
三叶因子3(trefoilfactorfamily3,tff3)又名肠三叶因子(intestinaltrefoilfactor,itf)。tff3是一种分泌型小分子多肽,生理条件下主要在胃肠道杯状细胞表达。tff3在保持胃肠道黏膜完整性、促进胃肠道黏膜修复中起到重要的作用,具有黏膜保护、促进上皮修复、抑制炎症反应、调节细胞增殖、迁移和细胞凋亡等功能。
我们分析了非酒精性脂肪性肝炎临床患者与对照组血清tff3的表达水平及与肝损伤的相关性,说明其保肝重要性。另外,通过体外和体内实验研究tff3核酸或肽在非酒精性脂肪性肝炎、急性肝损伤动物模型中对肝脏炎症、凋亡、组织修复的作用及相关调控信号通路,以及促进tff3表达的降脂颗粒、小檗碱、甘草酸在治疗肝损伤中的作用,以期发现新的肝损伤防治药物。
技术实现要素:
本发明所要解决的技术问题在于,提供一类治疗肝损伤的新的药物,为肝损伤的治疗提供新的方案。
为解决上述技术问题,本发明提供三叶因子3在制备预防和/或治疗肝损伤药物中的应用。
具体的,所述肝损伤包括非酒精性脂肪性肝炎、病毒性肝炎、药物性肝损伤、酒精性肝病等造成的肝损伤。
肝细胞过表达tff3基因或直接应用tff3小分子多肽可减轻肝细胞损伤和炎症反应,并促进肝细胞增殖修复。
所述三叶因子3在制备预防和/或治疗肝损伤药物中的应用,包括直接使用三叶因子3制备成预防和/或治疗肝损伤的药物。
所述三叶因子3在制备预防和/或治疗肝损伤药物中的应用,包括使用携带三叶因子3基因的载体制备成预防和/或治疗肝损伤的药物。所述载体包括质粒、噬菌体和病毒等形式。
所述三叶因子3在制备预防和/或治疗肝损伤药物,包括依据tff3基因序列或tff3分子结构获得的具有预防和/或治疗肝损伤的效果的化合物。所述药物的有效活性成分可以是核酸或蛋白质或天然化合物、化学小分子,对于化合物的来源、性质及机理无特别限制。
其中,三叶因子3是一种分泌型小分子多肽,其来源包括人、牛、猪、大鼠、小鼠来源或其重组体。
为解决上述技术问题,本发明还提供三叶因子3表达促进剂在制备预防和/或治疗肝损伤药物中的应用。
具体的,所述三叶因子3表达促进剂是指能够上调三叶因子3表达水平的试剂。
一种优选的实施方式为,所述三叶因子3表达促进剂选自小檗碱。
一种优选的实施方式为,所述三叶因子3表达促进剂选自甘草酸。
一种优选的实施方式为,所述三叶因子3表达促进剂选自中药复方降脂颗粒(jz)。具体的,该中药复方降脂颗粒的组分为绞股蓝、丹参、虎杖、茵陈、荷叶。
本发明所述的tff3防治肝损伤的给药方式包括口服、静脉注射,可单独给药或联合其它治疗。
本发明是针对现有技术的上述不足,依据发明人对tff3基因在人和小鼠肝脏损伤疾病中的变化、对肝细胞、巨噬细胞生物学功能的调控作用及其对肝损伤的防治效应的研究,提出tff3针对肝损伤的预防和治疗的一种新用途。
本发明首先检测分析临床nash患者与对照组血清tff3的表达水平及与肝损伤的相关性,以期发现新的nash诊疗靶标。通过小鼠肝组织rnasequence研究发现,在非酒精性脂肪性肝炎(nash)小鼠肝组织中tff3水平较正常饮食小鼠下降,中药复方降脂颗粒(jz)、小檗碱(bbr)、甘草酸(glycyrrhizin)干预小鼠肝组织导致tff3水平显著上调,改善肝损伤,提示tff3与nash发生发展及药物降脂颗粒、小檗碱、甘草酸苷改善nash的药效机制相关。通过上调tff3表达或直接用重组tff3肽可减轻肝细胞炎症反应和细胞凋亡,显著改善肝细胞损伤。
附图说明
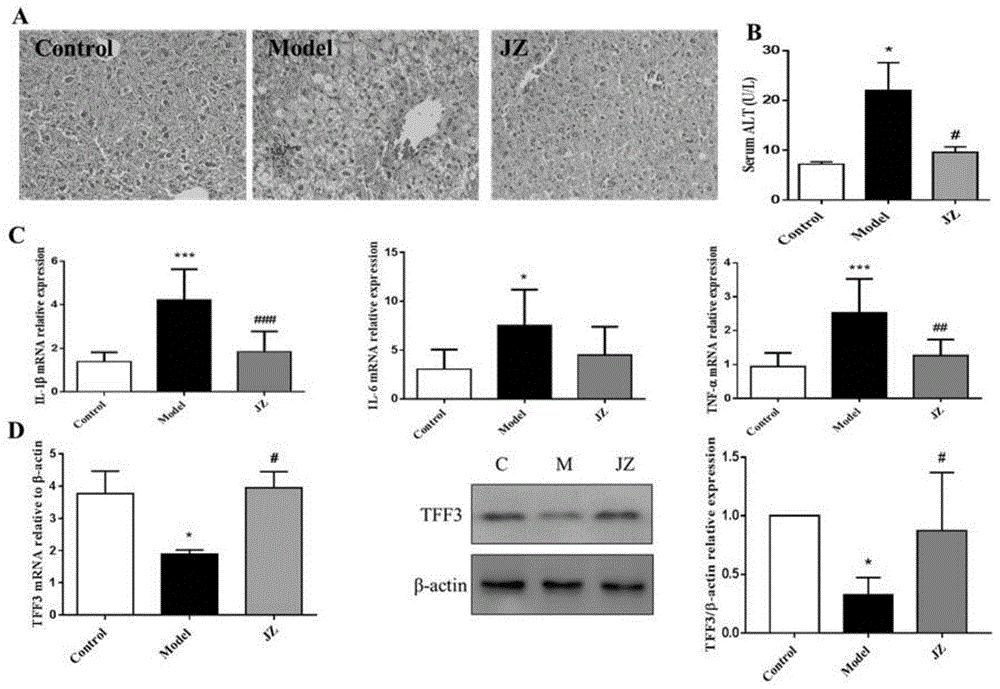
图1降脂颗粒(jz)上调nash小鼠肝组织tff3表达水平治疗小鼠肝损伤的作用图,jz(与对照比较,*p<0.05,与模型组比较,#p<0.05)。
图2为小檗碱、甘草酸上调小鼠肝组织tff3表达改善肝损伤的作用图(与对照比较,*p<0.05,与模型组比较,#p<0.05)。
图3为重组tff3肽(rhtff3)减少棕榈酸(pa)诱导的肝细胞凋亡图(与对照比较,***p<0.001,与模型组比较,##p<0.01)。
图4为重组tff3肽(rhtff3)抑制棕榈酸(pa)诱导的人肝细胞炎症反应图(与对照比较,*p<0.05,与模型组比较,#p<0.05)。
图5为重组tff3肽(rhtff3)促进肝细胞增殖图(与对照比较,*p<0.05)。
图6为重组tff3肽(rhtff3)减轻lps诱导的巨噬细胞raw264.7炎症反应图(与对照比较,***p<0.01,与模型组比较,###p<0.001)
图7为tff3在预防小鼠急性肝损伤中的作用图(与对照比较,*p<0.05)。
具体实施方式
下面将对本发明的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1:tff3在非酒精性脂肪性肝炎(nash)患者血清中的表达水平
收集110例非酒精性脂肪性肝病(nonalcoholicfattyliverdesease,nafld)患者血清,其中单纯性脂肪肝(nonalcoholicfattyliver,nafl)55例、nash55例,以55例非脂肪肝且肝功能正常者为对照组。采用elisa法检测血清tff3表达水平。
结果显示,nafl、nash患者血清tff3含量较对照组显著降低(p<0.05),且nash患者血清tff3含量显著低于nafl患者(p<0.05)。在nash患者中血清tff3与丙氨酸氨基转移酶(almandineaminotransferase,alt)水平呈负相关(p<0.01,r=-0.385)。提示tff3可能有保肝作用,可望作为一种潜在的nash肝脏损伤的诊疗指标。
其中,人三叶因子3基因序列如seqidno.1所示,基因编码序列如seqidno.2所示,蛋白质的氨基酸序列如seqidno.3所示。
实施例2:降脂颗粒、小檗碱、甘草酸上调肝脏tff3减轻nash小鼠肝损伤
用高脂饲料诱导雄性c57bl/6小鼠以建立nash模型,对照小鼠给予普通饲料饲养。动态观察肝组织病理及肝脏tff3的表达变化。自第18w药物组同时予一种中药复方降脂颗粒(jz)、天然化合物(小檗碱、甘草酸)干预,于22w结束实验。检测各组小鼠血清转氨酶水平及观察肝脏组织病理改变。并通过rt-pcr和westernblot检测肝组织tff3水平,以及凋亡和炎症相关基因的表达水平。
高脂喂养小鼠肝组织中肝细胞脂肪变性程度逐渐加重,22w出现局灶性炎性细胞浸润、肝细胞气球样变损伤,形成nash模型(图1a)。比较对照组,模型组血清alt升高(图1b),肝组织tff3mrna和蛋白表达均较对照组降低(图1d),促凋亡分子活化caspase-3、bim蛋白表达显著升高,炎症因子il-1β、il-6、tnf-α显著升高(图1c)。相对于模型组,jz治疗组小鼠血清alt明显降低,肝脏脂肪变性减轻、炎性浸润和气球样变减少,肝组织tff3mrna、蛋白表达显著升高,cleavedcaspase-3、bim蛋白表达降低,il-1β、tnf-α水平显著下调(如图1a-1d所示)。本实验结果提示,nash模型肝组织tff3下调,药物jz减轻肝脏炎症损伤、细胞凋亡,可上调tff3表达可能是其改善nash小鼠肝损伤的部分作用机制。另外,检测小檗碱、甘草酸的干预均使小鼠肝脏表达tff3水平显著上调,并改善了小鼠肝损伤(图2)。
实施例3:体外研究tff3在nash中的作用及其信号通路
通过慢病毒转染,构建tff3过表达的人肝细胞hepg2、huh7,检测内源性tff3对棕榈酸(palmiticacid,pa)诱导的细胞损伤、凋亡、炎症因子表达的干预作用,及对细胞增殖促进修复能力的影响。用重组人tff3(recombinanthumantrefoilfactor3,rhtff3)干预pa诱导的hepg2、huh7及小鼠正常肝细胞aml12,检测外源性tff3对抗损伤、凋亡、炎症反应和促修复的作用。并应用westernblot检测egfr/akt的活化水平来探讨tff3作用信号通路。另外,用rhtff3干预pa和脂多糖(lipopolysaccharides,lps)诱导的巨噬细胞raw264.7,研究tff3对巨噬细胞炎症反应的调控作用。
pa诱导24h后,与对照细胞比较,tff3过表达的hepg2、huh7生物学行为有所改变:细胞活力较高;tunel染色阳性细胞较少,cleaved-parp、bim蛋白表达水平明显下降,而抗凋亡的p-bcl-2蛋白水平上调;细胞表达炎症因子il-1β、il-6显著降低。另外,tff3过表达细胞的增殖能力显著增加。pa诱导24h同时给予1μg/ml的rhtff3干预的hepg2、huh7及aml12细胞的活力较高,凋亡细胞数减少(图3),cleaved-parp、bim蛋白水平下调,p-bcl-2表达上调,p-egfr、p-akt表达上调;p-nf-κb及il-1β、il-6显著降低(图4)。细胞的增殖能力在rhtff3作用下也显著增加(图5)。pa诱导24h或lps100ng/ml诱导1h,同时给予1μg/ml的rhtff3干预的raw264.7细胞,p-nf-κb及il-1β、il-6表达水平显著降低(图6)。
本实施例结果提示tff3具有减轻脂肪酸及内毒素诱导的肝损伤的作用,并且其作用可能通过促进egfr/akt活化减轻肝脏凋亡、促进组织修复,通过抑制nf-κb活化来抑制炎症反应。
实施例4:tff3在预防小鼠急性肝损伤中的作用
8周龄的雄性c57bl/6小鼠10只,饲养于spf级动物房。适应性喂养3d后,根据体重随机分为tff3组(aav-tff3)、对照组(aav-nc),tff3组小鼠尾静脉注射1011携带tff3基因载体的腺相关病毒(aav-tff3),对照组注射对照aav-nc。4周后,两组小鼠均予以腹腔注射800mg/kg的d-半乳糖胺溶液造成小鼠急性肝损伤。在注射d-半乳糖胺溶液24h后,处理小鼠收取血清及肝组织。检测肝功能,肝组织tff3水平及炎症因子水平。
如图7所示,aav-tff3小鼠肝组织表达tff3水平大幅度上调,急性肝损伤小鼠血清alt在tff3高表达小鼠中水平较对照下调,肝脏il-1β、tnf-αmrna表达水平在aav-tff3小鼠中也显著较对照组低。结果提示促进tff3的表达可预防肝脏损伤。
综上所述,上述各实施例仅为本发明的较佳实施例而已,并不用以限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,皆应包含在本发明的保护范围内。
序列表
<110>上海中医药大学附属龙华医院
<120>三叶因子3及三叶因子3表达促进剂在制备预防治疗肝损伤药物中的应用
<130>cpc-np-19-101780
<160>3
<170>siposequencelisting1.0
<210>1
<211>1054
<212>dna
<213>人三叶因子3()
<400>1
gccaaaacagtgggggctgaactgacctctcccctttgggagagaaaaactgtctgggag60
cttgacaaaggcatgcaggagagaacaggagcagccacagccaggagggagagccttccc120
caagcaaacaatccagagcagctgtgcaaacaacggtgcataaatgaggcctcctggacc180
atgaagcgagtcctgagctgcgtcccggagcccacggtggtcatggctgccagagcgctc240
tgcatgctggggctggtcctggccttgctgtcctccagctctgctgaggagtacgtgggc300
ctgtctgcaaaccagtgtgccgtgccagccaaggacagggtggactgcggctacccccat360
gtcacccccaaggagtgcaacaaccggggctgctgctttgactccaggatccctggagtg420
ccttggtgtttcaagcccctgcaggaagcagaatgcaccttctgaggcacctccagctgc480
ccccggccgggggatgcgaggctcggagcacccttgcccggctgtgattgctgccaggca540
ctgttcatctcagcttttctgtccctttgctcccggcaagcgcttctgctgaaagttcat600
atctggagcctgatgtcttaacgaataaaggtcccatgctccacccgaggacagttcttc660
gtgcctgagactttctgaggttgtgctttatttctgctgcgtcgtgggagagggcgggag720
ggtgtcaggggagagtctgcccaggcctcaagggcaggaaaagactccctaaggagctgc780
agtgcatgcaaggatattttgaatccagactggcacccacgtcacaggaaagcctaggaa840
cactgtaagtgccgcttcctcgggaaagcagaaaaaatacatttcaggtagaagttttca900
aaaatcacaagtctttcttggtgaagacagcaagccaataaaactgtcttccaaagtggt960
cctttatttcacaaccactctcgctactgttcaatacttgtactattcctgggttttgtt1020
tctttgtacagtaaacattatgaacaaacaggca1054
<210>2
<211>285
<212>dna
<213>基因编码序列()
<400>2
atgaagcgagtcctgagctgcgtcccggagcccacggtggtcatggctgccagagcgctc60
tgcatgctggggctggtcctggccttgctgtcctccagctctgctgaggagtacgtgggc120
ctgtctgcaaaccagtgtgccgtgccagccaaggacagggtggactgcggctacccccat180
gtcacccccaaggagtgcaacaaccggggctgctgctttgactccaggatccctggagtg240
ccttggtgtttcaagcccctgcaggaagcagaatgcaccttctga285
<210>3
<211>73
<212>prt
<213>人三叶因子3()
<400>3
metleuglyleuvalleualaleuleuserserserseralagluglu
151015
tyrvalglyleuseralaasnglncysalavalproalalysasparg
202530
valaspcysglytyrprohisvalthrprolysglucysasnasnarg
354045
glycyscyspheaspserargileproglyvalprotrpcysphelys
505560
proleuglnglualaglucysthrphe
6570
- 还没有人留言评论。精彩留言会获得点赞!