肿瘤边缘评估的制作方法
本发明涉及用于确定组织类型的基于光学的系统和方法。更具体地说,光学系统和方法可用于识别组织类型,例如,健康组织、良性组织、恶性或肿瘤组织、脂肪组织、肌肉组织、胶原蛋白组织、弹性蛋白组织、神经组织、肝组织、结肠组织、肺组织或脑组织。尽管本发明可以用于确定一般医学领域中的组织类型,但是本发明特别应用于癌症手术期间的肿瘤边缘的评估中,并且可以示例性地用于乳房保留手术中以确保足够的组织去除。
背景技术:
在许多医学领域,重要的是能够区分不同的组织类型。例如,在肿瘤学中,例如,健康组织、恶性组织和良性组织之间的区分对于确定需要移除多少组织以及评估已经被移除的组织类型很重要。
在通过乳房保留手术期间,在乳房肿瘤的手术切除(例如乳房切除术)的手术中,临床目标是完全切除肿瘤组织。理想情况下,应切除肿瘤组织以及周围1-2mm的边缘(即阴性边缘)。留在患者体内的任何肿瘤组织(即阳性边缘)都可能导致肿瘤复发,并且随后需要进行额外的手术或放疗。在手术之前,通常使用例如乳房x线照相术、计算机断层摄影术(即ct)、磁共振成像即mri或超声来术前图像产生切除计划。对于不可触及的肿瘤或接受新辅助化疗的患者,将标记物放置在肿瘤中以在手术期间进行引导。在手术期间中,注射蓝色染料以定位附近的淋巴结,针对是否存在肿瘤细胞检查淋巴结。手术后,对切除的肿瘤进行病理分析以确定组织切除的完整性,这通常需要两天。
当进行外科手术肿瘤切除时,外科医师使用标记物、蓝色染料、组织的触觉反馈以及对术前图像的思维导图来引导切除。但是,肿瘤边缘的定义可能很差,并且缺乏对组织类型的准确指导和实时反馈会导致显著比例的阳性边缘,其需要在后期进行额外的手术或放疗。
已经提出了各种光学技术来解决这个问题,包括使用漫反射光谱法,即drs。
deboer,l.l.等人的题为“fat/waterratiosmeasuredwithdiffusereflectancespectroscopy,drs,todetectbreasttumorboundaries”;breastcancerrestreat(2015)152:509-518;“deboer1”的文献涉及使用漫反射光谱术在乳房保留手术中的肿瘤边缘识别。报道了将肿瘤与良性组织区分开的光学参数。报道的最合适的光学参数涉及脂肪和水的吸收。在扩展的近红外波长区域(大约1000–1600nm)中的脂肪与水的比例提供了对良性和肿瘤部位的最佳区分,并提供了100%的敏感性和特异性,不包括脂肪和肿瘤之间的边界部位。
另一个与同一drs光学技术有关的文档,deboer,l.l.等人的标题为“usingdrsduringbreastconservingsurgery:identifyingrobustopticalparametersandinfluenceofinter-patientvariation”,第7卷,第12号,2016年12月1日,biomedicalopticsexpress5188;“deboer2”;解决了切除过程中可能会妨碍这种基于光的技术的患者间差异和组织生理变化。该文件报告,体内进行的测量与体外进行的测量没有显著差异。该文件得出的结论是,drs是在乳房保留手术期间检测肿瘤组织的可靠技术。
另一个也与drs有关的文件,wo2012143816,涉及基于光谱学测量来区分单个患者中的恶性组织与正常组织和良性组织。从正常组织的光谱测量开始,获得针对正常类别的参考值。利用其他组织的光谱测量,当光谱特性落在定义参考类别的阈值之外时,可以将数据点分配给(一个或多个)新的类别。也可以定义不同类别之间的阈值。查找到恶性组织的转变是基于将光谱值与区分正常和良性与恶性组织的分类阈值进行比较。因此,将正常光谱测量的基础针对个体患者特征进行调谐。据报道,与所有患者数据库的参考相比,从该参考中区分正常、良性和恶性更为有效。
然而,仍然需要使用光学技术来改善组织分类。
技术实现要素:
本发明寻求使用光学技术来改善组织分类。提供了一种系统和相关的计算机程序产品。该系统和计算机程序产品适用于医学领域中,特别是在肿瘤学中,并且特别关于乳腺癌手术的示例性领域进行了描述。然而,应当理解,本发明适用于使用光学技术的组织分类的更广泛医学领域中。
如权利要求1中所限定的,提供了一种用于确定组织区域的组织类型的系统。所述系统包括光学探头、光谱测量系统和处理单元。所述光学探头具有远端和至少三条光纤,每条光纤具有设置在光学探头的远端处的远端和与光谱测量系统光通信的近端。所述光谱测量系统包括至少一个光源和至少一个光学探测器。每条光纤的每个近端与所述至少一个光源中的一个光源或所述至少一个光学探测器中的一个光学探测器光通信,并且每条光纤的每个远端被布置所述在光学探头的远端,使得当所述组织区域与所述光学探头的所述远端接触时,在所述至少一个光源与所述至少一个光学探测器之间的组织区域内限定多条相交的光路。所述处理单元与所述光谱测量系统通信,并且被配置为使光谱测量系统生成对应于所述多条相交的光路中的每条光路的光谱测量数据,并且被配置为根据所述光谱测量数据来生成指示针对相应的光路的组织类型的组织信号。所述处理单元还被配置为:
将每个组织信号与针对所述组织类型的参考阈值进行比较;并且
将每个组织信号与所述组织信号的平均值进行比较;并且
如果i)所述组织区域中的每个组织信号与所述参考阈值相比指示其对应的组织不是所述组织类型,并且ii)所述组织区域中的至少一个组织信号位于所述组织信号的平均值与所述参考阈值之间,并且所述至少一个组织信号与所述组织信号的所述平均值之间的差超过预定值,则将所述组织区域的至少部分识别为所述组织类型。
光学探头中的三条或更多条光纤在所述至少一个光源与所述至少一个光学探测器之间的组织区域内提供相交的光路。与例如使用单条光路相比,通过提供多条光路,更大的表面积,并且由于光路在组织中的穿透,更大体积的组织区域可以被测量。有利地,这允许快速测量大面积或大体积的组织,这在示例性组织切除程序中可以减少为了扫描区域而必须将探头定位在组织上的次数。相交的光路提供了对组织区域的公共部分的采样,并且从而改善了由此获得的光谱测量数据之间的相关性。这有助于减少测量中的患者内变异性。通过使用相交的光路,还减少了由于在其末端稀疏地装有光纤的光学探头中的盲点而遗漏肿瘤的可能性。
如本文后面将更详细描述的,处理单元使光谱测量系统生成与每条光路相对应的光谱测量数据,并根据其来生成指示每条光路的组织类型的组织信号。组织类型可以例如是“肿瘤组织”。
先前已经在deboer1,deboer2和wo2012143816中报道了针对单个即非交叠的光路的这种组织类型的确定,其将遭受较大的患者间差异。这些引用提倡使用个人阈值而非患者间阈值,即基于人群的阈值,来区分组织类型与其他组织类型。
在本发明中,处理单元将每个测量的组织信号与针对所述组织类型的参考阈值进行比较。所述参考阈值可以是人口阈值。所述处理单元还将每个测量的组织信号与测量的组织信号的平均值进行比较。通过如果i)所述组织区域中的每个组织信号与参考阈值相比指示其对应的组织不是所述组织类型,并且ii)所述组织区域中的至少一个组织信号位于组织信号的平均值与参考阈值之间,并且所述至少一个组织信号与所述组织信号的所述平均值之间的差超过预定值,则通过处理单元将所述组织区域的至少一部分识别为所述组织类型,可以减少组织类型的假阴性识别的数量。
因此,本发明提供了改进的组织分类。
根据一个方面,所述处理单元还被配置为针对与光学探头在组织上的当前位置相对应的组织区域,以及针对与光学器件的一个或多个较早位置相对应的一个或多个组织区域,存储每个组织信号。在该方面中,基于对应于光学探头的所述一个或更多个较早位置的所述一个或多个组织区域的组织信号来确定针对光学探头的当前位置使用的预定值。通过在识别中使用更个性化的阈值水平,提供了更具体的组织分类。预定值例如可以基于在与光学探头的一个或多个较早位置相对应的一个或多个组织区域处的组织信号的变化来确定。
根据另一方面,提供了一种计算机程序产品。所述计算机程序产品包括指令,所述指令当在根据权利要求1的系统的处理单元的处理器上执行时,使所述处理器执行以下方法步骤:
使所述光谱测量系统生成与多条相交的光路中的每条光路相对应的光谱测量数据,并且根据所述光谱测量数据来生成指示针对相应光路的组织类型的组织信号;并且
将每个组织信号与针对所述组织类型的参考阈值进行比较;并且
将每个组织信号与所述组织信号的平均值进行比较;并且
如果i)所述组织区域中的每个组织信号与参考阈值相比指示其对应的组织不是所述组织类型,并且ii)所述组织区域中的至少一个组织信号位于组织信号的平均值与参考阈值之间,并且所述至少一个组织信号与所述组织信号的所述平均值之间的差超过预定值,则将所述组织区域的至少一部分识别为所述组织类型。
参考所附权利要求描述了其他方面。所描述发明的其他优点对于技术人员也是显而易见的。
附图说明
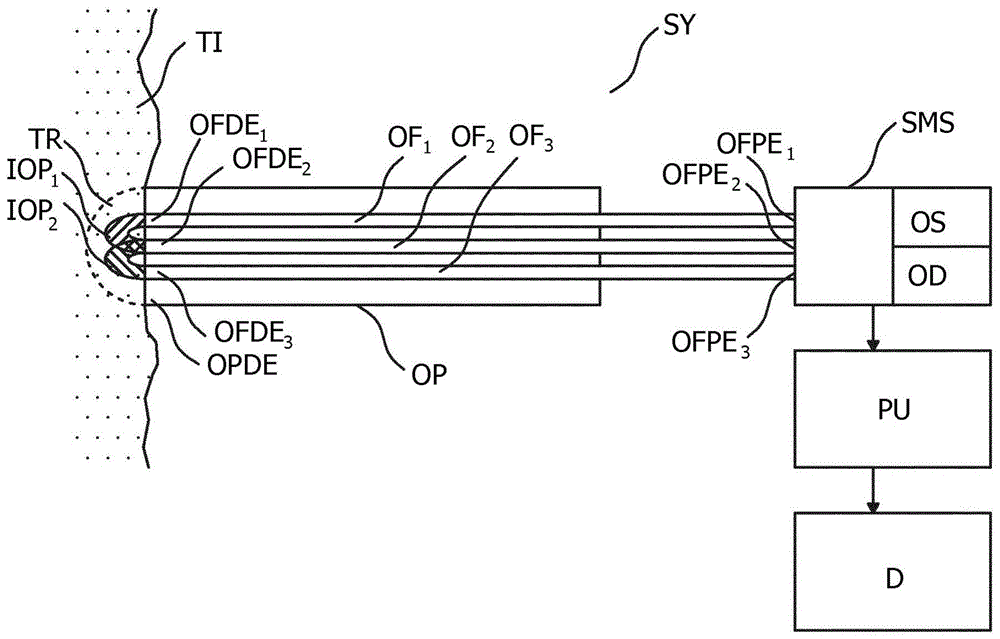
图1示出了系统sy,所述系统sy包括光学探头op,光谱测量系统sms和处理单元pu。
图2图示了人体中一些最重要的生色团,特别是血液、水和脂质(脂肪)在可见光和近红外范围内的光吸收光谱。
图3图示了胶原蛋白、弹性蛋白、烟酰胺腺嘌呤二核苷酸(即nadh)和黄素腺嘌呤二核苷酸(即fad)的荧光强度对波长的图。
图4图示了根据与图1中的每条光路iop1、iop2对应的光谱测量数据生成的示例性组织信号q1、q2。
图5图示了根据与图1中的每条光路iop1、iop2对应的光谱测量数据生成的另一组示例性组织信号q1、q2。
图6图示了在组织ti上分析组织区域tr的当前位置处的光学探头op的平面图,以及在分析组织区域tr'的较早位置处的相同光学探头的平面图。
图7图示了可以由显示器d显示的示例性图标ik。
图8图示了决策树,所述决策树可以由处理单元pu用于识别示例性组织类型“肿瘤”的组织类型ty。
图9图示了光学探头op的第二实施例,其中在四条光纤的远端ofde1..4之间提供了两条分开的相交的光路iop1,iop2。
图10图示了光学探头op的第三实施例,其中在三条光纤的远端ofde1..3之间提供三条分开的相交的光路iop1,iop2,iop3。
图11图示了光探测器op的第四实施例,其中在六条发射辐射的光纤ofde1..6中的每条的远端与一个接收辐射的光纤of7的远端之间提供了六条相交的光路。
图12图示了光学探头op的第五实施例,其中在六条发射辐射的光纤ofde1..6中的每条的远端与两条接收辐射的光纤of7、of8的远端之间设置了十二条相交的光路。
具体实施方式
为了说明本发明的原理,特别参考乳腺癌手术的示例性领域来描述系统和相关的计算机程序产品。然而,显而易见的是,应用领域不限于该特定示例,并且本发明适用于在使用光学技术的组织分类的更广泛医学领域中。
图1示出了系统sy,所述系统sy包括光学探头op,光谱测量系统sms和处理单元pu。系统sy可以用于确定组织ti内的组织区域tr的组织类型ty。组织区域tr可以是解剖结构的区域,例如乳房、皮肤、肝脏、胰腺、肺、结肠、脑等。
图1中的光学探头op包括远端opde和三条光纤of1..n。每条光纤具有设置在光学探头opde的远端的远端ofde1..n和与光谱测量系统sms光学通信的近端ofpe1..n。光谱测量系统sms包括至少一个光源os和至少一个光学探测器od。每条光纤ofpe1..n的每个近端与所述至少一个光源os中的一个或所述至少一个光学探测器od中的一个光通信,并且每条光纤ofde1..n的每个远端被布置在所述光学探头opde的远端,使得当组织区域tr与所述光学探头opde的远端接触时,在至少一个光源os与所述至少一个光学探测器od之间的组织区域内限定多条相交的光路iop1..k。针对光学探头op在组织ti上的每个位置定义了相交的光路iop1..k;因此,当光学探头op移动到组织ti上的新位置时,将定义一组新的相交的光路。可以以与图1光学探头op类似的方式包括额外的光纤。
在一个示例性系统sy中,光谱测量系统sms被配置为生成漫反射光谱光谱测量数据。宽带钨卤素灯光源用作光源os。在一种配置中,两个光谱仪用于生成跨越可见光和近红外nir光谱区域的光谱测量数据。硅探测器用于探测400至1100nm之间的可见辐射(andortechnology,du420abrdd),并且ingaas探测器用于探测800至1700nm的nir辐射(andortechnology,du492a-1.7)。在例如仅需要可见光或nir中的光谱测量的其他配置中,可以使用单个光谱仪并且因此可以使用单个光学探测器od。基于扫描干涉仪的系统还可以允许使用单个光学探测器,而例如基于固定光栅和基于光学滤波器的配置通常采用光学探测器阵列或多个光学探测器。用于光源os的替代合适光源包括:多个led或激光器,它们发射所需光谱范围内的辐射;固态激光器与远程磷光体的组合使用;卤素灯与将灯丝投射在光学纤of1..n上的透镜系统的组合。光纤可以在投影的灯丝场中以特定距离间隔开。可以使用带有多个孔或狭缝的旋转盘来确保在任何时间点仅照明一条光纤。通过改变盘的速度,可以调整照明时段。也可以使用卤素灯泡,所述灯泡伸出到纤维束的末端,并与每条光纤之间的机械快门一起使用,以允许对该光纤进行照明。
通常,光纤of1..n的每个发射和接收辐射的光纤的远端之间的距离最好在0.5mm-5mm的范围内,或者在1-4mm的更窄范围内,或者在1-3毫米的更窄范围内。在一个特定的示例中,光纤of1..n的每条发射和接收射线的光纤之间的距离为1.5mm,从而在组织区域tr中为每条光路提供大约1-3mm3的测量空间。在图1所示的配置中,使用了三条光纤。其中的两条用作发射辐射的光纤并且其中的一条用作普通的接收辐射的光纤。通常,每条光纤of1..n的优选芯径在50-600微米的范围内,或在50-400微米的更窄范围内,或在100-300微米的更窄范围内。在一个特定的示例中,每条光纤的芯直径为200微米。普通的接收辐射的光纤of2接收已被组织区域tr反向散射和/或反射的发射辐射。在图1中提供公共的接收辐射的光纤of2还提供了相交的光路iop1,iop2之间的交点,如朝光纤of2的远端的交叠阴影所示。在该drs配置中,可以通过增加每个发射辐射的和接收辐射的光纤之间的间隔来增加被探测的进入组织区域tr的深度。所述间隔的增加导致检测到的信号强度相应地降低。
当需要在反射型配置中进行光谱测量时(例如在drs中),如图1中所示,所有光纤of1..n优选地被布置面对共同的方向。当测量体组织,即仅从一侧具有方便进入的组织ti时,这种布置是优选的。还可以使用对drs的替代光谱测量技术来提供所需的光谱测量数据,包括荧光光谱、拉曼光谱和透射光谱。可以根据期望的光谱测量技术来选择(一个或多个)光源os,(一个或多个)光学探测器od和对应的光纤of1..n,并将其定位在光学探头远端opde处。薄组织样本尤其可以在透射配置中进行测量,在该配置中,发射辐射的和探测辐射的光纤布置成面对相对的方向。可以根据光谱测量系统的特性选择相应的光纤of1..n,根据光源os发射的光波长、要被辐照组织区域tr的表面区域以及由光学探测器od检测的期望的的检测灵敏度来选择它们的材料和纤芯直径。
处理单元pu可以包括一个或多个处理器。处理单元pu与光谱测量系统sms通信并且被配置为使光谱测量系统sms生成与多条相交的光路iop1..k中的每条相对应的光谱测量数据smd。继续上述drs的示例,可以为每条光路iop1..k生成漫反射光谱形式的光谱测量数据smd。例如,可以为大约400nm至大约1700nm的全部或部分波长间隔产生光谱。
随后,处理单元pu从所述光谱测量数据smd产生组织信号q1..k,其指示针对相应光路的组织类型ty。组织类型ty可以是例如健康组织、良性组织、恶性或肿瘤组织、脂肪组织、肌肉组织或胶原蛋白织、弹性蛋白组织、神经组织、肝组织、结肠组织、肺组织或脑组织中的一种。然而,本发明不限于这些具体示例。在一些实施方式中,将组织类型与组织光学参数(例如,脂肪、水、胆汁、血液、胶原蛋白、高铁血红蛋白、β-胡萝卜素、血液氧合或组织区域中的光散射的含量)组合地指示。这些组织光学参数也可以被计算为确定组织类型的中间步骤。在一特定实例中,确定组织类型的脂肪。在另一个具体示例中,计算组织类型的脂肪作为确定组织类型的乳腺肿瘤组织的中间步骤,这可以根据脂肪与水的比例来确定。在另一个实例中,结合组织类型指示血红蛋白的含量和氧合度。由于血液可能会使光学测量模糊,因此这在指示确定的组织类型的可靠性方面可能特别有用。
在一个示例性实施方式中,组织信号q1..k从分析模型得出,所述分析模型将漫反射光谱测量数据与组织类型ty相关。该模型在下文中进行了描述,并在以下文章中进行了详细说明:t.j.farrel的出版物“adiffusiontheorymodelofspatiallyresolved,steady-statediffusereflectanceforthenon-invasivedeterminationoftissueopticalproperties,”m.s.pattersonandb.c.wilson.med.phys.19(1992)p879-888;“farrel”;r.nachabé,b.h.w.hendriks,a.e.desjardins,m.vandervoort,m.b.vandermark,andh.j.c.m.sterenborg的出版物“estimationoflipidandwaterconcentrationsinscatteringmediawithdiffuseopticalspectroscopyfrom900to1600nm”j.biomed.opt.15,037015(2010);“nachabé1”;以及raminachabé,bennoh.w.hendriks,marjoleinvandervoort,adriene.desjardins,andhenricusj.c.m.sterenborg的出版物“estimationofbiologicalchromophoresusingdiffuseopticalspectroscopy:benefitofextendingtheuv-viswavelengthrangetoinclude1000to1600nm”;opticsexpress18(2010)p1432;“nachabé等人2”。
在这个广为接受的分析模型中,通过使用定制的matlab7.9.0(mathworks,natick,ma)算法拟合来自组织区域的漫反射光谱测量数据来确定生理参数。
farrel中描述模型的输入参数是吸收系数μa(λ),约化的散射系数μs’(λ)以及在光探头尖端处的发射和收集光维之间的中心到中心距离。
所使用的公式主要基于参考文献nachabé1和参考文献nachabé2的工作。双幂律函数可以被用于描述约化散射的波长依赖性,其中,波长λ以nm来表达并且被归一化到波长值λ0=800nm。参数α对应于在该具体波长处的约化散射幅度。
在该公式中,约化散射系数被表达为米氏散射和瑞利散射的和,其中,ρmr是米氏-总体约化散射的分数。米氏散射的约化散射斜率被指示为b并且与颗粒大小相关。对于吸收体的均匀分布,如图2所示,总的光吸收系数μa(λ)可以被计算为吸收体的体积分数与消光系数的积(参见图7)
总吸收μa总可以写成
其中,μa组织(λ)是由于血液、水和脂质的吸收,并且其中,μa其他(λ)对应于其余生色团,例如β-胡萝卜素、血红蛋白、胆汁、胶原蛋白、弹性蛋白。
作为对将吸收系数建模为通过四个感兴趣的发色团的各自的浓度加权的吸收系数μa组织(λ)的和的替代,决定将针对血液、水和脂肪的组织吸收系数表达为:
其中,μa血液(λ)对应于血液的吸收并且μawl(λ)对应于被探测体积中的水和脂类一起的吸收。水和脂质的体积分数为vwl=[脂质]+[h2o],而v血液表示全血中血红蛋白浓度为150mg/ml的血容量分数。
因子c是解释色素包装的影响以及吸收光谱的形状的改变的波长相关校正因子。该影响可以通过这样的事实来解释:组织中的血液限于总体积的非常小的分数,即血管。靠近血管的中心的红血细胞因此比外围处的那些吸收更少的光。事实上,当在组织内均匀分布时,较少的红血细胞将生成与分布在离散血管中的实际数量的红血细胞相同的吸收。校正因子可以被描述为:
其中,r表示以cm表示的平均血管半径。与血液相关的吸收系数由下式给出
其中,μahbo2(λ)和μahb(λ)分别表示了氧合血红蛋白hbo2和脱氧血红蛋白hb的基本消光系数光谱。将红蛋白总量中的氧合血红蛋白分数被记为:
αbl=[hbo2]/([[hbo2]+[hb]),通常称为血氧饱和度。由于被测组织中的水和脂类的存在的吸收被定义为:
在这种情况下,与血脂和水的总浓度相关的血脂浓度可以写成:αwf=[脂质]/([脂质]+[h2o]),其中,[脂质]和[h2o]分别对应于脂质(密度为0.86g/ml)和水的浓度。
这种以公式6中定义的吸收系数的表达将水和脂质参数相关联而不是单独估计水和脂质体积分数的方式对应于用于拟合的基函数的协方差的最小化,导致更稳定的拟合,参见参考文献nachabé2。为了进一步解释和验定这个定理,参考文献nachabé1。
借助于以上描述的算法可以导出光学组织参数,例如不同组织发色团的散射系数和吸收系数:例如血红蛋白、含氧血红蛋白、水、脂肪等。有关进一步的说明,也参见r.nachabé,d.j.evers,b.h.w.hendriksg.w.lucassen,m.vandervoort,j.wesselingandt.j.m.ruers,“effectofbileabsorptioncoefficientontheestimationoflivertissueopticalpropertiesandrelatedimplicationsindiscriminatinghealthyandtumoroussamples”biomedicalopticsexpress2,第600-614页(2011)。
图2图示了人体中一些最重要的生色团,特别是血液、水和脂质(脂肪)在可见光和近红外范围内的光吸收光谱。该图示出了脱氧血红蛋白(hb)220、氧合血红蛋白(hbo2)221、水222和脂质223的吸收系数与波长的关系。注意,在可见光范围内血液吸收主导,而在近红外范围内水分和脂肪主导。该图的横轴为纳米(nm)波长,纵轴为吸收系数,以厘米的倒数(1/cm)给出。
总吸收系数是例如血液、水和脂肪的吸收系数的线性组合(因此,每个成分的值等于图2所示的值乘以其体积分数)。通过将模型拟合到测量结果,同时针对散射使用幂律,可以确定血液、水和脂肪的体积分数以及散射系数。当包含其他生色团(例如β-胡萝卜素、胆汁、胶原蛋白和弹性蛋白)时,可以用相同的方法测定。
除了漫反射率测量之外,还可以使用上述漫反射率设置来测量荧光光谱。这样就可以测量诸如胶原蛋白、弹性蛋白、nadh和fad之类的参数,这些参数的荧光强度相对于波长绘制在图3中。nadh/fad之比称为光学氧化还原参数,是作为组织代谢状态的指标而感兴趣的(例如参见m.müllerandb.h.w.hendriks,“recoveringintrinsicfluorescencebymontecarlomodelling”,j.biomed.opticsvol.18(2013)p.027009-1至027009-133,其也可以用来区分组织。
使用上述技术,可以为示例性脂肪、胶原蛋白和弹性蛋白的组织类型生成指示相应光路的组织类型ty的组织信号q1..k。
也可以类似的方式确定其他组织类型,包括例如健康组织、良性组织、恶性或肿瘤组织、肌肉组织、神经组织、肝组织、结肠组织、肺组织和脑组织。例如,可以根据对上述组织参数的选择来确定组织类型“乳腺癌”,如出版物deboer1,deboer2中更详细地描述的那样。在这些出版物中,据报道脂肪与水的比例是组织类型乳腺肿瘤的可靠指标。
如上所述,使用现有技术进行组织确定的缺点是假阴性。参照图1、图4和图5,处理单元pu还被配置为:
将每个组织信号q1..k与组织类型ty的参考阈值qrt进行比较;并且
将每个组织信号q1..k与组织信号q1..k的平均qma进行比较;并且如果i)与参考阈值qrt相比,组织区域tr中的每个组织信号q1..k指示其对应的组织不是组织类型ty,并且ii)在所述组织区域tr中的组织的信号q1..k中的至少一个位于所述组织信号q1..k的平均qma和参考阈值qrt之间,并且所述至少一个组织信号q1..k与组织信号q1..k的平均qma之间的差δ超过预定值δp,则将组织区域tr的至少一部分识别为组织类型ty。
图4图示了根据与图1中的每条光路iop1、iop2对应的光谱测量数据生成的示例性组织信号q1、q2。组织信号q1、q2的大小沿图4的垂直轴“信号”以任意单位显示。组织信号q1、q2对应于每条光路iop1、iop2的脂肪与水的比率,并且如上所述根据drs测量(特别参考deboer1,deboer2)进行计算。因此,在该示例中,组织信号q1、q2指示乳腺肿瘤组织,但是可以以类似方式计算其他组织信号。在图4中还示出了用于组织类型ty的参考阈值qrt,即在该示例中为乳房组织。参考阈值qrt可以例如是患者间参考阈值,其在多个不同患者中对所述组织类型ty(即,乳腺肿瘤组织)和不同的组织类型(即,非肿瘤组织或对于乳房肿瘤组织的另一组织)进行区分。参考阈值qrt可以可替代地是个人参考阈值,其在组织类型ty(即乳腺肿瘤组织)与不同的组织类型(即非肿瘤组织或乳腺肿瘤组织的另一组织)之间进行区分,并且从与每个组织信号q1..k相同的患者导出。具有小于或等于参考阈值qrt的幅值的组织信号指示乳腺肿瘤组织,而具有超过参考阈值qrt的大小的组织信号指示不存在乳腺肿瘤组织,或者乳腺肿瘤组织的另一组织。
图4中还示出了qma,即组织信号q1、q2的平均值。如图4所示,组织信号q1、q2的平均值即qma超过参考阈值qrt,并且每个单独的组织信号q1、q2也超过参考阈值qrt。如果将参考阈值qrt用作确定组织类型的唯一基准,则将自然得出结论该组织不是所讨论的组织类型,即它不是乳腺肿瘤组织。根据本发明,在步骤ii)中进一步确定所述组织区域tr中的所述组织信号q1..k中的至少一个是否在组织信号q1..k的平均qma与基准阈值之间,至少一个组织信号q1..k与组织信号q1..k的平均qma之间的差δ超过预定值δp。在图4中,δ≤δp,并且因此不满足后一个条件。因此,组织区域tr的至少一部分将被识别为不是所述组织类型;而即基于图4中组织信号不是乳腺肿瘤。在图5中示出了不同的情况,图5示出了另一组示例性组织信号q1、q2,其根据与图1中的每条光路iop1、iop2对应的光谱测量数据生成。在图5中,组织信号q1、q2的平均值,即qma超过参考阈值qrt,并且每个单独的组织信号q1、q2超过参考阈值qrt,因此直接得出的结论是:如图4中,所述组织不是研究的组织类型,即它不是乳腺肿瘤组织。然而,在图5中,并且根据本发明的步骤ii),进一步确定所述组织区域tr中的所述组织信号q1..k中的至少一个是否在组织信号q1..k的平均qma与基准阈值之间,至少一个组织信号q1..k与组织信号q1..k的平均qma之间的差δ超过预定值δp。在图4中,δ>δp,并且因此满足后一个条件。因此,组织区域tr的至少一部分将被识别为是所述组织类型;而即基于图4中组织信号是乳腺肿瘤。因此,根据该步骤ii),在组织类型的方向上与平均组织信号qma的任何显著偏差都被解读为组织类型。这有助于减少对组织类型的假阴性确定,并且在乳房保留手术的示例性应用中具有特别的益处。因此,所述系统通过确保有足够的组织切除来为外科医师提供更好的指导,即,它减少了在以后阶段需要进行额外手术的阳性边缘的百分比。
在一种实施方式中,如果满足以上条件i)和ii),则被识别为组织类型ty的组织区域的至少部分是与组织信号q1..k中的至少一个项的光路相对应的组织区域的部分。在组织类型是乳腺肿瘤组织的上述示例中,这对于识别组织区域tr的确切部分是有利的,在所述确切部分处可能需要进行额外的手术来切除肿瘤组织。
在另一实施方式中,如果满足以上条件i)和ii),则被识别为组织类型ty的组织区域的至少一部分是整个组织区域tr。在组织类型是乳腺肿瘤组织的以上示例中,这在通常向外科医师识别仍然需要切除当前探头位置中的至少一些组织中是有利的。当在组织ti的多个位置快速扫描光学探头op时,此功能可能很有用。
可以通过包括视觉、听觉、触觉、振动等在内的一系列技术来识别组织。这种识别的具体方式在下文中描述。
在一种实施方式中,针对光学探头op的当前位置使用的预定值p是根据与光学探头op的一个或多个较早位置相对应的一个或多个组织区域tr'处的组织信号q1..k确定的。到此,处理单元pu可以任选地还被配置为存储与组织ti上的光学探头op的当前位置相对应的组织区域tr以及针对与光学探头op的一个或多个较早位置相对应的一个或多个组织区域tr’来存储每个组织信号q1..k。针对光学探头op的当前位置使用的预定值基于与光学探头op的一个或多个较早位置相对应的一个或多个组织区域tr'的组织信号q1..k确定。
这样的个人地确定的预定值δp通过进一步减少组织类型的假阴性识别的比例来提高组织分类的特异性。在光学探头op的当前位置处使用的预定值δp,以例如基于以下项的变化来确定;即,在光学探头op的一个或更多个较早位置处的一个或更多个组织区域tr'处的组织信号q1..k的值的扩展。例如,可以基于在光学探头op的一个或更多个较早位置处的组织信号q1..k的标准偏差或方差来确定该变化。对此,图6示出了光学探头op在组织ti上的分析了组织区域tr的当前位置处的平面图,以及同一光学探头在组织区域tr’被分析的先前位置。在一种场景中,可以设想将光学探头op最初设置在图6的左侧的分析组织区域tr'的位置上。基于例如触诊或视觉识别,外科医师已知组织区域tr’为肿瘤位置。在组织区域tr'这种已知的肿瘤组织中的与光路iop’1、iop’2相对应的组织信号的变化”在组织信号的变化被用于设置预定值δp,其用于在后续的(即图6右侧的当前组织区域tr)组织识别。通过这样做,可以实现组织类型“肿瘤组织”的假阴性指示的比例。其他组织类型(例如健康组织)的个人变化也可以相同的方式用于设置针对该特定类型的组织预定值δp。
上述光学探头可以用作独立设备或附接到介入设备或集成在介入设备中。作为独立设备,可以设想以笔状配置提供光学探头,所述光学探头在例如开放手术期间在组织区域上扫描,以使用单独的介入设备引导外科医师进行组织切除。当与介入设备结合时,例如组织切割设备,手术刀,活检设备,导管(例如激光导管),导丝,电外科设备,消融设备,超声外科设备,等离子外科设备,冷冻外科设备,针头在基于皮肤的组织去除装置,组织抽吸装置等上,预期可以实现改进的引导。还可以设想根据识别出的组织类型来控制介入设备,例如通过控制施加到电外科设备的功率量。
如图1所示,上述系统可以还提供有任选的显示器d。在一种配置中,显示器d被配置为显示指示光学探头的远端的图标ik,以及多个相交的光路iop1..k中的每一个的指示。此外,显示器d可以被配置为针对每个相交的光路iop1..k指示组织信号q1..k是否对应于组织类型ty。对此,图7示出了可以由显示器d显示的示例性图标ik。显示器d可以例如位于控制台上,或附接到光学探头或介入设备或独立单元。图标ik包括与每个相交的光路iop1、2相对应的区域r1、r2,并且区域r1、r2用于指示所识别的组织类型。组织类型可以通过例如颜色、亮度、颜色的色调或饱和度,通过闪烁等来识别。例如,肿瘤组织类型ty可以用红色表示,而健康组织可以用绿色表示。示例性图标ik中的任选区域r3可用于指示相交的光路中的至少一条已经识别出特定的组织类型,例如肿瘤组织,并且从而向外科医师提供一般警告,应从光学探头的当前位置中去除其他组织。当使用大量相交的光路iop1..k时,此功能特别有用。在替代实施方式中,组织类型ty的识别可以通过例如光学探头的振动形式的触觉反馈,音频反馈来进行,其中,特定的频率或声音与特定的组织类型ty相关联。
图8图示了决策树,所述决策树可以由处理单元pu用于识别示例性组织类型“肿瘤”的组织类型ty。参考图8,组织类型“肿瘤”由小于一个或多个阈值水平的组织信号q1..k指示。在步骤810中,将组织信号q1..k的平均值确定为参数qma。在步骤811中,将参数qma与肿瘤组织的参考阈值qrt进行比较。qrt可以是例如患者间参考阈值。如果qma>qrt,则在步骤811a中得出一个中间结论,所述组织平均而言是健康组织。然而,如果qma≤qrt,则在步骤811b、812中得出组织类型ty是肿瘤组织的最终结论。在步骤811a之后,在步骤813a、b中,确定每个单独的组织信号q1..k与参考阈值qrt之间的差。如果组织信号q1..k中的至少一个显著小于参考阈值qrt,则在步骤813b、814中得出组织类型ty是肿瘤组织的最终结论。或者,如果所有组织信号q1..k都超过参考阈值qrt,则在步骤813a中继续。如果在步骤813a之后,组织信号q1..k中的至少一个显著小于组织信号q1..k的平均值,即qma,则在步骤815b、816中得出组织类型是肿瘤的最终结论。在替代方案中,然后在步骤813a之后,步骤815a、817导致最终结论是组织类型不是肿瘤组织,即它是健康或良性组织。步骤813a、815b、816减少了假阴性指示的数量,即,它们减少了对组织健康的错误指示的数量,因为认为明显的个体测量值偏离其平均值被认为是肿瘤组织的指示。这是在尽管所有单个组织信号在与参考阈值qrt的比较中都指示健康组织的情况下。
显著小于一值,意味与该值的偏差大于预定量,所述偏差例如可以与该值的变化或方差或标准偏差有关。当组织类型ty由超过一个或多个阈值水平的组织信号的存在指示时,当然可以做出类似的决策树。
图9-图12显示了图1中图示的替代光学探头设计。
图9图示了光学探头op的第二实施例,其中在四条光纤的远端ofde1..4之间提供了两条分开的相交的光路iop1,iop2。在该示例中,对应的光纤of1、of2与一个或多个光源连通,并且光纤of3、of4与光谱测量系统sms中的一个或多个光学探测器连通。相交的光路iop1、iop2以与图1的截面图所示的方式相似的方式在从图平面升高的点处相交。对于光学探头op的给定位置的组织信号q1..k可以同时或连续地测量。
在一些实施例中,光路是硬连线的,而在其他实施例中,这些路径是通过光学开关来改变的,所述光学开关在发射辐射的和接收辐射的光纤之间改变光纤的功能。到此,图10示出了光学探头op的第三实施例,其中在三条光纤的远端ofde1..3之间提供三条分开的相交的光路iop1、iop2、iop3。例如在图10中,相交的光路iop1..3可以被光学硬连线,使得对应的光纤of1、of3充当发射辐射的光纤,of2充当接收辐射的光纤,并且使得光路在ofde2相交;或光谱测量系统sms中的一个或多个光开关可用于例如使光纤of1和of2分别在某一时刻充当发射辐射的光纤和接收辐射的光纤,并在稍后的时刻使光纤of2和of3分别充当发射辐射和接收辐射的光纤,并且在稍后的时刻仍然使光纤of3和of4分别充当发射辐射和接收辐射的光纤。因此,在后一个示例中,可以在相对于组织ti的固定位置处用光学探头op连续测量组织信号,并且在光路中的相交处也可以以光学探头op在相对于组织的固定位置ti在空间上移动。此外,对于所有相交的光路,每条光路的长度可以相同,如图9和图10所示,或者可以通过使用定义每条光路的光纤的接收辐射和发射辐射的远端之间的不同的间距来改变长度。这在探测组织ti的不同深度时可能有用。
图11图示了光探测器op的第四实施例,其中在六条发射辐射的光纤ofde1..6中的每条的远端与一个接收辐射的光纤of7的远端之间提供了六条相交的光路。六条光路在光纤远端ofde7处相交。在图11的配置中,可以经由接收辐射的光纤of7连续地测量光信号,这简化了光学探测器的设计,因为可以使用单个光学探测器或光谱仪。
图12图示了光学探头op的第五实施例,其中在六条发射辐射的光纤ofde1..6中的每条的远端与两条接收辐射的光纤of7、of8的远端之间设置了十二条相交的光路。十二条光路在光纤远端ofde7、ofde8附近相交。在一种实施方式中,对应的光纤of7、8可以与同一光谱仪光通信,并因此用于改善光学探头的灵敏度。在另一种实施方式中,光纤of7、8的每个可以连接到被配置为测量不同光谱范围的单独的光谱仪。例如,of7可以与可见光谱仪进行光通信,并且of8可以与可见光谱仪进行光通信。of7、8的其他接收辐射的光纤也可以以纤维束的形式使用,以进一步提高光谱测量系统sms的灵敏度。
因此,图9-图12示出了光学探头op的示例性配置,可以理解的是,可以类似的方式包括其他光纤和光路。
在一个实施例中,一种计算机程序产品包括指令,所述指令当在图1所述的系统的处理单元的处理器上执行时,使该处理器执行以下方法步骤:
使光谱测量系统sms生成与多条相交的光路iop1..k中的每条相对应的光谱测量数据smd,并且根据所述光谱测量数据smd来生成指示针对相应的光路的组织类型ty的组织信号q1..k;
将每个组织信号q1..k与针对所述组织类型ty的参考阈值qrt进行比较;并且
将每个组织信号q1..k与所述组织信号q1..k的平均qma进行比较;并且
如果i与所述参考阈值qrt比较,所述组织区域tr中的每个组织信号q1..k指示其对应的组织不是所述组织类型,并且ii所述组织区域tr中的所述组织信号q1..k中的至少一个位于所述组织信号q1..k的平均值qma与参考阈值qrt之间,并且所述至少一个组织信号q1..k与组织信号的平均值qma之间的差δ超过预定值δp,则将所述组织区域tr的至少一部分识别为组织类型ty。
本文公开的任何方法步骤,特别是关于图8描述的方法步骤,也可以可选地由处理单元pu执行。计算机程序产品可以由专用硬件以及能够执行与适当软件相关联的软件的硬件提供。当由处理器提供时,所述功能可以由单个专用处理器、单个共享处理器或者由多个独立处理器(其中一些可能是共享的)来提供。此外,术语“处理器”或“控制器”的明确使用不应被解读为仅仅指能够执行软件的硬件,并且能够隐含地包括,但不限于,数字信号处理器“dsp”硬件、用于存储软件的只读存储器“rom”、随机存取存储器“ram”、非易失性存储器等。此外,本发明的实施例可以采取计算机程序产品的形式,可由提供程序代码的计算机可用或计算机可读介质访问所述计算机程序产品,以供计算机或者任何指令执行系统使用或者与之结合使用。就本说明书的目的而言,计算机可用或计算机可读介质能够是可以包括、存储、交换、传播或发送程序的任何装置,所述程序供指令执行系统、装置或设备使用或者与之结合使用。所述介质能够是电子、磁、光、电磁、红外或半导体系统(或者装置或设备)或传播介质。计算机可读介质的示例包括半导体或固态存储器、磁带、可移除计算机软盘、随机存取存储器“ram”、只读存储器“rom”、刚性磁盘和光盘。当前的光盘的示例包括光盘-只读存储器“cd-rom”、光盘-读/写“cd-r/w”、蓝光碟tm和dvd。
总而言之,已经提供了用于确定组织区域tr的组织类型ty的系统sy,其中至少三条光纤的远端ofde1..n限定了在组织区域tr内的多条相交的光路iop1..k。指示针对相应的光路iop1..k的组织类型ty的组织信号q1..k根据与多条相交的光路iop1..k中的每条相对应的所述谱测量数据smd而被生成。将每个组织信号q1..k与组织类型的参考阈值qrt进行比较,并且与组织信号qma的平均值进行比较。如果i与所述参考阈值qrt比较,所述组织区域tr中的每个组织信号q1..k指示其对应的组织不是所述组织类型,并且ii所述组织区域tr中的所述组织信号q1..k中的至少一个位于所述组织信号q1..k的平均值qma与参考阈值qrt之间,并且所述至少一个组织信号q1..k与组织信号的平均值qma之间的差δ超过预定值δp,则将所述组织区域tr的至少一部分识别为组织类型ty。
已经关于组织类型确定系统描述了各种实施例和选择,并且注意,可以将各种实施例组合以获得进一步的有益效果。
- 还没有人留言评论。精彩留言会获得点赞!