治疗性抗体的稳定的制剂的制作方法
[0001]
本发明涉及抗体分子的稳定的制剂,其中用最小量的赋形剂稳定抗体。公开的制剂与冻干形式和液体形式相容,并且还适合静脉内和/或皮下途径的施用。
背景技术:
[0002]
在过去的二十年中,重组dna技术已导致许多蛋白质(特别是抗体治疗剂)的商业化。这些治疗性抗体的有效性主要取决于稳定性、施用途径以及它们的剂型和浓度。继而,需要适当地配制治疗性抗体以保持治疗性抗体的稳定性和活性。
[0003]
用于每种施用途径和剂型的制剂可以是独特的,并且因此具有特定要求。固体剂型(例如冻干粉剂)通常比液体(水性)制剂更稳定。然而,相对于液体制剂,冻干制剂的重构需要显著的小瓶过量填充、在处理时当心、并且而涉及高的生产成本。虽然液体制剂在这些方面是有利的,并且通常对于可注射蛋白质治疗剂而言是优选的(就最终用户的便利性和制造商的制备容易性而言),但鉴于蛋白质在诸如温度、ph值变化、搅拌等胁迫下易于变性、聚集、降解和氧化,此种形式可能并不总是可行的。这些胁迫因素均可能导致治疗性蛋白质/抗体的生物学活性的丧失。特别地,高浓度液体制剂易于降解和/或聚集。然而,由于降低了施用的频率和注射体积,可能期望高浓度制剂用于皮下或静脉内施用途径。另一方面,特定的治疗方案和剂量可能需要低浓度制剂,并且优选静脉内施用途径,以用于实现治疗药物的更可预测的递送以及完全生物利用度。
[0004]
因此,设计在高或低浓度的治疗性蛋白质/抗体下稳定,有助于不同的施用途径(静脉内或皮下)并且适合冻干或液体形式的制剂造成了重大的开发挑战。此外,每种具有其独特的特征和降解特性的蛋白质或抗体增加了开发稳定的制剂的复杂性,并且可能需要特定的制剂。
[0005]
治疗性蛋白质或抗体的稳定的制剂涉及多种稳定剂/赋形剂(包括氨基酸、糖、多元醇、表面活性剂、盐、聚合物、胺、抗氧化剂、螯合剂等)的添加。许多fda批准的治疗性蛋白质/抗体含有一种以上稳定剂。
[0006]
具有增加的蛋白质和/或稳定剂浓度的制剂组合可增加制剂的粘度,继而增加注射部位的疼痛和注射时间,并且在药物原料的加工过程中也造成困难。因此,有必要开发处于冻干形式以及液体形式的改进的制剂,其含有最小量或浓度的赋形剂,并且在宽范围的浓度下稳定药物。
[0007]
发明简述
[0008]
本发明公开了抗体的稳定的药物制剂,所述制剂包含缓冲液、糖和表面活性剂,其中所述制剂不含游离氨基酸和盐。根据本发明的抗体结合α4β7。
[0009]
特别地,本发明公开了在储存期间通过添加最佳浓度的糖来减少/防止含有α4β7抗体的制剂中聚集体和片段的形成的方法,其中所述制剂不含游离氨基酸和盐。
[0010]
公开的α4β7抗体制剂中存在的糖的最佳浓度为至少约60mg/ml。
[0011]
附图简述
[0012]
图1说明了多种糖对根据实施例1制备并使用sec色谱分析的维多珠单抗(60mg/ml)制剂的lmw、hmw和单体含量的影响。在50℃的储存条件下2周期间,图1(a)代表lmw含量(在“0”时间点lmw含量为0),图1(b)代表聚集体含量,并且图1(c)代表单体含量。
[0013]
图2说明了盐对根据实施例2制备并使用sec色谱分析的维多珠单抗(60mg/ml)制剂的lmw、hmw和单体含量的影响。在50℃的储存条件下2周期间,图2(a)代表lmw含量(在“0”时间点lmw含量为0),图2(b)代表聚集体含量,并且图2(c)代表单体含量。
[0014]
图3说明了盐对根据实施例制备并使用sec色谱分析的维多珠单抗(60mg/ml)制剂的lmw、hmw和单体含量的影响。在50℃的储存条件下2周期间,图3(a)代表lmw含量(在“0”时间点lmw含量为0),图3(b)代表聚集体含量,并且图3(c)代表单体含量。
[0015]
发明详述
[0016]
定义
[0017]
术语“抗体”是指包含通过二硫键相互连接的至少两条重(h)链和两条轻(l)链的糖蛋白或其抗原结合部分。本文所使用的“抗体”涵盖完整抗体或其任何抗原结合片段(即“抗原结合部分”)或其融合蛋白。
[0018]
术语“稳定的”制剂是指其中的抗体在储存时保持其物理稳定性和/或化学稳定性和/或生物学活性的制剂。
[0019]
稳定性研究提供了一段时间内多种环境因素的影响下抗体质量的证据。ich的“q1a:新药原料和产品的稳定性测试”指出了加速的稳定性研究中的数据可用于评价抗体运输过程中可能发生的高于或低于标记储存条件的短期偏移的影响。
[0020]
多种分析方法可用于测量药物制剂中抗体的物理和化学降解。如果在肉眼检查颜色和/或透明度、或通过uv光散射、或通过体积排阻色谱测量时基本上未显示出聚集、沉淀和/或变性迹象,则抗体在药物制剂中“保持了其物理稳定性”。当抗体显示无产物变体形成或最小量的产物变体形成时,则称抗体在药物制剂中“保持了其化学稳定性”,所述产物变体可包括由于对感兴趣的抗体的化学修饰(如脱氨、氧化等)而导致的产物变体。诸如离子交换色谱和疏水离子色谱等的分析方法可用于研究化学产物变体。
[0021]
本文使用的术语“单体”描述了由两条轻链和两条重链组成的抗体。通常通过尺寸排阻色谱(sec)分析抗体组合物的单体含量。根据sec的分离原理,大分子或具有高分子量(hmw)的分子首先被洗脱,然后较小或较低分子量的分子被洗脱。在抗体组合物的典型sec谱中,聚集体(可包括二聚体、多聚体等)首先被洗脱,然后单体被洗脱,且被剪切的抗体变体或降解物可最后被洗脱。在一些情况下,聚集体峰或降解物峰可不以基线分离峰洗脱,而是以肩峰或异常宽的峰洗脱。为维持抗体(特别是治疗性抗体)的适当活性,期望减少产物的片段化或聚集体的形成,并由此将单体含量控制在目标值。在稳定性研究期间的多个时间点测量的抑制聚集体和降解物含量形成的能力可表明候选制剂对感兴趣的抗体的适合性。tosch的tsk-gel g3000swxl(7.8mm
×
30cm)色谱柱可用于水hplc以进行sec。
[0022]
药学上可接受的赋形剂是指可有助于抗体在制剂中的稳定性的添加剂或载体。赋形剂可涵盖稳定剂和张力调节剂。稳定剂和张力调节剂的实例包括但不限于糖、多元醇、盐、表面活性剂以及它们的衍生物和组合。
[0023]
本文的糖包括糖和糖醇(例如多元醇)。糖可指单糖、二糖和多糖。糖的实例包括但不限于蔗糖、海藻糖、葡萄糖、右旋糖、棉子糖等。多元醇的实例包括但不限于甘露醇,山梨
糖醇和其它。
[0024]
表面活性剂是指用于保护蛋白质制剂免受多种压力条件(例如搅动、剪切、暴露于高温等)的药学上可接受的赋形剂。合适的表面活性剂包括但不限于聚氧乙烯失水山梨醇脂肪酸酯,例如tween 20
tm
或tween 80
tm
、聚氧乙烯-聚氧丙烯共聚物(例如泊洛沙姆、普朗尼克)、十二烷基硫酸钠(sds)等或它们的组合。
[0025]
本文使用的术语“游离氨基酸”是指包含在制剂中并且不是缓冲液组分的一部分的氨基酸。氨基酸可以以其d-和/或l-形式存在。氨基酸可以以任何合适的盐(例如盐酸盐,例如精氨酸盐酸盐)的形式存在。
[0026]
盐的实例包括但不限于氯化钠、氯化钾、氯化镁、硫氰酸钠、硫氰酸铵、硫酸铵、氯化铵、氯化钙、氯化锌和/或乙酸钠。
[0027]
通过参考以下实例更全面地描述了本发明的某些特定方面和实施方式。然而,这些实例不应以任何方式解释为限制本发明的范围。
[0028]
实施方式的详细描述
[0029]
本发明公开了抗体的稳定的药物制剂,所述制剂包含缓冲液、糖和表面活性剂,其中所述制剂不含游离氨基酸和盐。
[0030]
在以上实施方式中,抗体为治疗性单克隆抗体。
[0031]
在上述实施方式中,治疗性抗体结合α4β7。
[0032]
在一个实施方式中,本发明公开了α4β7抗体的稳定的药物制剂,所述制剂包含缓冲剂、糖和表面活性剂,其中所述制剂不含游离氨基酸和盐。
[0033]
在上述实施方式中,稳定α4β7抗体制剂的糖的浓度为至少约60mg/ml。
[0034]
在一个实施方式中,本发明公开了α4β7抗体的稳定的药物制剂,所述制剂包含缓冲剂、约60mg/ml的糖、表面活性剂,并且其中所述制剂不含游离氨基酸和盐。
[0035]
在任一上述实施方式中,糖为蔗糖、海藻糖或山梨糖醇。
[0036]
在任一上述实施方式中,所述缓冲剂包括有机缓冲剂、无机缓冲剂和/或它们的组合。
[0037]
在上述实施方式中,有机缓冲剂包括组氨酸、琥珀酸盐或乙酸盐缓冲剂以及它们的盐,无机缓冲剂包括磷酸盐缓冲剂。
[0038]
在另一实施方式中,本发明公开了在制剂中通过添加至少60mg/ml的糖来减少储存期间α4β7抗体的片段化和/或聚集体含量的形成的方法,其中所述制剂不含游离氨基酸和盐。
[0039]
在上述实施方式中,当在50℃下储存2周时,α4β7抗体制剂中聚集体和片段含量的量分别为在制剂中小于约1.5%和小于约2%。
[0040]
在实施方式中,本发明公开了稳定的药物制剂,所述制剂包含α4β7抗体、磷酸盐缓冲剂、至少60mg/ml的蔗糖、表面活性剂,并且其中所述制剂不含游离氨基酸和盐。
[0041]
在本发明的所有上述实施方式中,α4β7制剂中抗体的浓度为约50mg/ml至约200mg/ml。
[0042]
在本发明的任一所述实施方式中,α4β7抗体制剂的ph为6.0-7.0。
[0043]
在另一实施方式中,本发明提供了可用于肠胃外施用的液体制剂。肠胃外施用包括静脉内、皮下、腹膜内、肌内施用或通常被认为属于肠胃外施用范围内并且技术人员熟知
的任一其它递送途径。
[0044]
在本发明的上述任一实施方式中,α4β7抗体的稳定的药物制剂为适合冻干的液体/水形式。此外,将α4β7抗体的冻干制剂用适当的稀释剂重构以得到适合施用的液体制剂。
实施例
[0045]
通过本领域已知的标准方法生产本药物组合物中的适合储存的α4β7抗体维多珠单抗(vedolizumab)。例如,通过在哺乳动物宿主细胞(例如中国仓鼠卵巢细胞)中重组表达免疫球蛋白轻链和重链基因来制备维多珠单抗。此外,获得表达的维多珠单抗,并且对粗获取物进行标准下游工艺步骤,包括纯化、过滤以及任选的稀释或浓缩步骤。例如,可使用标准色谱技术(例如亲和色谱、离子交换色谱以及它们的组合)来纯化维多珠单抗的粗获取物。纯化的维多珠单抗溶液可额外进行一个或多个过滤步骤,并且将获得的溶液进行进一步的制剂研究。将由下游色谱过程获得的三醋酸盐缓冲剂中的维多珠单抗(浓度为8mg/ml)进行缓冲剂交换,并且在组氨酸缓冲剂中浓缩至70mg/ml。浓缩的维多珠单抗用于随后的实验。
[0046]
实施例1:氨基酸对含有多种糖的维多珠单抗制剂的稳定性的影响
[0047]
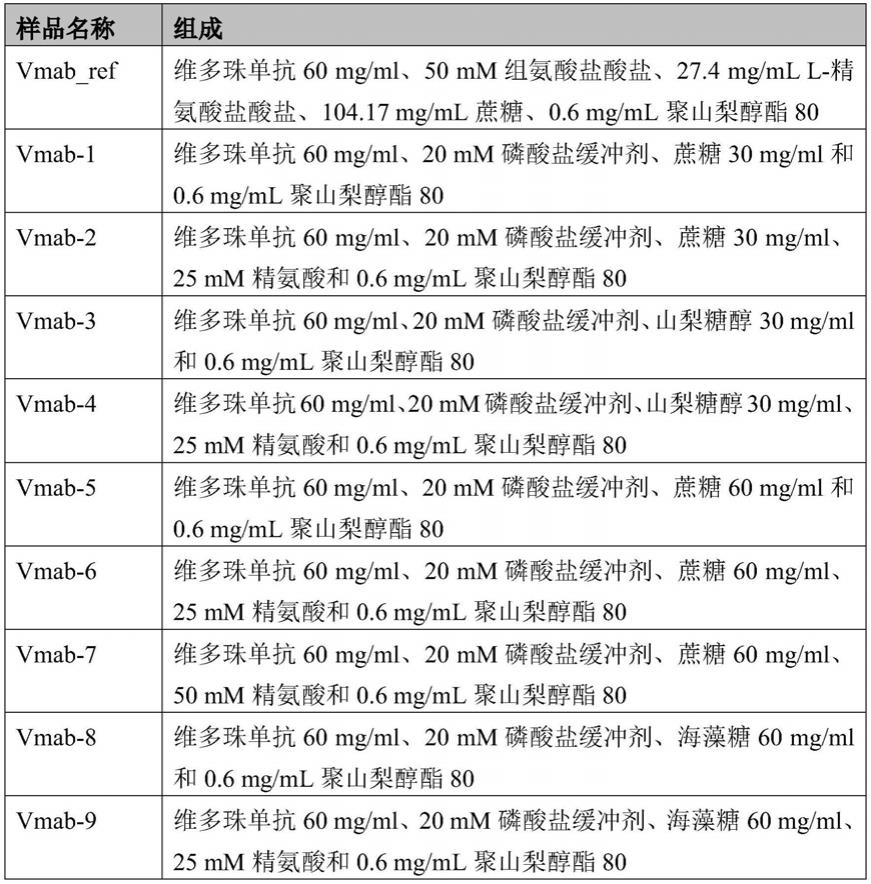
为了解具有或不具有氨基酸的多种糖的浓度对维多珠单抗稳定性的影响,制备了具有不同的糖(如蔗糖、海藻糖和山梨糖醇)的制剂。将组氨酸缓冲剂背景中的浓缩的维多珠单抗的一部分缓冲液交换为20mm磷酸盐缓冲液。之后将糖和聚山梨醇酯添加至组氨酸缓冲液背景和磷酸盐缓冲液背景中存在的维多珠单抗制剂中。选择精氨酸作为游离氨基酸,并添加至一些含糖的维多珠单抗制剂中,以了解游离氨基酸在稳定维多珠单抗中的作用。
[0048]
fda批准的维多珠单抗制剂含有精氨酸、组氨酸缓冲液和表面活性剂。因此,将相同的赋形剂添加至组氨酸缓冲液背景中的维多珠单抗中,并将其用作后续实验的参考标准。
[0049]
表1中给出了该实验使用的制剂的详细信息。所有样品在50℃下进行2周稳定性研究。之后使用尺寸排阻色谱(sec)分析样品的低分子量(lmw)种类或片段、高分子量(hmw)种类或聚集体以及单体含量[图1(a)-图1(c)中示出了结果]。表2中给出了维多珠单抗样品的肉眼观察数据。
[0050]
表1:具有和不具有氨基酸的含糖维多珠单抗制剂的组成
[0051][0052]
表2:根据实施例1制备的维多珠单抗(60mg/ml)制剂的肉眼观察数据
[0053]
[0054][0055]
w-表示星期
[0056]
实施例2:具有和不具有盐的维多珠单抗的制剂
[0057]
为了解盐对含有60mg/ml蔗糖和表面活性剂的维多珠单抗制剂的稳定性的影响,将50mm氯化钠添加至一种维多珠单抗制剂中。表3中给出了制剂的详细信息。所有样品在50℃下进行2周加速稳定性研究。之后使用尺寸排阻色谱(sec)分析样品的低分子量(lmw)种类或片段、高分子量(hmw)种类或聚集体以及单体含量[图2(a)-图2(c)中示出了结果]。表4中给出了维多珠单抗样品的肉眼观察数据。
[0058]
表3:根据实施例2制备的维多珠单抗制剂的组成
[0059][0060]
表4:根据实施例2制备的维多珠单抗(60mg/ml)制剂的肉眼观察数据
[0061][0062]
w-表示星期
[0063]
实施例3:多种缓冲液背景中的维多珠单抗制剂
[0064]
为了解不同缓冲液背景对含有60mg/ml蔗糖、50mm精氨酸和表面活性剂的维多珠单抗制剂的影响,制备了多种缓冲液,并在不同缓冲液背景中配制了相同成分的维多珠单抗。表5中给出了制剂的详细信息。所有样品在50℃下进行2周加速稳定性研究。之后使用尺
寸排阻色谱(sec)分析样品的低分子量(lmw/片段)种类、高分子量种类(hmw/聚集体)和单体含量[图3(a)-图3(c)中示出了结果]。表6中给出了维多珠单抗样品的肉眼观察数据。
[0065]
表5:不同缓冲液背景中的维多珠单抗制剂的组成
[0066][0067]
表6:根据实施例3制备的维多珠单抗(60mg/ml)制剂的肉眼观察数据
[0068][0069]
w-表示星期
[0070]
对根据实施例1、2和3制备的维多珠单抗样品的液体制剂进行本领域已知的冻干技术,并检查稳定性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1