TLR1/2激动剂地普罗考姆的佐剂作用协同增效检查点抑制性抗体以消除疾病
描述
政府支持
本发明在美国国立卫生研究院授予的ai125581的政府支持下完成。政府拥有本发明的某些权利。
背景技术:
通过激活包括树突状细胞(dc)和巨噬细胞在内的抗原呈递细胞(apc),佐剂具有释放细胞毒性t淋巴细胞(ctl)的天然功能以杀灭病原体或癌症的潜力。许多佐剂(包括tlr激动剂)与apc上的先天性免疫受体结合,诱导apc呈递抗原,产生细胞因子,并向抗原特异性cd8t细胞提供共刺激信号(1,2)。响应这些信号,cd8t细胞增殖并分化为能够杀灭表达其靶抗原的感染的或肿瘤细胞的ctl。另外,这种信号激活cd4t细胞,诱导其扩繁和分化为th1或th2t辅助细胞(3)。
改善的佐剂技术的最重要目标之一在于癌症免疫疗法领域,其中基于其癌症相关抗原或新生抗原的表达,利用适应性免疫系统杀灭癌细胞(4,5)。癌症免疫疗法的有效性取决于肿瘤特异性ctl的产生和激活(5,6)及其在体内的活性保持,从而导致肿瘤细胞的杀伤和持久的抗肿瘤记忆应答(5)。因此,免疫检查点抑制剂(比如抗pd-1、抗pd-l1和抗ctla-4)通过其阻断可抑制ctl激活的通路的作用而在黑色素瘤和其他癌症的治疗中取得了显著的临床成功(7,8)。
然而,即使在已知易受检查点阻断影响的那些肿瘤中,也有报道称pd-1/pd-l1抗体治疗的应答率仅为约20%(5,9),这可能是由于肿瘤反应性ctl的数量或激活不足或者其不能浸润肿瘤所致。由癌症环境诱导的免疫抑制可加剧这些缺陷。
另外,认为缺乏t细胞支持至少部分地是造成许多针对各种病原体以及癌症相关的细胞表面抗原的合成疫苗表现出缺乏活力的原因。_enref_21
长期以来,人们一直知道tlr配体在经衔接蛋白(myd88、trif、tram、mal)、激酶和泛素连接酶激活nf-κb和irf的适应性免疫应答(10,11)信号传导中起佐剂作用(12-14)。这些和其他转录因子诱导成千上万进行先天性免疫应答的基因的表达(15)。据报道,几种基于核苷酸的佐剂,比如tlr3激动剂聚i:c(9)、tlr9激动剂cpg(16)和sting激动剂cgamp(6)可提高免疫检查点抑制剂在临床前癌症治疗模型中的功效。
这些方法旨在增加检查点抑制剂可作用于的肿瘤特异性ctl的数量。然而,其主要依赖于天然tlr配体,这些配体难以合成,并且在某些情况下为相当毒性的,大概是因为它们在体内广泛传播,并且不加区分地激活髓样细胞,从而产生细胞因子风暴(17)。寻求开发具有优异的药理性质,具有确定的结构和分子机制(从其中可了解关键的佐剂设计原理)的激动剂。
通过筛选合成化合物的文库,鉴定出一种有效的人类和小鼠活性tlr1/2激动剂地普罗考姆(diprovocim),其与任何微生物tlr激动剂均无结构相似性。如下所述,在b16-ova黑色素瘤模型中,地普罗考姆在小鼠中说明性地引发强大的佐剂活性,并且当与癌症抗原和免疫检查点阻断相结合时成功地抑制肿瘤生长和延长生存期。
发明的简述
佐剂有时通过未知机制增强适应性免疫应答,并可用于增强对癌症抗原的体液和细胞应答。本文所述的发明说明合成化学佐剂地普罗考姆的协同免疫学作用,地普罗考姆靶向小鼠和人类中的先天性免疫受体tlr2/tlr1,当与患病细胞标志物免疫原分子和检查点抑制剂一起使用时,与使用单种组分或其中任何两种组分相比较,在抑制患病细胞的生长方面提供协同作用。
因此,本发明考虑一种抑制哺乳动物中患病细胞的生长的方法。那些患病细胞表达无该疾病的相同类型细胞中不存在的或与所述患病细胞相比较以明显减少的数量存在于无病细胞中的标志物分子。所考虑的方法包括通过以下对有需要的患病哺乳动物进行免疫的步骤:a)给予患病哺乳动物(i)佐剂足够量的地普罗考姆化合物,(ii)t细胞刺激量的免疫检查点抑制剂,和(iii)免疫量的疾病标志物分子。将经免疫的哺乳动物b)保持足以使哺乳动物对免疫产生免疫应答并抑制患病细胞的生长的时间段。
考虑的地普罗考姆化合物在结构上对应于以下结构式v,
其中
-a为-h(氢基)或-c(o)nh-r4;
r1、r2、r3和r4相同或不同,并且为2-(4-氟苯基)乙基、反式-2-苯基环丙基、反式-2-(4-氟苯基)-环丙基或c2-c18烃基,条件是:
1)r1、r2、r3和r4(r1-4)中的至少两个或r1、r2和r3(r1-3)中的至少两个为反式-2-苯基环丙基、反式-2-(4-氟苯基)-环丙基或其混合物,或者r1-4中的每一个为2-(4-氟苯基)乙基,
2)至少一个所示的吡咯烷基二甲酰胺基具有(s,s)构型,并且当r1-4中的每一个不同于2-(4-氟苯基)乙基时,除c2-c18烃基以外的每个所示的r取代基为反式-2-苯基环丙基、反式-2-(4-氟苯基)-环丙基或其混合物,
3)当-a为-c(o)nh-r4时,r1-4中不超过两个为c2-c18烃基,和
4)当a为氢基时,r1-3中的一个可为c2-c18烃基,并且所示的含有r3的吡咯烷基甲酰胺基可具有r或s构型,或两种构型的混合物;
-z为卤素、-h、-nh2、-oh、-och3、-no2、-och2co2h、-o(ch2ch2o)nch2ch2co2h、-och2conh(ch2ch2o)nch2ch2co2h、-nhcoch2o-(ch2ch2o)nch2co2h、-och2conhch2conhch(choh)co2h、-och2conhch2conhchco2h(ch2co2h)、-och2conhch2conhch(choh)(ch2ch2o)nch2ch2co2h、-och2conhch2conhch(choh)(ch2ch2o)nch2ch2co2h、-och2conhch2conhch[(ch2)4nh2]co2h、-och2conhch2conhch(ch2oh)co{nhch[(ch2)4nh2]co}mnhch-[(ch2)4nh2]co2h(seqidno:3-8)、-och2conhch2co{nhch[(ch2)4nh2]co}pnhch[(ch2)4nh]co2h(seqidno:9-13)和-och2conhch2co{nhch(ch2oh)co}qnhch(ch2oh)co2h(seqidno:14-18)中的一种或多种;
w为氮(n)或ch;
“n”为其平均值为1-约8的数字;
“m”为其值为1-约6的数字;“p”为其值为1-约6的数字;和
“q”为其值为1-约6的数字。
地普罗考姆-1(wo2018/005812;化合物3)在小鼠中表现出强大的佐剂活性,特别是促进细胞免疫应答。
当用地普罗考姆-1佐剂化时,针对基因工程改造的肿瘤特异性抗原卵清蛋白的免疫抑制了b16黑色素瘤的生长,并在存在抗pd-l1阻断免疫检查点的情况下延长生存期。用卵清蛋白加上地普罗考姆或卵清蛋白加上抗pd-l1抑制剂免疫表现出一些益处,但100%的小鼠对用以下3种组分免疫有反应:地普罗考姆、免疫原和检查点抑制剂。数据表明地普罗考姆-1通过增加能够对这种检查点抑制剂有反应的肿瘤特异性ctl的数量和激活来提高抗pd-l1治疗的成功率。
如wo2018/005812和morin等人,jamchemsoc,inpress(2018)中所公开的,已经制备地普罗考姆家族的几个成员,对其活性进行了测定,并赋予编号比如地普罗考姆-1至地普罗考姆-6。还已经制备和测定了具有相似的活性谱(在所用测定中类似于略低活性值)的地普罗考姆家族的几种其他化合物。
地普罗考姆-1在本文中已用作整个家族的示例性成员,并且在下文中应理解为意指当使用单词地普罗考姆而没有添加带连字符的数字时使用地普罗考姆家族成员。因此,当如“地普罗考姆家族”或“一种地普罗考姆”中那样连同单词“家族”或“一种”一起使用时,单词“地普罗考姆”用于意指如由式v定义的地普罗考姆家族的成员。与单词“优选的”一起使用的单词“地普罗考姆”是指式i的化合物,和短语“更优选”或“更优选地”是指式ia的地普罗考姆家族化合物。“最优选的”地普罗考姆为以下指出的标有字母a-1的化合物之一。
地普罗考姆化合物家族的一个优选成员为在结构上对应于以下结构式i的化合物,
其中-a为-c(o)nh-r4。所示的r1-4、w和z部分如上所述。
地普罗考姆化合物家族的一个仍然更优选的成员为在结构上对应于以下结构式ia的化合物,
在下文中将目前最优选的式ia化合物的结构式(其中r1-4如先前定义,和-z为氢基(-h))表示为式a、b、c、d、e、f、g、h和i的化合物。
以佐剂足够量使用地普罗考姆来接触表达抗原性疾病相关标志物分子的宿主哺乳动物细胞。
也将表达抗原性疾病相关标志物化合物(比如肽序列)的宿主哺乳动物细胞与免疫应答刺激量的检查点抑制剂(优选地为抗体或含有互补位的抗体部分)接触。
附图简述
在形成本公开的一部分的附图中
图1a至图1f提供一系列图表,其说明地普罗考姆诱导小鼠和人类细胞分泌细胞因子。图1a-1d说明在用地普罗考姆-1处理4小时(图1a、图1c-1d)或24小时(图1b)之后,人类thp-1细胞(图1a)、人类pbmc(图1b)、小鼠腹腔巨噬细胞(图1c)或小鼠bmdc(图1d)上清液中tnf的量。图1e说明在用地普罗考姆处理4小时之后,小鼠bmdc上清液中il-6的量。在图1a-1e的每一个中绘制3个独立样品的平均值;通过单因素方差分析确定p值,以比较对不同剂量的应答;在所有研究中p<0.0001。图1a-图1e中的结果代表两项独立研究。
图2a至图2d说明地普罗考姆激活小鼠和人类tlr1/tlr2。图2a为显示在用地普罗考姆(500nm)处理4小时(每基因型n=3只小鼠)之后所示基因型的小鼠腹腔巨噬细胞上清液中tnf的量的图表。细胞因子水平归一化为刺激的c57bl/6j细胞的那些水平。p值通过学生t检验确定,并代表刺激的c57bl/6j细胞的应答与刺激的突变基因型细胞之间差异的显著性;4颗星表示具有统计学显著差异的那些应答。图2b为显示用对照抗体、抗tlr1(20μg/ml)或抗tlr2(20μg/ml)预处理1小时,然后再用媒介物或地普罗考姆(250pm)处理4小时的人类thp-1细胞上清液中tnf的量的图表。p值通过学生t检验确定。在图2a和图2b中绘制3个独立样品的平均值。图2c和图2d为免疫印迹,显示用地普罗考姆(在thp-1中5nm和在小鼠腹腔巨噬细胞中500nm)处理指定时间的人类thp-1细胞(图2c)和小鼠腹腔巨噬细胞(图2d)的裂解产物的分析结果。所有结果代表两项独立研究。
图3a至图3g通过图表和方案说明地普罗考姆增强抗原特异性抗体和ctl应答。图3a-图3c显示wt或tlr2-/-c57bl/6j小鼠(每组4只小鼠)用100μgova与媒介物、地普罗考姆(10mg/kg)或铝佐剂(alum)(2mg/kg)的混合物进行i.m.免疫的结果。14天之后,通过elisa测量ova特异性igg(图3a)、ova特异性igg1(图3b)和ova特异性igg2b(图3c)的血清滴度。图3d显示实验设置的示意图(左)以及在与dc共培养24小时之后,ot-icd8t细胞上的cd69表达通过流式细胞术的检测(中心)和量化(右)结果,所述dc在用ova与媒介物或地普罗考姆的混合物进行i.m.免疫之后24小时从小鼠(每组4只小鼠)收集。
图3e和图3f显示来自未免疫或用100μgova与媒介物或地普罗考姆(10mg/kg)的混合物进行i.m.免疫的小鼠(每组4只小鼠)的结果。免疫之后7天,用未经脉冲(对照细胞)或用ova肽(a.a.257-263)脉冲(靶细胞)的celltraceviolet标记的小鼠脾细胞对小鼠进行i.v.注射。两天后,收集血液以测量剩余的活染料标记的细胞。图3e说明对野生型小鼠中剩余的靶细胞(右峰)和对照细胞(左峰)进行计数的代表性的流式细胞术图。图3f显示在wt、tlr1-/-或tlr2-/-小鼠中杀灭的靶细胞百分比的定量比较。p值通过学生t检验确定。所有结果代表两项独立研究。
图4a至图4j说明通过用地普罗考姆佐剂化的肿瘤疫苗接种和检查点阻断进行的肿瘤治疗前或后对b16-ova肿瘤生长的抑制作用。图4a提供肿瘤治疗前或后方案的示意图。在第0天用2x105b16-ova黑色素瘤细胞对c57bl/6j小鼠进行s.c.注射(每治疗n=8只小鼠)。对于肿瘤治疗前,在肿瘤注射之前的同一天,用ova(100μg)与媒介物或地普罗考姆(10mg/kg)或铝佐剂(2mg/kg)的混合物对小鼠进行i.m.免疫。小鼠在7天后接受加强免疫,其中在通过i.p.注射进行肿瘤接种之后第3、6和9天给予抗pd-l1(200μg)。对于肿瘤治疗后,初次免疫为在肿瘤接种之后第3天,并在7天后加强免疫。在通过i.p.注射进行肿瘤接种之后第3、6、9、12和15天给予抗pd-l1(200μg)。图4b至图4f说明肿瘤治疗前结果。肿瘤体积(图4b和图4d)和小鼠存活百分比(存活者/总小鼠)(图4c和图4e)。图4f显示幼稚小鼠(n=8)或来自(图4c)的第35天无肿瘤存活者(n=8)通过s.c.注射各自用2x105个细胞b16-ova和b16f10肿瘤细胞攻击,并监测肿瘤体积。图4g至图4j说明肿瘤治疗前(图4g和图4h)与肿瘤治疗后(图4i和图4j)的比较。显示肿瘤体积(图4g和图4i)和小鼠存活百分比(存活者/总小鼠)(图4h和图4j)。用于肿瘤体积分析的p值适用于如图所示的最终时间点,并通过学生t检验计算得出。通过kaplan-meier分析计算存活分析的p值。所有结果代表两项独立研究。
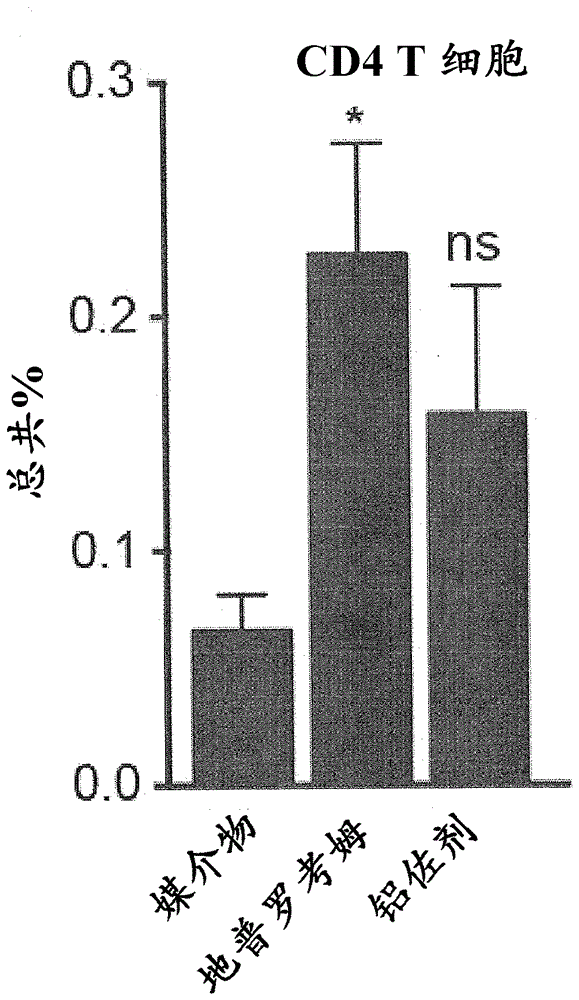
图5a至图5m说明地普罗考姆增强til和抗肿瘤ctl应答。图5a为图5a至图5j的治疗方案的示意图,其中c57bl/6j小鼠(每治疗n=6只小鼠)在第0天用2x105b16-ova黑色素瘤细胞进行s.c.注射和3天后用ova(100μg)与媒介物或地普罗考姆(10mg/kg)或铝佐剂(2mg/kg)的混合物进行i.m.免疫。小鼠在肿瘤接种之后第10天接受加强免疫,其中在通过i.p.注射进行肿瘤接种之后第3、6、9和12天给予抗pd-l1(200μg)。在第14天收获肿瘤以分离和分析肿瘤浸润白细胞(til)。图5a至图5j说明显示的总肿瘤细胞中每种细胞类型的频率。图5b显示til(cd45+)。图5c显示cd4t细胞(cd4+cd3+cd45+)。图5d显示激活的cd4t细胞(cd44高cd4+cd3+cd45+)。图5e显示cd8t细胞(cd8+cd3+cd45+)。图5f显示激活的cd8t细胞(cd44高cd8+cd3+cd45+)。图5g显示携带对ova(257-264)-h2kb四聚体具有特异性的t细胞受体的ova特异性cd8t细胞。图5h显示nk细胞(nk1.1+cd3-cd45+)。图5i显示dc(cd11c+cd3-cd45+)。图5j显示巨噬细胞(f4/80+cd11b+cd45+)。
图5k为图5l和图5m的治疗方案的示意图,其中c57bl/6j小鼠(每治疗n=8只小鼠)在第0天用2x105b16-ova黑色素瘤细胞进行s.c.注射和3天后用ova(100μg)与媒介物或地普罗考姆(10mg/kg)的混合物进行i.m.免疫。小鼠在肿瘤接种之后第10天接受加强免疫,其中在通过i.p.注射进行肿瘤接种之后第3、6、9、12和15天给予抗pd-l1(200μg)。在第0、3、6、9、12和15天,通过i.p.注射给予c57bl/6j小鼠抗cd4(300μg)、抗cd8(300μg)、抗nk1.1(300μg)或这3种抗体的混合物。说明肿瘤体积(图5l)和小鼠存活百分比(存活者/总小鼠)(图5m)。用于肿瘤体积分析的p值适用于如图所示的最终时间点,并通过学生t检验计算得出。通过kaplan-meier分析计算存活分析的p值。所有结果代表两项独立研究。
图6显示介导地普罗考姆-佐剂免疫加检查点抑制的抗肿瘤作用的关键细胞事件的示意性模型。
图7说明地普罗考姆不刺激小鼠腹腔巨噬细胞分泌ifn-β。测定了用地普罗考姆或lps处理4小时之后小鼠腹腔巨噬细胞上清液中的ifn-β。绘制3个独立样品的平均值。p值由学生t检验确定;在未刺激的细胞(0nm)与地普罗考姆刺激的细胞的应答之间未发现显著差异。结果代表两项独立研究。
图8a和图8b说明抗pd-l1抗体不抑制小鼠中b16肿瘤的生长。在第0天用2x105b16-ova黑色素瘤细胞对c57bl/6j小鼠(n=8)进行s.c.注射。在通过i.p.注射进行肿瘤接种之后第3、6和9天给予抗pd-l1(200μg)或小鼠igg2a同种型对照抗体。图8a为肿瘤体积相对于时间的图表,和图8b为显示小鼠存活百分比(存活者/总小鼠)相对于时间的图表。显示在两个值偏离的地方,两个图中的对照值均高于抗pd-l1值。用于肿瘤体积分析的p值适用于最终时间点,并通过学生t检验计算得出;治疗之间没有发现显著差异。通过kaplan-meier分析计算存活分析的p值;治疗之间没有发现显著差异。结果代表两项独立研究。
图9a和图9b说明在人类细胞中tnf产生的激活方面,地普罗考姆比pam3csk4更有效。图9a和图9b显示在用地普罗考姆或pam3csk4处理4小时(图9a)或24小时(图9b)之后,从人类thp-1细胞(图9a)和人类pbmc(图9b)的上清液中测定的tnf数量。地普罗考姆的数据点在图9a中通常显示在pam3csk4数据点的左侧,在图9b中线偏离的地方高于pam3csk4的数据点。绘制3个独立样品的平均值。结果代表两项独立研究。
定义
抗体:与配体基团免疫结合的多肽。如本文使用的抗体为免疫球蛋白分子和免疫球蛋白分子的免疫活性片段。包括在本领域中称为fab、fab’、f(ab’)2和fv的这类部分。一般地,抗体结合大小在约6至约34埃(å)范围内的配体,其缔合常数在约104-约1010m-1的范围内,并且高达1013m-1。抗体可结合广泛范围的配体,包括小分子(比如类固醇和前列腺素)、生物聚合物(比如核酸、蛋白和多糖)以及合成聚合物(比如聚丙烯)。
“抗体结合位点”或“互补位”为抗体分子的结构部分,其包含与“抗原”或“表位”特异性地结合(与之免疫反应)的重链和轻链可变和高变区。
术语“抗体”特别地意指包括单克隆抗体,其适合于注射(药学上可接受的)到需要治疗的患病哺乳动物中而不会由于污染物而产生过度不良反应。这种单克隆抗体可获自如本文所述免疫的动物物种,比如人类。或者,可在一只动物中诱导抗体,并修饰抗体产生细胞以产生要免疫的哺乳动物的抗体蛋白序列。尽管可考虑将其他物种的哺乳动物进行免疫,但是人类为特别优选的免疫接受者。结果,例如,最初在小鼠中诱导的预期的单克隆抗体作为所谓的“人源化”抗体或作为“嵌合”抗体对于人类接受者可能更有用。这些术语如internationalnonproprietarynames(inn)forbiologicalandbiotechnologicalsubstances(areview),worldhealthorganization(2016),§2.7中所述在本文中使用。
单词“抗原”在历史上一直被用于表示由抗体或受体结合的实体,并且也用于表示诱导抗体产生的实体。更最近的用法将抗原的含义限于由抗体或受体结合的实体,而单词“免疫原”用于诱导抗体产生或与受体结合的实体。当本文所述的实体既是免疫原性又是抗原性的时,一般地根据其预期用途将其称为免疫原或抗原。
本文中以其各种形式使用的术语“免疫反应”是指含有抗原决定簇的分子(抗原)与含有抗体结合位点的分子比如完整抗体分子或其含有互补位的部分之间的特异性结合。
“抗原决定簇”为由抗体结合位点或t细胞受体免疫结合的抗原的结构部分。该术语也可与“表位”互换使用。抗体可结合抗原的单个表位(单克隆)或多个表位(多克隆)。在蛋白材料中,线性表位的长度通常列举为约5-约7个氨基酸残基。
冠词“一(a)”和“一个(an)”在本文中用于指代该冠词的语法对象中的一个或多于一个(即至少一个)。举例来说,“元件”意指一个元件或多于一个元件。
单词“烃基”在本文中用作包括仅含有碳和氢的直链和分支链脂肪族以及脂环族基团或基的非芳族基团的简写术语。因此,考虑烷基、烯基和炔基,而严格来说也是烃基的芳族烃比如苯基和萘基在本文中称为芳基或基团,如下文所讨论。
当旨在特定的脂肪族烃基取代基时,列举该基团,即甲基、乙基、丁基、叔丁基、己基、己烯基、2-乙基己基、十二烷基(c12)、十八烷基(c18)。特别优选的烃基为烷基。结果,可通过在本文中枚举的任何取代基中用“烷基”替代描述符“烃基”来列举通用的但更优选的取代基。
尽管考虑长链(例如c18)烃基,但是在此说明性地使用较短的(c1-c4)基团的实例。这种说明性的烷基包括乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基和环丙基。合适的烯基的实例包括乙烯基(乙烯基团)、2-丙烯基、3-丙烯基、1,4-丁二烯基、1-丁烯基、2-丁烯基和3-丁烯基。炔基的实例包括乙炔基、2-丙炔基、1-丙炔基、1-丁炔基、2-丁炔基、3-丁炔基和1-甲基-2-丙炔基。
如技术人员将理解的那样,单词“烃基”不旨在包括不能存在的取代基,比如c1烯基,尽管旨在具有两个或更多个碳原子的这种取代基。
除了由于产生的名称可能与一种或多种取代基具有相似性而并不总是遵循去除末端“基(yl)”并添加适当的后缀的通常做法之外,当使用单词“烃基”时遵循通常的化学后缀命名法。因此,烃基醚称为“烃氧基(hydrocarbyloxy)”而不是“氢化羧基(hydrocarboxy)”,如当遵循通常的化学命名规则时可能更加合适的。说明性的烃氧基包括甲氧基、乙氧基、正丙氧基、异丙氧基、烯丙氧基、正丁氧基、异丁氧基、仲丁氧基和叔丁氧基。
配体:具有通常经静电力和/或氢键与特定受体分子特异性地结合的结构区域的分子。示例性的配体为表皮生长因子分子。
“标志物分子”(抗原或免疫原)可以但不必在细胞表面表达,而是可以在患病细胞的任何地方表达。这样的原因是,基本上哺乳动物的所有天然细胞蛋白均被细胞加工成较短的肽,并由i类mhc分子胞外结合。这种天然蛋白一般地在生物体未成熟期间进行如此加工,而可由那些天然蛋白部分诱导的t细胞或其他免疫细胞会在成熟之前被生物体消除,从而导致“自身蛋白”耐受。结果,除了某些免疫性疾病的情况之外,仅将由疾病比如癌症(其细胞起因于突变)引起的外源肽或新生抗原性肽识别为“外源”,并诱导对mhc结合的肽的免疫应答。
进一步地,关于突变,有时突变可为移码突变,并且导致氨基酸的非天然序列。标志物分子也可为“肿瘤抗原”;也就是说,例如可在胚胎发育期间由其他细胞表达,但在特征上由肿瘤比正常细胞表达多得多的蛋白。或者标志物分子可为癌基因产物,例如,由肿瘤细胞内的重组事件产生的异常融合蛋白。标志物分子也可为感染剂比如病毒或细菌的产物。
肽/多肽:包含至少两个氨基酸残基的低聚物或聚合物,其中相邻残基通过一个残基的α-氨基与相邻残基的α-羧基之间的肽键连接。多肽的一级结构在聚合物的一个末端具有伯胺基和在另一末端具有羧酸基团。在本文中并且通常在本领域中从左至右并且以从氨基末端到羧基末端的方向描绘肽或多肽。此外,取决于溶液的ph,水溶液中的多肽通常以一种或多种两性离子形式存在。单词“肽”和“多肽”在本文中可互换使用。
蛋白:包含多于约100个氨基酸残基的单个多肽或一组交联的多肽。蛋白可具有例如在同一多肽链内或在相邻多肽之间经二硫键的化学交联。当蛋白被糖基化时,其可称为糖蛋白。当蛋白包含如通过肽键、氨基酸残基序列、二硫键等连接在一起的一个或多个离散多肽/蛋白亚基时,蛋白通常称为融合蛋白、融合多肽、嵌合融合体等。
受体:具有与另一种分子(配体)特异性地结合的结构区域的生物活性蛋白分子。示例性的受体分子为参与细胞内或细胞间信号传导的抗体结合位点或跨膜细胞蛋白分子,比如称为egfr、erbb以及也称为her2的内皮生长激素受体等。
术语“残基”可与短语氨基酸残基互换使用。本文中鉴定的所有氨基酸残基均以天然或l-构型存在。为了与标准多肽命名法[j.biol.chem.,243:3557-59(1969)]一致,氨基酸残基的缩写如对应的下表所示。
本发明具有几个益处和优点。
本发明的显著益处为联合免疫在抑制患病细胞生长方面提供协同结果。
本发明的一个优点为联合免疫提供无病毒和无细菌疫苗通常缺乏的t细胞辅助。
本发明提供的另一个益处为,本领域的技术人员已经发现、研究和发表了疾病相关免疫原的化学式,其从1980年代初期以来就一直没有成功,但现在可以成功地使用。
通过以下公开,本发明的仍然其他益处和优点对于技术人员将是显而易见的。
优选实施方案的详述
本发明考虑一种抑制哺乳动物中的患病细胞生长的方法。那些患病细胞表达一种或多种在无病的相同类型细胞上不存在或与患病细胞相比较在无病细胞中以显著减少的数量存在的标志物分子。本领域技术人员已经发表了许多文章和综述,其讨论患病细胞中以明显大于无病细胞中存在的数量的数量存在的标志物分子以及用于确定那些差异的方法。参见例如kim等人,bmbrep50(6):285-298(2017)及其中的引用。另外,技术比如用光密度扫描或放射性检测手段及其他手段进行的定量western印迹为本领域中众所周知的。“相同类型”的细胞为来自与患病细胞相同的器官和组织的无病细胞。
所考虑的方法包括通过以下对有需要的患病哺乳动物进行免疫的步骤:a)给予患病哺乳动物(i)佐剂足够量的地普罗考姆化合物,(ii)t细胞刺激量的免疫检查点抑制剂,和(iii)免疫量的标志物分子。将经免疫的哺乳动物b)保持足以使哺乳动物对免疫产生免疫应答并抑制患病细胞生长的时间段。
考虑的地普罗考姆化合物在结构上对应于以下结构式v,
其中
-a为-h(氢基)或-c(o)nh-r4;
r1、r2、r3和r4相同或不同,并且为2-(4-氟苯基)乙基、反式-2-苯基环丙基、反式-2-(4-氟苯基)-环丙基或c2-c18烃基,条件是:
1)r1、r2、r3和r4(r1-4)中的至少两个或r1、r2和r3(r1-3)中的至少两个为反式-2-苯基环丙基、反式-2-(4-氟苯基)-环丙基或其混合物,或者r1-4中的每一个为2-(4-氟苯基)乙基,
2)至少一个所示的吡咯烷基二甲酰胺基具有(s,s)构型,并且当r1-4中的每一个不同于2-(4-氟苯基)乙基时,除c2-c18烃基以外的每个所示的r取代基为反式-2-苯基环丙基、反式-2-(4-氟苯基)-环丙基或其混合物,
3)当-a为-c(o)nh-r4时,r1-4中不超过两个为c2-c18烃基,和
4)当a为氢基时,r1-3中的一个可为c2-c18烃基,并且所示的含有r3的吡咯烷基甲酰胺基可具有r或s构型,或两种构型的混合物;
-z为卤素、-h、-nh2、-oh、-och3、-no2、-och2co2h、-o(ch2ch2o)nch2ch2co2h、-och2conh(ch2ch2o)nch2ch2co2h、-nhcoch2o-(ch2ch2o)nch2co2h、-och2conhch2conhch(choh)co2h、-och2conhch2conhchco2h(ch2co2h)、-och2conhch2conhch(choh)(ch2ch2o)nch2ch2co2h、-och2conhch2conhch(choh)(ch2ch2o)nch2ch2co2h、-och2conhch2conhch[(ch2)4nh2]co2h、-och2conhch2conhch(ch2oh)co{nhch[(ch2)4nh2]co}mnhch-[(ch2)4nh2]co2h(seqidno:3-8)、-och2conhch2co{nhch[(ch2)4nh2]co}pnhch[(ch2)4nh]co2h(seqidno:9-13)和-och2conhch2co{nhch(ch2oh)co}qnhch(ch2oh)co2h(seqidno:14-18)中的一种或多种;
w为氮(n)或ch;
“n”为其平均值为1-约8的数字;
“m”为其值为1-约6的数字;“p”为其值为1-约6的数字;和
“q”为其值为1-约6的数字。
式v化合物的地普罗考姆家族的一个优选成员为结构上对应于以下结构式i的化合物,其中-a=-c(o)nh-r4,并且所示的r1-4、w和z部分如上所述
在一种更优选的式i化合物中,取代基对r1和r3(r1或r3)或取代基对r1和r2(r1或r2)中的至少一个成员为反式-2-苯基环丙基或反式-2-(4-氟苯基)环丙基。还优选的是取代基对r1和r3或取代基对r1和r2中的至少一个成员具有反式-2-苯基环丙基或反式-2-(4-氟-苯基)环丙基的(1s,2r)构型。
更优选地,r1、r2、r3和r4中至少3个取代基具有反式-2-苯基环丙基或反式-2-(4-氟苯基)环丙基的(1s,2r)构型。仍然更优选地,r1、r2、r3和r4中的每一个具有反式-2-苯基环丙基或反式-2-(4-氟苯基)环丙基的(1s,2r)构型。
在另一个优选方案中,每个所示的吡咯烷基二甲酰胺基具有(s,s)构型,和每个所示的r1-4取代基为反式-2-苯基环丙基、反式-2-(4-氟-苯基)环丙基或其混合物,并且与环丙基部分的键具有(1s,2r)构型。
另一方面,式i化合物或其子通式之一中r1-4中的最多两个可为c2-c18烃基。优选的是烃基为烷基并且长度为4-约16个碳原子,并且仍然更优选地为约6-约10个碳原子。直链烃基也为优选的,尽管最多可存在两个甲基和乙基取代基或两者,碳环以及一个或两个双键或叁键亦可如此。特定的c2-c18烃基先前在单词烃基的使用讨论中讨论过。
从式i可以看出,每个分子含有至少一个,并且优选地两个3,4-吡咯烷基二羧基。羧基与端胺基r1、r2、r3和r4取代基键合,形成4个(或3个)酰胺键。因此,两个吡咯烷基二羧基也可称为两个吡咯烷基二甲酰胺基。
与吡咯烷基二羧基的羧基键合的取代基可为顺式或反式构象,即两个取代基均可投影于所示环的平面之上或之下(顺式),或者一个取代基可投影于该平面之上和另一个取代基投影于其之下(反式)。具有两个相同取代基的顺式二取代的吡咯烷基二羧基具有对称构型,并且不具有对映体形式。具有那些相同的两个相同取代基的反式二取代的吡咯烷基二羧基具有不对称(手性)构型,并且具有对映体形式。这两个手性构型称为(s,s)和(r,r),并且如下所示。其为
优选的是至少一个,和更优选地两个3,4-吡咯烷基二羧基具有(s,s)构型。
另一方面,当式v的-a为氢基和r1-3中的一个为c2-c18烃基,并且更优选地为c10-c16烃基。优选的化合物在结构上对应于以下式va,其中所示的r1-3、w和z部分如上所述。所示的-c(o)nh-r3基团可以r构型、s构型或作为两种构型的混合物存在。具有s构型的化合物具有略微更高的活性,并因此为更优选的。
在式va的化合物中,r3基团的碳原子数在此优选地为2-18,并且更优选地为10-16个碳原子。该烃基也更优选地为烷基,其为直链取代基,尽管甲基和乙基分支可被容许,链中双键和/或叁键亦可如此。也可使用环状烃基取代基化合物和含有碳环的取代基。
也优选的是w为ch。如下所示的结构式ia包含几个以上优选方案。
其中-z为氢基(-h)的目前最优选的式ia化合物的结构式作为式a、b、c、d、e、f、g、h和i的化合物如下所示。包括来自2018005812的地普罗考姆编号以供参考。
和
对于式f化合物,为了对人类thp-1细胞和小鼠巨噬细胞两者均具有最大活性,两个所示酰胺基中的“g”优选地为相同数目(长度)的5-9个亚甲基,g=5提供对两种细胞类型最具活性的化合物。对于式g化合物,所示酰胺基中的“h”为1-17,优选地为7-17,并且更优选地为9-15。对于式i化合物,所示酰胺基中的“j”为1-17,优选地为3-11,并且更优选地为5-9。
考虑的免疫检查点抑制剂一般地为完整抗体或抗体的含有互补位的部分。这种考虑的抗体或含有抗体互补位的部分优选地为单克隆人源化、嵌合或人类抗体。说明性的检查点usfda批准的检查点抑制剂包括keytruda®(抗pd-1)、yervoy®(抗ctla-4)、tecentriq®(抗pd-l1)、opdivo®(抗pd-1)]和imfinzi®(抗pd-l1)]。ctla-4本身与蛋白b7-1和b7-2结合以抑制t细胞活性。含有抗b7-1和抗b7-2互补位的分子也可用于阻断ctla-4/b7-1+b7-2相互作用,从而提供如同针对结合对pd-1和pd-l1中任一种的抗体的检查点抑制剂活性。
标志物分子在下文中详细讨论。这些材料一般地为蛋白,并且可为完整蛋白或蛋白的免疫原性部分。
当用于抑制哺乳动物中患病细胞生长的方法中时,给予佐剂足够量的地普罗考姆化合物、t细胞刺激量的免疫检查点抑制剂和免疫量的抗原性(免疫原性)疾病相关标志物分子以接触宿主哺乳动物细胞。这3种组分可一起给予,但是优选的是将检查点抑制剂与通常可一起给予的地普罗考姆和抗原(免疫原)分别给予。优选地,检查点抑制剂静脉内(iv)给予,而地普罗考姆和抗原以免疫药用组合物肌内(im)或皮下(sc)一起给予。
这些给予可在几分钟、几小时、几天或几周的跨度内完成。许多检查点抑制剂为抗体或含有互补位的抗体部分,其一般地具有大致约2-约4周的体内终末半衰期。[对于keytruda®(抗pd-1)、yervoy®(ctla-4)、tecentriq®(抗pd-l1)、opdivo®(抗pd-1)和imfinzi®(抗pd-l1)参见产品标签第12.3节]。因此,可在给予地普罗考姆和免疫原之前、同时或之后几天给予检查点抑制剂。
每种组分可在治疗过程期间多次给予。本文中说明了多次给予的使用。
地普罗考姆化合物以佐剂足够量给予。在本文中其他地方说明的研究中,本文中说明性地使用的地普罗考姆-1(a)起稳健的体内佐剂或tlr1/tlr2激动剂作用,当通过肌内途径以免疫药用组合物与免疫原共注射时,在小鼠体内以约0.25-约5mg/kg(i.m.)激发有效的tlr2依赖性佐剂活性。通过本领域众所周知的技术,可易于确定用于体重较大的哺乳动物的佐剂足够量。另外,地普罗考姆-1在用作佐剂时没有表现出lps给予特征性的明显毒性。
检查点抑制剂一般地以产品标签中讨论的量使用。说明性的剂量和给予包括以下使用黑色素瘤作为示例性的患病细胞供以所述量使用:keytruda®--黑色素瘤:每3周2mg/kg;yervoy®--佐剂黑色素瘤:每3周经90分钟静脉内给予10mg/kg,共4剂,然后每12周10mg/kg持续最多3年或直至有记载的疾病复发或毒性不可接受为止;tecentriq®--每3周经60分钟作为静脉内输注给予射1200mg;和opdivo®-不可切除的或转移性黑色素瘤:每2周240mg。
抗原性(免疫原性)疾病相关标志物分子的免疫量取决于所用标志物的免疫原性。对b细胞和t细胞具有免疫原性的肽的选择为本领域众所周知的,并且在此不再赘述。本领域中已经报道许多这种有用的肽,但是大概是由于缺乏t细胞辅助,未能像期望的那样成功地配制为疫苗。据信3部分免疫药用组合物克服了该缺陷。
许多小的疾病相关标志物分子,比如长度为约5-约20个残基的肽本身免疫原性差,并且通常最好地用作与载体分子化学连接的半抗原。说明性的蛋白载体分子包括匙孔䗩血蓝蛋白(klh)、乙型肝炎表面分子(hbsag)、乙型肝炎核心(衣壳;hbcag)、卵清蛋白、牛血清白蛋白、牛丙种球蛋白和人类丙种球蛋白已被用作半抗原载体,如文献中已经使用了许多其他分子。
考虑的疾病相关标志物分子存在于患病细胞中和/或之上。患病细胞一般地为癌性或病原体感染的。
用作实体瘤细胞中和/或之上存在的免疫原的疾病相关标志物分子或其部分,包括以下列出的在正常组织细胞上很少表达的癌症干细胞(csc)标志物。[kim等人,bmbrep50(6):285-298(2017).]。在正常(无病)细胞中基本上不存在并在患病细胞中存在的示例性csc标志物包括cd96、cd20、dll4、cd55、tim-3、cxcr1、cd54、cd114、lgr5、cd105、cd56、cd13、cd271、cd34、cxcr4、cd26、cd117、cd10、cd146、notch2、cd49f、cd24、abcg2、podxl-2、cripto-1、cd326、cd90、cd133、ssea1、tra-1-81、tra-1-60、ssea4、ssea3、cd151、cd340和cd44。
示例性的疾病相关标志物分子一般地存在于实体瘤细胞中和/或之上。说明性的实体瘤包括骨肉瘤细胞、卡波济肉瘤(kaposi'ssarcoma)细胞、黑色素瘤细胞、前列腺癌细胞、成胶质细胞瘤细胞、小细胞肺癌细胞、乳腺癌细胞、肝癌细胞、结肠癌细胞、卵巢癌细胞、肾癌细胞、胃癌细胞、成神经细胞瘤细胞、胰腺癌细胞和霍奇金淋巴瘤(hodgkin'slymphoma)细胞。
考虑的疾病相关标志物分子或其部分也可存在于病原体感染的细胞中和/或之上。说明性的感染病原体包括病毒、细菌、真菌和单细胞寄生虫中的一种或多种。
说明性的病毒包括流感、甲型、乙型、丙型和丁型肝炎病毒、疱疹病毒比如水痘带状疱疹(水痘)、单纯疱疹1和2(hsv1和hsv2)、人类乳头瘤病毒(hpv)等。说明性的细菌病原体包括大肠杆菌、粪肠球菌(e.faecalis)、金黄色葡萄球菌(s.aureus)等。一种说明性的单细胞寄生虫为恶性疟原虫(p.falciparum)、间日疟原虫(p.vivax)、伯氏疟原虫(p.bergeii)或约氏疟原虫(p.yoelli)的疟疾子孢子。
说明性的蛋白免疫原包括以下疾病相关标志物分子肽,其在以下伴随对其出版物来源的引用而列出。
美国专利号6942866
疟疾b细胞表位
恶性疟原虫
(nanp)4seqidno:
nanpnvdp(nanp)3nvdpseqidno:
nanpnvdp(nanp)3seqidno:
(nanp)3nvdpnanpseqidno:
nanpnvdp(nanp)3nvdpnanpseqidno:
npnvdp(nanp)3nvseqidno:
npnvdp(nanp)3nvdpseqidno:
npnvdp(nanp)3nvdpnaseqidno:
nvdp(nanp)3nvseqidno:
nvdp(nanp)3nvdpseqidno:
nvdp(nanp)3nvdpnaseqidno:
dp(nanp)3nvseqidno:
dp(nanp)3nvdpseqidno:
dp(nanp)3nvdpnaseqidno:
间日疟原虫
draagqpagdradgqpagseqidno:
angagnqpgangagdqpga-
ngadnqpgangaddqpgseqidno:
angagnqpgangagdqpgseqidno:
angadnqpgangaddqpgseqidno:
angagnqpgangadnqpgseqidno:
angadnqpgangaddqpgseqidno:
apganqeggaaapganqeggaaseqidno:
伯氏疟原虫
(dp4npn)2seqidno:
约氏疟原虫
(qgpgap)4seqidno:
疟疾通用t细胞表位
恶性疟原虫
gieylnkiqnslstewspcsvtseqidno:
间日疟原虫
yldkvratvgtewtpcsvtseqidno:
约氏疟原虫
efvkqissqlteewsqcsvtseqidno:
美国专利号8017127
甲型流感m2蛋白b细胞表位
如美国专利号8017127中所述,m2蛋白在被甲型流感毒株感染的细胞中表达。m2蛋白的n-末端残基1-24延伸穿过被感染细胞的膜。该蛋白的细胞外部分称为m2e。结果,使用该蛋白的甲型流感的细胞外m2e部分作为免疫原性标志物可提供免受所有流感毒株的保护。因此,可避免流感疫苗选择的年度变化。
序列seqidno
slltevetpirnewgcrcngssd
slltevetpirnewgcrcndssd
slltevetpirnewgarandssd
slltevetpirnewgsrsndssd
slltevetpirnewgsrcndssd
slltevetpirnewgcrsndssd
slltevetpirnewgcrandssd
slltevetpirnewgarcndssd
mslltevetpirnewgcrcndssd
mslltevetpirnewgsrsndssd
mgislltevetpirnewgcrcnd-
ssdellgwlwgi
mslltevetpirnewgarandssd
mslltevetpirnewgcrandssd
mslltevetpirnewgarcndssd
mslltevetpirnewgcrsndssd
mslltevetpirnewgsrcndssd
slltevetpirnewgsrsndssdsll-
tevetpirnewgsrsndssd
slltevetpirnewgsrsndssdsll-
tevetpirnewgsrsndssdsll-
tevetpirnewgcrcndssd
slltevetpirnewgarandssdsll-
tevetpirnewgcrcndssd
slltevetpirnewgarandssdsll-
tevetpirnewgarandssdsll-
tevetpirnewgcrcndssd
evetpirnewgsrcndssd
evetpirnewgsrcndssdevet-
pirnewgsrcndssd
evetpirnewgsrcndssdevet-
pirnewgsrcndssdeve-
tpirnewgcrcndssd
slltevetpirnewgsrsndssdsll-
tevetpirnewgsrsndssdsll-
tevetpirnewgsrsndssdsll-
tevetpirnewgcrcndssd
slltevetpirnewgsrsndssdsll-
tevetpirnewgsrsndssdsll-
tevetpirnewgsrsndssdsll-
tevetpirnewgsrsndssdsll-
tevetpirnewgcrcndssd
slltevetptrnewgcrcndssd
slltevetptrngwgcrcndssd
slltevetpirnewecrcngssd
slltevetptknewecrcndssd
slltevetptrngweckcsdssd
slltevdtltrngwgcrcsdssd
slltevetltrngweckcrdssd
乙型流感蛋白
nnatfnytnvnpishir
美国专利号4599231
乙型肝炎病毒表面抗原
乙型肝炎病毒表面抗原(hbsag)提供b细胞和t细胞多肽表位两者。如美国专利号4599231中基于来自ayw供体(p49)和adw供体(p72和p73)的dna所述,如该专利中公开的许多每种表位类型连同其肽名称和从n-末端起的括号内的序列位置在下表中列出。
序列seqidno
b细胞表位
p49(110-137)
fpgssttstgpcrtcmttaqgtsmypsc
p49a(125-137)
mttaqgtsmypsc
p72(125-137)
ipgstttstgpcktcttpaqgnsmfpsc
p72a(125-137)
ttpaqgnsmfpsc
p73(107-137)
cplipgstttstgpcktcttpaqgnsmfpsc
t细胞表位
p1(48-81)
clgqnsqsptsnhsptscpptcpgyrwmclrrfi
p5(38-52)
slnflggttvclgqn
p5a(74-52)
vclgqn
p6(95-109)
lifllvlldyqgmlpvcpl
美国专利号5180806
人类乳头瘤病毒(hpv)标志物肽
乳头瘤病毒可诱导皮肤或粘膜上皮的良性、发育不良性和恶性过度增殖。已经鉴定出多于50种类型(毒株)的人类乳头瘤病毒(hpv)。在人类中,已知不同的乳头瘤病毒类型会引起不同的疾病。例如,hpv1型和2型引起寻常疣,而6型和11型引起湿疣和生殖器扁平疣。相比之下,hpv16型、18型和33型在大多数宫颈癌中携带,并且不会引起寻常型湿疣,而是在宫颈内皮中弥漫性持续存在,仅表现出最小的病理变化。认为与宫颈癌相关的hpv类型在初次感染之后在宫颈内皮组织中保持潜伏状态数年,并然后在某些情况下发展为引起宫颈癌。
美国专利号5180806公开了几种诱导抗体产生的肽序列。在美国专利号5180806中公开的与16型相关的hpv序列的说明性肽标志物以下作为说明列出。该专利还公开了来自18型和33型的肽序列,以及由hpv6、11、18和33型的e2orf编码的序列。
hpv16型相关多肽
序列seqidno
madpagtngeegtgc
hededkendgdslptc
rpfksnkstcc
ccdwciaafgltpsi
tydsewqrdqflsqvkipc
hksaivtltydsewqrdqc
cincqkplcpeekqrh
预期的免疫组合物一般地还含有药学上可接受的盐、缓冲剂等赋形剂,统称为药学上(或生理学上)可接受的稀释剂或载体,与如在体外测定中那样的可存在于非旨在医药用途的组合物中的那些相比较。这些组合物在下文中进一步详细讨论。
可提供可用于本文中的地普罗考姆化合物按本身或作为药学上可接受的盐使用。可用于预期的化合物的示例性盐包括(但不限于)以下:硫酸盐、盐酸盐、氢溴酸盐、乙酸盐、己二酸盐、藻酸盐、枸橼酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、硫酸氢盐、丁酸盐、樟脑酸盐、樟脑磺酸盐、二葡糖酸盐、环戊烷丙酸盐、十二烷基硫酸盐、乙磺酸盐、葡庚糖酸盐、甘油磷酸盐、半硫酸盐、庚酸盐、己酸盐、富马酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、2-羟基乙磺酸盐、乳酸盐、马来酸盐、甲磺酸盐、烟酸盐、2-萘磺酸盐、草酸盐、扑酸盐、果胶酸盐、过硫酸盐、3-苯基-丙酸盐、苦味酸盐、新戊酸盐、丙酸盐、琥珀酸盐、酒石酸盐、硫氰酸盐、甲苯磺酸盐、甲磺酸盐和十一烷酸盐。羧酸根基团的盐包括钠、钾、镁、钙、铝、铵和多取代的铵盐。
关于与药用化合物形成药学上可接受的盐的常用药学上可接受的酸和碱的列表,读者可转到berge,j.pharm.sci.197768(1):1-19。
在某些情况下,盐还可用作分离、纯化或拆分本发明化合物的辅助剂。在这种用途中,所使用的酸或碱以及所制备的盐不必为药学上可接受的。
预期的免疫药用组合物含有佐剂有效量的溶解或分散于生理学上(药学上)可接受的载体中的式v化合物或其药学上可接受的盐以及免疫原性标志物。这种组合物可如在细胞培养物中那样在体外给予哺乳动物细胞以接触那些细胞,或者可如在有需要的活的宿主哺乳动物中那样在体内接触细胞。从本文的数据可以看出,以飞摩尔-纳摩尔量存在的预期的地普罗考姆化合物在体内和体外测定研究中提供佐剂作用。
当用作疫苗佐剂时,式v化合物优选地与所选标志物免疫原一起给予。如上所述,两种组分优选地一起存在于单一免疫药用组合物中。然而,这两种成分可存在于分开给予的免疫药用组合物中,并且那些分开的组合物可相隔最多约1-约2小时来给予。当给予两种分开的组合物时,优选的是它们在时间上尽可能接近一起给予。
在另一个实施方案中,可将所用的地普罗考姆化合物中的一些或全部与免疫标志物化合物化学键合。该化学键可使用式v中所示的z取代基形成,其中包括羧基的z取代基可与免疫原性肽标志物化合物的氨基键合。或者,在将免疫原性标志物化合物用作与载体分子键合的半抗原时,地普罗考姆化合物也可与相同的载体分子化学键合。
预期的免疫药用组合物一般地在1个月内多次(比如每天或每周)体内给予需要它的受试者,并且可在几个月至几年的时间段内给予。更通常地,预期的组合物在治疗过程内多次给予。
预期的免疫药用组合物优选地适合于胃肠外给予。因此,免疫药用组合物在给予时优选地以液体形式存在,并且最优选地液体为水性液体,尽管如以下讨论的那样也考虑其他液体,并且目前最优选的组合物为可注射制剂。
因此,可根据已知技术使用合适的分散或润湿剂和助悬剂来配制可注射制剂,例如无菌可注射水性或油性溶液剂或混悬剂。无菌可注射制剂也可为在非毒性胃肠外可接受的稀释剂或溶剂中的无菌可注射溶液剂或混悬剂,例如作为在1,3-丁二醇中的溶液剂。可采用的可接受的媒介物和溶剂中包括水、林格氏溶液和等渗氯化钠溶液、磷酸盐缓冲盐水。
其他液体药用组合物包括例如适合于胃肠外给予的溶液剂。式v化合物的无菌水溶液剂或式v化合物在包含水、乙醇或丙二醇的溶剂中的无菌溶液剂为适合于胃肠外给予的液体组合物的实例。在一些方面,预期的式v化合物作为干粉提供,所述干粉将在使用之前被溶解于适当的液体介质比如氯化钠中以注射。
另外,无菌的不挥发油常规用作溶剂或悬浮介质。为此,可采用任何温和的不挥发油,包括合成的单或二甘油酯。另外,脂肪酸比如油酸可用于制备可注射组合物。可使用二甲基乙酰胺、表面活性剂(包括离子型和非离子型去污剂)、聚乙二醇。溶剂和润湿剂比如以上讨论的那些的混合物,也是有用的。无菌溶液剂可通过将活性组分溶解于期望的溶剂系统中,并然后使所得溶液通过膜滤器以使其灭菌,或者通过使无菌化合物在无菌条件下溶解于先前灭菌的溶剂中来制备。
具有需要治疗的患病细胞并且给予至少含有式v化合物和免疫原性标志物化合物的药用组合物的哺乳动物(受试者)可为灵长类动物,比如人类、猿类(比如黑猩猩或大猩猩)、猴子(比如食蟹猴或猕猴)、实验动物(比如大鼠、小鼠或兔子)、伴侣动物(比如狗、猫、马)或食用动物比如母牛或阉牛、绵羊、羔羊、猪、山羊、美洲驼等。
优选地,药用组合物为单位剂型。在这种形式中,将组合物分为含有适当量的地普罗考姆和免疫原的单位剂量。单位剂型可为包装的制剂,该包装含有离散量的制剂,例如在小瓶或安瓿中。
结果
地普罗考姆诱导人类和小鼠细胞两者中的细胞因子产生
从含有约100000个成员的化学文库中,鉴定出一类具有双侧对称性的能够激活pma分化的人类thp-1髓样细胞中的tnf生物合成的化合物。该类别的最初成员来自未公开的经设计以促进细胞表面受体二聚化的化合物子库(18)。
以下地普罗考姆-1为在广泛的结构-活性关系(sar)研究之后从该类别中开发的。其诱导thp-1细胞(ec50110pm)和人类pbmc(ec50875pm)(图0a和图1b)以及小鼠腹腔巨噬细胞(ec501.3nm)和骨髓来源的树突状细胞(bmdc)(ec506.7nm)(图0c和图1d)的剂量依赖性tnf产生。除tnf之外,地普罗考姆-1还诱导小鼠bmdc产生il-6(图0e)。然而,地普罗考姆-1未能刺激小鼠腹腔巨噬细胞产生i型ifn(图7)。研究的其他编号的地普罗考姆和由结构式i定义的那些也共具这些活性。
地普罗考姆靶向tlr1/tlr2并激活下游mapk和nf-κb信号传导途径
为了确定地普罗考姆的分子靶标,分析了对来自野生型c57bl/6j小鼠和各种tlr信号传导成分缺陷型c57bl/6j小鼠的腹腔巨噬细胞的作用。在tlr1或tlr2缺陷型巨噬细胞中完全没有地普罗考姆对tnf的诱导,但是在tlr-6缺陷型巨噬细胞中却不如此(图1a)。在来自myd88-、tirap-和irak4-缺陷型细胞的巨噬细胞中,地普罗考姆的活性也显著降低(图1a)。这些数据表明地普罗考姆靶向小鼠tlr1/tlr2异二聚体。
tlr1或tlr2抗体显著降低地普罗考姆对thp-1细胞的作用,表明人类tlr1/tlr2也是地普罗考姆分子的靶标(图1b)。地普罗考姆在thp-1细胞和小鼠腹腔巨噬细胞中诱导ikkα、ikkβ、p38、jnk和erk的磷酸化以及iκbα的降解,表明地普罗考姆激活常规的tlr1/tlr2信号传导,包括mapk和经典的nf-κb信号传导(图1c和图2d)。
地普罗考姆在体内表现出佐剂活性
用卵清蛋白(ova)加上铝佐剂或地普罗考姆对野生型小鼠进行肌内免疫诱导相似水平的血清ova特异性igg,所述水平与用ova加上媒介物免疫所诱导的水平相比较显著升高(图2a-图3c)。尽管用ova+铝佐剂免疫主要诱导th2相关的ig亚类igg1,而ova+地普罗考姆却诱导igg1和th1相关的igg2b两者(图2b和图3c)。
用与其共培养的ova+地普罗考姆激活的ot-icd8t细胞对小鼠进行免疫之后24小时,从引流淋巴结和脾脏中纯化树突状细胞(dc),如ot-i细胞上的cd69上调证明的那样(图2d)。相比之下,来自用ova+媒介物免疫的小鼠的dc未能诱导ot-icd8t细胞上的cd69表达(图2d)。该研究结果表明,地普罗考姆在体内激活dc的抗原交叉呈递和cd8t细胞的交叉引发。
为了进一步研究地普罗考姆刺激的交叉引发是否在体内导致cd8+t细胞杀伤能力的发展,进行了ctl杀伤测定。将经荧光标志物标记的和ova肽(残基,257-263)脉冲的靶细胞i.v.注射到用ova+地普罗考姆免疫的小鼠中,并在两天后通过流式细胞术测量活靶细胞的数量。与用ova+媒介物免疫的小鼠中的约10%相比较,在用ova+地普罗考姆免疫的小鼠中约有70%的靶细胞被消除(图2e)。这些数据表明,地普罗考姆在抗原特异性抗体的产生和ctl杀伤中表现出佐剂活性,其在tlr1和/或tlr2缺陷型小鼠中则被消除(图2a-c、f和g)。
通过结合检查点阻断和用地普罗考姆佐剂化的抗癌疫苗完全抑制b16肿瘤的生长
在针对表达ova的b16黑色素瘤(b16-ova)的野生型小鼠的预防性免疫中,检查了地普罗考姆的佐剂活性(图3a)。在同一天但在接种b16-ova细胞之前,在有或没有地普罗考姆的情况下,对小鼠在肿瘤细胞注射部位的远端用ova进行i.m.注射。对于用单独的媒介物、单独的地普罗考姆或单独的ova免疫的小鼠,肿瘤生长速率和存活时间相似(图3b和图4c)。相对于单独的ova,用地普罗考姆+ova进行的免疫适度但明显减慢肿瘤的生长速率,但是未能延长生存期;用ova免疫联合抗pd-l1治疗观察到相似的效果(图3b和图4c)。
令人惊讶的是,尽管本身没有效果(图8a和图8b),但在向地普罗考姆+ova免疫中加入抗pd-l1治疗时,存在肿瘤生长的完全抑制和100%存活通过8周的观察(图3b和图4c)。这种显著的抗肿瘤作用取决于ova免疫,因为单独的地普罗考姆联合抗pd-l1治疗对肿瘤生长或小鼠存活无影响(图3d和图4e);该研究结果与b16黑色素瘤的免疫原性差一致(19-21)。
为了确定存活的小鼠是否被赋予针对癌症抗原的特异性和长期记忆,将来自图3c的5周存活者用b16-ova细胞和缺乏ova的b16细胞(b16)再攻击。在没有任何进一步治疗的情况下,观察到b16-ova肿瘤生长完全失败,而b16肿瘤生长迅速(图3f)。在幼稚c57bl/6j小鼠中,b16和b16-ova肿瘤细胞两者以相似的速率生长(图3f)。
综上所述,这些数据表明,地普罗考姆在用作癌症疫苗中的佐剂时会促进抗原特异性抗肿瘤免疫力,当与小鼠中的t细胞检查点阻断结合时,这种免疫力会大大增强。用地普罗考姆作为佐剂免疫可产生抗原特异性记忆应答,其保护宿主免受肿瘤生长的复发。
在具有已经建立的b16-ova肿瘤的小鼠的治疗性免疫中检查了地普罗考姆的抗肿瘤作用。在肿瘤接种当天或之后3天,在有或没有地普罗考姆的情况下,用ova对c57bl/6j小鼠进行免疫,并且其在7天后接受加强免疫(图3a)。在某些小鼠中,用铝佐剂取代地普罗考姆,以允许在这两种佐剂之间进行直接比较。对于所有情况,在肿瘤接种之后的第3天开始抗pd-l1治疗,并且之后每3天重复一次,持续12天。
在肿瘤接种的当天用单独的ova免疫的小鼠存活平均24天,并且到肿瘤接种之后38天100%的小鼠(8/8)死亡。正如预期的那样,在肿瘤接种的当天给予的地普罗考姆+ova完全抑制了肿瘤生长,从而允许100%的小鼠(8/8)存活通过54天的观察(图3g和图4h)。当在同一项研究中使用铝佐剂代替地普罗考姆时,肿瘤生长被部分地抑制,并且平均存活时间为37天,其中25%的小鼠(2/8)存活超过54天(图3g和图4h)。
当免疫延迟直至肿瘤接种之后3天时,与单独的ova相比较,地普罗考姆+ova仍显著抑制肿瘤生长并延长平均生存期(41天相对于22天)(图3i和图4j)。相比之下,铝佐剂+ova抑制肿瘤生长,但仅略微增加平均存活时间(30天);铝佐剂+ova的存活曲线与单独ova的曲线没有显著差异(p=0.082)(图3i和图4j)。在肿瘤治疗前和后,地普罗考姆对肿瘤生长、存活率和存活时间的影响均优于铝佐剂。
地普罗考姆增强抗肿瘤ctl应答
检查了联合的抗pd-l1治疗和地普罗考姆佐剂化的免疫消除肿瘤的细胞机制。在肿瘤接种之后3天,分析了用地普罗考姆+ova或铝佐剂+ova免疫的小鼠的肿瘤浸润白细胞(til)(图4a)。在接种之后14天收集肿瘤,并对单细胞悬液进行抗体染色,且通过流式细胞术进行分析,以检测总白细胞、cd4和cd8t细胞、nk细胞、dc和巨噬细胞。白细胞也用与ova肽(残基257-264)结合的h-2kbmhci类四聚体的抗体以及抗cd8的抗体染色以鉴定肿瘤特异性cd8t细胞。
与媒介物+ova相比较,含有地普罗考姆的ova免疫显著增加肿瘤中白细胞的频率(图4b)。对这些til的进一步分析表明,地普罗考姆提高cd4和cd8t细胞(包括激活的cd4和cd8t细胞(cd44高)和ova特异性cd8t细胞)的频率以及nk细胞的频率(图4c-图5h)。
铝佐剂+ova免疫显示朝til增加的趋势(图4b),其对于总的和cd44高cd8t细胞达到统计学显著性(图4e和图5f)。然而,与地普罗考姆+ova所诱导的增加的幅度相比较,增加的幅度有所降低。肿瘤接种之后第14天,铝佐剂+ova免疫没有增加ova特异性cd8t细胞(图4g);与媒介物+ova相比较,也没有增加总的和cd44高cd4t细胞(图4c和图5d)以及nk细胞(图4h)。
对于用媒介物+ova、地普罗考姆+ova和铝佐剂+ova免疫的小鼠,肿瘤内dc和巨噬细胞的频率相似(图4i和图5j)。总体而言,这些数据表明cd4和cd8t细胞、激活的cd4和cd8t细胞、ova特异性cd8t细胞和nk细胞(而不是dc或巨噬细胞)的肿瘤内频率与地普罗考姆和铝佐剂在免疫小鼠中的抗肿瘤作用相关。
为了确定地普罗考姆+ova加上抗pd-l1的抗肿瘤作用所必需的免疫细胞群,使用细胞类型特异性的抗体耗尽小鼠的cd8t细胞、cd4t细胞、nk细胞或所有3种细胞群。在b16-ova肿瘤接种的当天(第0天)并且之后每3天一次持续15天,i.p.给予耗尽抗体(图4k)。当小鼠的cd8t细胞或所有3种细胞类型(cd4t、cd8t、nk细胞)一起耗尽时,地普罗考姆+ova对肿瘤生长和小鼠存活两者的影响均被消除(图4l和图5m)。相比之下,cd4t细胞或nk细胞的耗尽对地普罗考姆+ova的抗肿瘤活性影响很小(图4l和图5m)。
有趣的是,注意到在用地普罗考姆+ova加上抗pd-l1治疗的小鼠中,cd8t细胞耗尽与cd4+cd8+nk细胞耗尽对肿瘤生长的影响之间存在轻微的统计学显著差异,其中肿瘤生长在耗尽所有3种细胞类型的小鼠体内更大。然而,这种差异并没有转化为存活率或时间上的差异。该研究结果表明,cd4t细胞、nk细胞或两者在介导地普罗考姆+ova加上抗pd-l1的抗肿瘤作用中起次要作用。这些数据表明,cd8t细胞对于通过治疗性地普罗考姆+ova免疫和检查点抑制在小鼠中根除肿瘤是必需的。
讨论
据信针对肿瘤新生抗原的癌症疫苗可通过增加能够对检查点抑制剂有反应的肿瘤特异性ctl的数量和激活来提高免疫检查点抑制治疗癌症的成功率。然而,t细胞对免疫的应答类型和幅度在很大程度上取决于疫苗佐剂;目前仅有少数佐剂被批准用于人类。
在此,描述了一种新型和有效的佐剂地普罗考姆的作用,所述佐剂接合并激活人类和小鼠tlr1/tlr2异二聚体。地普罗考姆与其他报道的合成化学配体或激活tlr1/tlr2的天然配体(22-26)没有结构相似性。地普罗考姆在激活人类tlr1/tlr2方面比众所周知的配体pam3csk4更强力和有效(图9a和图9b)。
在小鼠中,地普罗考姆诱导对共同给予的抗原强大的tlr1和tlr2依赖性体液和ctl应答。当与检查点抑制结合时,地普罗考姆佐剂化的免疫导致快速致命肿瘤的抗原特异性根除,并诱导能够预防肿瘤再生长的记忆应答。尽管单独的检查点抑制不足以防止致命的结果这一事实(图8a和图8b),但仍观察到肿瘤的治愈,从而支持这种联合免疫疗法的前提。
数据支持以下关键机制事件,这些事件介导地普罗考姆佐剂化的免疫加上检查点抑制的抗肿瘤作用(图5)。地普罗考姆与apc上的tlr1/tlr2结合,激活它们以产生促炎性细胞因子,并吸收所给予的肿瘤特异性抗原,以经mhci和mhcii进行加工和呈递。apc的抗原呈递、共刺激分子表达和细胞因子分泌诱导抗原特异性cd4t细胞和cd8t细胞的增殖和激活,这发展出对肿瘤细胞的溶细胞活性。nk细胞也被促炎性细胞因子激活并浸润肿瘤部位。抗pd-l1的添加抑制在肿瘤微环境中活跃的主要免疫抑制机制,允许响应于tcr/cd28连接的不受抑制的t细胞激活和增殖(27-29),进一步促进由cd8t细胞介导的肿瘤细胞裂解。
许多报告记载了tlr2信号传导的促肿瘤和抗肿瘤作用两者,这可能取决于所研究的细胞类型或癌症类型。例如,tlr2信号传导通过诱导免疫抑制性细胞因子(比如il-10)以及激活髓样来源的抑制性细胞和肿瘤相关的巨噬细胞来支持肿瘤的生长(30-32)。相比之下,tlr2信号传导也通过刺激dc激活和交叉呈递(33)并下调treg功能(34-36)来促进肿瘤消退。
对于地普罗考姆,在ova免疫与免疫检查点抑制相结合的情况下,全身性tlr2激活的总体结果为由肿瘤浸润抗原特异性cd8t细胞介导的肿瘤细胞裂解和肿瘤生长抑制。
佐剂的治疗指数大概取决于抗原联合靶向于apc的效率以及该apc的激活。地普罗考姆与tlr2之间的相互作用方式已通过x射线晶体学进行研究,并且其与该受体亚基的接触将在其他地方报道。地普罗考姆-tlr1/2复合物的结构表明地普罗考姆修饰以掺入免疫原性肽的机会,这可能通过确保所有活性地普罗考姆分子均伴有抗原而允许优化治疗指数。地普罗考姆易于合成,并且可快速适合于掺入肿瘤相关抗原和新生抗原中。这些特征使其成为临床开发的有吸引力的候选者。
材料和方法
小鼠
c57bl/6j、tlr2-/-、myd88-/-和ot-i小鼠购自thejacksonlaboratory。ly96-/-(md-2-/-)小鼠来自rikenbrc。通过enu诱变在纯c57bl/6j背景下生成了tlr4lps3/lps3、tlr6int/int、tlr7rsq1/rsq1、tiraptor/tor、ticam1lps2/lps2、ticam1lps2/lps2/irak4otiose/otiose小鼠,并在http://mutagenetix.utsouthwestern.edu进行了描述。
通过crispr/cas9基因靶向产生tlr1-/-小鼠。通过注射6.5u孕马血清促性腺激素(pmsg;millipore),然后在48小时后注射6.5u人类绒毛膜促性腺激素(hcg;sigma-aldrich)使雌性c57bl/6j小鼠超数排卵。随后将超数排卵的小鼠与c57bl/6j雄性小鼠交配过夜。第二天,从输卵管中收集受精卵,并将体外转录的cas9mrna(50ng/μl)和tlr1小碱基配对引导rna(50ng/μl;5’-caaaccgatcgtagtgctga-3’;seqidno:xx)注射到胚胎的细胞质或原核中。将注射的胚胎在m16培养基(sigma-aldrich)中于37℃下和5%co2中进行培养。为了产生突变小鼠,将两细胞阶段的胚胎转移到假孕hsd:icr(cd-1)雌性小鼠(harlanlaboratories)输卵管的壶腹中(每输卵管10-20个胚胎)。
所有使用小鼠的实验程序均已获得德克萨斯大学西南医学中心(theuniversityoftexassouthwesternmedicalcenter)的机构动物护理和使用委员会(institutionalanimalcareandusecommittee)(iacuc)的批准,并按照机构批准的有关动物护理和使用的方案和指南进行。按照机构批准的方案,将所有小鼠保持在德克萨斯大学西南医学中心。
腹腔巨噬细胞、bmdc、人类pbmc和细胞培养物的分离
在经用5ml磷酸盐缓冲盐水(pbs)腹腔灌洗而i.p.注射2mlbbl改良布氏(brewer)硫乙醇酸盐培养基(4%wt/vol;bdbiosciences)之后4天,回收硫乙醇酸盐引发的巨噬细胞。将腹腔巨噬细胞在dmem细胞培养基[含有10%vol/volfbs(geminibioproducts)、1%vol/vol青霉素和链霉素(lifetechnologies)的dmem]中于37℃和95%空气/5%co2下进行培养。
对于鼠bmdc,在培养皿中,于含有10ng/ml鼠gm-csf(r&dsystems)的10mldmem细胞培养基中培养骨髓细胞。在培养的第3天,将其更换为新鲜的gm-csf培养基。将松散粘附的细胞转移至新鲜的培养皿中,并且再培养4天。人类pbmc购自stemcelltechnologies。thp-1(atcc)细胞通过在rpmi细胞培养基[含有10%vol/volfbs(geminibioproducts)、1%青霉素和链霉素(lifetechnologies)的rpmi]中用100nmpma(sigma)处理24小时来分化。之后,在用于研究之前,将细胞用pbs洗涤并在新鲜的rpmi细胞培养基中培养24小时。
细胞因子产生的测量
将细胞以每孔1x105个细胞接种到96孔板上,并用地普罗考姆(溶解于dmso中,并且最终dmso浓度(≤0.2%)在所有实验中保持恒定)刺激持续4h。根据制造商的说明(ebioscience和pblassayscience),通过elisa试剂盒测量上清液中的小鼠tnf、il-6或ifn-β或者人类tnf。用20μg/ml抗tlr1、抗tlr2或同种型对照抗体(ebioscience)预处理1小时。除非另外指明,否则小鼠细胞来自野生型c57bl/6j小鼠。
western印迹
将小鼠腹腔巨噬细胞或人类thp-1细胞(每孔1x106个)对于小鼠细胞以500nm或对于人类细胞以5nm用地普罗考姆在12孔板中刺激指定时间,并直接在样品缓冲液(sigma)中裂解。通过sds-page分离细胞裂解产物,并转移至硝酸纤维素膜上。用以下抗体探测膜:磷酸化ikkα(ser176)/ikkβ(ser177)、iκbα、磷酸化p38(thr180/tyr182)、磷酸化jnk(thr183/tyr185)、磷酸化erk1/2(thr202/tyr204)(cellsignalingtechnology)和β-肌动蛋白(sigma)。
免疫和抗体应答的测量
最低纯度≥98%(sds-page)且内毒素水平<1eu/mg的endofit卵清蛋白(ova)购自invivogen。小鼠(每组4只小鼠)用100μgova与媒介物(dmso:tween80:盐水=1:1:8)、与10mg/kg地普罗考姆或与2mg/kg铝佐剂(alhydrogel佐剂2%,invivogen)的混合物i.m.免疫。14天之后,通过elisa测量ova特异性igg、igg1或igg2b(southernbiotech)的血清滴度。
体内ctl杀伤测定
用100μgova加上10mg/kg地普罗考姆对c57bl/6j雄性小鼠进行i.m.注射(每组n=4只小鼠)。一周后,处死幼稚的c57bl/6j小鼠,并收集脾细胞。将一半的脾细胞保持未脉冲状态,和将一半在完全培养基[含有10%vol/volfbs、1%青霉素和链霉素的rpmi]中于37℃下用ova257-263肽脉冲2小时。未经脉冲和肽脉冲的细胞分别在无血清培养基中用0.5μm(“低”)或5μm(“高”)celltraceviolet(invitrogen)标记20分钟。将相等数量(2x106)的celltraceviolet高(ova脉冲的)和celltraceviolet低(未经脉冲的)细胞混合在一起,并静脉内注射到免疫的小鼠中。48小时之后,收集来自经治疗的小鼠的血液并进行流式细胞术分析。确定剩余的活celltraceviolet高和celltraceviolet低细胞的数量,并用于计算杀伤的经ova肽脉冲的靶细胞的百分比。具体杀伤定义为
比率=celltraceviolet低细胞/celltraceviolet高细胞
靶细胞裂解的百分比=[1-未免疫的比率/已免疫的比率]x100。
肿瘤接种、免疫和肿瘤测量
b16-ova细胞(稳定表达鸡卵清蛋白的b16f10黑色素瘤细胞)在含有10%vol/volfbs的dmem中生长。将100μlpbs中的总共2x105个b16-ova细胞s.c.注射到8-12周龄的雄性c57bl/6j小鼠的右胁腹中,以建立肿瘤(每组n=8只小鼠)。为了进行预治疗,在有或没有ova(100μg)的情况下,在肿瘤接种的同一天(第0天)将10mg/kg地普罗考姆-1或2mg/kg铝佐剂i.m.注射到小鼠体内。首次免疫之后7天,小鼠接受加强注射。在第3、6和9天,某些组用100μl盐水中的200μg检查点抑制剂(抗mpd-l1,bioxcell)进行i.p.注射。
为了进行后治疗,在肿瘤接种之后第3天将10mg/kg地普罗考姆-1或2mg/kg铝佐剂与ova(100μg)i.m.注射到小鼠体内。首次免疫之后7天,小鼠接受加强注射。在肿瘤接种之后第3、6、9、12和15天,小鼠还用100μl盐水中的200μg抗mpd-l1进行i.p.注射。
为了耗尽cd4t细胞、cd8t细胞和/或nk细胞,在肿瘤接种之后第0、3、6、9、12和15天,将300μg抗mcd4(bioxcell)、300μg抗mcd8(bioxcell)、300μg抗mnk1.1(bioxcell)或3种抗体一起在200μl盐水中i.p.注射到小鼠体内。在肿瘤接种之后第3天,将10mg/kg地普罗考姆与ova(100μg)或媒介物i.m.注射到小鼠体内。首次免疫之后7天,小鼠接受加强注射。在肿瘤接种之后第3、6、9、12和15天,小鼠还用100μl盐水中的200μg抗mpd-l1进行i.p.注射。
用数显卡尺(fisher)测量肿瘤,并使用以下公式计算肿瘤大小:体积=0.5x长度x宽度2。当肿瘤的长度或宽度达到2cm时,处死小鼠。
肿瘤浸润白细胞的分离和染色
将100μlpbs中的总共2x105个b16-ova细胞s.c.注射到每只小鼠的肋腹中,以建立肿瘤(每治疗n=6只小鼠)。在肿瘤接种之后第3天,将10mg/kg地普罗考姆-1或2mg/kg铝佐剂与ova(100μg)i.m.注射到小鼠体内。首次免疫之后7天,小鼠接受加强注射。在肿瘤接种之后第3、6、9和12天,小鼠还用200μg抗mpd-l1进行i.p.注射。
在肿瘤接种之后第14天收获肿瘤,切碎并通过40μm过滤器过滤以获得单细胞悬液。用rbc裂解缓冲液(sigma)裂解红细胞。沉淀之后,将细胞用抗体混合物染色45分钟,所述抗体包括抗小鼠cd45.2-pe或cd45.2-apc(biolegend)、抗小鼠cd3-fitc(bdbiosciences)、抗小鼠cd4-bv786(bdbiosciences)、抗小鼠cd8-bv510(biolegend)、抗小鼠cd44-pe-cf594(biolegend)、apc缀合的h-2kb/ova(siinfekl;seqidno:xx)四聚体(baylorcollegeofmedicine)、抗小鼠f4/80-pe(tonbobioscience)、抗小鼠cd11b-bv605(biolegend)、抗cd11c-bv711(bdbiosciences)、抗nk1.1-bv650(bdbiosciences)。然后,将细胞用pbs洗涤两次。用lsrii仪器(bdbiosciences)分析染色的细胞,并使用flowjo软件分析流式细胞术数据。
cd8t细胞交叉引发的测量
c57bl/6j雄性小鼠用100μgova与媒介物或与10mg/kg地普罗考姆的混合物进行i.m.注射(每治疗n=4只小鼠)。24小时后,通过小鼠泛树突状细胞分离试剂盒(mousepandendriticcellisolationkit)(miltenyibiotech)纯化来自引流淋巴结和脾脏的dc。通过小鼠cd8+t细胞分离试剂盒(miltenyibiotech)纯化来自ot-i转基因小鼠的cd8t细胞。将3x105个dc与3x105ot-icd8t细胞在含有10%vol/volfbs和1%vol/vol青霉素和链霉素的rpmi培养基中共培养24小时。然后,收集细胞并用抗小鼠cd3-fitc、抗小鼠cd8-bv510和抗小鼠cd69-pe-cf594(biolegend)染色45分钟。然后,将细胞用pbs洗涤两次。用lsrii仪器分析染色的细胞,并使用flowjo软件分析流式细胞术数据。
统计分析
数据在描绘误差线的所有图表中均表示平均值±sem。使用graphpadprism7和指定的统计检验确定实验组之间差异的统计学显著性。为了比较两个未配对实验组之间的差异,使用未配对的学生t检验并报告双尾p值。p值由*p≤0.05;**p≤0.01;***p≤0.001;****p≤0.0001指示。p≤0.05被认为具有统计学显著性。
方法
地普罗考姆-1的合成
地普罗考姆分子和中间体的合成在2018年1月4日公布的wo2018/0058121a中详细显示和讨论。说明性合成也在下文中阐述。
(3s,4s)-4-((s)-4-苄基-2-氧代噁唑烷-3-羰基)吡咯烷-1,3-二甲酸1-叔丁酯3-乙酯(2).将(3s,4s)-1-苄基-4-((s)-4-苄基-2-氧代噁唑烷-3-羰基)吡咯烷-3-甲酸乙酯1(1,3.43g,7.86mmol)和boc2o(1.80g,8.25mmol,1.05当量)在室温下溶解于乙醇(etoh,50ml)中。加入pd(oh)2/c(500mg),并向反应混合物用氮气(n2)喷射15分钟。
1根据以下文献制备为单一立体异构体:bao等人,美国专利6489354b1。
连接三通冲洗适配器,其配备充有氢气(h2)的气球和真空源。抽空反应混合物上方的顶部空间直至溶剂开始沸腾,然后用h2回填。重复该真空/填充过程10-15次,以最大化顶部空间中的h2。搅拌18小时之后,将反应混合物通过6cmcelite塞过滤,用etoh等分试样(3×15ml)充分冲洗并浓缩。快速柱色谱法(sio2,25%etoac/己烷)提供2.93g(84%)为澄清的粘稠油的2。
1hnmr(400mhz,cdcl3)δ7.40-7.19(m,5h),4.69(dd,j=9.0,4.5hz,1h),4.52(q,j=7.7hz,1h),4.29-4.14(m,4h),3.95-3.75(m,2h),3.60(m,2h),3.52-3.27(m,2h),2.86-2.71(m,1h),1.46(s,9h),1.28(t,j=7.5hz,3h)。c23h31n2o7[m+h]+的hrms(esi-tof)m/z理论值447.2126,实测值447.2126。
(3s,4s)-1-(叔丁氧基羰基)吡咯烷-3,4-二甲酸(3).2将(3s,4s)-4-((s)-4-苄基-2-氧代噁唑烷-3-羰基)-吡咯烷-1,3-二甲酸1-叔丁酯3-乙酯((3s,4s)-2,2.06g,4.63mmol)溶解于无水四氢呋喃(thf,20ml)中并冷却至0℃。将过氧化氢(2.10ml,约18.5mmol,4.0当量,30%w/v)滴加到搅拌的反应溶液中。3-5分钟之后,加入lioh•h2o(500mg,11.9mmol)。2小时之后,加入另外的lioh(470mg,11.2mmol)以及h2o(10ml)和thf(15ml)。
2修改的程序来自:ma等人,tetrahedronasymm.8,883-887(1997)。
将含水thf反应混合物搅拌3小时,温热至室温。加入饱和na2so3水溶液(10ml),并在n2流下去除thf。将所得混合物倾入到h2o(200ml)中,并用二氯甲烷(ch2cl2,2x100ml)萃取以去除噁唑烷酮。
加入1nhcl水溶液将水相酸化至ph2(约75ml)。水相用乙酸乙酯(etoac,3x125ml)萃取,并经na2so4干燥有机萃取物,过滤并浓缩,提供1.13g(94%)为白色固体的(s,s)-3。
1hnmr(500mhz,dmso-d6)δ3.59-3.48(m,2h),3.41-3.31(m,2h),3.30-3.18(m,2h),1.39(s,9h)。
(3s,4s)-3,4-双(((1s,2r)-2-苯基环丙基)氨基甲酰基)吡咯烷-1-甲酸叔丁酯(5).(3s,4s)-1-(叔丁氧基羰基)吡咯烷-3,4-二甲酸((s,s)-3,775mg,2.99mmol)、(1s,2r)-反式-2-苯基环丙胺((1s,2r)-4,816mg,6.13mmol,2.05当量,可从d-lchiralchemicals市售获得)和1-羟基-7-氮杂苯并三唑(hoat,895mg,6.58mmol,2.20当量)在n2气氛下溶解于无水二甲基甲酰胺(dmf,15ml)中。缓慢加入2,6-二甲基吡啶(1.75ml,14.9mmol,5.00当量)。试剂溶解后(约15分钟),一次性加入1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(edci•hcl,1.43g,7.47mmol,2.50当量),并搅拌反应混合物18小时,之后将其倾入到1nhcl水溶液(150ml)和etoac(100ml)中。
用etoac(2x75ml)萃取水相,并依序用1nhcl水溶液(75ml)、饱和nahco3水溶液(75ml)和饱和nacl水溶液(50ml)洗涤合并的有机相。有机相经na2so4干燥,过滤并浓缩。快速柱色谱法(sio2,50%etoac/己烷)提供1.02g(70%)的5。
1hnmr(400mhz,cdcl3)δ7.33-7.24(m,5h),7.23-7.09(m,5h),6.61(s,1h),6.43(s,1h),3.85(t,j=9.7hz,1h),3.68(m,1h),3.60(t,j=10.5hz,1h),3.42(t,j=10.4hz,1h),3.27(q,j=10.0,9.3hz,1h),3.12(t,j=9.7hz,1h),2.88(m,2h),2.05(ddt,j=9.8,6.4,3.4hz,2h),1.46(s,9h),1.24(q,j=6.6hz,2h),1.13(dt,j=10.1,5.3hz,2h)。c29h36n3o4[m+h]+的hrms(esi-tof)m/z理论值490.2700,实测值490.2705。
(3s,4s)-n3,n4-双((1s,2r)-2-苯基-环丙基)吡咯烷-3,4-二甲酰胺盐酸盐(6).将(3s,4s)-3,4-双(((1s,2r)-2-苯基环丙基)氨基甲酰基)-吡咯烷-1-甲酸叔丁酯(5,998mg,2.04mmol)在室温下悬浮于无水thf(2ml)中。将4nhcl(8ml,4.0m的二噁烷溶液)滴加到剧烈搅拌的反应溶液中。在室温下搅拌3小时之后,期间一些产物从反应混合物中沉淀出来,经16小时通过n2流去除溶剂。将残留的固体悬浮于无水thf中并再次真空浓缩(3x5ml),以确保完全去除二噁烷和过量的hcl。用无水et2o(3x5ml)重复该过程,提供870mg(99%)为无定形白色固体的6。
1hnmr(500mhz,dmso-d6)δ9.35(s,2h),8.76(d,j=4.4hz,2h),7.26(t,j=7.6hz,4h),7.20–7.06(m,6h),3.76–3.62(m,1h),3.55–3.42(m,1h),3.26(t,j=8.2hz,2h),3.21–3.11(m,2h),2.90–2.78(m,2h),1.99(ddd,j=9.6,6.3,3.4hz,2h),1.26–1.13(m,4h)。c24h28n3o2[m+h]+的hrms(esi-tof)m/z理论值390.2176,实测值390.2178。
地普罗考姆-1:(3s,3's,4s,4's)-1,1'-对苯二甲酰基双(n3,n4-双((1s,2r)-2-苯基环丙基)吡咯烷-3,4-二甲酰胺).(3s,4s)-n3,n4-双((1s,2r)-2-苯基环丙基)-吡咯烷-3,4-二甲酰胺盐酸盐(6,500mg,1.17mmol,2.20当量)和对苯二甲酸(苯-1,4-二甲酸,89mg,0.53mmol,1.00当量)在室温下溶解于无水dmf(6ml)中。加入i-pr2net(0.280ml,1.60mmol,3.00当量),5分钟之后加入三吡咯烷子基溴化
合并的有机相用饱和nahco3水溶液(100ml)和饱和nacl水溶液(75ml)洗涤。有机相经na2so4干燥,倾析并浓缩。快速柱层析法(sio2,5-8%meoh/ch2cl2)提供地普罗考姆-1。地普罗考姆-1可通过用冷的(0℃)1:1et2o/etoac(3x5ml)研磨,倾析出液相以提供421mg(86%)的纯地普罗考姆而进一步纯化。[α]26d+57(c0.33,etoh)。ir(纯净)νmax3259、1633、1539、1426、1386、1073、695cm-1。
1hnmr(600mhz,dmso-d6)δ8.42(d,j=4.3hz,2h),8.29(d,j=4.3hz,2h),7.56(s,4h),7.27-7.21(m,8h),7.19-7.09(m,8h),7.09-7.03(m,4h),3.80(dd,j=12.0,8.6hz,2h),3.71-3.58(m,2h),3.51(ddd,j=15.6,11.2,8.2hz,4h),3.19(q,j=8.4hz,2h),3.10(q,j=8.1hz,2h),2.90-2.80(m,2h),2.80-2.73(m,2h),1.97(ddd,j=9.6,6.4,3.4hz,2h),1.86(ddd,j=9.5,6.3,3.4hz,2h),1.21-1.13(m,4h),1.13-1.05(m,4h).13cnmr(151mhz,dmso-d6)δ171.65,170.93,167.46,141.28,141.19,137.71,128.17,128.14,127.09,125.83,125.79,125.60,51.48,48.74,46.95,45.83,45.07,32.54,32.45,25.87,23.90,23.81,15.33,15.24。c56h57n6o6[m+h]+的hrms(esi-tof)m/z理论值909.4334,实测值909.4334。
引用
1.houb,reizisb&defrancoal(2008)toll-likereceptorsactivateinnateandadaptiveimmunitybyusingdendriticcell-intrinsicand-extrinsicmechanisms.immunity29(2):272-282.
2.macleodh&wetzlerlm(2007)tcellactivationbytlrs:arolefortlrsintheadaptiveimmuneresponse.scistke2007(402):pe48.
3.coffmanrl,shera&sederra(2010)vaccineadjuvants:puttinginnateimmunitytowork.immunity33(4):492-503.
4.haanenjbag(2017)convertingcoldintohottumorsbycombiningimmunotherapies.cell170(6):1055-1056.
5.sharmap,hu-lieskovans,wargoja&ribasa(2017)primary,adaptive,andacquiredresistancetocancerimmunotherapy.cell168(4):707-723.
6.wangh,etal(2017)cgasisessentialfortheantitumoreffectofimmunecheckpointblockade.procnatlacadsciusa114(7):1637-1642.
7.zouw,wolchokjd&chenl(2016)pd-l1(b7-h1)andpd-1pathwayblockadeforcancertherapy:mechanisms,responsebiomarkers,andcombinations.scitranslmed8(328):328rv4.
8.topaliansl,drakecg&pardolldm(2015)immunecheckpointblockade:acommondenominatorapproachtocancertherapy.cancercell27(4):450-461.
9.takeday,etal(2017)atlr3-specificadjuvantrelievesinnateresistancetopd-l1blockadewithoutcytokinetoxicityintumorvaccineimmunotherapy.cellrep19(9):1874-1887.
10.shahrr,hassettkj&britola(2017)overviewofvaccineadjuvants:introduction,history,andcurrentstatus.methodsmolbiol1494:1-13.
11.reedsg,orrmt&foxcb(2013)keyrolesofadjuvantsinmodernvaccines.natmed19(12):1597-1608.
12.kawait&akiras(2010)theroleofpattern-recognitionreceptorsininnateimmunity:updateontoll-likereceptors.natimmunol11(5):373-384.
13.kawasakit&kawait(2014)toll-likereceptorsignalingpathways.frontimmunol5:461.
14.beutlerba(2009)tlrsandinnateimmunity.blood113(7):1399-1407.
15.limkh&staudtlm(2013)toll-likereceptorsignaling.coldspringharbperspectbiol5(1):a011247.
16.wangs,etal(2016)intratumoralinjectionofacpgoligonucleotiderevertsresistancetopd-1blockadebyexpandingmultifunctionalcd8+tcells.procnatlacadsciusa113(46):e7240-e7249.
17.dowlingjk&mansella(2016)toll-likereceptors:theswissarmyknifeofimmunityandvaccinedevelopment.clintranslimmunology5(5):e85.
18.goldbergj,etal(2002)erythropoietinmimeticsderivedfromsolutionphasecombinatoriallibraries.jamchemsoc124(4):544-555.
19.uehas,etal(2015)robustantitumoreffectsofcombinedanti-cd4-depletingantibodyandanti-pd-1/pd-l1immunecheckpointantibodytreatmentinmice.cancerimmunolres3(6):631-640.
20.lechnermg,etal(2013)immunogenicityofmurinesolidtumormodelsasadefiningfeatureofinvivobehaviorandresponsetoimmunotherapy.jimmunother36(9):477-489.
21.chenl,etal(1994)tumorimmunogenicitydeterminestheeffectofb7costimulationontcell-mediatedtumorimmunity.jexpmed179(2):523-532.
22.murgueitioms,etal(2017)enhancedimmunostimulatoryactivityofinsilicodiscoveredagonistsoftoll-likereceptor2(tlr2).biochimbiophysacta1861(11pta):2680-2689.
23.guox,etal(2017)thenoveltoll-likereceptor2agonistsup3enhancesantigenpresentationandtcellactivationbydendriticcells.frontimmunol8:158.
24.guany,omueti-ayoadek,muthask,hergenrotherpj&tappingri(2010)identificationofnovelsynthetictoll-likereceptor2agonistsbyhighthroughputscreening.jbiolchem285(31):23755-23762.
25.chengk,etal(2015)specificactivationofthetlr1-tlr2heterodimerbysmall-moleculeagonists.sciadv1(3):10.1126/sciadv.1400139.
26.jinms,etal(2007)crystalstructureofthetlr1-tlr2heterodimerinducedbybindingofatri-acylatedlipopeptide.cell130(6):1071-1082.
27.freemangj,etal(2000)engagementofthepd-1immunoinhibitoryreceptorbyanovelb7familymemberleadstonegativeregulationoflymphocyteactivation.jexpmed192(7):1027-1034.
28.nishimurah,nosem,hiaih,minaton&honjot(1999)developmentoflupus-likeautoimmunediseasesbydisruptionofthepd-1geneencodinganitimmotif-carryingimmunoreceptor.immunity11(2):141-151.
29.dongh,zhug,tamadak&chenl(1999)b7-h1,athirdmemberoftheb7family,co-stimulatest-cellproliferationandinterleukin-10secretion.natmed5(12):1365-1369.
30.tangm,etal(2015)toll-likereceptor2activationpromotestumordendriticcelldysfunctionbyregulatingil-6andil-10receptorsignaling.cellrep13(12):2851-2864.
31.yamazakis,etal(2011)tlr2-dependentinductionofil-10andfoxp3+cd25+cd4+regulatorytcellspreventseffectiveanti-tumorimmunityinducedbypam2lipopeptidesinvivo.plosone6(4):e18833.
32.shimeh,etal(2017)toll-likereceptor2ligandandinterferon-gammasuppressanti-tumortcellresponsesbyenhancingtheimmunosuppressiveactivityofmonocyticmyeloid-derivedsuppressorcells.oncoimmunology7(1):e1373231.
33.shenky,etal(2014)molecularmechanismsoftlr2-mediatedantigencross-presentationindendriticcells.jimmunol192(9):4233-4241.
34.nyirendamh,etal(2011)tlr2stimulationdriveshumannaiveandeffectorregulatorytcellsintoath17-likephenotypewithreducedsuppressivefunction.jimmunol187(5):2278-2290.
35.zhangy,etal(2011)tlr1/tlr2agonistinducestumorregressionbyreciprocalmodulationofeffectorandregulatorytcells.jimmunol186(4):1963-1969.
36.amisetl,etal(2012)tlr2ligationprotectseffectortcellsfromregulatoryt-cellmediatedsuppressionandrepolarizesthelperresponsesfollowingmva-basedcancerimmunotherapy.oncoimmunology1(8):1271-1280.
本文引用的每篇专利、专利申请和文章均通过参考结合。
前述描述和实施例旨在为说明性的而不视为限制性的。在本发明的精神和范围内的仍然其他变化是可能的,并且将易于将其本身呈现给本领域的技术人员。
- 还没有人留言评论。精彩留言会获得点赞!