包含乳杆菌属的代谢健康用益生菌补充剂的制作方法
对保藏生物材料的引用
本申请含有对保藏生物材料的引用,该保藏通过引用并入本文。关于完整的信息,参见说明书的最后一段。
本发明涉及具有改进哺乳动物受试者的代谢健康的能力的细菌菌株、其细胞组分、代谢物和分泌的分子。本申请还涉及包含此类细菌菌株的组合物,以及此类组合物用于改进哺乳动物受试者的代谢健康的用途。
背景技术:
近年来,已经多次显示细菌对哺乳动物,特别是人类的健康具有重要且重大影响,并且已经认识到胃肠道中的有益微生物群对于适当的营养和健康很重要。
现在已经认为摄取微生物培养物或菌株(也称为益生菌)是使用微生物培养物或菌株改进个体健康的一种方式。就此而言,在整个说明书和权利要求书中,术语益生菌、微生物培养物和微生物菌株以普遍接受的方式理解为“当以适当量施用时赋予宿主健康益处的活微生物”(http://www.nature.com/articles/nrgastro.2014.66?foxtrotcallback=true)。
微生物菌株既可用于改进个体的不佳健康状况,又可用于防止不佳健康状况的出现。
益生菌的有益特性取决于形成益生菌的微生物菌株的特性,因此,重要的是提供具有有益特性的新微生物菌株,以使这些菌株可用作益生菌。
技术实现要素:
在第一方面,本发明涉及一种乳杆菌属(lactobacillus)菌株,该乳杆菌属菌株具有改进哺乳动物受试者的代谢健康,诸如减轻糖尿病前期的能力。在另一或替代方面,本发明的乳杆菌属菌株具有降低哺乳动物受试者的血糖水平的能力。本发明的乳杆菌属菌株可以例如为以如下保藏号保藏在dsmz-“德国微生物和细胞培养物保藏中心(germancollectionofmicroorganismsandcellculture)”中的菌株:dsm17648、dsm32851、dsm32853、dsm32910和/或dsm32911。
在第二方面,本发明涉及一种组合物,该组合物包含本发明的一种或多种乳杆菌属菌株,优选以离散剂量配制品进行配制。
在第三方面,本发明涉及使用本发明的一种或多种乳杆菌属菌株或包含本发明的一种或多种乳杆菌属菌株的组合物来改进哺乳动物受试者的代谢健康,诸如减轻糖尿病前期,维持个体的正常血糖水平和/或降低餐后血糖反应,预防或减轻胰岛素抵抗,或者预防或减少高脂肪和/或高糖饮食的个体的重量增加。
最后,在第四方面,本发明涉及一种用于筛选乳杆菌属菌株的方法,该乳杆菌属菌株具有改进哺乳动物受试者的代谢健康,诸如减轻糖尿病前期的能力。
附图说明
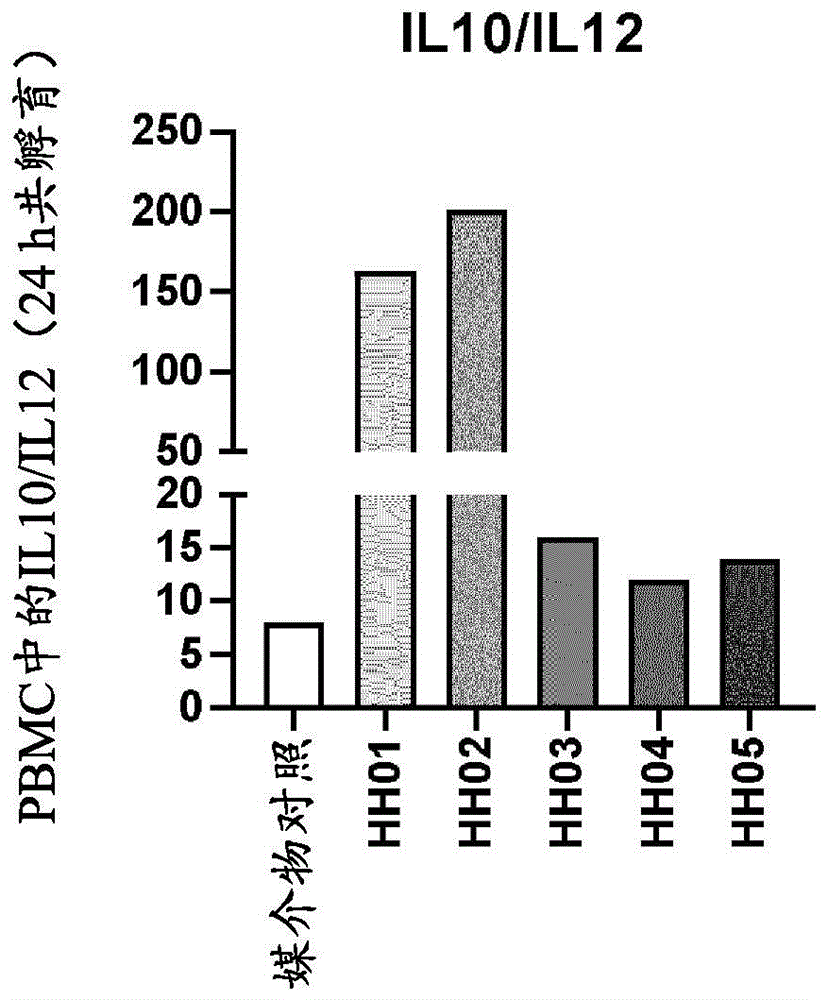
图1显示了表示与乳杆菌属菌株一起孵育24h的外周血单核细胞(pbmc)的上清液中,通过luminex或elisa测量的抗炎症细胞因子白介素10(il10)与促炎症细胞因子白介素12(il12)的比率的条形图。各列表示使用健康pbmc供体进行的3个实验的均值。更多细节,参见实例2。
图2显示了表示用促炎症刺激物(脂多糖)刺激并与乳杆菌属菌株一起孵育24h的pbmc的上清液中,通过luminex测量的促炎症细胞因子单核细胞趋化蛋白1(mcp-1)的条形图。各列表示使用健康pbmc供体进行的3个实验的均值。更多细节,参见实例2。
图3显示了表示用促炎症刺激物(脂多糖)刺激并与乳杆菌属菌株一起孵育24h的pbmc的上清液中,通过luminex测量的促炎症骨桥蛋白的条形图。各列表示使用健康pbmc供体进行的3个实验的均值。更多细节,参见实例2。
图4显示了显示促炎症环境中树突细胞(dc)分泌的细胞因子的条形图。每列代表n=1-3的均值。a:mcp-1;b:骨桥蛋白;c:il12p70。通过离心收获上清液,并使用多重测定用于细胞因子分析。更多细节,参见实例3。
图5显示表示与乳杆菌属和由tnfα+ifnγ+lps(混合物)组成的低级别炎症混合物一起孵育的dc培养物的上清液中,通过bdtm细胞计量珠阵列(cytometricbeadarray;cba)测量的抗炎症细胞因子白介素10(il10)与促炎症细胞因子白介素12p70(il12p70)的比率的条形图。将数据根据来自各供体的混合物对照标准化。将dc与乳杆菌属一起培养4小时,然后添加混合物,再维持16小时。混合物对照为与混合物一起培养16小时的dc。各列表示用来自个别健康人pbmc供体的单核细胞衍生dc进行的12个实验的比率。
图6显示表示与乳杆菌属和由tnfα+ifnγ+lps(混合物)组成的低级别炎症混合物一起孵育的dc培养物的上清液中,通过bdtm细胞计量珠阵列(cytometricbeadarray;cba)测量的单核细胞趋化蛋白-1(mcp-1/ccl2)的平均浓度的条形图。将dc与乳杆菌属一起培养4小时,然后添加混合物,再维持16小时。混合物对照为与混合物一起培养16小时的dc。各列表示用来自健康人pbmc供体的单核细胞衍生dc进行的12个实验的均值。
图7显示表示与乳杆菌属和由tnfα+ifnγ+lps(混合物)组成的低级别炎症混合物一起孵育的dc培养物的上清液中,通过bd细胞计量珠阵列(cytometricbeadarray;cba)测量的细胞因子白介素6(il6)的平均浓度的条形图。将dc与乳杆菌属一起培养4小时,然后添加混合物,再维持16小时。混合物对照为与混合物一起培养16小时的dc。各列表示用来自健康人pbmc供体的单核细胞衍生dc进行的12个实验的均值。
图8.显示了乳杆菌属菌株在孵育24h后,在感染复数(moi)5下,对上皮细胞系caco2的屏障强度的作用。使用跨上皮电阻(teer)技术测量此作用,并表示为teer比率。teer比率在不存在促炎症刺激物下测量为a,在存在促炎症刺激物下测量为b。更多细节,参见实例5。
图9通过在存在和不存在moi为5的乳杆菌属菌株以及由tnf-alpha(tnfα)和inf-gamma(infγ)组成的促炎症混合物下孵育24h后,显示了乳杆菌对上皮细胞系caco2的屏障强度的作用。a)乳杆菌属hh02的teer比率。每组2-3只的均值。b)乳杆菌属hh04的teer比率。每组2-3只的均值。c)乳杆菌属hh05的teer比率。每组2-3只的均值。
图10显示了冷冻干燥的乳杆菌属菌株hh02和hh04的跨上皮电阻(teer),将这些菌株以感染复数(moi)500与上皮细胞caco2共孵育24h后,储存在-20℃、4℃、25℃和40℃下一个月。a)乳杆菌属菌株hh02的teer比率。每组3-4只的均值。b)乳杆菌属菌株hh04的teer比率。每组3-4只的均值。
图11显示了在模拟肠中低糖(实心点)或高糖摄取(7mm果糖,实心倒三角形)的实验环境中,或在基底侧模拟全身性高葡萄糖(7mm葡萄糖,实心三角形)的情况下,或两者的组合情况下(实心正方形),乳杆菌属菌株hh02和hh04在moi为5下对上皮细胞系caco2的跨上皮电阻(teer)的影响。培养基对照描绘为空心圆。作为描述为在24h的孵育时间内连续的teer值。a)乳杆菌属菌株hh02的teer值。每组1-3只的均值。b)乳杆菌属菌株hh04的teer值。每组1-3只的均值。
图12披露了表示模拟胆汁盐汁中乳酸细菌(lab)消耗的胆汁盐浓度的条形图。各列代表一个实验(n=1)。更多细节,参见实例7。
图13显示了表示胰高血糖素样肽1(glp-1)的平均浓度的条形图,该胰高血糖素样肽1由与在yda培养基中培养的乳杆菌属菌株的无细胞生长肉汤一起孵育的l细胞(nci-h716)释放。将各测试样品稀释10倍和50倍,并添加至nci-h716细胞中维持2小时。各列表示5个个别实验的均值。更多细节,参见实例8。
图14显示了表示在与无细胞培养生长肉汤(1:10和1:50稀释)、新鲜培养肉汤(1:10和1:50稀释)和10μmpma阳性对照一起孵育2小时后nci-h716活力(%)的条形图。向细胞添加prestoblue溶液并孵育25分钟,然后在567nm(激发)/587nm(发射)下测量prestoblue荧光。各列表示5个个别实验的均值。
图15.显示了表示小鼠急性炎症(结肠炎)模型中各组动物的平均体重(第-6天时体重的%)的线图。每条线对应于实验过程中的每个处理(n=11-15)。乳杆菌属菌株处理在第-5天开始。更多细节,参见实例9。
图16显示了表示小鼠急性炎症(结肠炎)模型中每个处理组的华莱士评分(wallacescore;原始结肠损伤评分)的条形图。各列表示n=11-15的均值。评定结肠的炎症,并使用光学显微镜对结肠进行宏观分级以评价结肠的视觉外观。此由2位盲式观察员基于华莱士评分方法进行。结肠损伤评分的标准为:0-无损伤;1-充血。没有溃疡;2-充血和肠壁增厚。没有溃疡;3-一处溃疡,无肠壁增厚;4.-两个或超过两个溃疡或炎症位点;5.-两个或超过两个溃疡和炎症的大位点,或溃疡/炎症的一个位点沿结肠的长度延伸>1cm,以及6-10-如果损伤沿结肠的长度覆盖>2cm,则每增加一厘米得分增加1。更多细节,参见实例9。
图17显示了表示小鼠急性炎症(结肠炎)模型中每个处理组的平均结肠湿重(g)/长度(cm)的条形图。各列表示n=11-15的均值。更多细节,参见实例9。
图18显示了表示小鼠急性炎症(结肠炎)模型中结肠组织中细胞因子的条形图。各列表示n=11-15的均值。a:tnfα;b:il1b;c:il6;d:il17a,e:il25,f:il12以及g:il10。更多细节,参见实例9。
图19显示了可视化处理对微生物组成(物种水平)的作用的pca图。
图20显示了与处理相关的差异百分比。该分析在属水平上进行。
图21显示了实例10中描述的小鼠研究的研究概况。
图22显示了hh04和hh05对饮食诱发性肥胖小鼠(dio)模型中体重发展和身体组成的作用。显示了每组10-12只小鼠的均值:a)随机分配后的重量。b)在开始实验饮食和管饲处理后,实验组的重量发展。c)在所描绘时间点由磁共振扫描获得的脂肪质量(总体重的%)。d)如c中,但描绘为具有连接线的组均值。e)在所描绘时间点由磁共振扫描获得的瘦质量(总体重的%)。f)在所描绘时间点由磁共振扫描获得的体液质量(总体重的%)。更多细节可见于实例10中。
图23显示了乳杆菌属菌株对葡萄糖调节和肠渗透性的作用。a)hfd饲喂和每天管饲处理10周后的5h禁食血糖。条形图表示每组10-12只小鼠的均值。b)hfd饲喂和每天管饲处理10周后的5h禁食胰岛素。条形图表示每组10-12只小鼠的均值。c、e)hfd饲喂和每天管饲处理10周后,5h禁食小鼠中的口服葡萄糖耐量测试。c描绘了激发(2μg/g瘦质量)期间的血糖水平,并且e描绘了对葡萄糖激发的内源胰岛素反应的血浆水平。每组10-12只小鼠的均值。d)ogtt第10周的曲线下面积。条形图表示每组10-12只小鼠的均值。f)gsis第10周的曲线下面积。条形图表示每组10-12只小鼠的均值。g)hfd饲喂和每天管饲处理10周后,5h禁食小鼠中口服激发(150μl/只小鼠,浓度:10mg/ml)后的血浆磺酸荧光单位。每组10-12只小鼠的均值。h)hfd饲喂和每天管饲处理12周期间每只小鼠的累积饲料摄取。由于共同圈养,故摄取为每个笼每只小鼠的均值,其中每组中n=4。条形图表示均值。a-g)在口服激发前3小时,用相应的处理管饲所有小鼠。关于该研究的更多细节可见于实例10中。
图24显示了乳杆菌属菌株对饮食诱发性肥胖小鼠模型中组织重量或长度的作用。条形图表示每组10-12只小鼠的均值:a)每天管饲12周后尸检时的肝脏重量。b)每天管饲12周后,尸检时的结肠长度。条形图显示每组10-12只小鼠的均值。c)每天管饲12周后,尸检时腹股沟白色脂肪组织(iwat)的重量。d)每天管饲12周后,尸检时附睾白色脂肪组织(ewat)的重量。关于该研究的更多细节可见于实例10中。
图25显示了乳杆菌属菌株对饮食诱发性肥胖小鼠模型中组织重量的作用。条形图表示每天管饲12周后,尸检时每组10-12只小鼠的均值。a)腹膜后白色脂肪组织(rpwat)的重量。b)间充质白色脂肪组织(mwat)的重量。c)脑的重量。d)心脏的重量。关于该研究的更多细节可见于实例10中。
图26显示了在饮食诱发性肥胖小鼠模型中乳杆菌属菌株对血浆标志物的作用的生化分析。a)丙氨酸氨基转移酶。b)天冬氨酸氨基转移酶。c.1)甘油三酸酯,包括所有动物。c.2)甘油三酸酯,其中两只动物在评价超出特定测定的检测限后被排除。d)总胆固醇。每个条形图表示每组10-12只小鼠的均值。关于该研究的更多细节可见于实例10中。
图27显示了在饮食诱发性肥胖小鼠模型中乳杆菌属菌株对血浆标志物的作用的结果。a)血清淀粉样蛋白a。b)脂联素。c)非酯化脂肪酸。d)脂多糖。a-e)每个条形图表示每组10-12只小鼠的均值。关于该研究的更多细节可见于实例10中。
图28显示了在饮食诱发性肥胖小鼠模型中乳杆菌属菌株对肝脏脂质积聚的作用的结果。a)肝脏组织中的甘油三酸酯含量(mg/肝脏),和b)肝脏组织中的胆固醇(mg/肝脏)。每个条形图表示每组10-12只小鼠的均值。关于该研究的更多细节可见于实例10中。
图29显示了在饮食诱发性肥胖小鼠模型中乳杆菌属菌株对结肠细胞因子的作用的结果。a)结肠组织中的细胞因子干扰素γ(ifnγ)水平,以及b)结肠组织中的细胞因子白介素-10(il-10)水平。每个条形图表示每组10-12只小鼠的均值。关于该研究的更多细节可见于实例10中。
图30显示了在饮食诱发性肥胖小鼠模型中乳杆菌属菌株对肠微生物群组成的作用的结果。a)来自粪便样品中发现的hh04乳杆菌属菌株的dna。b)来自小肠内含物中发现的hh04益生菌菌株的dna。c)来自粪便样品中发现的hh05乳杆菌属菌株的dna。d)来自小肠内含物中发现的hh05乳杆菌属菌株的dna。e)使用从指定组中研究结束开始聚类粪便微生物群组成的加权unifrac距离进行主坐标分析(pcoa)。较大的点指示每组10-12只小鼠的组均值。f)使用从指定组中研究结束开始聚类小肠微生物群组成的加权unifrac距离进行主坐标分析(pcoa)。较大的点指示每组10-12只小鼠的组均值。关于该研究的更多细节可见于实例10中。
图31显示了hh04、hh05和hh02对饮食诱发性肥胖小鼠(dio)模型中体重发展和身体组成的作用。显示了每组10-12只小鼠的均值:a)随机分配后的重量。b)在开始实验饮食和管饲处理后,个别组的重量发展。c)在所描绘时间点由磁共振扫描获得的脂肪质量(总体重的%)。d)脂肪质量发展(克),其描绘为具有连接线的组均值。e)在所描绘时间点由磁共振扫描获得的瘦质量(克)。f)在所描绘时间点由磁共振扫描获得的体液质量(体重的%)。更多细节可见于实例11中。
图32显示了乳杆菌属菌株hh04、hh05和hh02对葡萄糖调节的作用。a)改良wd饲喂和每天管饲处理10周后的5h禁食血糖。条形图表示每组10-12只小鼠的均值。b)改良wd饲喂和每天管饲处理10周后的5h禁食胰岛素水平。c)改良wd饲喂和每天管饲处理10周后5h禁食小鼠在激发(1.5μg右旋糖/g瘦质量)期间的口服葡萄糖耐量测试。d)如c,但显示了激发期间血糖值相对于禁食值的变化。e)对葡萄糖激发的内源胰岛素反应的血浆水平。f)激发期间血浆中的c肽水平。a-f)数据表示每组10-12只小鼠的均值。关于该研究的更多细节可见于实例11中。
图33显示了乳杆菌属菌株hh04、hh05和hh02对饮食诱发性肥胖小鼠模型中组织重量的作用。条形图表示每组10-12只小鼠的均值:a)每天管饲12周后尸检时的肝脏重量。b)每天管饲12周后,尸检时腹股沟白色脂肪组织(iwat)的重量。c)每天管饲12周后,尸检时腹膜后白色脂肪组织(rpwat)的重量。d)每天管饲12周后,尸检时间充质白色脂肪组织(mwat)的重量。e)每天管饲12周后,尸检时肩胛内棕色脂肪组织(bat)的重量。f)每天管饲12周后,尸检时腓肠肌的重量。关于该研究的更多细节可见于实例11中。
图34显示了在饮食诱发性肥胖小鼠模型中乳杆菌属菌株对血浆标志物的作用的结果。a)丙氨酸氨基转移酶。b)天冬氨酸氨基转移酶。c)甘油三酸酯。d)总胆固醇。a-d)每个条形图表示每组10-12只小鼠的均值。关于该研究的更多细节可见于实例11中。
图35显示了在饮食诱发性肥胖小鼠模型中乳杆菌属菌株对肝脏脂质积聚的作用的结果。a)肝脏组织中的甘油三酸酯含量(μg/mg肝脏),b)肝脏组织中的胆固醇(μg/mg肝脏)。c)通过western印迹定量的胰岛素刺激的小鼠的肝脏组织中磷酸化(活化)的akt蛋白水平与总akt蛋白水平的比率。a-b)每个条形图表示每组10-12只小鼠的均值。c)每个条形图表示每组3-4只小鼠的均值。关于该研究的更多细节可见于实例11中。
图36显示了在饮食诱发性肥胖小鼠模型中乳杆菌属菌株对肝脏和结肠组织炎症的作用的结果。a)肝脏组织中的肿瘤坏死因子α(tnfα)水平,和b)肝脏组织中的细胞因子干扰素γ(ifnγ)水平。c)结肠组织中的肿瘤坏死因子α(tnfα)水平。d)结肠组织中的细胞因子干扰素γ(ifnγ)水平。a-d)每个条形图表示每组10-12只小鼠的均值。关于该研究的更多细节可见于实例11中。
图37显示了在饮食诱发性肥胖小鼠模型中乳杆菌属菌株对肠微生物群组成的作用的结果。使用从指定组中研究结束开始聚类粪便微生物群组成的加权unifrac距离进行主坐标分析(pcoa)。较大的点指示每组10-12只小鼠的组均值。关于该研究的更多细节可见于实例11中。
图38显示了hh04、hh05和hh02对两种饮食诱发性肥胖小鼠(dio)模型中体重发展和身体组成的作用。显示了每组8-9只小鼠的均值:a)饲喂lfd或hfd的小鼠随机分配后的重量。b)饲喂lfd或改良wd的小鼠随机分配后的重量。c)在开始实验饮食和管饲处理后,饲喂lfd或hfd的个别组的重量发展。d)如c,但在饲喂lfd或改良wd的组中。e)饲喂lfd或hfd的组在所描绘时间点由磁共振扫描获得的脂肪质量(总体重的%)。f)如e,但在饲喂lfd或改良wd的组中。g)饲喂lfd或hfd的组的脂肪质量发展(克),其描绘为具有连接线的组均值。h)如g,但在饲喂lfd或改良wd的组中。i)饲喂lfd或hfd的组在所描绘时间点由磁共振扫描获得的瘦质量(克)。j)如i,但在饲喂lfd或改良wd的组中。a-j)更多细节可见于实例12中。
图39显示了乳杆菌属菌株hh04、hh05和hh02对葡萄糖调节的作用。a)改良lfd或hfd饲喂和每天管饲处理10周后的5h禁食血糖。b)如a,但在饲喂lfd或改良wd的组中。c)lfd或hfd饲喂和每天管饲处理10周后的5h禁食胰岛素水平。d)如c,但为lfd或改良wd饲喂。e)每天管饲处理和饲喂lfd或hfd10周后,口服葡萄糖耐量测试期间的血糖值相对于空腹值的变化。f)如e,但描绘了lfd或改良wd饲喂组。g)饲喂lfd或hfd的组中对葡萄糖激发的内源胰岛素反应的血浆水平。h)如g,但描绘了饲喂lfd或改良wd的组。i)饲喂lfd或hfd的组在激发期间血浆中的c肽水平。j)如i,但在饲喂lfd或改良wd的组中。a-j)条形图表示每组8-9只小鼠的均值。关于该研究的更多细节可见于实例12中。
具体实施方式
乳杆菌属菌株
本发明涉及具有改进哺乳动物受试者的代谢健康,诸如减轻糖尿病前期的能力的乳杆菌属菌株、其细胞组分、代谢物和/或任何分泌的分子。
当在本文中使用时,术语“乳杆菌属菌株”应指一种或多种单独的乳杆菌属菌株,或乳杆菌属菌株与其细胞组分、代谢物和/或任何分泌的分子的组合。
术语“糖尿病前期”用于受试者的如下病症,其中并非诊断糖尿病所要的所有症状均存在,但是例如血糖异常高。如本文所用,糖尿病前期包括引起诸如以下的症状的病症,例如胰岛素抵抗、高血糖、低度炎症和/或肠屏障功能受损,即其中肠屏障功能的功能降低。
在一方面,本发明的乳杆菌属菌株在胃肠(gi)道中存活。
术语“在胃肠(gi)道中存活”在本文中用来指该菌株在通过gi道后有活性。肠道中的存活率例如通过鉴别受试者的粪便样品中的菌株来确定,该受试者已经诸如通过口服摄取施用该菌株。
本发明的乳杆菌属菌株可以具有改进诸如以下的一种或多种糖尿病前期症状的能力,例如胰岛素抵抗、高血糖、低度炎症和/或肠屏障功能。在一方面,本发明的一种或多种乳杆菌属菌株或包含其的组合物可以改进受试者的餐后血糖反应,和/或减轻受试者的胰岛素抵抗。
本发明的乳杆菌属菌株还可以或替代地具有改进诸如以下的一种或多种2型糖尿病症状的能力,例如胰岛素抵抗、高血糖、低度炎症和/或肠屏障功能。在一方面,本发明的一种或多种乳杆菌属菌株可以改进受试者的餐后血糖反应,和/或减轻受试者的胰岛素抵抗。因此,在一个实施例中,本发明的一种或多种乳杆菌属菌株或包含其的组合物改进患有2型糖尿病的受试者的餐后血糖反应和/或减轻胰岛素抵抗。
本发明的乳杆菌属菌株还可以具有降低接受高脂肪和/或糖饮食的个体的血糖浓度和/或减少重量增加的能力,其中本发明的一种或多种乳杆菌属菌株存在于胃肠道中。应当理解,本发明的乳杆菌属菌株具有降低由于特定饮食而血糖水平高于正常的个体的血糖水平的能力。不用怀疑本发明的乳杆菌属菌株可以将血糖水平降低到正常血糖水平以下。因此,与胃肠道中不存在本发明的一种或多种乳杆菌属菌株的同一个体摄取相同饮食的情况相比,本发明的一种或多种乳杆菌属菌株在存在于个体的胃肠道中时可以减少摄入高脂肪饮食的个体的重量增加
本发明的乳杆菌属菌株还可以具有改进哺乳动物,特别是人类的胃肠道中由高脂肪或西式饮食诱发的微生物生态失调的能力。此结果为,本发明的乳杆菌属菌株在存在于胃肠微生物群中时具有保护肠免受通常会引起正常胃肠功能严重紊乱的病症和疾病影响的能力。例如,本发明的一种或多种乳杆菌属菌株可以保护受试者免受诸如结肠炎的病症影响。
本发明的乳杆菌属菌株可以对哺乳动物细胞发挥抗炎症作用,例如表示为在存在促炎症刺激物下暴露于本发明的一种或多种乳杆菌属菌株的哺乳动物细胞具有高il10/il12比率。在一个实施例中,本发明的乳杆菌属菌株对哺乳动物细胞发挥抗炎症作用。在另一个实施例中,本发明的一种或多种乳杆菌属菌株使得在存在促炎症刺激物下在暴露于乳杆菌属菌株的哺乳动物细胞中产生高il10/il12比率。
在一个实施例中,乳杆菌属菌株选自乳杆菌属菌株、罗伊氏乳杆菌(lactobacillusreuteri)菌株或属于干酪乳杆菌(lactobacilluscasei)群的菌株。属于干酪乳杆菌群的菌株包括干酪乳杆菌、副干酪乳杆菌(l.paracasei)和鼠李糖乳杆菌(l.rhamnosus)菌株;优选副干酪乳杆菌(lactobacillusparacasei)菌株、副干酪乳杆菌坚韧亚种(lactobacillusparacaseisubsp.tolerans)或副干酪乳杆菌副干酪亚种(lactobacillusparacaseisubspparacasei)菌株。
特别优选的菌株选自以如下保藏号保藏在dsmz-“德国微生物和细胞培养物保藏中心”中的乳杆菌属菌株:dsm17648、dsm32851、dsm32853、dsm32910或dsm32911。
本发明的乳杆菌属菌株可以以本身已知的任何方式获得,诸如在合适的培养基中培养,优选以某种方式并且使用某种培养基以使得因此获得的微生物制剂适用于向人和/或动物施用,并且尤其能够在胃肠道的所要部位定殖。
如本领域中所已知,可以在适用于发酵乳杆菌属菌株的标准发酵设备中进行本发明的乳杆菌属菌株的培养。
培养后,使用本领域已知的技术从发酵肉汤回收本发明的乳杆菌属菌株,并且将其转化为本发明的组合物,或者替代地,可以将完整的发酵肉汤转化为根据本发明的组合物。
筛选
具有改进哺乳动物受试者的代谢健康诸如减轻糖尿病前期的能力的乳杆菌属菌株可以通过用于筛选菌株所要特性的一种或多种筛选步骤/方法从候选菌株库选择。
一种或多种筛选方法可以选自如下筛选方法,这些筛选方法筛选特性诸如免疫调节特性、细胞粘附、肠屏障功能的改进、脂肪细胞中脂质积聚的减少、最小抑制浓度(mic)和/或胃肠道存活率(gi存活率)。
优选的筛选方法包括但不限于:
·pbmc筛选,其中从一个或多个供体,诸如两个或超过两个、三个或超过三个、四个或超过四个或者五个或超过五个供体回收外周血单核细胞,并与细菌菌株一起孵育给定时间段,此后通过分析该孵育对细胞因子产生水平的影响来确定菌株的免疫调节特征,细胞因子例如干扰素γ(ifnγ);白介素10(il10);il12;il13;il17;il1b;il2;il4;il5;il6;il8;脂质运载蛋白;单核细胞趋化蛋白1(mcp-1):骨桥蛋白和tnfα。
·teer测定(如b.srinivasen等人(2015).jlabautom[实验室自动化杂志]2015,20:107-126中所述的跨上皮电阻),该测定在添加或不添加具有生物学活性的促炎症因子诸如促炎症细胞因子或脂多糖(lps)的情况下进行。
·树突细胞(dc)测定,其中通过如下方法使从一个或多个供体,诸如两个或超过两个、三个或超过三个、四个或超过四个或者五个或超过五个供体回收的dc成熟为炎症dc:与促炎症刺激物诸如细胞因子、lps、tnfα、ifnγ一起孵育,然后与乳杆菌属菌株一起孵育给定时间段,并测量细胞因子。在一个优选的实施例中,也可将dc与乳杆菌属菌株一起预孵育,随后添加促炎症刺激物。具有改进代谢健康,诸如减轻糖尿病前期的能力的乳杆菌属菌株与不具有此特性的菌株相比,应该降低il12水平,并且抗炎症细胞因子的水平(或抗炎症/促炎症细胞因子之间的比率)应该较高。
·脂肪细胞测定(如zhang等人2016,scientificreports[科学报告]6,36083所述),其中3t3-l1细胞历时10天分化为成熟的脂肪细胞,在特定时间与乳杆菌属菌株共孵育给定时间段,且使用细胞内积聚脂质的油红o染色来测量脂质形成以及通过qpcr测量脂肪形成相关基因和促炎症标志物基因的基因表达。
·l细胞测定,其中将含有10%胎牛血清和1%青霉素(penicillin)/链霉素(streptomycin)的生长培养基中的人l细胞系nci-h716在37℃/5%co2下的孵育箱中接种(传代12-20次)在24孔板中的预包被板上(200.000个细胞/孔),且使其分化48小时,然后用含有牛血清白蛋白(bsa,0.2%)的克雷布斯林格缓冲液(krebsringerbuffer)洗涤两次,最后与经稀释上清液或培养基对照共孵育2h,以在37℃/5%co2下的孵育箱中进行胰高血糖素样肽1(glp-1)释放测定。每个测试包括佛波醇12-肉豆蔻酸酯13-乙酸酯(10μm)和tritonx-100(0.2%)分别作为glp-1阳性对照和用于获得glp-1的总释放。所有测试样品均含有25μm二肽基肽酶-4抑制剂。孵育后,将所有上清液移出并保存在-20℃下直到分析glp-1为止。分析细胞的活力。使用活性glp-1elisa试剂盒分析上清液的glp-1。
·胆汁盐水解酶测定,其中将乳杆菌属菌株在37℃下在存在如下胆汁盐下在mrs培养基(deman,rogosa和sharpe)中孵育24h:甘氨胆酸盐、牛磺胆酸盐、甘氨鹅去氧胆酸盐、牛磺鹅去氧胆酸盐、甘氨去氧胆酸盐和牛磺去氧胆酸盐。胆汁盐分别以如下浓度存在:1,56mg/ml、0,56mg/ml、1,51mg/ml、0,54mg/ml、1,51mg/ml和0,33mg/ml。使用在不存在任何细菌下含有胆汁盐的参考物。孵育后,通过离心收获上清液。用乙酸甲醇萃取样品,并在反相(rp)液相色谱质谱(lcms)上进行高质量分辨率分析。建立该方法以定量所有上述六种胆汁盐。根据式cbs[%]=100[%]-(a*100[%]/b)计算以百分比表示的缀合胆汁盐(cbs)的转化率。a为在存在细菌下孵育24h后胆汁盐的量,而b为在不存在任何细菌下孵育24h后胆汁盐的量。cbs值越高,转化得到的胆汁盐越多。
·mic测定:mic测定(如关于动物饲料中使用并于2017年5月获得公众咨询认可的添加剂或产物或物质的efsa小组所述),其中乳杆菌属和对照菌株在存在经连续稀释的不同抗生素下生长并分配。对3个不同重复实验计算每种抗生素的断点。另外,使用resfinder分析进行了菌株基因组中可转移抗性基因的不存在的研究(zanktari等人,2012,j.antimicrob.chemotherapy[抗微生物化学疗法杂志],pmid22782487)。
在一个优选的实施例中,本发明的乳杆菌属菌株在包含选自以下的至少一种筛选方法的筛选方案中选择:pbmc筛选、teer测定、dc测定、脂肪细胞测定、mic测定、l细胞测定和胆汁盐水解酶测定。
在另一个优选的实施例中,本发明的乳杆菌属菌株在包含选自以下的至少两种筛选方法的筛选方案中选择:pbmc筛选、teer测定、dc测定、脂肪细胞测定、mic测定、l细胞测定和胆汁盐水解酶测定。
在另一个优选的实施例中,本发明的乳杆菌属菌株在包括以下步骤的筛选方案中选择:pbmc筛选、teer测定、dc测定、l细胞测定和胆汁盐水解酶测定;
·其中在pbmc测定中,il10/il12比率高于10,例如在pbmc测定中在使用来自至少3位健康供者的pbmc计算为均值形式时高于20、高于30或高于50;
·其中乳杆菌属菌株能够以至少1.15的倍数提高teer测定中的teer比率,其中teer比率以相对于孵育24小时后培养基对照的teer值比0小时后teer值,caco2细胞与乳杆菌属菌株一起孵育24小时后的teer值与0小时后的teer值的商的形式计算;
·其中乳杆菌属菌株能够使由促炎症混合物刺激的dc测定中的il12水平与促炎症刺激的对照相比降低至少10%,例如至少20%;以及
·其中这些菌株在胆汁盐和l细胞测定中的表现至少与菌株hh05在相同水平上。
在特别优选的实施例中,本发明的乳杆菌属菌株在包括以下步骤的筛选方案中选择:pbmc筛选、teer测定、dc测定和l细胞测定。
在一个实施例中,用于本发明的teer测定在添加或不添加具有生物学活性的促炎症因子诸如促炎症细胞因子或lps的情况下进行。在另一个实施例中,用于本发明的teer测定在添加具有生物学活性的促炎症因子诸如促炎症细胞因子或lps的情况下进行。在替代性实施例中,用于本发明的teer测定在不添加具有生物学活性的促炎症因子诸如促炎症细胞因子或脂多糖(lps)的情况下进行。在另一替代性实施例中,在筛选方案中使用两种teer测定,其中一种teer测定在不添加具有生物学活性的促炎症因子诸如促炎症细胞因子或lps的情况下进行,并且另一种teer测定在添加具有生物学活性的促炎症因子诸如促炎症细胞因子或lps的情况下进行。在一个实施例中,在添加具有生物学活性的促炎症因子的情况下进行的teer测定为使用促炎症细胞因子的teer测定。
组合物
本发明进一步涉及包含本发明的一种或多种乳杆菌属菌株的组合物。组合物包含至少103个活细胞/克组合物,优选至少104、105、106、107、108、109、1010、1011、1012或1013个活细胞/克组合物。在优选的实施例中,组合物包含106-1014个活细胞/克组合物,优选107-1013个活细胞/克组合物。
可以将一种或多种乳杆菌属菌株干燥,诸如冷冻干燥或喷雾干燥。当将微生物干燥,诸如冷冻干燥时,重要的是使用确保令人满意的高活细胞数的方法,并保留所选菌株的活性。此类技术在本领域中是已知的,并且本领域中已知的这些方法也可适用于本发明。
经干燥,诸如冷冻干燥的制剂可以含有本身已知的合适佐剂,例如冷冻保护剂,诸如营养糖、麦芽糖或益生元(例如,低聚半乳糖)。优选使用没有或具有低能量值或具有非常低的血糖指数的冷冻保护剂。
组合物可以进一步包含制备食品和食品补充剂的领域中已知的其他成分,例如选自填充剂、营养素、防腐剂、稳定剂、调味剂和着色剂。
组合物可以为粉末、糊剂或凝胶的形式,并填充到小袋、片剂或胶囊中。为了易于施用,优选将组合物配制成离散剂型,诸如小袋、片剂或胶囊。
组合物可以为食品补充剂,或者为食品或食品组合物的形式。替代性地,组合物可以为药物组合物的形式。在一方面,组合物为包含一种或多种乳杆菌属菌株且任选包含一种或多种可接受的赋形剂的食品、食品组合物或食品补充剂。在另一方面,组合物为包含一种或多种乳杆菌属菌株和一种或多种药学上可接受的赋形剂的药物组合物。在一方面,将药物组合物与药物诸如像二甲双胍(metformin)一起施用。在另一个实施例中,药物组合物进一步包含药物诸如像二甲双胍。
当本发明的制剂为食品补充剂的形式时,其可以为单独施用的形式,诸如胶囊、片剂、粉末或类似形式,该形式优选含有单位剂量的微生物,含有107-1013个细胞/剂,最优选1010-1011个细胞/剂。
食品补充剂也可以为粉末形式或类似形式,将该形式添加到合适食品(组合物)或合适液体或固体载体中或与之混合,以制备准备用于食用的食品。
例如,食品补充剂可以为冻干粉末的形式,该形式可以使用合适液体,诸如水、口服补液溶液、奶、果汁或类似可饮用液体来重构。食品补充剂也可以为粉末形式,将该形式与固体食品或具有高水含量的食品,诸如发酵奶产品,例如酸奶混合。
本发明的组合物也可以为准备用于食用的食品形式。此种食品可以例如通过以下方法制备:将上述本发明的补充剂添加到本身已知的食品或食品基质中;以施用所要的量将微生物(单独或以混合物形式)添加到本身已知的食品或食品基质中;或者在食品培养基中培养所要细菌,直到获得含有施用所要的细菌量的食品。食品培养基优选使得其已经形成食品的一部分或将在发酵后形成食品的一部分。
在此方面,食品或食品基质可以为发酵或非发酵的。
本发明的组合物可以为用于口服食用的食品,例如全食品或婴儿配方食品。
组合物可以进一步含有益生元化合物,特别是在发酵时产生丁酸酯/丁酸或丙酸酯/丙酸的纤维;含有氨基酸的大量营养素,诸如蛋白质;以及特定维生素、矿物质和/或微量元素。关于后者,并且如由实例可以看出,增加或适量高的量的维生素a、k、b12、生物素、mg、cr和zn的存在可能是有利的,叶酸和ω3脂肪酸的存在也是。
食品补充剂可以进一步包含纤维,例如至少0,5g纤维/100g总制剂的量。
作为纤维,制剂优选含有抗性淀粉或另一种丁酸酯产生剂,以及合适的丙酸酯产生剂,诸如树胶或大豆多糖,其量如上所示。短链脂肪酸,诸如丁酸和丙酸,也可以原样使用,优选以适当的包封形式使用,或以其生理等效物诸如丙酸钠形式使用,其量为至少0,1g/100g总组合物。
还可以包括例如酵母提取物形式的氨基酸/肽、维生素、矿物质和微量元素。
组合物,特别是在组合物为全食品形式时,还可以含有肽和/或蛋白质,特别是富含谷氨酸盐和谷氨酰胺的蛋白质;脂质;碳水化合物;维生素;矿物质和微量元素。优选使用对应于0,6-3g谷氨酰胺/100g产物的量的谷氨酰胺/谷氨酸盐前体,以及具有高谷氨酰胺含量的小多肽。替代性地,可以添加富含谷氨酰胺的蛋白质,诸如奶蛋白、小麦蛋白或其水解物。
本发明的组合物可以为无乳糖,清真,素食和/或犹太洁食组合物。
用途
优选以107-1013个细胞/天,优选1010-1011个细胞/天的量各自施用本发明的一种或多种乳杆菌属菌株或包含本发明的一种或多种乳杆菌属菌株的组合物。对于成人以及儿童两者,细胞均可以以单一给药施用,或者细胞可以每天分为2次或最多10次剂量。
将组合物口服施用,典型地与饮食一起。
应该每天施用本发明的一种或多种乳杆菌属菌株或组合物,只要接受其的个体对其具有需要,或者只要接受其的个体希望与本发明的乳杆菌属菌株的特性相适应,例如只要个体希望停止、减少或限制因摄取过丰富饮食而引起的重量增加,和/或改进其餐后血糖反应和/或减轻其胰岛素抵抗。
术语“胰岛素抵抗”是细胞将葡萄糖(糖)从血流转运到细胞中时,对胰岛素作用的反应能力降低。胰岛素抵抗可以例如通过口服葡萄糖耐量测试和/或葡萄糖刺激的胰岛素分泌或通过测量空腹胰岛素和血糖来测量。
术语“减轻胰岛素抵抗”用于描述已接受一种或多种乳杆菌属菌株的受试者的胰岛素抵抗与未接受乳杆菌属菌株的同一受试者的胰岛素抵抗相比的结果。
因此,在一个优选的实施例中,每天施用本发明的一种或多种乳杆菌属菌株或组合物持续非指定时间段,其原则上可以持续数年。
本发明的乳杆菌属菌株对胃肠道具有积极影响。为此目的,包含一种或多种乳杆菌属菌株的组合物可以进一步含有本身已知的健康改进化合物,诸如药物等。特别地,组合物可以含有对胃肠道具有有益影响的化合物,诸如谷氨酰胺/谷氨酸盐或其前体。
本发明的一种或多种乳杆菌属菌株或组合物可以用于减轻哺乳动物受试者的糖尿病前期,减轻或改进2型糖尿病,改进胰岛素抵抗,改进肝脏健康,减少肠炎症,改进肠屏障功能,降低血糖水平和/或预防或减少因高脂肪饮食引起的重量增加。
术语“肝脏健康”在本文中用于通过如下方法评价肝脏状态(已用乳杆菌属菌株治疗者与未治疗疾病或健康对照相比):评定肝脏组织中细胞因子、甘油三酸酯、胆固醇和/或与肝脏相关酶alt和/或akt的表达,和/或测量血浆、血清和/或血液样品中的肝脏相关酶alt和/或akt,和/或测量肝脏重量,和/或基于肝脏组织的组织学检查评价肝脏状态。
术语“肠炎症”在本文中用于在肠中产生炎症因子如促炎症细胞因子时和/或肠屏障功能破坏引起肠漏时的情况。可以通过测量肠样品和/或血浆样品中的细胞因子浓度和/或通过测量血浆中的lps来评定肠炎症和肠漏。
术语“肠屏障”在本文中用于肠粘膜确保在肠内充分容纳不期望的腔内物质,同时保持吸收营养素的能力。肠屏障功能可以通过测量跨越肠上皮细胞层的teer进行体外评定,并通过测量血浆样品中的lps水平和/或通过体内磺酸测定进行体内评定。
术语“血糖水平”在本文中用于血液中葡萄糖的浓度,如例如通过基于酶的测定进行测量。身体将血糖浓度维持在狭窄范围内。此严格调节称为葡萄糖稳态。降低血糖的胰岛素或增强胰岛素分泌的glp-1为参与血糖调节的最熟知激素之一。
本发明的一种或多种乳杆菌属菌株或组合物可以用于改进个体的代谢健康,诸如减轻糖尿病前期和/或2型糖尿病。在本发明的一方面中,一种或多种乳杆菌属菌株或组合物用于改进或减轻诸如以下的一种或多种糖尿病前期和/或2型糖尿病症状,例如胰岛素抵抗、高血糖、低度炎症和/或肠屏障功能。在另一方面或在另一个方面,一种或多种乳杆菌属菌株或组合物用于改进受试者的餐后血糖反应,和/或减轻受试者的胰岛素抵抗。在又另一方面或在另一个方面,一种或多种乳杆菌属菌株或组合物用于预防或减少结肠炎。在仍另一方面或在另一个方面,一种或多种乳杆菌属菌株或组合物用于减少摄取高脂肪和/或高糖的个体的重量增加。在本发明的一个特定方面,一种或多种乳杆菌属菌株或组合物用于改进或减轻选自由以下组成的组的两种或超过两种糖尿病前期和/或2型糖尿病症状:胰岛素抵抗、高血糖、低度炎症和肠屏障功能。在本发明的另一个特定方面,一种或多种乳杆菌属菌株或组合物用于改进或减轻选自由以下组成的组的三种或超过三种糖尿病前期和/或2型糖尿病症状:胰岛素抵抗、高血糖、低度炎症和肠屏障功能。在本发明的又另一个特定方面,一种或多种乳杆菌属菌株或组合物用于改进或减轻如下糖尿病前期和/或2型糖尿病症状:胰岛素抵抗、高血糖、低度炎症和肠屏障功能。
优选的实施例
本发明还可以通过以下带编号的实施例来描述:
实施例1.一种乳杆菌属菌株,该乳杆菌属菌株具有改进代谢健康,诸如减轻糖尿病前期的能力,或具有降低哺乳动物受试者的血糖水平的能力。
实施例2.根据实施例1所述的乳杆菌属菌株,其中该菌株具有减轻糖尿病前期的能力。
实施例3.根据实施例1或2所述的乳杆菌属菌株,其中该菌株具有改进或减轻选自由以下组成的组的一种或多种糖尿病前期症状的能力:胰岛素抵抗、高血糖、低度炎症和肠屏障功能。
实施例4.根据前述实施例中任一项所述的乳杆菌属菌株,其中该菌株具有预防和/或减轻2型糖尿病的能力。
实施例5.根据前述实施例中任一项所述的乳杆菌属菌株,其中该菌株具有预防和/或减轻选自由以下组成的组的一种或多种2型糖尿病症状的能力:胰岛素抵抗、高血糖、低度炎症和肠屏障功能。
实施例6.根据前述实施例中任一项所述的乳杆菌属菌株,其中该菌株具有改进受试者的餐后血糖反应和/或减轻受试者的胰岛素抵抗的能力。
实施例7.根据前述实施例中任一项所述的乳杆菌属菌株,其中该菌株在胃肠(gi)道中存活。
实施例8.根据前述实施例中任一项所述的乳杆菌属菌株,其中该菌株在包含选自以下的至少一种筛选方法的筛选方案中选择:pbmc筛选、teer测定、dc测定、脂肪细胞测定、l细胞测定、胆汁盐水解酶测定和mic测定。
实施例9.根据前述实施例中任一项所述的乳杆菌属菌株,其中该菌株在包含选自以下的至少两种筛选方法的筛选方案中选择:pbmc筛选、teer测定、dc测定、脂肪细胞测定、l细胞测定、胆汁盐水解酶测定和mic测定。
实施例10.根据前述实施例中任一项所述的乳杆菌属菌株,其中该菌株在包含如下方法的筛选方案中选择:pbmc筛选、teer测定、在添加促炎症细胞因子的情况下进行的teer测定和dc测定。
实施例11.根据前述实施例中任一项所述的乳杆菌属菌株,其中在pbmc测定中,il10/il12比率高于10,例如使用来自至少3位健康供者的pbmc计算为均值形式的情况下高于20,例如高于30,例如高于50。
实施例12.根据前述实施例中任一项所述的乳杆菌属菌株,其中该菌株能够以至少1.15的倍数提高teer测定中的teer比率,其中该teer比率以相对于孵育24小时后培养基对照的teer值比0小时后teer值,这些pbmc与该乳杆菌属菌株一起孵育24小时后的teer值与0小时后的teer值的商的形式计算。
实施例13.根据前述实施例中任一项所述的乳杆菌属菌株,其中该菌株能够使由促炎症混合物刺激的dc测定中的il12水平与促炎症刺激的对照相比降低至少10%,优选至少20%。
实施例14.根据前述实施例中任一项所述的乳杆菌属菌株,该乳杆菌属菌株为罗伊氏乳杆菌属菌株或短乳杆菌(lactobacillusbrevis)菌株或属于干酪乳杆菌群。
实施例15.根据前述实施例中任一项所述的乳杆菌属菌株,该乳杆菌属菌株为罗伊氏乳杆菌属菌株或属于干酪乳杆菌群。
实施例16.根据前述实施例中任一项所述的乳杆菌属菌株,该乳杆菌属菌株为罗伊氏乳杆菌属菌株、干酪乳杆菌属菌株、副干酪乳杆菌属菌株和/或鼠李糖乳杆菌属菌株。
实施例17.根据实施例14或15所述的乳杆菌属菌株,其中该乳杆菌属菌株为干酪乳杆菌群,并且选自干酪乳杆菌、副干酪乳杆菌和鼠李糖乳杆菌。
实施例18.根据实施例17所述的副干酪乳杆菌属菌株,该副干酪乳杆菌属菌株选自副干酪乳杆菌坚韧亚种和副干酪乳杆菌副干酪亚种菌株。
实施例19.根据前述实施例中任一项所述的乳杆菌属菌株,其中该菌株选自以如下保藏的菌株及其突变体:dsm17648、dsm32910、dsm32911、dsm32851和dsm32853。
实施例20.根据实施例19所述的乳杆菌属菌株,其中这些突变体来源于自然进化。
实施例21.根据实施例19所述的乳杆菌属菌株,其中这些突变体包含对以dsm17648、dsm32910、dsm32911、dsm32851或dsm32853保藏的乳杆菌属菌株的1至50个氨基酸取代、缺失和/或添加,诸如1至40、1至30、1至20或1至10个氨基酸取代、缺失和/或添加。
实施例22.一种组合物,该组合物包含一种或多种根据实施例1-21中任一项所述的乳杆菌属菌株。
实施例23.根据实施例22所述的组合物,该组合物包含两种或超过两种根据实施例1至21中任一项所述的乳杆菌属菌株,诸如三种或超过三种、四种或超过四种或者五种或超过五种根据实施例1至21中任一项所述的乳杆菌属菌株。
实施例24.根据实施例22至23中任一项所述的组合物,其中该组合物包含以dsm17648保藏的乳杆菌属菌株和选自以dsm32910、dsm32911、dsm32851和dsm32853保藏的菌株的一种或多种乳杆菌属菌株。
实施例25.根据实施例22至23中任一项所述的组合物,其中该组合物包含以dsm32910保藏的乳杆菌属菌株和选自以dsm17648、dsm32911、dsm32851和dsm32853保藏的菌株的一种或多种乳杆菌属菌株。
实施例26.根据实施例22至23中任一项所述的组合物,其中该组合物包含以dsm32911保藏的乳杆菌属菌株和选自以dsm17648、dsm32910、dsm32851和dsm32853保藏的菌株的一种或多种乳杆菌属菌株。
实施例27.根据实施例22至23中任一项所述的组合物,其中该组合物包含以dsm32851保藏的乳杆菌属菌株和选自以dsm17648、dsm32910、dsm32911和dsm32853保藏的菌株的一种或多种乳杆菌属菌株。
实施例28.根据实施例22至23中任一项所述的组合物,其中该组合物包含以dsm32853保藏的乳杆菌属菌株和选自以dsm17648、dsm32910、dsm32911和dsm32851保藏的菌株的一种或多种乳杆菌属菌株。
实施例29.根据实施例22至28所述的组合物,该组合物包含至多五种根据实施例1至21中任一项所述的乳杆菌属菌株,诸如至多四种、三种或两种根据实施例1至21中任一项所述的乳杆菌属菌株。
实施例30.根据实施例22至29中任一项所述的组合物,其中该组合物进一步包含来自不同物种的微生物菌株。
实施例31.根据实施例30所述的组合物,其中该进一步包含的微生物菌株选自鼠李糖乳杆菌属菌株和属于阿克曼菌属(akkermansia)物种的菌株。
实施例32.根据实施例22至31中任一项所述的组合物,其中该组合物进一步包含其细胞组分、代谢物和/或分泌的分子。
实施例33.根据实施例32所述的组合物,其中这些细胞组分、代谢物和/或分泌的分子来自发酵和离心后培养物的滞留物。
实施例34.根据实施例22至33中任一项所述的组合物,其中这些菌株经干燥,诸如冷冻干燥或喷雾干燥。
实施例35.根据实施例22至33中任一项所述的组合物,其中这些菌株经冷冻干燥。
实施例36.根据实施例22至35中任一项所述的组合物,其中该组合物包含106-1014个菌落形成单位(cfu)/克该组合物,优选包含107-1013,优选108-1012cfu/克。
实施例37.根据实施例22至36中任一项所述的组合物,其中将该组合物配制成单位剂量配制品,这些单位剂量配制品各自包含106-1014个菌落形成单位(cfu)/个单位,优选107-1013,优选108-1012cfu/个单位。
实施例38.根据实施例22至37中任一项所述的组合物,其中该组合物包含106与1014个之间,诸如106与1013个之间的细胞、108与1012个之间的细胞或109与1011个之间的细胞,其中总数指活细胞和死细胞的总量。
实施例39.根据实施例22至37中任一项所述的组合物,其中该组合物包含106与1014个之间,诸如106与1013个之间的细胞、108与1012个之间的细胞或109与1011个之间的细胞,其中总数指活细胞的总量。
实施例40.根据实施例22至37中任一项所述的组合物,其中该组合物包含106与1014个之间,诸如106与1013个之间的细胞、108与1012个之间的细胞或109与1011个之间的细胞,其中总数指死细胞的总量。
实施例41.根据实施例22至40中任一项所述的组合物,其中该组合物为包含乳杆菌属菌株和一种或多种药学上可接受的赋形剂的药物组合物。
实施例42.根据实施例22至40中任一项所述的组合物,其中该组合物为食品、食品补充剂或食品组合物。
实施例43.根据实施例42所述的组合物,该组合物包含一种或多种可接受的赋形剂。
实施例44.根据实施例42至43中任一项所述的组合物,其中该组合物准备用于食用。
实施例45.根据实施例42至44中任一项所述的组合物,该组合物包含其他食品补充剂。
实施例46.根据实施例45所述的组合物,其中这些其他食品补充剂选自一种或多种益生元、酶、维生素和矿物质。
实施例47.根据实施例22至46中任一项所述的组合物,其中该组合物进一步包含其细胞组分、代谢物和/或分泌的分子。
实施例48.一种饮食补充剂,该饮食补充剂包含一种或多种根据实施例1至21中任一项所述的乳杆菌属菌株。
实施例49.根据实施例48所述的饮食补充剂,该饮食补充剂进一步包含一种或多种叙述(narratively)有益成分,诸如益生元、酶、维生素和/或矿物质。
实施例50.一种或多种根据实施例1至21中任一项所述的乳杆菌属菌株或根据实施例22至47中任一项所述的组合物的用途,其用于改进哺乳动物受试者的代谢健康,诸如减轻糖尿病前期。
实施例51.一种或多种根据实施例1至21中任一项所述的乳杆菌属菌株或根据实施例22至47中任一项所述的组合物的用途,其用于减轻哺乳动物受试者的糖尿病前期,预防或减轻2型糖尿病,减轻胰岛素抵抗,改进肝脏健康,减少肠炎症,改进肠屏障功能,降低血糖水平和/或预防或减少因高脂肪饮食引起的重量增加。
实施例52.根据实施例50或51所述的用途,其中该用途用于减轻哺乳动物受试者的糖尿病前期,预防或减轻2型糖尿病,减轻胰岛素抵抗,改进肝脏健康,减少肠炎症和/或改进肠屏障功能。
实施例53.根据实施例50至52中任一项所述的用途,其中该用途用于减轻哺乳动物受试者的胰岛素抵抗,改进肝脏健康,减少肠炎症和/或改进肠屏障功能。
实施例54.一种或多种根据实施例1至21中任一项所述的乳杆菌属菌株或根据实施例22至47中任一项所述的组合物的用途,其用于降低哺乳动物受试者的血糖水平。
实施例55.一种或多种根据实施例1至21中任一项所述的乳杆菌属菌株或根据实施例22至47中任一项所述的组合物的用途,其用于预防或减少高脂肪饮食的个体的重量增加。
实施例56.根据实施例50至55中任一项所述的用途,其中该哺乳动物为人。
实施例57.根据实施例50至56中任一项所述的用途,其中每天向该哺乳动物受试者施用106-1014个菌落形成单位(cfu),优选107-1013,优选108-1012。
实施例58.一种用于筛选根据实施例1至21中任一项所述的乳杆菌属菌株的方法,该方法使用包含选自以下的至少一种筛选方法的筛选方案:pbmc筛选、teer测定、dc测定、脂肪细胞测定、l细胞测定、胆汁盐水解酶测定和mic测定。
实施例59.根据实施例58所述的方法,该方法使用包含选自以下的至少两种筛选方法的筛选方案:pbmc筛选、teer测定、dc测定和脂肪细胞测定。
实施例60.根据实施例58或59所述的方法,该方法使用包含如下筛选方法的筛选方案:pbmc筛选、teer测定、在添加促炎症细胞因子的情况下进行的teer测定和dc测定。
实施例61.根据实施例58至60中任一项所述的方法,该方法使用包含如下筛选方法的筛选方案:pbmc筛选、teer测定、dc测定和l细胞测定。
实例
材料与方法
使用标准培养基培养乳杆菌属、肠球菌属(enterococcus)、微球菌属(micrococcus)和双歧杆菌属(bifidobacterium)菌株,例如,每升提供15-20g蛋白胨或胰蛋白胨和每升约5克酵母提取物的培养基。为制备培养基,施加标准程序(组分浓缩、灭菌、接种),并使微生物在升高的温度(例如,35-42℃)下生长足够时间(例如,8-48小时)。
实例1.合适乳杆菌属菌株的筛选
使用下述筛选方案,发现了对代谢健康具有有益影响,诸如减轻糖尿病前期的乳杆菌属菌株。
1.预筛选:通过分析作为pbmc筛选测定中菌株的免疫调节潜能的指标的il10/il12比率筛选了640个乳杆菌:
对于外周血单核细胞(pbmc)测定,将来自一位供体的pbmc在适应环境24小时后与乳杆菌属菌株在不存在其他促炎症刺激物下共孵育24小时。孵育后,根据制造商的说明书,通过luminex测定(英杰公司(invitrogen))和/或elisa测量含有细胞因子的上清液的适当稀释物,并确定il10/il12比率。
在预筛选中选择了il10/il12比率>3的180个菌株。
2.筛选免疫调节和肠完整性
使在预筛选中选择的180个菌株进行与预筛选相同的pbmc确认筛选,但对来自三位不同供体的pbmc测试了这些菌株,以证实有益il10/il12比率。除il10/il12比率外,还测量了14种其他细胞因子。
在不添加任何促炎症刺激物例如tnfα的情况下,进一步对菌株进行teer评定(跨上皮电阻)(如b.srinivasen等人(2015).jlabautom[实验室自动化杂志]2015,20:107-126中所述),以评价乳杆菌属菌株对肠完整性的影响。在0和24小时后进行teer测量。
选择pbmc确认筛选确认il10/il12比率>3,并且使teer值增加的20个菌株用于后续筛选方法。
3.在存在促炎症触发物下进行命中确认
在此确认步骤中,还对步骤2中不存在tnfα下进行的teer评定中选择的20个菌株进行添加tnfα下的teer评定。
选择与没有菌株的对照相比引起teer值增加的乳杆菌属菌株。
在dc测定中进一步筛选这些菌株。对于此测试,dc由来源于3位供体的pbmc产生。通过用0.1μg/mllps+50ng/mltnf-α+20ng/mlifnγ处理使dc成熟为炎症dc,并孵育4小时。将成熟dc的等分试样与每种乳杆菌属菌株以4种不同剂量一起孵育,之后使用luminex确定细胞因子水平。
选择与没有菌株的对照组合物相比降低il12诱导的乳杆菌属菌株。
hh01
物种:罗伊氏乳杆菌
由16s和wgs确认
保藏号:dsm17648。
hh02
物种:罗伊氏乳杆菌
由16s和wgs确认
保藏号:dsm32910。
hh03
物种:鼠李糖乳杆菌
由16s和wgs确认
保藏号:dsm32911
hh04
物种:副干酪乳杆菌坚韧亚种
由16s和wgs确认
保藏号:dsm32851
hh05
物种:副干酪乳杆菌副干酪亚种
由16s和wgs确认
保藏号:dsm32853
实例2.pbmc中细胞因子的诱导
进一步体外表征实例1中选择的菌株hh01-hh05。
将从健康供体分离的1x106个pbmc/ml与媒介物或包含1x106个乳杆菌属菌株hh01-hh05/ml的媒介物一起孵育24小时,总体积为1ml。根据制造商的说明书,使用luminex测量细胞因子il10、il12、mcp-1和骨桥蛋白。使用不含mgcl2的磷酸盐缓冲生理盐水(pbs)ph7,4(目录号10010-023,吉博科公司(gibco))作为媒介物。
结果:
与媒介物对照相比,菌株hh01-hh05诱导增加的il10/il12比率,从而确认所选菌株具有抗炎症特性(图1)。
图2显示了用促炎症刺激物脂多糖(lps)刺激的pbmc上清液中mcp-1的含量。结果显示,仅用媒介物的情况下可见mcp-1大量产生,而菌株hh01-hh05则显著降低了mcp-1诱导,从而支持了这些菌株的抗炎症特性。
图3显示用促炎症刺激物(脂多糖)刺激的pbmc上清液中骨桥蛋白的含量。结果显示,仅用赋形剂的情况下可见骨桥蛋白的大量产生,而菌株hh01-hh05则显著降低了骨桥蛋白诱导,从而确认了这些菌株的抗炎症特性。
实例3.树突细胞中细胞因子的诱导
在第一组测定中,从来自3位健康供体的pbmc回收树突细胞(dc),并将等分试样与媒介物或包含乳杆菌属菌株hh01、hh03或hh05的媒介物一起孵育24小时。离心混合物,收集上清液,并根据制造商的说明书使用luminex(英杰公司(invitrogen))测量mcp-1、骨桥蛋白和il12p70。
在第二组测定中,从来自12位健康供体的pbmc回收dc,并将等分试样与媒介物或包含乳杆菌属菌株hh02、hh04或hh05的媒介物一起孵育24小时。离心混合物,收集上清液,并根据制造商的说明书使用luminex(英杰公司(invitrogen))测量il10、il12p70、mcp-1。
结果:
在第一组dc测定中,结果显示与菌株hh01和菌株hh05相比,当dc与乳杆菌属菌株hh03共孵育时,促炎症细胞因子mcp-1、il12和骨桥蛋白的浓度最低(图4)。
在第二组dc测定中,结果显示,与仅用低度炎症混合物刺激的对照相比,用低度炎症混合物刺激的乳杆菌属菌株hh01、hh04和hh05均诱导增加的il10/il12p70比率。另外,由低级别炎症混合物刺激的dc产生mcp-1,但与混合物对照相比降低,确认了所选菌株具有抗炎症特性。
实例4.dc培养物中细胞因子的诱导
将实例1中选择的菌株hh02、hh04和hh05在与dc的共孵育测定中进一步表征。在用促炎症混合物刺激后测量所选的细胞因子。
从血沉棕黄层(n=12)分离人pbmc,并通过阳性选择(cd14微珠,美天旎生物技术公司(miltenyibiotech))纯化cd14+单核细胞。将单核细胞与il4(20ng/ml)和gm-csf(20ng/ml)一起培养6天,以分化为未成熟的dc(imdc)。为了分化成成熟的dc,将1x105个细胞与所选乳杆菌属菌株hh02(106个乳杆菌属菌株/ml)和由tnfα(10ng/ml)、ifnγ(10ng/ml)和lps(100ng/ml)组成的低度炎症混合物一起培养。用乳杆菌属菌株刺激imdc4小时,然后添加低度炎症混合物再持续16小时。在用bd细胞计数珠阵列(bdcytometricbeadarray;cba)进行体外刺激后评价dc成熟以测量dc产生的il10、il12p70、mcp-1和il6。将菌株hh02、hh04、hh05对这些细胞因子的作用与仅用促炎症混合物刺激的不含菌株的对照比较。
结果
结果显示,由低度炎症混合物刺激的dc产生il10,并且与仅由混合物刺激相比,菌株hh02、hh04和hh05的存在均使il10浓度增加,由低度炎症混合物刺激的dc产生il12p70,并且与仅由混合物刺激相比,菌株hh02、hh04和hh05的存在均使il12p70浓度增加,并且与混合物对照相比,乳杆菌属菌株hh01、hh04和hh05均诱导il10/il12p70比率增加(图5),从而确认所选菌株具有抗炎症特性。
此外,还可见,由低级别炎症混合物刺激的dc产生mcp-1,并且乳杆菌属菌株hh02、hh04和hh05的存在均使培养期间的mcp-1浓度减少(图6)。另外,结果显示,由低度炎症混合物刺激的dc产生高水平的il6,并且乳杆菌属菌株hh04的存在使il6浓度维持在混合物对照的水平下,而菌株hh02和hh05使il6浓度增加(图7)。
实例5.用乳杆菌属菌株hh01-hh05进行teer测定
根据b.srinivasen等人(2015).jlabautom[实验室自动化杂志]2015,20:107-126进行teer测定。对于此测定,使用购自dsmz(德国微生物和细胞培养有限公司(deutschesammlungvonmikroorganismenandzellkulturgmbh))的编号为acc169的caco-2细胞。
接种2x105个caco-2细胞/ml并分化3周。在不存在促炎症刺激下,将这些细胞与媒介物或以1x106个细胞/ml的浓度含有乳杆菌属菌株hh01-hh05的媒介物一起孵育24h,然后确定teer比率。使用不含mgcl2的磷酸盐缓冲生理盐水ph7,4(目录号10010-023,吉博科公司)作为媒介物。teer比率>1指示乳杆菌属菌株能够增强肠屏障功能完整性。
在存在100ng/mltnfα的形式的促炎症刺激物下,将caco-2细胞与媒介物或含有乳杆菌属菌株hh01-hh05的媒介物一起孵育24h,然后确定teer比率。使用不含mgcl2的pbsph7,4(目录号10010-023,吉博科公司)作为媒介物。teer比率>1指示乳杆菌属菌株能够增强肠屏障功能。
结果:
teer数据显示,乳杆菌属菌株hh04和菌株hh03在不存在(图8a)或存在(图8b)促炎症因子下均最能增强肠道上皮屏障。在存在促炎症因子下,与单独的疾病对照(具有促炎症因子的培养基)相比,菌株hh01、hh02和hh05也能够提高teer。
实例6.teer测定
在存在炎症混合物下乳杆菌属菌株hh02、hh04和hh05对上皮细胞系caco2屏障完整性的影响:
使用以与“实例5.teer测定”中所述相同的方式进行的teerevom2测定,确定在存在炎症混合物下乳杆菌属菌株hh02、hh04和hh05对上皮细胞系caco2屏障完整性的影响,其中进行以下修改。共孵育开始时,在基底侧添加含有tnfα-alpha(100ng/ml)和infγ-gamma(10ng/ml)的炎症混合物。
结果:
结果显示,炎症混合物降低teer比率,这是caco2屏障完整性减弱的指示。由经测试菌株hh02、hh04和hh05弥补此作用,其中最强烈的是由hh04弥补(图9)。
储存一个月后的teer增强能力:
测试含有经冷冻干燥的乳杆菌属菌株hh02或hh04的配制产品在-20℃、4℃、25℃和40℃下储存一个月后的teer增强能力。使用以与“实例5.teer测定”中所述相同的方式进行的teerevom2测定,确定在存在配制产品下配制产品对上皮细胞系caco2屏障完整性的影响,其中进行以下修改。将含有为接种的caco2细胞五倍的乳杆菌属菌株(感染复数(moi)为500)的量的配制产品溶解在顶端培养基中的500μl培养基中。
结果:
结果显示,在储存温度-20℃、4℃和25℃下,hh02和hh04的配制产品的teer增强能力稳定至少1个月(图10)。对于在40℃下储存超过一个月的产品,可见较低的teer活性。
在存在/不存在果糖或葡萄糖下乳杆菌属菌株hh02和hh04对上皮细胞系caco2屏障完整性的影响:
使用以与“实例5.teer测定”中所述相同的方式进行的teercellzscope测定,确定乳杆菌属菌株hh02和hh04对上皮细胞系caco2屏障完整性的影响,其中进行以下修改。在顶侧添加单独的培养基或含有7mm果糖的培养基。在基底侧,添加单独的培养基或含有7mm葡萄糖的培养基。
结果:
结果显示,hh02最小程度地增加teer,其中不同浓度几乎没有影响。与在基底侧上存在标准培养基下测试菌株的情况相比,基底侧上存在高浓度葡萄糖使得hh04较快速地增加teer。此结果表明与健康个体中的效果相比,hh04在具有高血糖值的受试者中的效果提高。与单独的培养基相比,在顶侧存在高果糖浓度的情况下,使用hh04也观察到teer更快地增加。此结果表明,与空腹受试者中的效果相比,肠道中具有高果糖负荷的受试者中的效果提高(图11)。
实例7.胆汁盐的转化
将菌株hh01、hh02、hh04和hh05在37℃下在存在如下胆汁盐下在mrs培养基(deman,rogosa和sharpe)中孵育24小时:甘氨胆酸盐、牛磺胆酸盐、甘氨鹅去氧胆酸盐、牛磺鹅去氧胆酸盐、甘氨去氧胆酸盐和牛磺去氧胆酸盐。胆汁盐分别以如下浓度存在:1,56mg/ml、0,56mg/ml、1,51mg/ml、0,54mg/ml、1,51mg/ml和0,33mg/ml。使用在不存在任何细菌下含有胆汁盐的参考物。孵育后,通过离心收获上清液。用乙酸甲醇萃取样品,并在反相(rp)液相色谱质谱(lcms)上进行高质量分辨率分析。建立该方法以定量所有上述六种胆汁盐。根据式cbs[%]=100[%]-(a*100[%]/b)计算以百分比表示的缀合胆汁盐(cbs)的转化率。a为在存在细菌下孵育24h后胆汁盐的量,而b为在不存在任何细菌下孵育24h后胆汁盐的量。cbs值越高,转化得到的胆汁盐越多。
结果如图12中所示,并且显示菌株hh01和hh02能够部分转化所有胆汁盐,从而指示减少脂肪吸收的作用,而菌株hh04和hh05能够部分转化牛磺去氧胆酸盐,从而指示对代谢具有积极作用。
实例8.用于测量乳杆菌刺激的胰高血糖素样肽1(glp-1)释放的l细胞测定
如gagnon和brubaker(2015)nci-h716cells[nci-h716细胞].第221-228页,verhoeckxk.等人(编)theimpactoffoodbioactivesonhealth[食品生物活性成分对健康的影响].springer,cham[卡姆市斯普林格公司]中所述进行l细胞测定。使人l细胞系nci-h716在含有10%胎牛血清和1%青霉素/链霉素的rpmi-1640(罗斯威尔公园纪念学院(roswellparkmemorialinstitute))培养基中生长。将细胞(传代12-20次)接种在24孔板(200.000个细胞/孔)中,并使其分化48小时。将24孔板用0.5gmatrigel/孔预包被,然后进行细胞接种。
对于胰高血糖素样肽1(glp-1)释放测定,将含有人l细胞的板用含有牛血清白蛋白(bsa,0.2%)的克雷布斯林格缓冲液洗涤两次,然后添加来自hh02和hh04的乳杆菌属上清液的经稀释样品或培养基对照以在37℃/5%co2下的孵育箱中2小时。每个测试中包括佛波醇12-肉豆蔻酸酯13-乙酸酯(pma)(10μm)和tritonx-100(0.2%)分别作为glp-1阳性对照和用于获得glp-1的总释放。所有测试样品均含有25μm抑二肽素a(西格玛-奥德里奇公司(sigma-aldrich)),一种二肽基肽酶-4抑制剂。孵育后,将所有上清液移出并保存在-20℃下直到分析glp-1为止。使用prestoblue活力染色(英杰公司(invitrogen))分析细胞的活力。使用活性glp-1elisa试剂盒(eglp-35k,密理博-默克公司(millipore-merck))分析上清液的glp-1。在不存在菌株下,包括用于乳杆菌属培养的肉汤(酵母右旋糖琼脂肉汤(yda))和用于对照细菌表皮葡萄球菌(staphylococcusepidermidis)atcc35984(s.e)培养的肉汤(含葡萄糖的培养基17(gm17))作为额外对照。
结果:
结果显示,如果将菌株hh02和hh04的无细胞肉汤稀释10倍,则会刺激l细胞释放glp-1。这些菌株的无细胞肉汤的释放高于稀释10倍的yda培养基对照。如果将无细胞生长肉汤以50倍稀释进行测试,则未观察到高于背景水平的释放(图13)。从菌株hh02和hh04获得的无细胞肉汤在孵育2小时期间不影响nci-h716的活力,证明glp-1释放不是由于l细胞激增(图14)。
实例9.使用小鼠模型在实验性结肠炎中用乳杆菌属进行预防性处理
在此研究中,使用了三硝基苯磺酸(tnbs)诱发性急性结肠炎模型(foligne等人,2007doi:10.3748/wjg.v13.i2.236)。通过单次直肠内施用tnbs在小鼠中诱发结肠炎,之后观察小鼠2天。将实例1中描述的乳杆菌属菌株hh01-hh05用于此研究
研究计划
将7组15只balb/c小鼠用于实验。在第-19天将小鼠转移到笼中以使其适应环境,并自由获取饲料和无菌水。
在第-5天至第1天,如以下方案中所指定,小鼠各自接受含有媒介物、乳杆菌属菌株的100μl口服管饲。使用不含mgcl2的pbsph7,4(目录号10010-023,吉博科公司)作为媒介物。
在第0天,分别在tnbs和tnbs+乳杆菌属菌株组中的小鼠各自接受含100mg/kg2,4,6-tnbs的乙醇的直肠内施用,从而诱发结肠炎。
在第2天处死小鼠。
取样
第-6天至第2天监测临床体征:
·体重(参见图15)
·华莱士结肠评分(wallacescoringofcolon)(foligne等人,2007doi:10.3748/wjg.v13.i2.236)。
在研究结束时,确定结肠湿重和结肠长度(参见图16),并收集以下样品:
·尾部采血血浆样品
·直肠速冻样品
·结肠样品(参见图17)
·盲肠内含物样品
·在第-6天和第0天收集的粪便
结果:
经测试菌株显示良好的抗炎症作用,该作用由华莱士评分反映。
如所预期,媒介物对照组未显示任何结肠损伤,而疾病对照组(tnbs组)的平均损伤评分在2与3之间。与tnbs(疾病对照)组相比,接受乳杆菌属菌株hh01-hh05菌株处理的组显示结肠损伤减少,该减少由约1的平均损伤评分反映。
另外,乳杆菌属菌株组中的促炎症细胞因子il12、tnf-α、il1b、il25、il6和il17a以及调节细胞因子il10的水平均低于疾病对照(参见图18),这证实了炎症减轻。因此,该实验显示乳杆菌属菌株能够减轻结肠炎症。
因此,乳杆菌属菌株hh01-hh05改进了总体临床状况。
实例10.饲喂经典高脂肪饮食的饮食诱发性小鼠模型中乳杆菌属菌株的影响
该研究旨在证明在饮食诱发性肥胖(dio)小鼠模型中用两种乳杆菌属菌株测试菌株(hh04和hh05)达成了代谢健康改进,诸如减轻糖尿病前期。研究采用dio的预防方法,其中在接受高脂肪饮食(hfd)的同时通过每天口服管饲来施用菌株持续12周(关于研究概述,参见图21)。
研究概述:
将c57bl/6j小鼠(美国缅因州巴港杰克森实验室(jacksonlab.barharbour,maineusa))招募入4个批次中,每个批次12只小鼠(每组3只小鼠),其中每周开始处理(持续4周)。在实验开始时(第0周),所有小鼠均为8周龄。在实验开始前2周,将小鼠转移到笼中以适应环境。在适应环境期间,小鼠可以自由获取低脂肪饮食(lfd)和水。
实验在第0周开始,此时将小鼠转移至实验饮食,并根据以下方案每天接受总体积为100μl的口服管饲。此实例中使用的乳杆菌属菌株为乳杆菌实例1中描述的菌株hh04和菌株hh05。
高脂肪/蔗糖饮食(hfd)含有45%来自脂肪(87%猪油、13%大豆油)的能量、35%来自碳水化合物(主要为蔗糖和麦芽糊精)的能量、20%来自蛋白质(酪蛋白)的能量(d12451,美国新泽西州研究饮食公司(researchdietinc.,nj,usa))
低脂参考饮食(d12450h,美国新泽西州研究饮食公司(researchdietinc.,nj,usa))含有10%来自脂肪的能量。两种饮食均含有17%来自蔗糖的总质量。
采样与测量
通过在实验方案的第0、4、8和12周的磁共振(mr)扫描(布鲁克公司(bruker),使用时每天校准)的三次测量的均值来评定个别小鼠的身体组成。
在每天管饲前,在光周期开始(9am±1小时)时在mr扫描的同时收集新鲜粪便。将样品立即在干冰上冷冻并储存在-80℃直到进一步处理为止。
每周在8-9am测量体重。
重量发展和身体组成如图22中所示。显示了每组10-12只小鼠的均值:a)随机分配后的重量。b)在开始实验饮食和管饲处理后,个别组的重量发展。c)在所描绘时间点由磁共振扫描获得的脂肪质量(总体重的%)。d)脂肪质量(克),其描绘为具有连接线的组均值。e)在所描绘时间点由磁共振扫描获得的瘦质量(总体重的%)。f)在所描绘时间点由磁共振扫描获得的体液质量(总体重的%)。
在(9am±1小时)将小鼠转移至具有丰荣材料但没有筑巢材料的新洁净笼中。在转移时测量饲料,并且在24h后再次测量,此时将小鼠再转移至洁净的标准笼(包括筑巢材料)中。从垫料仔细收集24h的粪便,并保存在-80℃下直到进一步处理为止。
葡萄糖耐量测试、葡萄糖刺激的胰岛素分泌和肠渗透性测试
在实验方案的第10周进行了口服葡萄糖耐量测试。使小鼠在8am禁食5h,并在10am管饲。在用4μl50%右旋糖溶液/g瘦质量和150μl磺酸溶液口服管饲之前,执行5h禁食血糖测量(onetouchvarioflex,lifescan公司)和从尾静脉的血液取样。磺酸溶液由溶解在150μl0,5%羧甲基纤维素钠盐(cmc)(西格玛公司(sigma))的蒸馏水悬浮液中的1.5mg荧光素-5(6)-磺酸(英杰公司(invitrogen))组成。在右旋糖激发后的时间点0、15、30、60、90和120min时测量来自尾静脉穿刺的血糖,并且在激发后的时间点0、15、30、60和120min时将用于胰岛素和肠渗透性的血液样品置于经乙二胺四乙酸(edta)处理的毛细管(莎斯特公司(sarstedt))中。
在该程序后小鼠接受0.5ml生理盐水(hospira公司)以使小鼠补液。将血液样品在4℃下以1000rcf离心10min。为进行胰岛素测量,将前5μl血浆转移至干冰上的96孔pcr板中并保持在-80℃下直到下游处理为止。将用于肠渗透性测试的下一个5μl血浆转移至黑色96孔光学按钮板(能肯公司(nunc)),并保持在湿冰上直到添加150μl含0,5%cmc的蒸馏水并充分混合为止。在synergyht微板读取器(美国伯腾仪器有限公司(biotek))上在激发/发射485/528nm波长下读板。
按照制造商的方案,通过小鼠超灵敏胰岛素elisa(博奥派克公司(alpco))测量胰岛素水平,并在enspire2300多标记读数器(珀金埃尔默公司(perkinelmer))上定量。
乳杆菌属菌株对葡萄糖调节和肠渗透性的作用如图23中所示:a)hfd饲喂和每天管饲处理10周后的5h禁食血糖。条形图表示每组10-12只小鼠的均值。b)hfd饲喂和每天管饲处理10周后的5h禁食胰岛素水平。条形图表示每组10-12只小鼠的均值。c、e)hfd饲喂和每天管饲处理10周后,5h禁食小鼠中的口服葡萄糖耐量测试。c描绘了激发(2μg/g瘦质量)期间的血糖水平,并且e描绘了对葡萄糖激发的内源胰岛素反应的血浆水平。每组10-12只小鼠的均值。d)ogtt第10周的曲线下面积。条形图表示每组10-12只小鼠的均值。f)gsis第10周的曲线下面积。条形图表示每组10-12只小鼠的均值。g)hfd饲喂和每天管饲处理10周后,5h禁食小鼠中口服激发(150μl/只小鼠,浓度:10mg/ml)后的血浆磺酸荧光单位。每组10-12只小鼠的均值。h)hfd饲喂和每天管饲处理12周期间每只小鼠的累积饲料摄取。由于共同圈养,故摄取为每个笼每只小鼠的均值,其中每组中n=4。条形图表示均值。a-g)在口服激发前3小时,用相应的处理管饲所有小鼠。
尸检
尸检在实验方案的第12周进行。从7am开始将小鼠禁食,并在10am管饲。以交替的顺序进行安乐死,每个笼取一只小鼠。批次1的安乐死从组b开始,然后c等。批次2从组c开始,并且对于其余批次依次类推,分别从组d和a开始。用异氟烷(费森尤斯卡比公司(freseniuskabi))将小鼠麻醉。使用涂有edta(西格玛-奥德里奇公司(sigma-aldrich))的25g针头和1ml注射器进行心脏穿刺。将血液转移至含有1μl二肽基肽酶-iv(dpp-iv)抑制剂(密理博公司(millipore))和1μl蛋白酶抑制剂混合物(西格玛公司(sigma))的eppendorf管中。将样品以1000rcf离心10min,并将血浆一式三份等分,置于干冰上并转移至-80℃储存直到进一步处理为止。
组织收获
测量肝脏、胰腺、附睾白色脂肪组织(ewat)、腹股沟白色脂肪组织(iwat)、腹膜后白色脂肪组织(rpwat)、间充质白色脂肪组织(mwat)、心脏、四头肌、腓肠肌、脑和结肠的重量,将组织立即在液氮中冷冻,并储存在-80℃下。由同一个操作者解剖组织,并以相同的顺序对所有小鼠取组织。死后将脑在液氮中冷冻<60sec。
乳杆菌属菌株对组织重量的作用如图24所示,其中条形图表示每组10-12只小鼠的均值:a)每天管饲12周后尸检时的肝脏重量。b)每天管饲12周后,尸检时的结肠长度。条形图显示每组10-12只小鼠的均值。c)每天管饲12周后,尸检时iwat的重量。d)每天管饲12周后,尸检时ewat的重量;并且在图25中,其中条形图表示每天管饲12周后,尸检时每组10-12只小鼠的均值。a)rpwat的重量。b)mwat的重量。c)脑的重量。d)心脏的重量。
测量小肠(从胃到盲肠)和结肠(从盲肠到直肠)的长度并在整个处理时间保持在通过下方的湿冰降温的plexiglas板上。十二指肠被认为是小肠的前5cm,剩余的小肠组织被分成相等长度的3部分。丢弃前3cm,将小肠近端2/3的剩余部分分类为空肠。将小肠的远端1/3的前3cm丢弃,将剩余的组织分类为回肠。在清空肠组织之前,将十二指肠、空肠、回肠和结肠的最近端的cm保存于卡诺氏溶液(carnoy'ssolution)中用于组织学(以保持粘膜层完整性)。
通过机械压力分离小肠、盲肠和结肠的内容物,在干冰上冷冻,随后在-80℃下储存。将来自十二指肠、空肠、回肠、结肠和盲肠的组织在液氮中快速冷冻并储存在-80℃下。在批次1中,将来自肝脏、胰腺、ewat、iwat、rpwat、mwat、心脏、四头肌和腓肠肌的组织学用组织在4%多聚甲醛溶液中保存72小时,然后在70%乙醇中保存。在批次2-4中,将来自肝脏、ewat、iwat和mwat的组织学用组织在4%多聚甲醛溶液中保存72小时,然后在70%乙醇中保存。对于所有批次,将肝脏组织另外保存在o.c.t化合物(sakurafinetek公司)中以实现组织学油红o脂质染色。
血浆生化分析
乳杆菌属菌株对肝脏损伤和脂质水平的血浆生物标志物的作用如图26中所示,其中条形图表示每组10-12只小鼠的均值:a)丙氨酸氨基转移酶(alt),b)天冬氨酸氨基转移酶(ast),c.1)甘油三酸酯,包括所有数据点,c.2)如c.1,但在评价所用测定的检测限后不包括两个数据点。d)总胆固醇。这些分析由拉瓦尔大学心脏和肺部研究所的医学生物化学部门(medicalbiochemistrydepartmentatuniversitélaval,heartandlunginstitute)根据当地开发的程序进行,这些程序符合处理和分析人类和动物样品的最高标准。
乳杆菌属菌株对其他血浆标志物的作用如图27中所示,其中条形图表示每组10-12只小鼠的均值:a)血清淀粉样蛋白a(saa),b)脂联素,c)非酯化脂肪酸(nefa),d)按照elisa试剂盒制造商的方案进行lps测量。
肝脏脂质积聚
通过在保持冷冻下用研钵和研棒对组织进行冷冻研磨在液氮中将每只小鼠的肝脏均质化,并转移到新管中。从50mg粉末状组织提取脂质。乳杆菌属菌株对肝脏脂质积聚的作用通过量热测定进行测量,并如图28中所示,其中条形图表示每组10-12只小鼠的均值:a)甘油三酸酯和b)胆固醇。
肠细胞因子定量
按照制造商的说明书,使用bio-plex200luminex系统在均质化的结肠组织中测量细胞因子水平。乳杆菌属菌株对结肠中细胞因子水平的作用如图29中所示:a)干扰素-γ(ifny)和b)il-10,其中条形图表示每组10-12只小鼠的均值。
肠微生物群分析
从冰冻的粪便样品提取细菌dna,并使用illuminamiseq平台对高变v3-v416srrna区进行扩增和测序。
对序列数据进行预处理,标签鉴别和修剪,合并成对末端的读段,以4的质量分截短,并要求至少100bp重叠,其中合并的读段长度在300与600bp长度之间。将序列严格去重,丢弃少于5个序列的簇。通过使用最丰富的严格去重读段作为质心并根据内部比较丢弃可疑的嵌合体,将序列以97%序列相似性聚类。使用核糖体数据库项目(ribosomaldatabaseproject)中的数据库进行otu的分类学分配。
使用用特异于hh04或hh05菌株的引物进行的定量pcr来定量存在于来自肠内含物的样品中的益生菌dna的量。以任意单位表示的相对量如图30中所示,其中条形图指示每组10-12个样品的均值,其中:a)来自指示组的粪便样品中的hh04含量,b)小肠内含物中的hh04量,c)粪便样品中的hh05,以及d)小肠样品中的hh05。
益生菌对肠微生物群组成的作用如图30中所示,其中e)为粪便微生物群组成的加权unifrac距离的主坐标分析(pcoa),其中大点指示每组的均值,并且小点指示个别样品。f)如e,但为小肠内含物的微生物群组成。
结果-重量发展
所有组中的体重分布类似,然后在第0周,在hfd实验组中,从lfd适应饮食改为hfd。从第6周开始且继续地,与组b相比,组c中用hh04每天口服管饲显著降低了使用高脂肪饮食的重量增加。用hh05管饲的组d现在确实对体重增加表现出相同的作用。在整个研究阶段期间,从第2周开始,使用低脂肪饮食的组a的重量增加显著低于组b。
这些组之间在第0周的脂肪质量没有差异。在第4、8和12周,与组b相比,用hh04管饲使组c中使用高脂肪饮食的脂肪百分比较低。结果表明,较低的重量增加由较低的脂肪质量增加引起。与组b相比,组a在第4、8和12周类似地显示脂肪百分比显著较低。在整个研究阶段期间的任何时间点,组d与组b的脂肪百分比未表现出差异。与组b相比,组a在第4、8和12周,并且组c在第8周和第12周的绝对脂肪克数显著较低。在所有测量时间点,组d与组b具有类似绝对脂肪质量。
在第0周,这些组之间的瘦质量(总体重的百分比)相等。与组b相比,组c和组a的瘦质量百分比在第4、8和12周显著增加。这些结果进一步支持较低的重量增加为较低的脂肪质量增加所特有。这些结果支持如下结论:hh04对身体组成具有显著影响,并且每天施用此菌株可以减少脂肪含量。
结果-乳杆菌属菌株对葡萄糖调节和肠渗透性的作用。
与对照组b相比,组a和组c中的5h空腹血糖显著较低。与组b相比,在a和组c中的5h空腹后胰岛素水平显著较低。与组b相比,组d的空腹血糖或胰岛素水平未显示差异。
在整个口服葡萄糖耐量测试中,组a的血糖水平均低于组b。葡萄糖激发后30、60和90min,组c表现出血糖水平低于组b,此表明其葡萄糖耐量较佳。口服葡萄糖耐量测试的曲线下面积类似地表明,组a和组c中的葡萄糖耐量总体上改进。组d既未在口服葡萄糖测试期间显示血糖值改进,又未显示较低的曲线下面积。
与组b相比,组c在葡萄糖激发后前15min具有较低的葡萄糖刺激的胰岛素分泌,这表明口服管饲hh04后胰岛素敏感性改进。相反地,与组b相比,组a在口服葡萄糖激发后的胰岛素水平未显示统计学差异。在测试的前一小时,在葡萄糖激发后,组a分泌的胰岛素少于组b,而组d在整个测试中与组b没有差异。口服葡萄糖耐量测试期间胰岛素水平的曲线下面积显示组a和组b之间存在显著差异,其余组则没有差异。
结果-乳杆菌属菌株对组织重量的作用
组a和组c与组b相比肝脏重量分别较低。
与组b相比,组a和组c中的iwat质量,即皮下脂肪贮存较低,而组d没有差异。
与组b相比,组a和组c中的mwat质量,即内脏脂肪贮存显著较低。组b和组d之间未观察到差异。
在这些组中的任一个之间,与饮食或乳杆菌属菌株施用无关,脑和心脏的重量没有差异。
结果-乳杆菌属菌株对血脂和肝脏健康生物标志物的作用
与疾病对照组b相比,用hh04处理的组c中丙氨酸氨基转移酶(alt)(一种常用肝脏损伤生物标志物)较少。
与alt水平相比,这些组之间的天冬氨酸氨基转移酶(ast)(一种替代性肝病生物标志物)变化较少,但与疾病对照组b相比,趋向于由hh04(组c)降低。
这些组之间的循环甘油三酸酯水平没有差异。
与健康对照相比,疾病对照中的总循环胆固醇水平提高(组b和组c),并且通过hh04或hh05处理降低(组c和组d)。
结果-乳杆菌属菌株对肝脏脂质积聚的作用
如与组a相比,组b中发现的脂质水平增加中所观察,肝脏组织中甘油三酸酯和胆固醇的积聚是肥胖和非酒精性脂肪肝疾病(nafld)的指标。与组b相比,组c中的甘油三酸酯和胆固醇水平均降低,而组d具有类似脂质积聚。
结果-乳杆菌属菌株对肠炎症的作用
与组a相比,组b中的经典促炎症细胞因子干扰素γ(ifny)增加。与组b相比,组c中的ifny水平降低。与组a相比,组b中的抗炎症细胞因子il-10增加。
结果-乳杆菌属菌株对肠微生物群组成的作用
hh04dna仅在用此乳杆菌属菌株处理的小鼠中发现,并且在粪便和小肠样品中的量类似。在媒介物对照和hh04处理的小鼠的粪便样品中发现少量hh05dna,但在用hh05处理的小鼠中则丰富得多。在小肠内含物中,仅在用此乳杆菌属菌株处理的小鼠中发现了hh05。总体粪便微生物群组成极大地受饮食影响。hh05处理的小鼠的粪便微生物群组成聚类在媒介物处理的hfd饲喂小鼠与lfd饲喂小鼠之间,其中hh04处理的小鼠具有类似于对照的粪便微生物。饮食也极大地影响小肠的微生物群组成,并且hh04和hh05处理的小鼠均经聚类而远离对照,因此具有不同的微生物组成。指示乳杆菌属菌株处理可适度调节肠微生物群组成。
结论
在使用经典的高脂肪饮食时,乳杆菌属菌株hh04降低了体重和脂肪质量的增加,同时增加了瘦质量的百分比。另外,与高脂肪对照相比,hh04降低了5h空腹血糖和胰岛素水平,并增加了葡萄糖耐量和胰岛素敏感性。乳杆菌属菌株hh04还降低了皮下脂肪贮存iwat和内脏脂肪贮存mwat的质量以及肝脏脂质积聚,并使肠炎症朝向较抗炎症特征转变。
与经典的高脂肪饮食组合时,hh05降低了循环中的胆固醇水平,并改变了肠微生物群。
实例11饲喂改良高脂肪饮食的饮食诱发性小鼠模型中乳杆菌属菌株的影响
该研究旨在证明在使用经设计以诱发类似于人肥胖表型的炎症的改良西方饮食的饮食诱发性肥胖(dio)小鼠模型中用三种乳杆菌属菌株测试菌株(hh02、hh04和hh05)达成了代谢健康,诸如糖尿病前期改进。该研究与实例10中所示的研究相同,除了饮食和添加了乳杆菌属菌株hh02。研究概述如图21中所示。
研究概述:
如实例10所述设计和进行研究,除了随后增加组e和改变饮食以诱发以炎症增强为特征的肥胖表型:
改良西方饮食(hfd)含有43%来自脂肪(乳脂)的能量,42%来自碳水化合物(主要为蔗糖和果糖)的能量,15%来自蛋白质(混合来源)的能量(d12079mod*,德国ssniff特殊饮食公司(ssniff
与改良wd匹配的低脂参考饮食(德国ssniff特殊饮食公司(ssniff
采样与测量:
重量发展和身体组成如图31中所示。显示了每组9-12只小鼠的均值:a)随机分配后且在开始实验饮食和处理前的体重。b)在开始实验饮食和管饲处理后,个别组的重量发展。c)在所描绘时间点由磁共振扫描获得的脂肪质量(总体重的%)。d)脂肪质量(克),其描绘为具有连接线的组均值。e)在所描绘时间点由磁共振扫描获得的瘦质量(克)。f)在所描绘时间点由磁共振扫描获得的体液质量(总体重的%)。
葡萄糖耐量测试和葡萄糖刺激的胰岛素分泌
在实验方案的第10周进行了口服葡萄糖耐量测试。使小鼠在8am禁食5h,并在11am管饲。在用1.5μg右旋糖/g瘦质量口服管饲之前,执行5h禁食血糖测量(onetouchvarioflex,lifescan公司)和从尾静脉的血液取样。在右旋糖激发后的时间点0、15、30、60、90和120min时测量来自尾静脉穿刺的血糖,并且在激发后的时间点0、15、30、60和120min时将用于胰岛素和c肽的血液样品置于经edta处理的毛细管(莎斯特公司(sarstedt))中。在该程序后小鼠接受0.5ml生理盐水(hospira公司)以使小鼠补液。
乳杆菌属菌株对葡萄糖调节和肠渗透性的作用如图32中所示:a)wd饲喂和每天管饲处理10周后的5h禁食血糖。条形图显示每组9-12只小鼠的均值。b)wd饲喂和每天管饲处理10周后的5h禁食胰岛素水平。条形图表示每组9-12只小鼠的均值。c)wd饲喂和每天管饲处理10周后的口服葡萄糖耐量,其显示绝对血糖值。d)如c,但描绘了激发期间血糖相对于基线的变化。e)对葡萄糖耐量测试的内源胰岛素反应的血浆水平。f)葡萄糖耐量测试期间的c肽水平。
尸检和组织收获
尸检在实验方案的12周后进行。从8am开始将小鼠禁食,并在11am管饲。以交替的顺序进行安乐死,取一只小鼠,使用涂有edta(西格玛-奥德里奇公司(sigma-aldrich))的25g针头和1ml注射器进行心脏穿刺。测量重量,将组织立即在液氮中冷冻,并储存在-80℃下。由同一个操作者解剖组织,并以相同的顺序对所有小鼠取组织。
乳杆菌属菌株对组织重量的作用如图33中所示,其中条形图表示每组9-12只小鼠的均值:a)肝脏重量(克)、b)腹股沟白色脂肪组织(iwat)重量、c)腹膜后白色脂肪组织(rpwat)重量、d)间充质白色脂肪组织(mwat)重量、e)肩胛内棕色脂肪组织(bat)重量以及f)腓肠肌(gastroc)重量。
血浆生化分析
乳杆菌属菌株对肝脏损伤的血浆生物标志物和脂质水平的作用如图34中所示,其中条形图表示每组9-12只小鼠的均值。这些分析由拉瓦尔大学心脏和肺部研究所的医学生物化学部门(medicalbiochemistrydepartmentatuniversitélaval,heartandlunginstitute)根据当地开发的程序进行,这些程序符合处理和分析人类和动物样品的最高标准。a)肝脏损伤的丙氨酸氨基转移酶(alt)生物标志物,b)肝脏损伤的天冬氨酸氨基转移酶(ast)生物标志物,c)血浆甘油三酸酯水平,d)血浆总胆固醇水平。
肝脏脂质积聚以及肝脏组织中胰岛素信号传导路径的活化
通过在保持冷冻下用研钵和研棒对组织进行冷冻研磨在液氮中将每只小鼠的肝脏均质化,并转移到新管中。从50mg粉末状组织提取脂质。乳杆菌属菌株对肝脏脂质积聚的作用通过量热测定进行测量,并如图35中所示,其中条形图表示每组9-12只小鼠的均值。a)肝脏组织中甘油三酸酯的总量,和b)肝脏组织中胆固醇的总含量。
通过western印迹使用ps473akt和泛akt抗体(细胞信号传导公司(cellsignaling))定量每组(组a、b、c、e)3-4只胰岛素刺激的小鼠的肝脏组织中磷酸化(活化)akt和总akt的蛋白水平,并使用biorad软件定量。乳杆菌属菌株对akt路径活化中胰岛素刺激敏感性的作用如图35所示:c)以任意单位表示的肝脏组织中活化akt(ps473akt)与总akt蛋白水平的比率。
组织细胞因子定量
按照制造商的说明书,使用bio-plex200luminex系统在均质化的肝脏和结肠组织中测量细胞因子水平。水平如图36中所示,条形图表示每组9-12只小鼠的均值。a)肝脏组织中的肿瘤坏死因子α(tnfa)水平,b)肝脏组织中的干扰素γ(ifny)水平,c)结肠组织中的肿瘤坏死因子α(tnfa)水平,d)结肠组织中的干扰素γ(ifny)水平。
肠微生物群分析
从冰冻的粪便样品提取细菌dna,并使用illuminamiseq平台对高变v3-v416srrna区进行扩增和测序。
对序列数据进行预处理,标签鉴别和修剪,合并成对末端的读段,以4的质量分截短,并要求至少100bp重叠,其中合并的读段长度在300与600bp长度之间。将序列严格去重,丢弃少于5个序列的簇。通过使用最丰富的严格去重读段作为质心并根据内部比较丢弃可疑的嵌合体,将序列以97%序列相似性聚类。使用核糖体数据库项目(ribosomaldatabaseproject)中的数据库进行otu的分类学分配。
乳杆菌属菌株对肠微生物群组成的作用如图37中所示,该图显示粪便微生物群组成的加权unifrac距离的主坐标分析(pcoa),其中大点指示每组的均值,并且小点指示个别样品。
结果-乳杆菌属菌株对重量发展的作用
在研究开始时,在开始通过口服管饲每天处理和实验饮食之前,这些组的体重类似。在研究阶段期间,当饲喂改良wd时,用hh04或hh05处理的组重量增加略少,而用hh02处理的组在研究期间的重量增加较少。
在研究阶段开始时,所有组的脂肪%均类似,并且饲喂改良wd增加了脂肪%。在研究的第4、8和12周期间,用hh04、hh05或hh02处理的组具有略低的脂肪%,而对照组的瘦质量和体液质量没有变化。
结果-乳杆菌属菌株对葡萄糖调节的作用
当向小鼠饲喂改良wd10周且不实施乳杆菌属菌株处理时,禁食5小时后的血糖水平升高。然而,在用hh04处理的小鼠中相应的5h空腹胰岛素水平略微降低,并且在用hh05或hh02处理的小鼠中显著降低,从而指示通过这些处理改进了葡萄糖稳态。
在口服葡萄糖激发期间,用乳杆菌属菌株处理的组中有小的改进,在用hh02处理的组中最明显。在用hh02或hh05处理的小鼠中,相应的葡萄糖刺激的胰岛素分泌(gsis)大大减少,表明胰岛素敏感性改进,而在hh04处理组中则略有减少。c肽水平进一步支持葡萄糖激发期间减少的胰岛素产生,特别是通过菌株hh02和hh05以及来自菌株hh04的一些作用。
结果-乳杆菌属菌株对组织重量的作用
通过饲喂改良wd,肝脏重量大大增加,这通过乳杆菌属菌株hh02、hh04或hh05处理降低。乳杆菌属菌株处理趋向于减少各种白色脂肪组织,这在hh02处理的小鼠中最明显。在用hh04处理的组中,棕色脂肪组织趋向于减少,而通过任何乳杆菌属菌株处理,肌肉质量均没有差异。
结果-乳杆菌属菌株对血脂和肝脏健康生物标志物的作用
通过饲喂改良wd,肝脏损伤标志物alt大大增加。此通过乳杆菌属菌株处理改进,用hh02处理最明显。对另一种肝脏损伤标志物ast也进行了类似观察。在分别用hh05或hh02处理的小鼠中,循环甘油三酸酯和胆固醇的水平降低。通过hh02、hh04或hh05处理,减少了改良wd饲喂的小鼠中观察到的肝脏组织中甘油三酸酯和胆固醇的积聚。在饲喂改良wd的小鼠的肝脏组织中,通过磷酸化的akt与总akt蛋白水平的比率增加观察到的akt路径的活化减少。如通过增加的akt活化所观察,hh04或hh02处理抵消了肝脏中胰岛素抵抗的此指示。
结果-乳杆菌属菌株对肝脏和肠组织中炎症的作用
在不实施乳杆菌属菌株处理的情况下,饲喂改良wd的小鼠的肝脏组织中促炎症细胞因子tnfa和ifny的水平提高。用hh05或hh02处理的小鼠在结肠组织中具有降低的细胞因子水平。
结果-乳杆菌属菌株对肠微生物群组成的作用
总体粪便微生物群组成极大地受饮食影响。hh02、hh04或hh05处理的小鼠的粪便微生物群组成经聚类而与对照分开,但此作用小于lfd与wd对照组的距离。此指示,这些乳杆菌属菌株处理对肠微生物群组成诱导中等作用。
结论
该研究指示,饮食影响乳杆菌属菌株的功效。在向小鼠饲喂促进炎症的改良wd的当前研究中,用hh04处理的小鼠显示对体重和肝脏重量减轻的作用很小,然而,hh04处理的小鼠在葡萄糖耐量测试期间分泌较少的胰岛素,从而指示胰岛素敏感性改进。此由以下进一步支持:血浆中测量的肝脏损伤标志物减少,肝脏脂质和胆固醇积聚减少以及肝脏组织中胰岛素信号传导增强。
用hh05处理大大减少了禁食和葡萄糖刺激的胰岛素,表明胰岛素敏感性改进。另外,hh05处理降低了肝脏重量、肝脏损伤标志物、肝脏的甘油三酸酯和胆固醇水平。hh05处理还降低了循环胆固醇水平,同时减少了结肠炎症。
在研究期间,hh02处理的小鼠显示体重增加降低。在葡萄糖耐量测试期间,用hh02处理的小鼠比对照组更快地恢复其基线血糖,并且空腹和葡萄糖刺激的胰岛素水平大大降低,表明胰岛素敏感性大大改进。除了降低了循环胆固醇和甘油三酸酯的水平,hh02处理还降低了肝脏和间充质脂肪组织重量。肝脏损伤的标志物也大大减少,并与肝脏组织中胰岛素敏感性的增加有关。在结肠组织中,促炎症细胞因子水平降低。
实例12-益生菌作用在两种不同饮食诱发性小鼠模型中的可再现性
该研究旨在证明在使用经典hfd和改良西方饮食的两种不同饮食诱发性肥胖(dio)小鼠模型中三种益生菌测试菌株(hh02、hh04和hh05)改进代谢健康,诸如糖尿病前期的可再现性。该研究与实例10和实例11中所示研究相同,其旨在再现观察到的发现。另外,首次测试了hh02在经典hfd模型中的性能。研究概述如图21中所示。
研究概述:
该研究如实例10和11中所述设计并进行,包括在同时饲喂两种高脂肪饮食中的任一种的小鼠中进行相同的益生菌处理:
高脂肪/蔗糖饮食(hfd)含有45%来自脂肪(87%猪油、13%大豆油)的能量、35%来自碳水化合物(主要为蔗糖和麦芽糊精)的能量、20%来自蛋白质(酪蛋白)的能量(d12451,德国ssniff特殊饮食公司(ssniff
改良西方饮食(改良wd)含有43%来自脂肪(乳脂)的能量,42%来自碳水化合物(主要为蔗糖和果糖)的能量,15%来自蛋白质(混合来源)的能量(d12079mod*,德国ssniff特殊饮食公司(ssniff
与改良wd匹配的低脂参考饮食(德国ssniff特殊饮食公司(ssniff
采样与测量:
重量发展和身体组成如图38中所示。显示了每组8-9只小鼠的均值:a)在研究(a-e)期间,饲喂lf或hfd饮食的组在随机分配后且在开始实验饮食和处理前的体重。b)在研究(a,f-i)期间,饲喂lf或改良wd饮食的组在随机分配后且在开始实验饮食和处理前的体重。c)在开始实验饮食和管饲处理后,饲喂lfd或hfd的个别组(a-e)的重量发展。d)在开始实验饮食和管饲处理后,饲喂lfd或改良wd的个别组(a,f-i)的重量发展。e)饲喂lfd或hfd的组(a-e)在所描绘时间点由磁共振扫描获得的脂肪质量(总体重的%)。e)饲喂lfd或改良wd的组(a,f-i)在所描绘时间点由磁共振扫描获得的脂肪质量(总体重的%)。g)饲喂lfd或hfd的组(a-e)的脂肪质量(克),其描绘为具有连接线的组均值。h)饲喂lfd或改良wd的组(a,f-i)的脂肪质量(克),其描绘为具有连接线的组均值。i)饲喂lfd或hfd的组(a-e)在所描绘时间点由磁共振扫描获得的瘦质量(克)。j)饲喂lfd或改良wd的组(a,f-i)在所描绘时间点由磁共振扫描获得的瘦质量(克)。
葡萄糖耐量测试和葡萄糖刺激的胰岛素分泌
在实验方案的第10周进行了口服葡萄糖耐量测试。使小鼠在8am禁食5h,并在11am管饲。在用1.5μg右旋糖/g瘦质量口服管饲之前,执行5h禁食血糖测量(onetouchvarioflex,lifescan公司)和从尾静脉的血液取样。在右旋糖激发后的时间点0、15、30、60、90和120min时测量来自尾静脉穿刺的血糖,并且在激发后的时间点0、15、30、60和120min时将用于胰岛素和c肽的血液样品置于经edta处理的毛细管(莎斯特公司(sarstedt))中。在该程序后小鼠接受0.5ml生理盐水(hospira公司)以使小鼠补液。
益生菌对葡萄糖调节和肠渗透性的作用如图39中所示:a)hfd饲喂和每天管饲处理10周后的5h禁食血糖。条形图显示每个饲喂lfd或hfd的组(a-e)9-12只小鼠的均值。b)hfd饲喂和每天管饲处理10周后的5h禁食血糖。条形图显示每个饲喂lfd或改良wd的组(a,f-i)9-12只小鼠的均值。c)hfd饲喂和每天管饲处理10周后的5h禁食胰岛素水平。条形图表示每个饲喂lfd或hfd的组(a-e)9-12只小鼠的均值。d)hfd饲喂和每天管饲处理10周后的5h禁食胰岛素水平。条形图表示每个饲喂lfd或改良wd的组(a,f-i)9-12只小鼠的均值。e)hfd饲喂和每天管饲处理10周后的口服葡萄糖耐量,其显示在激发期间在饲喂lfd或hfd的组(a-e)中血糖相对于基线的变化。f)hfd饲喂和每天管饲处理10周后的口服葡萄糖耐量,其显示在激发期间在饲喂lfd或改良wd的组(a,f-i)中血糖相对于基线的变化。g)饲喂lfd或hfd的组(a-e)中对葡萄糖耐量测试的内源胰岛素反应的血浆水平。h)饲喂lfd或改良wd的组(a,f-i)中对葡萄糖耐量测试的内源胰岛素反应的血浆水平。i)饲喂lfd或hfd的组(a-e)中葡萄糖耐量测试的前30min期间的c肽水平。j)饲喂lfd或改良wd的组(a,f-i)中葡萄糖耐量测试的前30min期间的c肽水平。
结果-益生菌对重量发展的作用
在研究开始时,在开始通过口服管饲每天处理和实验饮食之前,这些组的体重类似。在研究期间,饲喂hfd(如实例10)且用hh04处理的组的重量增加较少。饲喂改良wd的组无论采用何种益生菌处理,均未降低重量增加。如在实例10中所观察,饲喂hfd且用hh04处理的组降低了脂肪质量增加。当向小鼠饲喂改良wd时,没有益生菌处理降低脂肪质量的增加。无论饮食如何,益生菌处理均不会影响瘦质量增加。
结果-益生菌对葡萄糖调节的作用
饲喂hfd或改良wd的小鼠在禁食5小时后的血糖水平提高,并且此不受益生菌处理的影响。当向小鼠饲喂hfd时,禁食5小时后的胰岛素水平提高,而另外用hh04处理的小鼠中则降低。饲喂改良wd的小鼠已经表现出空腹胰岛素水平提高。另外用hh05处理的小鼠显著降低了空腹胰岛素水平,其中用hh02处理的小鼠的空腹胰岛素值大大降低。
在饲喂hfd10周后,在口服葡萄糖耐量测试期间,类似于实例10中的发现,用hh04处理的小鼠在测试期间具有降低的血糖值,这显示了改进的葡萄糖耐量。饲喂改良wd的小鼠在葡萄糖耐量测试中的表现较差,但此可通过hh05或hh02处理降低。在饲喂hfd的情况下,在饲喂hh04的小鼠中,与其对照组相比,在测试期间通过胰岛素和c肽水平观察到的葡萄糖刺激的胰岛素分泌减少。当向用hh02处理的小鼠饲喂改良wd时,降低了胰岛素和c肽两者的水平,从而指示这些小鼠的胰岛素敏感性显著改进。饲喂改良wd且用hh05处理的小鼠与对照相比表现出降低的c肽水平。
结论:
不同益生菌菌株的有益作用取决于饲喂小鼠的饮食。在本研究中总体上再现了实例10和实例11中观察到的在使用两种实验饮食下各益生菌菌株对体重和葡萄糖调节的作用。总之,菌株hh04对正常的hfd显示出体重和脂肪质量降低作用,这转化为改进的葡萄糖调节。当向小鼠饲喂促进炎症的改良wd时,菌株hh05显示出不同葡萄糖耐量测试读数的有益作用。当向小鼠饲喂促进炎症的改良wd时,hh02菌株显示出极大的胰岛素抵抗降低,从而改进了葡萄糖调节。
生物材料保藏
以下生物材料已经依据布达佩斯条约(budapesttreaty)的条款保藏于莱布尼茨研究所(leibniz-institut)dsmz(德国布伦瑞克d-38124因霍芬大街7b的德国微生物和细胞培养物保藏中心有限公司(leibniz-institutdsmz-deutschesammlungvonmikroorganismenundzellkulturengmbh,inhoffenstrasse7b,d-38124braunschweig,germany)),并给予以下登录号:
罗伊氏乳杆菌(hh01);登录号:dsm17648;保藏日期:12-10-2005;国家来源:德国。
罗伊氏乳杆菌(hh02);登录号:dsm32910;保藏日期:04-09-2018;国家来源:德国。
鼠李糖乳杆菌(hh03);登录号:dsm32911;保藏日期:04-09-2018;国家来源:德国。
副干酪乳杆菌坚韧亚种(hh04);登录号:dsm32851;保藏日期04-07-2018;国家来源:德国。
副干酪乳杆菌副干酪亚种(hh05);登录号:dsm32853;保藏日期:04-07-2018;国家来源:德国。
这些菌株保藏在如下条件下,该条件确保其被国外专利法决定授权的未定期间可获得使用培养物的权利。该保藏物代表所保藏菌株的基本上纯的培养物。需要按一些国家的国外专利法要求提供保藏物,在这些国家提交该主题申请的副本,或其后续文本。然而应理解,保藏物的可用性不构成将本发明主题用于由政府行为批准的专利权的实践的许可。
- 还没有人留言评论。精彩留言会获得点赞!