用于治疗炎性、纤维化和增生性病状的DGLA和/或15-HETRE的制作方法
优先权要求本申请要求于2018年10月18日提交的美国临时专利申请第62/747,539号的优先权,所述美国临时专利申请的全部内容通过引用并入本文。本申请总体上涉及使用包括dgla和/或15-hetre的组合物治疗炎性、纤维化和增生性病状的方法及其使用方法和组合物。
背景技术:
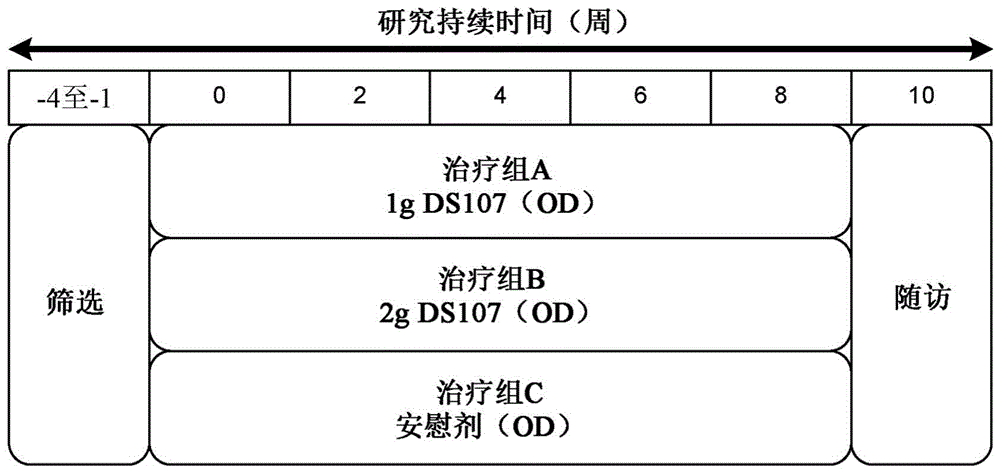
:二高γ亚麻酸(dgla)是作为γ亚麻酸(gla)的延伸产物天然存在于体内的必需脂肪酸。反过来,gla是亚油酸的去饱和产物。dgla的软明胶囊封具有挑战性,因为其易于氧化成醛,醛可以与胶囊壳中的明胶聚合物中的氨基相互作用。由于明胶聚合物的交联,这可能导致药物释放减慢。15(s)-羟基二十碳三烯酸(15s-hetre;15-羟基-8(z),11(z),13(e)-二十碳三烯酸)是γ-亚麻酸的代谢物,据报道是用于调节花生四烯酸(aa)代谢的多不饱和脂肪酸。15s-hetre抑制环氧合酶-2(cox-2)的表达和前列腺素e2(pge2)的合成。技术实现要素:本公开提供了包括dgla或其衍生物和/或15-hetre或其衍生物的可口服递送和/或可局部递送的药物组合物以及使用所述药物组合物来治疗各种病状和病症的方法。一方面,本公开提供了治疗有需要的受试者的肝纤维化和/或非脂肪性肝疾病或病症的方法,所述方法包括向所述受试者施用包括dgla或其衍生物、15-hetre或其衍生物或其组合的药物组合物。在一个实施例中,所述非脂肪性肝疾病或病症选自由以下组成的组:酒精性肝炎、原发性硬化性胆管炎、原发性胆汁性胆管炎、病毒性肝炎、自身免疫性肝炎、医源性诱发性肝损伤和肝静脉闭塞性疾病。在另一个实施例中,所述病毒性肝炎是由乙型肝炎病毒和/或丙型肝炎病毒引起的。在仍又一个实施例中,所述病毒性肝炎是慢性的。在另外的实施例中,所述医源性诱发性肝损伤是药物诱发的肝损伤。在仍另外的实施例中,所述方法进一步包括减少所述有需要的受试者的一种或多种细胞因子和/或趋化因子的量。在又另一个实施例中,所述一种或多种细胞因子和/或趋化因子选自由以下组成的组:转化生长因子α(tgf-α)、转化生长因子β(tgf-β)、表皮生长因子受体(egfr)、血管内皮生长因子亚基a(vegf-a)和酪氨酸蛋白激酶受体ufo(axl)。在仍另一个实施例中,所述一种或多种细胞因子和/或趋化因子是tgf-β和axl。在仍另一个实施例中,所述非脂肪性肝疾病是酒精性肝炎和/或病毒性肝炎。在另外的实施例中,所述一种或多种细胞因子和/或趋化因子是tgf-β和egfr。在又另外的实施例中,所述非脂肪性肝疾病是原发性硬化性胆管炎和/或原发性胆汁性胆管炎。在仍另外的实施例中,所述一种或多种细胞因子和/或趋化因子是tgf-β。在另外的实施例中,所述非脂肪性肝疾病是自身免疫性肝炎和/或医源性诱发性肝损伤。在又另一个另外的实施例中,所述一种或多种细胞因子和/或趋化因子是tgf-β和vegf-a。在仍又另一个另外的实施例中,所述非脂肪性肝疾病是肝静脉闭塞性疾病。另一方面,本公开提供了治疗有需要的受试者的眼部疾病或病症的方法,所述方法包括向所述受试者施用包括dgla或其衍生物、15-hetre或其衍生物或其组合的药物组合物。在另一个实施例中,所述眼部疾病或病症选自由以下组成的组:角膜浑浊、青光眼、年龄相关性黄斑变性和白内障。在仍另外的实施例中,所述方法进一步包括减少所述有需要的受试者的一种或多种细胞因子和/或趋化因子的量。在又另一个实施例中,所述一种或多种细胞因子和/或趋化因子是tgf-β和/或vegf-a。在又另一方面,本公开提供了治疗有需要的受试者的结缔组织疾病或病症的方法,所述方法包括向所述受试者施用包括dgla或其衍生物、15-hetre或其衍生物或其组合的药物组合物。在又另一个实施例中,所述方法进一步包括减少所述有需要的受试者的tgf-β的量。在又另一个实施例中,所述结缔组织疾病或病症选自由以下组成的组:马凡氏综合症(marfan'ssyndrome)、洛伊斯-迪茨综合症(loeys-dietzsyndrome)和血管性埃勒斯-丹洛斯氏综合症(vascularehlers-danlossyndrome)。在另外的方面,本公开提供了治疗有需要的受试者的阿尔茨海默氏病(alzheimer'sdisease)的方法,所述方法包括向所述受试者口服施用包括dgla或其衍生物、15-hetre或其衍生物或其组合的药物组合物。在另外的方面,本公开提供了治疗有需要的受试者的佩罗尼氏病(peyronie'sdisease)的方法,所述方法包括向所述受试者施用包括dgla或其衍生物、15-hetre或其衍生物或其组合的药物组合物。在又另一个实施例中,所述方法进一步包括减少所述有需要的受试者的tgf-β的量。在仍另外的方面,本公开提供了治疗有需要的受试者的癌症的方法,所述方法包括向所述受试者施用包括dgla或其衍生物、15-hetre或其衍生物或其组合的药物组合物。在仍又另一个实施例中,所述癌症选自由以下组成的组:肾细胞癌、肝细胞癌、胆管癌、乳腺癌和皮肤鳞状细胞癌。在又另一个实施例中,所述方法进一步包括减少所述有需要的受试者的tgf-β和/或egfr的量。在又另一个实施例中,所述方法进一步包括减少所述有需要的受试者的tgf-β和/或egfr的量。在又另外的方面,本公开提供了治疗有需要的受试者的与t细胞活化相关和/或由cd40介导的疾病、病症或病状的方法,所述方法包括向所述受试者施用包括dgla或其衍生物、15-hetre或其衍生物或其组合的药物组合物。在一个实施例中,所述与t细胞活化相关和/或由cd40介导的疾病、病症或病状选自由以下组成的组:多发性硬化症、炎性肠病、血液系统恶性肿瘤、乳腺癌和免疫抑制。在另一个实施例中,所述炎性肠病是克罗恩病(crohn'sdisease)或溃疡性结肠炎。在仍又另一个实施例中,所述血液系统恶性肿瘤选自由以下组成的组:霍奇金氏淋巴瘤(hodgkin'slymphoma)、非霍奇金氏淋巴瘤(non-hodgkin'slymphoma)、b细胞淋巴瘤、淋巴细胞性白血病、多发性骨髓瘤和急性髓性白血病。在仍另外的实施例中,所述免疫抑制进一步与器官移植相关。在又另一个实施例中,所述方法进一步包括减少所述有需要的受试者的一种或多种细胞因子和/或趋化因子的量。在仍另一个实施例中,所述一种或多种细胞因子和/或趋化因子选自由以下组成的组:白介素15受体α(il-15ra)、白介素2(il-2)、白介素2受体β(il-2rβ)、白介素7(il-7)、趋化因子配体25(ccl-25)、分化簇6(cd6)、信号传导淋巴细胞活化分子家族成员1(slamf1)、分化簇224(cd244)和活化白细胞粘附分子(alcam)。在又另一个实施例中,t细胞活化进一步包括选自由th1t细胞、th17t细胞和th2t细胞组成的组的t细胞的一种或多种亚型的活化。在另外的实施例中,所述t细胞亚型是th1t细胞,并且所述一种或多种细胞因子和/或趋化因子选自由以下组成的组:趋化因子配体16(ccl-16)、趋化因子配体3(ccl-3)、趋化因子c-x-c基序配体9(cxcl-9)、白介素18(il-18)、白介素18受体1(il-18r1)、白介素18结合蛋白(il-18bp)、趋化因子配体4(ccl-4)和趋化因子配体3(ccl-3)。在又另外的实施例中,所述t细胞亚型是th17t细胞,并且所述一种或多种细胞因子和/或趋化因子选自由以下组成的组:肽酶抑制剂3(pi3)、含cub结构域蛋白1(cdcp1)、白介素17α(il-17α)、白介素17d(il-17d)、白介素17β(il-17β)、白介素12β(il-12β)、白介素17受体α(il-17rα)、白介素20(il-20)、趋化因子c-x-c基序配体1(cxcl1)和白介素12(il-12)。在仍另外的实施例中,所述t细胞亚型是th2t细胞,并且所述一种或多种细胞因子和/或趋化因子选自由以下组成的组:白介素5受体α(il-5rα)、白介素10(il-10)、白介素10受体β(il-10rβ)和白介素13(il-13)。在另外的实施例中,所述t细胞亚型是th2t细胞,并且所述一种或多种细胞因子和/或趋化因子进一步选自由以下组成的组:趋化因子配体11(ccl-11)、趋化因子配体23(ccl-23)、趋化因子配体24(ccl-24)、趋化因子配体28(ccl-28)、白介素24(il-24)和vegf-a。在仍又另外的方面,本公开提供了诱导有需要的受试者的免疫抑制的方法,所述方法包括向所述受试者施用包括dgla或其衍生物、15-hetre或其衍生物或其组合的药物组合物。在一个实施例中,受试者已经接受肾移植物或将接受肾移植物。在甚至另外的方面,本公开提供了治疗有需要的受试者的硬皮病的方法,所述方法包括向所述受试者施用包括dgla或其衍生物、15-hetre或其衍生物或其组合的药物组合物。在一个实施例中,所述药物组合物包括15-hetre或其衍生物或者dgla或其衍生物。在一个实施例中,所述方法包含减少所述有需要的受试者的一种或多种细胞因子和/或趋化因子的量。在一个实施例中,所述一种或多种细胞因子和/或趋化因子选自由以下组成的组:tgf-β、egfr、vegf-a、pdgf和axl。在又另外的方面,本公开提供了治疗有需要的受试者的纤维化疾病或病症的方法,所述方法包括向所述受试者施用包括dgla或其衍生物、15-hetre或其衍生物或其组合的药物组合物。在一个实施例中,所述纤维化疾病或病症选自由以下组成的组:系统性纤维化、肾纤维化、肺纤维化、皮肤纤维化、骨髓纤维化和心脏纤维化。在一个实施例中,系统性纤维化是辐射纤维化。在一个实施例中,系统性纤维化是辐射纤维化。在一个实施例中,肾纤维化是肾小球疾病、肾小管间质性疾病、医源性肾病和/或肾缺血。在一个实施例中,肾小球疾病包含但不限于局灶性节段性肾小球硬化症、iga肾病、新月体性肾小球肾炎、狼疮性肾炎和糖尿病性肾病。在一个实施例中,肺纤维化是间质性肺疾病。在一个实施例中,肺纤维化进一步包括特发性肺纤维化、硬皮病、辐射纤维化、医源性、结节病、混合性结缔组织疾病、多肌炎、皮肌炎和/或系统性红斑狼疮。在一个实施例中,皮肤纤维化进一步包括硬皮病、系统性硬化症、肾源性纤维化皮肤病、混合性结缔组织疾病、硬化性粘液水肿、硬肿病、嗜酸性筋膜炎和/或医源性纤维化。在一个实施例中,所述方法包含减少所述有需要的受试者的一种或多种细胞因子和/或趋化因子的量。在一个实施例中,所述一种或多种细胞因子和/或趋化因子选自由以下组成的组:tgf-β、pdgf、egfr、vegf-a和/或axl。在一个实施例中,所述一种或多种细胞因子和/或趋化因子是tgf-β和pdgf。在一个实施例中,所述一种或多种细胞因子和/或趋化因子是tgf-β、pdgf、vegf-a和egfr。在一个实施例中,所述一种或多种细胞因子和/或趋化因子是tgf-β、pdgf和vegf-a。在一个实施例中,所述一种或多种细胞因子和/或趋化因子是tgf-β。在一个实施例中,所述组合物以足以提供每天至多约8gdgla或其衍生物的量施用于所述受试者。在一个实施例中,所述组合物以足以提供每天约4g到约8gdgla或其衍生物的量施用于所述受试者。在一个实施例中,所述组合物以足以提供每天至多约8g15-hetre或其衍生物的量施用于所述受试者。在一个实施例中,所述组合物以足以提供每天约4g到约8g15-hetre或其衍生物的量施用于所述受试者。在一个实施例中,所述组合物以足以提供每天至多约8gdgla或其衍生物和每天至多约8g15-hetre或其衍生物的量施用于所述受试者。在一个实施例中,所述组合物以足以提供每天约4g到约8gdgla或其衍生物和每天约4g到约8g15-hetre或其衍生物的量施用于所述受试者。在一个实施例中,所述组合物以足以提供每天约500mg到约4g15-hetre或其衍生物和每天约500mg到约4gdgla或其衍生物的量施用于所述受试者。在一个实施例中,所述组合物以每天1到8个胶囊施用。在一个实施例中,所述组合物以每天1到4个胶囊施用。在一个实施例中,所述组合物以每天4到8个胶囊施用。在一个实施例中,每个胶囊包括约200mg到约1gdgla或其衍生物和/或15-hetre或其衍生物。在一个实施例中,所述组合物施用于所述受试者,持续至少约1周、至少约2周、至少约4周、至少约6周、至少约8周或至少约10周的时间段。在一个实施例中,所述组合物未被囊封。在一个实施例中,所述组合物通过口服施用或通过局部施用进行施用。下面进一步详细描述了本发明的这些和其它实施例。附图说明参考以下附图,可以更好地理解本公开的许多方面。附图中的组件不一定是按比例的。而是将重点放在清楚地展示本公开的原理。图1是实例2中描述的研究及其持续时间的示意图。图2a-2c是示出了在施用药物1g、药物2g或安慰剂之后,两种剂量(1g或2g)下的ds107(药物)或安慰剂对受试者的生物标志物的表达的影响的热图的部分。图3示出了展示在向受试者施用药物1g、药物2g或安慰剂之后,一般炎性标志物(如trail、il1rt2、il1rt1/il1r1、mmp-1、mmp-10、mmp-7和tnfrsf9)的表达相对于基线的变化倍数的箱形图。图4示出了展示在向受试者施用药物1g、药物2g或安慰剂之后,先天免疫相关标志物(如cd163、il6ra、grn、marco、pglyrp1和csf.1)的表达相对于基线的变化倍数的箱形图。图5a和5b示出了展示向受试者施用药物1g、药物2g或安慰剂之后,t细胞和自然杀伤(nk)细胞活化标志物(如il-15ra、il-1、il-2rb、ccl23、il-7、cd6、slamf1、cd244、cd40和alcam)的表达相对于基线的变化倍数的箱形图。图6a和6b示出了展示在向受试者施用药物1g、药物2g或安慰剂之后,th1相关标志物(如ccl16、ccl3、cxcl9、il-18、il-18r1、il-18bp、ccl-3/mip-1-α和ccl-4)的表达相对于基线的变化倍数的箱形图。图7a和7b示出了展示在向受试者施用药物1g、药物2g或安慰剂之后,th17/th1相关标志物(如pi3/弹力素、cdcp1/cd318、il-17a、il-17d、il-12b、il-17ra、il-20、cxcl1和il-12)的表达相对于基线的变化倍数的箱形图。图8示出了展示在向受试者施用药物1g、药物2g或安慰剂之后,th2相关标志物(如il-5rα、il-10、il-10rb和il-13)的表达相对于基线的变化倍数的箱形图。图9示出了展示了在向受试者施用药物1g、药物2g或安慰剂之后,th2相关标志物、趋化因子和粘附分子(如ccl-23、ccl-24、ccl-28、il-24、ccl-11和vegf-a)的表达相对于基线的变化倍数的箱形图。图10a和10b示出了展示在向受试者施用药物1g、药物2g或安慰剂之后,纤维化和增生性标志物(如tgf-α、pdgf-a、gdf-15、egfr、vegf-a、hgf、axl和tgf-b)的表达相对于基线的变化倍数的箱形图。具体实施方式虽然本发明能够以各种形式体现,但是以下对若干实施例的描述是在理解将本公开认为是本发明的例示并且不旨在将本发明限制于所展示的具体实施例的情况下做出的。提供标题仅仅是为了方便起见,并且不应被解释为以任何方式限制本发明。在任何标题下所展示的实施例均可以与在任何其它标题下所展示的实施例组合。除非另外明确指明,否则本申请中指定的各个定量值中使用的数值被陈述为近似值,就好像所陈述范围内的最小值和最大值两者均以词语“约”开头。以此方式,可以使用从所陈述值的轻微变化(例如,+/-10%)来实现与所陈述值基本上相同的结果。同样,范围的公开旨在作为连续范围,包含所叙述的最小值与最大值之间的每个值,以及可以由这些值形成的任何范围。本文还公开了可以通过将所叙述的数值划分成任何其它所叙述的数值而形成的任何和所有比率(以及任何此类比率的范围)。因此,本领域技术人员将认识到,许多此类比率、范围和比率的范围可以由本文呈现的数值明确地推导出来;并且在所有情况下,此类比率、范围和比率的范围表示本发明的各个实施例。组合物在各个实施例中,本公开提供了可口服递送和/或可局部递送的药物组合物,所述药物组合物包括dgla或其衍生物、15-hetre或其衍生物或其组合。本文中的术语dgla是指呈游离酸形式的dgla。除了dgla之外或代替dgla,本发明的组合物还可以包括dgla衍生物。此类衍生物包含烷基酯;低级烷基酯,如dgla甲酯或乙酯;或呈甘油三酯形式的dgla。在一个实施例中,本公开提供了一种药物组合物,其包括囊封在胶囊壳中的dgla或其衍生物。在一个实施例中,所述组合物以足以提供每天至多约8gdgla或其衍生物的量施用于所述受试者。在一个实施例中,所述组合物以足以提供每天约4g到约8gdgla或其衍生物的量施用于所述受试者。在一个实施例中,将约500mg到约1gdgla或其衍生物囊封在胶囊壳中。15-羟基-二十碳-8(z),11(z),13(e)-三烯酸(“15-hetre”)是dgla的衍生物。如本文所使用的,术语“15-hetre”是指呈其游离酸形式(例如,15-羟基-二十碳-8(z),11(z),13(e)-三烯酸)的15-hetre和/或其药学上可接受的酯、衍生物、缀合物或盐;或者任何前述的混合物。除了15-hetre之外或代替15-hetre,本发明的组合物还可以包括15-hetre衍生物。此类衍生物包含烷基酯;低级烷基酯,如15-hetre甲酯或乙酯;或呈甘油三酯形式的15-hetre。在一个实施例中,本公开提供了一种药物组合物,其包括囊封在胶囊壳中的15-hetre或其衍生物。在一个实施例中,所述组合物以足以提供每天至多约8g15-hetre或其衍生物的量施用于所述受试者。在一个实施例中,所述组合物以足以提供每天约4g到约8g15-hetre或其衍生物的量施用于所述受试者。在一个实施例中,将约500mg到约1g15-hetre或其衍生物囊封在胶囊壳中。在一个实施例中,所述组合物以足以提供每天至多约8gdgla或其衍生物和每天至多约8g15-hetre或其衍生物的量施用于所述受试者。在一个实施例中,所述组合物以足以提供每天约4g到约8gdgla或其衍生物和每天约4g到约8g15-hetre或其衍生物的量施用于所述受试者。在一个实施例中,所述组合物以足以提供每天约500mg到约4g15-hetre或其衍生物和每天约500mg到约4gdgla或其衍生物的量施用于所述受试者。在一个实施例中,胶囊壳包括明胶(例如,具有较低分子量的明胶rxl或石灰骨明胶)。在另一个实施例中,胶囊壳包括已经通过蛋白水解酶处理以切割明胶图案并有效降低其分子量的明胶rxl。在另一个实施例中,药物组合物包括d-山梨糖醇和1,4-脱水山梨糖醇的dgla酯。在一个实施例中,胶囊壳包括(a)明胶和(b)选自d-山梨糖醇和1,4-脱水山梨糖醇中的一种或多种的增塑剂。在一个实施例中,明胶是如在u.s.7,485,323中所描述的,并且特此通过引用整体并入本文。在一个实施例中,增塑剂包括量为20%-30%,例如约24%和28%(以干基计)的1,4-脱水山梨糖醇,以及含量为约30%-50%,例如约35%到45%(以干基计)的d-山梨糖醇。在一些实施例中,胶囊壳进一步包括甘油、纯化水、二氧化钛、中链甘油三酯和卵磷脂。在各个实施例中,dgla或其衍生物和/或15-hetre或其衍生物以以下量存在于本发明的组合物中:约50mg到约5000mg、约75mg到约2500mg或约100mg到约1000mg,例如约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg、约300mg、约325mg、约350mg、约375mg、约400mg、约425mg、约450mg、约475mg、约500mg、约525mg、约550mg、约575mg、约600mg、约625mg、约650mg、约675mg、约700mg、约725mg、约750mg、约775mg、约800mg、约825mg、约850mg、约875mg、约900mg、约925mg、约950mg、约975mg、约1000mg、约1025mg、约1050mg、约1075mg、约1100mg、约1025mg、约1050mg、约1075mg、约1200mg、约1225mg、约1250mg、约1275mg、约1300mg、约1325mg、约1350mg、约1375mg、约1400mg、约1425mg、约1450mg、约1475mg、约1500mg、约1525mg、约1550mg、约1575mg、约1600mg、约1625mg、约1650mg、约1675mg、约1700mg、约1725mg、约1750mg、约1775mg、约1800mg、约1825mg、约1850mg、约1875mg、约1900mg、约1925mg、约1950mg、约1975mg、约2000mg、约2025mg、约2050mg、约2075mg、约2100mg、约2125mg、约2150mg、约2175mg、约2200mg、约2225mg、约2250mg、约2275mg、约2300mg、约2325mg、约2350mg、约2375mg、约2400mg、约2425mg、约2450mg、约2475mg或约2500mg。在任何这种实施例中,组合物可以进一步包括dgla或其衍生物和/或d-山梨糖醇和1,4-脱水山梨糖醇的15-hetre酯或其衍生物。本发明的药物组合物包括治疗有效量的15-hetre的赖氨酸盐或其衍生物。15-hetre的盐形式或其衍生物可以是所述组合物和本文所陈述的方法和用途中唯一的重要活性成分。15-hetre的盐形式或其衍生物可以是唯一的活性成分。可替代地,15-hetre的盐形式或其衍生物可以与用于治疗疾病或病症的其它药剂组合用于共调配或共施用。如果要使用另外的活性剂,则15-hetre的盐形式或其衍生物可以共调配成单个剂量单位或者可以调配成两个到多个剂量单位,用于协调、组合或伴随施用。在一个实施例中,药物组合物包括至少约50重量%、至少约60重量%、至少约70重量%、至少约80重量%或至少约90重量%的15-hetre的盐形式或其衍生物。在各个实施例中,15-hetre的盐形式或其衍生物以以下量存在于本发明的组合物中:约1mg到约10,000mg、约25mg到约7500mg、约25mg到约5000mg、约50mg到约5000mg、约50mg到约3000mg、约75mg到约2500mg或约100mg到约1000mg,例如约1mg、约2mg、约3mg、约4mg、约5mg、约6mg、约7mg、约8mg、约9mg、约10mg、约11mg、约12mg、约13mg、约14mg、约15mg、约16mg、约17mg、约18mg、约19mg、约20mg、约21mg、约22mg、约23mg、约24mg、约25mg、约50mg、约75mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg、约300mg、约325mg、约350mg、约375mg、约400mg、约425mg、约450mg、约475mg、约500mg、约525mg、约550mg、约575mg、约600mg、约625mg、约650mg、约675mg、约700mg、约725mg、约750mg、约775mg、约800mg、约825mg、约850mg、约875mg、约900mg、约925mg、约950mg、约975mg、约1000mg、约1025mg、约1050mg、约1075mg、约1100mg、约1025mg、约1050mg、约1075mg、约1200mg、约1225mg、约1250mg、约1275mg、约1300mg、约1325mg、约1350mg、约1375mg、约1400mg、约1425mg、约1450mg、约1475mg、约1500mg、约1525mg、约1550mg、约1575mg、约1600mg、约1625mg、约1650mg、约1675mg、约1700mg、约1725mg、约1750mg、约1775mg、约1800mg、约1825mg、约1850mg、约1875mg、约1900mg、约1925mg、约1950mg、约1975mg、约2000mg、约2025mg、约2050mg、约2075mg、约2100mg、约2125mg、约2150mg、约2175mg、约2200mg、约2225mg、约2250mg、约2275mg、约2300mg、约2325mg、约2350mg、约2375mg、约2400mg、约2425mg、约2450mg、约2475mg、约2500mg、2525mg、约2550mg、约2575mg、约2600mg、约2625mg、约2650mg、约2675mg、约2700mg、约2725mg、约2750mg、约2775mg、约2800mg、约2825mg、约2850mg、约2875mg、约2900mg、约2925mg、约2950mg、约2975mg、约3000mg、约3025mg、约3050mg、约3075mg、约3100mg、约3125mg、约3150mg、约3175mg、约3200mg、约3225mg、约3250mg、约3275mg、约3300mg、约3325mg、约3350mg、约3375mg、约3400mg、约3425mg、约3450mg、约3475mg、约3500mg、约3525mg、约3550mg、约3575mg、约3600mg、约3625mg、约3650mg、约3675mg、约3700mg、约3725mg、约3750mg、约3775mg、约3800mg、约3825mg、约3850mg、约3875mg、约3900mg、约3925mg、约3950mg、约3975mg、约4000mg、约4025mg、约4050mg、约4075mg、约4100mg、约4125mg、约4150mg、约4175mg、约4200mg、约4225mg、约4250mg、约4275mg、约4300mg、约4325mg、约4350mg、约4375mg、约4400mg、约4425mg、约4450mg、约4475mg、约4500mg、约4525mg、约4550mg、约4575mg、约4600mg、约4625mg、约4650mg、约4675mg、约4700mg、约4725mg、约4750mg、约4775mg、约4800mg、约4825mg、约4850mg、约4875mg、约4900mg、约4925mg、约4950mg、约4975mg、约5000mg、约5025mg、约5050mg、约5075mg、约5100mg、约5125mg、约5150mg、约5175mg、约5200mg、约5225mg、约5250mg、约5275mg、约5300mg、约5325mg、约5350mg、约5375mg、约5400mg、约5425mg、约5450mg、约5475mg、约5500mg、约5525mg、约5550mg、约5575mg、约5600mg、约5625mg、约5650mg、约5675mg、约5700mg、约5725mg、约5750mg、约5775mg、约5800mg、约5825mg、约5850mg、约5875mg、约5900mg、约5925mg、约5950mg、约5975mg、约6000mg、约6025mg、约6050mg、约6075mg、约6100mg、约6125mg、约6150mg、约6175mg、约6200mg、约6225mg、约6250mg、约6275mg、约6300mg、约6325mg、约6350mg、约6375mg、约6400mg、约6425mg、约6450mg、约6475mg、约6500mg、约6525mg、约6550mg、约6575mg、约6600mg、约6625mg、约6650mg、约6675mg、约6700mg、约6725mg、约6750mg、约6775mg、约6800mg、约6825mg、约6850mg、约6875mg、约6900mg、约6925mg、约6950mg、约6975mg、约7000mg、约7025mg、约7050mg、约7075mg、约7100mg、约7125mg、约7150mg、约7175mg、约7200mg、约7225mg、约7250mg、约7275mg、约7300mg、约7325mg、约7350mg、约7375mg、约7400mg、约7425mg、约7450mg、约7475mg、约7500mg、约7525mg、约7550mg、约7575mg、约7600mg、约7625mg、约7650mg、约7675mg、约7700mg、约7725mg、约7750mg、约7775mg、约7800mg、约7825mg、约7850mg、约7875mg、约7900mg、约7925mg、约7950mg、约7975mg、约8000mg、约8025mg、约8050mg、约8075mg、约8100mg、约8125mg、约8150mg、约8175mg、约8200mg、约8225mg、约8250mg、约8275mg、约8300mg、约8325mg、约8350mg、约8375mg、约8400mg、约8425mg、约8450mg、约8475mg、约8500mg、约8525mg、约8550mg、约8575mg、约8600mg、约8625mg、约8650mg、约8675mg、约8700mg、约8725mg、约8750mg、约8775mg、约8800mg、约8825mg、约8850mg、约8875mg、约8900mg、约8925mg、约8950mg、约8975mg、约9000mg、约9025mg、约9050mg、约9075mg、约9100mg、约9125mg、约9150mg、约9175mg、约9200mg、约9225mg、约9250mg、约9275mg、约9300mg、约9325mg、约9350mg、约9375mg、约9400mg、约9425mg、约9450mg、约9475mg、约9500mg、约9525mg、约9550mg、约9575mg、约9600mg、约9625mg、约9650mg、约9675mg、约9700mg、约9725mg、约9750mg、约9775mg、约9800mg、约9825mg、约9850mg、约9875mg、约9900mg、约9925mg、约9950mg、约9975mg或约10,000mg。在一个实施例中,存在于本发明的组合物中的15-hetre的盐形式或其衍生物包括至少90重量%的15-hetre的盐形式或其衍生物。含有15-hetre的盐形式或其衍生物的组合物可以包括甚至更高的纯度,例如至少91重量%、至少92重量%、至少93重量%、至少94重量%、至少95重量%、至少96重量%或至少97重量%的15-hetre的盐形式或其衍生物。在一个实施例中,本发明的组合物含有总脂肪酸的不超过约10重量%、不超过约9重量%、不超过约8重量%、不超过约7重量%、不超过约6重量%、不超过约5重量%、不超过约4重量%、不超过约3重量%、不超过约2重量%、不超过约1重量%或不超过约0.5重量%的脂肪酸,除了dgla或其衍生物和/或15-hetre或其衍生物。在另一个实施例中,dgla或其衍生物和/或15-hetre或其衍生物表示存在于本发明的组合物中的所有脂肪酸的至少约30重量%、约40重量%、约50重量%、至少约60重量%、至少约70重量%、至少约80重量%、至少约90重量%、至少约95重量%、至少约97重量%、至少约98重量%、至少约99重量%或100重量%。在一个实施例中,当本发明的组合物放置于标准崩解测试中时,例如如usp2040(膳食补充剂的崩解和溶解)中所阐述的,用水作为培养基,在40℃/75%rh下储存约1个月、约2个月或约3个月之后,本发明的组合物的dgla或其衍生物和/或15-hetre或其衍生物释放速率小于约60分钟、小于约50分钟、小于约40分钟、小于约30分钟或小于20分钟。在一个实施例中,在40℃/75%rh下储存约1个月、约2个月、约3个月或约6个月之后,本发明的组合物包括所有脂肪酸的小于约5重量%dgla酯和/或15-hetre酯、所有脂肪酸的小于约4重量%dgla酯和/或15-hetre酯、所有脂肪酸的小于约3重量%dgla酯和/或15-hetre酯、所有脂肪酸的小于约2重量%dgla酯和/或15-hetre酯或所有脂肪酸的小于约1重量%dgla酯和/或15-hetre酯。在一些实施例中,药物组合物呈适合于局部施用的形式。在各个实施例中,本发明提供了药物组合物,例如可局部递送的组合物,所述药物组合物包括dgla或其衍生物和/或15-hetre或其衍生物。在又另一个实施例中,本公开提供了局部药物组合物,其包括例如一定量(例如,治疗有效量)的dgla或其衍生物和/或15-hetre或其衍生物。方法本发明的任何组合物,包含上文所述的组合物或可以通过组合本公开的各个实施例而调配的组合物,可以用于治疗或预防以下:皮肤病症和疾病,包含寻常痤疮、酒渣鼻痤疮、特应性皮炎、牛皮癣、瘙痒/发痒、辐射保护、干性皮肤、平滑皮肤、健康皮肤、抗衰老和光保护;泌尿病症和疾病,包含膀胱癌、膀胱突出、血尿、间质性膀胱炎、神经源性膀胱、佩罗尼氏病、前列腺疾病、失禁、泌尿道感染和血管输尿管反流(vasicoureteralreflux);肾疾病和病症,包含肾脏衰竭、急性肾脏损伤、慢性肾脏疾病和多囊性肾脏疾病;风湿性疾病,包含强直性脊柱炎、纤维肌痛、痛风、感染性关节炎、狼疮、骨关节炎、风湿性多肌痛、银屑病关节炎、反应性关节炎、类风湿性关节炎、硬化病(sclerodoma);呼吸道病症,包含炎性肺疾病、呼吸道感染、胸膜腔疾病、肺血管疾病、肺炎、肺栓塞和肺癌;以及心血管病症,包含急性心脏缺血事件、急性心肌梗塞、心绞痛、心律失常、心房纤维形成、动脉粥样硬化、动脉纤维性颤动、心功能不全、心血管疾病、慢性心力衰竭、慢性稳定型心绞痛、充血性心力衰竭、冠状动脉疾病、冠心病、深静脉血栓形成、糖尿病(diabetes)、糖尿病(diabetesmellitus)、糖尿病性神经病、患有糖尿病的受试者的舒张功能障碍、水肿、原发性高血压、最终肺栓塞、脂肪肝疾病、心脏病、心力衰竭、纯合家族性高胆固醇血症(hofh)、纯合家族性谷固醇血症、高胆固醇血症、高脂血症、高血压、高甘油三酯血症、代谢综合症、混合性血脂异常、中度到轻度心力衰竭、心肌梗塞、肥胖管理、阵发性心房/动脉纤维性颤动/纤维化/扑动、阵发性室上性心动过速(psvt),特别是严重或快速发作的水肿,血小板聚集、原发性高胆固醇血症、原发性高脂血症、肺动脉高压、肺高压、复发性血液动力学不稳定室性心动过速(vt)、复发性室性心律失常、复发性心室纤维性颤动(vf)、破裂动脉瘤、谷固醇血症(sitisterolemia)、中风、室上性心动过速、症状性纤维性颤动/扑动、心动过速、ii型糖尿病、血管疾病、静脉血栓栓塞、室性心律失常和其它心血管事件和阿尔茨海默氏病。在一些实施例中,本发明的组合物,如dgla或其衍生物和/或15-hetre或其衍生物,可以减少(即,下调)与纤维化疾病或病症和癌症相关的一种或多种标志物的表达。在各个实施例中,响应于施用包括dgla或其衍生物和/或15-hetre或其衍生物的组合物,减少受试者的与纤维化和/或增生相关的一种或多种标志物的表达。在一些实施例中,标志物是在多种纤维化疾病、恶性肿瘤和具有纤维化元素的其它疾病(例如,多发性硬化症)中以高水平表达的标志物。与纤维化疾病和癌症相关的标志物的实例包含转化生长因子β(tgf-β)、表皮生长因子受体(egfr)、肝细胞生长因子(hgf)、血小板衍生的生长因子亚基a(pdgf亚基a)、血管内皮生长因子(vegf-a)、酪氨酸蛋白激酶受体ufo(axl)和转化生长因子α(tgf-α)。纤维化疾病的非限制性实例包含系统性纤维化(即,辐射纤维化)、肝纤维化和/或肝硬化、肾纤维化、肺纤维化和/或间质性肺疾病、皮肤纤维化、心脏纤维化、眼部纤维化、眼部疾病、结缔组织病症、骨髓纤维化、癌症和其它相关的纤维化疾病。在一些实施例中,受试者经历与其它疾病相关的一种或多种标志物的减少和/或肝纤维化和/或肝硬化的治疗或预防,所述其它疾病与肝纤维化和/或肝硬化相关。肝纤维化和/或肝硬化相关疾病的非限制性实例包含非酒精性脂肪肝疾病(nafld)、酒精性肝炎、原发性硬化性胆管炎、原发性胆汁性胆管炎、病毒性肝炎(慢性丙型肝炎、hbv)、自身免疫性肝炎、医源性和/或药物诱发的肝损伤和/或肝静脉闭塞性疾病。在一些实施例中,受试者经历与nafld相关的一种或多种标志物的减少。与nafld相关的标志物的实例包含tgf-β、hgf和pdgf。在另一个实施例中,受试者经历与酒精性肝炎相关的一种或多种标志物的减少。与酒精性肝炎相关的标志物的实例包含tgf-β和axl。在又另一个实施例中,受试者经历与原发性硬化性胆管炎相关的一种或多种标志物的减少。与原发性硬化性胆管炎相关的标志物的实例包含tgf-β和egfr。在一些实施例中,受试者经历与原发性胆汁性胆管炎相关的一种或多种标志物的减少。与原发性胆汁性胆管炎相关的标志物的实例包含tgf-β和egfr。在又另一个实施例中,受试者经历与病毒性肝炎相关的一种或多种标志物的减少。与病毒性肝炎相关的标志物的实例包含tgf-β和axl。在一些实施例中,受试者经历与自身免疫性肝炎相关的一种或多种标志物的减少。与自身免疫性肝炎相关的标志物的实例是tgf-β。在另一个实施例中,受试者经历与医源性和/或药物诱发的肝损伤相关的一种或多种标志物的减少。与医源性和/或药物诱发的肝损伤相关的标志物的实例是tgf-β。在一些实施例中,受试者经历与肝静脉闭塞性疾病相关的一种或多种标志物的减少。与静脉闭塞性疾病相关的标志物的实例是tgf-β和vegf-a。肾纤维化的非限制性实例包含肾小球疾病、肾小管间质性疾病和医源性肾病/肾缺血。在一些实施例中,受试者经历与肾小球疾病相关的一种或多种标志物的减少,和/或一种或多种肾小球疾病的治疗或预防。与肾小球疾病相关的标志物的实例包含tgf-β、egfr、pdgf和vegf-a。肾小球疾病的非限制性实例包含局灶性节段性肾小球硬化症(fsgs)、iga肾病、新月体性肾小球肾炎、狼疮性肾炎和糖尿病性肾病。在另一个实施例中,受试者经历与肾小管间质性疾病相关的一种或多种标志物的减少。与肾小管间质性疾病相关的标志物的实例包含tgf-β、egfr、pdgf和vegf-a。在一些实施例中,受试者经历与医源性肾病/肾缺血相关的一种或多种标志物的减少。与医源性肾病/肾缺血相关的标志物的实例包含tgf-β、egfr、pdgf和vegf-a。在一些实施例中,受试者经历与系统性纤维化相关的一种或多种标志物的减少和/或系统性纤维化的治疗或预防。与系统性纤维化相关的标志物的实例包含tgf-β和pdgf亚基a。在又另一个实施例中,受试者经历与肝纤维化和/或肝硬化相关的一种或多种标志物的减少,和/或肝纤维化和/或肝硬化的治疗或预防。与肝纤维化和/或肝硬化相关的标志物的实例包含tgf-β、tgf-α、hgf、pdgf亚基a和axl。在另一个实施例中,受试者经历与肾纤维化相关的一种或多种标志物的减少和/或肾纤维化的治疗或预防。与肾纤维化相关的标志物的实例包含tgf-β、egfr、pdgf和vegf-a。在各个实施例中,受试者经历与肺纤维化和/或间质性肺疾病相关的一种或多种标志物的减少,和/或肺纤维化和/或间质性肺疾病的治疗或预防。与肺纤维化和/或间质性肺疾病相关的标志物的实例包含tgf-β、egfr、axl、pdgf和vegf-a。在另一个实施例中,受试者经历与皮肤纤维化相关的一种或多种标志物的减少,和/或皮肤纤维化的治疗或预防。与皮肤纤维化相关的标志物的实例包含tgf-β、pdgf和vegf-a。在一些实施例中,受试者经历与心脏纤维化相关的一种或多种标志物的减少,和/或心脏纤维化的治疗或预防。与心脏纤维化相关的标志物的实例包含tgf-β、egfr和pdgf。在一些实施例中,受试者经历与眼部疾病相关的一种或多种标志物的减少,和/或眼部疾病的治疗或预防。眼部疾病的非限制性实例包含角膜浑浊、青光眼、年龄相关性黄斑变性(amd)、白内障和糖尿病性视网膜病(dr)。与眼部疾病相关的标志物的实例包含tgf-β和vegf-a。在另一个实施例中,受试者经历与结缔组织病症相关的一种或多种标志物的减少,和/或结缔组织病症的治疗或预防。在一些实施例中,受试者经历与骨髓纤维化相关的一种或多种标志物的减少。与骨髓纤维化相关的标志物的实例是tgf-β。在另一个实施例中,受试者经历与阿尔茨海默氏病相关的一种或多种标志物的减少,和/或阿尔茨海默氏病的治疗或预防。与阿尔茨海默氏病相关的示例标志物包含tgf-β。在另一个实施例中,受试者经历与佩罗尼氏病相关的一种或多种标志物的减少,和/或阿尔茨海默氏病的治疗或预防。与佩罗尼氏病相关的示例标志物包含tgf-β。在一些实施例中,受试者经历一种或多种肺疾病,如肺纤维化和/或间质性肺疾病的减少,和/或肺纤维化和/或间质性肺疾病的治疗或预防。肺疾病,如肺纤维化和/或间质性肺疾病的非限制性实例包含特发性肺纤维化、结节病、混合性结缔组织疾病、多肌炎、皮肌炎和系统性红斑狼疮。与皮肤疾病和病症相关的标志物的非限制性实例包含tgf-β、egfr、vegf-a、pdgf和axl。在一些实施例中,受试者经历一种或多种皮肤疾病或病症的减少,和/或一种或多种皮肤疾病或病症的治疗或预防。皮肤疾病和病症的非限制性实例包含硬皮病/系统性硬化症、肾源性纤维化皮肤病、混合性结缔组织疾病、硬化性粘液水肿、硬肿病、嗜酸性筋膜炎、医源性纤维化、硬皮病和辐射纤维化。与皮肤疾病和病症相关的标志物的非限制性实例包含tgf-β、egfr、vegf-a、pdgf和axl。在一些实施例中,受试者经历与心脏疾病相关的一种或多种标志物的减少,和/或一种或多种心脏疾病的治疗或预防。与心脏疾病相关的标志物的实例包含tgf-β、egfr和pdgf。在一些实施例中,受试者经历一种或多种结缔组织病症的减少,和/或一种或多种结缔组织病症的治疗或预防。结缔组织病症的非限制性实例包含马凡氏综合症、洛伊斯-迪茨综合症和血管性埃勒斯-丹洛斯氏综合症(eds)。在一些实施例中,受试者经历与马凡氏综合症相关的一种或多种标志物的减少。与马凡氏综合症相关的标志物的实例是tgf-β。在另一个实施例中,受试者经历与洛伊斯-迪茨综合症相关的一种或多种标志物的减少。与洛伊斯-迪茨综合症相关的标志物的实例是tgf-β。在又另一个实施例中,受试者经历与血管eds相关的一种或多种标志物的减少。与血管eds相关的标志物的实例是tgf-β。在另一个实施例中,受试者经历硬皮病的治疗或预防。在一些实施例中,受试者经历与硬皮病相关的一种或多种标志物的减少。与硬皮病相关的标志物的实例包含tgf-β、egfr、vegf-a、pdgf和axl。在另一个实施例中,受试者经历一种或多种纤维化疾病或病症的治疗或预防。在一些实施例中,受试者经历与纤维化疾病或病症相关的一种或多种标志物的减少。纤维化疾病或病症的非限制性实例包含系统性纤维化、肾纤维化、肺纤维化、皮肤纤维化、骨髓纤维化和心脏纤维化。在一个实施例中,系统性纤维化是辐射纤维化。在一个实施例中,系统性纤维化是辐射纤维化。在一个实施例中,肾纤维化是肾小球疾病、肾小管间质性疾病、医源性肾病和/或肾缺血。在一个实施例中,肾小球疾病包含但不限于局灶性节段性肾小球硬化症、iga肾病、新月体性肾小球肾炎、狼疮性肾炎和糖尿病性肾病。在一个实施例中,肺纤维化是间质性肺疾病。在一个实施例中,肺纤维化进一步包括特发性肺纤维化、硬皮病、辐射纤维化、医源性、结节病、混合性结缔组织疾病、多肌炎、皮肌炎和/或系统性红斑狼疮。在一个实施例中,皮肤纤维化进一步包括硬皮病、系统性硬化症、肾源性纤维化皮肤病、混合性结缔组织疾病、硬化性粘液水肿、硬肿病、嗜酸性筋膜炎和/或医源性纤维化。在一个实施例中,受试者经历有需要的受试者的一种或多种细胞因子和/或趋化因子的量的减少。与纤维化疾病或病症相关的标志物的实例包含tgf-β、pdgf、egfr、vegf-a和/或axl。在另一个实施例中,受试者经历一种或多种癌症的治疗或预防。在一些实施例中,受试者经历与癌症相关的一种或多种标志物的减少。癌症的非限制性实例包含肾细胞癌、肝细胞癌、胆管癌、乳腺癌和皮肤鳞状细胞癌。在一些实施例中,受试者经历与肾细胞癌相关的一种或多种标志物的减少。与肾细胞癌相关的标志物的实例包含tgf-β和egfr。在一些实施例中,受试者经历与肝细胞癌相关的一种或多种标志物的减少。与肝细胞癌相关的标志物的实例包含tgf-β和egfr。在一些实施例中,受试者经历与胆管癌相关的一种或多种标志物的减少。与胆管癌相关的标志物的实例包含tgf-β和egfr。在一些实施例中,受试者经历与乳腺癌相关的一种或多种标志物的减少。与乳腺癌相关的标志物的实例包含tgf-β和egfr。在一些实施例中,受试者经历与皮肤鳞状细胞癌相关的一种或多种标志物的减少。与皮肤鳞状细胞癌相关的标志物的实例包含tgf-β和egfr。在一些实施例中,本发明的组合物,如包括dgla或其衍生物和/或15-hetre或其衍生物的组合物,可以诱导免疫抑制。在各个实施例中,诱导器官移植受试者的免疫抑制,所述受试者如尚未接受器官移植物的受试者、正接受器官移植物的受试者或已经接受器官移植物的受试者。在一些实施例中,器官移植物是肾移植物。在一些实施例中,本发明的组合物,如包括dgla或其衍生物和/或15-hetre或其衍生物的组合物,可以减少(即,下调)与炎性病状或t细胞活化相关的一种或多种标志物。在各个实施例中,响应于包括dgla或其衍生物和/或15-hetre或其衍生物的组合物的施用,受试者经历系统性免疫活化的逆转。在另一个实施例中,受试者经历与炎性细胞因子和趋化因子相关的一种或多种标志物的减少。在一些实施例中,相关炎性细胞因子和趋化因子来自多个免疫轴。与细胞因子和趋化因子相关的标志物的非限制性实例包含t细胞和自然杀伤细胞活化因子、t辅助细胞(th)1、th2、th17、th22和t调节轴、全身性免疫和炎症。在一些实施例中,t细胞活化因子cd40与炎性病状相关。与cd40相关的炎性疾病的非限制性实例包含特应性皮炎、t细胞介导的自身免疫性疾病、血液系统恶性肿瘤、实体器官肿瘤,如乳腺癌和动脉粥样硬化。t细胞介导的自身免疫性疾病的实例包含多发性硬化症、类风湿性关节炎、1型糖尿病和炎性肠病。在各个实施例中,响应于包括dgla和/或15-hetre的组合物的施用,受试者经历免疫抑制。在一些实施例中,免疫抑制由组合物诱导。涉及免疫抑制的适应症的非限制性实例包含移植,如器官移植(例如,肾脏/肾)。炎性肠病的实例包含克罗恩病、系统性红斑狼疮、狼疮性肾炎、牛皮癣、痤疮、哮喘和化脓性汗腺炎。血液系统恶性肿瘤的非限制性实例包含霍奇金氏淋巴瘤、非霍奇金氏淋巴瘤、b细胞淋巴瘤、淋巴细胞性白血病、多发性骨髓瘤和急性髓性白血病。在各个实施例中,响应于包括dgla和/或15-hetre的组合物的施用,受试者经历以下标志物中的一种或多种标志物的减少:全身性炎症、先天免疫、t细胞/自然杀伤(nk)细胞活化、th1、th17/th1、th2、th2以及其它趋化因子和粘附分子以及纤维化和增生性。例如,全身性炎症全身性炎症标志物包含但不限于肿瘤坏死因子相关凋亡诱导配体(trail)、白介素1受体2型(il.1rt2)、白介素1受体1型/白介素1受体i型(il.rt1/il1r1)、基质金属蛋白酶-1(mmp.1)、基质金属蛋白酶-10(mmp.10)、基质金属蛋白酶-7(mmp7)和肿瘤坏死因子受体超家族/分化簇137(tnfrsf/cd137)。例如,先天免疫相关标志物包含但不限于分化簇163(cd163)、白介素6受体α(il.6ra)、颗粒体蛋白基因(grn)、巨噬细胞受体(marco)、肽聚糖识别蛋白1(pglyrp1)和集落刺激因子-1(csf.1)。例如,t细胞/nk细胞活化标志物包含但不限于白介素15受体亚基α(il.15ra)、白介素2(il2)、白介素2受体亚基β(il.2rb)、c-c基序趋化因子配体25(ccl-25)、白介素7(il7)、cd6、信号传导淋巴细胞活化分子1(slamf1)、分化簇224(cd244)、分化簇40(cd40)和活化白细胞细胞粘附分子(alcam)。例如,th1相关标志物包含但不限于c-c基序趋化因子配体16(ccl-16)、c-c基序趋化因子配体3(ccl-3)、c-x-c基序趋化因子配体9(cxcl9)、白介素18(il18)、白介素18受体1(il.18r1)、白介素18结合蛋白(il.18bp)、c-c基序趋化因子配体4(ccl-4)和c-c基序趋化因子配体3/小噬细胞炎性蛋白1α(ccl-3/mip-1-α)。例如,th17/th1相关标志物包含但不限于肽酶抑制剂3/弹力素(pi3/弹力素)、含cub结构域蛋白/分化簇结构域318(cdcp1/cd318)、白介素17a(il.17a)、白介素17d(il.17d)、白介素12b(il.12b)、白介素17受体α(il.17ra)、白介素20(il.20)、c-x-c基序趋化因子配体1(cxcl1)和白介素12(il12)。例如,th2相关标志物包含但不限于白介素5受体α(il.5rα)、白介素10(il10)、白介素-10受体亚基β(il.10rb)和白介素13(il13)。例如,th2和其它相关趋化因子和粘附分子包含但不限于c-c基序趋化因子配体23(ccl-23)、c-c基序趋化因子配体24(ccl-24)、c-c基序趋化因子配体28(ccl-28)、白介素24(il.24)、c-c基序趋化因子配体11(ccl-11)和vegf-a。与给定疾病或病症有关的术语“治疗”包含但不限于抑制疾病或病症,例如,阻止疾病或病症的发展;缓解疾病或病症,例如引起疾病或病症的消退;或缓解由疾病或病症引起或由疾病或病症产生的病状,例如缓解、预防或治疗疾病或病症的症状。与给定疾病或病症有关的术语“预防”意指:如果没有发生疾病,则预防疾病的发作;预防疾病或病症在可能易患病症或疾病但尚未诊断为患有病症或疾病的受试者中发生,和/或如果已经存在,则预防进一步的疾病/病症发展。在一个实施例中,确定受试者与参考水平相比具有低基线嗜酸性粒细胞计数。在一个实施例中,在施用dgla之前确定受试者具有低基线嗜酸性粒细胞计数。术语“参考水平”包含但不限于来自从健康患者收集的样品的水平。还可以根据从健康患者群体收集的多个样品确定参考水平。作为一个实例,低嗜酸性粒细胞计数可以基于从健康患者群体或健康患者子集(例如,特定种族的健康患者)确定的嗜酸性粒细胞计数来确定。在其它实施例中,参考水平是根据在较早时间点(例如,1天、3天、1周、1个月、3个月、6个月、12个月或更久)从正经历治疗的同一患者收集的样品确定的值。在一些实施例中,参考水平可以基于本领域的技术人员已知的或由医疗机构开发的值。在各个实施例中,本发明的组合物以足以提供每天以下量的dgla或其衍生物和/或15-hetre或其衍生物的每日dgla或其衍生物剂量和/或15-hetre或其衍生物剂量的量施用:约50mg到约10000mg、约100mg到约7500mg或约100mg到约5000mg,例如约200mg、约300mg、约400mg、约500mg、约600mg、约700mg、约800mg、约900mg、约1000mg、约1100mg、约1200mg、约1300mg、约1400mg、约1500mg、约1600mg、约1700mg、约1800mg、约1900mg、约2000mg、约2100mg、约2200mg、约2300mg、约2400mg、约2500mg、约2600mg、约2700mg、约2800mg、约2900mg、约3000mg、约3100mg、约3200mg、约3300mg、约3400mg、约3500mg、3600mg、约3700mg、约3800mg、约3900mg、约4000mg、约4100mg、约4200mg、约4300mg、约4400mg、约4500mg、4600mg、约4700mg、约4800mg、约4900mg、约5000mg、约5100mg、约5200mg、约5300mg、约5400mg、约5500mg。在一个实施例中,本发明提供了一种治疗特应性皮炎,例如轻度到中度特应性皮炎的方法。在一个实施例中,所述方法包括以每天约500mg到约3g、每天约1g到约2.5g、每天约1g或每天约2g的量向需要这种治疗的受试者施用dgla或其衍生物和/或15-hetre或其衍生物。在一个实施例中,每日向受试者施用dgla或其衍生物和/或15-hetre或其衍生物,持续至少约2周、至少约4周或至少约8周的时间段。在相关实施例中,在根据本发明进行治疗时,例如,在约1到约12周、约1到约8周或约1到约4周的时间段内,受试者或受试者组表现出以下结果中的一个或多个结果:(a)相对于基线或安慰剂对照,湿疹面积与严重程度指数(easi)评分降低;(b)相对于基线或对照,受特应性皮炎影响的解剖部位的面积百分比减小;(c)相对于基线或安慰剂对照,研究者的整体评估评分降低;(d)相对于基线或安慰剂对照,红斑、水肿/丘疹、渗出/结痂、表皮脱落、苔藓化和/或干燥的强度降低;(e)相对于基线或安慰剂对照,红斑、水肿/丘疹、渗出/结痂、表皮脱落、苔藓化和/或干燥减轻;(f)相对于基线或安慰剂对照,受特应性皮炎影响的体表面积(bsa)减小;(g)相对于基线或安慰剂对照,睡眠不足减轻;(h)相对于基线或安慰剂对照,瘙痒(发痒)发生率降低;(i)以视觉模拟量表表示,前三天和/或晚上平均的瘙痒严重程度降低;(j)相对于基线或安慰剂对照,scorad评分降低;(k)与基线或安慰剂对照相比,面向患者的湿疹测量(poem)改善;(l)在前一周中受试者报告由于湿疹引起皮肤发痒的天数减少;(m)在前一周中受试者报告由于湿疹引起睡眠受到干扰的天数减少;(n)在前一周中受试者经历皮肤出血的天数减少;(o)在前一周中受试者经历皮肤渗液或渗出澄清液体的天数减少;(p)在前一周中受试者皮肤破裂的天数减少;(q)在前一周中受试者皮肤成片剥落的天数减少;(r)在前一周中受试者经历皮肤干燥的天数减少;(s)与基线或安慰剂对照相比,经表皮水分流失增加;(t)与基线相比,血浆总dgla和游离dgla增加;(u)与基线或安慰剂对照相比,dgla:aa比率增加;和/或(v)与基线或安慰剂对照相比,动脉血压降低。在一个实施例中,本发明的方法包括在向受试者或受试者组给药之前测量上文(a)-(v)中所阐述的一种或多种标志物或参数的基线水平。在另一个实施例中,所述方法包括在确定(a)-(v)中所阐述的一种或多种标志物或参数的基线水平之后,向受试者施用如本文公开的组合物,并且随后对所述一种或多种标志物进行另外的测量。在另一个实施例中,在用本发明的组合物进行治疗时,例如在约1到约12周、约1到约8周或约1到约4周的时间段内,受试者或受试者组表现出上文刚刚描述的结果(a)-(v)中的任何2种或更多种、任何3种或更多种、任何4种或更多种、任何5种或更多种、任何6种或更多种、任何7种或更多种、任何8种或更多种、任何9种或更多种、任何10种或更多种、任何11种或更多种、任何12种或更多种、任何13种或更多种、任何14种或更多种、任何15种或更多种、任何16种或更多种、任何17种或更多种、任何18种或更多种、任何19种或更多种、任何20种或更多种、任何21种或更多种或所有22种。在另一个实施例中,在用本发明的组合物进行治疗时,受试者或受试者组表现出以下结果中的一个或多个结果:(a)相对于基线或安慰剂对照,湿疹面积与严重程度指数(easi)评分降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或、至少约95%;(b)相对于基线或对照,受特应性皮炎影响的解剖部位的面积百分比减小至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或、至少约95%;(c)相对于基线或安慰剂对照,研究者的整体评估评分降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(d)相对于基线或安慰剂对照,红斑、水肿/丘疹、渗出/结痂、表皮脱落、苔藓化和/或干燥的强度降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(e)相对于基线或安慰剂对照,红斑、水肿/丘疹、渗出/结痂、表皮脱落、苔藓化和/或干燥减轻至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(f)相对于基线或安慰剂对照,受特应性皮炎影响的体表面积(bsa)减小至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(g)相对于基线或安慰剂对照,睡眠不足减轻至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(h)相对于基线或安慰剂对照,瘙痒(发痒)发生率降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(i)以视觉模拟量表表示,前三天和/或晚上平均的瘙痒严重程度降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(j)相对于基线或安慰剂对照,scorad评分降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(k)与基线或安慰剂对照相比,面向患者的湿疹测量(poem)改善至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(l)在前一周中受试者报告由于湿疹引起皮肤发痒的天数减少至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(m)在前一周中受试者报告由于湿疹引起睡眠受到干扰的天数减少至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(n)在前一周中受试者经历皮肤出血的天数减少至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(o)在前一周中受试者经历皮肤渗液或渗出澄清液体的天数减少至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(p)在前一周中受试者皮肤破裂的天数减少至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(q)在前一周中受试者皮肤成片剥落的天数减少至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(r)在前一周中受试者经历皮肤干燥的天数减少至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(s)与基线或安慰剂对照相比,经表皮水分流失增加至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(t)与基线相比,血浆总dgla和游离dgla增加至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;(u)与基线或安慰剂对照相比,dgla:aa比率增加至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%;和/或(v)平均动脉血压降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%或至少约95%。在另一个实施例中,在单剂量施用或多剂量施用之后,在用本发明的组合物进行治疗时,例如在约1到约12周、约1到约8周或约1到约4周的时间段内,受试者或受试者组表现出上文刚刚描述的结果(a)-(v)中的任何2种或更多种、任何3种或更多种、任何4种或更多种、任何5种或更多种、任何6种或更多种、任何7种或更多种、任何8种或更多种、任何9种或更多种、任何10种或更多种、任何11种或更多种、任何12种或更多种、任何13种或更多种、任何14种或更多种、任何15种或更多种、任何16种或更多种、任何17种或更多种、任何18种或更多种、任何19种或更多种、任何20种或更多种、任何21种或更多种或所有22种。在另一个实施例中,在用本发明的组合物进行治疗时,受试者或受试者组表现出以下结果中的一个或多个结果:(a)相对于基线、安慰剂对照和/或未处理的患者,tgf-α水平降低;(b)相对于基线、安慰剂对照和/或未处理的患者,tgf-β水平降低;(c)相对于基线、安慰剂对照和/或未处理的患者,egfr水平降低;(d)相对于基线、安慰剂对照和/或未处理的患者,vegf-a降低;(e)相对于基线、安慰剂对照和/或未处理的患者,axl水平降低;(f)相对于基线、安慰剂对照和/或未处理的患者,il-15ra水平降低;(g)相对于基线、安慰剂对照和/或未处理的患者,il-2rβ水平降低;(h)相对于基线、安慰剂对照和/或未处理的患者,il-7水平降低;(i)相对于基线、安慰剂对照和/或未处理的患者,ccl-25水平降低;(j)相对于基线、安慰剂对照和/或未处理的患者,cd6水平降低;(k)相对于基线、安慰剂对照和/或未处理的患者,slamf1水平降低。(l)相对于基线、安慰剂对照和/或未处理的患者,cd244水平降低;(m)相对于基线、安慰剂对照和/或未处理的患者,alcam水平降低;(n)相对于基线、安慰剂对照和/或未处理的患者,ccl-16水平降低;(o)相对于基线、安慰剂对照和/或未处理的患者,ccl-3水平降低;(p)相对于基线、安慰剂对照和/或未处理的患者,il-2rβ水平降低;(q)相对于基线、安慰剂对照和/或未处理的患者,cxcl-9水平降低;(r)相对于基线、安慰剂对照和/或未处理的患者,il-18水平降低;(s)相对于基线、安慰剂对照和/或未处理的患者,il-18r1水平降低;(t)相对于基线、安慰剂对照和/或未处理的患者,il-18bp水平降低;(u)相对于基线、安慰剂对照和/或未处理的患者,ccl-4水平降低;(v)相对于基线、安慰剂对照和/或未处理的患者,ccl-3水平降低;(w)相对于基线、安慰剂对照和/或未处理的患者,pi3水平降低;(x)相对于基线、安慰剂对照和/或未处理的患者,cdcp1水平降低;(y)相对于基线、安慰剂对照和/或未处理的患者,il-17α水平降低;(z)相对于基线、安慰剂对照和/或未处理的患者,il-17d水平降低;(aa)相对于基线、安慰剂对照和/或未处理的患者,il-17β水平降低;(bb)相对于基线、安慰剂对照和/或未处理的患者,il-12β水平降低;(cc)相对于基线、安慰剂对照和/或未处理的患者,il-17rα水平降低;(dd)相对于基线、安慰剂对照和/或未处理的患者,il-20水平降低;(ee)相对于基线、安慰剂对照和/或未处理的患者,cxcl1水平降低;(ff)相对于基线、安慰剂对照和/或未处理的患者,il-12水平降低;(gg)相对于基线、安慰剂对照和/或未处理的患者,il-5rα水平降低;(hh)相对于基线、安慰剂对照和/或未处理的患者,il-10水平降低;(ii)相对于基线、安慰剂对照和/或未处理的患者,il-10rβ水平降低;(jj)相对于基线、安慰剂对照和/或未处理的患者,il-13水平降低;(kk)相对于基线、安慰剂对照和/或未处理的患者,ccl-11水平降低;(ll)相对于基线、安慰剂对照和/或未处理的患者,ccl-23水平降低;(mm)相对于基线、安慰剂对照和/或未处理的患者,ccl-24水平降低;(nn)相对于基线、安慰剂对照和/或未处理的患者,ccl-28水平降低;以及(oo)相对于基线、安慰剂对照和/或未处理的患者,il-24水平降低。在一个实施例中,本发明的方法包括在向受试者或受试者组给药之前测量上文(a)-(oo)中所阐述的一种或多种标志物或参数的基线水平。在另一个实施例中,所述方法包括在确定(a)-(oo)中所阐述的一种或多种标志物或参数的基线水平之后,向受试者施用如本文公开的组合物,并且随后对所述一种或多种标志物进行另外的测量。在另一个实施例中,在用本发明的组合物进行治疗时,例如在约1到约12周、约1到约8周或约1到约4周的时间段内,受试者或受试者组表现出上文刚刚描述的结果(a)-(oo)中的任何2种或更多种、任何3种或更多种、任何4种或更多种、任何5种或更多种、任何6种或更多种、任何7种或更多种、任何8种或更多种、任何9种或更多种、任何10种或更多种、任何11种或更多种、任何12种或更多种、任何13种或更多种、任何14种或更多种、任何15种或更多种、任何16种或更多种、任何17种或更多种、任何18种或更多种、任何19种或更多种、任何20种或更多种、任何21种或更多种或所有22种。在另一个实施例中,在用本发明的组合物进行治疗时,受试者或受试者组表现出以下结果中的一个或多个结果:(a)tgf-α水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(b)tgf-β水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(c)egfr水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(d)vegf-a降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(e)axl水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(f)il-15ra水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(g)il-2rβ水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(h)il-7水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(i)ccl-25水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(j)cd6水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(k)slamf1水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(l)cd244水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(m)alcam水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(n)ccl-16水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(o)ccl-3水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(p)il-2rβ水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(q)cxcl-9水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(r)il-18水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(s)il-18r1水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(t)il-18bp水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(u)ccl-4水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(v)ccl-3水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(w)pi3水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(x)cdcp1水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(y)il-17α水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(z)il-17d水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(aa)il-17β水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(bb)il-12β水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(cc)il-17rα水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(dd)il-20水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(ee)cxcl1水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(ff)il-12水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(gg)il-5rα水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(hh)il-10水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(ii)il-10rβ水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(jj)il-13水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(kk)ccl-11水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(ll)ccl-23水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(mm)ccl-24水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;(nn)ccl-28水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者;以及(oo)il-24水平降低至少约0.05倍、至少约0.10倍、至少约0.15倍、至少约0.20倍、至少约0.25倍、至少约0.30倍、至少约0.35倍、至少约0.40倍、至少约0.45倍、至少约0.50倍、至少约0.55倍、至少约0.60倍、至少约0.65倍、至少约0.70倍、至少约0.75倍、至少约0.80倍、至少约0.85倍、至少约0.90倍、至少约0.95倍或至少约1倍,其中倍数降低是相对于基线、安慰剂对照和/或未处理的患者。在一个实施例中,本发明的含有dgla的组合物包括如表1所示的以下脂肪酸指纹。表1c18:1n-9<lod–<5%c18:2n-6<lod–<5%20:3ω6–dglanlt95异构体a<lod–<5%c20:4n-6+异构体<lod–<5%未标识的总相关物质nmt2在一个实施例中,本发明的含有dgla的组合物包括如表2所示的以下脂肪酸指纹。表2本发明的说明性含有dgla的组合物包括如表3所示的以下脂肪酸指纹。表3c16:0<lod–<5%c18:1n-7<lod–<5%c18:1n-9<lod–<5%c18:2n-6<lod–<5%c18:3n-6<lod–<5%c20:3n-3<lod–<5%20:3n-6–dglanlt95c20:4n-6<lod–<5%未标识的总相关物质nmt2在一个实施例中,本发明的含有dgla的组合物包括如表4所示的以下脂肪酸指纹。表4在一个实施例中,本发明的含有dgla的组合物包括如表5所示的以下脂肪酸指纹。表5c20:3n-6(dgla-甘油三酯)最小值30%c16:0最大值26%c18:0最大值12%c18:1n-9最大值15%c18:2n-6最大值15%c18:3n-6最大值5%c20:4n-6最大值1%c22:0最大值5%c24:0最大值15%实例提供以下实例以进一步展示本发明技术的实施例,并且不应被解释为限制本发明技术的范围。在提及某些实施例或其特征的程度上,所述实施例或其特征仅用于说明的目的,并且除非另有指明,否则不旨在限制本发明技术。本领域的技术人员可以在不用运用发明能力并且不脱离本发明技术的范围的情况下开发等同的手段。将理解,可以在本文描述的过程中做出许多变化,同时仍然保持在本发明技术的界限内。此类变化旨在被包含在当前公开的技术的范围内。因此,在以下代表性实例中描述了当前公开的技术的实施例。实例1将包括dgla和2000pmdl-α生育酚的三批药物组合物填充到明胶胶囊中。(参见表6)。表6批号dgla(毫克/胶囊)明胶描述e09726/1250标准酸性牛明胶e09726/2250具有较低分子量(mw)的石灰骨明胶e09727500标准酸性牛明胶胶囊壳包含以下赋形剂:明胶、纯化水、甘油、二氧化钛以及加工助剂卵磷脂和中链甘油三酯。还制备了另外批次的胶囊,包含在含有明胶、聚山梨醇或甘油/聚山梨醇的混合物、纯化水、二氧化钛以及加工助剂卵磷脂和中-链甘油三酯的胶囊中用标称2000ppmdl-α生育酚稳定的dgla游离脂肪酸(ffa),如表7所示。表7每个批次的胶囊壳组合物示出于下表8和9中。表81rxl明胶含有较低数量的高分子量聚合物(约5%>200,000da)表9对上述胶囊进行稳定性测试。将每个批次的胶囊保存长达6个月,并且使用定性或定量usp2040崩解和溶解测试方案进行评估。结果示出于表10-12中。表10dgla软凝胶胶囊的稳定性数据:定性破裂测试结果表11:dgla甘油酯百分比表12如上所见,对于用甘油和标准酸性牛明胶(e09726/01,和e09727)调配的胶囊,在水中的溶出度随着时间推移而降低。在模拟胃液(ph1.2,胃蛋白酶)中在40℃/75%rh下6个月之后,dgla释放速率大于30分钟。仅用含有较低分子量(mw)的石灰骨明胶的胶囊,在模拟胃液(ph1.2,胃蛋白酶)中在40℃/75%rh下6个月之后,dgla释放速率小于30分钟(e09777/02)。在含有甘油的dgla胶囊壳中,dgla甘油酯形成随时间推移而显著增加(表9)。这与温度有关,在40℃75%rh下形成的dgla浓度最高。聚山梨醇通常用作亲水性增塑剂,以限制胶囊填充介质与壳之间的交换。d-山梨糖醇和1,4-脱水山梨糖醇的mw比甘油更高,这限制了其通过明胶壳的移动性。尽管如此,在批次e097771/2和3中,d-山梨糖醇和1,4-脱水山梨糖醇仍然相互作用形成dglaffa酯。用d-山梨糖醇和1,4-脱水山梨糖醇调配的批次(e097771/02/3)的dgla酸值没有降低,而用甘油调配的e09778的酸值降低。用d-山梨糖醇和1,4-脱水山梨糖醇调配的胶囊(e09777/03)在水中的溶出度不会随时间推移而减慢。在3个月40℃/75%rh之后,dgla在水中的释放速率小于30分钟。实例2进行随机、安慰剂对照、双盲、平行组、多中心3组2b期研究,以研究口服施用的含有dgla(ds107)的胶囊的功效以及在18岁及以上的特应性皮炎(ad)患者中ds107胶囊与安慰剂之间剂量-应答关系。研究医药产品(imp):ds107胶囊和安慰剂胶囊将用于本研究。每个ds107胶囊含有500mgdgla作为不透明卵形软明胶胶囊中的活性成分。每个匹配的安慰剂胶囊含有在不透明的卵形软明胶胶囊中的500mg液体石蜡。ds107胶囊将以制造形式,包装在28单位的冷成型铝箔泡罩中进行供应(盲法)。安慰剂将呈现于相同的泡罩和包装中并且与ds107胶囊相同地储存/包装。研究药物将根据美国法规进行标记。研究目标包含:·功效目标:功效目标是比较口服施用的ds107与安慰剂在患有中度到重度ad的成年患者的治疗中的功效。·安全性目标:安全性目标是评估口服施用的ds107与安慰剂在患有中度到重度ad的成年患者中的安全性。研究终点包含:·主要目标:本研究的主要目标是在第8周,与安慰剂群体相比,在经处理的群体中实现研究者的整体评估(iga)为0(澄清)或1(几乎澄清)并且iga降低至少2个点的患者的比例。·次要目标:本研究的次要目标如下:ο与基线到第2周、第4周、第6周和第10周的安慰剂群体相比,在经处理的群体中iga评分为0(澄清)或1(几乎澄清),并且iga降低至少2个点的患者的比例;ο与基线到第2周、第4周、第6周、第8周和第10周的安慰剂群体相比,在经处理的群体中实现iga降低至少2个点的患者的比例;ο在第2周、4周、6周、8周和10周,与安慰剂群体相比,在经处理的群体中的湿疹面积和严重程度指数(easi)相对于基线的变化;并且ο在第2周、第4周、第6周、第8周和第10周,与安慰剂群体相比,在经处理的群体中的瘙痒的数值评级量表(nrs)相对于基线的变化。·探索性终点:本研究的探索性终点如下:ο在第2周、第4周、第6周、第8周和第10周,与安慰剂群体相比,在经处理的群体中的皮肤学生命质量指数(dlqi)评分相对于基线的变化。ο在第2周、第4周、第6周、第8周和第10周,与安慰剂群体相比,在经处理的群体中的面向患者的湿疹测量(poem)评分相对于基线的变化。ο在第2周、第4周、第6周、第8周和第10周,与安慰剂群体相比,在经处理的群体中的患者整体严重程度印象(pgi-s)评分相对于基线的变化。ο在第2周、第4周、第6周、第8周和第10周,与安慰剂群体相比,在经处理的群体中的患者整体变化印象(pgi-c)评分相对于基线的变化。ο在基线/第0天、第4周、第8周和第10周,与安慰剂群体相比,在经处理的群体中的血浆dgla浓度(样品将被保留并且稍后对其进行分析以用于潜在分析)。ο在基线/第0天和第8周确定ad生物标志物(样品将被保留并且稍后对其进行分析以用于潜在分析)。研究设计:通常,所有患者签署知情同意书并且经历研究合格性的筛选。在基线访视时,将患者随机化(1:1:1)以接受2gds107、1gds107或安慰剂,每天一次,持续8周。在研究期间,患者7次来到诊所:筛选/第1次访视、基线/第2次访视、第2周/第3次访视、第4周/第4次访视、第6周/第5次访视和/第8周/第6次访视(治疗结束)和第10周/第7次访视(随访)。记录早期退出研究的患者的早期终止访视。所有患者在第10周访视时退出(即,完成)研究。在筛选访视时,在给予参与的知情同意之后,使用筛选检查对患者进行评估。招募满足纳入标准和不满足排除标准的患者。在图1中提供了研究的总体时间范围的示意图,其中od是指每天一次。在比较治疗期开始之前,将患者返回到部位以进行患者疾病的基线评估,并且将合格患者以1:1:1随机化随机分配到三个平行组治疗方案之一:·治疗组a:每日一次施用1gds107(2个ds107胶囊和2个安慰剂胶囊),持续8周。·治疗组b:每日一次施用2gds107(4个ds107胶囊),持续8周。·治疗组c:每日一次口服施用安慰剂(4个安慰剂胶囊),持续8周。为了保持双盲条件,ds107胶囊和安慰剂胶囊的外观是相同的。与用于ad(例如,类固醇)的其它口服治疗不同,ds107胶囊的治疗效果不是在治疗开始后立即预期发生的,而是随着时间推移而持续增加,在4-6周的时间段内达到其最大效果。因此,尽一切努力来继续用ds107治疗至少4周,以确定ds107的功效。因此,替换了由于在治疗的前4周内明显缺乏功效而不愿意继续参与研究的患者。一旦患者被纳入研究,就限制患者使用除了润肤剂之外的任何其它ad治疗。任何药物(即,处方以及非处方(otc)药物)或治疗干预被认为对于患者而言是必需的,并且在研究者看来不会干扰安全性和功效评估,允许患者继续使用,除非其被包含在以下详述的“伴随性药物”的列表中。患者和筛选:本研究中的参与者需要满足以下纳入标准并且必须未满足任何以下排除标准。另外,如果患者没有任何亚临床感染,则仅允许对患者进行本研究筛选,这通过在筛选1个月内嗜酸性粒细胞计数低于0.3×109/l的存在来指示。在筛选访视(第1次访视)和在治疗/基线访视(第2次访视)开始时验证纳入标准和排除标准。患者来源:研究群体由年龄为18岁或以上的确诊为ad的男性和女性患者组成。纳入标准:考虑参与研究的所有受试者都需要满足以下纳入标准:·根据以下讨论的哈尼芬(hanifin)和拉杰卡(rajka)标准,临床确诊为活性ad的患者。·在基线时具有中度到重度ad的如由在基线时研究者的整体评估(iga)为最小3所定义的患者。·在筛选和基线时湿疹面积和严重程度指数(easi)评分≥12的患者。·患有在基线时覆盖体表面积的最小10%的ad的患者。·在研究者看来,研究前临床实验室发现不干扰其参与研究的患者。·在整个研究中能够并愿意停止所有当前ad治疗的患者(除了允许的润肤剂之外)。·在基线之前至少7天应用bd的服用稳定剂量的温和润肤剂的患者(每天两次)。·在签署知情同意书(icf)当天,年龄为18岁及以上的男性或女性患者。·女性患者和具有潜在生育能力的女性伴侣的男性患者必须使用足够的避孕或在研究期间具有无菌伴侣。其中适当的避孕方法定义为:系统性激素避孕药、宫内避孕装置或屏障避孕方法结合杀精子剂或同意性禁欲。如果患者正使用激素避孕药,则其必须在基线之前服用稳定剂量至少一个月。排除标准:本研究的排除标准如下:·患有可能干扰ad诊断和/或评估的其它皮肤病状的患者,如牛皮癣或当前活性病毒、细菌和真菌皮肤感染。这些条件由研究者评估。·在基线访视之前(即,第0天)不到4周已使用可能影响ad的系统性治疗(除了生物制剂之外)的患者。这些系统性治疗可以包含例如类视黄醇、甲氨蝶呤、环孢菌素、羟基脲(hydroxycarbamide)(羟基脲(hydroxyurea))、硫唑嘌呤和口服/可注射皮质类固醇。然而,允许用于稳定医疗病状的鼻内皮质类固醇和吸入皮质类固醇。·在开始治疗/基线(第0天)前两周已使用任何局部药物治疗ad的患者,包含但不限于局部皮质类固醇、焦油和漂白剂。·在基线前两周使用含有尿素、神经酰胺或透明质酸的局部产品的患者。·在基线的2周内使用抗组胺剂用于ad的患者。可以在整个研究中使用用于其它适应症的非镇静性抗-组胺剂,条件是患者在基线前4周内服用稳定剂量。·存在活性或慢性过敏反应的患者,如通过在筛选访视时嗜酸性粒细胞>0.3×109/l确定的不规则白细胞计数所证明。·已经过度暴露于阳光、在基线之前四周使用日光浴浴房或其它紫外(uv)光源和/或计划去阳光明媚的气候旅行或在筛选与随访之间使用日光浴浴房或其它uv源的患者。·对ds107胶囊或安慰剂胶囊中的任何物质具有超敏史的患者。·具有任何临床上显著的受控的或不受控的医疗病状或实验室异常的患者,在研究者看来,所述医疗病状或实验室异常将使患者处于不适当的风险或干扰研究结果的解释。·具有肾或肝功能的临床上显著的损伤的患者。·患有显著不受控的心血管、神经、恶性、精神性、呼吸道或高血压疾病,以及不受控的糖尿病和氟利特关节炎(floridearthritis)或在研究者看来可能干扰研究完成的任何其它疾病的患者。·患有慢性感染性疾病的患者。慢性感染性疾病的实例是乙型肝炎、丙型肝炎或人免疫缺陷病毒感染。·在基线前最后一年中,在研究者看来具有临床上显著的药物或酒精滥用史的患者。·在施用研究治疗的第一天前3个月内使用研究药物已参与任何其它临床研究的患者。·根据以下用生物制剂进行治疗的患者:(a)在筛选访视前6个月内,或直至淋巴细胞计数恢复正常(以较长者为准)用细胞耗竭剂(包含但不限于利妥昔单抗(rituximab))进行的任何治疗,(b)在筛选访视前6个月内,用影响细胞增殖的其他生物制剂进行的任何治疗。·怀孕、计划怀孕、母乳喂养和/或不愿在试验期间使用足够避孕的患者。·在研究者看来,不适合参与研究的患者。研究方案:在研究期间,在筛选访视后至少一周安排对临床的六次访视:在比较治疗期/基线(第0天/第2次访视)开始时安排一次访视,并且在比较治疗期中安排五次访视。这五次访视表示为:第2周/第3次访视、第4周/第4次访视、第6周/第5次访视和第8周/第6次访视。另外,如果患者决定不完成研究,则在第8周/第6次访视后两周或在参加最终访视后两周进行最终安全性随访(表示为第7次访视)。在筛选访视后最近30天进行基线访视。要求早期中断研究的患者尽可能快参加研究部位,使得在早期终止访视时可以进行安排用于第8周/第6次访视的评估。在研究前患者接受ad治疗的情况下,可能需要长达4周的洗出期(washoutperiod)。在筛选访视时和在已经给予参与的知情同意之后,使用筛选检查对患者进行评估。使用如下所述的哈尼芬和拉杰卡标准确认患者患有ad,并且将在基线访视时不满足排除标准的患者招募到研究中。在治疗期和随访期期间,限制患者使用用于ad的任何其它治疗,除了患者在基线访视时一直使用的相同润肤剂之外。任何药物,如处方以及非处方药物或治疗干预被认为对于患者而言是必需的,并且在研究者看来不会干扰患者的安全性和功效评估,允许患者继续使用。下面定义了“排除在研究之外的药物和治疗方案”的列表。本研究的临床访视提供于下表13中。表13:临床访视研究流程图1fsh要求,以确认已经停止月经至少12个月的大于40岁妇女的女性不具有潜在生育能力。不具有潜在生育能力也可以在未确认fsh水平的情况下通过停止月经至少24个月来确认。2仅当在第8周记录实验室ae时。在那种情况下,仅应重新测试作为ae原因的样品。3身体检查将是症状定向的,根据章节9.2.2。4在第8周访视前一天,将指示患者服用其最后的研究药物剂量。5nrs/润肤剂使用将通过iwrs由患者电子地捕获。患者还可以使用论文来记录这些评估。6ae的收集将在第一次研究药物施用后开始。筛选访视(第1次访视):在筛选访视期间,一旦患者提供知情同意,就进行和/或获得以下筛选程序/评估:·人口统计学数据;·医疗/外科手术史;·评估纳入/排除标准;·哈尼芬和拉杰卡标准审查;·用于临床实验室安全性测试的样品,如血液学、血清生物化学、尿分析和促滤泡素(fsh)水平的评估(当适用时);·用于怀孕测试的样品(仅当女性患者具有潜在生育能力时);·生命体征,如血压、心率和体温的评估;·身体检查;·体质指数;·体表面积;·研究者的整体评估;·湿疹面积和严重程度指数(easi);·nrs瘙痒评估;以及·伴随性用药评估。当患者由于不良事件(ae)而需要在预定访视日期之间进行访视、难以符合研究方案要求或其疾病状态发生显著变化时,发生非预定访视。治疗期:在完成成功的筛选访视后,患者开始比较治疗期,总共8周。在比较治疗期开始时和在持续合格性得以确认之后,在基线访视(访视2)时将患者随机分配到三种治疗方案之一(即,1g的ds107、2g的ds107或安慰剂)。在治疗期开始时,指导患者服用4粒研究医药产品(imp)胶囊,所述胶囊含有1g的ds107、2g或ds107或安慰剂,这与治疗方案一致。尽一切努力确保imp施用在每天同一时间进行。当患者由于不良事件(ae)而需要在预定访视日期之间进行访视、难以符合研究方案要求或其疾病状态发生显著变化时,发生非预定访视。基线(第2次访视):在第2次访视时,确保关于疾病严重程度的所有纳入相对于筛选访视保持不变。进行这一步骤以便排除自从筛选访视以来对润肤剂使用有反应的那些患者。在第2次访视期间,进行和/或获得以下筛选程序/评估:·验证纳入/排除标准;·哈尼芬和拉杰卡标准审查;·患者随机化·用于临床实验室安全性测试的样品,如血液学、血清生物化学和尿分析的评估;·药代动力学采样;·生物标志物采样;·生命体征,如血压、心率和体温的评估;·身体检查;·体质指数;·分配研究药物;·分配患者依从性日志;·体表面积;·研究者的整体评估;·湿疹面积和严重程度指数(easi);·nrs瘙痒评估;·皮肤病生活质量指数(dlqi)调查表;·面向患者的湿疹测量;·患者整体严重程度印象调查表;·患者整体变化印象调查表;以及·伴随性用药评估。ds107或安慰剂的第一次施用是在第2次访视之后进行的。此后,每日一次施用ds107胶囊或安慰剂药物,并且每天在同一时间,在食物消耗后大约2小时施用imp。从基线到随访在每日的基础上捕获用于评估瘙痒的nrs。从访视到随访在每日的基础上捕获润肤剂使用。ae的收集是在第一次施用imp之后开始的。第2周(第3次访视):在第3次访视期间,在第2周/第3次访视时患者返回到研究部位并且进行和/或获得以下筛选程序/评估:·生命体征,如血压、心率和体温的评估;·身体检查;·分配研究药物;·收集研究药物;·分配患者依从性日志;·收集和审核患者依从性日志;·imp可计量性;·体表面积;·研究者的整体评估;·湿疹面积和严重程度指数(easi);·nrs瘙痒评估;·皮肤病生活质量指数(dlqi)调查表;·面向患者的湿疹测量;·患者整体严重程度印象调查表;·患者整体变化印象调查表;·伴随性用药评估;以及·ae评估。每天在同一时间,在食物消耗后大约2小时继续施用imp。从基线到随访在每日的基础上捕获用于评估瘙痒的nrs。从访视到随访在每日的基础上捕获润肤剂使用。第4周(第4次访视):在第4次访视期间,进行和/或获得以下筛选程序/评估:·药代动力学采样;·生命体征,如血压、心率和体温的评估;·身体检查;·分配研究药物;·收集研究药物;·分配患者依从性日志;·收集和审核患者依从性日志;·imp可计量性;·体表面积;·研究者的整体评估;·湿疹面积和严重程度指数(easi);·nrs瘙痒评估;·皮肤病生活质量指数(dlqi)调查表;·面向患者的湿疹测量;·患者整体严重程度印象调查表;·患者整体变化印象调查表;·伴随性用药评估;以及·ae评估。每天在同一时间,在食物消耗后大约2小时继续施用imp。从基线到随访在每日的基础上捕获用于评估瘙痒的nrs。从访视到随访在每日的基础上捕获润肤剂使用。第6周(第5次访视):在第5次访视期间,进行和/或获得以下筛选程序/评估:·生命体征,如血压、心率和体温的评估;·身体检查;·分配研究药物;·收集研究药物;·分配患者依从性日志;·收集和审核患者依从性日志;·imp可计量性;·体表面积;·研究者的整体评估;·湿疹面积和严重程度指数(easi);·nrs瘙痒评估;·皮肤病生活质量指数(dlqi)调查表;·面向患者的湿疹测量;·患者整体严重程度印象调查表;·患者整体变化印象调查表;·伴随性用药评估;以及·ae评估。每天在同一时间,在食物消耗后大约2小时继续施用imp。从基线到随访在每日的基础上捕获用于评估瘙痒的nrs。从访视到随访在每日的基础上捕获润肤剂使用。第8周(第6次访视)/治疗结束或早期终止:在第6次访视期间,服用最后剂量的ds107或安慰剂,并且进行和/或获得以下筛选程序/评估:·用于临床实验室安全性测试的样品,如血液学、血清生物化学和尿分析;·药代动力学采样;·生物标志物采样;·用于怀孕测试的样品(仅当女性患者具有潜在生育能力时);·生命体征,如血压、心率和体温的评估;·身体检查;·体质指数;·收集研究药物;·收集和审核患者依从性日志;·imp可计量性;·体表面积;·研究者的整体评估;·湿疹面积和严重程度指数(easi)·nrs瘙痒评估;·皮肤病生活质量指数(dlqi)调查表;·面向患者的湿疹测量;·患者整体严重程度印象调查表;·患者整体变化印象调查表;·伴随性用药评估;以及·ae评估。从基线到随访在每日的基础上捕获用于评估瘙痒的数值评定量表(nrs)。从访视到随访在每日的基础上捕获润肤剂使用。在完成此次访视时,建议需要在第7次访视返回到研究部位的患者评估自此次访视以来的任何ae并且进行安全性和功效评估。第10周(第7次访视)/随访:在第6次访视后或早期退出访视的两周,进行和/或获得以下筛选程序/评估:·用于临床实验室安全性测试的样品,如血液学、血清生物化学和尿分析。然而,只有当患者在第8周/第6次访视时在安全性实验室结果中表现出相对于基线的临床显著变化时,才获得这些样品;·药代动力学采样;·生命体征,如血压、心率和体温的评估;·身体检查;·体表面积;·研究者的整体评估;·湿疹面积和严重程度指数(easi);·nrs瘙痒评估;·皮肤病生活质量指数(dlqi)调查表;·面向患者的湿疹测量;·患者整体严重程度印象调查表;·患者整体变化印象调查表;·伴随性用药评估;以及·ae评估。评估这项研究的评估如下:功效评估:包含以下功效评估:研究者整体评估(iga):ad的临床严重程度由研究者在每次访视时使用下表14中提供的iga量表进行评估。表14iga量表基于从清晰疾病到严重疾病的5分制严重程度量表给予0-4的评分(0=清晰,1=几乎清晰,2=轻度疾病,3=中度疾病,4=严重疾病)。iga还使用红斑、浸润、丘疹和渗出/结痂的临床特性作为总体严重程度评估的评分指南。在每次访视时对iga进行评估。湿疹面积严重程度指数(easi):在筛选、基线/第2次访视、第2周/第3次访视、第4周/第4次访视、第6周/第5次访视、第8周/第6次访视/et和第10周/第7次访视(即,随访)时对easi进行评估。easi基于病灶严重程度和受影响的bsa的百分比来对患者的ad的严重程度进行定量。easi是范围为0-72的综合评分,考虑到了四个身体区域中的每一个的红斑、硬结/丘疹、表皮脱落和苔藓化的程度(各自评分分别为0到3),调整了每个身体区域涉及的bsa百分比以及身体区域在整个身体中所占的比例。下面提供了easi评分计算的详细程序。如检查当天所看到的,对四个解剖部位—头部、上肢、躯干和下肢—进行红斑、硬结(丘疹)、表皮脱落和苔藓化的评估。使用4分制(所允许的半分制)量表对每个体征的严重程度进行评估:·0=无·1=轻度·2=中度·3=重度在给定的解剖部位内受ad影响的区域被估计为解剖部位的总面积的百分比,并且根据ad累及的程度分配数值,如下:·0=未累及·1=<10%·2=10到29%·3=30到49%·4=50到69%·5=70到89%·6=90到100%easi评分是通过使用下式获得的:easi=0.1(eh+ih+exh+lh)ah+0.2(eu+iu+exu+lu)au+0.3(et+it+ext+lt)at+0.4(el+il+exl+ll)al在此式中,e、i、ex、l和a分别表示红斑、硬结、表皮脱落、苔癣化和面积,并且h、u、t和l分别表示头部/颈部、上肢、躯干和下肢。瘙痒nrs:每日由患者使用nrs对与ad相关的瘙痒的严重程度进行自我评估。要求患者在过去24小时内估计瘙痒最严重时的强度。瘙痒nrs是单一问题评估工具,其用于评估患者在过去24小时内由于ad引起的最严重发痒。患者因ad引起的瘙痒评分为0-10的量表,其中0(无发痒)和10(可想象的最严重发痒)。患者在筛选时完成评定量表,并且然后每日从基线开始直到最后一次研究访视。体表面积(bsa):在每次访视时对受ad影响的总体bsa(0到100%)进行评估。患者的手掌占其总体bsa的1%。皮肤病生活质量指数(dlqi)调查表:将由患者在基线/第2次访视、第2周/第3次访视、第4周/第4次访视、第6周/第5次访视、第8周/第6次访视/et和随访第10周/第7次访视时使用dlqi对ad对患者生活质量的影响进行自我评估。基于患者根据以下量表对十个问题的应答,dlqi的最大值为三十:·非常大=3·很多=2·少量=1·根本不=0·不相关=0·未回答的问题=0·问题7:“预防工作或学习”=3使用以下调查表确定dlqi:面向患者的湿疹测量(poem):除了筛选访视之外,在每次访视时对poem进行评估。poem是患者对疾病严重程度的自我评估。基于患者根据以下量表对七个问题的应答,poem的最大值为二十八:·没有天数=0·1-2天=1·3-4天=2·5-6天=3·每天=4使用以下调查表确定poem:患者整体严重程度印象(pgi-s):自我报告pgi-s是可以用于对具体病状(即,单状态量表)的严重程度进行评级的整体指数。pgi-s是临床医生可直观理解的简单、直接、易于使用的量表。pgi-s涉及向患者询问单个问题并且对其ad现在如何在1(正常皮肤)到4(严重)的量表上进行评级。由患者在基线/第2次访视、第2周/第3次访视、第4周/第4次访视、第6周/第5次访视、第8周/第6次访视/et和随访第10周/第7次访视时对pgi-s进行评估。患者整体变化印象(pgi-c):自我报告测量pgi-c反映患者关于治疗功效的信念。pgi-c是描绘了患者的总体改善评级的7分制量表。患者将其变化评级为“改善得非常多”、“改善得多”、“最低程度改善”、“无变化”、“最低程度恶化”、“恶化得多”或“非常恶化”。由患者在基线/第2次访视、第2周/第3次访视、第4周/第4次访视、第6周/第5次访视、第8周/第6次访视/et和随访第10周/第7次访视时对pgi-c进行评估。安全性评估:研究者或被指定者在筛选访视(第1次访视)时对患者的病史进行完整审查,以确保没有满足排除标准。必须报告任何伴随性疾病,无论研究者是否认为与研究相关。在可能的情况下,应当注意诊断日期或病状的持续时间。根据当地实践,研究者在每次访视时根据研究流程图(参见表13)进行身体检查。这种检查是症状定向的,即除非由患者指示,否则不评估身体系统的标准组。例如,如果患者向研究者报告“皮疹”的存在,则对皮肤进行评估。然而,除非临床上保证,否则不需要对另外的身体系统进行评估。应记录任何临床上显著的异常结果。进一步地,将与基线检查相比的身体检查的发现的变化记录为ae。在每次访视时根据研究流程图(参见表13)进行生命体征测量。测量包含:·血压:将作为仰卧(在静息至少5分钟之后)收缩压和舒张压(以mmhg计)进行·心率:静息时获取(以bpm计)·温度:将根据临床实践获取。温度和路径将记录在crf中。在获取任何血液样品之前进行生命体征测量。所有新发现或先前发现的被认为是临床上显著的变化被记录为ae。临床实验室测试包含以下血液学、血清生物化学和尿分析。对于临床实验室安全性测试,根据研究流程图(参见表13)采集血液和尿样品用于常规血液学、血清生物化学和尿分析测试。表15:临床实验室安全性测试如果需要卵泡刺激激素(fsh)测试来确认不具有潜在生育能力,则仅在筛选时进行这一测试。对于具有潜在生育能力的女性患者,根据研究流程图(参见表13),在筛选和第8周/第6次访视/et访视时进行怀孕测试。收集体重(kg)和身高(cm)以计算bmi(kg/m2),并且在筛选/第1次访视、基线/第2次访视和第8周/第6次访视/et时记录。在筛选访视时仅记录一次身高,并且在基线/第2次访视和第8周/第6次访视时使用同一值进行bmi计算。在基线/第2次访视、第4周/第4次访视、第8周/第6次访视/et和第10周/第7次访视/随访时,根据研究流程图(参见表13),通过直接静脉穿刺收集用于药代动力学(pk)分析的血液样品。生物标志物采样:在基线/第2次访视和第8周/第6次访视/et时,根据研究流程图(参见表13),通过直接静脉穿刺收集血液样品。任何药物,如处方以及otc药物、维生素和抗酸剂或被认为对于患者而言是必需的治疗干预,并且在研究者看来不会干扰安全性和功效评估,患者可以继续使用,除非其被包含在以下概述的“排除在研究之外的药物和治疗方案”的列表中。记录筛选(第1次访视)之前30天内直到完成(第7次访视)使用的任何药物、草药药物、天然健康补救剂和营养补充剂。还记录药物的通用名称(即,非本地商品名称)以及开始日期、停止日期、剂量、途径、方案和指示。在研究期间,在常规基础上更新任何新药物或对预先存在的药物的剂量或方案的改变。在研究的整个时间段期间,研究性新药物(即,未在本地市场上销售的药物)未与imp共同施用。在这项研究期间的所允许的疗法如下:所有患者应用其选择的温和润肤剂,在基线/第0天之前至少7天开始,在其皮肤上每天应用两次,包含ad病灶。在整个研究过程中,需要以同一频率和同一皮肤区域继续使用润肤剂。要求患者避免使用含有对ad具有影响或可能对ad具有影响的任何活性成分的润肤剂,所述润肤剂包含以下成分:·尿素·神经酰胺·透明质酸在整个研究过程中尽一切努力保持同一润肤剂。记录一种或多种所选润肤剂的商业名称,以及频率和数量。患者还根据临床工作人员的指示每天记录其润肤剂使用。在研究期间,不得将其它产品应用于病灶。其它所允许的疗法:只有当用于治疗除了ad之外的医疗病状时,在研究期间允许使用非镇静性抗组胺剂(例如,氯雷他定(loratadine)、非索非那定(fexofenadine))。只有当患者在基线/第0天之前已经服用稳定剂量至少4周并且在整个研究中每天继续使用同一药剂时,才在研究期间允许使用此类药物。允许用于稳定的医疗病状的吸入的和鼻内的皮质类固醇。在研究中排除使用药物和治疗方案:·可以影响ad的局部药物治疗,包含但不限于:·局部皮质类固醇·焦油·漂白剂,以及·含有尿素、神经酰胺或透明质酸的任何局部产品。可以影响ad的系统性疗法,例如类视黄醇、甲氨蝶呤、环孢菌素、羟基脲(羟基脲)、硫唑嘌呤和口服/可注射皮质类固醇;用于ad的抗组胺剂;任何生物制剂;uv-a或uv-b光疗法;补骨脂素+紫外线a(puva)疗法;日光浴浴房的使用;任何其它研究医药产品;或用于治疗ad的中药、草药提取物和补充剂。要求患者在整个研究过程中避免到阳光明媚的气候的任何旅行或使用鞣制设备、桑拿浴和游泳。在试验开始的4周内和试验期间,将禁止广泛的uv暴露或uv-b装置。在整个研究中指导患者放弃使用可能影响ad的任何药物/治疗(参考排除标准和禁止疗法或程序部分)。需要在消耗食物后2小时向患者施用药物。可以照常服用用于研究中所允许的其它病状的一种或多种药物。研究医药产品/研究药物:剂量和施用这项研究涉及ds107(2g和1g)与安慰剂的比较,每日一次口服施用,持续8周的总持续时间。最后一次研究药物施用应当在第8周(第6次访视)/早期终止(et)访视之前的那天进行。患者将以1:1:1的比率随机分配到三个治疗组之一:·治疗组a:每日一次施用1gds107(2个ds107胶囊和2个安慰剂胶囊),持续8周·治疗组b:每日一次施用2gds107(4个ds107胶囊),持续8周·治疗组c:每日一次口服施用安慰剂(4个安慰剂胶囊),持续8周需要在消耗食物后2小时向患者施用药物。可以照常服用用于研究中所允许的其它病状的一种或多种药物。泡罩包装将由7排的4个胶囊组成,其中每个工作日都是详细的。每排构成一个剂量。将指示患者在相关日期从左到右服用4个胶囊,如图9所示:为了在整个研究期间保持盲法,ds107胶囊和安慰剂胶囊的外观将是相同的。患者将每日一次口服施用ds107或安慰剂,持续8个连续周。不良事件和严重不良事件不良事件(ae):对于已经服用其第一剂量的研究药物的患者发生的任何不期望的经历,无论是否被认为与一种或多种研究性imp相关。严重不良事件(sae):如果患者在第一剂量的研究药物之后经历严重不良事件,则事件将被记录为严重不良事件。严重不良事件(经历)或反应是任何不适当的医学事件,其在任何剂量下:·导致死亡;·威胁生命;·需要住院或现有住院治疗延长;·导致持久或显著的残疾/无行为能力,或·是先天性异常/出生缺陷。在“严重”的定义中的术语“威胁生命”是指其中患者在事件发生时处于死亡风险的事件。其并不是指假设如果其更严重的话,则可能已经引起死亡的事件。医学和科学判断应当在决定在其它情形下加速报告是否适当时进行,如可能不会立即威胁生命或导致死亡或住院治疗,但可能危及患者或可能需要干预以防止以上定义中列出的其它结果之一的重要医疗事件。这些通常也应该被认为是严重的。这种事件的实例是在急诊室或家中进行强化治疗的过敏性支气管痉挛、不会导致住院治疗的血质不调或抽搐或药物依赖性或药物滥用的发展。严重程度:ae的强度是由研究者基于他或她的临床经验做出的事件的相对严重程度的估计。使用以下定义来评级ae的严重程度:·轻度:不良事件是短暂的并且容易耐受的。·中度:不良事件引起患者不适并且中断患者的惯常活动。·重度:不良事件对患者的惯常活动造成相当大的干扰,并且可能使患者丧失能力或威胁生命的。与imp的关系研究者将建立ae与实验处理的因果关系。研究者应当考虑患者的病史、最近的身体检查结果和伴随性药物。将使用以下定义来确定ae的因果关系:·不相关:相对于实验处理,ae开始的时间关系是不合理的或者另一个原因可以解释ae的发生。·相关:相对于实验处理,ae开始的时间关系是合理的,遵循对处理的已知应答模式,并且替代性原因是不可能的。报告ae和sae:必须将所有ae记录在案件报告表中,从而定义与imp和严重程度的关系。应该一直记录每个ae的频率,以指示事件是否是间歇的、连续的、一次性事件等。如果同一ae以大约同一强度在同一患者中重复发生,则此ae应仅计数一次。如果ae的任何方面发生改变(包含但不限于严重程度、频率、因果关系),则应记录新的ae。严重的不良反应和出乎意料的不良反应:不良反应:对与任何剂量相关的医药产品的所有有害的且非预期的应答应当被认为是不良药物反应。短语“对医药产品的应答”意指药品与不良事件之间的因果关系是至少合理的可能性,即不能排除这种关系。对于市售的医药产品,不良反应是对有害的且非预期的药物的应答,并且所述应答以人通常用于疾病的预防、诊断或疗法或用于改变生理功能的剂量发生。出乎意料的不良反应:不良反应,其性质或严重程度与适用的产品信息不一致疑似出乎意料的严重不良反应(susar):可能与imp相关并且根据以上定义是出乎意料的任何严重不良反应。治疗失败和ae的区分:ad症状的改善的缺乏不是ae并且应当被认为是治疗失败。怀孕报告:如果患者或患者的伴侣在研究期间怀孕,则患者应尽可能快地通知研究部位。在确认怀孕后,患者必须从研究药物中退出但可以继续研究参与。应进行治疗后随访以确保患者的安全性。怀孕本身不是ae或sae,然而母体/胎儿并发症或异常将视情况记录为ae或sae。样品大小的估计:在2a期试验中,对于ds107和安慰剂分别观察到21.6%和11.8%的iga应答率。假设这些比率和5%的显著性,300名可评估患者(每治疗组100名患者)将在本研究中产生45%的功效用于活性剂量与安慰剂之间的比较。中期分析:一旦50%的计划患者已完成其第8周评估,将进行中期分析。分析群体·登记群体:登记群体由签署知情同意书的所有患者组成。·筛选失败:筛选失败是来自登记群体的不满足合格性要求的并且在进行随机化之前从研究中退出的患者。·随机化群体:随机化群体由随机分配到研究的所有患者组成。·安全性分析组(sas):安全性分析组(sas)由接受至少一个剂量的药物的所有患者组成。saf是所有安全性终点的分析群体。将根据患者接受的实际治疗进行分析。·全分析组(fas):全分析组(fas)由随机分配到研究并且接受至少一个剂量的研究药物的所有患者组成。fas是功效终点的主要分析群体。将根据患者被随机分配到的治疗进行分析。·符合方案集(pps):符合方案集(pps)是在没有任何重大违反情况的情况下完成研究的fas的子集。在数据盲审会议(bdrm)上进行数据库锁定之前,将以盲法方式对每个患者的方案违反情况进行评估,并且还将在此会议期间最终确定pps。pps是功效终点的支持性分析群体。将根据患者被随机分配到的治疗进行分析。安全性分析:将列出每名患者的人口统计学、病史和身体检查数据并进行描述性总结。在研究期间记录的所有ae将使用当前版本的监管活动医学词典(medicaldictionaryforregulatoryactivities,meddra)被编码为系统器官类别和优选术语。ae将通过治疗、与治疗的关系和严重程度来制表和总结。每名患者的临床实验室值(血液学、生物化学和尿分析)将按治疗和天数列出。实验室正常范围之外的值将与关于其临床显著性的相关评论分开列出,其中通过治疗突出并总结潜在地临床上显著的异常。将在给药之前获得的临床实验室值定义为基线值。列出每次治疗和每天的生命体征的个体值并且对其进行描述性总结。药代动力学分析:将dgla的血浆浓度进行制表并且对其进行描述性总结。dgla的单个和平均血浆浓度-时间曲线将用以图形方式呈现。主要变量:主要变量将是在第8周实现iga评分为0(清晰)或1(几乎清晰)并且iga从基线降低至少2个点的患者的比例。将使用广义线性混合模型(glmm)对主要终点进行分析,其中治疗组和基线iga值作为因子,其中访视治疗相互作用项作为随机效应以解决缺失数据。主要分析将基于fas,并且对于pps重复作为支持性敏感性分析。在处理缺失数据时,主要统计分析假设“随机缺失(mar)”。在mar假设下获得的治疗效果基本上是如果所有患者已经完全遵守治疗则可能已经达到的治疗效果,或者换言之,如果患者按指导服用药物,则患者可能达到预期的效果。这有时被称为“法律上(dejure)”或“功效”被估量。由于在实践中缺乏完美的依附性,因此也将估计“实际上(defacto)”或有效性治疗效果。这种被估量包含关于当患者中断治疗时可能预期发生的治疗效果的假设。carpenter等人描述的跳转到参考方法(《生物制药统计学杂志(jbiopharmstat)》,2013;23(6):1352-71)将用于使用安慰剂组作为参考估计实际上被估量。这是基于以下假设:中断研究药物的患者不具有适合于长期使用的替代性口服治疗选项,并且因此所述患者的应答可能恢复到安慰剂组的那些应答。对于缺失数据的敏感性分析将仅在fas上进行。次要变量:还将使用glmm模型对其它时间点的iga应答者进行分析。连续功效变量及其相对于基线的变化将通过每个治疗组和访视的描述性统计学进行总结。这应用于瘙痒的iga、easi、nrs评分、dlqi、poem、pgi-s和pgi-c。将使用重复测量的混合模型(mmrm)对相对于基线终点的变化进行分析,其中治疗组作为因子并且基线值作为协变量,并且其中访视治疗相互作用项作为重复效应以解决缺失数据。次要功效分析将仅基于fas。安全性变量:不良事件的类型和频率将通过每治疗组的meddra系统器官类别和优选术语进行总结。另外,将总结每治疗组具有至少一个不良事件的患者的数量和比例。每治疗组将总结经历严重不良事件、导致退出的不良事件以及可能或很可能与治疗相关的不良事件的患者的数量和比例。次要安全性分析将仅基于安全性分析组。监测/质量控制:将在研究期间以规律的间隔进行监测访视。进行监测访视,以确保方案依附性、数据质量、ecrf中的条目的准确性、药物可计量性、符合监管要求和研究部位及其设施的持续充分性。所有临床数据将在临床数据库锁定之前进行质量控制检查。然后将对适当的数据库执行编辑检查作为使用检查缺失数据、数据不一致性、数据范围等的验证例程。试验结束:试验结束被定义为最后一名受试者最后一次访视(lslv)。lslv被定义为研究者审查最后一名受试者的安全性数据并确定受试者无需进一步评估而完成试验的日期。特应性皮炎的诊断特征(哈尼芬和拉杰卡标准):患者必须已经基于哈尼芬和拉杰卡诊断标准确诊为ad。对ad的确切诊断需要存在下述主要标准中的至少三个主要标准。除了具有三个主要标准之外,患者应表现出特异性较低或相对罕见的三个次要标准。主要标准:·瘙痒·影响成人弯曲表面和婴儿和儿童面部和伸肌的皮炎·慢性或复发性皮炎·皮肤或呼吸道特应性(哮喘、过敏性鼻炎、ad)的个人或家族史。次要标准可以分为4类:·面部特征:面部苍白、面部红斑、色素减退斑块、眼睑下暗、眼睑下褶皱(丹尼-摩根(dennie-morgan)褶皱)、唇炎、复发性结膜炎、前颈褶皱。·触发因素:食物、情绪因素、环境因素、皮肤刺激物。·并发症:对皮肤感染的易感性、细胞介导的免疫受损、立即皮肤测试反应性、ige升高、圆锥角膜、前囊下白内障。·其它:发病年龄早、皮肤干燥、鱼鳞癣、高线型手掌(hyperlinearpalms)、毛发角化病、手足皮炎、乳头湿疹、白色皮肤划痕症(whitedermatographism)、毛囊周加重(perifollicularaccentuation)。实例3这项双盲2b期研究的目标是评估口服应用的ds107对患有中度到重度ad的成人的功效和安全性。研究使用如实例2中描述的随机(1:1:1,治疗组a:1gds107;治疗组b:2gds107和治疗组c:安慰剂)、双盲、安慰剂对照平行组设计。对于中度和重度ad以及对于组合组,治疗组分别呈现出处置、依从性、人口统计学以及主要功效结果和次要功效结果。使用olink高通量蛋白质组学平台,针对特应性皮炎生物标志物评估符合方案集(pps)中的通过在基线/第2次访视和第8周/第6次访视的直接静脉穿刺收集的受试者的血液样品。pps是在没有任何重大违反情况的情况下完成研究的全分析组(fas)的子集。使用olink高-通量蛋白质组学平台分析如以上实例2中描述的在基线和第8周时的每个患者样品,以量化表16中列出的蛋白质组(即,生物标志物分析物)。表16:olink蛋白质组学生物标志物组和分析物人口统计学和其它基线特性:呈现所有受试者的人口统计学和其它基线特性的描述性统计学,并且按治疗组进行制表。基线特性包含年龄、性别、种族、人种、iga和瘙痒nrs。一般统计方法:评估了四组olink分析物,包含通常在皮肤中分析的炎性标志物,如th2趋化因子、th1趋化因子以及心血管标志物、神经免疫标志物和许多其它标志物。对在基线时和在治疗之后获得的血清进行血液评估。使用线性混合效应模型以log2量表对olink归一化的蛋白质表达(npx)值进行建模,其中时间和治疗作为每个患者的固定效应和随机截距。如在成对t-测试的情况下,此公式固有地对患者内相关结构进行建模。混合效应模型的优点在于:即使在存在缺失值的情况下,参数的估计也是可能的。这种方法引入的偏差比限制对具有完全观察的患者的分析更小。使用对比度来估计每个治疗组内治疗变化倍数并且进行假设测试。使用benjamini–hochberg程序对多个假设的p值进行调整,所述程序控制错误发现率(fdr)。与疾病严重程度的相关性:计算基线临床数据(iga、nrs)与生物标志物水平之间的皮尔逊(pearson)和斯皮尔曼(spearman)相关系数。另外,为每个治疗组提供临床数据与生物标志物水平之间的治疗后变化对治疗前变化的相关性。针对以下生成这项研究的统计输出:·在每个时间点安慰剂与2gds107和1gds107活性物之间差异表达的标志物;基线和第8周/治疗结束(eot),包含:活性物与安慰剂之间的变化倍数、p值和fdr值。·在iga应答者和非应答者中,在每个时间点安慰剂与2gds107和1gds107活性物之间差异表达的标志物的亚组分析,包含:活性物与安慰剂之间的变化倍数、p值和fdr值。·条形图(barplot)可视化每个治疗组相对于基线的变化倍数,包含亚组分析。·每个治疗组的基线临床数据(iga、nrs)与基线生物标志物水平之间的相关性,包含:相关系数(皮尔逊、斯皮尔曼)、p值、fdr值和散点图。·每个治疗组的基线生物标志物水平与临床数据的变化(第8周/eot时的iga应答者,从基线到第8周/eot的瘙痒nrs的变化)的相关性,包含:相关系数(皮尔逊、斯皮尔曼)、p值、fdr值和散点图。·每个治疗组的临床数据的变化(第8周/eot时的iga应答,从基线到第8周/eot的瘙痒nrs的变化)与生物标志物水平的变化之间的相关性,包含:相关系数(皮尔逊、斯皮尔曼)、p值、fdr值和散点图。结果差异表达的生物标志物:图2a-2c是示出了每个治疗组的差异表达的生物标志物的平均丰度的热图,其中药物1g是指治疗组a:1gds107,药物2g是指治疗组b:2gds107,并且安慰剂是指治疗组c:安慰剂。图2a-2c示出了根据每个治疗组的患者,测量122种不同的生物标志物水平,并且然后从基线(bl)到治疗结束(eot)进行比较。重要的是,与基线相比,来自治疗组a(即,药物2g)的每日施用2g的ds107持续8周的患者表现出从治疗结束起的分子改善。图3-10示出了显示所选生物标志物与基线相比的相对变化倍数的条形图。图3描绘了一般炎症标志物的变化,图4描绘了先天免疫相关标志物的变化,图5a和5b描绘了t细胞/nk细胞活化标志物的变化,图6a和6b描绘了th1相关标志物的变化,图7a和7b描绘了th17/th1相关标志物的生物标志物变化,图8描绘了th2相关物质的标志物变化,图9描绘了th2和其它趋化因子和粘附分子的标志物变化,并且图10a和10b描绘了纤维化和增生性标志物的变化。治疗组b:2gds107(即,药物2g)中的患者在血清炎性标志物中就差异表达的基因的数量及其显著性而言表现出与其它两个组(即,治疗组a:1gds107和治疗组c:安慰剂)的明显区分。对于许多炎性标志物以及纤维化标志物,这些差异是显著性的或接近显著性的。包含血清在内的机械分析在检测各个组之间的差异(包含在患者和部位选择不总是理想的临床情况下)方面更为敏感。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1