抗体制剂的制作方法
发明领域
本公开涉及药物活性抗原结合蛋白质例如单克隆抗体的制剂。具体地,本公开涉及抗cd38抗体的稳定的冻干药物制剂、该冻干制剂的重构液体制剂,并涉及制造和使用该冻干和重构制剂的方法。
背景技术:
过去数年间抗体的药物用途已增加。在许多情况下,这些抗体经由静脉内(iv)途径注射。另外可选的给药途径是皮下或肌肉内注射,其提供了潜在的优势,例如就患者依从性和易于给药而言。通常需要高度浓缩的、稳定的药物制剂。另外,出于例如储存和处理的原因,通常优选冻干制剂。
治疗性抗体是大而复杂的分子,因此这些蛋白质的制剂带来了特殊的挑战。蛋白质要保持生物活性,制剂必须保留至少蛋白质氨基酸核心序列的构象完整性,同时保护蛋白质的多个官能团不受降解。抗体的制剂可能保质期短,配制的抗体可能在储存期间由于化学和物理上的不稳定性而失去生物活性。蛋白质降解最常见的三种途径是蛋白质聚集、脱酰胺化和氧化(cleland等,criticalreviewsintherapeuticdrugcarriersystems10(4):307-377(1993))。特别是,聚集可能潜在地导致患者中免疫反应增加,造成安全性问题,必须尽量降低或加以防止。
蛋白质浓度较高的制剂还带来了额外的挑战,特别是在蛋白质稳定性、蛋白质-蛋白质相互作用和粘度方面。粘度不仅是关于治疗性蛋白质的生物物理和生化特性的问题,而且对于高浓度蛋白质溶液的递送和制造来说也是问题。溶液的粘度越高,经由注射器和针头注射这种粘性溶液所需的时间便越长。因此,可注射性方面受粘度的影响,需要在开发高浓度制剂时加以考虑。某些抗体还表现出不希望有的自相互作用的倾向,这使得它们不太适合用于高浓度制剂。这种自相互作用的倾向在高蛋白质浓度下可导致低聚化、聚集和高粘度。乳光(opalescence)是指示由于溶液中存在聚集体或液-液相分离使制剂在物理上不稳定的一个参数,在单克隆抗体(mab)制剂中已有报道。
为了解决这些问题,开发合适的制剂组合物至关重要。为了避免稳定性问题例如聚集体的形成,可以将蛋白质或抗体制剂冻干。
cd38是ii型膜蛋白,其在受体介导的粘附和信号转导中发挥作用,以及经由其胞外酶活性介导钙动员,催化由nad+形成环状adp-核糖(cadpr),并且还将cadpr水解成adp-核糖(adpr)。cd38介导细胞因子分泌和淋巴细胞的活化和增殖(funaro等,jimmunology145:2390-6,1990;guse等,nature398:70-3,1999),并经由其nad糖水解酶活性调节细胞外nad+水平,这与调节性t细胞区室的调控有关(adriouch等,14:1284-92,2012;chiarugi等,naturereviews12:741-52,2012)。
cd38在恶性浆细胞和其他淋巴细胞上表达,因此代表着多发性骨髓瘤和其他丙种球蛋白病的治疗中的治疗靶标。cd38也是针对其他适应症所利用或研究的靶点,上述其他适应症包括但不限于实体癌症、自身免疫性疾病和许多其他疾病。
若干cd38特异性抗体(包括双特异性抗体和其他构建体)正处于使用或开发中,其包括但不限于:wo199962526(mayofoundation);wo200206347(crucellholland),wo2005103083(morphosysag),wo2006125640(morphosysag),wo2007042309(morphosys);wo2006099875(genmab),wo2011154453a1(genmab),wo2008047242(sanofi-aventis),wo2015066450(sanofi),wo2012092616a1(takeda),wo2012092612a1(takeda),wo2013059885(teva),wo2014178820(teva),wo2015149077(xencor),wo2017081211a2(universityhamburg-eppendorf)和wo2017091656(amgen,xencor)。
本公开涉及适合施用于患者的抗cd38抗体例如称作mor202的抗体的高度稳定的制剂的开发和使用。
治疗性抗体的药物制剂是现有技术中已知的。例如,wo2013016648公开了一种包括抗pcsk9抗体、组氨酸缓冲液、非离子型表面活性剂和稳定剂的药物制剂。然而,所述文件并没有公开抗cd38抗体。wo2018204405公开了一种包括抗tigit抗体、组氨酸缓冲液、作为非离子型表面活性剂的聚山梨醇酯-80、非还原糖和抗氧化剂的制剂,但也没有公开抗cd38抗体。wo2017079150公开了包括抗cd38抗体、透明质酸酶(hyalorunidase)、组氨酸缓冲液、蛋氨酸和非离子型表面活性剂的皮下制剂。该文件教导了向组合物中添加透明质酸酶,并没有公开mor202或经冷冻干燥的冻干组合物。
因此,仍然需要稳定的冻干抗体制剂用于制备抗cd38药物,特别是包括抗体mor202的药物。
技术实现要素:
本发明的目的是提供抗cd38抗体的制剂,特别是具有适当保存期(shelftime)的抗cd38抗体制剂。
治疗性抗体的适当制剂可以是含水药物组合物或冻干物(lyophilisates),其可以经重构以提供用于对患者患者的溶液。
本文提供包括抗体的冻干药物制剂。在本公开的一方面,药物制剂包括抗cd38抗体。在本公开的另一方面,药物制剂包括称作mor202的抗体。
本公开提供用于所述抗cd38抗体例如mor202的药物制剂,其包括该抗原结合蛋白质、表面活性剂和ph为5.5至6.5的组氨酸缓冲液。
在一方面,本公开提供用于抗原结合蛋白质的药物制剂,其中所述抗原结合蛋白质是抗cd38抗体。
在某些方面,所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。
在某些方面,所述抗cd38抗体包括seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。
在其他方面,所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。
在其他方面,所述抗cd38抗体包括seqidno.:7的可变重链和seqidno.:8的可变轻链。
在一方面,本公开提供用于所述抗cd38抗体例如mor202的药物制剂,其中所述药物制剂包括表面活性剂。在某些方面,所述表面活性剂是非离子型表面活性剂。在其他方面,所述非离子型表面活性剂是聚山梨醇酯。在再其他方面,所述聚山梨醇酯是聚山梨醇酯20(ps20)或聚山梨醇酯80(ps80)。在再其他方面,所述聚山梨醇酯是聚山梨醇酯20。
在一方面,本公开提供用于所述抗cd38抗体例如mor202的药物制剂,其中所述药物制剂包括ph为5.5至6.5的组氨酸缓冲液。在某些方面,所述组氨酸缓冲液是ph为5.9至6.1的组氨酸缓冲液。在某些方面,所述组氨酸缓冲液的ph为约6.0。在某些方面,所述组氨酸缓冲液的ph为6.0。
在一方面,本公开提供用于所述抗cd38抗体例如mor202的药物制剂,其中所述药物制剂包括浓度为5mm至15mm的组氨酸缓冲液。在其他方面,所述组氨酸缓冲液的浓度为8mm至12mm。在其他方面,所述组氨酸缓冲液的浓度为约10mm。在其他方面,所述组氨酸缓冲液的浓度为10mm
在一方面,本公开提供用于所述抗cd38抗体例如mor202的药物制剂,其中所述药物制剂包括稳定剂。在某些方面,所述稳定剂是二糖。在其他方面,所述二糖是蔗糖。在其他方面,所述蔗糖的浓度为150mm至350mm。在其他方面,所述蔗糖的浓度为175mm至260mm。在其他方面,所述蔗糖的浓度为约260mm。在其他方面,所述蔗糖的浓度为260mm。
在一方面,本公开提供用于所述抗cd38抗体例如mor202的冻干药物制剂,其通过液体药物制剂的冻干来制备。
在一方面,本公开提供抗cd38抗体例如mor202的液体制剂,所述方法包括提供冻干药物制剂和重构所述冻干制剂。在某些方面,所述液体制剂经由向冻干制剂中添加水或其他药学可接受的试剂产生。
在一方面,本公开提供所述抗cd38抗体例如mor202的重构药物制剂。
在一方面,本公开提供用于所述抗cd38抗体例如mor202的药物制剂,其中所述抗cd38抗体的浓度为至少55mg/ml。
在一方面,本公开提供用于所述抗cd38抗体例如mor202的药物制剂,其中所述抗cd38抗体的浓度为55-75mg/ml。
在其他方面,所述抗cd38抗体的浓度为62.5-67.5mg/ml。
在再其他方面,所述抗cd38抗体的浓度为约65mg/ml。在再其他方面,所述抗cd38抗体的浓度为65mg/ml。
在一方面,本公开提供用于所述抗cd38抗体例如mor202的药物制剂,其中所述药物制剂包括浓度为0.05%(w/w)至0.2%(w/w)的表面活性剂。在其他方面,所述表面活性剂的浓度为约0.1%(w/w)。在其他方面,所述表面活性剂的浓度为0.1%(w/w)。
在一方面,本公开提供治疗受试者中疾病或病症的方法,其包括向所述受试者施用有效量的本公开的药物制剂。
在一方面,本公开提供本公开的药物制剂用于制备药物的用途。在某些方面,所述用途是用于制备用于治疗疾病或病症的药物的用途。在某些方面,所述疾病或病症是癌症或炎性病症。在某些方面,所述癌症是血液癌或实体癌。在某些方面,所述血液癌选自多发性骨髓瘤、淋巴瘤、白血病或其任何特定类型或亚型。在某些方面,所述癌症是多发性骨髓瘤。在某些方面,所述疾病或病症是癌症或炎性病症。
附图说明
图1:实施例2中测试的主要预制剂(pre-formulations)的概览。
图2:预制剂开发过程中的测试进度表。
图3:预制剂开发中的稳定性测试结果。
图3a-3b:时间点0
图3c-3d:时间点2周,40℃/75%rh
图3e:时间点4周,40℃/75%rh
图3f:时间点2周,5℃
图3g:时间点4周,5℃
图4:先导(lead)缓冲系统加上各种浓度的聚山梨醇酯20的各种测试的结果。
图4a-4c:t0、t24h和t48h的剪切测试结果
图4d-4e:冷冻/解冻测试的结果
图4f:盐水稀释测试的结果
图5:初始冻干实验之后的带有饼状物(cake)的小瓶。
图6:液体制剂的稳定性结果和显微镜下可见的(subvisible)颗粒。
图6a-6c:溶液的外观和uv检验
图6d:ph和se-hplc
图6e-6g:dls
图6h:hiac
图7:冻干制剂的稳定性结果和显微镜下可见的颗粒。
图7a:外观、uv检验和ph
图7b-7d:dls、饼状物外观、重构时间和水分含量
图7e:se-hplc和显微镜下可见的颗粒
图8:第五次冻干优化之后的药物产品的分析结果。
图9:第五次冻干优化之后的带有饼状物的小瓶。
具体实施方式
应当理解,本公开并不局限于特定的方法、试剂、化合物、组合物或生物系统,这些当然均可以变化。还应当理解,本文使用的术语仅出于对具体实施方式进行说明的目的,而无意于进行限定。
如本说明书和所附的权利要求中所用,除非内容中另有明确指出,否则单数形式的“一”和“该”(“a”、“an”和“the”)均包括复数的所指对象。因此,例如,提及“多肽”包括两个或更多个多肽的组合等等。
如本文所用,“大约”在提及可测量的值例如量、时长等时,是指包括距指定值±20%或±10%的变化,包括±5%、±1%和±0.1%的变化,这些变化适合于执行本公开的方法。除非另有定义,否则本文使用的所有技术和科学术语的含义与本公开所涉及领域的普通技术人员所理解的含义相同。尽管在本公开的测试的实践中可以使用任何与本文所述者类似或等同的方法和材料,本文对优选的材料和方法进行了说明,在本公开的说明书和权利要求书中,将使用以下术语。
“药物制剂”或“制剂”是指其形式允许活性成分的生物活性有效的制剂,并且其不含对该制剂要施用的受试者来说具有不可接受的毒性的额外成分。这样的制剂是无菌的。“无菌”制剂是无菌的或不含所有活的微生物及其孢子。
术语“粘度”是指流体在指定温度下所表现出的内部流动阻力;是剪切应力与剪切速率的比值。如果一个1达因/平方厘米的力使两个面积为1平方厘米且相距1平方厘米的平行液体表面以1厘米/秒的速度相互移动,则液体的粘度为1泊。一泊等于一百厘泊。在一实施方式中,包括缓冲剂和稳定剂的制剂的粘度小于约50cp、小于约45cp、小于约40cp、小于约35cp、小于约30cp、小于约25cp、小于约20cp、小于约15cp、或小于约10cp。
当提及表观粘度时,应理解到,粘度的值取决于测量进行的条件,例如所应用的温度、剪切速率和剪切应力。表观粘度定义为所应用的剪切应力与剪切速率的比值。测量表观粘度有若干种另外可选的方法。例如,粘度可以通过合适的锥板、平行板或其他类型的粘度计或流变计来测试。
如本文所用,“缓冲液”是指通过其酸-碱共轭组分的作用来抵抗ph值变化的缓冲溶液。本发明的缓冲液优选ph值在5.9至6.1的范围内,优选ph值为约6.0,更优选ph值为6.0。“组氨酸缓冲液”是包括组氨酸这种氨基酸的缓冲液。组氨酸缓冲液是本公开的优选缓冲液。组氨酸缓冲液的实例包括组氨酸盐酸盐、组氨酸乙酸盐、组氨酸磷酸盐和组氨酸硫酸盐。
如本文所用,“表面活性剂”是指具有表面活性的试剂。表面活性剂的实例包括聚山梨醇酯(例如,聚山梨醇酯20和聚山梨醇酯80),泊洛沙姆(poloxamer)(例如,泊洛沙姆188),triton,十二烷基硫酸钠(sds),月桂基硫酸钠,辛基糖苷钠,月桂基硫代甜菜碱、肉豆蔻基硫代甜菜碱、亚油基硫代甜菜碱(linoleylsulfobetaine)或硬脂基硫代甜菜碱,月桂基肌氨酸、肉豆蔻基肌氨酸、亚油基肌氨酸或硬脂基肌氨酸,亚油基甜菜碱、肉豆蔻基甜菜碱或十六烷基甜菜碱,月桂酰胺丙基甜菜碱、椰油酰胺丙基甜菜碱、亚油酰胺丙基甜菜碱、肉豆蔻酰胺丙基甜菜碱、棕榈酰胺丙基甜菜碱或异硬脂酰胺丙基甜菜碱(例如月桂酰胺丙基);肉豆蔻酰胺丙基二甲胺、棕榈酰胺丙基二甲胺或异硬脂酰胺丙基二甲胺;甲基椰油酰基牛磺酸钠或甲基油基牛磺酸二钠、和monaquattm系列(monaindustries,inc.,paterson,n.j.)、聚乙二醇、聚丙二醇以及乙二醇和丙二醇的共聚物(例如pluronics或pf68)。优选地,表面活性剂是非离子型表面活性剂。更优选地,所述非离子型表面活性剂是聚山梨醇酯20。聚山梨醇酯20也称作ps20或tween-20。聚山梨醇酯80也称作ps80或tween-80。
所述表面活性剂可以不同的浓度使用。优选地,所述表面活性剂的浓度为0.05%(w/w)至0.2%(w/w)。更优选地,所述表面活性剂的浓度为约0.1%(w/w)。更优选地,所述表面活性剂的浓度为0.1%(w/w)。优选地,所述表面活性剂是浓度为0.05%(w/w)至0.2%(w/w)的聚山梨醇酯20。更优选地,所述表面活性剂是浓度为约0.1%(w/w)的聚山梨醇酯20。更优选地,所述表面活性剂是浓度为0.1%(w/w)的聚山梨醇酯20。
在某些实施方式中,根据本公开的药物制剂可以包括稳定剂作为其他赋形剂。稳定剂包括,但不限于,人血清白蛋白、牛血清白蛋白、α-酪蛋白、球蛋白、a-乳清蛋白、ldh、溶菌酶、肌红蛋白、卵清蛋白和核糖核酸酶a。稳定剂还包括氨基酸及其代谢物,例如,甘氨酸、丙氨酸、精氨酸、甜菜碱、亮氨酸、赖氨酸、谷氨酸、天冬氨酸、脯氨酸、4-羟基脯氨酸、肌氨酸、γ-氨基丁酸(gaba)、奥品类(opines)(丙氨奥品(alanopine)、章鱼碱、甘氨奥品(strombine))和三甲胺n-氧化物(tmao)。稳定剂还可以包括糖醇和/或单糖、二糖或多糖,例如甘露醇、山梨糖醇、海藻糖、葡萄糖、乳糖、蔗糖等。优选的稳定剂是蔗糖。
如本文所用,与本公开的药物制剂关联的术语“重构的”是指制剂被冻干并且通过添加重构介质而重新溶解。重构介质包括但不限于水,特别是注射用水(wfi),注射用抑菌水(bwfi),氯化钠溶液(例如0.9%(w/v)nacl),葡萄糖溶液(例如5%葡萄糖),含表面活性剂的溶液(例如0.01%聚山梨酯20),ph缓冲溶液(例如磷酸盐缓冲溶液)。
在一方面,本公开的药物制剂在冷冻和解冻时是稳定的。“稳定”的制剂是在预期的存储温度例如2-8℃下存储时其中所有的蛋白质基本上保持其物理稳定性和/或化学稳定性和/或生物稳定性的制剂。合意的是,制剂在存储时基本上保持其物理和化学稳定性,以及其生物稳定性。存储期间通常根据预期的制剂保存期而选择。而且,制剂应当在将制剂冷冻(至例如-70℃)和解冻之后,例如,1、2或3轮冷冻和解冻之后是稳定的。用于测定蛋白质稳定性的各种分析技术在本领域中是可获得的,例如,在以下文献中综述:peptideandproteindrugdelivery',247-301,vincentleeed.,marceldekker,inc.,newyork,n.y.,pubs.(1991);和jones,a.adv.drugdeliveryrev.10:29-90(1993)。稳定性可以在选定的温度下在选定的时间期间测量。稳定性可以通过许多种不同的方式进行定量和/或定性评价,其包括评价聚集体形成(例如使用尺寸排阻色谱、通过测量浊度和/或通过目测检查);通过使用阳离子交换色谱或毛细管区带电泳评估电荷异质性;氨基端或羧基端序列分析;质谱分析;sds-page分析来比较降解的(reduced)和完整的抗体;肽谱(map)(例如胰蛋白酶或lys-c)分析;评估抗体的生物活性或抗原结合功能。
在一实施方式中,本公开的药物制剂适合于静脉内、皮下或肌肉内给药。在其他实施方式中,本公开的药物经皮下给药。在另一实施方式中,本公开的药物制剂经静脉内给药。
术语“cd38”是指称作cd38的蛋白质,其具有以下同义词:adp-核糖环化酶1、cadpr水解酶1、环状adp-核糖水解酶、t10。
人cd38(uniprot:p28907)的氨基酸序列为:
如本文所用,术语“抗体”是指包括与抗原相互作用的通过二硫键互相连接的至少两个(h)重链和两个轻(l)链的蛋白质。每个重链包括重链可变区(在本文中缩写为vh)和重链恒定区。重链恒定区包括三个结构域ch1、ch2和ch3。每个轻链包括轻链可变区(在本文中缩写为vl)和轻链恒定区。轻链恒定区包括一个结构域cl。vh和vl区可以进一步细分成称作互补决定区(cdr)的高变区,其散布有称作框架区(fr)的更加保守的区域。每个vh和vl由以如下顺序从氨基端到羧基端排列的三个cdr和四个fr组成:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可以介导免疫球蛋白与宿主组织或因子的结合,包括各种免疫系统细胞(例如效应细胞)和经典补体系统的第一组分(clq)。术语“抗体”包括,例如,单克隆抗体、人抗体、人源化抗体、骆驼化(camelised)抗体和嵌合抗体。抗体可以是任意同种型(例如,igg、ige、igm、igd、iga和igy)、分类(例如,lgg1、lgg2、lgg3、lgg4、lga1和lga2)或子类的。重链和轻链均划分为结构和功能同源性的区域。
如本文所用,短语“抗体片段”是指保持与抗原特异性相互作用(例如,通过结合、空间位阻、稳定化空间分布)的能力的一个或多个抗体部分。结合片段的例子包括,但不限于,fab片段,由vl、vh、cl和ch1结构域组成的单价片段;f(ab)2片段,包括两个在铰链区通过二硫桥连接的fab片段的二价片段;由vh和ch1结构域组成的fd片段;由抗体单臂的vl和vh结构域组成的fv片段;dab片段(ward等,(1989)nature341:544-546),其由vh结构域组成;和分离的互补决定区(cdr)。而且,尽管fv片段的两个结构域vl和vh通过单独的基因编码,但它们可以使用重组方法通过能够使其成为单个蛋白质链的合成接头而接合,其中vl和vh区域成对形成单价分子(称作单链fv(scfv);参见,例如,bird等,(1988)science242:423-426;和huston等,(1988)proc.natl.acad.sci.85:5879-5883)。这些单链抗体也意在被包括在术语“抗体片段”内。这些抗体片段使用本领域技术人员已知的常规技术得到,并与完整抗体以相同方式筛选具有实用性的片段。抗体片段还可以并入到单结构域抗体、巨型抗体(maxibody)、微型抗体(minibody)、胞内抗体(intrabody)、双抗体(diabody)、三抗体(triabody)、四抗体(tetrabody)、v-nar和bis-scfv中(参见,例如,hollinger和hudson,(2005)naturebiotechnology23:1126-1136)。抗体片段可以接枝到基于多肽的支架(scaffold)例如iii型纤连蛋白(fn3)中(参见,美国专利第6,703,199号,其描述了纤连蛋白多肽单抗体(monobodies))。抗体片段可以并入到包括一对串联fv区段(vh-ch1-vh-ch1)的单链分子中,其与互补轻链多肽一起形成一对抗原结合部位(zapata等,(1995)proteineng.8:1057-1062;和美国专利第5,641,870号)。
如本文所用,“人抗体”或“人抗体片段”包括具有其中框架区和cdr区二者均源自于人来源序列的可变区的抗体和抗体片段。人抗体还可以从合成的文库或者从转基因小鼠(例如xenomouse)中分离,其条件是各个系统产生具有其中框架区和cdr区二者均等同于人来源序列的可变区的抗体。
而且,如果抗体含有恒定区,恒定区也源自这些序列。人来源包括,例如,人种系(germline)序列,或者人种系序列的突变版本,或者含有源自人框架序列分析的共有框架序列的抗体,例如,如knappik等,(2000)jmolbiol296:57-86中所述。
免疫球蛋白可变结构域例如cdr的结构和位置可以使用公知的编号方式例如kabat编号方式、chothia编号方式或者kabt和chothia的组合来定义(参见,例如,sequencesofproteinsofimmunologicalinterest,美国卫生与人类服务部(u.s.departmentofhealthandhumanservices)(1991)kabat等编著;lazikani等,(1997)j.mol.bio.273:927-948);kabat等,(1991)sequencesofproteinsofimmunologicalinterest,第5版,nih公开号91-3242美国卫生与人类服务部;chothia等,(1987)j.mol.biol.196:901-917;chothia等,(1989)nature342:877-883;和al-lazikani等,(1997)j.mol.biol.273:927-948。
“人源化抗体”或“人源化抗体片段”在本文中定义为其中恒定抗体区源自于人来源的序列并且可变抗体区或其部分或仅cdr源自于其他物种的抗体分子。例如,人源化抗体可以是cdr-接枝的,其中可变结构域的cdr来自非人来源,而可变结构域的一个或多个框架是人来源的,并且恒定结构域(如果有的话)是人来源的。
术语“嵌合抗体”或“嵌合抗体片段”在本文中定义为其中恒定抗体区来源于或对应于一物种中发现的序列并且可变抗体区源自于其他物种的抗体分子。优选地,恒定抗体区来源于或者对应于在人中发现的序列,且可变抗体区(例如,vh、vl、cdr或fr区)源自于非人动物例如小鼠、大鼠、兔或仓鼠中发现的序列。
术语“分离的抗体”是指抗体或抗体片段基本上不含其它具有不同抗原特异性的抗体或抗体片段。而且,分离的抗体或抗体片段可以基本上不含其它的细胞材料和/或化学物质。因此,在一些方面,提供的抗体是分离的抗体,其已经与具有不同特异性的抗体分离。分离的抗体可以是单克隆抗体。分离的抗体可以是重组的单克隆抗体。但是,与靶标的表位、同种型或变体特异性结合的分离的抗体可以与其他相关抗原例如来自其他物种者(例如物种同源物)具有交叉反应性。
如本文所用,术语“重组抗体”包括所有通过自然界中不存在的方式制备、表达、产生或分离的抗体。例如,从经转化以表达抗体的宿主细胞分离的抗体,从重组的组合人抗体文库选择和分离的抗体,通过任何其他涉及剪接部分或全部人免疫球蛋白基因、序列至其他dna序列的方式制备、表达、产生或分离的抗体,或者从人免疫球蛋白基因转基因或转染色体动物(例如小鼠)或由其制备的杂交瘤分离的抗体。优选地,这些重组抗体具有如下的可变区,其中框架区和cdr区源自于人种系免疫球蛋白序列。然而,在某些实施方式中,这些重组人抗体可以进行体外诱变(或者,当使用人ig序列转基因的动物时,进行体内的体细胞诱变),因此,重组抗体vh和vl区的氨基酸序列是尽管源自于人种系vh和vl序列并与其相关、但不可能在体内天然存在于人抗体种系组库(repertoire)内的序列。重组抗体可以是单克隆抗体。在一实施方式中,本文公开的抗体和抗体片段从hucal文库分离(rothe等,j.mol.biol.(2008)376,1182-1200)。
如本文所用,术语“单克隆抗体”是指单一分子组成的抗体分子制剂。单克隆抗体组合物表现出独特的结合位点,其对于特定表位具有独特的结合特异性和亲和力。
在一实施方式中,本公开的抗原结合蛋白质是单克隆抗体或其片段。在另一实施方式中,本公开的抗原结合蛋白质是单克隆抗体。在另一实施方式中,单克隆抗体是小鼠、嵌合的、人源化的或人抗体。在另一实施方式中,单克隆抗体是人抗体。在另一实施方式中,单克隆抗体是人源化抗体。在另一实施方式中,单克隆抗体是嵌合抗体。在另一实施方式中,单克隆抗体是小鼠抗体。
在一实施方式中,本公开的抗原结合蛋白质与cd38结合。在另一实施方式中,本公开的抗原结合蛋白质与cd38特异性地结合。在另一实施方式中,本公开的抗原结合蛋白质对于cd38具有特异性。在另一实施方式中,本公开的抗原结合蛋白质特异性地识别cd38。
查询氨基酸序列和对象氨基酸序列之间的“百分比同一性”是表示成百分比的“同一性”数值,其在对象氨基酸序列具有与查询氨基酸序列的100%查询覆盖率时在进行成对blastp比对之后通过blastp算法计算。查询氨基酸序列和对象氨基酸序列之间的这种成对blastp比对通过使用国家生物技术中心研究所(thenationalcenterforbiotechnologyinstitute)网站上可获得的blastp算法的默认设置来进行,并关闭对低复杂度区域的过滤器。重要的是,查询氨基酸序列可以由本文一项或多项权利要求中确定的氨基酸序列描述。
查询序列可以具有与对象序列的100%同一性,或者与对象序列比较时它可以包括至多某个整数的氨基酸变化,使得%同一性小于100%。例如,查询序列可以具有与对象序列至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%的同一性。这些变化包括以下的至少一种:氨基酸缺失、取代(包括保守取代和非保守取代)或插入,其中所述变化可以在查询序列的氨基端或羧基端位置处、或者在这些末端位置之间的任意位置处发生,其单独地散布在查询序列的氨基酸当中,或者以一个或多个连续的组散布在查询序列内。
“给药”或“施用”包括但不限于通过可注射的形式递送,例如,通过例如静脉内、肌肉内、皮内或皮下路径,或者通过粘膜路径,例如,作为鼻喷雾或吸入用气溶胶,或者作为可吸收的溶液、胶囊或片剂。
化合物或组合的“治疗有效量”是指足以至少部分地抑制指定疾病或病症及其并发症的临床表现的量。对于特定治疗目的来说有效的量将取决于疾病或损伤的严重程度以及受试者的重量和一般状况。应当理解到,可以使用常规实验,通过构建数值矩阵并对矩阵中不同的点进行测试,实现适当剂量的确定,所有这些均在训练有素的医生或临床科学家的普通技能范围内。
“mor202”是抗cd38抗体,也称作“mor03087”或“mor3087”。在本公开中上述术语可互换使用。
如kabat定义的mor202hcdr1的氨基酸序列为:
如kabat定义的mor202hcdr2的氨基酸序列为:
如kabat定义的mor202hcdr3的氨基酸序列为:
如kabat定义的mor202lcdr1的氨基酸序列为:
如kabat定义的mor202lcdr2的氨基酸序列为:
如kabat定义的mor202lcdr3的氨基酸序列为:
mor202可变重链结构域的氨基酸序列为:
mor202可变轻链结构域的氨基酸序列为:
编码mor202可变重链结构域的dna序列为:
编码mor202可变轻链结构域的dna序列为:
mor202具有igg1fc区。
如本文所用,术语“血液癌”是指血液的癌症,包括白血病、淋巴瘤和骨髓瘤等。“白血病”是指一种血液癌症,其中产生过多的在对抗感染时不起作用的白细胞,从而挤出其他血液构成部分例如血小板和红细胞。应当理解到,白血病病例分为急性或慢性。通过非限制性的例子,某些形式的白血病包括,急性淋巴细胞性白血病(all);急性髓系白血病(aml);慢性淋巴细胞性白血病(cll);慢性髓细胞性白血病(cml);骨髓增生性疾病/肿瘤(mpds);和脊髓异常增生综合症。“淋巴瘤”可以指霍奇金淋巴瘤,惰性和侵袭性非霍奇金淋巴瘤二者,伯基特氏淋巴瘤(burkitt'slymphoma)和滤泡性淋巴瘤(小细胞和大细胞)等。骨髓瘤可以指多发性骨髓瘤(mm)、巨细胞骨髓瘤、重链骨髓瘤和轻链骨髓瘤或本周氏(bence-jones)骨髓瘤。
如本文所用,术语“实体肿瘤”或“实体癌”是指通常不含囊肿(cysts)或液体区域的肿瘤。如本文所用,实体肿瘤包括肉瘤和癌(carcinomas),例如,如乳腺肿瘤、卵巢肿瘤、胃肿瘤、肺肿瘤、胰腺肿瘤、前列腺肿瘤、黑色素瘤、结直肠肿瘤、肺肿瘤、头颈肿瘤、膀胱肿瘤、食道肿瘤、肝脏肿瘤、甲状腺肿瘤和肾脏肿瘤。
在某些实施方式中,本公开提供治疗受试者中疾病或病症的方法,其包括向所述受试者施用有效量的本公开的制剂。在某些实施方式中,所述疾病或病症是癌症或炎性病症。在某些实施方式中,所述癌症是血液癌或实体癌。在某些实施方式中,所述癌症是血液癌,选自白血病、淋巴瘤和骨髓瘤。在某些实施方式中,所述癌症是多发性骨髓瘤。在某些实施方式中,所述癌症是选择肉瘤和癌的实体癌,例如,如乳腺肿瘤、卵巢肿瘤、胃肿瘤、肺肿瘤、胰腺肿瘤、前列腺肿瘤、黑色素瘤、结直肠肿瘤、肺肿瘤、头颈肿瘤、膀胱肿瘤、食道肿瘤、肝脏肿瘤、甲状腺肿瘤和肾脏肿瘤。
在某些实施方式中,所述炎性病症选自炎性肠病、类风湿性关节炎、银屑病、淀粉样变性、系统性红斑狼疮(sle)、遗传过敏性皮炎、韦格纳氏肉芽肿病(wegener'sgranulomatosis)和银屑病性关节炎。
在某些实施方式中,本公开提供本公开的药物制剂用于制备药物的用途。在某些实施方式中,所述用途是用于制备用于治疗疾病或病症的药物的用途。在某些实施方式中,所述疾病或病症是癌症或炎性病症。在某些实施方式中,所述癌症是血液癌或实体癌。在某些实施方式中,所述癌症是选自白血病、淋巴瘤和骨髓瘤的血液癌。在某些实施方式中,所述癌症是多发性骨髓瘤。在某些实施方式中,所述癌症是选自肉瘤和癌的实体癌,例如,如乳腺肿瘤、卵巢肿瘤、胃肿瘤、肺肿瘤、胰腺肿瘤、前列腺肿瘤、黑色素瘤、结直肠肿瘤、肺肿瘤、头颈肿瘤、膀胱肿瘤、食道肿瘤、肝脏肿瘤、甲状腺肿瘤和肾脏肿瘤。在某些实施方式中,所述炎性病症选自炎性肠病、类风湿性关节炎、银屑病、淀粉样变性、系统性红斑狼疮(sle)、遗传过敏性皮炎、韦格纳氏肉芽肿病和银屑病性关节炎。
在一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和缓冲液的药物制剂,其中,所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和缓冲液的药物制剂,其中所述抗cd38抗体是mor202。
在一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和缓冲液的药物制剂,其中所述抗cd38抗体的浓度为至少55mg/ml。在一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和缓冲液的药物制剂,其中所述抗cd38抗体的浓度为55-75mg/ml。在一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和缓冲液的药物制剂,其中所述抗cd38抗体的浓度为62.5-67.5mg/ml。在一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和缓冲液的药物制剂,其中所述抗cd38抗体的浓度为约65mg/ml。在一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和缓冲液的药物制剂,其中所述抗cd38抗体的浓度为65mg/ml。
在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和ph为5.5至6.5的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和ph为5.9至6.1的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和ph为约6.0的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和ph为6.0的组氨酸缓冲液的药物制剂。
在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和浓度为5mm至15mm并且ph为5.9至6.1的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和浓度为8mm至12mm并且ph为5.9至6.1的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和浓度为约10mm并且ph为5.9至6.1的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和浓度为10mm并且ph为5.9至6.1的组氨酸缓冲液的药物制剂。
在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和浓度为5mm至15mm并且ph为约6.0的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和浓度为8mm至12mm并且ph为约6.0的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和浓度为约10mm并且ph为约6.0的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和浓度为10mm并且ph为约6.0的组氨酸缓冲液的药物制剂。
在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和浓度为5mm至15mm并且ph为6.0的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和浓度为8mm至12mm并且ph为6.0的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和浓度为约10mm并且ph为6.0的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂和浓度为10mm并且ph为6.0的组氨酸缓冲液的药物制剂。
在另一实施方式中,本公开提供包括抗原结合蛋白质、非离子型表面活性剂和缓冲液的药物制剂。在其他实施方式中,本公开提供包括抗原结合蛋白质、聚山梨醇酯和缓冲液的药物制剂。在其他实施方式中,本公开提供包括抗原结合蛋白质、聚山梨醇酯20和缓冲液的药物制剂。在其他实施方式中,本公开提供包括抗原结合蛋白质、聚山梨醇酯80和缓冲液的药物制剂。在其他实施方式中,本公开提供包括抗原结合蛋白质、聚山梨醇酯20和缓冲液的药物制剂,其中所述聚山梨醇酯20的浓度为0.05%(w/w)至0.2%(w/w)。在其他实施方式中,本公开提供包括抗原结合蛋白质、聚山梨醇酯20和缓冲液的药物制剂,其中所述聚山梨醇酯20的浓度为约0.1%(w/w)。在其他实施方式中,本公开提供包括抗原结合蛋白质、聚山梨醇酯20和缓冲液的药物制剂,其中所述聚山梨醇酯20的浓度为0.1%(w/w)。
在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为5.5至6.5的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为5.9至6.1的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为约6.0的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为6.0的组氨酸缓冲液的药物制剂。
在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为5.5至6.5的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为5.9至6.1的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为约6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。
在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为5.5至6.5的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为5.9至6.1的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为约6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。
在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为5.5至6.5的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为5.9至6.1的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为约6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202。
在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为5.5至6.5的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为5.9至6.1的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为约6.0的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为6.0的组氨酸缓冲液的药物制剂。
在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为5.5至6.5的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为5.9至6.1的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为约6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。
在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为5.5至6.5的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为5.9至6.1的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为约6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。
在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为5.5至6.5的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为5.9至6.1的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为约6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202。
在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为5.5至6.5的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为5.9至6.1的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为约6.0的组氨酸缓冲液的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为6.0的组氨酸缓冲液的药物制剂。
在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为5.5至6.5的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为5.9至6.1的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为约6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。在另一实施方式中,本公开提供包括抗cd38抗体、非离子型表面活性剂和ph为6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.5至6.5的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.9至6.1的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为约6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.5至6.5的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.9至6.1的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为约6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,其中所述聚山梨醇酯20的浓度为0.05%(w/w)至0.2%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.5至6.5的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,并且其中所述聚山梨醇酯20的浓度为0.05%(w/w)至0.2%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.9至6.1的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,并且其中所述聚山梨醇酯20的浓度为0.05%(w/w)至0.2%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为约6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,并且其中所述聚山梨醇酯20的浓度为0.05%(w/w)至0.2%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,并且其中所述聚山梨醇酯20的浓度为0.05%(w/w)至0.2%(w/w)。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202并且其中所述聚山梨醇酯20的浓度为0.05%(w/w)至0.2%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.5至6.5的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202并且其中所述聚山梨醇酯20的浓度为0.05%(w/w)至0.2%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.9至6.1的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202并且其中所述聚山梨醇酯20的浓度为0.05%(w/w)至0.2%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为约6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202并且其中所述聚山梨醇酯20的浓度为0.05%(w/w)至0.2%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202并且其中所述聚山梨醇酯20的浓度为0.05%(w/w)至0.2%(w/w)。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,其中所述聚山梨醇酯20的浓度为约0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.5至6.5的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,并且其中所述聚山梨醇酯20的浓度为约0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.9至6.1的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,并且其中所述聚山梨醇酯20的浓度为约0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为约6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,并且其中所述聚山梨醇酯20的浓度为约0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,并且其中所述聚山梨醇酯20的浓度为约0.1%(w/w)。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202并且其中所述聚山梨醇酯20的浓度为约0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.5至6.5的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202并且其中所述聚山梨醇酯20的浓度为约0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.9至6.1的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202并且其中所述聚山梨醇酯20的浓度为约0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为约6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202并且其中所述聚山梨醇酯20的浓度为约0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202并且其中所述聚山梨醇酯20的浓度为约0.1%(w/w)。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,其中所述聚山梨醇酯20的浓度为0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.5至6.5的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,并且其中所述聚山梨醇酯20的浓度为0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.9至6.1的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,并且其中所述聚山梨醇酯20的浓度为0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为约6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,并且其中所述聚山梨醇酯20的浓度为0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,并且其中所述聚山梨醇酯20的浓度为0.1%(w/w)。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202,其中所述聚山梨醇酯20的浓度为0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.5至6.5的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202,并且其中所述聚山梨醇酯20的浓度为0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为5.9至6.1的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202,并且其中所述聚山梨醇酯20的浓度为0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为约6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202,并且其中所述聚山梨醇酯20的浓度为0.1%(w/w)。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和ph为6.0的组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202,并且其中所述聚山梨醇酯20的浓度为0.1%(w/w)。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,并且其中所述组氨酸缓冲液的ph为5.9至6.1。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,并且其中所述组氨酸缓冲液的ph为约6.0。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,并且其中所述组氨酸缓冲液的ph为6.0。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,其中所述聚山梨醇酯20的浓度为约0.1%(w/w)并且其中所述组氨酸缓冲液的ph为5.9至6.1。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,其中所述聚山梨醇酯20的浓度为约0.1%(w/w)并且其中所述组氨酸缓冲液的ph为约6.0。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,其中所述聚山梨醇酯20的浓度为约0.1%(w/w),并且其中所述组氨酸缓冲液的ph为6.0。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,其中所述聚山梨醇酯20的浓度为0.1%(w/w)并且其中所述组氨酸缓冲液的ph为5.9至6.1。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,其中所述聚山梨醇酯20的浓度为0.1%(w/w)并且其中所述组氨酸缓冲液的ph为约6.0。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,其中所述聚山梨醇酯20的浓度为0.1%(w/w)并且其中所述组氨酸缓冲液的ph为6.0。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链并且其中所述组氨酸缓冲液的ph为5.9至6.1。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链并且其中所述组氨酸缓冲液的ph为约6.0。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,并且其中所述组氨酸缓冲液的ph为6.0。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,其中所述聚山梨醇酯20的浓度为约0.1%(w/w)并且其中所述组氨酸缓冲液的ph为5.9至6.1。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,其中所述聚山梨醇酯20的浓度为约0.1%(w/w)并且其中所述组氨酸缓冲液的ph为约6.0。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,其中所述聚山梨醇酯20的浓度为约0.1%(w/w),并且其中所述组氨酸缓冲液的ph为6.0。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,其中所述聚山梨醇酯20的浓度为0.1%(w/w)并且其中所述组氨酸缓冲液的ph为5.9至6.1。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,其中所述聚山梨醇酯20的浓度为0.1%(w/w)并且其中所述组氨酸缓冲液的ph为约6.0。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链,其中所述聚山梨醇酯20的浓度为0.1%(w/w),并且其中所述组氨酸缓冲液的ph为6.0。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202,其中所述聚山梨醇酯20的浓度为约0.1%(w/w)并且其中所述组氨酸缓冲液的ph为5.9至6.1。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202,其中所述聚山梨醇酯20的浓度为约0.1%(w/w)并且其中所述组氨酸缓冲液的ph为约6.0。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202,其中所述聚山梨醇酯20的浓度为约0.1%(w/w),并且其中所述组氨酸缓冲液的ph为6.0。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202,其中所述聚山梨醇酯20的浓度为0.1%(w/w)并且其中所述组氨酸缓冲液的ph为5.9至6.1。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202,其中所述聚山梨醇酯20的浓度为0.1%(w/w)并且其中所述组氨酸缓冲液的ph为约6.0。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体是mor202,其中所述聚山梨醇酯20的浓度为0.1%(w/w),并且其中所述组氨酸缓冲液的ph为6.0。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,其中所述组氨酸缓冲液的ph为5.9至6.1并且其中所述抗cd38抗体的浓度为65mg/ml。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,其中所述组氨酸缓冲液的ph为约6.0,并且其中所述抗cd38抗体的浓度为65mg/ml。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,其中所述组氨酸缓冲液的ph为6.0,并且其中所述抗cd38抗体的浓度为65mg/ml。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,其中所述聚山梨醇酯20的浓度为约0.1%(w/w),其中所述组氨酸缓冲液的ph为5.9至6.1,并且其中所述抗cd38抗体的浓度为65mg/ml。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,其中所述聚山梨醇酯20的浓度为约0.1%(w/w),其中所述组氨酸缓冲液的ph为约6.0,并且其中所述抗cd38抗体的浓度为65mg/ml。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,其中所述聚山梨醇酯20的浓度为约0.1%(w/w),其中所述组氨酸缓冲液的ph为6.0,并且其中所述抗cd38抗体的浓度为65mg/ml。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,其中所述聚山梨醇酯20的浓度为0.1%(w/w),其中所述组氨酸缓冲液的ph为5.9至6.1,并且其中所述抗cd38抗体的浓度为65mg/ml。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,其中所述聚山梨醇酯20的浓度为0.1%(w/w),其中所述组氨酸缓冲液的ph为约6.0,并且其中所述抗cd38抗体的浓度为65mg/ml。在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20和组氨酸缓冲液的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3,其中所述聚山梨醇酯20的浓度为0.1%(w/w),其中所述组氨酸缓冲液的ph为6.0,并且其中所述抗cd38抗体的浓度为65mg/ml。
在一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂、缓冲液和稳定剂的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂、缓冲液和稳定剂的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂、缓冲液和稳定剂的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂、缓冲液和稳定剂的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂、缓冲液和稳定剂的药物制剂,其中所述抗cd38抗体是mor202。
在一实施方式中,本公开提供包括抗原结合蛋白质、表面活性剂、缓冲液和蔗糖的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂、缓冲液和蔗糖的药物制剂。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂、缓冲液和蔗糖的药物制剂,其中所述抗cd38抗体具有seqidno.:1的hcdr1、seqidno.:2的hcdr2、seqidno.:3的hcdr3、seqidno.:4的lcdr1、seqidno.:5的lcdr2和seqidno.:6的lcdr3。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂、缓冲液和蔗糖的药物制剂,其中所述抗cd38抗体具有seqidno.:7的可变重链和seqidno.:8的可变轻链。在另一实施方式中,本公开提供包括抗cd38抗体、表面活性剂、缓冲液和蔗糖的药物制剂,其中所述抗cd38抗体是mor202。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20、组氨酸缓冲液和蔗糖的药物制剂,其中所述抗cd38抗体是mor202,其中所述聚山梨醇酯20的浓度为约0.1%(w/w),其中所述组氨酸缓冲液的浓度为约10mm并且ph为5.9至6.1,并且其中所述蔗糖的浓度为150至350mm。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20、组氨酸缓冲液和蔗糖的药物制剂,其中所述抗cd38抗体是mor202,其中所述聚山梨醇酯20的浓度为约0.1%(w/w),其中所述组氨酸缓冲液的浓度为约10mm并且ph为5.9至6.1,并且其中所述蔗糖的浓度为175至300mm。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20、组氨酸缓冲液和蔗糖的药物制剂,其中所述抗cd38抗体是mor202,其中所述聚山梨醇酯20的浓度为约0.1%(w/w),其中所述组氨酸缓冲液的浓度为约10mm并且ph为5.9至6.1,并且其中所述蔗糖的浓度为约260mm。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20、组氨酸缓冲液和蔗糖的药物制剂,其中所述抗cd38抗体是mor202,其中所述聚山梨醇酯20的浓度为0.1%(w/w),其中所述组氨酸缓冲液的浓度为10mm并且ph为约6.0,并且其中所述蔗糖的浓度为260mm。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20、组氨酸缓冲液和蔗糖的药物制剂,其中所述抗cd38抗体是浓度为约65mg/ml的mor202,其中所述聚山梨醇酯20的浓度为约0.1%(w/w),其中所述组氨酸缓冲液的浓度为约10mm并且ph为5.9至6.1,并且其中所述蔗糖的浓度为约260mm。
在另一实施方式中,本公开提供包括抗cd38抗体、聚山梨醇酯20、组氨酸缓冲液和蔗糖的药物制剂,其中所述抗cd38抗体是浓度为65mg/ml的mor202,其中所述聚山梨醇酯20的浓度为0.1%(w/w),其中所述组氨酸缓冲液的浓度为10mm并且ph为约6.0,并且其中所述蔗糖的浓度为260mm。
在某些实施方式中,本公开提供冻干药物制剂,其由本发明公开的任意药物制剂制备。在某些实施方式中,本公开提供通过将本公开所述的抗cd38抗体的药物制剂冻干而制备的抗cd38抗体的冻干药物制剂。
在某些实施方式中,本公开提供制备抗cd38抗体的液体制剂的方法,所述方法包括提供根据本公开的冻干药物制剂和重构所述冻干制剂。
在某些实施方式中,本公开提供制备抗cd38抗体的液体制剂的方法,所述方法包括提供根据本公开的冻干药物制剂和重构所述冻干制剂,其中所述重构经由添加水或药学可接受的试剂来实现。在某些实施方式中,本公开提供制备抗cd38抗体的液体制剂的方法,所述方法包括提供根据本公开的冻干药物制剂和重构所述冻干制剂,其中所述重构经由添加水来实现。
在某些实施方式中,本公开提供通过重构本公开的冻干制剂而获得的抗cd38抗体的重构药物制剂。在某些实施方式中,所述重构经由向包括抗cd38抗体的冻干溶液中添加水或药学可接受的试剂来实现。在某些实施方式中,所述重构经由向抗cd38抗体的冻干溶液中添加水来实现。
在某些实施方式中,本公开提供液体制剂或冻干制剂或由冻干制剂重构的液体制剂。
在某些实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为5.5至6.5的组氨酸缓冲液的重构药物制剂,其中所述抗cd38抗体的浓度为55-75mg/ml。在某些实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为5.5至6.5的组氨酸缓冲液的重构药物制剂,其中所述抗cd38抗体的浓度为62.5-67.5mg/ml。在某些实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为5.5至6.5的组氨酸缓冲液的重构药物制剂,其中所述抗cd38抗体的浓度为约65mg/ml。在某些实施方式中,本公开提供包括抗cd38抗体、表面活性剂和ph为5.5至6.5的组氨酸缓冲液的重构药物制剂,其中所述抗cd38抗体的浓度为65mg/ml。
在某些实施方式中,重构药物制剂还包括稳定剂。合适的稳定剂包括但不限于人血清白蛋白、牛血清白蛋白、α-酪蛋白、球蛋白、a-乳清蛋白、ldh、溶菌酶、肌红蛋白、卵清蛋白和核糖核酸酶a。稳定剂还包括氨基酸及其代谢物,例如,甘氨酸、丙氨酸、精氨酸、甜菜碱、亮氨酸、赖氨酸、谷氨酸、天冬氨酸、脯氨酸、4-羟基脯氨酸、肌氨酸、γ-氨基丁酸(gaba)、奥品类(opines)(丙氨奥品(alanopine)、章鱼碱、甘氨奥品(strombine))和三甲胺n-氧化物(tmao)。稳定剂还可以包括糖醇和单糖、二糖或多糖,例如甘露醇、山梨糖醇、海藻糖、葡萄糖、乳糖、蔗糖等。优选地,稳定剂是蔗糖。
在某些实施方式中,本公开提供包括抗cd38抗体、表面活性剂、ph为5.5至6.5的组氨酸缓冲液和稳定剂的重构药物制剂,其中所述抗cd38抗体的浓度为55-75mg/ml。在某些实施方式中,在某些实施方式中,本公开提供包括抗cd38抗体、表面活性剂、ph为5.5至6.5的组氨酸缓冲液和稳定剂的重构药物制剂,其中所述抗cd38抗体的浓度为62.5-67.5mg/ml。在某些实施方式中,在某些实施方式中,本公开提供包括抗cd38抗体、表面活性剂、ph为5.5至6.5的组氨酸缓冲液和稳定剂的重构药物制剂,其中所述抗cd38抗体的浓度为约65mg/ml。在某些实施方式中,在某些实施方式中,本公开提供包括抗cd38抗体、表面活性剂、ph为5.5至6.5的组氨酸缓冲液和稳定剂的重构药物制剂,其中所述抗cd38抗体的浓度为65mg/ml。
在某些实施方式中,本公开的药物制剂用于治疗疾病或病症。在某些实施方式中,本公开提供治疗受试者中疾病或病症的方法,其包括向所述受试者施用有效量的本公开的药物制剂。在某些实施方式中,本公开提供本公开的药物制剂用于制备用于治疗疾病或病症的药物的用途。
实施例
实施例1:抗cd38抗体的液体制剂
开发适合于长期存储的抗cd38特异性抗体mor202的液体制剂。
制剂策略由以下组成:基于热稳定性的缓冲液和ph筛选,然后是重点在于针对聚集体形成的保护性特性的赋形剂优化。缓冲液筛选通过差示扫描量热法(dsc)进行,并产生两个先导缓冲液:组氨酸缓冲液(10mm组氨酸ph6.8)和磷酸盐缓冲液(10mm磷酸盐缓冲液ph6.6)。在全因子设计中将这些缓冲液与nacl和蔗糖组合。
样品经受冷冻-解冻以及热机械应力,并目测检查乳光和颗粒形成。最后,通过uv光谱、尺寸排阻色谱(sec)和动态光散射(dls)对不同配方的产物进行表征。分析结果的加权排序确定磷酸盐或组氨酸缓冲液与125mmnacl是最有利的组合物。组氨酸缓冲液表现出优越的针对冷冻-解冻的保护性能,因此被选择为最终制剂的基础。
基于来自该研究的数据和来自在先的预制剂工作的经验,选择以下制剂(cmc-1制剂):
10mml-组氨酸,ph6.8
140mmnacl
0.02%tween20
cmc-1制剂用于i/iia期临床研究中。
实施例2:冻干制剂的预制剂开发
启动预制剂项目,以开发用于iii期临床试验和用于市场供应的抗cd38特异性抗体mor202的药物产品的制剂。
该研究的目的包括:
·确认最大化学和物理稳定性的ph以及蛋白质浓度对分子稳定性的影响
·评价剪切力(震摇)和冷冻-解冻循环对分子的物理和化学稳定性的影响
·确定稀释到0.9%nacl盐水(生理盐水)中之后的蛋白质稳定性
实施例2.1:原料药的浓度
将mor202原料药通过切向流过滤(omegacentramate30kd0.02sqm,pall)浓缩至终浓度为80-90mg/ml。使用不超过6psi的跨膜压力来监测切向流过滤过程。将产生的经浓缩的溶液分成小批量,装入slide-a-lyzer透析瓶,并用各个缓冲液(2.0升,至少5x缓冲液交换)透析24小时。将0.3%nacl加入到柠檬酸盐缓冲液基质中,以增加离子强度并使mor202溶液稳定化。
缓冲液交换完成时测量mor202浓度。随后将溶液用各个缓冲液稀释,并使用0.22μm注射器式滤器(pvdf、millipore或pall)过滤。然后将经过滤的制剂装填到5ml玻璃小瓶中,装塞,并密封。
关键预制剂测试总结于图1中。对两种不同的mor202浓度进行测试:–50g/l和75g/l。基于预实验和经验,对两种关键缓冲液系统进行比较:组氨酸缓冲液和柠檬酸盐缓冲液。
实施例2.2:稳定性和应力测试
对实施例2.1中制备的溶液进行各种稳定性和应力测试。主要目的在于确定最佳ph,并研究蛋白质浓度的影响。
稳定性通过将小瓶存储在不同的条件下测试:5±3℃、25±2℃/60±5%rh,和40±2℃/75±5%rh(rh=相对湿度)。在某些时间点对样品进行考察。进行的测试以及测试间隔如图2中所示。
使用剪切和冷冻-解冻循环来考察有效解决制剂的任何物理稳定性问题(例如,聚集、外观)并且在加工过程中(例如,混合、泵送)保护api所需的表面活性剂浓度。从之前的研究已知,聚山梨醇酯20针对降解和聚集提供保护。测试以下聚山梨醇酯20浓度(w/v%):0.02%、0.04%和0.1%。
对于剪切测试,将溶液在室温下在40-60rpm的旋转振荡器上搅动24和48小时。分析物理外观(目测)、纯度(sec)、蛋白质含量(uv)和流体动力学尺寸(hydrodynamicsize)/可溶性聚集(dls)。
对于冷冻-解冻测试,制剂经受三(3)个冷冻-解冻循环(-70℃)。样品如剪切测试中那样进行分析。
对于盐水稀释测试,将制剂用生理盐水以1:100稀释。纯度经由sec测量。显微镜下可见的颗粒经由hiac测量。
实施例2.3:稳定性测试结果
稳定性测试结果总结于图3a-3g中。做出以下观察:
·组氨酸缓冲液在使api(mor202)稳定化方面优异。
·稳定性研究期间没有观察到显著的外观和ph的差异。
·没有检测到uv含量随时间的显著差异。在最终检查点似乎所有制剂的蛋白质含量均有增加。蛋白质浓度增加可归因于方法的变异性,因为标准溶液也检测到同样的增加。
·sec分析表明所有制剂在5℃下具有稳定性,但ph5.5l-组氨酸(75g/l)制剂除外,该制剂在2周后表现出聚集体和污染物的增加。
·随着ph的增加,颗粒数增加。
·整个稳定性研究期间,dls评估的尺寸保持不变。
总之,选择以下先导缓冲系统作为进一步开发的基础:
该先导缓冲系统的结果可以描述如下:
外观:溶液在零时间点澄清,在稳定性期间变得略呈乳光;颜色和颗粒的存在保持恒定
uv含量:恒定
ph:恒定
hiac:在稳定性过程中对于每个直径颗粒数量保持类似,零时间点时最低
sec:%igg在5℃下恒定;在40℃降低
%聚集体在5℃下恒定,在40℃增加
%污染物在5℃下恒定,在40℃增加
该制剂在零时间点聚集体的值最低,igg的值最高。
dls:通过dls评估的尺寸在整个稳定性研究的期间保持不变。
实施例2.4:剪切测试、冷冻/解冻测试和盐水稀释测试的结果
mor202溶液在实施例2.3中鉴别的先导缓冲系统中进行测试。聚山梨醇酯20浓度调节至0.02%、0.04%和0.1%。
剪切测试的结果示于图4a-4c中。
冷冻/解冻测试的结果示于图4d-4e中。
盐水溶液测试的结果示于图4f中。
剪切测试的结果:
·剪切48小时之后物理外观仅在乳光方面改变。含有0.02%聚山梨醇酯20的制剂含有最高级别的乳光。纤维和颗粒的形状和外观(aspect)似乎并不归因于产品。可以想到的是,纤维和颗粒的存在是外部来源的。
·对于ps20浓度为0.04%和0.1%的制剂,uv含量略有降低。
·sec结果表明,所有ps20浓度均有%igg少量降低以及相应的%聚集体少量增加的特征。
·当通过dls评估样品时,没有观察到尺寸和多分散性的大的变化。
冷冻/解冻测试的结果:
·纤维和颗粒的形状和外观似乎不归因于产品。可以想象,纤维和颗粒的存在是外部来源。
·所有ps20浓度的uv含量的略微增加都可归因于方法变异性。
·关于sec结果,所有ps20浓度均显示%igg小幅降低和相应的%聚集体的小幅增加。
·通过dls评估的尺寸保持不变。
盐水稀释测试的结果:
·如通过sec所评估,在所有制剂中在零时间点和24小时时间点之间没有显著差异。
·通过不透光度观察到所有直径范围内颗粒数量的增加。在初始含有0.04%聚山梨醇酯20的溶液中检测到的增加最高,其中对于2μm尺寸范围,颗粒数量增加四倍。
实施例2.5:预制剂开发的最终结果
进行一系列预制剂研究,选择最佳ph和使mor202稳定化所必需的赋形剂。这些研究涉及确认5.5至6.3的最佳ph,研究聚山梨醇酯20对冷冻-解冻和搅动的影响,以及在生理盐水中稀释时mor202的稳定性。
分子在10mm组氨酸缓冲液ph6.0中表现出良好的化学和物理稳定性。基于这些研究的结果,10mm组氨酸缓冲液ph6.0被认为是用于mor202制剂的最佳基质。
基于剪切、冷冻-解冻和稀释研究的结果,发现聚山梨醇酯20的存在是重要且优选的。
选择以下组成作为进一步制剂开发的基础:
该制剂的特征可以描述如下:
外观:仅在48h剪切之后变得呈乳光
uv含量:在48h剪切之后显示降低,在第3次冷冻/解冻循环之后显示增加
sec:在剪切和冷冻/解冻循环测试之后%igg少量降低以及相应的%聚集体少量增加。对于盐水稀释测试,%igg和%聚集体保持恒定。
hiac:在盐水测试期间对于所有直径颗粒的数量增加。颗粒总数量显著低于使用0.04%ps20的情况。
dls:通过dls评估的尺寸保持不变。
实施例3:mor202冻干制剂的制剂开发
预制剂之后,启动新的项目,以开发用于抗cd38特异性抗体mor202的药物产品的制剂。
该研究的目的包括:
·制备冻干mor202原型制剂,以评价冷冻干燥过程的稳定性;
·分析冻干mor202原型制剂的稳定性;
·基于稳定性数据选择一先导mor202冷冻干燥制剂;
·基于所选择的先导mor202制剂开发和优化冷冻干燥循环;
·推荐适合于在装填/精加工设备中工艺转移和放大的冻干循环。
实施例3.1:原型制剂的热评估
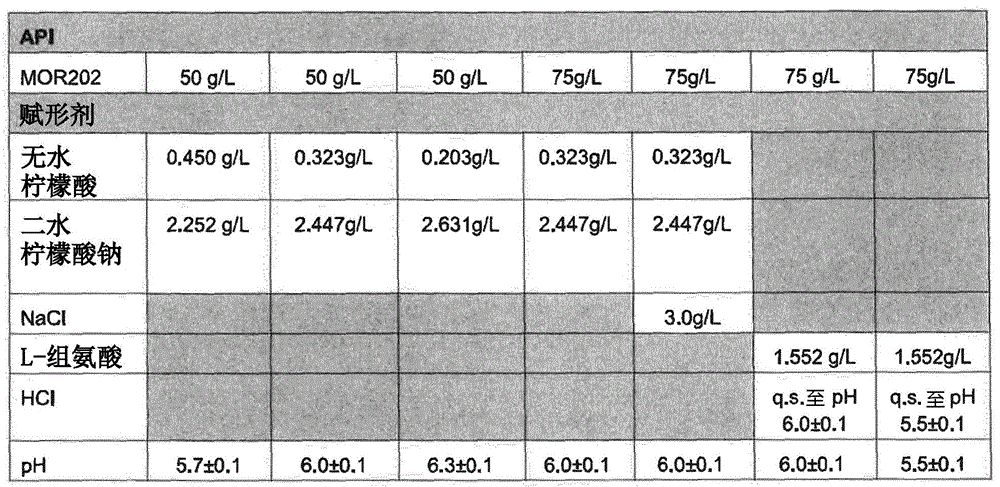
基于之前的知识和预制剂研究中获得的信息,选择以下制剂进行冷冻干燥开发的筛选:
表1:筛选冷冻干燥开发的原型制剂
评价原型制剂的热性质,基于分析结果,提出适合于五个原型的冷冻干燥循环。
对表1的原型制剂进行热性质评估之后,将mor202的浓度从75mg/ml降低至65mg/ml。api浓度的降低不影响原型制剂的热性质。
表2:筛选冷冻干燥开发的新的原型制剂
表2的新的原型制剂称作f1-f5。
对影响冷冻、冷冻-干燥、传热和传质的物理化学的参数的理解是确定冻干循环参数的关键。使用pyris1perkinelmer系统进行低温差示扫描量热(dsc)研究。使用的参数示于表3中。
表3:dsc研究的参数:
主要焦点在于识别结晶发生的温度(共晶点,te)和识别最大冷冻-浓缩溶液的玻璃化转变温度(tg’)。得到所有原型溶液f1-f5的热谱图(冷冻和加热曲线)。所有结果总结于表4中:
表4:dsc研究的结果
所有五个制剂具有可比较的共晶点,表明与一个冷冻干燥循环的相容性。制剂f2、f4和f5呈轻微乳光,但目测没有观察到沉淀物/聚集体。制剂f2和f4的渗透压(osmolality)接近350mosmol/kg,仍在静脉给药的可接受范围内。但是,如果目标渗透压更加接近300mosmol/kg的标准,则f2和f4的蔗糖含量可以分别降低12和10mg。这将使渗透压更接近310mosmol/kg,而不影响制剂的热性能。
基于这些考虑,为第一次冻干运行定义了初始冻干参数。
实施3.2:原型制剂的初始冷冻干燥
将原型溶液f1-f5(参见表2)冷冻干燥。初始参数基于dcs研究的结果(参见实施例3.1)。
将配置的原溶液使用0.22pmpvdf滤器过滤,并装入20r小瓶,装填体积为5.00ml+0.3ml过填充。
循环长度为约64小时。实时监测循环。第一和第二干燥分别从最初提出的50小时减少至46小时,以及从20小时减少至8小时。方案(recipe)显示于表5。
表5:原型冻干筛选的冻干方案
所有五个自己的饼状物看起来干燥良好。总体上,外观可以分类如下(从较好到不太好):f3=f5>f2=f4>f1。该分类将饼状物中裂缝的数量、收缩水平和破裂倾向均考虑在内。所有制剂的小瓶的照片显示于图5。
实施例3.3:冷冻干燥和液体原型制剂测试
分析液体和冷冻干燥的原型制剂的以下参数:
·外观(液体和冻干)
·水分含量(仅冻干)
·ph(液体和冻干)
·尺寸排阻色谱(液体和冻干)
·显微镜下可见的颗粒(hiac)(液体和冻干)
·dls(液体和冻干)
·重构时间(冻干)
·uv(液体和冻干)
另外测试了制剂在不同温度下(2-8℃,0%rh;25℃,60%rh;40℃,75%rh)存储不同时间点(0、2和4周)的制剂稳定性。
液体制剂的结果显示于图7a-7h中。冻干制剂的结果显示于图8a-8e中。
实施例3.4:最终结果
基于五个原型液体和冷冻干燥制剂的深度分析,选择制剂f3用于开发步骤。
制剂f3显示的乳光程度最低。另外,与所测试的其他四个制剂相比,在稳定性研究期间没有观察到液体制剂的显微镜下可见的颗粒的增加。而且,冷冻干燥制剂在重构之后制剂f3显示的乳光程度也最低,并且稳定性研究期间没有观察到聚集体的增加。
实施例4:冻干的优化
在若干后续步骤中对冻干过程加以优化。各个后续过程利用了在先实验期间获得的结果和经验。在冻干过程中评价的关键工艺参数是温度、压力和时间。
实施例4.1:首次优化
基于第一次冻干实验(参见实施例3)中收集的结果,对方法进行改良。主要目的之一在于缩短二次干燥过程,并且使升温速率(ramprate)适合于不同冷冻/加热步骤。首次优化的冻干方案显示于表6中。总循环的长度为约72小时。
表6:首次优化的冻干方案
分析结果确认,冻干的药物产品表现出期望的特性,并且未显示任何异常。
在5小时的二次干燥(步骤8)之后,残余水分含量为0.9%w/w,使使得该步骤必须延长额外的3小时。8小时之后,残余水分含量为0.3%w/w,即,低于<0.5%w/w的目标。
另外还观察到,一次干燥和之后的二次干燥步骤的升温有可能缩短。这可以导致整个过程额外节省约4个小时。
所有饼状物均干燥良好。
对饼状物的外观进行分类,将饼状物中的裂缝数量、收缩水平和破裂倾向均考虑在内。
所测试的24个小瓶分类如下:
9个小瓶很好
13个小瓶有非常轻微的收缩
2个小瓶有裂缝
使用冷冻干燥显微术(fdm)来确认药物产品的临界温度。fdm使用btllyostat冷冻干燥显微镜(idpds250)进行。
对1.5pl的样品溶液进行分析,以允许样品冷冻干燥的实时观察。从fdm获取的信息是制剂的塌陷点(tc)和共晶(teu)点。
一些样品表现出塌陷区(collapsezone)行为,即,干燥样品的结构在温度范围内逐渐丧失,而不是在明确的点处丧失。
在-26.8℃下观察到第一个塌陷的迹象。随着升华的进行和温度的升高,塌陷也变得更加明显。表中总结了较低的塌陷区温度,并推荐一次干燥的温度和压力。
表7:首次优化的fdm分析小结
得出以下结论:
·整个一次干燥过程中温度应当理想地保持成低于其各自的塌陷区下限,以防止产品塌陷
·出于额外的产品安全性和质量,应当设想2℃至7℃的安全余量。这可以适应规模放大、技术转移和使用不同的冷冻干燥机过程中可能发生的微小变化
·一次干燥的温度不应升高
实施例4.2:第二次优化
与首次优化比较,在第二次优化中,增加一次干燥和二次干燥的升温速率。一次温度保持在-15℃。
表8:第二次优化的冻干方案
总循环的长度为约66小时,即,大大短于首次优化。
分析结果确认,冻干的药物产品表现出期望的特性,并且未显示任何异常。
所有饼状物均干燥良好。
再次,对饼状物的外观进行分类,将饼状物中的裂缝数量、收缩水平和破裂倾向均考虑在内。
所测试的29个小瓶分类如下:
27个小瓶有非常轻微的收缩
2个小瓶有非常轻微的收缩并且在表面上有裂缝
进行的观察和对下一轮优化可能的改变:
·通过应用不同的升温速率和条件并没有改善冻干饼状物;饼状物外观可能是因为赋形剂和药物产品
·冷冻步骤中的升温速率1℃/min不可能用于所有常用的冷冻干燥机,因此推荐以安全余量工作,并使用0.5℃/min的冷冻升温速率
实施例4.3:第三次优化
该优化的主要焦点在于确保药物产品的质量不受到在规模放大至商业规模的过程中可能发生的温度和压力变化影响。为了测试最恶劣情况下的条件,对±3℃的温度变化和±30μbars的压力变化进行评价。
对于稳健性研究进行两次冻干实验ht/hp和lt/lp,试验在实验室规模(0.5m2冻干装置)下进行作为衔接实验室规模的外推和gmp制造之间的手段。
该优化目的在于对高温和高压条件进行考察。
表9:第三次优化的冻干方案
总循环的长度为约64小时,即,比上一次优化又更短。
分析结果确认,冻干的药物产品表现出期望的特性,并且未显示任何异常。
所有饼状物均干燥良好。
再次,对饼状物的外观进行分类,将饼状物中的裂缝数量、收缩水平和破裂倾向均考虑在内。
所测试的29个小瓶分类如下:
24个小瓶有凝聚的白色饼状物,其有非常轻微的收缩
5个小瓶有非常轻微的收缩并且在表面上有裂缝
实施例4.4:第四次优化
该优化的目的在于对低温低压条件进行考察。
表10:第四次优化的冻干方案
总循环的长度再次为约64小时。
分析结果确认,冻干的药物产品显示出预期的特性,并且不显示任何异常。
所有26个饼状物均干燥良好,并且凝聚。26个小瓶中有3个小瓶显示并不认为是缺陷的轻微收缩。
这些运行的结果已经证明,所选择的制剂即便在冻干工艺步骤中有温度和压力的较小变化时也能够成功地得以冻干。
这便确保了用于大规模常规制造的稳定可靠过程。
实施例4.5:第五次优化
基于迄今掌握的所有经验,进行第五次优化。
表11:第五次优化的冻干方案
总循环的长度为约66小时。
分析结果确认,冻干产品显示出预期的特性,并且不显示任何异常。图8示出冻干药物产品的分析结果。重构体积为4.8ml。所有饼状物都是凝聚的。
215个小瓶是一致的。215个一致小瓶中有3个在表面上显示并不认为是缺陷的裂缝。60个小瓶由于瓶塞和瓶颈之间的药物产品而被丢弃。该缺陷与冻干方法无关,但与装填方法有关。44个小瓶在靠近瓶塞处显示出污点,或者在瓶塞和架子(rack)之间存在有非常少量的产品。该缺陷可能是在冻干机装载过程中造成的。示例性饼状物的图片显示于图9中。
第五次优化的结果说明,该方法是稳健的,并且适于制造gmp材料。
序列表
<110>莫佛塞斯公司
<120>抗体制剂
<130>ms287ep-prov
<140>
<141>
<160>11
<170>patentin版本3.5
<210>1
<211>5
<212>prt
<213>人工序列
<220>
<221>来源
<223>/注解=“人工序列的说明:合成肽"
<400>1
sertyrtyrmetasn
15
<210>2
<211>17
<212>prt
<213>人工序列
<220>
<221>来源
<223>/注解=“人工序列的说明:合成肽"
<400>2
glyileserglyaspproserasnthrtyrtyralaaspservallys
151015
gly
<210>3
<211>11
<212>prt
<213>人工序列
<220>
<221>来源
<223>/注解=“人工序列的说明:合成肽"
<400>3
aspleuproleuvaltyrthrglyphealatyr
1510
<210>4
<211>11
<212>prt
<213>人工序列
<220>
<221>来源
<223>/注解=“人工序列的说明:合成肽"
<400>4
serglyaspasnleuarghistyrtyrvaltyr
1510
<210>5
<211>7
<212>prt
<213>人工序列
<220>
<221>来源
<223>/注解=“人工序列的说明:合成肽"
<400>5
glyaspserlysargproser
15
<210>6
<211>9
<212>prt
<213>人工序列
<220>
<221>来源
<223>/注解=“人工序列的说明:合成肽"
<400>6
glnthrtyrthrglyglyalaserleu
15
<210>7
<211>120
<212>prt
<213>人工序列
<220>
<221>来源
<223>/注解=“人工序列的说明:合成多肽"
<400>7
glnvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrphesersertyr
202530
tyrmetasntrpvalargglnalaproglylysglyleuglutrpval
354045
serglyileserglyaspproserasnthrtyrtyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargaspleuproleuvaltyrthrglyphealatyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
<210>8
<211>109
<212>prt
<213>人工序列
<220>
<221>来源
<223>/注解=“人工序列的说明:合成多肽"
<400>8
aspilegluleuthrglnproproservalservalalaproglygln
151015
thralaargilesercysserglyaspasnleuarghistyrtyrval
202530
tyrtrptyrglnglnlysproglyglnalaprovalleuvaliletyr
354045
glyaspserlysargproserglyileprogluargpheserglyser
505560
asnserglyasnthralathrleuthrileserglythrglnalaglu
65707580
aspglualaasptyrtyrcysglnthrtyrthrglyglyalaserleu
859095
valpheglyglyglythrlysleuthrvalleuglygln
100105
<210>9
<211>300
<212>prt
<213>智人(homosapiens)
<400>9
metalaasncysglupheserprovalserglyasplysprocyscys
151015
argleuserargargalaglnleucysleuglyvalserileleuval
202530
leuileleuvalvalvalleualavalvalvalproargtrparggln
354045
glntrpserglyproglythrthrlysargpheprogluthrvalleu
505560
alaargcysvallystyrthrgluilehisproglumetarghisval
65707580
aspcysglnservaltrpaspalaphelysglyalapheileserlys
859095
hisprocysasnilethrglugluasptyrglnproleumetlysleu
100105110
glythrglnthrvalprocysasnlysileleuleutrpserargile
115120125
lysaspleualahisglnphethrglnvalglnargaspmetphethr
130135140
leugluaspthrleuleuglytyrleualaaspaspleuthrtrpcys
145150155160
glyglupheasnthrserlysileasntyrglnsercysproasptrp
165170175
arglysaspcysserasnasnprovalservalphetrplysthrval
180185190
serargargphealaglualaalacysaspvalvalhisvalmetleu
195200205
asnglyserargserlysilepheasplysasnserthrpheglyser
210215220
valgluvalhisasnleuglnproglulysvalglnthrleugluala
225230235240
trpvalilehisglyglyarggluaspserargaspleucysglnasp
245250255
prothrilelysgluleugluserileileserlysargasnilegln
260265270
phesercyslysasniletyrargproasplyspheleuglncysval
275280285
lysasnprogluaspsersercysthrsergluile
290295300
<210>10
<211>360
<212>dna
<213>人工序列
<220>
<221>来源
<223>/注解=“人工序列的说明:合成多核苷酸"
<400>10
caggtgcaattggtggaaagcggcggcggcctggtgcaaccgggcggcagcctgcgtctg60
agctgcgcggcctccggatttaccttttcttcttattatatgaattgggtgcgccaagcc120
cctgggaagggtctcgagtgggtgagcggtatctctggtgatcctagcaatacctattat180
gcggatagcgtgaaaggccgttttaccatttcacgtgataattcgaaaaacaccctgtat240
ctgcaaatgaacagcctgcgtgcggaagatacggccgtgtattattgcgcgcgtgatctt300
cctcttgtttatactggttttgcttattggggccaaggcaccctggtgacggttagctca360
<210>11
<211>327
<212>dna
<213>人工序列
<220>
<221>来源
<223>/注解=“人工序列的说明:合成多核苷酸"
<400>11
gatatcgaactgacccagccgccttcagtgagcgttgcaccaggtcagaccgcgcgtatc60
tcgtgtagcggcgataatcttcgtcattattatgtttattggtaccagcagaaacccggg120
caggcgccagttcttgtgatttatggtgattctaagcgtccctcaggcatcccggaacgc180
tttagcggatccaacagcggcaacaccgcgaccctgaccattagcggcactcaggcggaa240
gacgaagcggattattattgccagacttatactggtggtgcttctcttgtgtttggcggc300
ggcacgaagttaaccgttcttggccag327
- 还没有人留言评论。精彩留言会获得点赞!