抗病毒组合物的制作方法
抗病毒组合物
1.本发明涉及具有抗病毒特性的褐藻多酚,所述褐藻多酚可以是作为来自海藻的提取物获得或可获得的,包括所述褐藻多酚或所述提取物作为抗病毒剂的用途。此外,本发明涉及所述褐藻多酚或所述提取物在具有抗病毒特性的组合物中的用途以及所述组合物作为抗病毒剂的用途。
2.本说明书中对显然在前公开的文件的列举或讨论不应必然地被视为是承认所述文件是现有技术的一部分或是公知常识。
3.海藻或大型藻类通常分为以下3种类型:红藻(rhodophyta)、褐藻(phaeophyta)和绿藻(chlorophyta)。还有第四种藻类,形成簇的蓝绿藻(蓝细菌(cyanobacteria)),其有时被认为是海藻。有约10,000种海藻,其中大约6,500种是红藻,2,000种是褐藻,并且1,500种是绿藻。
4.褐藻(或褐海藻)是最大的海藻类型。褐藻可能是褐色或黄褐色的,并且通常在北半球的温带或北极水域中发现。褐藻通常具有称为“吸盘”的根状结构,以将藻类锚定至表面上。
5.尽管红藻和褐藻几乎全是海洋藻类,但是绿藻在淡水(河流和湖泊)甚至陆地(在潮湿地方的岩石、墙壁、房屋和树皮)情况下也很常见。
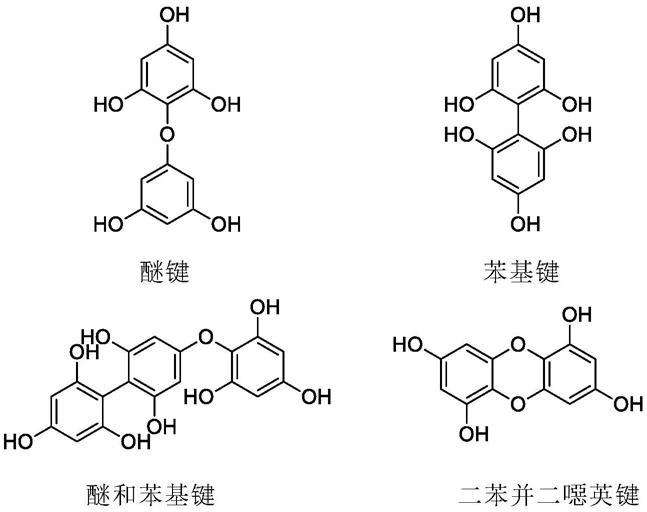
6.多酚化合物存在于多种陆地和海洋植物中。一类称为褐藻多酚的多酚类仅在棕海藻中发现。褐藻多酚是通过间苯三酚单元的聚合形成的。
[0007][0008]
间苯三酚(1,3,5
‑
三羟基苯)
[0009]
褐藻多酚由海藻作为次生代谢产物产生,并通过乙酸丙二酸途径进行生物合成。它们以游离形式存在于海藻中,或与细胞壁的不同组分(例如藻酸)形成复合物。褐藻多酚对于海藻的生理完整性是必不可少的,并且参与若干重要的次要作用,例如化学防御、防止响应于养分利用率和紫外线辐射的变化而发生的氧化损伤、与其它生物体或非生物环境的相互作用以及作为细胞壁的组成组分。
[0010]
一般而言,基于间苯三酚单元之间的键合类型和/或是否存在附加羟基,将褐藻多酚分为四个亚类,这些亚类如下:
[0011]
1.具有醚键的褐藻多酚(即多羟基苯醚(phloroethols)和多(间、邻)羟基苯醚(fuhalols),所述多(间、邻)羟基苯醚由邻苯三酚单元构建,所述邻苯三酚单元与对位和邻位排列的醚桥连接,在每个第三环中含有一个附加的oh
‑
基团)。
[0012]
2.具有苯基键的褐藻多酚(即多羟基联苯(fucols))。
[0013]
3.具有醚键和苯基键的褐藻多酚(即混合多羟基联苯多苯醚(fucophlorethols))
[0014]
4.具有二苯并二噁英键的褐藻多酚。(即二苯呋喃(eckols)和carmalols)
[0015]
褐藻多酚中的键类型的示例如下所示:
[0016][0017]
这些化合物的分子量可以在126g/mol至大于105g/mol的范围内。海藻中多酚的量随栖息地、收获时间、光强度曝光和周围水域中的养分利用率以及物种而变化。
[0018]
酚类化合物(包括褐藻多酚)的总含量通常通过比色测定(例如folin
‑
ciocalteu方法)进行测量,并且酚类的浓度通常在海藻干质量的0.1%至20%的范围内,这再次取决于上述因素。液相色谱与质谱联用的方法(有时辅以高分辨率nmr)可用于提供有关酚含量的化学组成的信息。
[0019]
使用这些技术,可以获得例如间苯三酚单元的聚合度(dp)、分子量、间苯三酚单元之间的键合类型、以及存在的异构体的信息。由于目前化学物种的复杂性和巨大多样性,此类研究远非简单易行,需要大量的精力和实验技术来提取和分级褐藻多酚,然后分析和解释结果。
[0020]
本发明的目的是提供从天然来源获得或可获得的抗病毒剂。
[0021]
本发明人已经惊奇地发现,从海藻(例如褐海藻)获得或可获得的提取物包含多酚(例如褐藻多酚),具有抗病毒活性。
[0022]
根据本发明,提供了用作抗病毒剂的褐藻多酚或褐藻多酚混合物。特别地,将分子量为约1000g/mol至约3000g/mol的褐藻多酚或褐藻多酚混合物用作抗病毒剂。褐藻多酚可用于治疗或预防病毒感染。
[0023]
还提供了一种或多种褐藻多酚作为抗病毒剂,例如用于治疗或预防病毒感染的药剂的用途。特别地,提供了一种或多种分子量为约1000g/mol至约3000g/mol的褐藻多酚作为抗病毒剂的用途。
[0024]
还提供了一种或多种褐藻多酚在抗病毒组合物,例如用于治疗或预防病毒感染的组合物的制造中的用途。特别地,提供了一种或多种分子量为约1000g/mol至约3000g/mol的褐藻多酚在抗病毒组合物,例如用于治疗或预防病毒感染的组合物的制造中的用途。
[0025]
本发明的褐藻多酚可以作为从海藻中获得或可获得的提取物提供。
[0026]
因此,根据本发明,提供了从海藻获得或可获得的提取物,所述提取物在下文中可称为“本发明的提取物”。
[0027]
本发明的提取物包含多酚。存在于本发明的提取物中的酚类化合物通常包含至少2个间苯三酚单元的低聚物,所述低聚物称为褐藻多酚。特别地,本发明的提取物包含一种或多种褐藻多酚。
[0028]
本发明的提取物可以是从选自褐海藻、绿海藻和红海藻中的至少一种海藻获得或可获得的。例如,海藻可以是从褐海藻获得或可获得的。
[0029]
例如,本发明的提取物可以是从来自以下海藻科的至少一种海藻获得或可获得的:鹿角菜科(fucaceae)、海条藻科(himanthaliaceae)、durvillaeacae、昆布科(laminariaceae)、翅藻科(alariaceae)、和/或马尾藻科(sargassaceae)。
[0030]
特别地,本发明的提取物可以是从选自以下属中的一者或多者的至少一种海藻获得或可获得的:泡叶藻属(ascophyllum)、墨角藻属(fucus)、西叶藻属(hesperophycus)、鹿角菜属(pelvetia)、pevetiopsi silvetia、海条藻属(himanthalia)、公牛藻属(durvillaea)、anthrothamnus、中华桫椤属(costularia)、cymathere、feditia、昆布属(laminaria)、巨藻属(macrocystis)、海囊藻属(nereocystis)、浮叶藻属(pelagophycus)、phyllariella、海棕榈属(postelsia)、pseudolessonia、海带属(saccharina)、steptophyllopsis、翅藻属(alaria)、aureophycus、eualaria、拟巨藻属(lessoniopsis)、中肋藻属(pleurophycus)、裙带菜属(undaria)、undariella、undariopsis acrocarpia、acystis、anthophycus、axillariella、双叉藻属(bifurcaria)、carpoglossum、carpophyllum、caulocystis、叶状茎(cladophyllum)、丝状分枝褐藻属(coccophora)、泡沫复珊瑚属(cystophora)、囊叶藻属(cystophyllum)、囊链藻属(cystoseira)、长角藻属(halidrys)、羊栖菜属(hizikia)、叶囊藻属(hormophysa)、landsburgia、囊链藻属(myagropsis)、myriodesma、nizamuddinia、oerstedtia、platythalia、马尾藻属(sargassum)、scaberia、和/或陀螺珊瑚属(turbinaria)。
[0031]
例如,本发明的提取物可以是从泡叶藻(ascophyllum nodosum)获得或可获得的。
[0032]
如本领域技术人员所理解的,如本文所用,术语“可从......获得”是指提取物可以从海藻获得或可以从海藻中分离,或者可以从替代来源获得,例如通过化学合成或酶促生产。而本文所用的术语“获得”是指提取物直接来源于海藻来源。
[0033]
本发明的提取物可包含基于提取物的干重约1重量%至约100重量%,例如约1重量%至95重量%、或2重量%至90重量%、或2重量%至约80重量%、或约5重量%至约70重量%、或约8%至约65%的褐藻多酚。
[0034]
除褐藻多酚外,本发明的粗提取物通常还包含多糖(例如岩藻多糖和海带多糖)、单糖(例如甘露醇)和矿物质(例如氯化钠)。通常,褐藻多酚将以粗提取物的约1%至约20%或约30%的量存在于所述提取物中。本领域中已知的纯化技术可用于去除物质,例如多糖和单糖,从而增加褐藻多酚的浓度。
[0035]
已经经受一个或多个纯化步骤的本发明的提取物可包含基于提取物的干重至多约100重量%的褐藻多酚。例如,此类提取物可包含基于提取物的干重至少约50重量%的褐藻多酚。本发明的这些提取物可包含基于提取物的干重约50重量%至约100重量%的褐藻多酚,例如基于提取物的干重约60重量%至约95重量%或约70重量%至约90重量%的褐藻多酚。
[0036]
本发明的褐藻多酚,例如本发明的提取物中存在的褐藻多酚,可以例如包含平均
至少约2个或至少约10个间苯三酚单元,例如平均约10个至约50个间苯三酚单位,例如平均约10个至约30个或约10个至约25个或约10个至约23个间苯三酚单元。
[0037]
本发明的褐藻多酚,例如存在于本发明的提取物中的褐藻多酚,可包含基于干提取物中的褐藻多酚的干重至少约70重量%的具有平均至少10个间苯三酚单元,例如平均约10个至23个间苯三酚单元的褐藻多酚。例如,基于干提取物中的褐藻多酚的干重约75重量%至约100重量%或约80重量%至约95重量%的此类褐藻多酚。
[0038]
本发明的褐藻多酚,例如存在于本发明的提取物中的褐藻多酚,可包含基于干提取物中的褐藻多酚的干重至少约70重量%的平均分子量超过250g/mol的褐藻多酚。例如,基于干提取物中的褐藻多酚的干重约75重量%至约100重量%或约80重量%至约95重量%的此类褐藻多酚。
[0039]
本发明的褐藻多酚,例如存在于本发明的提取物中的褐藻多酚,可包含基于干提取物中的褐藻多酚的干重至少约70重量%的平均分子量超过1000g/mol,例如约1000g/mol至约3000g/mol,例如约1200g/mol至约2500g/mol的褐藻多酚。例如,基于干提取物中的褐藻多酚的干重约75重量%至约100重量%或约80重量%至约95重量%的平均分子量超过1000g/mol,例如约1000g/mol至约3000g/mol,例如约1200g/mol至约2500g/mol的此类褐藻多酚。
[0040]
本发明的褐藻多酚,例如存在于本发明的提取物中的褐藻多酚的平均分子量可超过1000g/mol,例如约1000g/mol至约3000g/mol,例如约1200g/mol至约2500g/mol。
[0041]
例如,少于20重量%,例如小于10%或小于5%的褐藻多酚的平均分子量可小于1000g/mol或大于3000g/mol。在一些方面中,本发明的褐藻多酚,例如存在于本发明的提取物中的褐藻多酚可不具有小于1000g/mol或大于3000g/mol的平均分子量。
[0042]
构成本发明的褐藻多酚的间苯三酚单元,例如存在于本发明的提取物中的褐藻多酚,可以通过选自由以下项组成的组中的键中的至少一个键连接:苯基键、醚键和二苯并二噁英键和它们的组合。
[0043]
构成本发明的褐藻多酚的间苯三酚单元,例如存在于本发明的提取物中的间苯三酚单元,可以连接以形成直链、支链或它们的混合物。
[0044]
本发明的一些提取物可不包含源自或可源自海藻的多糖(即:不含多糖)或包含少量源自或可源自海藻的多糖(即:基本上不含多糖),例如基于提取物的干重约0%至约30%或约0%至约20%,例如约0%至约10%或约0%至约5%或约0%至约1%的所述多糖。
[0045]
例如,可以使用本领域中已知的技术来纯化本发明的提取物以去除多糖,例如使用固相提取(solid phase extract,spe)或切向流过滤(tangential flow filtration,tff)。此类提取物可以被称为本发明的纯化的提取物。
[0046]
本发明的一些提取物可不包含源自或可源自海藻的抗病毒多糖(即:不含抗病毒多糖)或包含少量源自或可源自海藻的抗病毒多糖(即:基本上不含抗病毒多糖),例如基于提取物的干重约0%至约30%或约0%至约20%,例如约0%至约10%或约0%至约5%或约0%至约1%的所述多糖。
[0047]
本发明的一些提取物可不包含源自或可源自海藻的岩藻多糖(即:不含岩藻多糖)或包含少量源自或可源自海藻的岩藻多糖(即:基本上不含岩藻多糖),例如基于提取物的干重约0%至约30%或约0%至约20%,例如约0%至约10%或约0%至约5%或约0%至约
1%的岩藻多糖。
[0048]
可以通过从生物材料(例如海藻)中提取和/或分离来获得本发明的褐藻多酚,例如存在于本发明的提取物中的褐藻多酚。
[0049]
用于提取和/或分离的溶剂可以是水、醇、有机溶剂或它们的混合物。
[0050]
如本文所用的术语“水性提取物”是指当使用水作为唯一溶剂执行从海藻中提取时,从海藻获得的褐藻多酚和/或提取物。
[0051]
如本文所用的术语“醇提取物”是指当使用醇作为溶剂执行从海藻中提取时,从海藻获得的褐藻多酚和/或提取物。醇溶剂可以仅由醇(例如100%的醇),例如100%的乙醇组成。
[0052]
如本文所用的术语“水醇提取物”是指当使用醇和术的混合物作为溶剂执行从海藻中提取时,从海藻获得的褐藻多酚和/或提取物。例如,在水中约1%至约99%的醇。例如,乙醇和水的混合物。例如,溶剂可以是水中10%、20%、30%、40%、50%、60%、70%、80%或90%的醇,例如水中60%的醇(基于溶剂的总量,如果使用新鲜海藻的话则包括海藻中存在的水)。例如,溶剂可以是水中约10%的醇(即乙醇)至水中约90%的醇,例如约20%至约80%或约30%至约70%或40%至约60%。可提及的醇包括乙醇(etoh,水
‑
乙醇)和甲醇(meoh,水
‑
甲醇)。在本发明的一些方面中,优选使用水
‑
乙醇提取溶剂。
[0053]
如本文所用的术语“有机提取物”是指当使用不是醇的有机溶剂作为溶剂执行从植物提取时从海藻获得的褐藻多酚和/或提取物。例如,有机溶剂可选自由以下项组成的组:乙酸、丙酮、乙腈、苯、1
‑
丁醇、2
‑
丁醇、2
‑
丁酮、四氯化碳、氯化苯、氯仿、环己烷、1,2
‑
二氯乙烷、二甘醇、二乙醚、二甘醇二甲醚(diglyme/diethylene glycol,dimethyl ether)、1,2
‑
二甲氧基
‑
乙烷(甘醇二甲醚,dme)、二甲基甲酰胺(dmf)、二甲基亚砜(dmso)、1,4
‑
二噁烷、乙酸乙酯、乙二醇、甘油、庚烷、六甲基磷酰胺(hmpa)、六甲基亚磷酰三胺(hmpt)、己烷、甲基叔丁基醚(mtbe)、亚甲基氯、n
‑
甲基
‑2‑
吡咯烷酮(nmp)、硝基甲烷、戊烷、石油醚(挥发油)、1
‑
丙醇、2
‑
丙醇、吡啶、四氢呋喃(thf)、甲苯、三乙胺、邻二甲苯、间二甲苯和对二甲苯。
[0054]
例如,可以使用水醇提取溶剂从褐藻中获得或可获得本发明的褐藻多酚和/或本发明的提取物(即,为水醇提取物)。
[0055]
水醇溶剂的使用可以允许从海藻(例如褐海藻)中选择性地提取较低分子量和/或更水溶性的化合物。例如,当本发明的提取物是水醇褐海藻提取物(即,水乙醇提取物)时,一种或多种褐藻多酚可以具有约10个至约30个或约10个至约23个间苯三酚单元和/或平均分子量为1000g/mol或更高,例如约1000g/mol至约3000g/mol或约12000g/mol至约2500g/mol。
[0056]
例如,提取物可以是从包含一种或多种褐藻多酚的褐海藻中获得或可获得的,其中基于干提取物中的褐藻多酚的干重,至少约70重量%具有的分子量为基于提取物的干重约1000g/mol至约3000g/mol。
[0057]
术语水溶性是指至少约2%(即至少约2g/100ml),例如至少约5%、10%、20%、40%、60%、或70%(即至少约5g/100ml、10g/100ml、20g/100ml、40g/100ml、60g/100ml、或70g/100ml)的组合物将在室温(即约25℃的温度)下溶于水。
[0058]
本发明的提取物可以是使用水醇(水乙醇)提取溶剂从褐藻中获得或可获得的(即水醇(水乙醇)提取物),其中所述提取物包含基于提取物的干重约1重量%至约100重量%,
例如约1重量%至95重量%、或2重量%至90重量%、或2重量%至约80重量%、或约5重量%至约70重量%、或约8重量%至约65重量%的一种或多种褐藻多酚。
[0059]
本发明的提取物可以是使用水醇(水乙醇)提取溶剂从褐藻中获得或可获得的(即水醇(水乙醇)提取物),其中所述提取物包含基于提取物的干重约1重量%至约100重量%,例如约1重量%至95重量%、或2重量%至90重量%、或2重量%至约80重量%、或约5重量%至约70重量%、或约8重量%至约65重量%的一种或多种褐藻多酚,其中所述一种或多种褐藻多酚具有约10个至约30个间苯三酚单元或约10个至约23个间苯三酚单元,例如,其中基于干提取物中的褐藻多酚的干重,至少约70重量%具有约10个至约30个间苯三酚单元或约10个至约23个间苯三酚单元。
[0060]
本发明的提取物可以是使用水醇(水乙醇)提取溶剂从褐藻中获得或可获得的(即水醇(水乙醇)提取物),其中所述提取物包含基于提取物的干重约1重量%至约100重量%,例如约1重量%至95重量%、或2重量%至90重量%、或2重量%至约80重量%、或约5重量%至约70重量%、或约8重量%至约65重量%的一种或多种褐藻多酚,并且所述一种或多种褐藻多酚的平均分子量为1000g/mol或更大,例如约1000g/mol至约3000g/mol或约1200g/mol至约2500g/mol,例如其中基于干提取物中的褐藻多酚的干重至少约70重量%的分子量为基于提取物的干重约1000g/mol至约3000g/mol。
[0061]
本发明的提取物可以是使用水醇(水乙醇)提取溶剂从褐藻中获得或可获得的(即水醇(水乙醇)提取物),其中所述提取物包含基于提取物的干重约1重量%至约100重量%,例如约1重量%至95重量%、或2重量%至90重量%、或2重量%至约80重量%、或约5重量%至约70重量%、或约8重量%至约65重量%的一种或多种褐藻多酚,其中所述一种或多种褐藻多酚具有约10个至约30个间苯三酚单元或约10个至约23个间苯三酚单元,并且平均分子量为1000g/mol或更大,例如约1000g/mol至约3000g/mol或约1200g/mol至约2500g/mol,例如其中基于干提取物中的褐藻多酚的干重至少约70重量%具有约10个至约30个间苯三酚单元或约10个至约23个间苯三酚单元和/或分子量为基于提取物的干重约1000g/mol至约3000g/mol。
[0062]
本发明的纯化的提取物可以是使用水醇(水乙醇)提取溶剂从褐藻中获得或可获得的(即水醇(水乙醇)提取物),其中所述提取物包含基于提取物的干重约1重量%至约100重量%,例如约1重量%至95重量%、或2重量%至90重量%、或2重量%至约80重量%、或约5重量%至约70重量%、或约8重量%至约65重量%的一种或多种褐藻多酚,其中所述一种或多种褐藻多酚具有约10个至约30个间苯三酚单元或约10个至约23个间苯三酚单元,并且平均分子量为1000g/mol或更大,例如约1000g/mol至约3000g/mol或约1200g/mol至约2500g/mol,例如其中基于干提取物中的褐藻多酚的干重至少约70重量%的分子量为基于提取物的干重约1000g/mol至约3000g/mol,并且可不包含源自或可源自海藻的多糖(即:不含多糖)或包含少量源自或可源自海藻的多糖(即:基本上不含多糖),例如基于提取物的干重约0%至约10%,例如约0%至约5%,例如约0%至约1%。
[0063]
用于获得本发明的提取物的提取方法可包括两个或更多个提取步骤。例如,可以对海藻进行水醇提取,例如水乙醇提取,以产生粗提取产物。然后可以对该粗提取产物进行一个或多个另外的提取步骤。在这些另外的步骤中,可以使用相同的水醇溶剂或可以使用不同的水醇溶剂(例如,可以改变醇与水的比率)或可以使用有机溶剂(例如乙酸乙酯)作为
溶剂。如果需要的话,可以在提取步骤之间将粗提取物干燥以去除提取溶剂。
[0064]
作为示例,可以先进行水乙醇提取,之后用乙酸乙酯进行提取。可以将在水乙醇提取后获得的粗提取物干燥,然后用乙酸乙酯提取。
[0065]
除非本文另有说明,否则列出的重量百分比是基于以干燥形式获得的提取物的总重量。例如,在一些方面中,列出的重量百分比基于干提取物的总重量。提取物可以是固体或液体。
[0066]
本文所用的术语“干燥”,例如当涉及本发明的提取物时,是指这样的固体或液体提取物,所述固体或液体提取物不含溶剂(例如提取中所用的溶剂),使得至少95%的溶剂已例如通过蒸发被去除。
[0067]
为避免疑义,除非上下文另有说明,否则本发明的给定方面、特征或参数所指示的偏好、选项、特定特征等应被视为已与本发明的相同或其它方面、特征和参数所示的任何和所有其它偏好、选择、特定特征等结合公开。
[0068]
本文所用的术语“约”,例如当提及可测量的值(例如反应混合物中特定组分的量或重量)时,是指指定量的
±
20%、
±
10%、
±
5%、
±
1%、
±
0.5%,或特别是
±
0.1%的变化。
[0069]
本领域技术人员将理解,可以以固体形式或液体形式(例如油)提供本发明的褐藻多酚和/或本发明的提取物(一旦已经去除了提取溶剂)。关于固体形式,其包括本发明的褐藻多酚和/或提取物可以作为无定形固体提供,或作为结晶或部分结晶固体提供。
[0070]
本发明的褐藻多酚和/或本发明的提取物可以是通过如下一般地描述的提取方法或其常规变型从至少一种类型的海藻获得或可获得的。
[0071]
用于获得本发明的褐藻多酚和/或本发明的提取物的提取方法包括使海藻与提取溶剂接触。合适的提取溶剂如上所述。
[0072]
合适的溶剂包括水、醇、醇/水混合物(水
‑
醇溶剂)、乙酸乙酯、丙酮、己烷,或通常可用于提取的任何其它溶剂,以及它们的混合物。例如,溶剂可以是水中10%、20%、30%、40%、50%、60%、70%、80%或90%的醇,例如水中60%的醇(基于所用的溶剂的总量,如果使用新鲜海藻的话则包括海藻中存在的任何水)。可提及的具体醇包括乙醇(etoh,水
‑
乙醇)和甲醇(meoh,水
‑
甲醇)。例如,溶剂可以是水中约10%的醇至水中约90%的醇(即乙醇),例如约20%至约80%或约30%至约70%或40%至约60%。
[0073]
接触(提取)步骤的温度将取决于所用的溶剂,并且可以在约10℃至约50℃的范围内。例如,用于提取的温度可以在约20℃至约40℃或约15℃至约25℃,例如约20℃的范围中。
[0074]
可以使用本领域已知的任何合适的方法来增强提取。例如,海藻的接触(提取)可以在有或没有搅拌的情况下执行,例如通过例如使用顶置式搅拌器进行搅拌。另外,也可以使用压制;例如,可以将海藻放在压机中。
[0075]
接触(提取)时段(即海藻材料与溶剂接触的时段)通常为约0.5小时至约24小时,例如约1小时至18小时或12小时或10小时。
[0076]
例如,在实验室规模上,可以使海藻与提取溶剂在不透明的大烧杯中接触,并使用顶置式搅拌器在室温(15℃至25℃)下和大气压下搅动约5小时。
[0077]
作为示例,在更大的规模上,可以使海藻与提取溶剂在不透明的牛奶罐中接触,并
使用顶置式搅拌器在室温(15℃至25℃)下和大气压下搅动约17小时。
[0078]
海藻的接触(提取)可以在大气压下执行,或者在高于或低于大气压的压力下执行。通常,接触(提取)在大气压下进行。
[0079]
可以使用任何合适的提取装置。提取装置可以是不透明的,或例如以锡箔覆盖,以保护提取物避光,因为已知褐藻多酚对光敏感。
[0080]
溶剂与海藻材料的比率可以在宽范围内变化。通常,在提取过程中使用的溶剂与海藻材料的比率在以毫升/克计为约1:1至约10:1,例如约2:1至5:1,例如3:1w/v的范围中。
[0081]
然后可以根据需要重复进行接触(提取)步骤。例如,接触步骤可以重复两次、三次或四次,即,接触步骤可以重复至少三次。
[0082]
在使海藻与提取溶剂接触之前,可能会发生以下可选步骤中的一个或多个可选步骤:
[0083]
(a)洗涤海藻;和/或
[0084]
(b)将海藻粗切成更小的块;和/或
[0085]
(c)使用旋转的锋利刀片(通常称为搅拌机)以低速将海藻切碎成较小的粒径。
[0086]
可用于获得本发明的褐藻多酚和/或本发明的提取物的海藻可以是冷冻、冻干、新鲜或干燥的。优选地,使用新鲜的海藻。如果海藻已经干燥或冻干,则优选将其在使用前复水。
[0087]
在步骤(a)中,可以用水性溶剂(例如海水、饮用水和/或蒸馏水)洗涤海藻,所述水性溶剂可以从海藻样品中去除沙子和石头以及其它污垢。可以先用海水洗涤,之后用饮用水或蒸馏水洗涤。
[0088]
在步骤(b)中,可使用例如剪刀或刀的切碎装置或机械切碎装置将海藻粗切成块。可以将海藻切碎成面积在约1cm2至5cm2范围内的粒子。
[0089]
在步骤(c)中,可将海藻进一步切碎成面积在约1mm2至4mm2,例如约1.5mm2至3.5mm2,例如约2mm2至3mm2范围内的粒子。可以使用本领域中已知的任何合适的共混技术,例如搅拌机。
[0090]
通常,步骤(b)和(c)可以如下进行:
[0091]
在小规模样品(例如<1kg的海藻,例如新鲜的海藻)上,首先用剪刀切割,然后再使用搅拌机(例如waring搅拌机)进行低速搅拌;
[0092]
对于较大的工业规模样品(例如,>50kg的海藻(例如新鲜的海藻),在研磨机(例如urschel研磨机)中分两个阶段进行研磨(例如:用66708网格进行粗磨,然后用66896网格进行精磨)。
[0093]
在提取步骤之前,可以通过以下步骤来确定海藻的干质量和水含量:在烘箱中干燥海藻以获得恒定的重量,例如在103℃干燥约24小时。该信息可用于确定所需的溶剂量,例如,水醇溶剂中所需的水量,
[0094]
使海藻与提取溶剂接触后,可以执行以下可选步骤中的一个或多个可选步骤:
[0095]
(e)从溶剂中分离出海藻粒子;和/或
[0096]
(f)蒸发溶剂;和/或
[0097]
(g)纯化粗提取物。
[0098]
在接触(提取步骤)之后,可以使样品沉降,例如长达1小时,例如约30分钟。
[0099]
可以从溶剂中去除任何未溶解的植物材料,例如通过过滤,并重新溶解在溶剂中。
[0100]
在步骤(e)中,可以将溶剂与任何未溶解的海藻材料分离(例如,通过过滤),并且在步骤(f)中,将溶剂(滤液)浓缩(即去除溶剂)。例如,可以浓缩溶剂直至去除所有溶剂,仅剩下固体提取物。
[0101]
例如,在实验室规模上,然后使用布氏过滤器对混合物进行筛分。在更大的规模上,可以例如使用300微米的筛子,例如sweco。
[0102]
在步骤(f)中,可以将溶剂(滤液)浓缩(例如,通过在实验室规模上或在较大规模上使用brouillon过程蒸发器,在低温(例如约35℃至约45℃)下旋转蒸发)至约90%至99%的dm(干材料、干物质或干燥物质)。
[0103]
在步骤(g)中,可以将粗提取物进一步纯化以提供本发明的纯化的提取物。可以使用本领域已知的任何合适的纯化方法。合适方法的示例包括色谱技术,例如反相液相色谱、过滤方法(例如切向流过滤(tff)或超滤)、和/或如上所述的另外提取步骤,例如固相提取(spe)。例如,粗提取物可以通过1000g/mol的超滤膜,这可以去除分子量低于1000g/mol的化合物。
[0104]
例如,可以使用以下方法获得本发明的提取物:
[0105]
(a)洗涤海藻;
[0106]
(b)任选地,将海藻粗切成更小的块;
[0107]
(c)任选地使用旋转的锋利刀片(通常称为搅拌机)以低速将海藻切碎成较小的粒径;
[0108]
(d)使海藻粒子与溶剂接触;
[0109]
(e)从溶剂中分离出海藻颗粒;
[0110]
(f)蒸发溶剂;以及
[0111]
(g)任选地纯化粗提取物。
[0112]
通过提取过程,当与来源植物中发现的活性化合物的百分比相比时,提取物内的某些活性化合物的百分比增加并且其它化合物的百分比减少。
[0113]
本发明的褐藻多酚和/或本发明的提取物可以是从如前所述的本发明方法获得的提取物(或通过其可获得的提取物)。
[0114]
本发明的提取物可以是冻干的。例如,冻干的提取物可通过将提取物在约
‑
10℃至
‑
50℃(例如,约
‑
36℃)的温度下在浅托盘中冷冻,然后在约
‑
50℃至
‑
100℃,例如约
‑
87℃的冷凝器温度和200
‑
400mtorr的压力下冻干至多3天而获得,具体取决于样品的大小。
[0115]
可将本发明的褐藻多酚和/或提取物研磨成粉末。
[0116]
本发明的褐藻多酚和/或本发明的提取物可以任何合适的方式存储。例如,可以将本发明的褐藻多酚和/或提取物(例如以粉末形式)冷冻并保护其免受湿气、热和光的影响而避免劣化。
[0117]
本发明的褐藻多酚和/或本发明的提取物可以以组合物的形式提供。本文所述的此类组合物可以根据本领域技术人员已知的方法制备,例如通过将组合物的组分掺混。
[0118]
存在于包含本发明的提取物的组合物中的本发明的褐藻多酚和/或提取物的量将取决于预期用途以及组合物中存在的其它组分。
[0119]
当包含在组合物中时,本发明的褐藻多酚和/或提取物通常以基于所述组合物的
总重量约0.01重量%至约100重量%,例如约0.1重量%至约90重量%或约10重量%至约80重量%或约5重量%至约70重量%或约40重量%至约60重量%的量存在。
[0120]
在使用或应用时,组合物中本发明的褐藻多酚和/或本发明的提取物的浓度可以例如为基于所述组合物的总重量约0.01重量%至约100重量%;例如约0.1重量%至约50重量%;或约0.5重量%至约20重量%;或约1重量%至约10重量%。组合物可以以即用形式制备,或者可以以更浓缩的形式制备,所述更浓缩的形式将在使用前根据建议的稀释因子(例如1:100、1:50;1:20;1:10或1:5)稀释以在使用时达到所需的浓度。
[0121]
当组合物中包含本发明的褐藻多酚和/或本发明的提取物时,所述组合物通常包含的褐藻多酚的量为该组合物的约0.0025重量%至约50重量%,例如该组合物的0.025重量%或0.1重量%至25重量%,例如该组合物的1重量%至10重量%。
[0122]
在使用或应用时,组合物中的褐藻多酚的浓度可以例如是基于所述组合物的总重量约0.0025重量%至约25重量%;例如约0.025重量%至约15重量%;或约0.1重量%至约5重量%;或约0.25重量%至约2.5重量%。组合物可以以即用形式制备,或者可以以更浓缩的形式制备,所述更浓缩的形式将在使用前根据建议的稀释因子(例如1:100、1:50;1:20;1:10或1:5)稀释以在使用时达到所需的浓度。
[0123]
为避免疑义,在本说明书中,当我们使用术语“包含(comprising/comprises)”时,我们的意思是所描述的提取物或组合物必须含有所列成分但可任选地含有其它成分。当我们使用术语“基本上由......组成(consisting essentially of/consists essentially of)”时,我们的意思是所描述的提取物或组合物必须含有所列成分并且还可以含有少量(例如至多5重量%,或至多1重量%或0.1重量%)其它成分,条件是任何其它成分不影响所述提取物或组合物的基本性质。当我们使用术语“由......组成”时,我们的意思是所描述的提取物或组合物必须仅含有所列成分。这些术语可以以类似的方式应用于过程,方法和用途。
[0124]
本发明的提取物和/或包含本发明的提取物的组合物可以用作抗病毒剂。
[0125]
术语“抗病毒”是指破坏和/或使病毒不能存活和/或抑制病毒复制的化合物或组合物。
[0126]
可以基于病毒的基因组性质对病毒进行分类。该系统被称为巴尔的摩(baltimore)病毒分类系统。在此系统中,有七个组:
[0127]
i.双链dna病毒
[0128]
一些在细胞核中复制,例如使用细胞蛋白的腺病毒。痘病毒在细胞质中复制,并制造它们自己的用于核酸复制的酶。例如腺病毒;疱疹病毒;痘病毒等
[0129]ⅱ.单链(+)有义dna病毒
[0130]
复制发生在细胞核中,涉及(
‑
)有义链的形成,该链用作(+)链rna和dna合成的模板。
[0131]
例如细小病毒
[0132]ⅲ.双链rna病毒
[0133]
这些病毒具有分段的基因组。每个基因组区段单独转录以产生单顺反子mrna。例如呼肠孤病毒
[0134]ⅳ.单链(+)有义rna病毒(小核糖核酸病毒;囊膜病毒等)
[0135]
■
多顺反子mrna:基因组rna可以用作mrna。由于rna与mrna具有相同的含义,因此单独的rna是传染性的,没有病毒体粒子相关的聚合酶。翻译导致形成多蛋白产物,所述多蛋白产物随后被切割以形成成熟蛋白。例如小核糖核酸病毒(脊髓灰质炎病毒、鼻病毒);甲型肝炎病毒
[0136]
■
复杂转录:产生基因组rna需要两轮或更多轮翻译。例如小核糖核酸病毒;甲型肝炎病毒。
[0137]
v.单链(
‑
)有义rna病毒
[0138]
病毒体rna是反义的(与mrna互补),因此必须复制成互补的正义mrna中才能制成蛋白质。这组病毒必须编码rna依赖性rna聚合酶,并且还必须将其携带在病毒体中,使得它们可在感染细胞后制造mrna。例如正粘病毒、弹状病毒等
[0139]
■
分段的,例如正粘病毒。复制中的第一步骤是通过病毒体rna依赖性rna聚合酶转录(
‑
)有义rna基因组以产生单顺反子mrna,该单顺反子mrna也可用作基因组复制的模板。
[0140]
■
非分段的,例如弹状病毒。复制如上所述发生并且产生单顺反子mrna。
[0141]
ⅵ
.在生命周期中具有dna中间体的单链(+)有义rna病毒
[0142]
rna基因组是(+)有义的,但在病毒中是唯一的,因为它是diploid并且不作为mrna,而是作为逆转录的模板。例如逆转录病毒。
[0143]
因此,逆转录病毒编码rna依赖性dna聚合酶(逆转录酶)以制备dna前病毒,该dna前病毒由宿主酶rna聚合酶ⅱ转录为基因组rna。
[0144]
ⅶ
.具有rna中间体的双链dna病毒
[0145]
这组病毒也依赖于逆转录,但是与逆转录病毒不同,这种病毒在成熟时会在病毒粒子内部存在。感染新细胞后,首先发生的事件是修复带空位的基因组,然后进行转录。例如,嗜肝dna病毒(hepadnavirus)
[0146]
本发明的提取物或组合物可以用作抗所有七个组中的病毒的抗病毒剂,或者本发明的提取物可以用作抗一个或多个组中的病毒的抗病毒剂。例如,本发明的提取物可以用作抗组ⅰ(例如腺病毒)、组ⅱ(例如细小病毒)、组ⅲ(例如轮状病毒)、组ⅳ(例如脊髓灰质炎病毒和诺如病毒)、组
ⅴ
(例如甲型h1n1流感病毒)、组
ⅵ
或组
ⅶ
中的一者或多者中的病毒的抗病毒剂。例如,本发明的提取物可以用作抗组i、ⅱ、ⅲ或v中的一者或多者中的病毒的抗病毒剂。
[0147]
可以使用测试方法bs en 14476:2013+a1:2015测量化合物或组合物破坏和/或使病毒无法存活的程度
[0148]
化学消毒剂和防腐剂
‑
用于评估医疗领域的杀病毒活性的定量悬浮试验。测试方法和要求(2期/步骤1)已被定义为《杀生物产品法规》(biocidal products regulation,bpr)中的标准欧洲测试方法。该方法的完整细节可以在该法规中找到。
[0149]
本领域技术人员将理解下面的概述:将要测试的化合物或组合物的样品加入到病毒在干扰物质溶液中的测试悬浮液中。将混合物保持在条款4和5.5.1.1规定的温度和接触时间中的一者下。在此接触时间结束时,取等分试样;通过经验证的方法(在冰冷的细胞维持培养基中稀释样品)立即抑制了这部分中的杀病毒作用。使用单层或细胞悬浮液将稀释液转移到培养单元(有盖培养皿、试管、或微量滴定板孔)中。感染性测试是通过噬菌斑测试
或局量子测试(quantal test)进行的。在孵育后,根据spearman和karber(局量子测试,c.1)或通过噬菌斑计数(噬菌斑测试,c.2)计算感染力滴度并进行评估。病毒感染力的降低是根据用产品处理前的对数病毒滴度(病毒对照)和用产品处理后的对数病毒滴度的差异计算出的。
[0150]
出于本发明的目的,如果化合物或组合物实现了为至少1.0,优选地至少2.0,更优选至少3.0,甚至更优选至少4.0的上述对数降低(处理后对比处理前),甚至更优选完全消除病毒,则认为该化合物或组合物使病毒无法存活或抑制病毒的复制。
[0151]
本发明的褐藻多酚或提取物和/或本发明的组合物可以用于抗包膜和/或非包膜病毒。
[0152]
例如,本发明的褐藻多酚或提取物和/或本发明的组合物可以用于降低选自以下科的包膜病毒中的至少一种包膜病毒的活性或杀伤所述病毒:疱疹病毒科(herpesviridae)、痘病毒科(poxviridae)、肝病毒科(hepadnaviridae)、冠状病毒科(coronaviridae)、黄病毒科(flaviviridae)、披膜病毒科(togaviridae)、逆转录病毒科(retroviridae)、正粘病毒科(orthomyxoviridae)、砂粒病毒科(arenaviridae)、布尼雅病毒科(bunyaviridae)、丝状病毒科(filoviridae)、副粘病毒科(paramyxoviridae)、和弹状病毒科(rhabdoviridae)。
[0153]
本发明的褐藻多酚或提取物和/或本发明的组合物可用于降低选自以下的包膜病毒中的至少一种包膜病毒的活性或杀伤所述病毒:单纯疱疹1型、单纯疱疹2型、水痘
‑
带状疱疹病毒、艾巴氏(esptein
‑
barr)病毒、人类巨细胞病毒、人类疱疹病毒8型、天花病毒、乙型肝炎病毒、严重急性呼吸道综合征病毒、丙型肝炎病毒、黄热病病毒、登革热病毒、西尼罗河病毒、tbe病毒、风疹病毒、人类免疫缺陷病毒、流感病毒、拉沙病毒、克里米亚
‑
刚果出血热病毒、汉坦病毒、埃博拉病毒、马尔堡病毒、麻疹病毒、腮腺炎病毒、副流感病毒、呼吸道合胞病毒和狂犬病病毒。
[0154]
本发明的褐藻多酚或提取物和/或本发明的组合物可以用于抗选自以下科的非包膜病毒中的至少一种非包膜病毒:腺病毒科(adenoviridae)、乳头瘤病毒科(papillomaviridae)、多瘤病毒科(polyomaviridae)、细小病毒科(parvoviridae)、星状病毒科(astroviridae)、杯状病毒科(caliciviridae)、小rna病毒科(picornaviridae)、肝炎病毒科(hepeviridae)和呼肠孤病毒科(reoviridae)。
[0155]
本发明的褐藻多酚或提取物和/或本发明的组合物可以用于抗选自以下的非包膜病毒中的至少一种非包膜病毒:腺病毒、人乳头瘤病毒、bk病毒、jc病毒、细小病毒b19、人星状病毒、柯萨奇病毒、甲型肝炎病毒、脊髓灰质炎病毒、鼻病毒、戊型肝炎病毒、轮状病毒、环状病毒、科罗拉多蜱媒热病毒(coltivurs)、诺如病毒和版纳病毒。
[0156]
因此,本发明提供了如先前定义的用作抗病毒剂的提取物或组合物。
[0157]
本发明的褐藻多酚或提取物和/或本发明的组合物可以用于治疗或预防病毒感染,例如动物或植物的病毒感染。
[0158]
这些还提供了如先前定义的提取物或组合物在用于治疗或预防病毒感染的药物的制备中的用途。
[0159]
还提供了一种治疗或预防病毒感染的方法,所述方法包括将治疗有效量的如先前定义的提取物或组合物施用给有需要的受试者,例如已经被病毒感染的受试者或将或可能
会接触到病毒的受试者。
[0160]
因此,还提供了如先前定义的提取物或组合物作为抗病毒剂的用途。
[0161]
病毒可以存在于体内或活生物体外。本发明可用于减少或控制表面上或表面处的病毒。
[0162]
本发明还提供了包含平均约10个至约23个间苯三酚单元的褐藻多酚作为抗病毒剂的用途。
[0163]
本发明还提供了包含平均约10个至约23个间苯三酚单元的褐藻多酚,所述褐藻多酚用作抗病毒剂。
[0164]
本发明还提供了一种抗病毒组合物,所述抗病毒组合物包含含有平均约10个至约23个间苯三酚单元的褐藻多酚。
[0165]
本发明还提供了一种组合物,所述组合物包含含有平均约10个至约23个间苯三酚单元的褐藻多酚,所述组合物用于用作抗病毒剂。
[0166]
本发明还提供了包含含有平均约10个至约23个间苯三酚单元的褐藻多酚的组合物作为抗病毒剂的用途。
[0167]
包含平均约10个至约23个间苯三酚单元的褐藻多酚可以用于抵抗本文提及的病毒。
[0168]
本发明还提供了一种抗病毒组合物,所述抗病毒组合物包含一种或多种褐藻多酚。特别地,抗病毒组合物包含一种或多种分子量为约1000g/mol至约3000g/mol的褐藻多酚。
[0169]
本发明还提供了一种组合物,所述组合物包含一种或多种褐藻多酚,所述组合物用于用作抗病毒组合物,例如用于治疗或预防病毒感染。特别地,包含一种或多种分子量为约1000g/mol至约3000g/mol的褐藻多酚的组合物用作抗病毒组合物,例如用于治疗或预防病毒感染。
[0170]
本发明还提供了包含一种或多种褐藻多酚的组合物作为抗病毒组合物的用途。特别地,包含一种或多种分子量为约1000g/mol至约3000g/mol的褐藻多酚的组合物作为抗病毒组合物的用途。
[0171]
如上所述,可使用水、醇、有机溶剂或它们的混合物来获得褐藻多酚。
[0172]
如本文所述,存在于本文所述的组合物中的褐藻多酚可以是从如先前所述的褐海藻获得或可获得的,并且可用作如前所述的抗病毒组合物或抗病毒剂。
[0173]
应理解,本发明的组合物可包含本领域常用的其它成分。使用的任何其它成分的性质将取决于组合物的性质和预期目的。本领域普通技术人员将知道哪些其它成分适合用于不同应用的组合物。可用于本发明的组合物中的其它成分包括但不限于—缓冲剂、ph调节剂、络合剂、表面活性剂、溶剂(例如水)。本发明的组合物还可含有本领域中标准的其它成分,例如着色剂、芳香剂、润肤剂、抗氧化剂、增稠剂和腐蚀抑制剂,以及它们的混合物。
附图说明
[0174]
图1a示出了实施例3的提取物中具有奇数个重复单元的褐藻多酚低聚物的峰面积。
[0175]
图1b示出了实施例3的提取物中具有偶数个重复单元的褐藻多酚低聚物的峰面
积。
[0176]
图2示出了实施例3的提取物中的褐藻多酚低聚物的粒径分布。
[0177]
图3示出了实施例5中从lh20分级分离中回收酚类。
[0178]
图4示出了实施例5中original、fub和fub级分的组成。
[0179]
图5示出了实施例5中的m/z 1117组分的可能结构。
[0180]
图6示出了实施例5中的bound级分中富集了特征性的褐藻多酚m/z物质。
[0181]
图7示出了实施例5中褐藻多酚在sephadex lh20上的分级分离。
[0182]
图8示出了实施例5中lh20级分中的褐藻多酚峰的ms光谱。
[0183]
图9示出了实施例5中带双电荷的褐藻多酚组分的orbitrap ms迹象。
[0184]
图10示出了实施例5中原始级分和spe级分的正模式lc
‑
ms迹线。
[0185]
图11示出了实施例5中3个组在其特定保留时间内的ms质谱图。
[0186]
图12示出了实施例5中的结合洗涤样品中m/z 831的ms质谱图。
[0187]
图13示出了hplc
‑
sec ri检测到实施例6中本发明的提取物的tff级分>1kda(左)和<1kda(右)。
[0188]
图14示出了左图:hplc
‑
sec ri检测到80%meoh不溶性级分(观察到更高的mw材料[即,更早的保留时间])。右:hplc
‑
sec ri检测到80%可溶性tff级分,实施例6。
[0189]
图15示出了实施例7中结合的级分和未结合的级分的抗病毒活性。
[0190]
图16示出了实施例7的<1000gmol
‑
1的级分的抗病毒活性;(ii)>1000gmol
‑
1的级分的抗病毒活性。
[0191]
图17示出了海藻提取物和富集褐藻多酚的级分与表没食子儿茶素的抗病毒活性的比较,表没食子儿茶素是从实施例8中的绿茶中提取的多酚。
[0192]
通过以下非限制性实施例说明本发明。
[0193]
实施例1
–
本发明的提取物的小规模制备
[0194]
使用已经在2016年1月收获的源自爱尔兰新鲜泡叶藻(褐海藻)。
[0195]
如下确定新鲜海藻的水含量:
[0196]
海藻的含水量是通过将已知重量的海藻在烘箱中在103℃下干燥至恒重达约24小时来确定的。
[0197]
将海藻称重,并确定海藻的干质量。通过从新鲜海藻的质量中减去海藻的干质量来确定新鲜海藻中包含的水的对应质量,然后确定新鲜海藻中的水百分比。对于该海藻,确定新鲜海藻70%为水(即1000g海藻包含700g水)。
[0198]
如下制备本发明的提取物:
[0199]
使用1000g的海藻。将其用海水预洗涤以去除任何碎屑,例如沙子和石头。然后用淡水洗涤海藻。
[0200]
将海藻切成直径约2
‑
3mm的块。这是通过首先用剪刀切割,然后使用waring搅拌机以低速搅拌进行的。
[0201]
将乙醇/水共混物添加到海藻中。所用的乙醇是96%的纯乙醇和4%的水。此乙醇/水共混物中使用的乙醇和水的量满足以下两个条件:
[0202]
‑
共混物中乙醇的质量与所存在的总水量(即海藻中所含水+共混物中的水+共混物中添加的任何附加水)之比为60:40
[0203]
‑
水和乙醇的总质量是水和乙醇添加至的新鲜海藻质量的三倍。
[0204]
可以通过简单的数学方法确定作为乙醇/水共混物的一部分添加以满足上述条件的水的质量。
[0205]
在此实施例中,使用了1000g新鲜海藻,并且确定了所述新鲜海藻中的700g是水,300g是干海藻。
[0206]
乙醇和水的总质量为3000g(即1000g的3倍)。并且乙醇:水的比率为60:40。因此,需要1875g乙醇(考虑所用的乙醇是96%乙醇和4%水)和1125g水。新鲜海藻中已经包含700g这种水,因此需要添加附加425g水作为乙醇/水共混物。
[0207]
在不透明的大烧杯中,将乙醇/水共混物添加到洗涤过的新鲜海藻中。使用顶置式搅拌器在室温下将混合物搅动约5小时。
[0208]
在这段时间之后,将样品静置约30分钟。
[0209]
然后使用布氏过滤器筛分混合物。
[0210]
然后使用旋转蒸发仪在低温(34
‑
45℃)下蒸发醇。
[0211]
然后将提取物在浅盘中在
‑
36℃下冷冻以使表面积最大化。
[0212]
然后将提取物用
‑
87℃的冷凝器温度和压200
‑
400mtorr的压力冻干约3天。
[0213]
然后将提取物研磨以产生粉末。
[0214]
然后将粉末提取物冷冻,并保护其免受湿气、热量和光照的影响以免劣化。
[0215]
测试前根据需要将所述提取物解冻。
[0216]
实施例2
–
抗病毒测试
[0217]
使用在实施例1中获得的海藻提取物。
[0218]
将解冻的海藻提取物溶解在脱矿质水中以达到测试所需的浓度。
[0219]
使用测试方法bs en 14476:2013+a1:2015化学消毒剂和防腐剂—用于评估医疗领域中的杀病毒活性的定量悬浮测试,测量化合物或组合物使病毒无法存活或抑制病毒复制的程度。测试方法和要求(2期/步骤1)已被定义为《杀生物产品法规》(biocidal products regulation,bpr)中的标准欧洲测试方法。该方法的完整细节可以在该法规中找到。
[0220]
使用这种方法,可以确定所测试的提取物溶液对特定病毒的对数减少值。
[0221]
接触时间是测试溶液在测试期间与测试病毒接触的时间。结果在下表9中示出。
[0222]
表1
[0223]
[0224][0225]
*在log
10
r值显示≥符号的情况下,其暗示已完全清除病毒。h1n1表示甲型流感病毒亚型h1n1。
[0226]
实施例3
‑
本发明提取物的大规模制备
[0227]
使用已经在2017年11月收获的源自法国布列塔尼(brittany)的新鲜泡叶藻(褐海藻)。
[0228]
如下确定新鲜海藻的水含量:
[0229]
海藻的含水量是通过将已知重量的海藻在烘箱中在103℃下干燥至恒重达约24小时来确定的。
[0230]
将海藻称重,并确定海藻的干质量。通过从新鲜海藻的质量中减去海藻的干质量来确定新鲜海藻中包含的水的对应质量,然后确定新鲜海藻中的水百分比。
[0231]
使用69kg的新鲜泡叶藻(褐海藻)。将收获的海藻在海水中浸泡过夜。第二天,对所述海藻进行手工分选,以去除附着在泡叶藻生物质上的附生海藻,并沥干30分钟。然后将所述海藻用淡水冲洗3分钟,并再次沥干。
[0232]
然后将海藻在urschel研磨机中分两步进行研磨(使用66708网格粗磨,然后使用66896网格精磨)。这产生了2
‑
3mm的粒子。
[0233]
将乙醇/水共混物添加到海藻中。所用的乙醇是96%的纯乙醇和4%的水。此乙醇/水共混物中使用的乙醇和水的量满足以下两个条件:
[0234]
‑
共混物中乙醇的质量与所存在的总水量(即海藻中所含水+共混物中的水+共混物中添加的任何附加水)之比为60:40。水和乙醇的总质量是水和乙醇添加至的新鲜海藻质量的三倍。
[0235]
通过简单的数学方法确定添加到乙醇/水共混物中以满足上述条件的水的质量。
[0236]
在此实施例中,使用了69kg新鲜海藻,并且确定了所述新鲜海藻中的52kg是水,17kg是干海藻。
[0237]
乙醇和水的总质量为207kg(即69kg的3倍)。并且乙醇:水的比率为60:40。因此,为129.4kg的乙醇(考虑所用的乙醇是96%的乙醇和4%的水)和77.6kg的水。新鲜海藻中已经包含52kg这种水,因此需要添加附加25.6kg水作为乙醇/水共混物。
[0238]
提取在搅动的牛奶罐中在室温和压力下执行17小时。
[0239]
用300μm筛子(sweco)从提取物中分离出用过的生物质。
[0240]
在brouillon过程蒸发器中在低温下蒸发醇(初始温度34℃,最终温度45℃),需要
约8小时。
[0241]
使用安装在密理博(millipore)框架上的助滤剂fw12(硅藻土)和kds12过滤器(基于纤维素的深度过滤片)进一步使提取物澄清。
[0242]
将所得的经过滤的提取物转移至聚丙烯托盘中,并使用慢循环(25
‑
30kg.prg)冻干以避免不均匀的冷冻。这花费了约3天的时间。
[0243]
然后使用实验室规模的搅拌机研磨提取物。得到2.92kg的粉状提取物。
[0244]
然后将粉末提取物冷冻,并保护其免受湿气、热量和光照的影响以免劣化。
[0245]
测试前根据需要将所述提取物解冻。
[0246]
分析所获得的提取物的组成。
[0247]
将少量提取物样品添加到folin
‑
ciocalteu酚试剂中,并对比作为标准酚化合物的没食子酸的标准曲线评定加入碳酸钠溶液后显现的蓝色。
[0248]
与folin
‑
ciocalteu酚试剂的这种阳性反应表明存在褐藻多酚。
[0249]
然后使用液相色谱质谱技术,使用带有ltq orbitrap xl质谱仪(thermo fisher scientific)的lc系统,研究褐藻多酚的性质。将纯净的提取物样品在反相c18柱上分离,并以负esi模式进行分析(所使用的方法描述于austin等人,(2017)extracts from the edible seaweed,ascophyllum nodosum,inhibit lipase activity in vitro:contributions of phenolic and polysaccharide components.food&function,9,502
–
510
‑
doi:10.1039/c7fo01690e中)
[0250]
检测到一系列褐藻多酚低聚物的间苯三酚单元表观聚合度(degree of polymerisation,dp)为10至23。图1a中示出了检测到具有指示低聚物具有奇数个dp(例如11
‑
23个dp)的质量的褐藻多酚,并且图1b中示出了检测到具有指示低聚物具有偶数个dp的质量的褐藻多酚。通常,每种低聚物都存在多于一种异构体。
[0251]
通过pt低聚物的ms峰面积来评定pt低聚物的相对量(图2)。从dp 10至23的粒径分布很大,其中最丰富的形式是从dp11至18的尺寸最多,并且从dp19向前的丰度急剧下降。
[0252]
实施例4
–
抗病毒测试
[0253]
使用实施例3中获得的海藻提取物。
[0254]
将解冻的海藻提取物溶解在脱矿质水中以达到测试所需的浓度。使用所描述的抗病毒测试方法来确定所测试的提取物溶液对特定病毒的对数减少值。接触时间是测试溶液在测试期间与测试病毒接触的时间。结果在下表2中示出。
[0255]
表2
[0256][0257]
*在log
10
r值显示≥符号的情况下,其暗示已完全清除病毒。
[0258]
实施例5
‑
使用固相提取(spe)纯化粗品(水乙醇提取物)以分离成两个级分(i)亲水性更高的级分:(ii)疏水性更高的级分。
[0259]
将提取物(从实施例3获得)自由溶于含有5%(w/w)的0.1%甲酸(fa)的超纯水(ultra
‑
pure water,upw)中,并制备250ml溶液以用于第一轮测试(spe
‑
1)。用2倍体积的含有0.1%fa的乙腈(acetonitrile,acn)制备spe unit(strata c18
‑
e giga管,50g容量和150ml体积;phenomenex ltd)管,然后用3倍体积的含有0.1%fa的upw均衡(nwosu等人,2011)。将提取物以多个60ml批次施加,并使用侧臂烧瓶和真空管线加快洗脱。
[0260]
施加所有提取物样品溶液后,去除unbound(亲水性)级分,并将spe单元用2倍体积的upw+fa洗涤,收集作为wash级分。然后通过用2倍体积的乙腈+fa洗脱该单元获得bound(疏水)级分。然后可以通过用过量的upw+fa进行洗涤来重新均衡该单元以供进一步使用,并在需要之前一直在冰箱中存储在upw+fa中。
[0261]
对于第二轮spe(spe
‑
2)运行,制备400ml的5%(w/v)提取物。除了两次改变外,spe程序是相同的。由于使用该量的材料会超出spe单元的容量,因此重复进行spe程序以重新捕获已进入unbound级分的任何酚类材料。因此,bound级分由从该单元洗脱的两个合并级分组成。而且,收集在spe单元的重新洗涤期间在去除结合的级分之后从所述单元上洗脱的材料。
[0262]
级分的总chon和酚含量
[0263]
使用苯酚
‑
硫酸法测量bound级分和unbound级分的总碳水化合物(chon)含量,并使用folin
–
ciocalteu方法测量总酚含量(total phenol content,tpc)(austin等人,2017)。
[0264]
在spe
‑
1中,chon的总回收率为46.3%,其中unbound级分中的回收率为44.3%,并且bound级分中的回收率为2.0%。总苯酚含量(tpc)的总体回收率较高,为70.3%,其中大部分是在bound级分中回收的(56.8%),并且较少的部分是在unbound级分中回收的(13.7%)。
[0265]
在spe
‑
2中,chon的总回收率较高,为59.1%,其中unbound级分中的回收率为54.6%,并且bound级分中的回收率为4.5%。然而,bound
‑
wash回收级分包含大量chon(即总量为10.7%),因此chon的总回收率达到了69.8%。考虑到spe单元的化学性质,这种“反洗”级分占spe
‑
1中“丢失的”chon的相当数量是出乎意料的。
[0266]
对于spe
‑
2,tpc回收率达到82.1%,其中大部分(70.0%)在bound级分中,并且12.1%在unbound级分中。结合洗涤级分占另外3.4%,因此tpc的总回收率达到85.5%。必须注意的是,这两种定量方法都不是完全特定于chon或酚类的,因此其它组分可能会干扰它们的定量。
[0267]
总体而言,unbound级分富含chon并且tpc较差,而bound级分包含大部分tpc。
[0268]
以chon/tpc的比率表示,原始提取物的值为约3.71,而unbound 1的比率为11.86,并且unbound 2的比率为17.24,这说明chon的富集程度相当高。bound级分1的比率为0.136并且bound级分2的比率为0.255,这表明了酚类的富集和chon的去除。结合洗涤级分是12.04,也显示出chon的富集。
[0269]
通过sephadex lh
‑
20进行分级分离
[0270]
使用sephadex lh20,使用众所周知的用于选择褐藻多酚样组分的技术(pantidos等人,2014)对一部分提取物进行分级分离(https://www.users.miamioh.edu/hagermae/)。制备提取物在upw中的25mg/ml溶液,然后将5ml溶液加入5ml乙醇中并充分混合。提取物可溶于50%乙醇中,在其它测试中,可完全溶于高达80%乙醇中。
[0271]
将提取物添加到5ml sephadex lh20在50%乙醇中的浆液中,并在室温下充分混合10分钟。在5℃下以2500g离心5分钟后,去除未结合的级分,并添加5ml 50%乙醇。重复离心程序以得到wash级分,然后类似地用50%丙酮洗涤,然后用80%丙酮洗涤两次。如前所述测量总chon和苯酚含量,并将每个级分的2
×
1ml等分试样在speed
‑
vac中干燥以供用于lc
‑
ms分析。
[0272]
如图3所示,大多数酚类物质是在前80%的丙酮级分中回收的,其中超过80%在由丙酮释放的级分中,所述酚类物质应是褐藻多酚组分中所富含的。
[0273]
液相色谱质谱(lc
‑
ms)分析:褐藻多酚的迹象
[0274]
使用先前描述的方法(pantidos等人,2014;nwosu等人,2011),使用正模式和负模式两者的电喷雾电离ms分析bound级分和unboud级分的样品,以检查所述级分的组成。在c18反相柱上分离组分,并在280nm下监测酚类物质的洗脱。使用fleet ms获得初始lc
‑
ms数据,然后使用提供更高灵敏度的orbitrap ms与用于给出精确质量数据和多电荷离子的辨别的设施的组合重新分析选定的样品。
[0275]
如图4所示,bound样品富集后期洗脱的uv吸收峰,而unbound级分基本上没有这些
峰。
[0276]
在bound级分中,从12至21分钟的一组峰在负模式下给出了一组m/z信号,这些信号是褐藻多酚的特征。它们表现为两个系列的m/z值,该两个系列的m/z值相差124amu,该124amu等同于间苯三酚减去2个h原子的延伸单位质量,其在我们的研究中先前已经被注意到了(nwosu等人,2010;pantidos等人,2014;austin等人,2018)。来自m/z 745、869、993、1117、1241、1365和1489的系列可能来自将间苯三酚相继添加到m/z值为373的三聚体(例如triphlorethol)中,并且m/z 621、745等处的信号可以是pentaphloroethol、hexaphloroethol等(martinez等人,2013)。因此,在m/z 1117处的主要峰可能是nonaphloroethol(见图5)。值得注意的是,单宁ms信号是在bound级分中约4倍富集的(图6)。
[0277]
如果在12分钟与21分钟之间将整个分离区的ms光谱均分,则这些系列是明显的。并非所有的褐藻多酚组分都可以通过在c18色谱柱上洗脱而容易地分离出来,并且大多数是作为混合峰洗脱。每种褐藻多酚种类也可能有多种异构体。然而,某些峰似乎代表了离散的褐藻多酚组分。特别地,在17.4分钟处的主峰在1117处产生离散的m/z信号,在16.82处的峰产生m/z 1055,在17.62处产生m/z 1179,并且在16.22的峰处产生m/z 933。然而,需要进一步的工作来定义这些组分的结构。
[0278]
后期洗脱的褐藻多酚峰仅存在于通过丙酮从sephadex lh20释放的结合样品中。分级分离可以通过更严格的50%乙醇洗涤然后直接移至80%丙酮洗脱来改善,但结果支持了丙酮对褐藻多酚的预期分级分离(pantidos等人,2014),参见图7。
[0279]
因此,我们可以确信bound级分富集了与先前所述类似种类的褐藻多酚,所述褐藻多酚的表观质量在dp 4
‑
13范围内,并且分子量为约1000g/mol至3000g/mol。
[0280]
使用orbitrap ms的进一步研究提供了进一步的信息。
[0281]
在orbitrap上,f
‑
bound样品显示出与以前相同的后期洗脱紫外线峰,并在12
‑
21分钟的分离区中提供了相似的ms光谱(图9)。
[0282]
和以前一样,主要的紫外线峰在m/z 1117处给出ms信号,但更仔细检查时发现,该信号具有0.5amu的变异,指示[m
‑
h]2‑
离子。作为双电荷离子,真实质量将是两倍多,并且这表明该组分是18个间苯三酚单元的低聚物,而不是之前描述的nonaphloroethol。实际上,从m/z 621向上的系列中的所有m/z值都是带双电荷的,这表明它们都比原始ms数据所表明的更大。dp的这一范围与对来自泡叶藻的褐藻多酚结构的先前报道吻合(steevensz等人,2012)。
[0283]
碳水化合物组分的性质的lc
‑
ms证明
[0284]
在正模式下,原始样品中存在三组电离物质(图10)。存在来自rt 12
‑
21的褐藻多酚组分、来自rt 2
‑
3.7分钟的早期洗脱组分和另一组在4
‑
10分钟之间洗脱的组分。褐藻多酚在bound样品中积累,但是早期洗脱组分在unbound中富集,而其它组分在bound级分中存在却在bound wash级分中富集(见图10)。
[0285]
褐藻多酚给出了特征性ms质谱图(参见迹线3,图11),并且如先前所看到的在bound级分中富集。早期洗脱峰也给出了特定ms信号(参见迹线1,图11),但这些特定ms信号与任何报告的海藻组分都不相似。初始工作表明可能存在硫酸化组分,因为这些信号显示中性损失为80amu,但要鉴定它们的性质将需要进一步的工作。
[0286]
中间洗脱组分也富集在bound wash级分中,产生了一系列有趣的ms信号(参见迹线2,图9)。鉴于与原始相比,bound wash级分富集了chon,因此这些组分在自然界中可能是碳水化合物。存在从m/z[m+h]
+
=831开始的相差162amu的系列。
[0287]
在负模式下也可以看到类似的模式,但是正模式可以提供更强的信号。添加162是向现有结构添加己糖基团(例如葡萄糖)的特征。
[0288]
m/z 831处的信号与laminaripentaitol的分子量相符(可从https://secure.megazyme.com/1
‑3‑
beta
‑
d
‑
laminaripentaitol获得),并且m/z 993、1155、1317和1479处的信号可能是由于在该带有末端甘露醇基团的昆布多糖寡糖的核心结构中添加了己糖。已知甘露醇封端的昆布多糖(m
‑
昆布多糖)存在于泡叶藻属中(kadam等人,2014),并且这些m/z信号表明这种寡糖存在于粗提取物物质中。这些m/z信号给出了非常差的片段化,因此在obritrap ms上重复多个轮次。在orbitrap ms数据中明显有一系列相同的信号(图12)。
[0289]
假定的五寡糖产生ms2片段,所述ms2片段特征为丢失162(丢失己糖基基团=葡萄糖)或182(丢失甘露醇)。m/z 325和345处的信号分别可以是β
‑
连接的葡萄糖二聚体(mw 324)和葡糖基
‑
甘露醇(mw 344)的质子化形式。此外,在831处的m/z信号的精确质量为831.29499,这产生了预测式c
30
h
55
o
26
(误差<2ppm),该式与laminaripentaitol的式相符。
[0290]
可以获得该系列的在m/z 669(dp4)、933(dp6)和1155(dp7)处的其它成员的相似的ms质谱图和片段化数据以及精确的质量公式。
[0291]
总而言之,以上结果证实了粗提取物富集了聚合度为约10至约30,对应于分子量为约1000g/mol至约3000g/mol的褐藻多酚。
[0292]
上述结果还证实,可以使用固相提取spe(色谱法)将粗提取物纯化为富集褐藻多酚的级分和富集多糖的级分,其中褐藻多酚存在于结合的级分中。
[0293]
实施例6
‑
使用切向流过滤tff分离粗品(水乙醇提取物)以分离成两个级分(i)<1000gmol
‑
1;和(ii)>1000gmol
‑
1。
[0294]
a)初始处理/观察
[0295]
将提取物存储在2
‑
8℃,用箔覆盖,并进行了尽可能保护样品避光的工作。
[0296]
研究提取物在水中的溶解度,以告知随后的质量平衡。将提取物制备成在水中为2%,充分混合,离心,然后将不溶和可溶的级分冻干。
[0297]
b)进行切向流过滤(tff)实验以去除低分子量材料/基于尺寸的分离
[0298]
使用在kros flow iii系统(spectrum)上的现有1kda mw截止中空纤维滤芯进行初始范围的轮次,随后使用具有2x表面积的新滤芯进行后续轮次。
[0299]
通过以下方式制备提取物样品:将其以0.5%重悬于水中,然后过滤至gfc(1.2um)(除第一范围的实验(其为0.4%)外)。
[0300]
在各轮次之间尽可能地将tff浓缩和渗滤步骤标准化,并通过渗透物电导率监控分离。
[0301]
将所有提取物样品冻干,并通过folin
‑
ciocalteau测定和带有ri和pda检测器的hplc尺寸排阻色谱(size exclusion chromatography,sec)进行分析。
[0302]
在对样品进行分析和评估之后,还使用vivaspin离心单元(sartorius)以30kda或10kda mw的截止对>1kda的材料进行附加分级分离轮次,以评估使用这种方法是否可以实
现进一步的分离。
[0303]
还使用在pall离心tff系统上的5kda和100kda mw截止t系列膜进行了附加分级分离轮次,以评估这是否可以改善分离。这种膜具有较大的表面积,从而允许较高的样品上样量,但是保留体积也较大。
[0304]
c)基于溶解度/电荷的提取方法
[0305]
所有初始提取实验均对>1kda的材料进行。使用乙酸乙酯提取>1kda的样品,并生成乙酸乙酯可溶和不溶性级分。通过旋转蒸发从样品中去除乙酸乙酯,并将样品重悬并冻干。在几批样品上重复此步骤,并通过folin
‑
ciocalteau测定和hplc
‑
sec分析级分。
[0306]
使用80%甲醇对>1kda的物质进行醇提取。将80%不溶性沉淀物风干,重悬并冻干。通过旋转蒸发从可溶级分中去除甲醇,并将所得物质冻干。通过folin
‑
ciocalteau测定和hplc
‑
sec分析级分。
[0307]
对乙酸乙酯不溶级分进行离子交换色谱法以确定该方法的范围。将样品在tris
‑
nacl缓冲液中上样到q
‑
琼脂糖柱上,并用nacl梯度洗脱。收集,透析和分析两个最大的峰。
[0308]
d)开发folin
‑
ciocalteau测定以估算多酚含量
[0309]
基于文献中描述的方法开发了folin
‑
ciocalteau测定,并发表了这些测定。使用间苯三酚生成标准曲线,并针对定时和孵育温度对方法进行优化。结果生成为以间苯三酚当量计。还引入了pvpp消隐步骤,以估计多少信号可归因于褐藻多酚,以及多少可能是其它多酚或非特异性测定干扰。
[0310]
e)hplc体积排阻色谱、hplc c18分析和gc
‑
fid单糖分析
[0311]
glycomar的现有hplc
‑
sec方法适用于评估byotrol样品级分。使用具有ri和pda检测以及水性流动相(tris
‑
hcl/nacl)的经右旋糖酐标准品(1
‑
1400kda)校准的shodex sb806m柱,其中样品在流动相中制备。
[0312]
已探索开发使用kinetex xb c18柱(phenomenex)的hplc方法来改善多酚评估。流动相为2%乙酸,0
‑
100%甲醇梯度,其中样品在甲醇中制备。将间苯三酚用作对照。
[0313]
使用内部甲醇分解和tms衍生化方法对选定样品进行单糖分析,然后进行gc
‑
fid分析。
[0314]
使用基于氯化钡的内部改良terho方法进行硫酸盐分析。
[0315]
结果概述
[0316]
a)初始观察
[0317]
干重产量表明只有极少量的原始样品(约0.4%w/w)是水不溶性碎屑,例如细胞物质。
[0318]
b)进行切向流过滤实验以去除低分子量材料。
[0319]
表3
‑
使用现有的1kda mw截止中空纤维单元,2g样品载量进行范围划分轮次
[0320][0321]
*此轮次未对渗滤渗透物产量进行量化
[0322]1间苯三酚当量
[0323]
从该单元回收的>1kda物质的回收率低于预期(基于先前的ceva数据),并且有多酚粘附在纤维上的迹象。随后的所有1kda轮次均使用具有更高表面积的新型中空纤维单元进行(下表4)。
[0324]
表4
‑
使用新的1kda mw截断中空纤维单元进行的后续轮次,该单元的表面积为2倍,样品载量为5g:
[0325][0326]
*将来自该轮次>1kda级分和<1kda级分送至bvotrol。
[0327]
(自18年6月12日起的其它轮次仍有待分析)
[0328]
在相同的处理条件(体积、浓度和渗滤)下,新单元上的>1kda级分的产率%远高于划定范围的轮次。再次观察到该单元的有色结垢,但性能检查表明该单元在使用后恢复良好。然而,>1kda的产率随着时间推移而降低,这可能表明了该单元的稳定化。
[0329]
folin测定数据:所有tff级分均在folin
‑
ciocalteau测定中进行测试,并且结果表明多酚保留在>1kda级分中(参见上面的表1和表2)。如果<1kda的级分中存在任何多酚,则所述多酚低于folin测定的定量极限。样品的外观也有很大不同,其中>1kda级分是深褐色和脆的,而<1kda级分是奶油色/白色、易碎且略发粘的。
[0330]
hplc分析:初步hplc
‑
sec分析证实了两个级分的低分子量(mw)轮廓,但在>1kda级分和<1kda级分之间有明显的差异(下图13:左边>1kda,右边<1kda)。当前的方法并未针对解决这种低mw物质进行优化,但是从色谱法中明白的是,<1kda级分由比>1kda级分mw更低(即,保留时间更晚)的水溶性物质组成。这可能是由于<1kda级分中存在大量的甘露醇(甘露醇标准品在21.3分钟处在室温下洗脱)。这些样品的ri色谱图在所有tff批次中均一致。
[0331]
还使用其它分离方法进行了渗析试验以评定产率(下表5)。
[0332]
表5
‑
渗析试验:
[0333]
1kda mwco样品/g开始时>1的产率%(w/w)folin pg当量μg/ml在2018年5月7日的渗析0.512.644.5
[0334]
根据使用1kda mw截断tff进行分级分离的结论是,它已成功从样品中分离出了<1kda的物质。>1kda的物质可包含不同量的较小组分,具体取决于tff步骤的成功。多酚保留在>1kda级分中。多酚样物质在膜上结垢是成问题的。
[0335]
c)基于溶解度和电荷的提取方法。
[0336]
尝试通过在乙酸乙酯或80%甲醇中提取来进一步对>1kda级分进行次级分级分离。
[0337]
表6
‑
21年11月17日的ascox的>1kda级分的基于溶解度的分级分离
[0338][0339]
*在最终folin测定方法开发之前。
[0340]
用80%meoh和更高的载量进行重复提取仍有待分析
[0341]
乙酸乙酯提取:少量>1kda物质可溶于乙酸乙酯,但产率低,并且提取似乎是非特异性的。在以后的批次中,许多物质保留在不溶性级分中,其中在可溶性级分和不溶性级分中都检测到了多酚(上表6)。在第二试验中,>1kda级分中只有小百分比可溶于乙酸乙酯。这些样品也具有据hplc
‑
sec分析可以区分的非常相似的色谱和mw剖面。
[0342]
80%甲醇提取:由于使用乙酸乙酯方法没有成功,因此考虑使用sephadex lh 20方法。然而,由于多酚粘附在树脂和膜过滤器上的问题,因此决定这种方法不太可能导致改善的分离。因此,测试了在80%甲醇而不是乙酸乙酯中的不同溶解度。文献表明,多酚最易溶于80%甲醇(而不是100%甲醇)中,其中较低百分比的甲醇还导致碳水化合物增溶,即碳水化合物应不溶于80%甲醇中,从而允许分离这些物质。
[0343]
>1kda级分中有87.1%可溶于80%甲醇(上表6)。甲醇不溶物仅有低产率(约1
‑
2%),但是这看起来具有降低的多酚含量(上表6)。这些级分的初步hplc
‑
sec表明,不溶物包含mw较高的组分,这些组分似乎不是多酚(按mw和吸光度光谱计)(图14,左)。80%的可溶物质包含所有低mw物质(图14,右)。这些样品中单糖和硫酸盐含量的分析表明,岩藻多糖存在于80%不溶性组分中,但岩藻多糖与其它化合物(包括一些多酚)混合在一起(下表7)。在80%meoh可溶性级分中也检测到了葡萄糖,该糖的来源尚不清楚。尽管这应进一步评估,但是昆布多糖不太可能溶于80%meoh中。
[0344]
表5
‑
80%甲醇提取级分的单糖分析和硫酸盐数据。80%meoh不溶物包含岩藻糖和半乳糖,指示有岩藻多糖。存在硫酸盐,但其含量低于纯岩藻多糖的预期量。葡萄糖也在可溶性和不溶性级分中存在。
[0345][0346]
根据基于溶解度的分级分离方法的结论是,乙酸乙酯不能有效地分配>1kda级分中的组分。尽管来自80%甲醇提取的级分组成不同,但是不溶性级分的产率仅为起始物质的1%(w/w),表明如果该级分富含岩藻多糖,则岩藻多糖仅以非常低的水平存在。在80%meoh可溶性级分中也检测到了葡萄糖,该糖的来源尚不清楚。尽管这应进一步评估,但是昆布多糖不太可能溶于80%meoh中。对其它样品进行了进一步的单糖分析,所述其它样品包括甘露醇和昆布多糖对照。
[0347]
离子交换色谱法:尽管缺乏使用乙酸乙酯进行分级分离的方法,但进行了乙酸乙酯不溶性级分的离子交换色谱法以评估该方法。氯化钠梯度洗脱在整个梯度上产生多个小峰,其中有多酚粘附在柱顶部的迹象。存在最小的基线分离度,并且由于物质粘附在柱上,所以目前尚不清楚有多少样品正在被解析。然而,收集,渗析和冻干了两个最大的峰。对这些峰的分析表明它们不含多酚(下表8),但是低回收率可能会使定量偏倚。初步hplcsec还表明存在一些mw较高的组分,但单糖分析表明仅存在最少量的碳水化合物(此分析中的回收率<5%)。使用这种方法可能将其它组分与多酚分离,但是由于多酚粘附在柱上,并且有多个峰洗脱出来,因此该方法很难控制和扩大规模。
[0348]
表8
‑
21年11月17日的ascox的etac不溶物、>1kda tff级分的离子交换色谱
[0349][0350]
*在最终folin测定方法开发之前
[0351]
d)以碳水化合物和多酚组分为目标的附加分级分离方法。
[0352]
基于溶解度(etac/80%meoh)将>1kda的样品进行分级分离以得到富集多酚或碳水化合物的级分的尝试大都是不成功的,并且处理(例如离子交换)受到多酚的性质及所述多酚对树脂的非特性粘附限制。
[0353]
尽管性质上是初步的,但是所有hplc数据均表明多酚的mw低(大部分<5kda,其中文献表明可能<1kda)。因此,基于预测的多酚的低mw,使用mw截止分离进行进一步试验,以尝试对样品进行进一步分级分离。
[0354]
vivaspin离心分离器:使用两个不同的mw截止,使用vivaspin离心单元对>1kda的21年11月17日的ascox的两个300mg样品进行按mw的进一步分级分离。尽管所得级分的外观有所不同(下图4),但通过folin测定检测到了除<10kda级分外的所有级分中有多酚(下表7)。这些和其它样品证实了样品的颜色确实看起来与存在的多酚的量相关。
[0355]
表9
‑
21年11月17日的ascox的>1kda物质的vivaspin分离
[0356][0357]
使用更高mw截止膜的tff:由于难以将多酚与21年11月17日的ascox中的其它组分分离,因此还使用pall离心tff系统以及100kda和5kda t系列膜进行了试验。该系统也将允许高得多的样品载量(20g),以便生成更大量的级分。如上所述将21年11月17日的ascox溶解并过滤,然后在tff上进行处理。依次使用膜,即使样品通过100kda,然后将所有渗透物(包括来自渗滤步骤的渗透物)汇集起来并施加至5kda膜上。参见表10的产率数据。
[0358]
表8
‑
使用100kda和5kdat系列膜进行的更高mw截止试验
[0359][0360]
*不包括渗滤渗透物的产率
[0361]
初步hplc
‑
sec分析表明,来自21年11月21日的ascox的mw较高物质在>100kda级分中富集。在5
‑
100kda级分中存在限定的峰,其中大多数低mw物质存在于<5kda的级分中。使用比多酚mw高得多的分子筛以及<30kda的vivapsin样品的这种方法也表明,如果mw截止远大于预测的多酚mw,则多酚将通过滤膜。然而,一些多酚仍然保留,这可能是由于膜相互作用或形成大聚集体所致。有可能通过以下方式来改善这种分离:改变膜上的条件(例如较低的离子性或非极性条件、低醇%)以防止聚集并获得更精确的基于尺寸的多酚分离。
[0362]
根据附加离心过滤和tff方法得出的结论是,基于尺寸的膜分级分离由于多酚膜相互作用而受限。然而,使用更高mw截止允许实现改善的分离,其中预测岩藻多糖保留在>100kda级分中,并且大多数多酚通过膜。
[0363]
实施例7
–
在以上实施例5和6中获得粗提取物和级分的抗病毒活性。
[0364]
然后使用如实施例4中所述的方法,使在实施例5和6中获得的亲水、疏水、(i)<1000gmol
‑1;和(ii)>1000gmol
‑
1的级分分别经受针对鼠诺如病毒的抗病毒测试。
[0365]
结果示出在图15和图16中,并确认了bound(疏水性)并且>1000gmol
‑
1的级分是有活性的。
[0366]
实施例8
–
将海藻提取物和富集了褐藻多酚的级分与表没食子儿茶素的抗病毒活性进行比较,表没食子儿茶素是从绿茶中提取的多酚
[0367]
使用从实施例3获得的海藻提取物(粗提取物)和从实施例5获得的海藻提取物(结合提取物)以及从sigma aldrich获得的表没食子儿茶素没食子酸酯(≥95%)。所使用的测试条件如实施例7中所述。
[0368]
结果表明,粗提取物和结合的提取物两者的抗病毒活性均显示出显著的抗病毒活性(参见图17)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1