用于纯化聚乙二醇化蛋白的方法与流程
相关申请的交叉引用
本专利申请要求2018年11月5日提交的美国临时专利申请62/756,020的优先权,将其通过引用以其整体特此并入。
背景技术:
通过共价附接聚乙二醇分子(peg)分子而对蛋白质或生物药物进行化学修饰可以赋予优于未经修饰的蛋白质或生物药物的若干个显著的优势,包括经修饰的蛋白质或生物药物的延长的半衰期、增强的水溶解度、降低的毒性、降低的肾清除率、和降低的免疫原性和抗原性。这些优势似乎主要是由于通过中性、化学惰性、亲水性peg聚合物而显著增加的分子大小(流体动力学半径)以及表面改变和保护(“掩蔽”)。
与聚乙二醇化蛋白的产生相关的挑战之一是,由聚乙二醇化过程产生异质产物,包括未反应的天然蛋白、未反应的peg、和具有一系列聚乙二醇化位点和不同程度的缀合的聚乙二醇化物质。当聚乙二醇化产物用作治疗剂时,从不希望的残余杂质中纯化聚乙二醇化治疗分子是必需的。
目前使用若干种用于纯化聚乙二醇化蛋白的方法,诸如尺寸排阻色谱法(sec)、疏水相互作用色谱法、和最常见的静电相互作用色谱法(离子交换色谱法,iec)。然而,由于与peg聚合物的性质相关的若干个因素,纯化聚乙二醇化蛋白是复杂的。peg聚合物是中性的、亲水性的,并且它们在水溶液中的溶解度反而随温度降低。含有peg和聚乙二醇化蛋白的聚乙二醇化反应产物混合物可以展现出起泡、粘度、和蛋白质或聚合物沉淀。由于聚乙二醇化产物是高分子量聚合物,因此它们倾向于非特异性地吸附到表面并且倾向于增加水溶液的粘度。这些特征强制性地使用于色谱纯化目的的负载溶液浓度降低至约1克/升以便适应色谱介质的能力,这导致低的产率和代价高昂的纯化方法。
因此,需要开发一种用于纯化聚乙二醇化产物的快速并且经济的方法,所述方法导致更高产率的纯聚乙二醇化产物。
技术实现要素:
本公开文本提供了一种使用离子交换色谱法纯化聚乙二醇化产物的有效方法。出人意料地,发现与实践的色谱原理相矛盾,增加负载到分离基质上的聚乙二醇化蛋白浓度导致离子交换基质的结合能力出乎意料地增加和/或聚乙二醇化产物的纯化产率改善。本公开文本的方法提供了时间和成本节约两者:(1)通过增加负载的蛋白质的浓度,减少纯化循环的次数,并且(2)观察到的基质的较高结合能力降低了频繁清洁和更换色谱基质的必要性。
因此,在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,所述方法包括将具有至少6克/升的高浓度的聚乙二醇化蛋白负载到离子交换色谱基质上,并且收集所述聚乙二醇化蛋白。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中与以1g/l的浓度负载的收集的聚乙二醇化蛋白的产率相比,所述具有高浓度的聚乙二醇化蛋白的负载导致所收集的聚乙二醇化蛋白的产率增加。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所收集的聚乙二醇化蛋白的产率增加至少约1.5倍、至少约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍、约10倍、约20倍、约30倍、或约40倍。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中与当聚乙二醇化蛋白以1g/l的浓度负载时所述离子交换基质的负载能力相比,所述具有高浓度的聚乙二醇化蛋白的负载导致所述离子交换基质的负载能力增加。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述离子交换基质的负载能力从6g增加至约7g、约8g、约9g、约10g、约11g、约12g、约13g、约14g、约15g、约16g、约17g、约18g、约19g、或约20g聚乙二醇化蛋白/l基质。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中与当聚乙二醇化蛋白以1g/l的浓度负载时所述离子交换基质的结合能力相比,所述具有高浓度的聚乙二醇化蛋白的负载导致离子交换基质的结合能力增加。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中与当聚乙二醇化蛋白以1g/l的浓度负载时离子交换基质的负载能力相比,所述离子交换基质的结合能力增加约1.1倍、约1.2倍、约1.3倍、约1.5倍、约1.6倍、约1.7倍、约1.8倍、约1.9倍、约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍、约10倍、约15倍、约20倍、或约30倍。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述离子交换色谱基质的结合能力是至少7g、至少7.5g、至少8g、至少8.5g、至少9g、至少9.5g、至少10g、至少10.5g、至少11g、至少11.5g、至少12g、至少12.5g、至少13g、至少13.5g、至少14g、至少14.5g、至少15g、至少15.5g、至少16g、至少16.5g、或至少17g聚乙二醇化蛋白/l基质。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所收集的聚乙二醇化蛋白是至少约20%纯、至少约25%纯、至少约30%纯、至少约35%纯、至少约40%纯、至少约45%纯、至少约50%纯、至少约55%纯、至少约60%纯、至少约65%纯、至少约70%纯、至少约75%纯、至少约80%纯、至少约85%纯、至少约90%纯、至少约95%纯、或至少约98%纯。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中在离子交换色谱法期间的uv干扰降低至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、或至少98%。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中在所述负载前将所负载的聚乙二醇化蛋白在无催化剂的情况下浓缩。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中在所述负载前将所负载的聚乙二醇化蛋白通过切向流过滤浓缩。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中以高浓度负载的聚乙二醇化蛋白具有至少约7g/l、至少约8g/l、至少约9g/l、至少约10g/l、至少约11g/l、至少约12g/l、至少约13g/l、至少约14g/l、至少约15g/l、至少约20g/l、至少约25g/l、至少约30g/l、至少约35g/l、至少约40g/l、至少约45g/l、至少约50g/l、至少约55g/l、或至少约60g/l的浓度。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中以高浓度负载的聚乙二醇化蛋白具有约10g/l、约15g/l、约20g/l、约25g/l、约30g/l、约35g/l、约40g/l、约45g/l、约50、约55、或约60g/l的浓度。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述以高浓度负载的聚乙二醇化蛋白具有约30g/l的浓度。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述聚乙二醇化蛋白的产率是至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、或至少99%。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,所述方法进一步包括使用洗涤缓冲液洗涤基质。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,所述方法进一步包括使用洗脱缓冲液洗脱所述聚乙二醇化蛋白。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述离子交换色谱法是阳离子交换色谱法。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述离子交换色谱法包括cex树脂,所述cex树脂选自poroshs、porosxs、羧甲基纤维素、bakerbondabxtm、固定在琼脂糖上的磺丙基和固定在琼脂糖上的磺酰基、monos、minis、source15s、30s、spsepharosetm、cmsepharosetm、bakerbondcarboxy-sulfon、wpcbx、wp磺酸、hydrocellcm、hydrocelsp、unospheres、macro-prephighs、macro-prepcm、陶瓷hyperds、陶瓷hyperdcm、陶瓷hyperdz、trisacrylmcm、trisacryllscm、trisacrylmsp、trisacryllssp、spherodexlssp、dowex细网目强酸阳离子树脂、dowexmac-3、matrexcellufinec500、matrexcellufinec200、fractogelemdso3-、fractogelemdse、fractogelemdcoo-、amberlite弱和强阳离子交换剂、diaion弱和强阳离子交换剂、tsk凝胶sp-5pw-hr、tsk凝胶sp-5pw、toyopearlcm(650s、650m、650c)、toyopearlsp(650s、650m、650c)、cm(23、32、52)、se(52、53)、p11、express-ionc和express-ions、及其任何组合。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述离子交换色谱法是阴离子交换色谱法。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述离子交换色谱法包括aex树脂,所述aex树脂选自poroshq、porosxq、qsepharosetm快流、deaesepharosetm快流、
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述聚乙二醇化蛋白具有至少约5kda、至少约10kda、至少约15kda、至少约20kda、至少约25kda、至少约30kda、至少约35kda、至少约40kda、至少约45kda、至少约50kda、至少约55kda、至少约60kda、至少约75kda、至少约80kda、至少约85kda、至少约90kda、至少约95kda、至少约100kda、至少约105kda、至少约110kda、至少约115kda、至少约120kda、至少约125kda、至少约130kda、至少约135kda、至少约140kda、至少约145kda、至少约150kda、至少约155kda、至少约160kda、至少约165kda、至少约170kda、至少约175kda、至少约180kda、至少约185kda、至少约190kda、至少约195kda、至少约200kda、至少约300kda、至少约350kda、至少约400kda、至少约450kda、至少约500kda、至少约550kda、或至少约600kda的分子量。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述聚乙二醇化蛋白是已经被聚乙二醇化的野生型蛋白质、突变体、衍生物、变体、或片段。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述聚乙二醇化蛋白是已经被聚乙二醇化的天然存在的蛋白质或重组产生的蛋白质。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述聚乙二醇化蛋白是抗体或融合蛋白。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述聚乙二醇化蛋白是细胞因子、凝血因子、激素、细胞表面受体、生长因子、或其任何组合。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述聚乙二醇化蛋白是成纤维细胞生长因子21(fgf21)、白细胞介素2、因子viii、重组苯丙氨酸氨裂解酶、培伐利酶、adynovate、干扰素(例如,干扰素β-1a(例如,plegridy))、纳洛醇(例如,naloxegol)、培吉沙肽、培塞利珠单抗、红细胞生成素(例如,甲氧基聚乙二醇-依泊汀β)、哌加他尼、重组甲硫氨酰基人粒细胞集落刺激因子、培非格司亭、人生长激素拮抗剂(例如,培维索孟)、干扰素α、(例如,培干扰素α-2a或聚乙二醇干扰素α-2b)、l-天冬酰胺酶(例如,培门冬酶)、腺苷脱氨酶(例如,牛聚乙二醇化腺苷脱氨酶)、或多柔比星。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述聚乙二醇化蛋白是fgf21。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述聚乙二醇化蛋白包含聚乙二醇化部分。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述聚乙二醇化部分是线性的、支链的、单聚乙二醇化的、无规聚乙二醇化的、和多聚乙二醇化的(pegmer)。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述聚乙二醇化部分是至少约1kda、至少约2kda、至少约3kda、至少约4kda、至少约5kda、至少约6kda、至少约7kda、至少约8kda、至少约9kda、至少约10kda、至少约11kda、至少约12kda、至少约13kda、至少约14kda、至少约15kda、至少约16kda、至少约17kda、至少约18kda、至少约19kda、至少约20kda、至少约21kda、至少约22kda、至少约23kda、至少约24kda、至少约25kda、至少约30kda、至少约40kda、至少约50kda、至少约55kda、至少约60kda、至少约65kda、至少约70kda、至少约75kda、至少约80kda、至少约90kda、至少约95kda、或至少约100kda。
在一些实施方案中,本公开文本提供了一种用于纯化聚乙二醇化蛋白的方法,其中所述聚乙二醇化部分是约30kda。
在一些实施方案中,本公开文本提供了一种使用本公开文本的方法纯化的聚乙二醇化蛋白。
附图说明
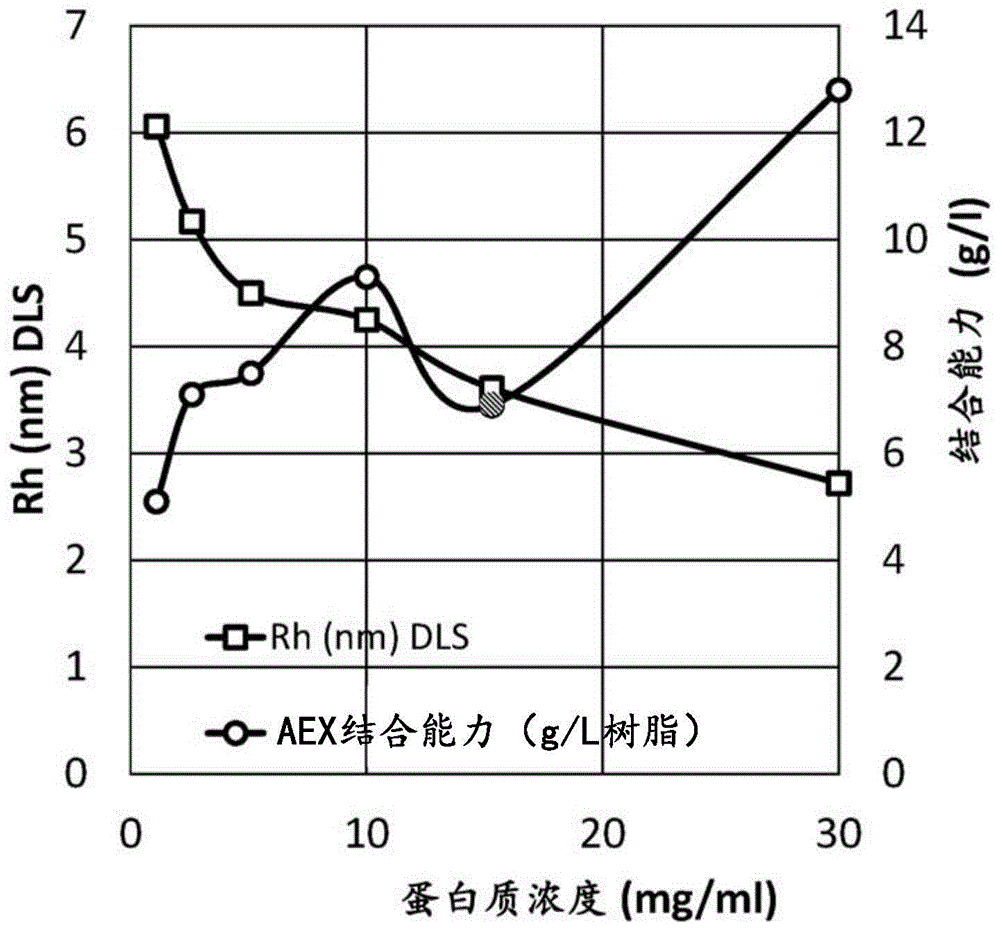
图1:蛋白质浓度对peg-蛋白大小(rh:半径流体动力学,以纳米为单位;dls:动态光散射)和结合能力的影响。聚乙二醇化蛋白浓度从1g/l增加至30g/l,聚乙二醇化蛋白的rh从6.1nm降低至2.7nm,而结合能力从5.1g/l树脂增加至12.8g/l树脂。aex:阴离子交换色谱法。
图2:在当前方案下(聚乙二醇化反应产物的31x稀释;左侧)和在本公开文本的新方法下(中央和右侧)(例如不稀释,通过tff(切向流过滤;如所指示,孔径为10kda和30kda)浓缩,并且负载在iec基质上)聚乙二醇化蛋白的负载浓度和iec基质的结合能力的比较。4-abh:4-氨基苯甲酰肼(聚乙二醇化反应的催化剂)。
具体实施方式
本公开文本提供了一种从不希望的杂质中纯化所希望的聚乙二醇化目标物的有效方法。与本领域的教导相反,本公开文本的方法包括将至少6g/l(而不是低于6g/l(例如1g/l)的稀释溶液)的高浓度的聚乙二醇化蛋白负载到离子交换基质上。出人意料地发现,高浓度的负载的聚乙二醇化蛋白溶液增加了色谱基质的结合能力和负载能力,并且产生了高产率的纯化蛋白质。本公开文本的方法通过以下方式来节省时间、劳力和费用:减少所需的纯化循环的次数,这进而减少了清洁和更换代价高昂的色谱基质的需要,从而获得所希望的聚乙二醇化蛋白。
聚乙二醇化蛋白是使用各种不同的化学试剂从peg链与天然蛋白质的化学附接而形成的。在某些实施方案中,本公开文本提供了一种从包含目的聚乙二醇化蛋白和一种或多种污染物的混合物中纯化目的聚乙二醇化蛋白的方法。可能的污染物包括未反应的peg、未反应的天然蛋白质、反应催化剂、宿主细胞蛋白(hcp)、高分子量物质(hmw)、低分子量物质(lmw)、和dna。本公开文本还提供了一种通过以下方式从溶液中的杂质中纯化所希望的聚乙二醇化目标物的方法:将具有至少6克/升的高浓度的聚乙二醇化蛋白的溶液负载到色谱基质或离子交换基质上,并且收集目标聚乙二醇化产物。
i.定义
为了可以更容易地理解本公开文本,首先定义某些术语。
在本文中使用的情况下,将术语“和/或”视为对两个指定特征或组分中的每一个与或不与另一个的具体公开。因此,如在本文中以短语如“a和/或b”使用的术语“和/或”旨在包括“a和b”、“a或b”、“a”(单独)和“b”(单独)。同样地,如以短语如“a、b和/或c”使用的术语“和/或”旨在包括以下方面中的每一个:a、b和c;a、b或c;a或c;a或b;b或c;a和c;a和b;b和c;a(单独);b(单独);以及c(单独)。
应理解,无论在哪里在本文中用语言“包括/包含(comprising)”描述方面,还提供了以“由……组成”和/或“基本上由……组成”措辞描述的其他类似方面。
除非另有定义,否则本文所用的所有技术和科学术语均具有与本公开文本所涉及领域的普通技术人员通常所理解的相同的含义。例如,concisedictionaryofbiomedicineandmolecularbiology,juo,pei-show,第2版,2002,crc出版社;thedictionaryofcellandmolecularbiology,第3版,1999,学术出版社;以及oxforddictionaryofbiochemistryandmolecularbiology,修订版,2000,牛津大学出版社为技术人员提供了本公开文本中所用的许多术语的通用词典。
单位、前缀和符号以其国际单位制(si)可接受的形式表示。数值范围包括定义所述范围的数字。本文提供的标题不是对本公开文本的各个方面的限制,所述各个方面可以通过参考说明书作为整体而获得。因此,通过以其整体参考说明书,更全面地定义以下紧接着定义的术语。
替代方案(例如,“或”)的使用应当理解为意指替代方案之一、两者或其任何组合。如本文所用,不定冠词“一个/种”(“a”或“an”)应当理解为是指任何所列举或枚举的组分中的“一个/种或多个/种”。
术语“约”或“基本上包含……”是指在如通过本领域普通技术人员确定的特定值或组成的可接受误差范围内的值或组成,其部分取决于如何测量或确定所述值或组成,即测量系统的限制。例如,根据本领域的实践,“约”或“基本上包含……”可以意指在1个或多于1个标准偏差内。可替代地,“约”或“基本上包含……”可以意指高达10%的范围。此外,特别是关于生物系统或过程,所述术语可以意指高达值的一个数量级或高达值的5倍。当在本申请和权利要求中提供特定值或组成时,除非另有说明,否则应当假定“约”或“基本上包含……”的含义在该特定值或组成的可接受误差范围内。
如本文所述,除非另有指示,否则任何浓度范围、百分比范围、比率范围或整数范围应理解为包括所述范围内的任何整数的值,并且在适当时包括其分数(如整数的十分之一和百分之一)。
如本文所用,术语“蛋白质”或“目的蛋白”以其最广义使用,以包括存在于混合物中希望纯化的任何蛋白质(天然的或重组的)。此类目的蛋白包括但不限于酶、激素、生长因子、细胞因子、免疫球蛋白(例如,抗体)和/或任何融合蛋白、及其衍生物和部分。
如在本文中可互换使用的术语“纯化”、“分开”或“分离”是指从包含目的蛋白和一种或多种杂质的组合物或样品中提高目的蛋白的纯度。通常,通过从组合物中去除(完全或部分)至少一种杂质来提高目的蛋白的纯度。
如本文所用,术语“缓冲液”是指这样的物质,通过其在溶液中的存在而增加必须添加以引起ph单位变化的酸或碱的量。缓冲溶液通过其酸碱共轭组分的作用来抵抗ph的变化。用于与生物试剂一起使用的缓冲溶液通常能够维持恒定的氢离子浓度,使得溶液的ph在生理范围内。传统的缓冲液组分包括但不限于有机和无机盐、酸和碱。
术语“色谱法”是指将目的蛋白(例如,聚乙二醇化蛋白)与混合物中存在的其他分子(例如,污染物)分离的任何种类的技术。通常,由于在流动相的影响下混合物的单个分子迁移通过固定介质的速率差异,或在结合和洗脱过程中,将目的蛋白与其他分子(例如,污染物)分离。术语“基质”或“色谱基质”在本文中可互换使用,并且是指任何种类的吸附剂、树脂或固相,其在分离过程中将目的蛋白(例如,含有fc区的蛋白质(诸如免疫球蛋白))与混合物中存在的其他分子分离。非限制性例子包括可置于柱或盒中的微粒状、整体的或纤维状树脂以及膜。用于形成基质的材料的例子包括多糖(诸如琼脂糖和纤维素);以及其他机械稳定的基质,诸如二氧化硅(例如,可控孔度玻璃)、聚(苯乙烯二乙烯基)苯、聚丙烯酰胺、陶瓷颗粒和以上任何一种的衍生物。适用于本公开文本的方法的典型的基质类型的例子是阳离子交换树脂、亲和树脂、阴离子交换树脂或混合模式树脂。“配体”是与色谱基质附接并且决定基质的结合特性的官能团。“配体”的例子包括但不限于离子交换基团、疏水相互作用基团、亲水相互作用基团、亲硫相互作用基团、金属亲和基团、亲和基团、生物亲和基团和混合模式基团(上述的组合)。可以在本文中使用的一些优选的配体包括但不限于强阳离子交换基团,诸如磺丙基、磺酸;强阴离子交换基团,诸如三甲基氯化铵;弱阳离子交换基团,诸如羧酸;弱阴离子交换基团,诸如n5n二乙氨基或deae;疏水相互作用基团,诸如苯基、丁基、丙基、己基;以及亲和基团,诸如蛋白质a、蛋白质g和蛋白质l。
如本文所用,与色谱法相关的术语“色谱柱”或“柱”是通常呈填充有色谱基质或树脂的圆柱体或空心柱的形式的容器。色谱基质或树脂是提供用于纯化的物理和/或化学特性的材料。
术语“离子交换”和“离子交换色谱法”是指这样的色谱过程,其中在适当的ph和电导率条件下,可电离的目的溶质(例如,混合物中的目的蛋白)与和固相离子交换材料连接(例如,通过共价附接)的带相反电荷的配体相互作用,使得目的溶质与带电化合物比混合物中的溶质杂质或污染物更多或更少地非特异性相互作用。混合物中的污染性溶质可以从离子交换材料的柱上洗去,或者与目的溶质相比,更快或更慢地与树脂结合或从树脂中排除。“离子交换色谱法”具体包括阳离子交换(cex)、阴离子交换(aex)和混合模式色谱法。离子交换色谱法在本文中可互换地称为iec和iex。
“阳离子交换树脂”或“阳离子交换膜”是指带负电荷的固相,并且所述固相具有游离阳离子以与经过或通过固相的水溶液中的阳离子交换。可以使用适合于与固相附接形成阳离子交换树脂的任何带负电荷的配体,例如如下所述的羧酸盐、磺酸盐和其他。可商购的阳离子交换树脂包括但不限于例如具有以下的那些:基于磺酸盐的基团(例如,monos、minis、source15s和30s、sp
“阴离子交换树脂”或“阴离子交换膜”是指带正电荷的固相,因此具有与其附接的一个或多个带正电荷的配体。可以使用适合于与固相附接形成阴离子交换树脂的任何带正电荷的配体,诸如季氨基。可商购的阴离子交换树脂包括deae纤维素,来自appliedbiosystems的
如本文所用,术语“污染物”以其最广义使用,以覆盖混合物内的任何不希望的组分或化合物。在细胞培养物、细胞裂解物或澄清的物料(例如,澄清的细胞培养上清液)中,污染物包括例如细胞培养基中存在的宿主细胞核酸(例如,dna)和宿主细胞蛋白质。宿主细胞污染物蛋白质包括但不限于由宿主细胞天然或重组产生的那些蛋白质以及与目的蛋白相关或由其衍生的蛋白质(例如,蛋白水解片段)和其他过程相关的污染物。在某些实施方案中,使用另一种手段(诸如离心、无菌过滤、深度过滤和切向流过滤)从细胞培养物中分离出污染物沉淀物。
在一些实施方案中,术语“抗体”是指包含由二硫键相互连接的至少两条重(h)链和两条轻(l)链的蛋白质。每条重链由重链可变区(在本文中缩写为vh)和重链恒定区(在本文中缩写为ch)组成。在一些抗体(例如,天然存在的igg抗体)中,重链恒定区由铰链和三个结构域ch1、ch2和ch3组成。在一些抗体(例如,天然存在的igg抗体)中,每条轻链由轻链可变区(在本文中缩写为vl)和轻链恒定区组成。轻链恒定区由一个结构域(在本文中缩写为cl)组成。vh和vl区可以进一步细分为具有高变性的区域,称为互补决定区(cdr),散布有更保守的区域,称为框架区(fr)。每个vh和vl由三个cdr和四个fr构成,按照以下顺序从氨基末端到羧基末端排列:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。重链可以具有或不具有c末端赖氨酸。术语“抗体”可以包括双特异性抗体或多特异性抗体。
在一些实施方案中,如本文所用的“igg抗体”(例如,人igg1、igg2、igg3和igg4抗体)具有天然存在的igg抗体的结构,即,其具有与相同亚类的天然存在的igg抗体相同数量的重链和轻链和二硫键。例如,igg1、igg2、igg3或igg4抗体可以由两条重链(hc)和两条轻链(lc)组成,其中两条hc和lc分别通过在天然存在的igg1、igg2、igg3和igg4抗体中存在的相同数量和位置的二硫桥连接(除非抗体已经突变以修饰二硫桥)。
免疫球蛋白可以来自任何公知的同种型,包括但不限于iga、分泌型iga、igg和igm。igg同种型在某些物种中分为以下亚类:人中的igg1、igg2、igg3和igg4,以及小鼠中的igg1、igg2a、igg2b和igg3。免疫球蛋白(例如,igg1)以若干种同种异型存在,它们彼此最多有几个氨基酸的差异。举例来说,“抗体”包括天然存在的抗体和非天然存在的抗体;单克隆抗体和多克隆抗体;嵌合抗体和人源化抗体;人抗体和非人抗体;以及全合成抗体。
如本文所用,术语抗体的“抗原结合部分”是指抗体的保留与抗原特异性结合的能力的一个或多个片段。已经显示抗体的抗原结合功能可以由全长抗体的片段执行。包括在术语抗体的“抗原结合部分”内的结合片段的例子包括(i)fab片段(来自木瓜蛋白酶切割的片段)或由vl、vh、lc和ch1结构域组成的相似的单价片段;(ii)f(ab')2片段(来自胃蛋白酶切割的片段)或包含由铰链区的二硫桥连接的两个fab片段的相似的二价片段;(iii)由vh和ch1结构域组成的fd片段;(iv)由抗体单臂的vl和vh结构域组成的fv片段;(v)dab片段(ward等人,(1989)nature341:544-546),其由vh结构域组成;(vi)分离的互补决定区(cdr);以及(vii)可以任选地通过合成接头连接的两个或更多个分离的cdr的组合。此外,尽管fv片段的两个结构域vl和vh由分开的基因编码,但是它们可以使用重组方法通过合成接头来连接,从而使得它们能够成为单条蛋白质链,在其中vl和vh区配对形成单价分子(称为单链fv(scfv);参见例如,bird等人(1988)science242:423-426;和huston等人(1988)proc.natl.acad.sci.usa85:5879-5883)。此类单链抗体也旨在包括在术语抗体的“抗原结合部分”内。这些抗体片段是使用本领域技术人员已知的常规技术获得的,并且以与完整抗体相同的方式针对效用筛选所述片段。抗原结合部分可以通过重组dna技术或通过完整免疫球蛋白的酶促或化学切割来产生。
如本文所用,术语“重组人抗体”包括通过重组手段制备、表达、产生或分离的所有人抗体,如(a)从对于人免疫球蛋白基因而言是转基因或转染色体的动物(例如,小鼠)或者由其制备的杂交瘤分离的抗体,(b)从转化用于表达所述抗体的宿主细胞(例如,从转染瘤)分离的抗体,(c)从重组的组合人抗体文库分离的抗体,和(d)通过涉及将人免疫球蛋白基因序列剪接到其他dna序列的任何其他手段制备、表达、产生或分离的抗体。
如本文所用,“同种型”是指由重链恒定区基因编码的抗体种类(例如,igg1、igg2、igg3、igg4、igm、iga1、iga2、igd和ige抗体)。
氨基酸在本文中由其通常已知的三字母符号或由iupac-iub生化命名委员会推荐的单字母符号来提及。同样,核苷酸由其普遍接受的单字母代码来提及。
如本文所用,术语“多肽”是指由通过酰胺键(也称为肽键)线性连接的单体(氨基酸)构成的分子。术语“多肽”是指两个或更多个氨基酸的任何一条或多条链,并且不涉及产物的具体长度。如本文所用,术语“蛋白质”旨在包括由一种或多种多肽组成的分子,所述多肽在一些情况下可以通过除酰胺键以外的键缔合。另一方面,蛋白质也可以是单条多肽链。在后一种情况下,单条多肽链在一些情况下可以包含两个或更多个多肽亚基,其融合在一起以形成蛋白质。术语“多肽”和“蛋白质”也指表达后修饰的产物,所述表达后修饰包括但不限于糖基化、乙酰化、磷酸化、酰胺化、通过已知的保护/阻断基团衍生化、蛋白水解切割或通过非天然存在的氨基酸修饰。多肽或蛋白质可以从天然生物来源衍生或通过重组技术产生,但是不一定从指定的核酸序列翻译。它可以以任何方式(包括通过化学合成)产生。
如本文所用的术语“多核苷酸”或“核苷酸”旨在包括包含单个核酸以及多个核酸,并且是指分离的核酸分子或构建体,例如信使rna(mrna)、互补dna(cdna)或质粒dna(pdna)。在某些方面,多核苷酸包含常规磷酸二酯键或非常规键(例如酰胺键,诸如见于肽核酸(pna)中)。
术语“核酸”是指存在于多核苷酸中的任何一个或多个核酸区段,例如dna、cdna或rna片段。当应用于核酸或多核苷酸时,术语“分离的”是指已经从其天然环境中移除的核酸分子、dna或rna,例如,出于本公开文本的目的,认为包含在载体中的编码抗原结合蛋白的重组多核苷酸是分离的。分离的多核苷酸的其他例子包括在异源宿主细胞中维持或从溶液中的其他多核苷酸纯化(部分或基本)的重组多核苷酸。分离的rna分子包括本公开文本的多核苷酸的体内或体外rna转录物。根据本公开文本的分离的多核苷酸或核酸还包括合成产生的此类分子。另外,多核苷酸或核酸可以包括调节元件,诸如启动子、增强子、核糖体结合位点或转录终止信号。
蛋白质的术语“等电点”或“pi”是指蛋白质在其中不带净电荷的溶液的ph的量度。当发现蛋白质处在等同于其pi的ph时,它将携带全局中性的净电荷。pi低于其溶液的ph的蛋白质将携带净负电荷。同样,pi高于其溶液的ph的蛋白质将携带净正电荷。
术语“负载缓冲液”是指用于制备混合物或样品并且将其负载到色谱单元中的缓冲液。
术语“追逐缓冲液”是指在负载缓冲液之后使用的缓冲液,以便驱使混合物或样品通过色谱过程。
术语“hmw种类”是指混合物中存在的任何一种或多种不想要的蛋白质。高分子量种类可以包括二聚体、三聚体、四聚体或其他多聚体。这些种类通常被认为是与产物相关的杂质;并且可能共价或非共价连接;并且也可能例如由错误折叠的单体组成,其中疏水氨基酸残基暴露于极性溶剂;并且可能引起聚集。
术语“lmw物质”是指混合物中存在的任何一种或多种不想要的物质。低分子量物质通常被认为是与产物相关的杂质;并且可能包括截短的物质或旨在成为二聚体的化合物的半分子(诸如单克隆抗体)。
术语“宿主细胞蛋白”或hcp是指由宿主细胞产生的与所需目的蛋白的产生无关的不需要的蛋白质。不需要的宿主细胞蛋白可能会分泌到上游细胞培养上清液中。不需要的宿主细胞蛋白也可能在细胞裂解过程中释放。用于上游细胞培养的细胞需要用于生长、转录和蛋白质合成的蛋白质,并且这些不相关的蛋白质在最终药物产物中是不希望的。
如在本申请中使用的术语“负载”及其语法等效语表示纯化方法的步骤,其中使含有待纯化的目的物质的溶液与固定相接触。这表示a)将溶液添加到固定相所在的色谱装置中,或b)将固定相添加到溶液中。在情况a)中,使含有待纯化的目的物质的溶液通过固定相,从而允许固定相与溶液中的物质之间的相互作用。取决于条件,诸如例如ph、电导率、盐浓度、温度、和/或流速,溶液的一些物质与固定相结合并且因此从溶液中除去。其他物质留在溶液中。溶液中剩余的物质可以在流过物中找到。“流过物(flow-through)”表示通过色谱装置后获得的溶液,所述溶液可以是含有目的物质的负载溶液或缓冲液,所述缓冲液用于冲洗柱或用于引起与固定相结合的一种或多种物质的洗脱。在一个实施方案中,所述色谱装置是柱或盒。可以通过本领域技术人员熟悉的方法(诸如例如沉淀、盐析、超滤、渗滤、冻干、亲和色谱法、或减少溶剂体积以获得呈基本均匀形式的目的物质)进行纯化步骤后从溶液中回收或“收集”目的物质。在情况b)中,将固定相(例如,作为固体)添加到含有待纯化的目的物质的溶液中,从而允许固定相与溶液中的物质之间的相互作用。在相互作用之后,例如通过过滤除去固定相,并且目的物质与固定相结合并且随之从溶液中除去或不与固定相结合并且保留在溶液中。
如本申请中使用的术语“在适于结合的条件下”及其语法等效语表示目的物质(例如,聚乙二醇化蛋白)当与固定相(例如,离子交换材料)接触时与其结合。这不一定意味着100%的目的物质与固定相结合,而是基本上100%的目的物质与固定相结合,即至少50%的目的物质与固定相结合,更优选至少75%的目物质与固定相结合,甚至更优选至少85%的目的物质与固定相结合,并且尤其优选多于95%的目的物质与固定相结合。
如在本申请中使用的术语“缓冲的”表示其中由于酸性或碱性物质的添加或释放而引起的ph的变化被缓冲物质调平的溶液。可以使用产生此类效果的任何缓冲物质。在一些实施方案中,使用药学上可接受的缓冲物质,诸如例如磷酸或其盐、乙酸或其盐、柠檬酸或其盐、吗啉、2-(n-吗啉代)乙磺酸或其盐、组氨酸或其盐、甘氨酸或其盐,或三(羟甲基)氨基甲烷(tris)或其盐。在一个实施方案中,磷酸或其盐、或乙酸或其盐、或柠檬酸或其盐、或其组氨酸或其盐用作缓冲物质。任选地,缓冲溶液可以包含另外的盐,诸如例如氯化钠、硫酸钠、氯化钾、硫酸钾、柠檬酸钠、或柠檬酸钾。
通用的色谱方法及其用途是本领域技术人员已知的。参见例如,chromatography,第5版,a部分:fundamentalsandtechniques,heftmann,e.(编辑),elseviersciencepublishingcompany,纽约,(1992);advancedchromatographicandelectromigrationmethodsinbiosciences,deyl,z.(编辑),elseviersciencebv,荷兰阿姆斯特丹,(1998);chromatographytoday,poole,c.f.,和poole,s.k.,elseviersciencepublishingcompany,纽约,(1991);scopes,proteinpurificationprinciplesandpractice(1982);sambrook,j.,等人(编辑),molecularcloning:alaboratorymanual,第2版,coldspringharborlaboratorypress,纽约冷泉港,1989;或currentprotocolsinmolecularbiology,ausubel,f.m.,等人(编辑),johnwiley&sons,inc.,纽约。
根据本公开文本的“peg”或“peg基团”意指含有聚(乙二醇)作为主要部分的残基。此类peg可以含有其他化学基团,所述化学基团是结合(即,缀合)反应所必需的、是由分子的化学合成产生的、或是分子部分的最佳距离的间隔子。此外,此类peg可以由连接在一起的一个或多个peg侧链组成。具有多于一个的peg链的peg称为多臂或支链peg。支链peg可以例如通过将聚环氧乙烷添加到多种多元醇(包括甘油、季戊四醇、和山梨醇)中来制备。
术语“聚乙二醇化”意指在多肽的n末端处的聚(乙二醇)残基和/或内部氨基酸(例如,赖氨酸残基)的共价连接。蛋白质的聚乙二醇化在现有技术中是广泛已知的,并且由例如bonorag.,dirolis.reactivepegsforproteinconjugation.in:veronesefm,编辑pegylatedproteindrugs:basicscienceandclinicalapplications.basel:birkhauser;2009:33-45综述。还参见,veronese,f.m.,biomaterials22(2001)405-417。peg可以使用不同的官能团连接,并且具有不同分子量的聚乙二醇以及线性和支链peg以及不同的连接基团是本领域已知的(还参见francis,g.e.,等人,int.j.hematol.68(1998)1-18;delgado,c.,等人,crit.rev.ther.drugcarriersystems9(1992)249-304)。聚乙二醇化可以在具有聚乙二醇化试剂的水溶液中进行,如通过使用nhs活化的线性或支链peg分子所述。根据lu,y.,等人,reactivepolymers22(1994)221-229,聚乙二醇化还可以在固相上进行。
合适的peg衍生物是具有从约2kda至约40kda、在一个实施方案中从约20至约40kda、优选约30kda至约35kda的平均分子量的活化的peg分子。在一个实施方案中,peg衍生物是线性或支链peg。适用于制备peg-蛋白质和peg-肽缀合物的多种多样的peg衍生物可以从shearwaterpolymers(美国亚拉巴马州亨茨维尔;www.nektar.com)获得。
活化的peg衍生物是本领域已知的并且描述于例如对于peg-乙烯基砜的morpurgo,m.,等人,j.bioconjug.chem.7(1996)363-368。线性链和支链peg物质适用于制备聚乙二醇化片段。反应性peg试剂的例子是碘-乙酰基-甲氧基-peg、或甲氧基-peg-乙烯基砜(m优选是从约450至约900的整数并且r是具有1至6个碳原子的线性或支链的c1-至c6-烷基,诸如甲基、乙基、异丙基等。这些碘活化的物质是本领域已知的并且例如通过hermanson,g.t.,inbioconjugatetechniques,academicpress,圣地亚哥(1996)第147-148页描述。
ii.纯化方法
蛋白质的聚乙二醇化通常导致不同化合物的混合物,所述化合物诸如多-聚乙二醇化蛋白、单-聚乙二醇化蛋白、非聚乙二醇化蛋白、活化的peg酯的水解产物(例如,游离的聚乙二醇化酸)以及蛋白质本身的水解产物、以及聚乙二醇化反应催化剂。为了获得所希望的聚乙二醇化产物,必须分离这些物质,并且必须纯化目的聚乙二醇化蛋白。
因此,在一方面,本公开文本提供了一种用于获得呈基本上纯化的形式的聚乙二醇化蛋白的方法,所述方法包括将高浓度的聚乙二醇化蛋白的溶液负载到离子交换材料上,并且回收或收集纯化的聚乙二醇化蛋白。在一些实施方案中,本发明的方法涉及一种用于纯化聚乙二醇化蛋白的方法,所述方法包括将具有至少约6克/升(g/l)(例如,至少约10g/l、至少约15g/l、或至少约30g/l)的高浓度的聚乙二醇化蛋白负载到离子交换色谱基质上,并且收集聚乙二醇化蛋白。
作为包括本公开文本的纯化的色谱过程的例子,将单-聚乙二醇化蛋白或多-聚乙二醇化蛋白的混合物以至少约6g/l的蛋白质浓度应用于在缓冲水溶液中的离子交换色谱柱上。在一方面,将混合物使用切向流过滤浓缩,并且去除催化剂以便降低uv干扰并且进行蛋白质浓度确定。在进一步的实施方案中,在应用之前和之后,将第一柱用相同的缓冲溶液洗涤。在与离子交换材料结合的多肽的回收步骤中,通过离子交换柱的缓冲液/溶液的离子强度(即,电导率)增加。这可以通过增加缓冲盐浓度或通过向缓冲溶液中添加其他盐(所谓的洗脱盐)来完成。取决于洗脱方法,通过分批添加浓缩的缓冲液或洗脱盐溶液,一次性(分步洗脱方法)或连续地(连续洗脱方法)增加缓冲液/盐浓度。优选的洗脱盐是柠檬酸钠、氯化钠、硫酸钠、磷酸钠、氯化钾、硫酸钾、磷酸钾、或柠檬酸或磷酸的其他盐、或这些组分的任何混合物。在一个实施方案中,所述洗脱盐是柠檬酸钠、氯化钠、氯化钾、或其混合物。
在一些实施方案中,在本发明的方法后收集的聚乙二醇化蛋白的产率增加至少约1.5倍、至少约2倍、至少约3倍、至少约4倍、至少约5倍、至少约6倍、至少约7倍、至少约8倍、至少约9倍、至少约10倍、至少约20倍、至少约30倍、或至少约40倍。
在一些实施方案中,与当聚乙二醇化蛋白以低于6g/l(例如,约5g/l、约4g/l、约3g/l、约2g/l、或约1g/l)的浓度负载时离子交换基质的负载能力相比,具有高浓度(例如,至少约6g/l、至少约10g/l、至少约15g/l、或至少约30g/l)的聚乙二醇化蛋白的负载导致离子交换基质的负载能力增加。
在一些实施方案中,离子交换基质的负载能力从约6g增加至约7g、约8g、约9g、约10g、约11g、约12g、约13g、约14g、约15g、约16g、约17g、约18g、约19g、或约20g聚乙二醇化蛋白/l基质。在一些实施方案中,负载能力离子交换从约6.5g增加至10g聚乙二醇化蛋白/l基质。在一些实施方案中,负载能力离子交换从约6.5g增加至11mg聚乙二醇化蛋白/l基质。在一些实施方案中,负载能力离子交换从约6.5g增加至12g聚乙二醇化蛋白/l基质。在一些实施方案中,负载能力离子交换从约6.5g增加至13g聚乙二醇化蛋白/l基质。在一些实施方案中,负载能力离子交换从约6.5g增加至14g聚乙二醇化蛋白/l基质。在一些实施方案中,负载能力离子交换从约6.5g增加至15g聚乙二醇化蛋白/l基质。
在一些实施方案中,与当聚乙二醇化蛋白以低于6g/l(例如,约1g/l)的浓度负载时离子交换基质的负载能力相比,具有高浓度(例如,至少6g/l、至少约10g/l、至少约15g/l、或至少约30g/l)的聚乙二醇化蛋白的负载导致离子交换基质的负载能力增加。
在一些实施方案中,与当聚乙二醇化蛋白以低于6g/l(例如,约1g/l)的浓度负载时离子交换基质的结合能力相比,当负载高浓度的聚乙二醇化蛋白时,离子交换基质的结合能力增加约1.1倍、约1.2倍、约1.3倍、约1.5倍、约1.6倍、约1.7倍、约1.8倍、约1.9倍、约2倍、约3倍、约4倍、约5倍、约6倍、约7倍、约8倍、约9倍、约10倍、约15倍、约20倍、或约30倍。
在一些实施方案中,当负载高浓度的聚乙二醇化蛋白时离子交换色谱基质的结合能力是至少7g、至少7.5g、至少8g、至少8.5g、至少9g、至少9.5g、至少10g、至少10.5g、至少11g、至少11.5g、至少12g、至少12.5g、至少13g、至少13.5g、至少14g、至少14.5g、至少15g、至少15.5g、至少16g、至少16.5g、或至少17g聚乙二醇化蛋白/l基质。在一些实施方案中,当负载高浓度的聚乙二醇化蛋白时离子交换色谱基质的结合能力是至少8g聚乙二醇化蛋白/l基质。在一些实施方案中,离子交换色谱基质的结合能力是至少9g聚乙二醇化蛋白/l基质。在一些实施方案中,离子交换色谱基质的结合能力是至少10g聚乙二醇化蛋白/l基质。在一些实施方案中,离子交换色谱基质的结合能力是至少11g聚乙二醇化蛋白/l基质。在一些实施方案中,离子交换色谱基质的结合能力是至少12g聚乙二醇化蛋白/l基质。在一些实施方案中,离子交换色谱基质的结合能力是至少13g聚乙二醇化蛋白/l基质。在一些实施方案中,离子交换色谱基质的结合能力是至少14g聚乙二醇化蛋白/l基质。在一些实施方案中,离子交换色谱基质的结合能力是至少15g聚乙二醇化蛋白/l基质。在一些实施方案中,离子交换色谱基质的结合能力是至少16g聚乙二醇化蛋白/l基质。在一些实施方案中,离子交换色谱基质的结合能力是至少17g聚乙二醇化蛋白/l基质。
在一些实施方案中,当负载高浓度的聚乙二醇化蛋白时在离子交换色谱后收集的聚乙二醇化蛋白是至少约20%纯、至少约25%纯、至少约30%纯、至少约35%纯、至少约40%纯、至少约45%纯、至少约50%纯、至少约55%纯、至少约60%纯、至少约65%纯、至少约70%纯、至少约75%纯、至少约80%纯、至少约85%纯、至少约90%纯、至少约95%纯、或至少约98%纯。
在一些实施方案中,在离子交换色谱法期间的uv干扰降低至少至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、或至少98%。在一些实施方案中,uv干扰从约5%降低至约25%。在一些实施方案中,uv干扰约从10%降低至约30%。在一些实施方案中,uv干扰从约20%降低至约50%。在一些实施方案中,uv干扰从约30%降低至约60%。在一些实施方案中,uv干扰从约40%降低至约75%。在一些实施方案中,uv干扰从约50%降低至约80%。在一些实施方案中,uv干扰从约60%降低至约85%。在一些实施方案中,uv干扰从约70%降低至约90%。在一些实施方案中,uv干扰从约85%降低至约95%。在一些实施方案中,uv干扰从约85%降低至约99%。
在一些实施方案中,在所述负载前将所负载的聚乙二醇化蛋白在无催化剂的情况下浓缩。在一些实施方案中,催化剂是4-氨基苯甲酰肼、4abh或其衍生形式或降解形式。浓缩是涉及从溶液中去除流体同时保留溶质分子的简单过程。溶质浓度的增加与溶液体积的减少成正比(即,将体积减半则有效地使浓度加倍)。
在一些实施方案中,在所述负载前将所负载的聚乙二醇化蛋白通过切向流过滤浓缩。切向流过滤是一种超滤程序,其依赖于使用流体压力来驱动较小分子迁移通过超滤膜同时保留较大分子。通常,选择具有截留分子量(mwco)的膜,所述截留分子量比待保留的蛋白质的分子量小三至六倍。本领域人员已知的其他因素也可以影响适当的mwco的选择,例如流速、加工时间、跨膜压力、分子形状或结构、溶质浓度、其他溶质的存在、和离子条件。tff的主要应用是浓缩、渗滤(脱盐和缓冲液交换)以及将大生物分子与小生物分子分级。
渗滤是分级过程,将较小的分子洗涤通过膜并且使较大的分子留在渗余物中,而最终不会改变浓度。它可以用于去除盐或交换缓冲液。它可以去除乙醇或其他小溶剂或添加剂。
渗滤可以是连续的或不连续的。在连续渗滤中,将渗滤溶液(水或缓冲液)以与产生滤液相同的速率添加到样品进料储库中。以此方式,样品储库中的体积保持恒定,但是可以自由渗透通过膜的小分子(例如,盐)被洗掉。使用脱盐为例,每个另外的渗滤体积(dv)均进一步降低盐浓度。(一个渗滤体积等于将一定体积的水或缓冲液添加到等于系统中产物的体积的进料储库中,然后浓缩回起始体积。例如,如果你开始有200ml样品,则1dv=200ml。)使用2dv用连续渗滤将使离子强度降低约99%。
在不连续渗滤中,首先将溶液稀释,并且然后浓缩回起始体积。然后重复所述过程,直到达到在储库中剩余的小分子(例如,盐)的所需浓度。每个另外的dv都会进一步降低盐浓度。连续渗滤需要较少的滤液体积以实现与不连续渗滤相同程度的盐降低。通过第一次浓缩样品,可以显著降低为了实现指定离子强度所需的渗滤溶液的量。
在一些实施方案中,在切向流过滤之后在离子交换色谱法之前聚乙二醇化蛋白的浓度是至少约20g/l、至少约25g/l、至少约26g/l、至少约27g/l、至少约28g/l、至少约29g/l、至少约30g/l、至少约31g/l、至少约32g/l、至少约33g/l、至少约34g/l、至少约35g/l、至少约36g/l、至少约37g/l、至少约38g/l、至少约39g/l、至少约40g/l、至少约41g/l、至少约42g/l、至少约43g/l、至少约44g/l、至少约45g/l、或至少约50g/l。在一些实施方案中,在切向流过滤之后在离子交换色谱法之前聚乙二醇化蛋白的浓度是至少约35g/l。
在一些实施方案中,根据本公开文本以高浓度负载的聚乙二醇化蛋白具有至少约7g/l、至少约8g/l、至少约9g/l、至少约10g/l、至少约11g/l、至少约12g/l、至少约13g/l、至少约14g/l、至少约15g/l、至少约20g/l、至少约25g/l、至少约30g/l、至少约35g/l、至少约40g/l、至少约45g/l、至少约50g/l、至少约55g/l、或至少约60g/l的浓度。在一些实施方案中,根据本公开文本以高浓度负载的聚乙二醇化蛋白具有从约6g/l至约60g/l、从约10g/l至约60g/l、从约15g/l至约50g/l、从约15g/l至约40g/l、从约15g/l至约35g/l、从约15g/l至约40g/l、从约20g/l至约60g/l、从约20g/l至约50g/l、从约20g/l至约40g/l、从约20g/l至约35g/l、从约20g/l至约30g/l、从约25g/l至约60g/l、从约25g/l至约50g/l、从约25g/l至约40g/l、从约25g/l至约35g/l、从约25g/l至约30g/l、或从约30g/l至约35g/l的浓度。
在一些实施方案中,负载至离子交换色谱法的聚乙二醇化蛋白的高浓度是约10g/l、约15g/l、约20g/l、约25g/l、约30g/l、约35g/l、约40g/l、约45g/l、约50g/l、约55g/l、或约60g/l。
在一些实施方案中,以高浓度负载的聚乙二醇化蛋白具有约15g/l的浓度。在一些实施方案中,以高浓度负载的聚乙二醇化蛋白具有约20g/l的浓度。在一些实施方案中,以高浓度负载的聚乙二醇化蛋白具有约25g/l的浓度。在一些实施方案中,以高浓度负载的聚乙二醇化蛋白具有约30g/l的浓度。在一些实施方案中,以高浓度负载的聚乙二醇化蛋白具有约35g/l的浓度。
在一些实施方案中,与当以低于6g/l(例如,约1g/l)的浓度负载聚乙二醇化蛋白时离子交换基质的结合能力相比,在根据本公开文本运行离子交换色谱法之后聚乙二醇化蛋白的蛋白质产率增加至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约98%、或至少约99%。在一些实施方案中,在根据本公开文本运行离子交换色谱法之后聚乙二醇化蛋白的蛋白质产率从约10%增加至约20%。在一些实施方案中,与当以低于6g/l(例如,约1g/l)的浓度负载聚乙二醇化蛋白时离子交换基质的结合能力相比,在根据本公开文本运行离子交换色谱之后聚乙二醇化蛋白的蛋白质产率从约15%增加至约30%。在一些实施方案中,与当以低于6g/l(例如,约1g/l)的浓度负载聚乙二醇化蛋白时离子交换基质的结合能力相比,在根据本公开文本运行离子交换色谱之后聚乙二醇化蛋白的蛋白质产率从约20%增加至约35%。在一些实施方案中,与当以低于6g/l(例如,约1g/l)的浓度负载聚乙二醇化蛋白时离子交换基质的结合能力相比,在根据本公开文本运行离子交换色谱之后聚乙二醇化蛋白的蛋白质产率从约25%增加至约40%。在一些实施方案中,与当以低于6g/l(例如,约1g/l)的浓度负载聚乙二醇化蛋白时离子交换基质的结合能力相比,在根据本公开文本运行离子交换色谱之后聚乙二醇化蛋白的蛋白质产率从约45%增加至约60%。在一些实施方案中,与当以低于6g/l(例如,约1g/l)的浓度负载聚乙二醇化蛋白时离子交换基质的结合能力相比,在根据本公开文本运行离子交换色谱之后聚乙二醇化蛋白的蛋白质产率从约65%增加至约80%。在一些实施方案中,与当以低于6g/l(例如,约1g/l)的浓度负载聚乙二醇化蛋白时离子交换基质的结合能力相比,在根据本公开文本运行离子交换色谱之后聚乙二醇化蛋白的蛋白质产率从约85%增加至约90%。在一些实施方案中,与当以低于6g/l(例如,约1g/l)的浓度负载聚乙二醇化蛋白时离子交换基质的结合能力相比,在根据本公开文本运行离子交换色谱之后聚乙二醇化蛋白的蛋白质产率从约90%增加至约99%。在一些实施方案中,所述方法进一步包括使用洗涤缓冲液洗涤基质。缓冲液ph和离子强度对于所有形式的离子交换色谱法至关重要。缓冲液抗衡离子应与树脂具有相同的电荷;tris缓冲液通常用于带正电荷的阴离子交换树脂,并且磷酸盐缓冲液通常用于带负电荷的阳离子交换树脂。
在一些实施方案中,所述方法进一步包括使用洗脱缓冲液洗脱聚乙二醇化蛋白。所述洗脱缓冲液被设计用于回收或收集与离子交换材料结合的多肽。通常,通过离子交换柱的缓冲液/溶液的离子强度(即,电导率)增加。这可以通过增加缓冲盐浓度或通过向缓冲溶液中添加其他盐(所谓的洗脱盐)来完成。取决于洗脱方法,通过分批添加浓缩的缓冲液或洗脱盐溶液,一次性(分步洗脱方法)或连续地(连续洗脱方法)增加缓冲液/盐浓度。优选的洗脱盐是柠檬酸钠、氯化钠、硫酸钠、磷酸钠、氯化钾、硫酸钾、磷酸钾、或柠檬酸或磷酸的其他盐、或这些组分的任何混合物。在一个实施方案中,所述洗脱盐是柠檬酸钠、氯化钠、氯化钾、或其混合物。
在一些实施方案中,所述离子交换色谱法是阳离子交换色谱法。阳离子交换色谱法使用对具有净正表面电荷的分子具有亲和力的带负电荷的离子交换树脂。阳离子交换色谱法用于制备和分析目的二者,并且可以分离大范围的分子,从氨基酸和核苷酸到大的蛋白质。
在一些实施方案中,所述离子交换色谱法包括cex树脂,所述cex树脂选自poroshs、porosxs、羧甲基纤维素、bakerbondabxtm、固定在琼脂糖上的磺丙基和固定在琼脂糖上的磺酰基、monos、minis、source15s、30s、spsepharosetm、cmsepharosetm、bakerbondcarboxy-sulfon、wpcbx、wp磺酸、hydrocellcm、hydrocelsp、unospheres、macro-prephighs、macro-prepcm、陶瓷hyperds、陶瓷hyperdcm、陶瓷hyperdz、trisacrylmcm、trisacryllscm、trisacrylmsp、trisacryllssp、spherodexlssp、dowex细网目强酸阳离子树脂、dowexmac-3、matrexcellufinec500、matrexcellufinec200、fractogelemdso3-、fractogelemdse、fractogelemdcoo-、amberlite弱和强阳离子交换剂、diaion弱和强阳离子交换剂、tsk凝胶sp-5pw-hr、tsk凝胶sp-5pw、toyopearlcm(650s、650m、650c)、toyopearlsp(650s、650m、650c)、cm(23、32、52)、se(52、53)、p11、express-ionc和express-ions、及其任何组合。
在一些实施方案中,所述离子交换色谱法是阴离子交换色谱法。阴离子交换色谱法使用对具有净负表面电荷的分子具有亲和力的带正电荷的离子交换树脂。阴离子交换色谱法用于制备和分析目的二者,并且可以分离大范围的分子,从氨基酸和核苷酸到大的蛋白质。
在一些实施方案中,所述阴离子交换色谱法包括aex树脂,所述aex树脂选自poroshq、porosxq、qsepharosetm快流、deaesepharosetm快流、
在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有至少约5、至少约10kda、至少约15kda、至少约20kda、至少约25kda、至少约30kda、至少约35kda、至少约40kda、至少约45kda、至少约50kda、至少约55kda、至少约60kda、至少约75kda、至少约80kda、至少约85kda、至少约90kda、至少约95kda、至少约100kda、至少约105kda、至少约110kda、至少约115kda、至少约120kda、至少约125kda、至少约130kda、至少约135kda、至少约140kda、至少约145kda、至少约150kda、至少约155kda、至少约160kda、至少约165kda、至少约170kda、至少约175kda、至少约180kda、至少约185kda、至少约190kda、至少约195kda、至少约200kda、至少约300kda、至少约35kda0、至少约400kda、至少约450kda、至少约500kda、至少约550kda、或至少约600kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约2kda至约15kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约15kda至约35kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约35kda至约55kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约50kda至约75kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约70kda至约95kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约80kda至约115kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约95kda至约140kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约135kda至约170kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约160kda至约200kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约180kda至约235kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约205kda至约250kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约225kda至约280kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约270kda至约330kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约325kda至约360kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约350kda至约425kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约415kda至约465kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约450kda至约500kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约485kda至约525kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约500kda至约550kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约530kda至约575kda的分子量。在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白具有约560kda至约605kda的分子量。
在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白是已经被聚乙二醇化的野生型蛋白质、突变体、衍生物、变体、或片段,其中蛋白质来源可以是哺乳动物、真核或原核来源,包括但不限于,例如生长因子,例如fgf21、人粒细胞集落刺激因子;白细胞介素,例如白细胞介素2;血液凝血因子,例如因子viii或ix;干扰素,例如干扰素α1a、干扰素α1b、干扰素α2b、干扰素β1;阿片类拮抗剂;激素,例如红细胞生成素;激素拮抗剂,例如人生长激素拮抗剂;酶,例如l-天冬酰胺酶、腺苷脱氨酶、尿酸酶、透明质酸酶;抗体,例如抗体的fab1或fab2片段,例如针对人肿瘤坏死因子α(tnfα)的单克隆抗体的fab片段;细胞因子,例如il10;胶囊化在聚乙二醇化脂质体中的蛋白质,例如多柔比星;和抗生素。
在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白是已经被聚乙二醇化的天然存在的蛋白质或重组产生的蛋白质,或融合蛋白。
在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白是抗体,其中蛋白质来源可以是哺乳动物、真核或原核来源,包括但不限于多克隆抗体、单克隆抗体、人源化抗体、双特异性抗体、多特异性抗体、iga、igg或igm抗体、抗体的抗原结合部分(例如,抗体的fab1或fab2片段,例如针对人肿瘤坏死因子α(tnfα)的单克隆抗体的fab片段)、由vh和ch1结构域组成的fd片段、由抗体单臂的vl和vh结构域组成的fv片段、由vh结构域组成的dab片段、分离的互补决定区(cdr)、以及可以任选地通过合成接头连接的两个或更多个分离的cdr的组合。
在一些实施方案中,可用于本公开文本的聚乙二醇化蛋白是细胞因子、凝血因子、激素、细胞表面受体、生长因子、或其任何组合。
在一些实施方案中,所述聚乙二醇化蛋白是成纤维细胞生长因子21fgf21野生型多肽或经修饰的fgf-21多肽。如本文所用,“经修饰的fgf-21多肽”应当包括与野生型fgf-21不同并且典型地具有成纤维细胞生长因子21的至少一种生物活性的那些多肽和蛋白质及其fgf-21类似物、fgf-21同种型、fgf-21模拟物、fgf-21片段、杂交fgf-21蛋白、融合蛋白、寡聚体和多聚体、同系物、糖基化模式变体、变体、剪接变体、和突变蛋白,无论其生物活性如何。某些fgf-21多肽及其用途描述于以下文献中:美国专利公开号20010012628;美国专利号6,716,626;美国专利公开号2004/0259780;wo03/011213;kharitonenkov等人jclininvest.2005年6月;115(6):1627-35;wo03/059270;美国专利公开号2005/0176631;wo2005/091944;wo2007/0293430;美国专利公开号2007/0293430;wo/2008/121563;美国专利号4,904,584;wo99/67291;wo99/03887;wo00/26354;和美国专利号5,218,092,将所述文献中的每一篇通过引用以其整体并入本文。
在一些实施方案中,所述聚乙二醇化蛋白包含聚乙二醇化部分。
在一些实施方案中,所述聚乙二醇化部分是线性的、支链的、单聚乙二醇化的、无规聚乙二醇化的、和多聚乙二醇化的(pegmer)。
在一些实施方案中,所述聚乙二醇化部分是至少约1、至少约2、至少约3、至少约4、至少约5、至少约6、至少约7、至少约8、至少约9、至少约10、至少约11、至少约12、至少约13、至少约14、至少约15、至少约16、至少约17、至少约18、至少约19、至少约20、至少约21、至少约22、至少约23、至少约24、至少约25、至少约30、至少约40、至少约50、至少约55、至少约60、至少约65、至少约70、至少约75、至少约80、至少约90、至少约95、至少约100kda。在一些实施方案中,所述聚乙二醇化部分是从约1至约100kda。在一些实施方案中,所述聚乙二醇化部分是从约2至约5kda。在一些实施方案中,所述聚乙二醇化部分是从约10至约20kda。在一些实施方案中,所述聚乙二醇化部分是从约25至约50kda。在一些实施方案中,所述聚乙二醇化部分是从约2至约50kda。在一些实施方案中,所述聚乙二醇化部分是从约20至约100kda。在一些实施方案中,所述聚乙二醇化部分是从约5至约30kda。在一些实施方案中,所述聚乙二醇化部分是从约5至约40kda。在一些实施方案中,所述聚乙二醇化部分是从约10至约80kda。
在一些实施方案中,所述聚乙二醇化部分是约30kda。
在一些实施方案中,使用本公开文本的方法纯化的聚乙二醇化蛋白是例如,仅举几例,成纤维细胞生长因子21(fgf21)、白细胞介素2、因子viii、因子ix、重组苯丙氨酸氨裂解酶、干扰素(例如,干扰素β-1a)、阿片类拮抗剂诸如纳洛醇、培塞利珠单抗(certolizumabpegol)、红细胞生成素(例如,甲氧基聚乙二醇-依泊汀(epoetin)β)、哌加他尼、重组甲硫氨酰基人粒细胞集落刺激因子、培非格司亭、人生长激素拮抗剂(例如,培维索孟(pegvisomant))、干扰素α(例如,聚乙二醇干扰素α-2a或聚乙二醇干扰素α-2b)、l-天冬酰胺酶(例如,培门冬酶)、腺苷脱氨酶(例如,牛聚乙二醇化腺苷脱氨酶(pegademasebovine),adagen)、peg-尿酸酶、培罗替卡酶(pegloticase)、代谢尿酸的酶(krystexxa)、重组人透明质酸酶、天冬酰胺酶、人源化抗体诸如阿拉赛珠单抗、单克隆抗体诸如赛利珠单抗的fab片段、可溶性肿瘤坏死因子(pegsunercept)、白细胞介素诸如重组鼠il-10、多柔比星。
聚乙二醇化蛋白的例子包括但不限于以下:
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
iii.组合物和治疗方法
本公开文本还包括一种根据本发明的方法纯化的蛋白质。在一些实施方案中,所述纯化的蛋白质可以进一步被配制为适于施用于哺乳动物(例如,人)。在其他实施方案中,本公开文本包括一种治疗或预防疾病或病症的方法,所述方法包括施用通过本发明的方法纯化的蛋白质。
应领会,具体实施方式部分而不是发明内容和摘要部分旨在用于解释权利要求。发明内容和摘要部分可以阐述如诸位发明人所设想的本公开文本的一个或多个但不是所有的示例性实施方案,并且因此,不旨在以任何方式限制本公开文本和所附权利要求。
以上和以下已经借助于说明指定功能的实现及其关系的功能建立区块描述了本公开文本。为了描述的方便,在本文中已经任意定义了这些功能建立区块的边界。只要适当执行指定功能及其关系,就可以定义可替代的边界。
本文中具体实施方案的描述将如此充分地揭示本公开文本的一般性质,其他人可以通过应用本领域技术范围内的知识,在无需过度实验并且不偏离本公开文本的总体概念的情况下容易地针对各种应用修改和/或调整此类具体实施方案。因此,基于本文给出的传授内容和指导,此类调整和修改旨在包含在所公开的实施方案的等效方案的含义和范围内。应理解,本文中的措辞或术语是出于描述而非限制的目的,因此本说明书的术语或措辞将由本领域技术人员根据传授内容和指导来解释。
本公开文本的广度和范围不应当受本文所述的任何示例性实施方案的限制,而应当仅根据以下权利要求及其等效项来定义。
实施例
实施例1.蛋白质浓度对聚乙二醇化蛋白的大小及其在离子交换色谱法中的吸收的影响
所有大小的蛋白质均可以被聚乙二醇化以出于治疗目的来改善药代动力学特征。在下游加工过程中,聚乙二醇化蛋白存在一些挑战。使用离子交换色谱法纯化聚乙二醇化蛋白。然而,与天然蛋白质相比,聚乙二醇化蛋白的动态结合能力显著降低。潜在的原因包括缀合的peg聚合物链对蛋白质电荷的屏蔽,以及由于大的聚乙二醇化蛋白大小而在树脂珠中降低的扩散率。
在此研究中,我们发现聚乙二醇化蛋白的浓度可以影响聚乙二醇化蛋白的大小和结构,并且因此影响其在离子交换色谱法中的结合行为(参见图1)。与聚乙二醇化反应相关的另一个挑战是,聚乙二醇化反应催化剂的uv吸光度可能干扰随后的色谱图和蛋白质浓度确定。
我们利用切向流过滤浓缩聚乙二醇化蛋白并且去除催化剂和其他杂质。切向流过滤是通过聚乙二醇化混合物的初始稀释、用aex负载缓冲液的渗滤和最终浓缩用于aex负载来进行。aex通过以下方式进行:柱平衡、蛋白质负载、柱洗涤、和使用线性梯度洗脱,然后进行剥离和清洁。用渗滤和浓缩的聚乙二醇化蛋白,实现更高的结合和负载能力,并且在离子交换色谱法中去除uv干扰(参见图1)。
确定aex树脂对浓缩的聚乙二醇化fgf21的结合能力和聚乙二醇化fgf21的流体动力学半径随负载到aex树脂上的聚乙二醇化fgf21浓度的变化(参见图1)。fgf21根据本领域已知的方法被聚乙二醇化。
使用动态光散射确定流体动力学半径,所述动态光散射是本领域中常用的方法。通过将蛋白质负载在aex柱上并且通过uv280监测在突破(breakthrough)之前结合的蛋白质来确定动态结合能力,所述uv280是本领域常用的方法。
如图2所示,其中将聚乙二醇化反应稀释31x并且然后以1g聚乙二醇化fgf21/l的负载浓度经受阴离子交换色谱法的当前方法导致6.5g聚乙二醇化fgf21/laex树脂的结合能力。相比之下,在将聚乙二醇化fgf21通过切向流过滤(如所指示,具有10kda或30kda的孔径)浓缩至30g聚乙二醇化fgf21/l的负载浓度的情况下,所得的结合能力是10g聚乙二醇化fgf21/laex树脂。
缩写:rh,流体动力学半径;dls,动态光散射;dbc,动态结合能力;aex,阴离子交换色谱法;tff,切向流过滤;dv,渗滤体积;qff,q琼脂糖快流;4abh,4-氨基苯甲酸酰肼;paba,对氨基苯甲酸。
- 还没有人留言评论。精彩留言会获得点赞!