产生基因工程化T细胞的方法与流程
相关申请的交叉引用
本申请要求2018年11月6日提交的标题为“产生基因工程化t细胞的方法(processforproducinggeneticallyengineeredtcells)”的美国临时申请62/756,571和2019年1月29日提交的标题为“产生基因工程化t细胞的方法(processforproducinggeneticallyengineeredtcells)”的美国临时申请62/798,457的优先权,所述申请的内容出于所有目的通过引用以其整体并入。
通过引用并入的序列表
本申请是与电子格式的序列表一起提交的。序列表以2019年11月5日创建、大小为74千字节的名为735042017640seqlist.txt的文件提供。将在电子格式的序列表中的信息通过引用以其整体并入。
在一些方面,本公开文本涉及富集cd57阴性t细胞或耗尽cd57阳性细胞的细胞群,以及用于刺激、培育、扩增和/或基因工程化富集cd57阴性t细胞或耗尽cd57阳性t细胞的细胞群的方法。还包括用于生成、分离、富集或选择cd57阴性t细胞或者耗尽cd57阳性细胞的方法,如通过阴性选择来进行。
背景技术:
多种细胞疗法方法可用于治疗疾病和病症。细胞疗法方法包括涉及用重组受体(如嵌合抗原受体)基因工程化的免疫细胞(如t细胞)的方法。然而,在一些情况下,一些现有方法可能得到在体内具有低一致性、效力或持久性的群体。需要用于制造和/或工程化此类细胞疗法的改进方法,包括提供在体内具有高一致性、效力和持久性的改进的细胞疗法产物。
技术实现要素:
本文提供富集t细胞的方法,所述方法包括进行第一选择,所述第一选择包括从含有原代人t细胞的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体含有的cd57+t细胞少于所述生物样品;以及对来自所述耗尽的群体的细胞进行第二选择,所述第二选择包括从所述耗尽的群体富集cd3+t细胞,所述富集由此生成cd57-cd3+t细胞的富集的群体。
本文还提供富集t细胞的方法,所述方法包括进行第一选择,所述第一选择包括从含有原代人t细胞的生物样品富集cd3+t细胞,从而生成富集的t细胞群;以及对来自所述富集的t细胞群的细胞进行第二选择,所述第二选择包括从富集的样品细胞群去除cd57+t细胞,从而生成耗尽的群体,其中所述耗尽的群体含有的cd57+t细胞少于所述生物样品和/或少于所述富集的t细胞群,并且富集cd3+t细胞。
本文还提供富集t细胞的方法,所述方法包括从含有包含原代人t细胞的单采术产物或白细胞单采术产物的生物样品去除cd57+t细胞,从而生成t细胞的耗尽的群体,其中所述耗尽的群体含有的cd57+t细胞少于所述生物样品,并且其中所述耗尽的群体含有以下中的至少一种:(i)少于为或约5%cd57+t细胞;(ii)一定频率的cd57+t细胞,所述频率是所述生物样品中存在的cd57+t细胞的频率的少于为或约35%;以及(iii)cd3+t细胞,其中至少为或约95%的所述cd3+t细胞是cd57-。
在一些任何此类实施方案中,所述耗尽的群体含有以下中的至少一种:(i)少于为或约5%cd57+t细胞;(ii)一定频率的cd57+t细胞,所述频率是所述生物样品中存在的cd57+t细胞的频率的少于为或约35%;(iii)cd4+t细胞,其中至少为或约95%的所述cd4+t细胞是cd57-;以及(iv)cd8+t细胞,其中至少为或约95%的所述cd8+t细胞是cd57-。在一些任何此类实施方案中,所述耗尽的群体中至少为或约95%的所述cd3+t细胞含有cd57-cd3+t细胞。在一些任何此类实施方案中,所述耗尽的群体是第一耗尽的群体,并且所述方法还包括从所述第一耗尽的群体富集cd3+t细胞,从而生成cd57-cd3+t细胞的富集的群体。
在一些任何此类实施方案中,所述生物样品包含单采术产物或白细胞单采术产物。
本文还提供富集t细胞的方法,所述方法包括进行第一选择,所述第一选择包括从含有包含原代人t细胞的单采术产物或白细胞单采术产物的生物样品去除cd57+t细胞,从而生成第一耗尽的群体,所述第一耗尽的群体含有的cd57+t细胞少于所述生物样品;以及(b)对来自所述第一耗尽的群体的细胞进行第二选择,所述第二选择包括从所述第一耗尽的群体富集cd3+t细胞,所述富集由此生成cd57-cd3+t细胞的富集的群体。
本文还提供富集t细胞的方法,所述方法包括(a)进行第一选择,所述第一选择包括从含有包含原代人t细胞的单采术产物或白细胞单采术产物的生物样品富集cd3+t细胞,从而生成富集的生物样品;以及(b)对来自所述富集的生物样品的细胞进行第二选择,所述第二选择包括从所述富集的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体是cd57-cd3+t细胞的富集的群体。
本文还提供富集t细胞的方法,所述方法包括从含有包含原代人t细胞的单采术产物或白细胞单采术产物的生物样品去除cd57+t细胞,从而生成t细胞的耗尽的群体,其中所述耗尽的群体含有的cd57+t细胞少于所述生物样品,并且其中所述耗尽的群体含有:(i)少于为或约5%cd57+t细胞;(ii)一定频率的cd57+t细胞,所述频率是所述生物样品中存在的cd57+t细胞的频率的少于为或约35%;(iii)cd4+t细胞,其中至少为或约95%的所述cd4+t细胞是cd57-;和/或(iv)cd8+t细胞,其中至少为或约95%的所述cd8+t细胞是cd57-。
在一些任何此类实施方案中,所述耗尽的群体含有cd57-cd4+t细胞。在一些任何此类实施方案中,所述耗尽的群体含有cd57-cd8+t细胞。在一些任何此类实施方案中,所述耗尽的群体含有cd57-cd4+t细胞和cd57-cd8+t细胞。
在一些任何此类实施方案中,所述耗尽的群体是第一耗尽的群体,并且所述方法还包括从所述第一耗尽的群体选择cd4+t细胞,从而生成富含cd57-cd4+t细胞的富集的第二耗尽的群体和未选择的群体。在一些任何此类实施方案中,所述方法还包括从所述未选择的群体选择cd8+t细胞,从而生成作为cd57-cd8+t细胞的富集的群体的第三耗尽的群体和第二未选择的群体。
在一些任何此类实施方案中,所述耗尽的群体是第一耗尽的群体,并且所述方法还包括从所述第一耗尽的群体选择cd8+t细胞,从而生成作为cd57-cd8+t细胞的富集的群体的第二耗尽的群体和未选择的群体。在一些任何此类实施方案中,所述方法还包括从所述未选择的群体选择cd4+t细胞,从而生成作为cd57-cd4+t细胞的富集的群体的第三耗尽的群体和第二未选择的群体。
在一些任何此类实施方案中,所述耗尽的群体是第一耗尽的群体,并且所述方法还包括从所述第一耗尽的群体选择cd3+t细胞,从而生成作为cd57-cd3+t细胞的富集的群体的第二耗尽的群体和未选择的群体。
还提供富集t细胞的方法,所述方法包括:(a)进行第一选择,所述第一选择包括从含有包含原代人t细胞的单采术产物或白细胞单采术产物的生物样品去除cd57+t细胞,从而生成第一耗尽的群体,所述第一耗尽的群体含有的cd57+t细胞少于所述生物样品;(b)对来自所述第一耗尽的群体的细胞进行第二选择,所述第二选择包括从所述第一耗尽的群体富集(i)cd4+t细胞和(ii)cd8+t细胞中的一种,所述富集由此生成富集(i)cd4+t细胞和(ii)cd8+t细胞中的一种的第二耗尽的群体以及未选择的群体;以及(c)进行第三选择,所述第三选择包括从所述未选择的群体富集(i)cd4+细胞和(ii)cd8+细胞中的另一种,所述富集由此生成富集(i)cd4+t细胞和(ii)cd8+t细胞中的另一种的第三耗尽的群体。在一些任何此类实施方案中,所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)中cd57+细胞的频率是所述生物样品中cd57+t细胞的频率的少于为或约35%、30%、20%、10%、5%、1%或0.1%。在一些任何此类实施方案中,所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)中cd57+t细胞的频率是所述生物样品中cd57+t细胞的频率的少于为或约35%、30%、20%、10%、5%、1%或0.1%。在一些任何此类实施方案中,所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)包含少于为或约3%、少于为或约2%、少于为或约1%、少于为或约0.1%或者少于为或约0.01%cd57+t细胞。在一些任何此类实施方案中,所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)不含或基本上不含cd57+t细胞。在一些实施方案中,基本上不含cd57+t细胞的耗尽的群体包含少于约或约3%、少于约或约2%、少于约或约1%、少于约或约0.1%或者少于约或约0.01%cd57+t细胞。
在一些任何此类实施方案中,所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)中至少为或约95%的所述cd4+t细胞包含cd57-cd4+t细胞。在一些任何此类实施方案中,所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)中至少为或约95%的所述cd8+t细胞包含cd57-cd8+t细胞。在一些任何此类实施方案中,所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)中至少为或约95%的所述cd4+t细胞和至少为或约95%的所述cd8+t细胞分别包含cd57-cd4+t细胞和cd57-cd8+t细胞。
在一些任何此类实施方案中,所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)中幼稚样细胞的频率比为或约所述生物样品中幼稚样细胞的频率大至少为或约10%、20%、30%、40%或50%。在一些任何此类实施方案中,所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)中cd25+t细胞、cd27+t细胞、cd28+t细胞、ccr7+t细胞或cd45ra+t细胞中的一种或多种的频率比为或约所述生物样品中相应细胞的频率大至少为或约10%、20%、30%、40%或50%。
在一些任何此类实施方案中,所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)包含至少为或约15%、20%、25%、30%、35%或40%cd27+t细胞。在一些任何此类实施方案中,所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)包含至少为或约10%、15%、20%、25%、25%、30%、35%或40%cd28+t细胞。在一些任何此类实施方案中,所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)包含至少为或约10%、15%、20%、25%、25%、30%、35%或40%cd27+cd28+t细胞。在一些任何此类实施方案中,所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)包含至少为或约10%、15%、20%、25%、30%、35%、40%、50%、60%、70%或80%cd27+cd28+t细胞。在一些任何此类实施方案中,所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)包含至少为或约70%或80%cd27+cd28+t细胞。在一些任何此类实施方案中,所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)包含至少为或约10%、15%、20%或25%ccr7+t细胞。
在一些任何所提供实施方案中,使用所述耗尽的群体(任选地所述第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)作为用于基因工程化t细胞的过程中的后续步骤的输入组合物。在一些实施方案中,输入组合物包括富集cd4+细胞(cd57-cd4+)和富集cd8+细胞(cd57-cd8+)的cd57耗尽的群体。在一些实施方案中,输入组合物包括富集cd4+t细胞(cd57-cd4+)和富集cd8+t细胞(cd57-cd8+)的cd57耗尽的群体。在任何所述方法的一些实施方案中,所述方法包括组合所述第二耗尽的群体和第三耗尽的群体的细胞,从而生成输入组合物。在任何所提供实施方案的一些中,所述方法还包括组合所述第二耗尽的群体和所述第三耗尽的群体。在一些任何所提供实施方案中,将所述第二耗尽的群体和所述第三耗尽的群体以为或约1:3与为或约3:1之间的比率组合,从而生成包含所述第二耗尽的群体和所述第三耗尽的群体的耗尽的群体。在一些任何所提供实施方案中,将所述第二耗尽的群体和所述第三耗尽的群体以为或约1:1的比率组合,从而生成包含所述第二耗尽的群体和所述第三耗尽的群体的耗尽的群体。
在任何所提供方法中的一些中,所述方法产生含有至少为或约90%、至少为或约95%、至少为或约97%、至少为或约99%或至少为或约99.9%cd57-cd4+t细胞的t细胞组合物。在任何所提供方法中的一些中,所述方法产生含有至少为或约90%、至少为或约95%、至少为或约97%、至少为或约99%或至少为或约99.9%cd57-cd8+t细胞的t细胞组合物。在任何所提供方法中的一些中,所述方法产生含有至少为或约90%、至少为或约95%、至少为或约97%、至少为或约99%或至少为或约99.9%cd57-cd3+t细胞的t细胞组合物。
在一些任何所提供实施方案中,所述组合物中cd4+与cd8+t细胞的比率在3:1与1:3之间,每个都包含端值。在一些任何所提供实施方案中,所述组合物中cd4+与cd8+t细胞的比率在2:1与1:2之间,每个都包含端值。在一些任何所提供实施方案中,所述组合物中cd4+与cd8+t细胞的比率在1.5:1与1:1.5之间,每个都包含端值。在一些任何所提供实施方案中,所述组合物中cd4+与cd8+t细胞的比率在1.2:1与1:1.2之间,每个都包含端值。在一些任何所提供实施方案中,所述组合物中cd4+与cd8+t细胞的比率是为或约1:1cd4+。在一些任何所提供实施方案中,原代t细胞来自人受试者。在一些任何所提供实施方案中,原代t细胞来自患有疾病或病症的受试者。在一些任何所提供的实施方案中,所述疾病或病症是癌症。在一些任何所提供实施方案中,原代t细胞来自健康受试者。
在一些任何所提供实施方案中,去除cd57+t细胞包括基于免疫亲和力的选择。在一些任何所提供实施方案中,所述基于免疫亲和力的选择包括使细胞与能够与cd57特异性结合的抗体接触并回收未与所述抗体结合的细胞,从而实现阴性选择,其中使回收的细胞耗尽cd57+细胞。在一些任何所提供实施方案中,富集细胞包括基于免疫亲和力的选择。在一些任何所提供实施方案中,所述第一、第二和/或第三选择富集cd4或cd8t细胞,并且所述基于免疫亲和力的选择是通过以下方式来实现:使细胞分别与能够与cd4或cd8特异性结合的抗体接触,并回收与所述抗体结合的细胞,从而实现阳性选择,其中使回收的细胞富集cd4+细胞或cd8+细胞。在一些任何所提供实施方案中,所述选择富集cd3t细胞,并且所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与能够与cd3特异性结合的抗体接触,并回收与所述抗体结合的细胞,从而实现阳性选择,其中使回收的细胞富集cd3+细胞。在一些任何所提供实施方案中,将所述抗体固定在固体表面上。在一些任何所提供实施方案中,所述固体表面是磁粒。在一些任何所提供实施方案中,将所述抗体固定在亲和色谱基质上或附着至亲和色谱基质。
在一些任何所提供实施方案中,所述抗体还包括能够与固定在所述基质上的结合试剂形成可逆键的一种或多种结合配偶体,借此所述抗体在所述接触期间与所述色谱基质可逆地结合。在一些任何所提供实施方案中,所述结合试剂是与所述结合配偶体可逆地结合的链霉亲和素突变蛋白。在一些任何所提供实施方案中,参考seqidno:66中所示氨基酸序列中的链霉亲和素中的位置,在对应于位置44至47的序列位置,所述链霉亲和素突变蛋白含有氨基酸序列lle44-gly45-ala46-arg47;或者参考seqidno:66中所示氨基酸序列中的链霉亲和素中的位置,在对应于位置44至47的序列位置,所述链霉亲和素突变蛋白含有氨基酸序列va144-thr45-ala46-arg47。在一些任何所提供实施方案中,所述结合配偶体是链霉亲和素结合肽。在一些任何所提供实施方案中,所述链霉亲和素结合肽选自trp-ser-his-pro-gln-phe-glu-lys(seqidno:69)、ser-ala-trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)3-trp-ser-his-pro-gln-phe-glu-lys(seqidno:78)、sawshpqfekgggsgggsggsawshpqfek(seqidno:79)、trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)3-trp-ser-his-pro-gln-phe-glu-lys(seqidno:70)、trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)2-trp-ser-his-pro-gln-phe-glu-lys(seqidno:71)和trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)2gly-gly-ser-ala-trp-ser-his-pro-gln-phe-glu-lys(seqidno:72)。在一些任何所提供实施方案中,所述链霉亲和素结合肽具有序列sawshpqfekgggsgggsggsawshpqfek(seqidno:79)。在一些任何所提供实施方案中,所述方法还包括,在使所述样品中的细胞与所述亲和色谱基质接触后,施加竞争试剂以破坏所述结合配偶体与结合试剂之间的键,从而回收与所述抗体结合的细胞。在一些任何所提供实施方案中,所述竞争试剂是生物素或生物素类似物。在一些任何所提供实施方案中,所述色谱基质填充于分离容器中,所述分离容器是柱。在一些任何所提供实施方案中,包含原代t细胞的所述生物样品是用低温保护剂配制的样品。在一些任何所提供实施方案中,所述单采术或白细胞单采术样品是用低温保护剂配制的样品。
还提供刺激t细胞的方法,其包括在刺激条件下孵育输入组合物的t细胞,从而生成t细胞的刺激的群体,其中所述输入组合物含有通过本文所述的任何方法生成的耗尽的群体(任选地第一耗尽的群体、第二耗尽的群体或第三耗尽的群体)。
还提供刺激t细胞的方法,所述方法包括在刺激条件下孵育输入组合物的t细胞,其中所述输入组合物中cd57+t细胞的百分比低于cd57+t细胞的阈值百分比,其中所述阈值是不超过为或约30%cd57+t细胞。在一些任何此类实施方案中,所述阈值百分比是不超过为或约25%、20%、15%、10%、5%或1%cd57+t细胞。
在一些任何此类实施方案中,所述输入组合物含有:(i)少于为或约5%cd57+t细胞;(ii)至少为或约95%cd57-t细胞;(iii)至少为或约90%cd57-cd4+t细胞;(iv)至少为或约90%cd57-cd8+t细胞;以及(v)至少为或约90%cd57-cd3+细胞。
本文还提供刺激t细胞的方法,其包括在刺激条件下孵育输入组合物的t细胞,从而生成t细胞的刺激的群体,其中所述输入组合物含有以下中的至少一种:(i)少于为或约5%cd57+t细胞;(ii)至少为或约95%cd57-t细胞;(iii)至少为或约90%cd57-cd4+t细胞;(iv)至少为或约90%cd57-cd8+t细胞;以及(v)至少约或约90%cd57-cd3+t细胞。
在一些任何此类实施方案中,所述输入组合物包括从含有包含原代人t细胞的单采术产物或白细胞单采术产物的生物样品获得的细胞。
在一些任何此类实施方案中,所述方法还包括从所述生物样品去除cd57+t细胞,从而生成含有t细胞的耗尽的群体的输入组合物。
还提供刺激t细胞的方法,所述方法包括:(a)进行第一选择,所述第一选择包括从含有原代人t细胞的生物样品去除cd57+t细胞,从而生成第一耗尽的群体,所述第一耗尽的群体含有的cd57+t细胞少于所述生物样品;(b)对来自所述第一耗尽的群体的细胞进行第二选择,所述第二选择包括从所述第一耗尽的群体富集(i)cd4+t细胞和(ii)cd8+t细胞中的一种,所述富集由此生成富集(i)cd57-cd4+t细胞和(ii)cd57-cd8+t细胞中的一种的第二耗尽的群体以及未选择的群体;(c)对来自所述未选择的群体的细胞进行第三选择,所述第三选择包括从所述未选择的群体富集(i)cd4+细胞和(ii)cd8+细胞中的另一种,所述富集由此生成富集(i)cd57-cd4+t细胞和(ii)cd57-cd8+t细胞中的另一种的第三耗尽的群体;以及(d)在刺激条件下孵育一种或多种输入组合物,所述一种或多种输入组合物包含来自所述第二耗尽的群体或所述第三耗尽的群体的t细胞。
在一些任何此类实施方案中,步骤(d)包括孵育包含来自所述第二和第三耗尽的群体的cd4+t细胞和cd8+t细胞的输入组合物。在一些任何此类实施方案中,步骤(d)包括单独孵育第一输入组合物和第二输入组合物,所述第一输入组合物含有来自所述第二耗尽的群体的t细胞,并且所述第二输入组合物含有来自所述第三耗尽的群体的t细胞。
在一些任何此类实施方案中,所述第二选择包括富集(i)cd4+t细胞,从而生成富集(i)cd57-cd4+t细胞的第一富集的群体,并且其中所述第一输入组合物含有富集的cd57-cd4+t细胞;并且所述第三选择包括富集(ii)cd8+t细胞,从而生成富集(ii)cd57-cd8+t细胞的第二富集的群体,并且其中所述第二输入组合物含有富集的cd57-cd8+t细胞。在一些任何此类实施方案中,所述第二选择包括富集(ii)cd8+t细胞,从而生成富集(ii)cd57-cd8+t细胞的第一富集的群体,并且其中所述第一输入组合物含有富集的cd57-cd8+t细胞;并且所述第三选择包括富集(i)cd4+t细胞,从而生成富集(i)cd57-cd4+t细胞的第二富集的群体,并且其中所述第二输入组合物含有富集的cd57-cd4+t细胞。本文还提供刺激t细胞的方法,所述方法包括(a)进行第一选择,所述第一选择包括从含有原代人t细胞的生物样品去除cd57+t细胞,从而生成第一耗尽的群体,所述耗尽的群体含有的cd57+t细胞少于所述生物样品;(b)对来自所述第一耗尽的群体的细胞进行第二选择,所述第二选择包括从所述第一耗尽的群体富集cd3+t细胞,所述富集由此生成富集cd3+t细胞的第二耗尽的群体;以及(c)在刺激条件下孵育一种或多种输入组合物,所述一种或多种输入组合物含有来自所述第二耗尽的群体的t细胞。
本文还提供刺激t细胞的方法,所述方法包括(a)对来自生物样品的细胞进行第一选择,所述第一选择包括从所述生物样品富集cd3+t细胞,所述富集由此生成富集cd3+t细胞的富集的生物样品;(b)进行第二选择,所述第二选择包括从含有原代人t细胞的所述富集的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体含有的cd57+细胞少于所述富集的生物样品;以及(c)在刺激条件下孵育一种或多种输入组合物,所述一种或多种输入组合物含有来自所述耗尽的群体的t细胞。
在一些任何此类实施方案中,所述输入组合物包含少于为或约5%cd57+t细胞。在一些任何此类实施方案中,所述输入组合物含有少于为或约3%、少于为或约2%、少于为或约1%、少于为或约0.1%或者少于为或约0.01%cd57+t细胞。在一些任何此类实施方案中,所述输入组合物中cd57+细胞的频率是所述生物样品中存在的cd57+t细胞的频率的少于为或约35%、30%、25%、20%、10%、5%、1%或0.1%。在一些任何此类实施方案中,所述输入组合物中cd57+t细胞的频率是所述生物样品中存在的cd57+t细胞的频率的少于为或约35%、30%、25%、20%、10%、5%、1%或0.1%。在一些任何此类实施方案中,所述输入组合物不含或基本上不含cd57+t细胞。在一些实施方案中,基本上不含cd57+t细胞的耗尽的群体包含少于约或约3%、少于约或约2%、少于约或约1%、少于约或约0.1%或者少于约或约0.01%cd57+t细胞。
在一些任何此类实施方案中,所述输入组合物含有至少为或约95%cd57-t细胞。在一些任何此类实施方案中,所述输入组合物含有至少为或约90%、至少为或约95%、至少为或约97%、至少为或约99%或者至少为或约99.9%cd57-cd4+t细胞。在一些任何此类实施方案中,所述输入组合物含有至少为或约90%、至少为或约95%、至少为或约97%、至少为或约99%或者至少为或约99.9%cd57-cd8+t细胞。在一些任何此类实施方案中,所述cd57-t细胞包括cd57-cd4+t细胞和cd57-cd8+t细胞。在一些任何此类实施方案中,所述输入组合物含有3:1与1:3之间、2:1与1:2之间、1.5:1与1:1.5之间或1.2:1与1:1.2之间的cd4+t细胞与cd8+t细胞的比率,包含端值。在一些任何此类实施方案中,所述输入组合物含有为或为约1:1的cd4+t细胞与cd8+t细胞的比率。
在一些任何此类实施方案中,所述输入组合物中幼稚样细胞的频率比为或约所述生物样品中幼稚样细胞的频率大至少为或约10%、20%、30%、40%或50%。在一些任何此类实施方案中,所述输入组合物中cd25+t细胞、cd27+t细胞、cd28+t细胞、ccr7+t细胞或cd45ra+t细胞中的一种或多种的频率比为或约所述生物样品中相应细胞的频率大至少为或约10%、20%、30%、40%或50%。
在一些任何此类实施方案中,所述输入组合物含有至少为或约15%、20%、25%、30%、35%或40%cd27+t细胞。在一些任何此类实施方案中,所述输入组合物含有至少为或约10%、15%、20%、25%、25%、30%、35%或40%cd28+t细胞。在一些任何此类实施方案中,所述输入组合物含有至少为或约10%、15%、20%、25%、30%、35%、40%、50%、60%、70%或80%cd27+cd28+t细胞。在一些任何此类实施方案中,所述输入组合物含有至少为或约70%或80%cd27+cd28+t细胞。在一些任何此类实施方案中,所述输入组合物含有至少为或约10%、15%、20%或25%ccr7+t细胞。
在一些任何此类实施方案中,所述第一和/或第二选择中的从所述生物样品去除cd57+t细胞和/或富集细胞包括基于免疫亲和力的选择。在一些任何此类实施方案中,所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与能够与cd57、cd4或cd8特异性结合的抗体接触并回收未与所述抗体结合的细胞,从而实现阴性选择,或者回收与所述抗体结合的细胞,从而实现阳性选择,其中使回收的细胞耗尽cd57+细胞,和/或富集cd4+细胞或cd8+细胞,并且将抗体固定在磁粒上。在一些任何此类实施方案中,所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与固定在亲和色谱基质上或附着至亲和色谱基质的抗体接触,所述抗体能够与cd57、cd4或cd8特异性结合,以实现cd57+细胞的阴性选择或cd4+或cd8+细胞的阳性选择。在一些任何此类实施方案中,所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与能够与cd57、cd4或cd8特异性结合的抗体接触并回收未与所述抗体结合的细胞,从而实现阴性选择,或者回收与所述抗体结合的细胞,从而实现阳性选择,其中使回收的细胞耗尽cd57+t细胞,和/或富集cd4+t细胞或cd8+t细胞,并且将抗体固定在磁粒上。在一些任何此类实施方案中,所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与固定在亲和色谱基质上或附着至亲和色谱基质的抗体接触,所述抗体能够与cd57、cd4或cd8特异性结合,以实现cd57+t细胞的阴性选择或cd4+或cd8+t细胞的阳性选择。
在一些任何此类实施方案中,所述刺激条件包括刺激试剂的存在,所述刺激试剂能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域。在一些任何此类实施方案中,所述刺激试剂含有(i)一级药剂,所述一级药剂与tcr复合物的成员特异性结合,任选地与cd3特异性结合,以及(ii)二级药剂,所述二级药剂与t细胞共刺激分子特异性结合,任选地其中所述共刺激分子选自cd28、cd137(4-1-bb)、ox40或icos。
在一些任何此类实施方案中,所述一级和二级药剂中的一种或两种包括抗体或其抗原结合片段。在一些任何此类实施方案中,所述一级和二级药剂包括抗体,任选地其中所述刺激试剂包括与抗cd3抗体和抗cd28抗体或其抗原结合片段一起孵育。在一些任何此类实施方案中,所述一级药剂是抗cd3抗体或其抗原结合片段,并且所述二级药剂是抗cd28抗体或其抗原结合片段。在一些任何此类实施方案中,所述抗原结合片段是选自以下的单价抗体片段:fab片段、fv片段和单链fv片段(scfv)。在一些任何此类实施方案中,所述一级药剂是抗cd3fab,并且所述二级药剂包含抗cd28fab。在一些任何此类实施方案中,所述一级药剂和二级药剂存在于或附着在固体支持物的表面上。在一些任何此类实施方案中,所述固体支持物是或包含珠,任选地顺磁珠。在一些任何此类实施方案中,所述固体支持物是具有表面附着的抗cd3和抗cd28抗体的顺磁珠,并且所述刺激试剂是以少于约或约3:1的珠与细胞的比率存在。
在一些任何此类实施方案中,所述刺激条件包括含有具有表面附着的抗cd3和抗cd28抗体的顺磁珠的刺激试剂的存在,所述刺激试剂是以少于为或约3:1的珠与细胞的比率存在。在一些任何此类实施方案中,所述刺激试剂是以为或为约1:1的珠与细胞的比率存在。
在一些任何此类实施方案中,所述方法还包括从细胞分离所述刺激试剂,所述分离包括使细胞暴露于磁场。
在一些任何此类实施方案中,所述一级药剂和二级药剂可逆地结合在包含多个链霉亲和素或链霉亲和素突变蛋白分子的寡聚颗粒试剂的表面上。在一些任何此类实施方案中,所述链霉亲和素或链霉亲和素突变蛋白分子结合至或能够结合至生物素、抗生物素蛋白、生物素类似物或突变蛋白、抗生物素蛋白类似物或突变蛋白和/或其生物活性片段。在一些任何此类实施方案中,参考seqidno:66中所示氨基酸序列中的链霉亲和素中的位置,在对应于位置44至47的序列位置,链霉亲和素突变蛋白分子包括氨基酸序列val44-thr45-ala46-arg47或ile44-gly45-ala46-arg47。在一些任何此类实施方案中,所述链霉亲和素突变蛋白分子含有:a)seqidno:66-68、73、80-82或85-88中任一项中所示的氨基酸序列;b)如下氨基酸序列:其展现与seqidno:70-73、78和85-89中任一项的至少为或约85%、86%、87%、88%、89%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列同一性,并且含有对应于val44-thr45-ala46-arg47或ile44-gly45-ala46-arg47的氨基酸序列,和/或与生物素、生物素类似物或链霉亲和素结合肽可逆地结合;或者c)a)或b)的与生物素、生物素类似物或链霉亲和素结合肽可逆地结合的功能片段。
在一些任何此类实施方案中,所述链霉亲和素突变蛋白分子含有seqidno:73或78中所示的氨基酸序列。在一些任何此类实施方案中,所述链霉亲和素突变蛋白分子含有seqidno:73中所示的氨基酸序列。在一些任何此类实施方案中,所述链霉亲和素突变蛋白分子含有seqidno:78中所示的氨基酸序列。在一些任何此类实施方案中,所述一级药剂和所述二级药剂各自含有链霉亲和素结合肽。在一些任何此类实施方案中,所述链霉亲和素结合肽选自trp-ser-his-pro-gln-phe-glu-lys(seqidno:69)、trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)3-trp-ser-his-pro-gln-phe-glu-lys(seqidno:76)、trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)2-trp-ser-his-pro-gln-phe-glu-lys(seqidno:77)和trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)2gly-gly-ser-ala-trp-ser-his-pro-gln-phe-glu-lys(seqidno:89)。在一些任何此类实施方案中,所述链霉亲和素结合肽选自trp-ser-his-pro-gln-phe-glu-lys(seqidno:69)、trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)3-trp-ser-his-pro-gln-phe-glu-lys(seqidno:70)、trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)2-trp-ser-his-pro-gln-phe-glu-lys(seqidno:71)和trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)2gly-gly-ser-ala-trp-ser-his-pro-gln-phe-glu-lys(seqidno:89)。在一些任何此类实施方案中,所述一级药剂包括抗cd3fab,并且其中所述二级药剂含有抗cd28fab。
在一些任何此类实施方案中,所述寡聚颗粒试剂含有大于为或约60nm、大于为或约70nm、大于为或约80nm或者大于为或约90nm的半径。在一些任何此类实施方案中,所述寡聚颗粒试剂含有如下分子量:至少为或约5x107g/mol或者至少为或约1x108g/mol;和/或在5x107g/mol与5x108g/mol之间、在1x108g/mol与5x108g/mol之间或在1x108g/mol与2x108g/mol之间。在一些任何此类实施方案中,所述寡聚颗粒试剂含有至少为或约500个链霉亲和素或链霉亲和素突变蛋白四聚体、至少为或约1,000个链霉亲和素或链霉亲和素突变蛋白四聚体、至少为或约1,500个链霉亲和素或链霉亲和素突变蛋白四聚体或者至少为或约2,000个链霉亲和素或链霉亲和素突变蛋白四聚体;和/或;在1,000与20,000之间的链霉亲和素或链霉亲和素突变蛋白四聚体、在1,000与10,000之间的链霉亲和素或链霉亲和素突变蛋白四聚体或者在2,000与5,000之间的链霉亲和素或链霉亲和素突变蛋白四聚体。
在一些任何此类实施方案中,所述方法还包括从细胞分离所述刺激试剂,所述分离包括使物质与所述细胞接触,所述物质能够逆转所述一级和二级药剂与所述寡聚颗粒试剂之间的键。
在一些任何此类实施方案中,所述物质是游离结合配偶体和/或是竞争剂。在一些任何此类实施方案中,所述物质的存在终止或减少t细胞中通过所述一级和二级药剂诱导或调节的信号。在一些任何此类实施方案中,所述物质是或包括链霉亲和素结合肽、生物素或生物活性片段或者生物素类似物或生物活性片段。在一些任何此类实施方案中,所述物质是或包括生物素类似物。在一些任何此类实施方案中,所述物质是或包括链霉亲和素结合肽,并且所述链霉亲和素结合肽选自trp-ser-his-pro-gln-phe-glu-lys(seqidno:69)、trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)3-trp-ser-his-pro-gln-phe-glu-lys(seqidno:70)、trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)2-trp-ser-his-pro-gln-phe-glu-lys(seqidno:77,例如seqidno:71)和trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)2gly-gly-ser-ala-trp-ser-his-pro-gln-phe-glu-lys(seqidno:89,也示于seqidno:72中)。在一些任何此类实施方案中,所述物质是或包括生物素或生物活性片段或者生物素类似物或生物活性片段。
在一些任何此类实施方案中,所述刺激条件包括一种或多种重组细胞因子的存在。在一些任何此类实施方案中,所述刺激条件包括重组il-2、il-7和il-15中的一种或多种的存在。
在一些任何此类实施方案中,所述方法还包括将编码重组受体的异源多核苷酸引入从所述耗尽的群体或所述输入组合物或所述刺激的群体获得的t细胞群中,从而生成t细胞的工程化的群体。
还提供基因工程化t细胞的方法,所述方法包括将编码重组受体的异源多核苷酸引入t细胞的刺激的群体中,所述t细胞的刺激的群体是通过如果所述输入组合物中cd57+t细胞的百分比低于cd57+t细胞的阈值百分比,则在刺激条件下孵育输入组合物的t细胞生成的,其中所述阈值是不超过为或约30%。在一些任何此类实施方案中,所述阈值是不超过为或约25%、20%、15%、10%、5%或1%。
还提供基因工程化t细胞的方法,所述方法包括将编码重组受体的异源多核苷酸引入来自通过本文任何方法的方法产生的t细胞组合物的t细胞群中,从而生成t细胞的工程化的群体。还提供基因工程化t细胞的方法,所述方法包括将编码重组受体的异源多核苷酸引入来自本文提供的任何刺激的t细胞群的t细胞群中,从而生成t细胞的工程化的群体。
还提供基因工程化t细胞的方法,其包括将编码重组受体的异源多核苷酸引入来自输入组合物的t细胞中,其中所述输入组合物含有以下中的一种或多种:(i)少于为或约5%cd57+t细胞;(ii)至少为或约95%cd57-t细胞;(iii)至少为或约90%cd57-cd4+t细胞;或者(iv)至少为或约90%cd57-cd8+t细胞。
还提供基因工程化t细胞的方法,所述方法包括:(a)进行第一选择,所述第一选择包括从含有原代人t细胞的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体含有的cd57+t细胞少于所述生物样品;(b)对来自所述耗尽的群体的细胞进行第二选择,所述第二选择包括从含有原代人t细胞的所述生物样品富集(i)cd4+t细胞和(ii)cd8+t细胞中的一种,所述富集由此生成富集(i)cd57-cd4+t细胞和(ii)cd57-cd8+t细胞中的一种的第一富集的群体以及未选择的群体;以及(c)对来自所述未选择的群体的细胞进行第三选择,所述第三选择包括从所述未选择的群体富集(i)cd4+细胞和(ii)cd8+细胞中的另一种,所述富集由此生成富集(i)cd57-cd4+t细胞和(ii)cd57-cd8+t细胞中的另一种的第二富集的群体;(d)将编码重组受体的异源多核苷酸引入来自所述第一和第二富集的群体中的一个或两个的t细胞中,从而生成t细胞的第一和第二工程化的群体。
还提供基因工程化t细胞的方法,所述方法包括进行第一选择,所述第一选择包括从含有原代人t细胞的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体含有的cd57+t细胞少于所述生物样品;对来自所述耗尽的群体的细胞进行第二选择,所述第二选择包括从含有原代人t细胞的所述生物样品富集cd3+t细胞,所述富集由此生成富集cd57-cd3+t细胞的第一富集的群体;以及将编码重组受体的异源多核苷酸引入来自所述第一富集的群体的t细胞中,从而生成t细胞的第一工程化的群体。在一些任何此类实施方案中,在所述引入前,在刺激条件下孵育所述第一富集的群体。
本文还提供基因工程化t细胞的方法,所述方法包括进行第一选择,所述第一选择包括从含有原代人t细胞的生物样品富集cd3+t细胞,所述富集由此生成富集cd3+t细胞的富集的生物样品;对来自所述富集的生物样品的细胞进行第二选择,所述第二选择包括从含有原代人t细胞的所述富集的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体含有的cd57+t细胞少于所述富集的生物样品;以及将编码重组受体的异源多核苷酸引入来自所述耗尽的群体的t细胞中,从而生成t细胞的第一工程化的群体。在一些任何此类实施方案中,在所述引入前,在刺激条件下孵育所述耗尽的群体。
在一些任何此类实施方案中,在所述引入前,在刺激条件下孵育所述输入组合物或所述富集的群体。
在一些任何此类实施方案中,所述步骤(d)包括将所述异源多核苷酸引入含有来自所述第一和第二富集的群体的cd4+t细胞和cd8+t细胞的细胞群中。在一些任何此类实施方案中,步骤(d)包括将所述异源多核苷酸单独引入所述第一富集的群体的细胞和所述第二富集的群体的细胞中。
在一些任何此类实施方案中,所述第二选择包括富集(i)cd4+t细胞,从而生成富集(i)cd57-cd4+t细胞的第一富集的群体,并且其中所述第一工程化的群体包含cd57-cd4+t细胞;并且所述第三选择包括富集(ii)cd8+t细胞,从而生成富集(ii)cd57-cd8+t细胞的第二富集的群体,并且其中所述第二工程化的群体包含cd57-cd8+t细胞。在一些任何此类实施方案中,所述第二选择包括富集(ii)cd8+t细胞,从而生成富集(ii)cd57-cd8+t细胞的第一富集的群体,并且其中所述第一工程化的群体包含cd57-cd8+t细胞;并且所述第三选择包括富集(i)cd4+t细胞,从而生成富集(i)cd57-cd4+t细胞的第二工程化的群体,并且其中所述第二输入群体包含cd57-cd4+t细胞。
在一些任何此类实施方案中,在所述引入前,在刺激条件下孵育所述第一和第二富集的群体中的一个或两个的细胞。在一些任何此类实施方案中,所述引入包括用包含所述异源多核苷酸的病毒载体进行转导。在一些任何此类实施方案中,所述病毒载体是γ逆转录病毒载体或慢病毒载体。在一些任何此类实施方案中,所述病毒载体是慢病毒载体。
在一些任何此类实施方案中,所述方法还包括在所述引入后将含有转导的细胞的组合物孵育长达96小时。在一些任何此类实施方案中,所述孵育是在为或约37℃±2℃的温度下进行。在一些任何此类实施方案中,在所述引入后,所述孵育进行长达72小时。在一些任何此类实施方案中,在所述引入后,所述孵育进行长达48小时。在一些任何此类实施方案中,在所述引入后,所述孵育进行长达24小时。在一些任何此类实施方案中,所述孵育导致所述病毒载体整合至t细胞的基因组中。
在一些任何此类实施方案中,所述方法任选地还包括在促进工程化细胞的增殖或扩增的条件下培育转化的群体的细胞,从而生成扩增的细胞群。在一些任何此类实施方案中,所述培育是在一种或多种重组细胞因子的存在下进行。在一些实施方案中,所述一种或多种重组细胞因子是il-2、il-7和il-15中的一种或多种。在一些任何此类实施方案中,所述增殖或扩增导致包含所述异源多核苷酸的活t细胞的数量的为、为约或至少为或约2倍、3倍、4倍、5倍或大于为或约5倍增加。
还提供收获或收集细胞的方法,所述方法包括收获或收集通过本文所述任何方法产生的细胞群。
还提供基因工程化t细胞的方法,所述方法包括:(a)在刺激条件下孵育来自通过本文所述任何方法生成的耗尽的群体的t细胞,所述刺激条件包括能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域的刺激试剂的存在,从而生成刺激的t细胞;以及(b)将异源多核苷酸引入所述刺激的t细胞中,所述引入包括用包含编码重组受体的所述异源多核苷酸的病毒载体转导所述刺激的t细胞,从而生成t细胞的工程化的群体。
还提供基因工程化t细胞的方法,所述方法包括:(a)进行第一选择,所述第一选择包括从包含原代人t细胞的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体含有的cd57+t细胞少于所述生物样品;(b)对来自所述耗尽的群体的细胞进行第二选择,所述第二选择包括从含有原代人t细胞的所述生物样品富集(i)cd4+t细胞和(ii)cd8+t细胞中的一种,所述富集由此生成富集(i)cd57-cd4+t细胞和(ii)cd57-cd8+t细胞中的一种的第一富集的群体以及未选择的群体;以及(c)对来自所述未选择的群体的细胞进行第三选择,所述第三选择包括从所述未选择的群体富集(i)cd4+细胞和(ii)cd8+细胞中的另一种,所述富集由此生成富集(i)cd57-cd4+t细胞和(ii)cd57-cd8+t细胞中的另一种的第二富集的群体;(d)在刺激条件下孵育来自所述第一富集的群体和所述第二富集的群体的t细胞,所述刺激条件包括能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域的刺激试剂的存在,从而生成所述第一和第二富集的群体的刺激的t细胞;以及(e)将异源多核苷酸引入所述第一和第二富集的群体的刺激的t细胞中,所述引入包括用含有所述异源多核苷酸的病毒载体转导所述刺激的t细胞,从而生成来自所述第一和第二富集的群体的t细胞的工程化的群体。
本文还提供基因工程化t细胞的方法,所述方法包括进行第一选择,所述第一选择包括从含有原代人t细胞的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体含有的cd57+t细胞少于所述生物样品;对来自所述耗尽的群体的细胞进行第二选择,所述第二选择包括从含有原代人t细胞的所述生物样品富集cd3+t细胞,所述富集由此生成富集cd57-cd3+t细胞的富集的群体;在刺激条件下孵育来自所述富集的群体的t细胞,所述刺激条件包括能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域的刺激试剂的存在,从而生成所述富集的群体的刺激的t细胞;以及将编码重组受体的异源多核苷酸引入所述富集的群体的刺激的t细胞中,所述引入包括用含有所述异源多核苷酸的病毒载体转导所述刺激的t细胞,从而生成来自所述富集的群体的t细胞的工程化的群体。
本文还提供基因工程化t细胞的方法,所述方法包括进行第一选择,所述第一选择包括从含有原代人t细胞的生物样品富集cd3+t细胞,所述富集由此生成富集cd3+t细胞的富集的生物样品;对来自所述富集的生物样品的细胞进行第二选择,所述第二选择包括从含有原代人t细胞的所述富集的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体含有的cd57+t细胞少于所述富集的生物样品;在刺激条件下孵育来自所述耗尽的群体的t细胞,所述刺激条件包括能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域的刺激试剂的存在,从而生成所述耗尽的群体的刺激的t细胞;以及(d)将编码重组受体的异源多核苷酸引入所述耗尽的群体的刺激的t细胞中,所述引入包括用含有所述异源多核苷酸的病毒载体转导所述刺激的t细胞,从而生成来自所述耗尽的群体的t细胞的工程化的群体。
在一些任何此类实施方案中,所述方法还包括:(i)在促进工程化的群体的增殖或扩增的条件下培育工程化t细胞的群体,从而生成t细胞的扩增的群体;以及(ii)收获或收集所述扩增的群体。
在一些任何此类实施方案中,在所述孵育前,所述第一富集的群体和所述第二富集的群体含有以下中的一种或多种:(i)少于为或约5%cd57+t细胞;(ii)一定频率的cd57+t细胞,所述频率是所述生物样品中存在的cd57+t细胞的频率的少于为或约35%;或者(iii)至少为或约95%cd57-t细胞。在一些任何此类实施方案中,在所述孵育前,所述第一富集的群体和所述第二富集的群体含有少于为或约5%cd57+t细胞。在一些任何此类实施方案中,在所述孵育前,所述第一富集的群体和所述第二富集的群体各自含有少于为或约3%、少于为或约2%、少于为或约1%、少于为或约0.1%或者少于为或约0.01%cd57+t细胞。在一些任何此类实施方案中,在所述孵育前,所述第一富集的群体和所述第二富集的群体中cd57+细胞的频率含有所述生物样品中cd57+t细胞的频率的少于为或约35%、30%、20%、10%、5%、1%或0.1%。在一些任何此类实施方案中,在所述引入前,所述第一富集的群体和所述第二富集的群体不含或基本上不含cd57+t细胞。在一些实施方案中,基本上不含cd57+t细胞的耗尽的群体包含少于约或约3%、少于约或约2%、少于约或约1%、少于约或约0.1%或者少于约或约0.01%cd57+t细胞。
在一些任何此类实施方案中,将第一富集的组合物和第二组合物的细胞在单一混合群体中一起孵育和/或培育。在一些任何此类实施方案中,在所述引入前,所述单一混合群体包括3:1与1:3之间、2:1与1:2之间、1.5:1与1:1.5之间或1.2:1与1:1.2之间的cd4+t细胞与cd8+t细胞的比率,包含端值。在一些任何此类实施方案中,在所述引入前,所述单一混合群体包括为或为约1:1的cd4+t细胞与cd8+t细胞的比率。在一些任何此类实施方案中,将所述第一富集的群体和所述第二富集的群体的细胞单独孵育和/或培育。
在一些任何此类实施方案中,所述刺激试剂包括具有表面附着的抗cd3和抗cd28抗体的顺磁珠。在一些任何此类实施方案中,所述刺激试剂包括含有多个链霉亲和素或链霉亲和素突变蛋白分子和可逆地结合的抗cd3和抗cd28fab的寡聚颗粒试剂。
在一些任何此类实施方案中,所述第一和/或第二选择中的从所述生物样品去除cd57+t细胞和/或富集细胞包括基于免疫亲和力的选择。在一些任何此类实施方案中,所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与能够与cd57、cd4或cd8特异性结合的抗体接触并回收未与所述抗体结合的细胞,从而实现阴性选择,或者回收与所述抗体结合的细胞,从而实现阳性选择,其中使回收的细胞耗尽cd57+细胞,和/或富集cd4+细胞或cd8+细胞,并且将抗体固定在磁粒上。在一些任何此类实施方案中,所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与固定在亲和色谱基质上或附着至亲和色谱基质的抗体接触,所述抗体能够与cd57、cd4或cd8特异性结合,以实现cd57+细胞的阴性选择或cd4+或cd8+细胞的阳性选择。在一些任何此类实施方案中,所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与能够与cd57、cd4或cd8特异性结合的抗体接触并回收未与所述抗体结合的细胞,从而实现阴性选择,或者回收与所述抗体结合的细胞,从而实现阳性选择,其中使回收的细胞耗尽cd57+t细胞,和/或富集cd4+t细胞或cd8+t细胞,并且将抗体固定在磁粒上。在一些任何此类实施方案中,所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与固定在亲和色谱基质上或附着至亲和色谱基质的抗体接触,所述抗体能够与cd57、cd4或cd8特异性结合,以实现cd57+t细胞的阴性选择或cd4+或cd8+t细胞的阳性选择。
在一些任何此类实施方案中,在t细胞的工程化的群体或扩增的群体包括阈值数量的t细胞、活t细胞、工程化t细胞或活工程化t细胞或者阈值浓度的t细胞、活t细胞、工程化t细胞或活工程化t细胞的时间或所述时间后,进行所述收获。在一些任何此类实施方案中,在起始刺激后为或约4、5、6或7天内,达到t细胞、活t细胞、工程化t细胞或活工程化t细胞的所述阈值数量或浓度。
在一些任何此类实施方案中,在多个工程化t细胞群体或扩增的t细胞群体之间,在所述多个的至少为或约或者至少为或约70%、80%、90%或95%中,在起始刺激后为或约5或6天内,达到t细胞、活t细胞、工程化t细胞或活工程化t细胞的所述阈值数量或浓度。在一些任何此类实施方案中,在起始刺激后为或约2、3、4或5次群体倍增内,达到t细胞、活t细胞、工程化t细胞或活工程化t细胞的所述阈值数量或浓度。
在一些任何此类实施方案中,所述工程化的群体或所述扩增的群体含有少于为或约3%、少于为或约2%、少于为或约1%、少于为或约0.1%或者少于为或约0.01%cd57+t细胞。在一些任何此类实施方案中,所述工程化的群体或所述扩增的群体不含或基本上不含cd57+t细胞。在一些实施方案中,基本上不含cd57+t细胞的耗尽的群体包含少于约或约3%、少于约或约2%、少于约或约1%、少于约或约0.1%或者少于约或约0.01%cd57+t细胞。
在一些任何此类实施方案中,所述工程化的群体或所述扩增的群体中幼稚样细胞的频率是所述群体中所述细胞的至少为或约10%、20%、30%、40%或50%。在一些任何此类实施方案中,所述工程化的群体或所述扩增的群体中cd25+t细胞、cd27+t细胞、cd28+t细胞、ccr7+t细胞或cd45ra+t细胞中的一种或多种的频率比为或约所述群体中相应细胞的频率大至少为或约10%、20%、30%、40%或50%。在一些任何此类实施方案中,所述工程化的群体或所述扩增的群体含有至少为或约15%、20%、25%、30%、35%或40%cd27+t细胞。在一些任何此类实施方案中,所述工程化的群体或所述扩增的群体含有至少为或约10%、15%、20%、25%、25%、30%、35%或40%cd28+t细胞。在一些任何此类实施方案中,所述工程化的群体或所述扩增的群体含有至少为或约10%、15%、20%、25%、30%、35%、40%、50%、60%、70%或80%cd27+cd28+t细胞。
在一些任何此类实施方案中,所述工程化的群体或所述扩增的群体含有至少为或约70%或80%cd27+cd28+t细胞。在一些任何此类实施方案中,所述工程化的群体或所述扩增的群体含有至少为或约10%、15%、20%或25%ccr7+t细胞。
在一些任何此类实施方案中,收获细胞包括通过冲洗或洗涤所述细胞来去除细胞碎片。在一些任何此类实施方案中,所述收获或收集还包括配制所述细胞用于低温保存或施用至受试者。在一些任何此类实施方案中,在药学上可接受的赋形剂的存在下配制收获或收集的细胞。在一些任何此类实施方案中,配制收获或收集的细胞用于在低温保护剂的存在下进行低温保存。在一些任何此类实施方案中,所述低温保护剂包含dmso。在一些任何此类实施方案中,在容器、任选地小瓶或袋子中配制收获或收集的细胞。
在一些任何此类实施方案中,所述分离在所述收获前进行。在一些任何此类实施方案中,所述分离在所述培育之前或期间进行。在一些任何此类实施方案中,所述分离在所述引入后进行。
在一些任何此类实施方案中,所述重组受体能够与靶抗原结合,所述靶抗原与疾病、障碍或病症的细胞或组织相关,为疾病、障碍或病症的细胞或组织所特有,和/或在疾病、障碍或病症的细胞或组织上表达。在一些任何此类实施方案中,所述疾病、障碍或病症是感染性疾病或障碍、自身免疫性疾病、炎性疾病、或肿瘤或癌症。在一些任何此类实施方案中,所述靶抗原是肿瘤抗原。在一些任何此类实施方案中,所述靶抗原选自αvβ6整联蛋白(avb6整联蛋白)、b细胞成熟抗原(bcma)、b7-h3、b7-h6、碳酸酐酶9(ca9,也称为caix或g250)、癌症-睾丸抗原、癌症/睾丸抗原1b(ctag,也称为ny-eso-1和lage-2)、癌胚抗原(cea)、细胞周期蛋白、细胞周期蛋白a2、c-c基序趋化因子配体1(ccl-1)、cd19、cd20、cd22、cd23、cd24、cd30、cd33、cd38、cd44、cd44v6、cd44v7/8、cd123、cd133、cd138、cd171、硫酸软骨素蛋白聚糖4(cspg4)、表皮生长因子蛋白(egfr)、表皮生长因子受体iii型突变体(egfrviii)、上皮糖蛋白2(epg-2)、上皮糖蛋白40(epg-40)、肝配蛋白b2、肝配蛋白受体a2(epha2)、雌激素受体、fc受体样蛋白5(fcrl5;也称为fc受体同源物5或fcrh5)、胎儿乙酰胆碱受体(胎儿achr)、叶酸结合蛋白(fbp)、叶酸受体α、神经节苷脂gd2、o-乙酰化gd2(ogd2)、神经节苷脂gd3、糖蛋白100(gp100)、磷脂酰肌醇蛋白聚糖-3(gpc3)、g蛋白偶联受体5d(gprc5d)、her2/neu(受体酪氨酸激酶erb-b2)、her3(erb-b3)、her4(erb-b4)、erbb二聚体、人高分子量黑色素瘤相关抗原(hmw-maa)、乙型肝炎表面抗原、人白细胞抗原a1(hla-a1)、人白细胞抗原a2(hla-a2)、il-22受体α(il-22rα)、il-13受体α2(il-13rα2)、激酶插入结构域受体(kdr)、κ轻链、l1细胞粘附分子(l1-cam)、l1-cam的ce7表位、含有富亮氨酸重复序列的蛋白8家族成员a(lrrc8a)、路易斯y、黑色素瘤相关抗原(mage)-a1、mage-a3、mage-a6、mage-a10、间皮素(msln)、c-met、鼠类巨细胞病毒(cmv)、粘蛋白1(muc1)、muc16、自然杀伤细胞2族成员d(nkg2d)配体、黑色素a(mart-1)、神经细胞粘附分子(ncam)、癌胚胎抗原、黑色素瘤优先表达抗原(prame)、孕酮受体、前列腺特异性抗原、前列腺干细胞抗原(psca)、前列腺特异性膜抗原(psma)、受体酪氨酸激酶样孤儿受体1(ror1)、存活蛋白、滋养层糖蛋白(tpbg,也称为5t4)、肿瘤相关糖蛋白72(tag72)、酪氨酸酶相关蛋白1(trp1,也称为tyrp1或gp75)、酪氨酸酶相关蛋白2(trp2,也称为多巴色素互变异构酶、多巴色素δ异构酶或dct)、血管内皮生长因子受体(vegfr)、血管内皮生长因子受体2(vegfr2)、肾母细胞瘤1(wt-1)、病原体特有的或病原体表达的抗原、或与通用标签相关的抗原、和/或生物素化的分子、和/或由hiv、hcv、hbv或其他病原体表达的分子。
在一些任何此类实施方案中,所述重组蛋白是或包括功能性非tcr抗原受体或者tcr或其抗原结合片段。在一些任何此类实施方案中,所述重组蛋白是嵌合抗原受体(car)。在一些任何此类实施方案中,所述重组受体是抗bcmacar。在一些任何此类实施方案中,所述重组蛋白是抗cd19car。在一些任何此类实施方案中,所述嵌合抗原受体包括含有抗原结合结构域、间隔子和/或铰链区的细胞外结构域、跨膜结构域以及含有共刺激信号传导区的细胞内信号传导结构域。在一些任何此类实施方案中,包括抗原结合结构域的细胞外结构域包括scfv。
在一些任何此类实施方案中,所述细胞内信号传导结构域是或包括初级信号传导结构域、能够在t细胞中诱导初级激活信号的信号传导结构域、t细胞受体(tcr)组分的信号传导结构域和/或包括免疫受体酪氨酸激活基序(itam)的信号传导结构域。在一些任何此类实施方案中,所述细胞内信号传导结构域是或包括cd3链、任选地cd3-zeta(cd3ζ)链的细胞内信号传导结构域或其信号传导部分。在一些任何此类实施方案中,所述共刺激信号传导区包括cd28、4-1bb或icos的细胞内信号传导结构域或其信号传导部分。
还提供鉴定能够扩增的细胞群的方法,所述方法包括测量所述群体中cd57+细胞的频率,其中如果cd57+细胞的频率低于阈值频率,则将所述细胞群鉴定为能够扩增。还提供鉴定能够扩增的细胞群的方法,所述方法包括测量所述群体中cd57+t细胞的频率,其中如果cd57+t细胞的频率低于阈值频率,则将所述细胞群鉴定为能够扩增。
在一些任何此类实施方案中,所述阈值频率是少于为或约35%、30%、20%、10%、5%、1%或0.1%的百分比。在一些任何此类实施方案中,在促进增殖或扩增的条件下培育的4、5、6、7或8天内,能够扩增的群体扩增至少为或约2倍、4倍、8倍或16倍。
还提供确定t细胞群的扩增能力的方法,所述方法包括测量t细胞群中与cd57表达相关的性状的值,其中如果所述性状的值少于为或约所述性状的阈值,则将所述t细胞群确定为能够扩增。
在一些任何此类实施方案中,所述阈值:i)低于多个参考t细胞群中与cd57表达相关的所述性状的平均或中位测量值25%、20%、15%、10%或5%,约25%、20%、15%、10%或5%,或25%内、20%内、15%内、10%内或5%内,和/或比为或约所述平均或中位测量值小低于一个标准差;ii)低于来自多个参考t细胞群的群体中与cd57表达相关的所述性状的最低测量值,任选地低于所述最低测量值50%内、25%内、20%内、15%内、10%内或5%内;iii)低于从来自多个参考t细胞组合物的超过65%、75%、80%、85%的样品计算的与cd57表达相关的所述性状的平均或中位测量值;其中所述多个参考t细胞群是当在促进t细胞的增殖或扩增的条件下培育时未扩增的多个群体,任选地其中在培育的4、5、6、7或8天内,所述细胞未扩增至少为或约2倍、4倍、8倍或16倍。
在一些任何此类实施方案中,所述性状是在总t细胞、cd4+t细胞或cd8+t细胞中表达的cd57多肽的水平或量。在一些任何此类实施方案中,所述性状是所述细胞群中存在的cd57+t细胞、cd57+cd4+t细胞或cd57+cd8+t细胞的频率、百分比或量。在一些任何此类实施方案中,所述性状是所述细胞群中的t细胞中存在的cd57mrna的水平或量。在一些任何此类实施方案中,所述性状是编码cd57的基因(b3gat1)的染色质可及性的水平或量。
在一些任何此类实施方案中,其中所述方法还包括测量t细胞群中与一种或多种第二基因产物的表达相关的第二性状的第二值,其中如果所述性状的值少于为或约所述性状的阈值并且如果所述第二性状的第二值大于为或约所述第二性状的第二阈值,则所述群体能够扩增。
在一些任何此类实施方案中,所述第二基因产物是与幼稚样t细胞相关的标记。在一些任何此类实施方案中,所述一种或多种第二基因产物选自cd27、cd28、ccr7或cd45ra。在一些任何此类实施方案中,所述一种或多种第二基因产物是cd27和cd28。
在一些任何此类实施方案中,第二阈值:i)高于多个第二参考t细胞组合物中与第二基因的表达相关的性状的平均或中位测量值25%、20%、15%、10%或5%,约25%、20%、15%、10%或5%,或25%内、20%内、15%内、10%内或5%内,和/或比为或约所述平均或中位测量值大高于一个标准差;ii)高于来自多个参考t细胞组合物的组合物中与第二基因的表达相关的第二性状的最高测量值,任选地高于所述最高测量值50%内、25%内、20%内、15%内、10%内或5%内;iii)低于从来自所述多个参考t细胞组合物的超过65%、75%、80%、85%的样品计算的与第二基因的表达相关的性状的平均或中位测量值。
在一些任何此类实施方案中,第二性状是:(i)由总t细胞、cd4+t细胞或cd8+t细胞中存在的第二基因编码的多肽的水平或量;(ii)是由总t细胞、cd4+t细胞或cd8+t细胞的表面上存在的第二基因编码的多肽的水平或量;(iii)是如下性状:其是对第二基因的表达呈阳性的t细胞、cd4+t细胞或cd8+t细胞的频率、百分比或量;(iv)是t细胞中存在的第二基因的mrna的水平或量;或者(v)是第二基因的可及性的水平或量。
还提供基因工程化t细胞的方法,所述方法包括:(a)在刺激条件下孵育来自通过本文所述任何方法鉴定或确定的t细胞群的t细胞,所述刺激条件包括能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域的刺激试剂的存在,从而生成刺激的t细胞;以及(b)将异源多核苷酸引入所述刺激的t细胞中,所述引入包括用包括编码重组受体的异源多核苷酸的病毒载体转导所述刺激的t细胞,从而生成t细胞的工程化的群体。
本文还提供细胞组合物,其包括通过本文所述方法产生的那些组合物中的任一种。本文还提供细胞组合物,其包括cd57-cd4+细胞。本文还提供细胞组合物,其包括cd57-cd8+细胞。本文还提供细胞组合物,其包括cd57-cd3+细胞。
还提供细胞组合物,其包括通过本文所述的任何方法产生的缺失的群体的cd57-t细胞。
还提供富集的cd57-cd4+t细胞的组合物,其包括通过本文所述的任何方法产生的cd57-cd4+t细胞的富集的群体的cd57-cd4+t细胞。
还提供富集的cd57-cd8+t细胞的组合物,其包括通过本文所述的任何方法产生的cd57-cd8+t细胞的富集的群体的cd57-cd8+t细胞。
还提供富集的cd57-cd3+t细胞的组合物,其包括通过本文所述的任何方法产生的cd57-cd3+t细胞的富集的群体的cd57-cd3+t细胞。
还提供细胞组合物,其包括通过本文所述的任何方法产生的t细胞的刺激的群体的群体。
还提供组合物,其包括通过本文所述的任何方法产生的t细胞的工程化的群体的细胞。
还提供组合物,其包括通过本文所述的任何方法产生的t细胞的扩增的群体的细胞。
还提供组合物,其包括通过本文所述任何方法鉴定或确定为能够扩增的t细胞群。
还提供治疗患有或怀疑患有疾病、障碍或病症的受试者的方法,所述方法包括向所述受试者施用一定剂量的t细胞,所述t细胞来自通过本文所述的任何方法产生的工程化t细胞群或通过本文所述的任何方法产生的t细胞的扩增的群体。
还提供通过本文所述的任何方法产生的工程化t细胞群或通过本文所述的任何方法产生的t细胞的扩增的群体用于治疗受试者的疾病、障碍或病症的用途。
还提供通过本文所述的任何方法产生的工程化t细胞群或通过本文所述的任何方法产生的t细胞的扩增的群体用于制造用于治疗受试者的疾病、障碍或病症的药物的用途。
还提供制品,其包括(i)对cd57、cd4和/或cd8具有特异性的用于细胞的基于免疫亲和力的选择的一种或多种试剂;以及(ii)所述一种或多种试剂用于进行本文所述的任何方法的使用说明。
还提供制品,其包括:(i)对cd57、cd4和/或cd8具有特异性的用于细胞的基于免疫亲和力的选择的一种或多种试剂;(ii)能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域的一种或多种刺激试剂;以及(iii)所述一种或多种试剂用于进行本文所述的任何方法的使用说明。
在一些任何此类实施方案中,用于基于免疫亲和力的选择的所述试剂是或包括能够与cd57、cd4或cd8特异性结合的抗体。在一些任何此类实施方案中,用于基于免疫亲和力的选择的所述试剂是或包括能够与cd57特异性结合的抗体。在一些任何此类实施方案中,将所述抗体固定在磁粒上或者固定在亲和色谱基质上或附着至亲和色谱基质。
在一些任何此类实施方案中,所述刺激试剂包括(i)一级药剂,所述一级药剂与tcr复合物的成员特异性结合,任选地与cd3特异性结合,以及(ii)二级药剂,所述二级药剂与t细胞共刺激分子特异性结合,任选地其中所述共刺激分子选自cd28、cd137(4-1-bb)、ox40或icos。在一些任何此类实施方案中,所述一级和二级药剂中的一种或两种包括抗体或其抗原结合片段。在一些任何此类实施方案中,所述一级和二级药剂包括抗体,任选地其中所述刺激试剂包括与抗cd3抗体和抗cd28抗体或其抗原结合片段一起孵育。在一些任何此类实施方案中,所述一级药剂和二级药剂存在于或附着在固体支持物的表面上。在一些任何此类实施方案中,所述固体支持物是或包括珠,任选地顺磁珠。在一些任何此类实施方案中,所述一级药剂和二级药剂可逆地结合在包括多个链霉亲和素或链霉亲和素突变蛋白分子的寡聚颗粒试剂的表面上。
还提供制品,其包括(i)本文所述的任何组合物;以及(ii)用于将所述组合物施用至受试者的说明书。
本文还提供治疗性t细胞组合物,其包括表达重组受体的cd4+t细胞和表达重组受体的cd8+t细胞,其中所述组合物中至少80%的总受体+/cd8+细胞是cd57-,并且所述组合物中至少80%的总受体+/cd4+细胞是cd57-。
在一些任何此类实施方案中,所述组合物中至少或至少约80%、至少或至少约85%、至少或至少约90%、至少或至少约95%、至少或至少约96%、至少或至少约97%、至少或至少约98%、至少或至少约99%、约100%或100%的细胞是cd4+t细胞和cd8+t细胞。在一些任何此类实施方案中,所述组合物中至少80%的总受体+/cd3+细胞是cd57-。在一些任何此类实施方案中,所述组合物中至少或至少约80%、至少或至少约85%、至少或至少约90%、至少或至少约95%、至少或至少约96%、至少或至少约97%、至少或至少约98%、至少或至少约99%、约100%或100%的细胞是cd3+t细胞。在一些任何此类实施方案中,所述组合物中受体+/cd4+t细胞与受体+/cd8+t细胞的比率在约1:3与约3:1之间。在一些任何此类实施方案中,所述组合物中受体+/cd4+t细胞与受体+/cd8+t细胞的比率是为或约1:1。
在一些任何此类实施方案中,所述重组蛋白是或含有能够与靶蛋白结合的重组受体,所述靶蛋白与疾病、障碍或病症相关,为疾病、障碍或病症所特有,和/或在疾病、障碍或病症的细胞或组织上表达。在一些任何此类实施方案中,所述重组蛋白是嵌合抗原受体(car)。在一些任何此类实施方案中,所述组合物中活t细胞的数量在为或约10x106个细胞与为或约200x106个细胞之间,任选地其中所述组合物中活t细胞的数量在为或约10x106个细胞与为或约100x106个细胞之间、为或约10x106个细胞与为或约70x106个细胞之间、为或约10x106个细胞与为或约50x106个细胞之间、为或约50x106个细胞与为或约200x106个细胞之间、为或约50x106个细胞与为或约100x106个细胞之间、为或约50x106个细胞与为或约70x106个细胞之间、为或约70x106个细胞与为或约200x106个细胞之间、为或约70x106个细胞与为或约100x106个细胞之间或者为或约100x106个细胞与为或约200x106个细胞之间,每个都包含端值。在一些任何此类实施方案中,所述组合物的体积在1.0ml与10ml之间,包含端值,任选地为或约2ml、为或约3ml、为或约4ml、为或约5ml、为或约6ml、为或约7ml、为或约8ml、为或约9ml或者为或约10ml,或任何前述值之间的任何值。
附图说明
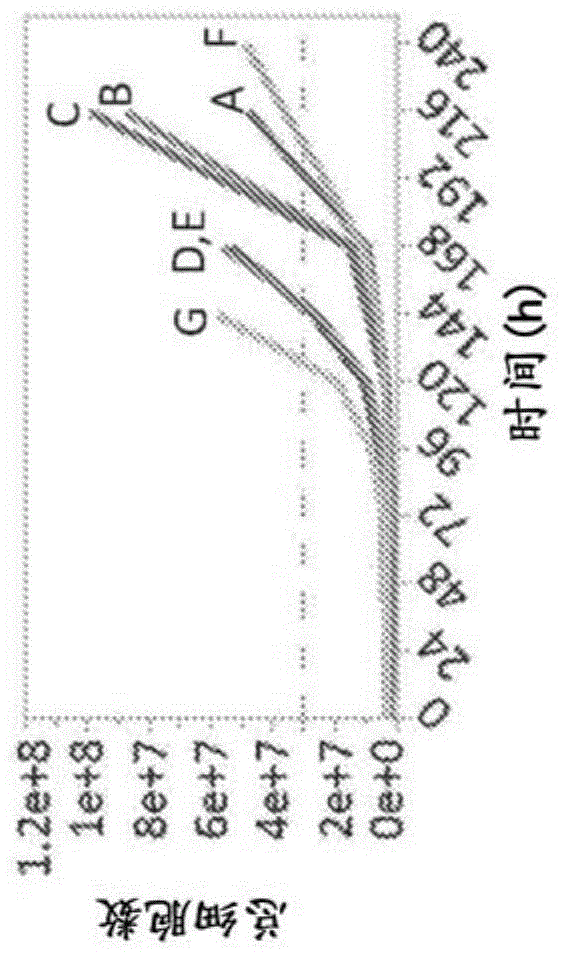
图1a-图1d显示在用于原代人t细胞的示例性制造过程或不进行细胞转导的类似过程中,在开始刺激后大约240小时中,从七个不同供体(供体a-g)获得的cd8+t细胞之间的总细胞数(图1a)、倍数扩增(图1b)、活力百分比(图1c)和ki-67+细胞的百分比(与细胞周期进入相关的标记;图1d)。
图2a显示在用于原代人t细胞的示例性过程中,在开始刺激后大约216小时中的各个时间点,对cd57和ki-67表达的流式细胞术分析。图2b显示在三个不同供体(供体a-c)中,在刺激和培育期间,细胞群中cd57+细胞的百分比。图2c显示在刺激和培育期间,细胞群中cd57+细胞或cd57-细胞之间ki-67+细胞的百分比。图2d显示在三个不同供体(供体a-c)中,在刺激和培育期间,cd4+细胞群中cd57+细胞的百分比。图2e显示在刺激后随时间而变的来自供体细胞组合物的细胞上的cd57和ki67表达。一种供体细胞组合物的细胞需要8天来达到收获标准(“8d至收获”),而另一种供体细胞组合物的细胞仅需要7天来达到收获标准(“7d至收获”)。图2f显示来自图2e中所述的供体细胞组合物的细胞上的cd45ra和cd27表达。
图3a显示在用于原代人t细胞的示例性过程中,在刺激和培育期间,在细胞群中的cd57+细胞和cd57-细胞之间,对cd69和cd25表达(与激活相关的标记)的流式细胞术分析。图3b和图3c显示对与t细胞分化表型(例如,幼稚样t细胞、效应t(teff)细胞、记忆t细胞、中枢记忆t细胞(tcm)、效应记忆t(tem)细胞、效应记忆rat(temra)细胞)相关的各种表面标记的表达以及cd57(图3b)或ki-67(图3c)的表达的层次聚类分析。每行表示来自单独供体的细胞群,列表示与t细胞分化表型相关的标记或标记的组合。
图4a显示在示例性制造过程中,在开始刺激后大约240小时中,对于按以下频率含有cd57+与cd57-细胞的混合物的滴定的细胞组合物,总细胞的数量和活细胞的百分比:(1)100%cd57+细胞;(2)75%cd57+细胞;(3)25%cd57+细胞;以及(4)0%cd57+细胞。指示示例性收获标准。图4b显示在滴定的细胞组合物的刺激和培育中,在开始刺激后48小时的细胞培养孔的图像,其显示在刺激试剂存在下的细胞聚簇。图4c显示在滴定的细胞组合物的刺激和培育中,在开始刺激后12和48小时,培养基中存在的il-2的量(μg/ml)。
图5a和图5b显示cd57+t细胞(图5a)、cd27+cd28+t细胞(图5b)的百分比。图5c显示未耗尽cd57+细胞的(未耗尽的)或耗尽cd57+细胞的(耗尽的)四种供体细胞组合物中cd27的表达。图5d显示耗尽的和未耗尽的cd3+细胞组合物中的ki67表达。图5e显示对于从耗尽cd57+细胞的(耗尽的)或未耗尽cd57+细胞的(未耗尽的)的受试者获得的原代cd8+细胞,培育至收获(从开始刺激至达到收获标准的时间)的持续时间。图5f显示在刺激后,耗尽的和未耗尽的细胞组合物中随时间而变的t细胞的总数量。图5g显示在转导后,耗尽的和未耗尽的细胞组合物中表达嵌合抗原受体(car)的细胞的百分比。
图6a显示须状图,其指示对于使用示例性制造过程来工程化细胞以表达嵌合抗原受体(car),从非霍奇金淋巴瘤(nhl)患者获得的cd4+和cd8+t细胞中cd57+t细胞的百分比。箱表示四分位距,并且须表示数据集的全范围。图6b显示在从nhl患者获得的各种细胞群中,cd57+cd8+细胞的百分比与ki-67+细胞的百分比之间的关系。图6c显示对与t细胞分化表型(例如,幼稚样t细胞、效应t(teff)细胞、记忆t细胞、中枢记忆t细胞(tcm)、终末效应细胞)相关的各种表面标记的表达以及从nhl患者获得的细胞群中cd57的表达的层次聚类分析。每行表示单独患者,列表示与t细胞分化表型相关的标记或标记的组合。图6d显示在按cd27和cd45ra表达状态分组的细胞群的子集中,表达ki67的活cd57+细胞的百分比。图6e显示在按cd27和cd45ra表达分选的细胞群的子集中,活cd8+cd57+细胞的百分比(上图),以及在按cd27和cd45ra表达分选的细胞群的子集中,活cd4+cd57+细胞的百分比(下图)。
图7显示治疗性输出t细胞组合物(例如,药物产品)中的中枢记忆/幼稚样cd4+t细胞的百分比与实现收获标准的群体倍增数之间的关系(spearmanρ:-0.54;p值:<0.001)。对于治疗性输出t细胞组合物(例如,药物产品)中的cd8+t细胞,观察到类似结果。
图8a显示在产生过程的扩增步骤期间,对于高(0.35x10^6个细胞/ml)和低(0.05x10^6个细胞/ml)接种密度,达到收获标准的群体倍增数。图8b显示在产生过程的扩增步骤期间,随接种密度而变的输出治疗组合物中cd27+car+cd8+t细胞的百分比。图8c显示处理持续时间对输出t细胞组合物中的中枢记忆t细胞的量的影响。
图9a-图9d显示被施用car+t细胞组合物的受试者的卡普兰-迈耶(kaplan-meier)存活曲线,将所述受试者分为被施用含有在cd4+car+t细胞中(图9a关于无进展存活期,图9c关于反应持续时间)和在cd8+car+t细胞中(图9b关于无进展存活期,图9d关于反应持续时间)百分比高于或低于某个阈值水平的ccr7+cd27+car+t细胞的组合物的组。
图10显示对于具有cd8+/car+t细胞的“高”或“低”群体倍增(pdl)数的患者,基于最佳分割对数秩检验的pfs曲线。低pdl是指<6pdl,并且>6pdl是指高pdl。
图11显示源自非霍奇金淋巴瘤患者的富集的cd4+(左图)和cd8+(右图)输入组合物中cd27+cd28+t细胞的百分比。
图12显示富集的cd4+输入组合物中效应记忆t细胞的百分比与实现收获标准所需的群体倍增数之间的关系(spearmanρ:0.43;p值:<0.001)。对于富集的cd8+输入组合物,观察到类似结果。
图13a-图13d显示在包括多个非扩增和扩增的工程化过程的制造运行期间和之后,总活细胞(图13a)、活力(图13b)和表型(图13c和图13d)。
图14显示在包括多个非扩增和扩增的工程化过程的制造运行期间和之后,cd4+和cd8+细胞群中cd57+细胞的百分比。
具体实施方式
本文提供尤其用于选择、分离、富集、刺激、激活、基因工程化或扩增如与起始细胞材料或生物样品相比具有降低频率的cd57+t细胞的细胞样品、群体或组合物的方法和组合物。在一些方面,本文提供一种富集t细胞的方法,所述方法是或包括从生物样品选择、分离或去除cd57+t细胞,如以生成富集的cd57-t细胞的群体或耗尽cd57+细胞的群体。在一些方面,本文提供一种富集t细胞的方法,所述方法是或包括从生物样品选择、分离或去除cd57+t细胞,如以生成富集的cd57-t细胞的群体或耗尽cd57+t细胞的群体。
在一些方面,本文提供一种通过在刺激条件下孵育群体的细胞来刺激cd57-t细胞群的方法。本文还提供一种通过将异源多肽引入细胞中来基因工程化t细胞的方法,所述细胞如富集的cd57-t细胞的群体的细胞或源自所述群体的细胞。
特定实施方案考虑,用于生成工程化t细胞(例如,表达嵌合抗原受体(car)的工程化t细胞)的现有方法可以包括其中t细胞的群体或组合物增殖或扩增的步骤、阶段或时期。然而,在一些情况下,一部分群体或组合物可能不展示任何增殖或扩增,或者在一些情况下,可能缓慢扩增,因此需要额外的时间来完成工程化过程。
在一些方面,用于生成或制造工程化细胞组合物的现有方法或过程可以导致制造过程中的异质性。在一些方面,与记忆t细胞相关的表型可能影响临床结果(参见例如,fraietta等人,natmed.2018;24(5):563-571;以及larson等人,cancerres.2018;78(13增刊):abstractnr960)。在一些情况下,展现早期记忆t细胞表型的细胞的富集可以改进工程化细胞组合物的制造(参见例如,singh等人,scitransmed.2016;8(320):320ra3)。
所提供的方法和组合物解决了这些问题。所提供的方法和组合物至少部分涉及经历改进的或更快的增殖和扩增的细胞群(例如,富集的cd57-t细胞的群体),如在用于刺激或工程化t细胞的过程期间。cd57(其也被称为hnk1和leu7)是β-1,3-葡糖醛酸内酯转移酶,它可以在t和nk淋巴细胞的表面上表达。在一些方面,cd57表达(例如,表面表达)与t和nk细胞的成熟的效应子分化的亚群相关。在一些方面,cd57表达对应于缺少共刺激受体cd28和cd27的表达的t细胞或t细胞群,在某些方面,所述共刺激受体cd28和cd27的表达的缺少可能影响持续增殖和细胞存活。在特定方面,cd57表达也可以鉴定具有较低或降低的增殖能力的细胞。在一些方面,如与cd57-细胞群相比,cd57+cd28-细胞群可以显示缩短的端粒长度和降低的增殖能力(综述于strioga、pasukoniene和characiejus,immunol.(2011)中)。
特定实施方案考虑,从用于基因工程化过程中的起始细胞材料降低cd57+t细胞的频率将富集具有更强增殖能力的细胞。在一些方面,cd57+t细胞的阴性选择通过预富集更好地准备扩增的细胞来提高制造成功率和药物产品一致性。另外,在一些实施方案中,富集具有展现增加的增殖能力的细胞的细胞群体或组合物可以降低效应细胞分化的程度,这应该有助于改进自体环境中受试者之间或同种异体环境(cd27+、ccr7+t细胞)中批次之间的目标产物谱一致性。
在一些实施方案中,所述方法与以可能比替代性过程更快且更有效的方式生成或产生适合于细胞疗法的基因工程化细胞的过程结合使用。在某些实施方案中,与替代性过程可能实现的相比,本文提供的方法具有从更广泛的受试者群体生成或产生工程化细胞组合物的高成功率。因此,在一些方面,与一些替代性方法可能实现的相比,所提供方法生成用于细胞疗法的工程化细胞的速度和效率允许针对更广泛的受试者群体更容易地计划和协调细胞疗法治疗,如自体疗法。在一些方面,考虑到耗尽cd57+细胞(例如cd57+t细胞)是有利的,如因为改进下游过程中细胞群的一致性。例如,在本文中观察到,耗尽cd57+细胞可以耗尽具有较低或降低的增殖能力的细胞,使得耗尽的组合物展现改进的细胞增殖速率的一致性。相关地,改进细胞增殖速率的一致性可以改进细胞群达到收获标准所需持续时间的一致性。在本文中另外观察到,在用编码嵌合抗原受体(car)的载体转导细胞群之前耗尽cd57+细胞可以改进所转导细胞的car表达的一致性。
在一些方面,预选择具有改进的增殖能力的进入的供体细胞(例如,通过去除cd57+t细胞或针对少量cd57+t细胞进行筛选)可以提供改进的对用于生成细胞疗法的过程中的细胞数量的过程控制。在某些实施方案中,cd57的表达可以用作指示展现延迟或较差生长的细胞的生物标记。因此,一些所提供的实施方案涉及在用于刺激、基因工程化或扩增细胞的过程之前利用一种或多种选择试剂或过程步骤选择性去除cd57+细胞的方法。在一些方面,此类试剂和过程步骤可以与cd8+和cd4+选择策略结合使用。例如,在一些实施方案中,在用于cd8+或cd4+选择的任何步骤之前,利用cd57+细胞的选择从细胞的样品、组合物或群体去除或耗尽cd57+细胞。例如,在一些实施方案中,在用于cd8+或cd4+选择的任何步骤之前,利用cd57+t细胞的选择从细胞的样品、组合物或群体去除或耗尽cd57+t细胞,从而生成cd57-耗尽群体。在一些方面,可能有利的是通过阴性选择(与阳性选择相反)耗尽cd57+细胞,如在用于cd8+或cd4+选择的任何步骤之前。在一些方面,如在用于cd8+或cd4+选择的任何步骤之前通过阴性选择耗尽cd57+细胞减小cd57-耗尽的群体被用于cd57选择步骤中的一种或多种试剂或溶液污染的可能性。
在一些实施方案中,在用于cd8+或cd4+选择的任何步骤之后,利用cd57+t细胞的选择从细胞的样品、组合物或群体去除或耗尽cd57+t细胞。在一些方面,此类试剂和过程步骤可以与cd3+选择策略结合使用。例如,在一些实施方案中,在用于cd3+选择的任何步骤之前,利用cd57+t细胞的选择从细胞的样品、组合物或群体去除或耗尽cd57+t细胞。在一些实施方案中,在用于cd3+选择的任何步骤之后,利用cd57+t细胞的选择从细胞的样品、组合物或群体去除或耗尽cd57+t细胞。在一些实施方案中,如在柱中用结合cd57+细胞的cd57定向磁珠选择或去除cd57+细胞,然后柱流出物(未结合级分)会含有cd57+耗尽的细胞来源,例如,富集cd57-t细胞的细胞群。在一些实施方案中,如在柱中用结合cd57+t细胞的cd57定向磁珠选择或去除cd57+t细胞,然后柱流出物(未结合级分)会含有cd57+耗尽的细胞源,例如,富集cd57-t细胞的细胞群。
特定实施方案考虑,一些现有的离体t细胞激活或扩增方案可能在一定时间后(如在所述过程的前48小时后)减少cd57+t细胞的存在,因为cd57+t细胞不太可能增殖。在一些方面,cd57+细胞(例如cd57+t细胞)在此类过程期间死亡,或者其频率被能够稳健扩增的细胞子集减小。然而,尽管在此类过程期间可能发生cd57+t细胞的自然减少,但是所述自然减少不控制展现高增殖能力的进入过程的细胞(例如,cd57-细胞)的量。因此,在一些方面,因为cd57+细胞(例如cd57+t细胞)是活的但增殖性较低的细胞,它们对过程的总体起始细胞数输入有贡献。因此,在一些实施方案中,在样品、组合物或群体中去除cd57+t细胞或验证低cd57+t细胞含量的优点确保,cd57-t细胞(例如,具有增殖能力的细胞)不构成进入的材料中的少数群体。因此,在一些实施方案中,确保cd57+t细胞的低频率或增殖细胞的降低分数可以降低在工程化过程期间与延长的过程时间,增加的细胞分化和/或不符合收获标准相关的发生率。
在一些方面,所提供的实施方案是基于如下观察:在用于工程化细胞的过程(如用于生成含有用于细胞疗法的重组受体表达t细胞的组合物的制造过程)期间,许多细胞在刺激(如在抗cd3/抗cd8抗体的存在下孵育细胞)后表达或上调与t细胞的刺激或激活相关的标记,包括cd25和cd69。在一些方面,仅观察到细胞子集进入细胞周期,如基于ki-67的表达所示。在一些情况下,ki-67+细胞主要包括表达cd27和cd28的细胞,而观察到ki67-群体富集cd57+细胞并展现cd27-cd28-表型。在一些方面,在本文中观察到cd57+细胞展现与刺激或激活相关的表型,并且在制造过程的整个早期阶段中持续存在。在一些方面,在刺激后大约48小时后,cd57+t细胞的频率降低,这通常与t细胞扩增和增加的活力一致。在一些方面,尽管持续使用生长因子和/或激活试剂,但细胞的特定类型(如cd57+细胞,例如cd57+t细胞)在刺激或培育期间展现低或无扩增,从而导致过程和产物异质性。
在一些方面,观察到,当在刺激前选择cd57+细胞(例如cd57+t细胞)并与cd57-细胞(例如cd57+t细胞)以不同比率组合时,刺激前细胞组合物(例如,输入组合物)中cd57+细胞的频率与更长过程持续时间相关。在一些方面,还观察到,在细胞组合物(如含有car+t细胞的组合物)中95%或更多(如100%)的t细胞是cd57+t细胞时,所述组合物没有扩增或增殖。
在一些方面,尽管cd27+t细胞可以在用于生成工程化t细胞的制造过程期间促进扩增细胞,但是cd57+细胞(例如,cd57+t细胞)通常不扩增,并且观察到其对工程化细胞组合物(例如,用于施用的细胞组合物)中的细胞仅有最低程度的贡献。因此,cd57+t细胞的百分比可以影响制造过程,并且还观察到其促进过程(例如,在用于扩增的培育期间)和其他细胞组合物属性的变异性。在一些方面,如本文所提供,在制造过程开始时(例如,在刺激细胞前)选择性耗尽cd57+t细胞可以改进工程化细胞组合物的一致性、质量和效力。
因此,在一些实施方案中,所提供的方法可以缩短用于生成细胞疗法的过程持续时间,并且因此,在某些方面,改进制造时间表的一致性。此外,在一些方面,与一些替代性方法可能实现的相比,用于生成用于细胞疗法的工程化细胞的所提供方法的速度和效率允许针对更广泛的受试者群体更容易地计划和协调细胞疗法治疗,如自体疗法。
在某些实施方案中,在生成用于细胞疗法的细胞(例如,工程化t细胞的群体或组合物)的过程起始时,所提供的方法成功去除至少一部分非增殖细胞。在一些方面,这是通过以下方式来实现的:在起始前或在此类过程之前选出cd57+细胞(例如cd57+t细胞),或者通过筛选以确保仅将具有无或低cd57+t细胞含量的细胞组合物或群体用于此类过程,改进所述过程的成功率(例如,成功生成适用于细胞疗法中的细胞群的速率或频率)。在一些实施方案中,所提供的方法缩短得到用作细胞疗法的t细胞的必需数量所需的持续时间和细胞倍增数(例如,在增殖、培育或扩增至收获期间)。因此,不希望受理论限制,一些实施方案考虑,所提供的方法增加或验证足够数量的展现改进增殖能力的进入的供体细胞。
在一些实施方案中,从富集的cd57-t细胞的群体生成的细胞疗法含有的t细胞的分化程度低于从替代性过程生成的细胞疗法。在某些实施方案中,细胞疗法的降低的细胞分化改进通过所提供过程生成的细胞疗法之间的一致性(例如,如与替代性过程(例如,从含有可变量的cd57+t细胞的细胞群生成的细胞疗法)相比)。在某些实施方案中,细胞疗法的降低的细胞分化改进细胞疗法的产物质量概况。
特定方面考虑,除了t细胞外,nk和nkt细胞也表达cd57,它们都可能存在于生物样品(例如,白细胞单采术材料)中。因此,在一些实施方案中,对cd57+细胞(例如cd57+t细胞)的阴性选择减少残留的非t细胞并提高t细胞纯度。因此,所提供的方法增加如通过刺激、转导或扩增处理的t细胞群的纯度,以及所得细胞疗法的t细胞纯度。
本申请中提及的所有出版物(包括专利文献、科学文章和数据库)出于所有目的通过引用以其整体并入,其并入程度如同将每个单独出版物通过引用单独并入一般。如果本文所述的定义与通过引用并入本文的专利、申请、公开的申请和其他出版物中所述的定义相反或在其他方面不一致,则本文所述的定义优先于通过引用并入本文的定义。
本文使用的章节标题仅用于组织目的,而不应解释为限制所描述的主题。
i.富集的cd57-t细胞的群体
在某些实施方案中,本文提供富集的cd57-t细胞的群体(本文也称为cd57-t细胞群、富集的cd57-t细胞的组合物或cd57-t细胞组合物)。在某些实施方案中,所提供的富集的cd57-t细胞的群体是与用于刺激、激活、工程化、转导、培育或扩增t细胞(例如,富集的cd57-t细胞的群体的t细胞或源自所述群体的t细胞)的方法结合使用。在一些实施方案中,富集的cd57-t细胞的群体得自例如生物样品(如含有一种或多种免疫细胞的生物样品)的分离、选择或富集,或者是所述过程的产物。在某些实施方案中,富集的cd57-t细胞的群体是或包括活t细胞、cd3+t细胞、cd4+t细胞和/或cd8+t细胞。在特定实施方案中,富集的cd57-t细胞的群体的细胞是或包括活t细胞、cd3+t细胞、cd4+t细胞和/或cd8+t细胞或前述任一种的组合。在各种实施方案中,富集的cd57-t细胞的群体的细胞是或包括活的cd57-t细胞、cd57-cd3+t细胞、cd57-cd4+t细胞、cd57-cd8+t细胞或前述任一种的组合。
特定实施方案考虑,可以通过任何合适的已知手段来测量含有细胞的样品、群体或组合物中cd57表达的量(例如,cd57+t细胞的量)。在一些实施方案中,在样品、群体或组合物中测量cd57表达,以测量、评估或确定所述样品、群体或组合物中cd57+细胞(例如,cd57+t细胞)的量、频率或百分比。在某些实施方案中,在样品、群体或组合物中测量cd57表达,以测量、评估或确定所述样品、群体或组合物中cd57+细胞(例如,cd57+t细胞)的量、频率或百分比。
在一些实施方案中,具有更高cd57+细胞百分比的细胞组合物可以得到更低的能够增殖性扩增的细胞的百分比。在一些情况下,具有高cd57+细胞百分比的工程化细胞组合物与降低的增殖能力相关,并且可能在用于产生用于细胞疗法工程化t细胞组合物的制造过程中导致延长的过程时间、实现阈值细胞数量的更高倍增、增加的细胞分化和/或不符合收获标准。
在一些方面,还提供鉴定能够扩增的细胞群的方法,所述方法包括测量所述群体中cd57+细胞的频率,其中如果cd57+细胞的频率低于阈值频率,则将所述细胞群鉴定为能够扩增。在一些任何此类实施方案中,所述阈值频率是少于为或约35%、30%、20%、10%、5%、1%或0.1%的百分比。在一些任何此类实施方案中,在促进增殖或扩增的条件下培育的4、5、6、7或8天内,能够扩增的群体扩增至少为或约2倍、4倍、8倍或16倍。
在一些方面,还提供确定t细胞群的扩增能力的方法,所述方法包括测量t细胞群中与cd57表达相关的性状的值,其中如果所述性状的值少于为或约所述性状的阈值,则将所述t细胞群确定为能够扩增。
在一些实施方案中,所述阈值:i)低于多个参考t细胞群中与cd57表达相关的所述性状的平均或中位测量值25%、20%、15%、10%或5%,约25%、20%、15%、10%或5%,或25%内、20%内、15%内、10%内或5%内,和/或比为或约所述平均或中位测量值小低于一个标准差;ii)低于来自多个参考t细胞群的群体中与cd57表达相关的所述性状的最低测量值,任选地低于所述最低测量值50%内、25%内、20%内、15%内、10%内或5%内;iii)低于从来自多个参考t细胞组合物的超过65%、75%、80%、85%的样品计算的与cd57表达相关的所述性状的平均或中位测量值;其中所述多个参考t细胞群是当在促进t细胞的增殖或扩增的条件下培育时未扩增的多个群体,任选地其中在培育的4、5、6、7或8天内,所述细胞未扩增至少为或约2倍、4倍、8倍或16倍。
在一些实施方案中,所述性状是在总t细胞、cd4+t细胞或cd8+t细胞中表达的cd57多肽的水平或量。在一些实施方案中,所述性状是所述细胞群中存在的cd57+t细胞、cd57+cd4+t细胞或cd57+cd8+t细胞的频率、百分比或量。在一些实施方案中,所述性状是在cd3+t细胞中表达的cd57多肽的水平或量。在一些实施方案中,所述性状是所述细胞群中存在的cd57+cd3+t细胞的频率、百分比或量。在一些实施方案中,所述性状是所述细胞群中的t细胞中存在的cd57mrna的水平或量。在一些实施方案中,所述性状是编码cd57的基因(b3gat1)的染色质可及性的水平或量。
在一些实施方案中,其中所述方法还包括测量t细胞群中与一种或多种第二基因产物的表达相关的第二性状的第二值,其中如果所述性状的值少于为或约所述性状的阈值并且如果所述第二性状的第二值大于为或约所述第二性状的第二阈值,则所述群体能够扩增。
在一些实施方案中,所述第二基因产物是与幼稚样t细胞相关的标记。在一些实施方案中,所述一种或多种第二基因产物选自cd27、cd28、ccr7或cd45ra。在一些实施方案中,所述一种或多种第二基因产物是cd27和cd28。
在某些实施方案中,阴性表达(例如,cd57的阴性表达或cd57-)是等于或低于背景表达水平的表达,例如,如使用标准技术(如涉及抗体染色的技术)所检测。在某些实施方案中,阴性表达等于或低于背景表达水平,如通过用于评估蛋白质或基因表达的合适技术所检测,所述技术例如但不限于基于免疫组织化学、免疫荧光或流式细胞术的技术。在一些实施方案中,例如特定蛋白质的阳性表达是或包括所述蛋白质以高于背景的量、水平或浓度的表面表达。在特定实施方案中,例如特定蛋白质的阴性表达是或包括所述蛋白质以等于或低于背景的量、水平或浓度的表面表达。
在某些实施方案中,本文提供的方法包括评估、测量、确定和/或定量样品、群体或组合物中一种或多种蛋白质或基因(例如,cd57)的表达的一个或多个步骤,如以对所述样品、组合物或群体中具有所述蛋白质或基因(例如,cd57)的阳性或阴性表达的细胞进行定量。此类步骤可以包括评估、测量、确定和/或定量与表达相关的任何合适的性状,如测量蛋白质、表面蛋白、mrna或基因可及性(例如,表观遗传基因可及性)的水平。
在一些实施方案中,蛋白质(例如,cd57)的表达是或包括评估、测量、确定和/或定量在细胞表面上表达的蛋白质或基因编码的蛋白质的水平、量或浓度。在特定实施方案中,蛋白质(例如,cd57)的表达是通过评估、测量、确定和/或定量蛋白质的表面表达(例如,细胞表面上蛋白质的水平、量或浓度)来评估。在特定实施方案中,对蛋白质的表面表达呈阳性的细胞(例如,具有表面上具有比用于测量表面蛋白的技术的背景信号更大的更大量、浓度或密度的蛋白质的表面的细胞)的量、频率或百分比。在特定实施方案中,蛋白质(例如,cd57)的表面表达是通过基于免疫组织化学、免疫荧光或流式细胞术的技术来测量。在一些实施方案中,对蛋白质的表面表达呈阳性的细胞的量、频率或百分比是通过合适的已知技术(如基于免疫组织化学、免疫荧光或流式细胞术的技术)来确定。
在特定实施方案中,样品、组合物或群体中对蛋白质表达(例如,表面表达)呈阴性或阳性的细胞的量、频率或百分比是通过流式细胞术来确定。在一些实施方案中,所述蛋白质是cd3、cd4、cd8、cd25、cd27、cd28、cd57、ccr7或cd45ra。在特定实施方案中,所述蛋白质是cd57。
在特定实施方案中,样品、群体或组合物中蛋白质(例如,cd57)的表达是或包括用于评估、测量、确定和/或定量蛋白质的水平、量或浓度的任何合适的方法。此类方法包括但不限于用以下进行检测:免疫测定、基于核酸或基于蛋白质的适体技术、hplc(高精度液相色谱)、肽测序(如edman降解测序或质谱(如ms/ms),任选地与hplc偶联)以及前述任一项的微阵列适应(包括核酸、抗体或蛋白质-蛋白质(即,非抗体)阵列)。在一些实施方案中,免疫测定是或包括基于免疫学反应来检测蛋白质的方法或测定,例如通过检测抗体或抗原结合抗体片段与基因产物的结合。免疫测定包括但不限于定量免疫细胞化学或免疫组织化学、elisa(包括直接、间接、夹心、竞争性、多重和便携式elisa(参见例如,美国专利号7,510,687))、蛋白质印迹(包括一维、两维或更高维印迹或其他色谱手段,任选地包括肽测序)、酶免疫测定(eia)、ria(放射性免疫测定)和spr(表面等离子体共振)。
在某些实施方案中,蛋白质或其相应基因的表达是通过测量编码蛋白质(例如,cd57)的mrna(或源自所述mrna的cdna产物)来测量、评估或定量。在特定实施方案中,mrna(或相应cdna)的量或水平是通过任何合适的手段(pcr)来评估、测量、确定和/或定量,所述pcr包括逆转录酶(rt)pcr、微滴数字pcr、实时和定量pcr方法(包括例如,
在一些实施方案中,蛋白质或其相应基因的表达是或包括蛋白质的表观遗传分析。在一些实施方案中,评估细胞群的基因可及性,例如,编码cd57的b3gat1的可及性。表观遗传分析可以通过任何合适的已知手段来进行,所述手段包括但不限于使用测序测定转座酶可及染色质(atac-seq)以检查染色质可及性。
在一些实施方案中,富集的cd57-细胞的群体含有、含有约或含有少于为或约25%、20%、15%、12%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.01%或0.001%cd57+t细胞。在某些实施方案中,富集的cd57-细胞的群体基本上不含cd57+细胞。在某些实施方案中,富集的cd57-细胞的群体基本上不含cd57+细胞。在特定实施方案中,富集的cd57-细胞的群体含有少于为或约20%cd57+细胞。在某些实施方案中,富集的cd57-细胞的群体含有少于为或约10%cd57+细胞。在一些实施方案中,富集的cd57-细胞的群体含有少于为或约5%cd57+细胞。在各种实施方案中,富集的cd57-细胞的群体含有少于为或约1%、0.1%或0.01%cd57+细胞。
在某些实施方案中,富集的cd57-细胞的群体含有、含有约或含有至少为或约60%、65%、70%、75%、80%、85%、90%、95%、97%、98%、99%、99.5%、99.9%、99.99%或100%或约100%cd57-t细胞。在某些实施方案中,富集的cd57-t细胞的群体含有至少为或约80%cd57-t细胞。在某些实施方案中,富集的cd57-t细胞的群体含有至少为或约95%cd57-t细胞。在各种实施方案中,富集的cd57-t细胞的群体含有至少为或约99%、99.9%或99.99%cd57-t细胞。在特定实施方案中,富集的cd57-t细胞的群体中所有或基本上所有细胞是cd57-t细胞。在一些实施方案中,富集的cd57-细胞的群体含有、含有约或含有至少为或约60%、65%、70%、75%、80%、85%、90%、95%、97%、98%、99%、99.5%、99.9%、99.99%或100%或约100%cd57-cd3+t细胞。在某些实施方案中,富集的cd57-t细胞的群体含有至少为或约80%cd57-cd3+t细胞。在某些实施方案中,富集的cd57-t细胞的群体含有至少为或约95%cd57-cd3+t细胞。在各种实施方案中,富集的cd57-t细胞的群体含有至少为或约99%、99.9%或99.99%cd57-cd3+t细胞。在特定实施方案中,富集的cd57-t细胞的群体中所有或基本上所有细胞是cd57-cd3+t细胞。
在特定实施方案中,富集的cd57-t细胞的群体的细胞是或包括活细胞。在一些实施方案中,细胞活力是用如下测定来评估:其可以包括但不限于染料摄取测定(例如,钙黄绿素am测定)、xtt细胞活力测定和染料排除测定(例如,锥虫蓝、伊红或丙啶染料排除测定)。在特定实施方案中,活细胞具有一种或多种细胞凋亡标记(例如,膜联蛋白v或活性半胱天冬酶3)的阴性表达。在一些实施方案中,活细胞对一种或多种细胞凋亡标记的表达呈阴性,所述细胞凋亡标记可以包括但不限于半胱天冬酶或活性半胱天冬酶,例如,半胱天冬酶2、半胱天冬酶3、半胱天冬酶6、半胱天冬酶7、半胱天冬酶8、半胱天冬酶9或半胱天冬酶10;bcl-2家族成员,例如,bax、bad和bid;膜联蛋白v;或tunel染色。在特定实施方案中,活细胞是活性半胱天冬酶3阴性的。在某些实施方案中,活细胞是膜联蛋白v阴性的。在某些实施方案中,富集的cd57-t细胞的群体中至少为或约60%、至少为或约65%、至少为或约70%、至少为或约75%、至少为或约80%、至少为或约85%、至少为或约90%、至少为或约95%、至少为或约97%、至少为或约99%、至少为或约99.5%、至少为或约99.9%或100%或约100%的细胞是活细胞。在一些实施方案中,活细胞是或包括活cd3+、活cd4+、活cd8+、活cd57-、活cd57-cd3+、活cd57-cd4+或活cd57-cd8+t细胞或前述任一种的组合。在一些实施方案中,活细胞是活性半胱天冬酶3阴性的。在特定实施方案中,活细胞是膜联蛋白v阴性的。
在某些实施方案中,富集的cd57-细胞的群体含有、含有约或含有至少为或约60%、65%、70%、75%、80%、85%、90%、95%、97%、98%、99%、99.5%、99.9%、99.99%或100%或约100%cd57-cd4+t细胞。在某些实施方案中,富集的cd57-t细胞的群体含有至少为或约80%cd57-cd4+t细胞。在某些实施方案中,富集的cd57-t细胞的群体含有至少为或约90%cd57-t细胞。在各种实施方案中,富集的cd57-t细胞的群体含有至少为或约95%cd57-cd4+t细胞。在特定实施方案中,富集的cd57-t细胞的群体中所有或基本上所有细胞是cd57-cd4+t细胞。在一些实施方案中,富集的cd57-细胞的群体含有、含有约或含有至少为或约60%、65%、70%、75%、80%、85%、90%、95%、97%、98%、99%、99.5%、99.9%、99.99%或100%或约100%cd57-cd8+t细胞。在某些实施方案中,富集的cd57-t细胞的群体含有至少为或约80%cd57-cd8+t细胞。在某些实施方案中,富集的cd57-t细胞的群体含有至少为或约90%cd57-cd8+t细胞。在各种实施方案中,富集的cd57-t细胞的群体含有至少为或约95%cd57-cd8+t细胞。在特定实施方案中,富集的cd57-t细胞的群体中所有或基本上所有细胞是cd57-cd8+t细胞。在一些实施方案中,富集的cd57-细胞的群体含有、含有约或含有至少为或约60%、65%、70%、75%、80%、85%、90%、95%、97%、98%、99%、99.5%、99.9%、99.99%或100%或约100%cd57-cd3+t细胞。在某些实施方案中,富集的cd57-t细胞的群体含有至少为或约80%cd57-cd3+t细胞。在某些实施方案中,富集的cd57-t细胞的群体含有至少为或约90%cd57-cd3+t细胞。在各种实施方案中,富集的cd57-t细胞的群体含有至少为或约95%cd57-cd3+t细胞。在特定实施方案中,富集的cd57-t细胞的群体中所有或基本上所有细胞是cd57-cd3+t细胞。
在特定实施方案中,富集的cd57-细胞的群体中一定频率的细胞是幼稚样细胞。在一些实施方案中,幼稚样t细胞是对于一种或多种标记的表达呈阳性的t细胞,所述标记指示细胞是幼稚细胞和/或是幼稚样细胞。在某些实施方案中,幼稚样t细胞是对于标记的表达呈阳性的细胞,所述标记与t细胞中的幼稚状态或幼稚样状态相关。在特定实施方案中,幼稚样t细胞是对于一种或多种标记的表达呈阴性的t细胞,所述标记指示细胞不是幼稚细胞和/或不是幼稚样细胞。在某些实施方案中,t细胞中的非幼稚状态或非幼稚样状态包括例如但不限于效应t(teff)细胞、记忆t细胞、中枢记忆t细胞(tcm)、效应记忆t(tem)细胞及其组合。
在一些实施方案中,幼稚样t细胞对至少一种或多种标记的表达呈阳性,所述标记表明所述细胞是幼稚细胞和/或是幼稚样细胞,和/或与t细胞中的幼稚或幼稚样状态相关。在一些实施方案中,所述标记是在细胞表面上表达。在某些实施方案中,幼稚样t细胞对至少一种或多种标记的表达呈阴性,所述标记表明所述细胞是非幼稚细胞和/或是非幼稚样细胞,和/或与t细胞中的非幼稚或非幼稚样状态相关。
指示t细胞是幼稚细胞和/或是幼稚样t细胞、和/或与t细胞中的幼稚或幼稚样状态相关的标记包括但不限于cd27、cd28、cd45ra、cd62l和/或ccr7。在一些实施方案中,幼稚样t细胞(例如,幼稚样cd4+和/或cd8+t细胞)对cd27、cd28、cd45ra和/或ccr7的表达呈阳性。在某些实施方案中,幼稚样t细胞对cd27、cd28、cd45ra和/或ccr7中的一种或多种的表面表达呈阳性。在一些实施方案中,幼稚样t细胞(例如,幼稚样cd4+和/或cd8+t细胞)对cd62l的表达呈阴性。在一些实施方案中,幼稚样t细胞(例如,幼稚样cd3+t细胞)对cd62l的表达呈阴性。在一些实施方案中,幼稚样t细胞(例如,幼稚样cd3+、cd4+和/或cd8+t细胞)对cd62l的表达呈阴性。
指示细胞是非幼稚t细胞和/或是非幼稚样t细胞、和/或与t细胞中的非幼稚或非幼稚样状态相关的标记包括但不限于cd25、cd45ro、cd56、klrg1和/或cd95。在一些实施方案中,幼稚样t细胞(例如,幼稚样cd4+和/或cd8+t细胞)对cd25、cd45ro、cd56和/或klrg1的表达呈阴性。在特定实施方案中,幼稚样t细胞(例如,幼稚样cd4+和/或cd8+t细胞)具有与非幼稚细胞或非幼稚样细胞相关的标记的低表达。在一些实施方案中,幼稚样t细胞(例如,幼稚样cd3+t细胞)对cd25、cd45ro、cd56和/或klrg1的表达呈阴性。在特定实施方案中,幼稚样t细胞(例如,幼稚样cd3+t细胞)具有与非幼稚细胞或非幼稚样细胞相关的标记的低表达。在特定实施方案中,幼稚样t细胞具有cd95的低表达。在某些实施方案中,幼稚样t细胞对cd25、cd45ro、cd56和/或klrg1中的一种或多种的表面表达呈阴性。
在一些实施方案中,与非幼稚细胞或非幼稚样细胞相关的标记的低表达是或包括比所述标记在如下细胞中的表达低至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%或至少99%的表达:所述细胞是非幼稚样细胞,和/或所述细胞对一种或多种标记呈阳性,所述一种或多种标记表明所述细胞是非幼稚t细胞和/或是非幼稚样t细胞,和/或与t细胞中的非幼稚或非幼稚样状态相关。在某些实施方案中,与非幼稚细胞或非幼稚样细胞相关的标记的低表达是或包括比所述标记在效应t(teff)细胞、记忆t细胞、中枢记忆t细胞(tcm)和/或效应记忆t(tem)细胞中的表达低至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%或至少99%的表达。
在一些实施方案中,表明细胞是非幼稚t细胞和/或是非幼稚样t细胞和/或与t细胞中的非幼稚或非幼稚样状态相关的标记包括一种或多种细胞因子。例如,在某些实施方案中,非幼稚t细胞或非幼稚样t细胞对il-2、ifn-γ、il-4和il-10中的一种或多种的表达和/或产生呈阴性。在一些实施方案中,所述一种或多种细胞因子被分泌。在特定实施方案中,例如,在用防止、抑制或减少分泌的药剂处理期间或之后,所述一种或多种细胞因子在非幼稚样t细胞的内部表达。
在某些实施方案中,幼稚样t细胞(例如,幼稚样cd57-t细胞)对cd45ra和ccr7的表达(例如,表面表达)呈阳性。在特定实施方案中,幼稚样cd4+t细胞对cd45ra和ccr7的表达(例如,表面表达)呈阳性。在一些实施方案中,幼稚样cd8+t细胞对cd45ra和ccr7的表达(例如,表面表达)呈阳性。在一些实施方案中,幼稚样cd3+t细胞对cd45ra和ccr7的表达(例如,表面表达)呈阳性。在特定实施方案中,幼稚样t细胞对cd45ra、cd27和ccr7的表达(例如,表面表达)呈阳性,并且对cd45ro的表达(例如,表面表达)呈阴性。在特定实施方案中,幼稚样cd4+t细胞对cd45ra、cd27和ccr7的表达(例如,表面表达)呈阳性,并且对cd45ro的表达(例如,表面表达)呈阴性。在一些实施方案中,幼稚样cd8+t细胞对cd45ra、cd27和ccr7的表达(例如,表面表达)呈阳性,并且对cd45ro的表达(例如,表面表达)呈阴性。在一些实施方案中,幼稚样cd3+t细胞对cd45ra、cd27和ccr7的表达(例如,表面表达)呈阳性,并且对cd45ro的表达(例如,表面表达)呈阴性。
在某些实施方案中,富集的cd57-t细胞的群体含有、含有约或含有至少为或约10%、15%、20%、25%、30%、35%、40%、45%或50%对cd25表达呈阳性的t细胞。在各种实施方案中,富集的cd57-t细胞的群体含有、含有约或含有至少为或约10%、15%、20%、25%、30%、35%、40%、45%或50%cd57-cd25+t细胞。在各种实施方案中,富集的cd57-细胞的群体含有在或在约10%与60%之间、20%与50%之间或25%与40%之间的cd25+t细胞,每个都包含端值。在一些实施方案中,富集的cd57-细胞的群体含有在或在约10%与60%之间、20%与50%之间或25%与40%之间的cd57-cd25+t细胞,每个都包含端值。
在某些实施方案中,富集的cd57-t细胞的群体含有、含有约或含有至少为或约10%、15%、20%、25%、30%、35%、40%、45%或50%对cd27表达呈阳性的t细胞。在各种实施方案中,富集的cd57-t细胞的群体含有、含有约或含有至少为或约10%、15%、20%、25%、30%、35%、40%、45%或50%cd57-cd27+t细胞。在各种实施方案中,富集的cd57-细胞的群体含有在或在约10%与60%之间、20%与50%之间或25%与40%之间的cd27+t细胞,每个都包含端值。在一些实施方案中,富集的cd57-细胞的群体含有在或在约10%与60%之间、20%与50%之间或25%与40%之间的cd57-cd27+t细胞,每个都包含端值。在某些实施方案中,富集的cd57-t细胞的群体含有至少为或约25%cd27+t细胞。
在特定实施方案中,富集的cd57-t细胞的群体含有、含有约或含有至少为或约10%、15%、20%、25%、30%、35%、40%、45%或50%对cd28表达呈阳性的t细胞。在各种实施方案中,富集的cd57-t细胞的群体含有、含有约或含有至少为或约5%、10%、15%、20%、25%、30%、35%、40%、45%或50%cd57-cd28+t细胞。在某些实施方案中,富集的cd57-细胞的群体含有在或在约为或约5%与为或约50%之间、为或约5%与为或约35%之间或者为或约10%与为或约25%之间的cd27+t细胞,每个都包含端值。在一些实施方案中,富集的cd57-细胞的群体含有在或在为或约5%与为或约50%之间、为或约5%与为或约35%之间或者为或约10%与为或约25%之间的cd57-cd27+t细胞,每个都包含端值。在某些实施方案中,富集的cd57-t细胞的群体含有至少为或约25%cd27+t细胞。
在一些实施方案中,富集的cd57-t细胞的群体含有、含有约或含有至少为或约10%、15%、20%、25%、30%、35%、40%、45%或50%对ccr7表达呈阳性的t细胞。在某些实施方案中,富集的cd57-t细胞的群体含有、含有约或含有至少为或约5%、10%、15%、20%、25%、30%、35%、40%、45%或50%cd57-ccr7+t细胞。在一些实施方案中,富集的cd57-细胞的群体含有在或在约为或约5%与为或约50%之间、为或约5%与为或约35%之间或者为或约10%与为或约25%之间的ccr7+t细胞,每个都包含端值。在特定实施方案中,富集的cd57-细胞的群体含有在或在约为或约5%与为或约50%之间、为或约5%与为或约35%之间或者为或约10%与为或约25%之间的cd57-ccr7+t细胞,每个都包含端值。在一些实施方案中,富集的cd57-t细胞的群体含有至少为或约25%ccr7+t细胞。
在一些实施方案中,富集的cd57-t细胞的群体含有、含有约或含有至少为或约10%、15%、20%、25%、30%、35%、40%、45%或50%对cd45ra表达呈阳性的t细胞。在某些实施方案中,富集的cd57-t细胞的群体含有、含有约或含有至少为或约5%、10%、15%、20%、25%、30%、35%、40%、45%或50%cd57-cd45ra+t细胞。在一些实施方案中,富集的cd57-细胞的群体含有在或在约为或约5%与为或约50%之间、为或约5%与为或约35%之间或者为或约10%与为或约25%之间的cd45ra+t细胞,每个都包含端值。在特定实施方案中,富集的cd57-细胞的群体含有在或在约为或约5%与为或约50%之间、为或约5%与为或约35%之间或者为或约10%与为或约25%之间的cd57-cd45ra+t细胞,每个都包含端值。在一些实施方案中,富集的cd57-t细胞的群体含有至少为或约25%cd45ra+t细胞。
在一些实施方案中,耗尽的群体中幼稚样细胞的频率比为或约生物样品中幼稚样细胞的频率大至少为或约10%、20%、30%、40%或50%。在一些实施方案中,耗尽的群体中cd25+t细胞、cd27+t细胞、cd28+t细胞、ccr7+t细胞或cd45ra+t细胞中的一种或多种的频率比为或约生物样品中相应细胞的频率大至少为或约10%、20%、30%、40%或50%。在一些实施方案中,耗尽的群体包含至少为或约15%、20%、25%、30%、35%或40%cd27+t细胞。在一些实施方案中,耗尽的群体包含至少为或约10%、15%、20%、25%、25%、30%、35%或40%cd28+t细胞。在一些实施方案中,耗尽的群体包含至少为或约10%、15%、20%、25%、30%、35%、40%、50%、60%、70%或80%cd27+cd28+t细胞。在一些实施方案中,耗尽的群体包含至少为或约70%或80%cd27+cd28+t细胞。在一些实施方案中,耗尽的群体包含至少为或约10%、15%、20%或25%ccr7+t细胞。
ii.cd57-t细胞的选择和/或cd57+t细胞的耗尽
在一些实施方案中,从生物样品获得富集的cd57-t细胞的群体。在特定实施方案中,从生物样品选择、分离或富集富集的cd57-t细胞的群体。在特定实施方案中,从生物样品去除、分离或耗尽cd57+t细胞。在某些实施方案中,从生物样品去除、分离或耗尽至少25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或99.9%cd57+t细胞。
在特定实施方案中,在从生物样品选择、分离或富集cd57-t细胞之前,从生物样品选择、分离或富集细胞的子集(例如,t细胞的子集)。在一些实施方案中,从富集的cd57-t细胞的群体选择、分离或富集细胞(例如,t细胞)的子集。
在一些实施方案中,例如,在所述选择、分离或富集前,富集的cd57-t细胞的群体含有生物样品中为、为约或少于50%、45%、40%、35%、30%、25%、20%、15%、10%、5%、1%、0.1%、0.01%或0.001%的cd57+t细胞。在特定实施方案中,富集的cd57-t细胞的群体含有生物样品中为、为约或少于20%的cd57+t细胞。在某些实施方案中,富集的cd57-t细胞的群体含有生物样品中为、为约或少于5%的cd57+t细胞。在一些实施方案中,例如,在所述选择、分离或富集前,富集的cd57-t细胞的群体含有生物样品中为、为约或少于1%的cd57+t细胞。在各种实施方案中,富集的cd57-t细胞的群体含有生物样品中为、为约或少于0.1%的cd57+t细胞。在特定实施方案中,富集的cd57-t细胞的群体含有生物样品中为、为约或少于0.01%的cd57+t细胞。在一些实施方案中,耗尽的群体中cd57+t细胞的频率是所述生物样品中cd57+t细胞的频率的少于为或约35%、30%、20%、10%、5%、1%或0.1%。在一些实施方案中,耗尽的群体包含少于为或约3%、少于为或约2%、少于为或约1%、少于为或约0.1%或者少于为或约0.01%cd57+t细胞。在一些实施方案中,耗尽的群体不含或基本上不含cd57+t细胞。
在特定实施方案中,例如,在所述选择、分离或富集前,富集的cd57-t细胞的群体的细胞的分化程度低于生物样品的细胞。在某些实施方案中,富集的cd57-t细胞的群体含有的幼稚样细胞的频率大于生物样品。在某些实施方案中,例如,在所述选择、分离或富集前,富集的cd57+t细胞的群体包括的幼稚样细胞比生物样品多为、为约或者至少为或约25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、125%、150%、1倍、2倍、3倍、4倍、5倍或10倍。
在一些实施方案中,幼稚样细胞包括幼稚t细胞或中枢记忆t细胞。在一些实施方案中,幼稚样细胞可以包括对一种或多种表面标记呈阳性或高水平表达的所述表面标记的细胞,例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+t细胞。在一些方面,所述细胞是cd27+。在一些方面,所述细胞是cd28+。在一些方面,所述细胞是ccr7+。在特定方面,ccr7由幼稚或幼稚样t细胞(例如ccr7+cd45ra+或ccr7+cd27+)和中枢记忆t细胞(ccr7+cd45ra-)表达。在某些实施方案中,幼稚样t细胞或对幼稚样t细胞上表达的标记呈表面阳性的t细胞是ccr7+cd45ra+,其中所述细胞是cd27+或cd27-。在某些实施方案中,幼稚样t细胞或对幼稚样t细胞上表达的标记呈表面阳性的t细胞是cd27+ccr7+,其中所述细胞是cd45ra+或cd45ra-。在某些实施方案中,幼稚样t细胞或对幼稚样t细胞上表达的标记呈表面阳性的t细胞是cd62l-ccr7+。在某些实施方案中,幼稚样细胞包括处于分化早期阶段的细胞(例如,呈ccr7+cd27+的细胞)。
在某些实施方案中,中枢记忆t细胞可以包括处于不同分化状态的细胞,并且特征可以是某些细胞标记的阳性或高表达(例如,表面表达)和/或其他细胞标记的阴性或低表达(例如,表面表达)。在一些方面,分化程度较低的细胞(例如,中枢记忆细胞)不再存活,并且消耗较慢,从而增加持久性和耐久性。在一些方面,细胞疗法(如car-t细胞疗法)的反应者具有增加的中枢记忆基因的表达。参见例如,fraietta等人(2018)natmed.24(5):563-571。在一些方面,中枢记忆t细胞的特征为cd45ro、cd62l、ccr7、cd28、cd3和/或cd127的阳性或高表达。在一些方面,中枢记忆t细胞的特征为cd45ra和/或颗粒酶b的阴性或低表达。在某些实施方案中,中枢记忆t细胞或对中枢记忆t细胞上表达的标记呈表面阳性的t细胞是ccr7+cd45ra-。
在特定实施方案中,例如,在所述选择、分离或富集前,富集的cd57-t细胞的群体包括的cd27+t细胞比生物样品多为、为约或者至少为或约25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、125%、150%、1倍、2倍、3倍、4倍、5倍或10倍。在特定实施方案中,例如,在所述选择、分离或富集前,富集的cd57-t细胞的群体包括的cd28+t细胞比生物样品多为、为约或者至少为或约25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、125%、150%、1倍、2倍、3倍、4倍、5倍或10倍。在各种实施方案中,例如,在所述选择、分离或富集前,富集的cd57-t细胞的群体包括的cd25+t细胞比生物样品多为、为约或者至少为或约25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、125%、150%、1倍、2倍、3倍、4倍、5倍或10倍。在某些实施方案中,例如,在所述选择、分离或富集前,富集的cd57-t细胞的群体包括的ccr7+t细胞比生物样品多为、为约或者至少为或约25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、125%、150%、1倍、2倍、3倍、4倍、5倍或10倍。在某些实施方案中,例如,在所述选择、分离或富集前,富集的cd57-t细胞的群体包括的cd45ra+细胞比生物样品多为、为约或者至少为或约25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、125%、150%、1倍、2倍、3倍、4倍、5倍或10倍。
在某些实施方案中,在从生物样品选择、分离或富集cd57-t细胞之前,从生物样品选择、分离或富集t细胞(例如,cd3+t细胞)。在一些实施方案中,从富集的cd57-t细胞的群体选择、分离或富集t细胞(例如,cd3+t细胞)。在特定实施方案中,选择、分离或富集t细胞(例如,cd3+t细胞)涉及对来自样品的细胞的阳性选择。
在一些实施方案中,从样品、细胞组合物或细胞群选择、分离或富集cd57+细胞,从而产生分离或选择的cd57+细胞和富集的cd57-细胞(例如,t细胞)的群体。在某些实施方案中,从生物样品选择、分离或富集cd57+细胞,从而产生分离或选择的cd57+细胞和富集的cd57-细胞(例如,t细胞)的群体。在某些实施方案中,从富集的cd57-细胞的群体富集、选择或分离cd3+t细胞,从而生成富集的cd57-cd3+t细胞的群体和富集的cd57-细胞的未选择的群体。在某些实施方案中,从富集的cd57-细胞的未选择的群体富集、选择或分离cd3+t细胞,从而生成富集的cd57-cd3+t细胞的群体。在各种实施方案中,从富集的cd57-细胞的群体富集、选择或分离cd3+t细胞,从而生成富集的cd57-cd3+t细胞的群体和富集cd57-细胞的未选择的群体,然后从富集的cd57-细胞的未选择的群体富集、选择或分离cd4+或cd8+t细胞,从而生成富集的cd57-cd4+t细胞或cd57-cd8+t细胞的群体。
在某些实施方案中,在从生物样品选择、分离或富集cd57-t细胞之前,从生物样品选择、分离或富集t细胞(例如,cd4+或cd8+t细胞)的子集。在一些实施方案中,从富集的cd57-t细胞的群体选择、分离或富集t细胞(例如,cd4+或cd8+t细胞)的子集。在特定实施方案中,选择、分离或富集t细胞(例如,cd4+或cd8+t细胞)的子集涉及对来自样品的细胞的阳性选择。
在一些实施方案中,从样品、细胞组合物或细胞群选择、分离或富集cd57+细胞,从而产生分离或选择的cd57+细胞和富集的cd57-细胞(例如,t细胞)的群体。在某些实施方案中,从生物样品选择、分离或富集cd57+细胞,从而产生分离或选择的cd57+细胞和富集的cd57-细胞(例如,t细胞)的群体。在特定实施方案中,从富集的cd57-细胞的群体富集、选择或分离cd4+t细胞,从而生成富集的cd57-cd4+t细胞的群体和富集cd57-细胞的未选择的群体。在某些实施方案中,从富集的cd57-细胞的群体富集、选择或分离cd8+t细胞,从而生成富集的cd57-cd8+t细胞的群体和富集的cd57-细胞的未选择的群体。在某些实施方案中,从富集的cd57-细胞的未选择的群体富集、选择或分离cd8+t细胞,从而生成富集的cd57-cd8+t细胞的群体。在特定实施方案中,从富集的cd57-细胞的未选择的群体富集、选择或分离cd4+t细胞,从而生成富集的cd57-cd4+t细胞的群体。
在特定实施方案中,从富集的cd57-细胞的群体富集、选择或分离cd4+t细胞,从而生成富集的cd57-cd4+t细胞的群体和富集cd57-细胞的未选择的群体,然后从富集的cd57-细胞的未选择的群体富集、选择或分离cd8+t细胞,从而生成富集的cd57-cd8+t细胞的群体。在各种实施方案中,从富集的cd57-细胞的群体富集、选择或分离cd4+t细胞,从而生成富集的cd57-cd4+t细胞的群体和富集cd57-细胞的未选择的群体,然后从富集的cd57-细胞的未选择的群体富集、选择或分离cd8+t细胞,从而生成富集的cd57-cd8+t细胞的群体。
在特定实施方案中,(1)从生物样品富集、选择或分离cd4+t细胞,从而生成富集的cd4+t细胞的群体和富集cd4-细胞的未选择的群体;(2)从富集的cd4-细胞的未选择的群体富集、选择或分离cd8+t细胞,从而生成富集的cd8+t细胞的群体;以及(3)从富集的cd4+和cd8+t细胞群耗尽cd57+t细胞,从而生成富集的cd57-cd4+和cd57-cd8+t细胞的群体。在特定实施方案中,(1)从生物样品富集、选择或分离cd8+t细胞,从而生成富集的cd8+t细胞的群体和富集cd8-细胞的未选择的群体;(2)从富集的cd4-细胞的未选择的群体富集、选择或分离cd4+t细胞,从而生成富集的cd4+t细胞的群体;以及(3)从富集的cd4+和cd8+t细胞群耗尽cd57+t细胞,从而生成富集的cd57-cd4+和cd57-cd8+t细胞的群体。
在特定实施方案中,从生物样品富集、选择或分离cd4+t细胞,从而生成cd4+t细胞的富集的群体,然后从cd4+t细胞的富集的群体去除cd57+细胞,从而生成富集的cd57-cd4+t细胞的群体。在特定实施方案中,从生物样品富集、选择或分离cd8+t细胞,从而生成cd8+t细胞的富集的群体,然后从cd8+t细胞的富集的群体去除cd57+细胞,从而生成富集的cd57-cd8+t细胞的群体。
在一些实施方案中,在分离、选择和/或富集后,将富集的cd57-t细胞的一个或多个群体冷冻,例如,低温保存和/或低温保护。在特定实施方案中,在分离、选择和/或富集后,将富集的cd57-cd4+t细胞的群体冷冻,例如,低温保存和/或低温保护。在某些实施方案中,在分离、选择和/或富集后,将富集的cd57-cd8+t细胞的群体冷冻,例如,低温保存和/或低温保护。在某些实施方案中,在分离、选择和/或富集后,将富集的cd57-cd3+t细胞的群体冷冻,例如,低温保存和/或低温保护。在一些实施方案中,在孵育、激活、刺激、工程化、转导、转染、培育、扩增、收获和/或配制细胞群的任何步骤之前,将富集的t细胞的一个或多个群体冷冻,例如,低温保存和/或低温保护。在特定实施方案中,在孵育、激活、刺激、工程化、转导、转染、培育、扩增、收获和/或配制细胞群的任何步骤之前,将富集的cd57-cd4+t细胞的群体冷冻,例如,低温保存和/或低温保护。在一些实施方案中,在孵育、激活、刺激、工程化、转导、转染、培育、扩增、收获和/或配制细胞群的任何步骤之前,将富集的cd57-cd8+t细胞的群体冷冻,例如,低温保存和/或低温保护。在一些实施方案中,在孵育、激活、刺激、工程化、转导、转染、培育、扩增、收获和/或配制细胞群的任何步骤之前,将富集的cd57-cd3+t细胞的群体冷冻,例如,低温保存和/或低温保护。在特定实施方案中,将一种或多种低温保护的输入组合物储存,例如,在或在约-80℃下储存12小时与7天之间、24小时与120小时之间或2天与5天之间。在特定实施方案中,将一种或多种低温保护的输入组合物在或在约-80℃下储存少于10天、9天、8天、7天、6天、或5天、4天、3天、2天或1天的时间量。在一些实施方案中,将一种或多种低温保护的输入组合物在或在约-70℃或-80℃下储存少于3天,如储存约2天。
在一些实施方案中,在涉及一种或多种特定细胞类型或细胞群时,“耗尽”或“去除”是指例如,与组合物中的细胞总数或组合物的体积相比,或者相对于其他细胞类型,减少所述细胞类型或群体的数量或百分比,如通过基于所述群体或细胞表达的标记的阴性选择,或通过基于要耗尽的细胞群或细胞上不存在的标记的阳性选择来进行。通常,术语耗尽或去除不需要从组合物完全去除细胞、细胞类型或群体。
在一些实施方案中,在涉及一种或多种特定细胞类型或细胞群时,“富集”是指例如,与组合物中的细胞总数或组合物的体积相比,或者相对于其他细胞类型,增加所述细胞类型或群体的数量或百分比,如通过基于所述群体或细胞表达的标记的阳性选择,或通过基于要耗尽的细胞群或细胞上不存在的标记的阴性选择来进行。通常,术语富集不需要从组合物完全去除其他细胞、细胞类型或群体,并且不需要如此富集的细胞在富集的组合物中以100%或甚至接近100%存在。
在一些方面,从受试者(如人受试者)获得的用于细胞疗法(例如,过继细胞疗法)的细胞群或细胞组合物可以展现低生长或慢生长,使得达不到用于生成治疗组合物的收获细胞的阈值(例如,收获标准)(例如,无生长),或者在特定时间段内达不到用于生成治疗组合物的收获细胞的阈值(例如,收获标准)(例如,慢生长)。在一些方面,一些此类细胞群可以含有高频率的cd57+细胞,如频率高于阈值的cd57+。在其他方面,与展现无生长或慢生长的群体相比,从受试者(如人受试者)获得的用于细胞疗法(例如,过继细胞疗法)的细胞群或细胞组合物可以展现改进的生长。在一些方面,此类细胞群或细胞组合物可以含有低频率的cd57+细胞,如频率低于阈值的cd57+细胞。在一些方面,展现改进的生长的细胞群或细胞组合物可以展现与幼稚样或中枢记忆样表型相关的表型或表达与幼稚样或中枢记忆样表型相关的标记,如cd27+、cd28+和/或ccr7+。在一些实施方案中,所提供的方法是基于如下观察:在来自人受试者的生物样品(例如白细胞单采术或单采术样品)中的t细胞之间,在cd57+t细胞表达中存在变异性或异质性,这在一些方面可以导致从多个不同受试者产生的用于过继细胞疗法中的工程化t细胞组合物的表型和功能的变异性,即使使用相同的制造过程。在特定实施方案中,所提供的方法通过从生物样品选择、分离或富集cd57-t细胞,如通过从生物样品去除、分离或耗尽cd57+t细胞,来控制或减小这种变异性。然后可以将此类细胞用于过程中以工程化或制造用于细胞疗法的细胞,以使产物之间的变异性降至最低,同时还改进特定产物的属性和特征,如在施用至受试者后扩增并持续存在的能力。
a.样品和细胞制备
在特定实施方案中,所提供的方法与从生物样品分离、选择或富集细胞以生成富集的细胞(例如,cd57-t细胞)的一个或多个群体结合使用。在一些实施方案中,所提供的方法包括从生物样品分离细胞或其群体,所述生物样品如获自或源自受试者的那些,所述受试者如患有特定疾病或病症或者需要细胞疗法或者将被施用细胞疗法的受试者。在一些方面,受试者是人,如作为需要特定治疗性干预(如过继细胞疗法,其中分离、处理和/或工程化细胞以用于所述过继细胞疗法)的患者的受试者。因此,在一些实施方案中,细胞是原代细胞,例如原代人细胞。样品包括直接从受试者获取的组织、流体和其他样品。生物样品可以是直接从生物来源获得的样品或经过处理的样品。生物样品包括但不限于体液(如血液、血浆、血清、脑脊液、滑液、尿液和汗液)、组织和器官样品,包括源自它们的被处理样品。
在一些方面,样品是血液或血液来源的样品,或者是或源自单采术或白细胞单采术产物。示例性样品包括全血、外周血单核细胞(pbmc)、白细胞、骨髓、胸腺、组织活检、肿瘤、白血病、淋巴瘤、淋巴结、肠相关淋巴组织、粘膜相关淋巴组织、脾、其他淋巴组织、肝、肺、胃、肠、结肠、肾、胰腺、乳房、骨、前列腺、子宫颈、睾丸、卵巢、扁桃体或其他器官和/或源自它们的细胞。在细胞疗法(例如,过继细胞疗法)的背景下,样品包括来自自体和同种异体来源的样品。在一些实施方案中,样品是或包含全血样品、血沉棕黄层样品、外周血单核细胞(pbmc)样品、未分级t细胞样品、淋巴细胞样品、白细胞样品、单采术产物或白细胞单采术产物。
在一些例子中,例如通过单采术或白细胞单采术获得来自受试者的循环血液的细胞。在一些方面,样品含有淋巴细胞,包括t细胞、单核细胞、粒细胞、b细胞、其他有核白细胞、红细胞和/或血小板,并且在一些方面含有除了红细胞和血小板以外的细胞。
在一些实施方案中,洗涤从受试者收集的血细胞,例如以去除血浆级分并将细胞置于适当的缓冲液或介质中以用于后续处理步骤。在一些实施方案中,用磷酸盐缓冲盐水(pbs)洗涤细胞。在一些实施方案中,洗涤溶液缺少钙和/或镁和/或多种或全部二价阳离子。在一些方面,根据制造商的说明书,通过半自动“流通式”离心机(例如,cobe2991细胞处理器,baxter)完成洗涤步骤。在一些方面,根据制造商的说明书,通过切向流过滤(tff)完成洗涤步骤。在一些实施方案中,在洗涤后将细胞重悬于多种生物相容性缓冲液中,所述缓冲液如例如不含ca++/mg++的pbs。在某些实施方案中,去除血细胞样品的组分并将细胞直接重悬于培养基中。
在一些实施方案中,洗涤含有细胞的样品(例如,单采术产物或白细胞单采术产物),以去除在单采术或白细胞单采术期间添加的一种或多种抗凝剂,如肝素。
在一些实施方案中,将含有细胞的样品(例如,全血样品、血沉棕黄层样品、外周血单核细胞(pbmc)样品、未分级t细胞样品、淋巴细胞样品、白细胞样品、单采术产物或白细胞单采术产物)低温保存和/或低温保护(例如,冷冻),然后在用于分离、选择、激活、刺激、工程化、转导、转染、孵育、培养、收获、配制细胞群和/或将配制的细胞群施用至受试者的任何步骤之前,将其解冻并任选地洗涤。
在一些实施方案中,在适于确保适当质量的方法中从受试者收集含有自体外周血单核细胞(pbmc)的样品以供制造。在一个方面,含有pbmc的样品源自分级分离的全血。在一些实施方案中,将来自受试者的全血通过白细胞单采术使用离心力并利用细胞表型之间的密度差异进行分级分离,此时优先富集自体单核细胞(mnc),而其他细胞表型如红细胞在收集的细胞组合物中减少。在一些实施方案中,在mnc收集期间并行收集自体血浆,这在一些方面可以允许延长的白细胞单采术产物稳定性。在一个方面,将自体血浆添加至白细胞单采术产物以改进白细胞单采术产物基质的缓冲能力。在一些方面,进行处理以产生白细胞单采术产物的全血的总体积为或为约2l、4l、6l、8l、10l、12l、14l、16l、18l或20l,或者是任何前述值之间的任何值。在一些实施方案中,收集的自体血浆的体积为或为约10ml、50ml、100ml、150ml、200ml、250ml或300ml或更多,或者是任何前述值之间的体积。在一些实施方案中,在白细胞单采术收集完成的约48小时内,使白细胞单采术产物经历一种程序,例如,洗涤和配制用于过程中低温保存。在一些实施方案中,例如,在白细胞单采术收集完成的约2小时、6小时、12小时、18小时、24小时、36小时或48小时内,使白细胞单采术产物经历一个或多个洗涤步骤。在一些方面,所述一个或多个洗涤步骤去除白细胞单采术收集期间的抗凝剂、可能在白细胞单采术产物中积累的细胞废物、残余血小板和/或细胞碎片。在一些实施方案中,在所述一个或多个洗涤步骤期间进行一次或多次缓冲液交换。
在特定实施方案中,将单采术产物或白细胞单采术产物低温保存和/或低温保护(例如冷冻),然后在经历如下所述的细胞富集、选择或分离步骤(例如,t细胞选择或分离步骤)之前进行解冻。在一些实施方案中,在使低温保存的和/或低温保护的单采术产物或白细胞单采术产物经历t细胞选择或分离步骤之后,在任何随后步骤(如激活、刺激、工程化、转导、转染、孵育、培养、收获、配制细胞群和/或将所配制的细胞群施用至受试者的步骤)期间或之间,不再进行低温保存和/或低温保护步骤。例如,在解冻并任选地洗涤用于下游过程(如t细胞激活/刺激或转导)之前,不再对选自解冻的低温保存的和/或低温保护的单采术产物或白细胞单采术产物的t细胞进行低温保存和/或低温保护。
在特定实施方案中,将单采术产物或白细胞单采术产物以以下密度在低温保存溶液或缓冲液中进行低温保存和/或低温保护(例如,冷冻):为、为约或至少5x106个细胞/ml、10x106个细胞/ml、20x106个细胞/ml、30x106个细胞/ml、40x106个细胞/ml、50x106个细胞/ml、60x106个细胞/ml、70x106个细胞/ml、80x106个细胞/ml、90x106个细胞/ml、100x106个细胞/ml、110x106个细胞/ml、120x106个细胞/ml、130x106个细胞/ml、140x106个细胞/ml、或150x106个细胞/ml,或者任何前述值之间的任何值。在一些实施方案中,所述低温保存溶液或缓冲液是或含有例如任选地包含人血清白蛋白(hsa)的dmso溶液,或其他合适的细胞冷冻介质。
在特定实施方案中,将低温保存的和/或低温保护的单采术产物或白细胞单采术产物存放(例如,在冷冻样品之前不进行t细胞选择),这在一些方面可以允许更灵活地进行后续制造步骤。在一些方面,将低温保存的和/或低温保护的单采术产物或白细胞单采术产物等分至多个低温保存容器(如袋子)中,所述容器可以各自单独地或组合地用于产物处理中。例如,在单采术产物或白细胞单采术产物中活细胞的总数量小于15x109个细胞时,将低温保存的和/或低温保护的单采术产物或白细胞单采术产物等分至四个低温保存容器(如袋子)中。在一些实施方案中,在单采术产物或白细胞单采术产物中活细胞的总数量是15-30x109个细胞时,将低温保存的和/或低温保护的单采术产物或白细胞单采术产物等分至八个低温保存容器(如袋子)中。
在一个方面,在选择前存放细胞增加用于下游过程的细胞产量,并且较早存放细胞可能意味着,所述细胞更健康并且可能更易于符合制造成功的标准。在另一个方面,一旦解冻,就可以使低温保存的和/或低温保护的单采术产物或白细胞单采术产物经历一种或多种不同的选择方法。这种方式的优点尤其在于,增强用于治疗受试者的疾病或病症的细胞疗法的细胞的可用性、功效和/或其他方面,如在所述样品的供体和/或另一接受者中。
在一些实施方案中,在供体被诊断为患有疾病或病症之后的时间,在细胞选择之前或在不进行在先细胞选择的情况下(例如,不进行在先t细胞选择,如通过色谱进行选择),收集样品(例如单采术或白细胞单采术样品)并进行低温保存和/或低温保护。在一些方面,低温保存的时间也在供体已经接受以下中的一种或多种之前:用于所述疾病或病症的任何初始治疗、用于所述疾病或病症的任何靶向治疗或针对治疗进行标记的任何治疗、或者除了辐射和/或化学疗法以外的任何治疗。在一些实施方案中,在疾病的初始治疗后疾病首次复发之后,以及在供体或受试者接受用于所述疾病的后续治疗之前,收集样品。所述初始和/或后续治疗可以是除了细胞疗法以外的疗法。在一些实施方案中,所收集的细胞可以用于初始和/或后续治疗后的细胞疗法中。在一个方面,在不进行在先细胞选择的情况下,低温保存的和/或低温保护的样品可以有助于降低前期费用,如与随机化临床试验中的非治疗患者相关的那些费用,所述患者可能发生交叉并且以后需要治疗。
在一些实施方案中,在疾病的二线治疗后疾病第二次复发后,以及在供体或受试者接受用于所述疾病的后续治疗之前的时间,在细胞选择前或在不进行在先细胞选择的情况下(例如,不进行在先t细胞选择,如通过色谱进行的选择),收集样品(例如单采术或白细胞单采术样品)并进行低温保存和/或低温保护。在一些实施方案中,例如通过评估某些风险因子,将患者鉴定为可能在二线治疗后复发。在一些实施方案中,所述风险因子是基于疾病类型和/或遗传学,如双打击淋巴瘤、原发性难治性癌症、或激活的b细胞淋巴瘤。在一些实施方案中,所述风险因子是基于临床表现,如一线治疗之后的早期复发、或治疗之后的其他不良预后指数(例如,ipi(国际预后指数)>2)。
在一些实施方案中,在供体或受试者被诊断为患有疾病之前的时间,在细胞选择前或在不进行在先细胞选择的情况下(例如,不进行在先t细胞选择,如通过色谱进行的选择),收集样品(例如单采术或白细胞单采术样品)并进行低温保存和/或低温保护。在一些方面,可以确定供体或受试者具有患上疾病的风险。在一些方面,供体或受试者可以是健康受试者。在某些情况下,在被认为没有患上疾病的风险或被诊断为未患疾病的情况下,供体或受试者可以选择存放或储存细胞,以免在生命的后期需要细胞疗法。在一些实施方案中,可以基于诸如以下等因素,认为供体或受试者具有患上疾病的风险:基因突变、基因异常、基因破坏、家族病史、蛋白质异常(如蛋白质产生和/或加工的缺陷),以及可能增加患病风险的生活方式的选择。
在一些实施方案中,收集细胞作为预防药。
在一些实施方案中,将低温保存的和/或低温保护的细胞样品(例如单采术或白细胞单采术样品),如尚未经历在先细胞选择(例如,不进行在先t细胞选择,如通过色谱进行的选择)的细胞样品储存或存放如下时间段:大于或等于12小时、24小时、36小时或48小时,或者大于或等于0.5天、一天、1.5天或两天。在一些实施方案中,将样品储存或存放如下时间段:大于或等于1周、2周、3周或4周。在一些实施方案中,将样品放置于长期储存或长期存放中。在一些方面,将样品储存如下时间段:大于或等于1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、1年、2年、3年、4年、5年、6年、7年、8年、9年、10年、11年、12年、13年、14年、15年、16年、17年、18年、19年、20年、25年、30年、35年、40年或更久。
在一些实施方案中,将从供体获取的单采术或白细胞单采术样品在冷却的环境中运输到储存或处理设施,和/或在储存设施中低温储存,或在处理设施中进行处理。在一些实施方案中,在运输前处理样品,例如,通过选择t细胞,如cd3+t细胞、cd4+t细胞和/或cd8+t细胞进行处理。在一些实施方案中,在运输之后且在低温储存样品之前进行这种处理。在一些实施方案中,在低温储存后解冻样品之后进行所述处理。
通过允许供体在所述供体及因此其细胞尚未经历疾病的广泛治疗时和/或在患上疾病或病症或其诊断之前的阶段储存其细胞,与在一轮或多轮治疗后收获的细胞相比,此类细胞可能具有用于细胞疗法的某些优点。例如,与已经历几轮治疗的细胞相比,在一轮或多轮治疗之前收获的细胞可能更健康,可能展现更高水平的某些细胞活性,可能生长更快,和/或可能更易接受基因操作。根据本文所述的实施方案的优点的另一个例子可以包括便利性。例如,通过在细胞疗法需要供体细胞之前收集、任选地处理和储存所述供体细胞,如果接受者以后需要所述细胞以及在接受者以后需要所述细胞时,将容易获得所述细胞。这可以增加单采术实验室容量,从而为技术人员安排单采术收集过程提供更高灵活性。
用于来自样品(如单采术样品)的细胞的低温储存和处理的示例性方法和系统可以包括wo2018170188中所述的那些。在一些实施方案中,所述方法和系统涉及在患者需要细胞疗法之前收集单采术,然后使所述单采术样品经历低温保存,以供以后用于用重组受体(例如car)工程化细胞(例如t细胞)的过程中。在一些情况下,此类过程可以包括本文所述的那些。在一些实施方案中,从受试者收集单采术样品,并且在细胞群的后续t细胞选择、激活、刺激、工程化、转导、转染、孵育、培养、收获、配制和/或将所配制的细胞群施用至受试者之前进行低温保存。在此类例子中,在使样品经历一个或多个选择步骤(如本文所述的任何步骤)之前,将低温保存的单采术样品解冻。
在一些实施方案中,将低温保存的和/或低温保护的细胞样品(例如单采术或白细胞单采术样品),如尚未经历在先细胞选择(例如,不进行在先t细胞选择,如通过色谱进行的选择)的细胞样品解冻,之后将其用于制造用于细胞疗法的细胞群(例如,含有car+t细胞的t细胞群)的下游过程中。在一些实施方案中,这种低温保存的和/或低温保护的细胞样品(例如单采术或白细胞单采术样品)与本文所提供的用于工程化t细胞疗法(如car+t细胞疗法)的过程结合使用。在特定例子中,在收获/配制步骤之前或期间不再进行低温保存步骤。
在一些实施方案中,将低温保存的和/或低温保护的单采术产物或白细胞单采术产物解冻。在一些实施方案中,使解冻的细胞组合物经历稀释(例如,用无血清培养基)和/或洗涤(例如,用无血清培养基),这在一些情况下可以去除或减少不需要或不期望的组分。在一些情况下,稀释和/或洗涤去除或减少含于解冻样品中的低温保护剂(例如dmso)的存在,所述低温保护剂原本可能会在延长的室温暴露后对细胞活力、产量、回收率造成负面影响。在一些实施方案中,稀释和/或洗涤允许将解冻的低温保存的产物培养基交换至无血清培养基中,如在通过引用并入本文的pct/us2018/064627中。
在一些实施方案中,无血清培养基包含补充有一种或多种补充剂的基础培养基(例如optmizertmt细胞扩增基础培养基(thermofisher))。在一些实施方案中,所述一种或多种补充剂不含血清。在一些实施方案中,无血清培养基包含补充有一种或多种另外的组分的基础培养基,所述另外的组分用于细胞(例如,t细胞)的维持、扩增和/或激活,如通过另外的补充剂(例如optmizertmt细胞扩增补充剂(thermofisher))所提供。在一些实施方案中,无血清培养基还包含血清替代物补充剂,例如,免疫细胞血清替代物,例如,thermofisher(#a2596101)、ctstm免疫细胞血清替代物或smith等人clintranslimmunology.2015年1月;4(1):e31中所述的免疫细胞血清替代物。在一些实施方案中,无血清培养基还包含游离形式的氨基酸,如l-谷氨酰胺。在一些实施方案中,无血清培养基还包含二肽形式的l-谷氨酰胺(例如,l-丙氨酰-l-谷氨酰胺),如glutamaxtm(thermofisher)中的二肽。在一些实施方案中,无血清培养基还包含一种或多种重组细胞因子,如重组人il-2、重组人il-7和/或重组人il-15。
b.t细胞选择
在一些实施方案中,细胞(例如,cd57+或cd57-细胞,例如cd57+t细胞)的选择、分离或富集包括一个或多个制备步骤和/或非基于亲和力的细胞分离步骤。在一些例子中,将细胞在一种或多种试剂的存在下洗涤、离心和/或孵育,例如以去除不需要的组分、富集所需组分、裂解或去除对特定试剂敏感的细胞。在一些例子中,基于一种或多种特性(如密度、粘附特性、大小、对特定组分的敏感性和/或抗性)分离细胞。在一些实施方案中,所述方法包括基于密度的细胞分离方法,如通过裂解红细胞并通过percoll或ficoll梯度离心而从外周血制备白细胞。在某些实施方案中,用于选择、分离和富集的方法、技术和试剂描述于例如pct申请号wo2013124474和wo2015164675中,所述申请通过引用以其整体特此并入。
在某些实施方案中,在涉及一个或多个选择步骤的过程或程序中分离、富集或选择cd57-细胞。在一些实施方案中,所述一个或多个选择步骤是或涉及阴性选择。在某些实施方案中,通过分离或去除cd57+细胞来分离、富集或选择cd57-细胞。在某些实施方案中,富集cd57-细胞的细胞群得自对来自所述群体的cd57+细胞的阴性选择。
在某些实施方案中,二价抗体将cd57+细胞连接至大密度细胞或珠。这种技术最主要德与红细胞一起使用(例如rosetteseptmstemcelltechnologies),或者与任何其他类似或合适的技术一起用于将靶细胞(例如,cd57+t细胞)偶联至密度梯度以供去除。
在一些实施方案中,至少一部分选择步骤包括将细胞与选择试剂一起孵育。与一种或多种选择试剂一起孵育,例如作为选择方法的一部分可以使用一种或多种选择试剂来进行,以用于基于一种或多种特定分子(如表面标记(例如表面蛋白)、细胞内标记或核酸)在细胞中或细胞上的表达或存在来选择一种或多种不同的细胞类型。在某些实施方案中,此类表面蛋白可以包括cd57、cd4或cd8。在某些实施方案中,此类表面蛋白可以包括cd3。在一些实施方案中,可以使用利用一种或多种选择试剂进行基于此类标记的分离的任何已知方法。在一些实施方案中,所述一种或多种选择试剂导致分离,所述分离是基于亲和力或基于免疫亲和力的分离。例如,在一些方面,选择包括与一种或多种试剂一起孵育,用于基于一种或多种标记(通常是细胞表面标记)的细胞表达或表达水平来分离细胞和细胞群,例如通过与特异性地结合至此类标记的抗体或结合配偶体一起孵育,之后通常进行洗涤步骤并分离已结合抗体或结合配偶体的细胞与未结合至抗体或结合配偶体的那些细胞。在一些实施方案中,用于分离细胞的一种或多种试剂是或包括结合至或识别cd4、cd8或cd57的抗体或其抗原结合片段。在一些实施方案中,用于分离细胞的一种或多种试剂是或包括结合至或识别cd3的抗体或其抗原结合片段。
在此类过程的一些方面,将一定体积的细胞与一定量的基于亲和力的所需选择试剂混合。基于免疫亲和力的选择可以使用任何系统或方法进行,所述系统或方法使得在分离的细胞与特异性地结合至细胞上的标记的分子(例如,固体表面(例如颗粒)上的抗体或其他结合配偶体)之间产生有利的能量相互作用。在一些实施方案中,方法是使用颗粒(如珠,例如磁珠)进行,所述颗粒包被有对细胞的标记具有特异性的选择剂(例如抗体)。可以将颗粒(例如珠)与细胞在容器(如管或袋子)中一起孵育或混合,同时振荡或混合,其中细胞密度与颗粒(例如,珠)的比率是恒定的,以帮助促进能量上有利的相互作用。在其他情况下,所述方法包括选择细胞,其中所述选择的全部或一部分是在离心室的内部空腔中进行,例如在离心旋转下进行。在一些实施方案中,将细胞与选择试剂(如基于免疫亲和力的选择试剂)一起孵育是在离心室中进行。在某些实施方案中,使用在国际专利申请公开号wo2009/072003或us20110003380a1中所述的系统、装置或设备进行分离或分开。在一个例子中,所述系统是如国际公开号wo2016/073602中所述的系统。
在一些实施方案中,通过在离心室的空腔中进行此类选择步骤或其部分(例如,与抗体包被的颗粒(例如,磁珠)一起孵育),用户能够控制某些参数,如各种溶液的体积、在处理期间溶液的添加及其时间安排,从而可以提供与其他可用方法相比的多种优势。例如,在孵育期间减少空腔中液体体积的能力可以增加选择中使用的颗粒(例如珠试剂)的浓度,并由此增加溶液的化学势,而不影响空腔中的细胞总数量。这又可以增强正在处理的细胞与用于选择的颗粒之间的成对相互作用。在一些实施方案中,例如,在与如本文所述的系统、电路和控制相关联时,在室中进行孵育步骤,允许用户在孵育期间的一个或多个所需时间实现对溶液的搅动,这也可以改善相互作用。
在一些实施方案中,至少一部分选择步骤是在离心室中进行,所述部分包括将细胞与选择试剂一起孵育。在此类过程的一些方面,将一定体积的细胞与一定量所需的基于亲和力的选择试剂混合,所述量远少于根据制造商的说明书在管或容器中进行类似选择用于选择相同细胞数量和/或细胞体积时通常所用的量。在一些实施方案中,所采用的一种或多种选择试剂的量是根据制造商的说明书在基于管或容器的孵育中针对相同细胞数量和/或相同细胞体积进行细胞选择所采用的一种或多种相同选择试剂的量的不超过5%、不超过10%、不超过15%、不超过20%、不超过25%、不超过50%、不超过60%、不超过70%或不超过80%。
在一些实施方案中,对于细胞的选择,例如基于免疫亲和力的选择,将细胞在室空腔中在群体中孵育,所述群体还含有具有选择试剂的选择缓冲液,所述选择试剂如与期望富集和/或耗尽的细胞上而不是群体中的其他细胞上的表面标记特异性结合的分子,如抗体,所述分子任选地偶联到支架,如聚合物或表面,例如珠,例如磁珠,如与对cd4和cd8具有特异性的单克隆抗体偶联的磁珠。在一些实施方案中,对于细胞的选择,例如,基于免疫亲和力的选择,将细胞在室的空腔中在群体中孵育,所述群体还含有具有选择试剂的选择缓冲液,所述选择试剂如与期望富集和/或耗尽的细胞上而不是群体中的其他细胞上的表面标记特异性结合的分子,如抗体,所述分子任选地偶联到支架,如聚合物或表面,例如珠,例如磁珠,如与对cd3具有特异性的单克隆抗体偶联的磁珠。在一些实施方案中,如所描述的,将选择试剂添加至室空腔中的细胞,所添加的量与在振荡或旋转的管中进行选择时,实现相同细胞数量或相同细胞体积的大致相同或类似的选择效率通常使用或将需要的选择试剂的量相比显著较小(例如不超过所述量的5%、10%、20%、30%、40%、50%、60%、70%或80%)。在一些实施方案中,在向细胞和选择试剂添加选择缓冲液的情况下进行孵育,以实现例如10ml至200ml试剂的孵育的目标体积,如至少或约至少或约或为10ml、20ml、30ml、40ml、50ml、60ml、70ml、80ml、90ml、100ml、150ml或200ml。在一些实施方案中,将选择缓冲液和选择试剂在添加至细胞之前预混合。在一些实施方案中,将选择缓冲液和选择试剂单独添加至细胞。在一些实施方案中,选择孵育是在周期性温和混合条件下进行,这可有助于促进能量上有利的相互作用,从而允许在实现高选择效率的同时使用较少的总选择试剂。
在一些实施方案中,与选择试剂一起孵育的总持续时间是为或为约5分钟至6小时,如30分钟至3小时,例如,至少或约至少30分钟、60分钟、120分钟或180分钟。
在一些实施方案中,孵育通常在混合条件下进行,如在旋转的存在下,通常以相对低的力或速度旋转,如速度低于用于使细胞沉淀的速度,如为或为约600rpm至1700rpm(例如,为或约或至少600rpm、1000rpm或1500rpm或1700rpm),如在室或其他容器的样品或壁处的一定rcf下,所述rcf为或为约80g至100g(例如,为或约或至少80g、85g、90g、95g或100g)。在一些实施方案中,旋转是使用如下重复间隔来进行:以这种低速旋转,之后是休息时间段,如旋转和/或休息1、2、3、4、5、6、7、8、9或10秒,如旋转大约1或2秒,然后休息大约5、6、7或8秒。
在一些实施方案中,这个过程是在与室为整体的完全封闭的系统内进行的。在一些实施方案中,这个过程(在一些方面,以及一个或多个另外的步骤,如洗涤含有细胞的样品(如单采术样品)的预先洗涤步骤)是以自动化方式进行,使得将细胞、试剂和其他组分在适当时间吸入和推出室并进行离心,以使用自动化程序在单一封闭系统中完成洗涤和结合步骤。
在一些实施方案中,在孵育和/或混合细胞和一种和/或多种选择试剂后,使所孵育的细胞经历分离,以基于一种或多种特定试剂的存在或不存在来选择细胞。在一些实施方案中,在同一封闭系统中进行分离,其中将细胞与选择试剂一起进行孵育。在一些实施方案中,在与选择试剂一起孵育后,将所孵育的细胞(包括其中已经结合选择试剂的细胞)转移到系统中用于基于免疫亲和力来分离细胞。在一些实施方案中,用于基于免疫亲和力的分离的系统是或含有磁分离柱。
此类分离步骤可以基于阳性选择(其中保留已经结合试剂(例如抗体或结合配偶体)的细胞以供进一步使用)和/或阴性选择(其中保留尚未结合试剂(例如抗体或结合配偶体)的细胞)。在一些例子中,保留两种级分以供进一步使用。在一些方面,在无法获得专门鉴定异质性群体中的细胞类型的抗体,使得最好基于除了所需群体以外的细胞表达的标记来进行分离的情况下,阴性选择可以特别有用。
在一些实施方案中,过程步骤还包括如使用可以进行基于亲和力的选择的系统或设备对孵育的细胞进行阴性和/或阳性选择。在一些实施方案中,通过以下方式进行分离:通过阳性选择富集特定细胞群,或通过阴性选择耗尽特定细胞群。在一些实施方案中,阳性或阴性选择通过将细胞与一种或多种抗体或其他结合剂一起孵育来完成,所述一种或多种抗体或其他结合剂与分别在阳性或阴性选择的细胞上表达(标记+)或以相对较高水平表达(标记高)的一种或多种表面标记特异性结合。
分离无需导致特定细胞群或表达特定标记的细胞的100%富集或去除。例如,针对特定类型的细胞(如表达标记的那些)的阳性选择或富集是指增加此类细胞的数量或百分比,但不需要导致不表达所述标记的细胞的完全不存在。同样,特定类型的细胞(如表达标记的那些)的阴性选择、去除或耗尽是指减少此类细胞的数量或百分比,但不需要导致所有此类细胞的完全去除。
在一些例子中,进行多轮分离步骤,其中使来自一个步骤的阳性或阴性选择的级分经历另一分离步骤,如后续阳性或阴性选择。在一些例子中,单一分离步骤可以同时耗尽表达多种标记的细胞,如通过将细胞与多种抗体或结合配偶体(每种抗体或结合配偶体对被靶向用于阴性选择的标记具有特异性)一起孵育。同样,通过将细胞与在各种细胞类型上表达的多种抗体或结合配偶体一起孵育,可以同时对多个细胞类型进行阳性选择。在某些实施方案中,将分离步骤重复和/或进行超过一次,其中使来自一个步骤的阳性或阴性选择级分经历相同的分离步骤,例如重复的阳性或阴性选择。在一些例子中,将单一分离步骤重复和/或进行超过一次,例如以增加所选择的细胞的纯度和/或以进一步从阴性选择的级分中去除和/或耗尽阴性选择的细胞。在某些实施方案中,将一个或多个分离步骤进行两次、三次、四次、五次、六次、七次、八次、九次、十次或超过十次。在某些实施方案中,将一个或多个选择步骤进行和/或重复一次与十次之间、一次与五次之间或三次与五次之间。
例如,在一些方面,通过阳性或阴性选择技术分离t细胞的特定亚群,如对一种或多种表面标记呈阳性或高水平表达的所述表面标记的细胞,例如,cd3+、cd4+、cd8+或cd57+t细胞。在一些实施方案中,通过与特异性结合此类标记的一种或多种抗体或结合配偶体一起孵育来选择此类细胞。在一些实施方案中,所述抗体或结合配偶体可以与固体支持物或基质(如磁珠或顺磁珠)缀合(如直接或间接地)以实现选择。例如,在一些实施方案中,可以用cd4微珠、cd8微珠或cd57微珠(miltenylbiotec)选择(例如,阳性选择)cd4+t细胞、cd8+t细胞或cd57+t细胞。例如,在一些实施方案中,可以用cd3微珠(miltenylbiotec)选择(例如,阳性选择)cd3+t细胞。
在某些实施方案中,通过对cd57表达呈阳性的细胞的阴性选择从pbmc样品分离cd57-细胞。在各种实施方案中,通过在非t细胞(如b细胞、单核细胞或其他白细胞)上表达的标记(如cd14)的阴性选择,从pbmc样品分离t细胞。在一些方面,使用cd3+选择步骤分离t细胞与非t细胞。可以通过针对cd4+或cd8+和/或在一种或多种幼稚样、记忆和/或效应t细胞亚群上表达或以相对较高的程度表达的标记进行阳性或阴性选择,将这个cd3+群体进一步分选为多个亚群。在一些方面,使用cd4+或cd8+选择步骤分离cd4+辅助t细胞与cd8+细胞毒性t细胞。可以通过针对在一种或多种幼稚样、记忆和/或效应t细胞亚群上表达或以相对较高程度表达的标记进行阳性或阴性选择,将此类cd4+和cd8+群体进一步分选为多个亚群。
在一些实施方案中,如通过基于cd57的表面表达进行阳性或阴性选择,进一步富集或耗尽cd8+细胞中的cd57-t细胞。在某些实施方案中,如通过基于cd57的表面表达进行阳性或阴性选择,进一步富集或耗尽cd4+细胞中的cd57-t细胞。在某些实施方案中,如通过基于cd57的表面表达进行阳性或阴性选择,进一步富集或耗尽cd3+细胞中的cd57-t细胞。
在一些实施方案中,如通过基于与相应亚群相关的表面抗原进行阳性或阴性选择,进一步富集或耗尽cd8+细胞中的幼稚、中枢记忆、效应记忆和/或中枢记忆干细胞。在一些实施方案中,进行中枢记忆t(tcm)细胞的富集以增加功效,如以改进施用后的长期存活、扩增和/或移植物植入,这在一些方面在此类亚群中特别稳健。参见terakura等人,(2012)blood.1:72-82;wang等人(2012)jimmunother.35(9):689-701。在一些实施方案中,组合富集tcm的cd8+t细胞与cd4+t细胞进一步增强功效。
在一些方面,将用于制备cd8+细胞群或亚群的基于cd4表达的相同选择步骤也用于生成cd4+细胞群或亚群,使得来自基于cd4的分离的阳性和阴性级分二者都被保留并用于所述方法的后续步骤中,任选地在一个或多个其他阳性或阴性选择步骤之后。在一些实施方案中,对cd4+细胞群的选择和对cd8+细胞群的选择同时进行。在一些实施方案中,对cd4+细胞群的选择和对cd8+细胞群的选择以任一顺序依次进行。在一些实施方案中,用于选择细胞的方法可以包括公开的美国申请号us20170037369中所述的那些。在一些实施方案中,可以在选择之后组合所选择的cd4+细胞群和所选择的cd8+细胞群。在一些方面,可以将所选择的cd4+细胞群和所选择的cd8+细胞群在如本文所述的生物反应器袋中组合。
在各种实施方案中,使生物样品(例如,pbmc或其他白细胞的样品)经历cd57+t细胞的选择,其中保留含有富集的cd57-细胞的阴性级分。在一些实施方案中,使富含cd57-细胞的阴性级分经历cd3+t细胞的选择,其中保留阳性级分。在某些实施方案中,从富含cd57-细胞的阴性级分选择cd8+t细胞。在一些实施方案中,使富含cd57-细胞的阴性级分经历cd8+t细胞的选择,其中保留阴性和阳性级分二者。在某些实施方案中,从阴性级分选择cd4+t细胞。在特定实施方案中,使富含cd57-细胞的阴性级分经历cd4+t细胞的选择,其中保留阴性和阳性级分二者。在某些实施方案中,从阴性级分选择cd8+t细胞。
在一些方面,将要分离的孵育的细胞样品或群体与含有小的可磁化或磁响应材料(如磁响应颗粒或微粒,如顺磁珠(例如,如dynabeads或
在一些实施方案中,磁粒或磁珠包含与特异性结合成员(如抗体或其他结合配偶体)结合的磁响应材料。用于磁分离方法中的许多熟知的磁响应材料是已知的,例如molday,美国专利号4,452,773和欧洲专利说明书ep452342b中所述的那些,所述专利通过引用特此并入。也可以使用胶体大小的颗粒,如在owen的美国专利号4,795,698和liberti等人的美国专利号5,200,084中所述的那些。
通常在如下条件下进行孵育,借此附着至磁粒或磁珠的抗体或结合配偶体或者与此类抗体或结合配偶体特异性结合的分子(如二抗或其他试剂)与样品内细胞上的细胞表面分子(如果存在)特异性结合。
在某些实施方案中,将磁响应颗粒包被在一抗或其他结合配偶体、二抗、凝集素、酶或链霉亲和素中。在某些实施方案中,磁粒经由对一种或多种标记具有特异性的一抗的包被而附着至细胞。在某些实施方案中,用一抗或结合配偶体标记细胞而不是珠,然后添加细胞类型特异性二抗或其他结合配偶体(例如,链霉亲和素)包被的磁粒。在某些实施方案中,链霉亲和素包被的磁粒是与生物素化的一抗或二抗结合使用。
在一些方面,在如下程序中实现分离:其中将样品置于磁场中,并且其上附着有磁响应或可磁化颗粒的那些细胞将被吸引至磁体并与未标记的细胞分离。对于阳性选择,保留被吸引至磁体的细胞;对于阴性选择,保留未被吸引的细胞(未标记的细胞)。在一些方面,在同一选择步骤期间进行阳性与阴性选择的组合,其中保留阳性和阴性级分并将其进一步处理或使其经历进一步分离步骤。
在一些实施方案中,基于亲和力的选择是经由磁激活细胞分选(macs)(miltenyibiotech,加利福尼亚州奥本)进行的。磁激活细胞分选(macs)(例如,clinimacs系统)能够对其上附着有磁化颗粒的细胞进行高纯度选择。在某些实施方案中,macs以如下模式操作,其中在施加外部磁场后依序洗脱非靶种类和靶种类。也就是说,附着至磁化颗粒的细胞被保持在适当的位置,而未附着的种类被洗脱。然后,在完成这个第一洗脱步骤后,以某种方式释放被捕获在磁场中并被阻止洗脱的种类,使得它们可以被洗脱和回收。在某些实施方案中,标记非靶细胞并将其从异质性细胞群中耗尽。在各种实施方案中,选择剂是cd3、cd4、cd8或cd57
在一些实施方案中,亲和试剂的次最佳产率浓度是低于在给定选择或富集中实现所结合细胞的最佳或最大产率所使用或需要的浓度的浓度,所述选择或富集涉及将细胞与所述试剂一起孵育以及回收或分离已经与所述试剂结合的细胞(例如,“产率”是与孵育中被所述试剂靶向、或者所述试剂对其具有特异性、或者具有所述试剂有特异性并且能够结合的标记的细胞的总数量相比,如此回收或选择的细胞的数量)。次最佳产率浓度通常是在这个过程或步骤中,在回收已经与所述试剂结合的细胞后,实现所结合细胞(例如,cd57+、cd4+或cd8+t细胞)的少于全部(例如,不超过70%)产率的所述试剂的浓度或量。在一些实施方案中,次最佳产率浓度通常是在这个过程或步骤中,在回收已经与所述试剂结合的细胞后,实现所结合细胞(例如,cd3+t细胞)的少于全部(例如,不超过70%)产率的所述试剂的浓度或量。在一些实施方案中,不超过或不超过约50%、45%、40%、30%或25%产率是通过亲和试剂的次最佳浓度来实现。所述浓度可以根据每个细胞的颗粒或表面的数量或质量和/或每个细胞的药剂(例如,抗体,如抗体片段)的质量数或分子数来表示。
在一些实施方案中,例如,当以具有对cd57+、cd4+或cd8+t细胞的亲和力的两种或更多种选择试剂中的每一种或者一或多种的次最佳产率浓度操作时,此类试剂中的一种或多种是以高于一种或多种其他此类试剂的浓度来使用,以使该试剂所识别的细胞类型如与其他一种或多种试剂所识别的一种或多种细胞类型相比的比率有所偏向。在一些实施方案中,例如,当以具有对cd57+、cd3+、cd4+或cd8+t细胞的亲和力的两种或更多种选择试剂中的每一种或者一或多种的次最佳产率浓度操作时,此类试剂中的一种或多种是以高于一种或多种其他此类试剂的浓度来使用,以使该试剂所识别的细胞类型如与其他一种或多种试剂所识别的一种或多种细胞类型相比的比率有所偏向。例如,与一种或多种其他药剂相比,与期望针对其来偏向所述比率的标记特异性结合的试剂被包括的浓度(例如,每个细胞的药剂或质量)可以增加一半、1倍、2倍、3倍、4倍、5倍、10倍或更多,取决于期望以多大程度增加所述比率。在一些实施方案中,当在次最佳范围内和/或用足以实现试剂饱和的细胞操作时,免疫亲和试剂的量与富集的细胞的近似产率成比例。在某些实施方案中,可以按常规方式确定免疫亲和试剂的适当量或浓度,其取决于含有富集的或选择的细胞(例如,cd57-、cd4+或cd8+t细胞)的所生成群体的所需比率。在某些实施方案中,可以按常规方式确定免疫亲和试剂的适当量或浓度,其取决于含有富集的或选择的细胞(例如,cd3+t细胞)的所生成群体的所需比率。
在一些实施方案中,使用磁珠进行分开和/或分离步骤,在所述磁珠中免疫亲和试剂如通过与链霉亲和素突变蛋白的肽配体相互作用被可逆地结合,如wo2015/164675中所述。此类磁珠的示例是
在一些实施方案中,磁响应颗粒保持附着至细胞,所述细胞随后被孵育、培养和/或工程化;在一些方面,颗粒保持附着至用于施用至患者的细胞。在一些实施方案中,从细胞中去除可磁化或磁响应颗粒。用于从细胞中去除可磁化颗粒的方法是已知的,并且包括例如使用竞争性非标记抗体、与可切割接头缀合的可磁化颗粒或抗体等。在一些实施方案中,可磁化颗粒是可生物降解的。
在一些实施方案中,所述分离和/或选择得到富集的t细胞(例如,cd57-t细胞、cd3+t细胞、cd4+t细胞和/或cd8+t细胞)的一个或多个群体。在一些实施方案中,从单一生物样品分离、选择、富集或获得富集的t细胞的两个或更多个单独群体。在一些实施方案中,从自同一受试者收集、获取和/或获得的单独生物样品分离、选择、富集和/或获得单独群体。
在某些实施方案中,所述分离和/或选择得到富集的t细胞的一个或多个群体,所述群体包括至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%、至少99.9%或者为或为约100%cd57-cd3+t细胞。在特定实施方案中,富集的t细胞的群体基本上由cd57-cd3+t细胞组成。
在某些实施方案中,所述分离和/或富集得到富集的cd4+t细胞的群体,所述群体包括至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%、至少99.9%或者为或为约100%cd57-cd4+t细胞。在某些实施方案中,cd4+t细胞的输入组合物包括小于40%、小于35%、小于30%、小于25%、小于20%、小于15%、小于10%、小于5%、小于1%、小于0.1%或小于0.01%cd8+t细胞,和/或不含cd8+t细胞,和/或不含或基本上不含cd8+t细胞。在一些实施方案中,富集的t细胞的群体基本上由cd57-cd4+t细胞组成。
在某些实施方案中,所述分离和/或富集得到富集的cd57-cd8+t细胞的群体,所述群体包括至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%、至少99.9%或者为或为约100%cd57-cd8+t细胞。在某些实施方案中,cd8+t细胞的群体含有小于40%、小于35%、小于30%、小于25%、小于20%、小于15%、小于10%、小于5%、小于1%、小于0.1%或小于0.01%的cd4+t细胞,和/或不含cd4+t细胞,和/或不含或基本上不含cd4+t细胞。在一些实施方案中,富集的t细胞的群体基本上由cd57-cd8+t细胞组成。
c.通过色谱进行细胞选择
在本文提供的方法的多个方面,样品的细胞(例如,t细胞)是通过色谱分离,如通过柱色谱(包括亲和色谱或凝胶渗透色谱)来选择。在一些实施方案中,细胞(例如,cd57-t细胞)是通过色谱分离,如通过柱色谱(包括亲和色谱或凝胶渗透色谱)来分离、选择或富集。在一些实施方案中,所述方法采用受体结合试剂,所述受体结合试剂与位于靶细胞表面上的受体分子(例如,cd57)结合,所述靶细胞如要分离、选择或富集的细胞(例如,cd57+细胞)。此类方法可被描述为(无痕)细胞亲和色谱技术(catch),并且可以包括pct申请号wo2013124474和wo2015164675中所述的任何方法或技术,所述申请通过引用以其整体特此并入。在特定实施方案中,通过色谱分离对cd57+细胞进行阴性选择。
在一些实施方案中,靶细胞(例如,cd57+细胞)在细胞表面上具有或表达受体分子,使得通过至少一种常见特异性受体分子(例如,cd57)的存在来限定要分离、选择或富集的细胞。在一些实施方案中,含有靶细胞的样品也可以含有缺乏所述受体分子的另外的细胞。例如,在一些实施方案中,从含有多个细胞类型(例如,红细胞或b细胞)的样品分离、富集和/或选择t细胞。在某些实施方案中,从含有多个细胞类型(例如,红细胞或b细胞)的样品分离、富集和/或选择cd57+细胞,从而提供分离的cd57+细胞和未选择的细胞群,例如,富集的cd57-t细胞的群体。
在一些实施方案中,受体结合试剂包含在色谱柱中,例如,与色谱基质(例如,固定相)直接或间接结合。在一些实施方案中,在将样品添加至柱时,受体结合试剂存在于色谱基质(例如,固定相)上。在一些实施方案中,受体结合试剂能够经由试剂(例如,如本文所述的亲和试剂)与色谱基质(例如,固定相)间接结合。在一些实施方案中,亲和试剂与柱的固定相共价或非共价结合。在一些实施方案中,亲和试剂可逆固定在色谱基质(例如,固定相)上。在一些情况下,亲和试剂经由共价键固定在色谱基质(例如,固定相)上。在一些方面,亲和试剂非共价地可逆固定在色谱基质(例如,固定相)上。
在一些实施方案中,在将样品添加至色谱柱(例如,固定相)时,受体结合试剂可以存在(例如,直接结合(例如,共价或非共价)或经由亲和试剂间接结合)于色谱基质(例如,固定相)上。因此,在添加样品后,靶细胞可以由受体结合试剂结合并固定在柱的色谱基质(例如,固定相)上。可替代地,在一些实施方案中,可以将受体结合试剂添加至样品。以这种方式,受体结合试剂与样品中的靶细胞(例如,t细胞)结合,然后可以将样品添加至包含亲和试剂的色谱基质(例如,固定相),其中已经与靶细胞结合的受体结合试剂与亲和试剂结合,从而将靶细胞固定在色谱基质(例如,固定相)上。在一些实施方案中,例如如本文所述,受体结合试剂经由包含于受体结合试剂中的如本文所述的结合配偶体c与如本文所述的亲和试剂结合。
在一些方面,将受体结合试剂添加至样品。在某些实施方案中,受体结合试剂具有结合位点b,所述结合位点b与细胞(例如,靶细胞)表面上的受体分子特异性结合。在一些方面,受体结合试剂还包括结合配偶体c,所述结合配偶体c可以与亲和试剂的结合位点z特异性地可逆地结合。例如,在某些方面,将结合至并识别cd57的受体结合试剂添加至样品,所述受体结合试剂在结合位点b与对cd57表达呈阳性的细胞表面上的cd57结合。
在某些方面,亲和试剂还可以含有可以被结合配偶体c结合的两个或更多个结合位点z,从而提供受体结合试剂的多聚化。本文所用的该亲和试剂因此也可以是多聚化试剂。亲和试剂可以例如是链霉亲和素、链霉亲和素突变蛋白、抗生物素蛋白、抗生物素蛋白突变蛋白或其混合物。在一些方面,不同色谱基质与不同亲和试剂偶联,并且可以在柱中分层,从而形成用于分离的多组分系统。
在一些实施方案中,两种或更多种受体结合试剂如经由所述亲和试剂上存在的一个或多个结合位点z与亲和试剂缔合,如可逆或不可逆地结合。在一些情况下,这导致受体结合试剂彼此靠近排列,使得如果使具有(至少两个拷贝的)细胞表面分子(例如,选择标记)的靶细胞与能够结合特定分子(例如,选择标记)的受体结合试剂接触,则可以发生亲合力效应。
在一些实施方案中,相同(即具有相同选择标记结合特异性)的两种或更多种不同的受体结合试剂可以与亲和试剂可逆地结合。在一些实施方案中,可以使用至少两种不同的受体结合试剂,并且在一些情况下,可以使用三种或四种不同的受体结合试剂,所述受体结合试剂与不同的选择标记结合。在一些方面,至少两种受体结合试剂中的每一种可以与不同分子(例如,选择标记)结合,如第一分子、第二分子等。在一些情况下,不同分子(例如,选择标记,如细胞表面分子)可以存在于相同靶细胞上。在其他情况下,不同分子(例如,选择标记,如细胞表面分子)可以存在于同一细胞群中存在的不同靶细胞上。在一些情况下,第三、第四等受体结合试剂可以与相同试剂缔合,每种受体结合试剂含有另一不同的结合位点。
在一些实施方案中,两种或更多种不同的受体结合试剂含有相同的结合配偶体c。在一些实施方案中,两种或更多种不同的受体结合试剂含有不同的结合配偶体。在一些方面,第一受体结合试剂可以具有结合配偶体c1,所述结合配偶体c1可以与亲和试剂上存在的结合位点z1特异性结合,并且第二受体结合试剂可以具有结合配偶体c2,所述结合配偶体c2可以与亲和试剂上存在的结合位点z1或结合位点z2特异性结合。因此,在一些情况下,亲和试剂包含的多个结合位点z包括结合位点z1和z2,它们分别能够与受体结合试剂包含的结合配偶体c1和c2可逆地结合。在一些实施方案中,c1和c2是相同的,和/或z1和z2是相同的。在其他方面,多个结合位点z中的一个或多个可以是不同的。在其他情况下,多个结合配偶体c中的一个或多个可以是不同的。熟练的技术人员可以熟练地选择与含有结合位点z的亲和试剂相容的不同结合配偶体c的任何组合,只要每个结合配偶体c能够与结合位点z之一相互作用(如特异性结合)。
在某些实施方案中,将样品(例如,含有细胞的样品)和受体结合试剂(例如抗体)加载至含有附着或固定的亲和试剂(例如结合试剂)的色谱基质上或与所述色谱基质接触。在特定方面,亲和试剂具有多个结合位点z,所述结合位点z与受体结合试剂的结合配偶体c特异性结合。在某些方面,受体结合试剂通过结合配偶体c与结合位点z之间的相互作用与亲和试剂结合。因此,在一些实施方案中,细胞(例如,靶细胞)通过由亲和试剂的一个或多个结合位点z和受体结合试剂的结合位点z形成的复合物固定在色谱基质上。在其他方面,可以从样品耗尽细胞(例如,靶细胞),如通过从色谱基质冲洗、释放或洗涤剩余样品来进行。在特定方面,受体结合试剂可以包括在含有细胞的样品中,或者可以将其施加至色谱基质或与色谱基质接触用于与附着的亲和或多聚化试剂结合,如在将样品添加至色谱基质之前。
在一些实施方案中,例如通过阴性选择,使用色谱基质从样品去除或分离靶细胞。例如,在某些实施方案中,将含有cd57+细胞和cd57-细胞的样品与结合至和/或识别cd57的受体结合试剂接触或一起孵育。在某些实施方案中,将样品和受体结合试剂加载至基质上,其中,在一些方面,由固定或附着的亲和试剂、受体结合试剂和cd57+t细胞形成复合物。在一些实施方案中,从色谱基质去除或冲洗未结合的细胞,从而去除结合的cd57+细胞并提供富集cd57-细胞的样品(例如,群体)。
在某些实施方案中,例如通过阳性选择,使用色谱基质从样品分离、选择或富集靶细胞。例如,在一些实施方案中,将含有cd4+或cd8+t细胞和其他细胞(例如,非t细胞免疫细胞)的样品与结合至和/或识别cd4或cd8的受体结合试剂接触或一起孵育。在某些实施方案中,将样品和受体结合试剂加载至基质上,其中,在一些方面,由固定或附着的亲和试剂、受体结合试剂和cd4+或cd8+t细胞形成复合物。在某些实施方案中,从色谱基质去除或冲洗未结合的细胞。在特定实施方案中,可以通过添加竞争试剂,如通过破坏复合物,来去除或释放固定的cd4+或cd8+细胞。在一些方面,分离、释放或洗脱的cd4+或cd8+t细胞因此是富集cd4+或cd8+t细胞的细胞样品、组合物或群体。
在某些实施方案中,例如通过阳性选择,使用色谱基质从样品分离、选择或富集靶细胞。例如,在一些实施方案中,将含有cd3+t细胞和其他细胞(例如,非t细胞免疫细胞)的样品与结合至和/或识别cd3的受体结合试剂接触或一起孵育。在某些实施方案中,将样品和受体结合试剂加载至基质上,其中,在一些方面,由固定或附着的亲和试剂、受体结合试剂和cd3+t细胞形成复合物。在某些实施方案中,从色谱基质去除或冲洗未结合的细胞。在特定实施方案中,可以通过添加竞争试剂,如通过破坏复合物,来去除或释放固定的cd3+细胞。在一些方面,分离、释放或洗脱的cd3+t细胞因此是富集cd3+t细胞的细胞样品、组合物或群体。
在一些方面,将竞争试剂加载至色谱柱上。在一些实施方案中,在结合配偶体c与结合位点z之间形成的可逆键可以被竞争试剂破坏。在特定实施方案中,竞争试剂具有结合位点,所述结合位点能够与亲和试剂的结合位点z结合。在一些实施方案中,竞争试剂可以是能够与结合配偶体c竞争结合一个或多个结合位点z的生物素、生物素衍生物或类似物或者链霉亲和素结合肽。在某些实施方案中,竞争试剂与亲和试剂形成复合物,并由此固定在色谱基质上。在一些实施方案中,结合配偶体c和竞争试剂是不同的,并且与结合配偶体的亲和力相比,竞争试剂展现对一个或多个结合位点z的更高结合亲和力。在本文提供的任何方法的特定方面,使靶细胞(例如,t细胞)从色谱基质(例如,固定相)脱附不需要将竞争试剂添加至色谱柱的固定相以破坏选择剂(例如,受体结合剂)与亲和试剂的结合。
作为该竞争性结合的结果,受体结合试剂与亲和试剂之间在结合配偶体c和结合位点z的结合被置换。在特定实施方案中,将竞争试剂添加或加载至具有附着的复合物(其含有亲和试剂、受体结合试剂和细胞(例如,靶细胞))的色谱基质,将所述细胞从色谱基质洗脱。在一些方面,受体结合试剂在结合位点b处对细胞的受体分子具有低亲和力,使得受体结合试剂在竞争试剂的存在下从细胞解离。因此,在一些实施方案中,从不含或基本上不含结合的受体结合分子的色谱基质洗脱细胞,例如靶细胞。
在一些实施方案中,从第一色谱柱的洗脱物收集洗脱样品,其包括细胞(例如,靶细胞)、竞争试剂和受体结合试剂。在某些实施方案中,将洗脱样品加载至第二色谱柱上,所述第二色谱柱具有合适的固定相,所述固定相既是亲和色谱基质,同时也可以用作凝胶渗透基质。在特定实施方案中,所述亲和色谱基质上固定有亲和试剂。在一些方面,受体结合试剂和竞争试剂结合至亲和试剂上的结合位点z,并由此固定在色谱基质上。因此,在某些方面,含有分离的靶细胞的洗脱样品耗尽了受体结合试剂和竞争试剂。因此,在一些方面,不含任何反应物的靶细胞现在处于用于进一步使用的条件中,例如,用于通过本文所述的任何方法进行处理。
在一些实施方案中,可以从样品耗尽样品的细胞(例如,靶细胞),如通过从色谱基质(例如,固定相)冲洗、释放或洗涤剩余样品来进行。在一些实施方案中,使用一个或多个(例如,2、3、4、5、6)个洗涤步骤从色谱基质(例如,固定相)去除未结合的细胞和碎片。在一些实施方案中,进行至少两个洗涤步骤。在一些实施方案中,在进行一个或多个洗涤步骤之前,允许样品将基质渗透至少或约5、10、15、16、20、25、30、35、40、45、50、55、60、70、80、90、100或120分钟。在一些实施方案中,在将样品添加至色谱柱(例如,固定相)之后为、约或至少5、10、15、20、25、30、35、40、45、50、55、60、70、80、90、100或120分钟,进行洗涤步骤。在一些实施方案中,在将样品添加至色谱柱(例如,固定相)之后为、约或至少5、10、15、20、25、30、35、40、45、50、55或60分钟,进行洗涤步骤。在一些实施方案中,在将样品添加至色谱柱(例如,固定相)之后在或在约120、100、90、80、70、60、55、50、45、40、35、30、25、20、15、10或5分钟内,进行一个或多个洗涤步骤。在一些实施方案中,在将样品添加至色谱柱(例如,固定相)之后在或在约60、55、50、45、40、35、30、25、20、15、10或5分钟内,进行一个或多个洗涤步骤。在一些实施方案中,在将样品添加至色谱柱(例如,固定相)之后在或在约5至60分钟内,进行一个或多个洗涤步骤。在一些实施方案中,在将样品添加至色谱柱(例如,固定相)之后在或在约5至50分钟内,进行一个或多个洗涤步骤。在一些实施方案中,在将样品添加至色谱柱(例如,固定相)之后在或在约5至40分钟内,进行一个或多个洗涤步骤。在一些实施方案中,在将样品添加至色谱柱(例如,固定相)之后在或在约5至30分钟内,进行一个或多个洗涤步骤。在一些实施方案中,在将样品添加至色谱柱(例如,固定相)之后在或在约5至20分钟内,进行一个或多个洗涤步骤。在一些实施方案中,在将样品添加至色谱柱(例如,固定相)之后在或在约5至10分钟内,进行一个或多个洗涤步骤。在一些实施方案中,在将样品添加至色谱柱(例如,固定相)之后在或在约10至60分钟内,进行一个或多个洗涤步骤。在一些实施方案中,在将样品添加至色谱柱(例如,固定相)之后在或在约20至60分钟内,进行一个或多个洗涤步骤。在一些实施方案中,在将样品添加至色谱柱(例如,固定相)之后在或在约30至60分钟内,进行一个或多个洗涤步骤。在一些实施方案中,在将样品添加至色谱柱(例如,固定相)之后在或在约40至60分钟内,进行一个或多个洗涤步骤。在一些实施方案中,在将样品添加至色谱柱(例如,固定相)之后在或在约50至60分钟内,进行一个或多个洗涤步骤。
在一些实施方案中,进行多轮细胞选择步骤,其中使来自一个步骤的阳性或阴性选择的级分经历另一选择步骤,如后续阳性或阴性选择。在某些实施方案中,用于选择、分离和富集的方法、技术和试剂描述于例如pct申请号wo2015164675中,所述申请通过引用以其整体特此并入。
在一些实施方案中,可以使用单一选择步骤从样品分离靶细胞(例如,cd57-t细胞)。在一些实施方案中,单一选择步骤可以在单一色谱柱上进行。在一些例子中,单一选择步骤可以同时耗尽表达多种标记的细胞。同样,可以同时对多种细胞类型进行阳性选择。在某些实施方案中,将选择步骤重复进行和/或进行多于一次,其中使来自一个步骤的阳性或阴性选择的级分经历相同的选择步骤,如重复的阳性或阴性选择。在一些例子中,将单一选择步骤重复进行和/或进行多于一次,例如以增加所选细胞的纯度和/或从阴性选择的级分进一步去除和/或耗尽阴性选择的细胞。在某些实施方案中,将一个或多个选择步骤进行两次、三次、四次、五次、六次、七次、八次、九次、十次或超过十次。在某些实施方案中,将一个或多个选择步骤进行和/或重复一次与十次之间、一次与五次之间或三次与五次之间。在一些实施方案中,进行两个选择步骤。
细胞选择可以使用一个或多个色谱柱来进行。在一些实施方案中,一个或多个色谱柱包括在封闭系统中。在一些实施方案中,所述封闭系统是自动化封闭系统,例如需要最少或不需要用户(例如,人)输入。在一些实施方案中,细胞选择是依序进行(例如,顺序选择技术)。在一些实施方案中,一个或多个色谱柱是顺序排列。例如,第一柱的定向可以使得可以例如经由连接管道将所述柱的输出(例如,洗脱液)进给至第二色谱柱。在一些实施方案中,多个色谱柱可以顺序排列。在一些实施方案中,细胞选择可以通过进行连续阳性和阴性选择步骤来实现,后一步骤使来自前一步骤的阴性和/或阳性级分经历进一步选择,其中整个过程在同一管或管道组中进行。
在一些实施方案中,使含有靶细胞的样品经历顺序选择,其中实现第一选择以富集cd4+或cd8+群体中的一种,并且使用来自第一选择的未选择细胞作为第二选择的细胞来源,用于富集cd4+或cd8+群体中的另一种。在一些实施方案中,可以实现一次或多次进一步选择以富集cd4+或cd8+群体中的一种或两种的亚群,例如,中枢记忆t(tcm)细胞、幼稚t细胞和/或对一种或多种表面标记(例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+)呈阳性或高水平表达的细胞。在一些实施方案中,使含有靶细胞的样品经历顺序选择,其中实现第一选择以富集cd3+群体,并且使用所选细胞作为第二选择的细胞来源,用于富集cd3+群体。在一些实施方案中,使含有靶细胞的样品经历顺序选择,其中实现第一选择以在第一固定相上(例如,在第一色谱柱中)富集cd3+群体,并且使用含有未结合细胞的流出物作为第二选择的细胞来源,以在第二固定相上(例如,在第二色谱柱中)富集cd3+群体,其中第一和第二固定相顺序排列。在一些实施方案中,可以实现一次或多次进一步选择以富集cd3+群体的亚群,例如,中枢记忆t(tcm)细胞、幼稚t细胞和/或对一种或多种表面标记(例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+)呈阳性或高水平表达的细胞。在一些实施方案中,使含有靶细胞的样品经历顺序选择,其中实现第一选择以富集cd3+群体,并且使用所选细胞作为第二选择的细胞来源,以富集cd4+群体。在一些实施方案中,可以实现一次或多次进一步选择以富集cd3+cd4+群体的亚群,例如,中枢记忆t(tcm)细胞、幼稚t细胞和/或对一种或多种表面标记(例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+)呈阳性或高水平表达的细胞。在一些实施方案中,使含有靶细胞的样品经历顺序选择,其中实现第一选择以富集cd3+群体,并且使用所选细胞作为第二选择的细胞来源,以富集cd8+群体。在一些实施方案中,可以实现一次或多次进一步选择以富集cd3+cd8+群体的亚群,例如,中枢记忆t(tcm)细胞、幼稚t细胞和/或对一种或多种表面标记(例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+)呈阳性或高水平表达的细胞。考虑到在一些方面,通过阳性或阴性顺序选择技术选择t细胞的特定亚群(例如,cd3+细胞),如对一种或多种表面标记呈阳性或高水平表达的细胞,例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+t细胞。
在一些实施方案中,使含有靶细胞的样品经历顺序选择,其中实现第一选择以富集cd57-群体,并且使用所选细胞作为第二选择的细胞来源,用于富集cd3+群体。在一些实施方案中,使含有靶细胞的样品经历顺序选择,其中实现第一选择以在第一固定相上(例如,在第一色谱柱中)富集cd57-群体,并且使用含有未结合细胞的流出物作为第二选择的细胞来源,以在第二固定相上(例如,在第二色谱柱中)富集cd3+群体,其中第一和第二固定相顺序排列。在一些实施方案中,可以实现一次或多次进一步选择以富集cd57-群体的亚群,例如,中枢记忆t(tcm)细胞、幼稚t细胞和/或对一种或多种表面标记(例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+)呈阳性或高水平表达的细胞。在一些实施方案中,使含有靶细胞的样品经历顺序选择,其中实现第一选择以富集cd57-群体,并且使用所选细胞作为第二选择的细胞来源,用于富集cd3+群体。在一些实施方案中,可以实现一次或多次进一步选择以富集cd57-cd3+群体的亚群,例如,中枢记忆t(tcm)细胞、幼稚t细胞和/或对一种或多种表面标记(例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+)呈阳性或高水平表达的细胞。考虑到在一些方面,通过阳性或阴性顺序选择技术选择t细胞的特定亚群(例如,cd57-细胞),如对一种或多种表面标记呈阳性或高水平表达的细胞,例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+t细胞。
在一些实施方案中,使含有靶细胞的样品经历顺序选择,其中实现第一选择以富集cd3+群体,并且使用所选细胞作为第二选择的细胞来源,用于富集cd57-群体。在一些实施方案中,使含有靶细胞的样品经历顺序选择,其中实现第一选择以在第一固定相上(例如,在第一色谱柱中)富集cd3+群体,并且使用含有未结合细胞的流出物作为第二选择的细胞来源,以在第二固定相上(例如,在第二色谱柱中)富集c57-群体,其中第一和第二固定相顺序排列。在一些实施方案中,可以实现一次或多次进一步选择以富集cd3+群体的亚群,例如,中枢记忆t(tcm)细胞、幼稚t细胞和/或对一种或多种表面标记(例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+)呈阳性或高水平表达的细胞。在一些实施方案中,使含有靶细胞的样品经历顺序选择,其中实现第一选择以富集cd3+群体,并且使用所选细胞作为第二选择的细胞来源,用于富集cd57-群体。在一些实施方案中,可以实现一次或多次进一步选择以富集cd3+cd57-群体的亚群,例如,中枢记忆t(tcm)细胞、幼稚t细胞和/或对一种或多种表面标记(例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+)呈阳性或高水平表达的细胞。考虑到在一些方面,通过阳性或阴性顺序选择技术选择t细胞的特定亚群(例如,cd57-细胞),如对一种或多种表面标记呈阳性或高水平表达的细胞,例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+t细胞。
在一些实施方案中,平行进行细胞选择(例如,平行选择技术)。在一些实施方案中,一个或多个色谱柱是平行排列。例如,两个或更多个柱的排列可以使得将样品经由管道同时加载至两个或更多个柱上,所述管道允许将样品添加至每个柱,例如无需样品穿过第一柱。例如,使用平行选择技术,细胞选择可以通过例如在封闭系统中同时进行阳性和/或阴性选择步骤来实现,其中整个过程在同一管或管道组中进行。在一些实施方案中,使含有靶细胞的样品经历平行选择,其中将样品加载至两个或更多个色谱柱上,其中每个柱实现细胞群的选择。在一些实施方案中,两个或更多个色谱柱单独实现cd57-、cd3+、cd4+或cd8+群体的选择。在一些实施方案中,两个或更多个色谱柱(包括亲和色谱或凝胶渗透色谱)独立实现相同细胞群的选择。例如,两个或更多个色谱柱可以实现cd57-细胞的选择。在一些实施方案中,两个或更多个色谱柱(包括亲和色谱或凝胶渗透色谱)独立实现不同细胞群的选择。例如,两个或更多个色谱柱可以独立地实现cd57-细胞、cd4+细胞、cd3+和/或cd8+细胞的选择。在一些实施方案中,可以例如使用顺序选择技术实现一次或多次进一步选择,以富集经由平行选择而选择的一个或所有细胞群的亚群。例如,可以针对中枢记忆t(tcm)细胞、幼稚t细胞和/或对一种或多种表面标记(例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+)呈阳性或高水平表达的细胞,进一步选择所选细胞。在一些实施方案中,使含有靶细胞的样品经历平行选择,其中在两个或更多个柱上实现平行选择以富集cd57-群体。在一些实施方案中,可以实现一次或多次进一步选择以富集cd57-群体的亚群,例如,中枢记忆t(tcm)细胞、幼稚t细胞和/或对一种或多种表面标记(例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+)呈阳性或高水平表达的细胞。在一些实施方案中,使含有靶细胞的样品经历平行选择,其中在两个或更多个柱上独立地实现选择以富集cd57-群体和cd3+群体。在一些实施方案中,可以实现一次或多次进一步选择以富集cd57-和cd3+群体的亚群,例如,中枢记忆t(tcm)细胞、幼稚t细胞和/或对一种或多种表面标记(例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+)呈阳性或高水平表达的细胞。在一些实施方案中,使含有靶细胞的样品经历平行选择,其中在两个或更多个柱上独立地实现选择以富集cd57-群体和cd4+群体。在一些实施方案中,可以实现一次或多次进一步选择以富集cd57-和cd4+群体的亚群,例如,中枢记忆t(tcm)细胞、幼稚t细胞和/或对一种或多种表面标记(例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+)呈阳性或高水平表达的细胞。在一些实施方案中,使含有靶细胞的样品经历平行选择,其中实现平行选择以富集cd57-群体和cd8+群体。在一些实施方案中,可以实现一次或多次进一步选择以富集cd57-和cd8+群体的亚群,例如,中枢记忆t(tcm)细胞、幼稚t细胞和/或对一种或多种表面标记(例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+)呈阳性或高水平表达的细胞。在一些实施方案中,使含有靶细胞的样品经历平行选择,其中实现平行选择以富集cd4+群体和cd8+群体。在一些实施方案中,可以实现一次或多次进一步选择以富集cd4+和cd8+群体的亚群,例如,中枢记忆t(tcm)细胞、幼稚t细胞和/或对一种或多种表面标记(例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+)呈阳性或高水平表达的细胞。考虑到在一些方面,通过阳性或阴性平行选择技术来选择t细胞的特定亚群(例如,cd3+、cd4+、cd8+t细胞),如对一种或多种表面标记呈阳性或高水平表达的细胞,例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+t细胞。在一些实施方案中,顺序和平行选择技术可以组合使用。
在一些实施方案中,使用两个柱进行平行选择。在一些实施方案中,两个柱选择相同的细胞类型(例如,相同的选择标记)。在一些实施方案中,两个柱各自选择cd57-t细胞。
通常,固定相(例如,选择树脂)的结合能力影响需要多少固定相来选择某个数量的靶部分,例如,靶细胞,如t细胞。可以使用结合能力(例如,每ml固定相(例如,选择树脂)可以固定的靶细胞的数量)来确定或控制在一个或多个柱上捕获的靶细胞的数量。可以使用一个或多个色谱柱进行本文公开的柱上细胞选择和刺激。在使用多个柱时,它们可以依序、平行或以其合适的组合来排列。因此,可以使用固定相(例如,选择树脂)的结合能力来标准化单柱方法中的试剂量或多柱方法中每个柱的试剂量。
在一些实施方案中,本文所用固定相的结合容量是在将过量靶细胞加载至固定相上时,在给定溶剂和细胞浓度条件下,与固定相结合的靶细胞的最大数量。在一些实施方案中,结合容量是每ml固定相为或为约1亿±2500万个靶细胞(例如,t细胞)。在一些实施方案中,本文公开的固定相(例如,选择树脂)的静态结合容量的范围是每ml固定相在约7500万个靶细胞与约1.25亿个靶细胞之间。在一个方面,本文用于柱上细胞选择和刺激的固定相的结合能力是静态结合能力。在一些实施方案中,所述静态结合容量是例如在某些溶剂和细胞浓度条件下,能够固定在固定相上的最大细胞量。在一些实施方案中,本文公开的固定相(例如,选择树脂)的静态结合能力的范围是每ml固定相在约5000万个与约1亿个之间的靶细胞。在一些实施方案中,所述静态结合容量是每ml固定相为或为约1亿±2500万个靶细胞(例如,t细胞)。在一些实施方案中,本文公开的固定相(例如,选择树脂)的静态结合容量的范围是每ml固定相在约7500万个靶细胞与约1.25亿个靶细胞之间。在一些实施方案中,固定相(例如,选择树脂)的静态结合容量是每ml固定相在约1000万与约2000万之间、在约2000万与约3000万之间、在约3000万与约4000万之间、在约4000万与约5000万之间、在约5000万与约6000万之间、在约6000万与约7000万之间、在约7000万与约8000万之间、在约8000万与约9000万之间、在约9000万与约1亿之间、在约1亿1000万与约1亿2000万之间、在约1亿2000万与约1亿3000万之间、在约1亿3000万与约1亿4000万之间、在约1亿4000万与约1亿5000万之间、在约1亿5000万与约1亿6000万之间、在约1亿6000万与约1亿7000万之间、在约1亿7000万与约1亿8000万之间、在约1亿8000万与约1亿9000万之间、或在约1亿9000万与约2亿之间的靶细胞。
在一些实施方案中,本文所用固定相的结合容量是在未结合靶细胞发生显著穿透之前,在给定流动条件下,与固定相结合的靶细胞数量。在一个方面,本文用于柱上细胞选择的固定相的结合能力是动态结合能力,即,在样品施加期间,在填充色谱柱中,在操作条件下的结合能力。在一些实施方案中,动态结合能力是通过以下方式来确定:加载含有已知浓度的靶细胞的样品,并监测流出物,并且靶细胞将结合固定相至某个转折点(breakpoint),之后未结合靶细胞将流出柱。在一些实施方案中,动态结合容量是每ml固定相为或为约1亿±2500万个靶细胞(例如,t细胞)。在一些实施方案中,本文公开的固定相(例如,选择树脂)的动态结合容量是每ml固定相在或在约7500万个靶细胞与约1.25亿个靶细胞之间。在一些实施方案中,本文公开的固定相(例如,选择树脂)的动态结合能力的范围是每ml固定相在约5000万个与约1亿个之间的靶细胞。在一些实施方案中,固定相(例如,选择树脂)的动态结合能力是每ml固定相在约1000万与约2000万之间、在约2000万与约3000万之间、在约3000万与约4000万之间、在约4000万与约5000万之间、在约5000万与约6000万之间、在约6000万与约7000万之间、在约7000万与约8000万之间、在约8000万与约9000万之间、在约9000万与约1亿之间、在约1亿1000万与约1亿2000万之间、在约1亿2000万与约1亿3000万之间、在约1亿3000万与约1亿4000万之间、在约1亿4000万与约1亿5000万之间、在约1亿5000万与约1亿6000万之间、在约1亿6000万与约1亿7000万之间、在约1亿7000万与约1亿8000万之间、在约1亿8000万与约1亿9000万之间、或在约1亿9000万与约2亿之间的靶细胞。
在一些实施方案中,固定相是20ml。在一些实施方案中,固定相的结合容量为20亿±5亿个细胞。
通常,色谱是流体色谱,通常是液相色谱。在一些方面,色谱可以以流通模式进行,其中在柱的含有色谱基质的一端上例如通过重力流动或通过泵施加含有细胞(例如,靶细胞)的流体样品,并且其中流体样品在柱的另一端存在柱。另外,色谱可以以“上下(upanddown)”模式进行,其中在柱的含有填充在移液管尖端内的色谱基质的一端上例如通过移液管施加含有要分离的细胞的流体样品,并且其中流体样品在柱的另一端进入并存在色谱基质/移液管尖端。可替代地,色谱还可以以分批模式进行,其中将色谱材料(固定相)与含有细胞的样品例如在振荡、旋转或流体样品的重复接触和去除(例如,借助移液管)下一起孵育。
在一些方面,在本发明的背景下可以将任何材料用作色谱基质,只要所述材料适合于细胞的色谱分离。在特定方面,合适的色谱材料是至少无害的或基本上无害的,例如,当在用于细胞分离和/或细胞分开的所需条件下在填充色谱柱中使用时,对细胞活力无害。在一些方面,色谱基质保持在预定的部位中,通常在预定的位置中,而要分离的样品和其中包括的组分的定位处于改变中。因此,在一些方面,色谱基质是“固定相”。
通常,相应色谱基质具有固相或半固相的形式,而含有要分离/分开的靶细胞的样品是流体相。用于实现色谱分离的流动相同样是流体相。色谱基质可以是颗粒材料(具有任何合适的大小和形状)或整体色谱材料,包括纸衬底或膜(参照实施例章节)。因此,色谱可以是柱色谱以及平面色谱两者。除了标准色谱柱以外,允许双向流动或移液管尖端的柱可以用于如本文所述的细胞的基于柱/基于流通模式的色谱分离。因此,在一些情况下,可用于本发明方法中的色谱柱也包含微量移液枪头或允许双向流动的柱。在一些方面,使用颗粒基质材料,并且颗粒基质材料可以例如具有约5μm至约200μm、或约5μm至约400μm、或约5μm至约600μm的平均粒径。在一些方面,使用平面色谱,并且基质材料可以是适合于平面色谱的任何材料,如常规的基于纤维素的或基于有机聚合物的膜(例如,纸膜、硝酸纤维素膜或聚偏二氟乙烯(pvdf)膜)或二氧化硅涂布的玻璃板。在一个实施方案中,色谱基质/固定相是非磁性材料或不可磁化材料。
在一些方面,色谱基质/固定相是无磁性材料或不可磁化材料。这种材料可以包括衍生的二氧化硅或交联的凝胶。交联的凝胶(其通常以珠形式来制造)可以基于天然聚合物,如交联的多糖。多糖基质的例子包括但不限于琼脂糖凝胶(例如,可以以不同的珠尺寸和孔径商购获得的superflowtm琼脂糖或
在一些实施方案中,交联凝胶也可以基于合成聚合物,例如基于在自然界中不存在的聚合物类别。合适的例子包括但不限于琼脂糖凝胶或者一种或多种交联葡聚糖的凝胶。交联的凝胶也可以基于合成聚合物,即基于在自然界中不存在的聚合物类别。通常,用于细胞分离的色谱固定相所基于的这种合成聚合物是具有极性单体单元,且因此本身具有极性的聚合物。因此,在一些情况下,这样的极性聚合物是亲水性的。在一些方面,亲水性分子(也称为疏脂性)含有可以与水分子形成偶极-偶极相互作用的部分。通常,疏水性分子(也称为亲脂性)具有与水分离的倾向。
合适的合成聚合物的说明性例子是聚丙烯酰胺、苯乙烯-二乙烯基苯凝胶、以及丙烯酸酯和二醇的共聚物或丙烯酰胺和二醇的共聚物。说明性例子是聚甲基丙烯酸酯凝胶,可作为
在一些实施方案中,例如在用于如本文所述的去除罐中时,本发明中采用的色谱基质是凝胶过滤(也称为尺寸排阻)基质。凝胶过滤的特征可以在于如下特性:其被设计为至少基本上不经历与要分离的细胞的相互作用。因此,凝胶过滤基质允许主要基于其大小来分离细胞或如本文所定义的其他生物学实体。相应色谱基质通常是如上文所提及的颗粒多孔材料。色谱基质可以具有一定的排阻极限,其通常依据一个分子量来定义,高于所述分子量的分子完全不能进入孔中。限定尺寸排阻极限的相应分子量可以选择为低于与要分离的靶细胞(或生物学实体)的重量对应的重量。在这种实施方案中,防止靶细胞进入尺寸排阻色谱基质的孔中。同样,作为亲和色谱基质的固定相可以具有孔,所述孔的大小小于所选靶细胞的大小。在说明性实施方案中,亲和色谱基质和/或凝胶过滤基质的平均孔径为0至约500nm。
样品中存在的其他组分如受体结合分子或竞争试剂的大小可以低于孔的排阻极限,并且这可以进入尺寸排阻色谱基质的孔中。在能够部分或完全进入孔体积中的此类组分中,较少进入孔体积中的较大分子通常将首先洗脱,而最小的分子最后洗脱。在一些实施方案中,尺寸排阻色谱基质的排阻极限被选择为低于靶细胞的最大宽度。因此,可进入孔体积中的组分通常将在尺寸排阻色谱基质中/上保持比靶细胞更长的时间。因此,可以在色谱柱的洗脱物中与样品的其他物质/组分分开收集靶细胞。因此,组分如受体结合试剂或(适用时)竞争试剂从凝胶过滤基质洗脱的时间点晚于靶细胞。如果凝胶渗透基质包含亲和试剂(通常共价结合在所述基质上),所述亲和试剂包含能够结合样品中存在的试剂(如受体结合试剂和/或竞争试剂)的结合位点,例如结合位点z,则这种分离作用将被进一步增强。受体结合试剂和/或竞争试剂将由亲和试剂的结合位点z结合,并由此固定在凝胶渗透基质上。这种方法通常在如本发明所用的去除罐中进行,并且在一些实施方案中,根据本发明的方法、组合和试剂盒包括和/或采用这种凝胶过滤基质。在相应方法中,因此基于大小来分离细胞。
本发明采用的色谱基质还可以包括磁性可吸引的物质,如一种或多种磁性可吸引的颗粒或铁磁流体。相应的磁性可吸引的颗粒可以包含多聚化试剂或亲和试剂,其具有能够结合靶细胞的结合位点。磁性可吸引的颗粒可以含有反磁性、强磁性、顺磁性或超顺磁性材料。超顺磁性材料响应于磁场,其感应磁场不会导致永久磁化。仅举几例,基于氧化铁的磁性颗粒例如可以以
受体结合试剂
如上所述,在某些方面,本文提供的方法采用受体结合试剂。在一些实施方案中,如本章节中所述的试剂是受体结合试剂。在一些实施方案中,受体结合试剂与细胞表面上的分子(如细胞表面分子)结合。在一些情况下,细胞表面分子是选择标记。在一些实施方案中,受体结合试剂能够与样品中的一种或多种细胞表达的选择标记特异性结合。在一些实施方案中,在本公开文本通篇中提及与分子(如细胞表面分子或细胞表面受体)的特异性结合时,不一定意味着所述药剂仅与这种分子结合。例如,与分子特异性结合的试剂可以以通常显著更低的亲和力与其他分子结合,如通过例如免疫测定、
在一些实施方案中,细胞(例如,靶细胞,例如,t细胞)在细胞表面上具有或表达分子(例如,选择标记),使得通过至少一种共有特异性分子(例如,选择标记)的存在来限定要选择的细胞。在一些实施方案中,含有靶细胞的样品也可以含有缺乏所述分子(例如,选择标记)的另外的细胞。例如,在一些实施方案中,t细胞可以选自含有多个细胞类型(例如,红细胞或b细胞)的样品。选择标记和受体分子可以在本文中可互换地用于指代细胞表面分子。
在一些实施方案中,位于细胞表面(例如,靶细胞表面)上的受体分子可以是任何分子,只要它在根据本发明的方法中的色谱分离过程期间保持与细胞表面的共价或非共价结合。受体分子是受体结合试剂可以指向的分子。在一些实施方案中,受体是肽或蛋白质,如膜受体蛋白。在一些实施方案中,受体是脂质、多糖或核酸。作为蛋白质的受体可以是外周膜蛋白或整合膜蛋白。在一些实施方案中,它可以具有一个或多个跨膜结构域。在某些实施方案中,受体分子是免疫细胞的表面蛋白,例如,cd4、cd8或cd57。在一些情况下,对于t细胞,受体分子是cd3。在一些情况下,对于t细胞,受体分子是cd4或cd8。在一些实施方案中,受体分子可以是限定所需细胞群或亚群的抗原,所述细胞群或亚群例如血细胞的群体或亚群,例如淋巴细胞(例如t细胞、cd57+t细胞、cd4+t细胞或cd8+t细胞)。
在一些方面,细胞表面分子(例如,选择标记)可以是限定所需细胞群或亚群的抗原,所述细胞群或亚群例如以下细胞的群体或亚群:血细胞,例如淋巴细胞(例如t细胞、t辅助细胞(例如,cd57-t细胞、cd3+t细胞、cd8+t细胞、cd4+t辅助细胞)、b细胞或自然杀伤细胞)、单核细胞或干细胞(例如,cd34阳性外周干细胞或者表达nanog或oct-4的干细胞)。在一些实施方案中,所述选择标记可以是在t细胞或t细胞的子集的表面上表达的标记,如cd57、cd25、cd28、cd62l、ccr7、cd27、cd127、cd3、cd4、cd8、cd45ra和/或cd45ro。t细胞的例子包括诸如以下的细胞:cmv特异性cd8+t-淋巴细胞、细胞毒性t细胞、记忆t细胞和调节t细胞(treg)。treg的说明性例子包括cd4cd25cd45ratreg细胞,并且记忆t细胞的说明性例子包括cd62lcd8+特异性中枢记忆t细胞。
在一些实施方案中,受体结合试剂具有或含有结合位点b。在某些实施方案中,所述结合位点b是单价的。在一些方面,单价结合位点b是或含有单价抗体片段或具有免疫球蛋白样功能的蛋白质性结合分子、适体或mhc分子。单价抗体片段的例子包括但不限于fab片段、fv片段和单链fv片段(scfv),包括二价单链fv片段。(重组)抗体片段的例子是fab片段、fv片段、单链fv片段(scfv)、二价抗体片段(如(fab)2'片段)、双抗体、三抗体(iliades,p.,等人,febslett(1997)409,437-441)、十抗体(stone,e.,等人,journalofimmunologicalmethods(2007)318,88-94)和其他结构域抗体(holt,l.j.,等人,trendsbiotechnol.(2003),21,11,484-490)。在一些实施方案中,受体分子结合试剂的一个或多个结合位点可以是二价蛋白质性人工结合分子,如二聚脂质运载蛋白突变蛋白,也称为“双运载蛋白(duocalin)”。在一些实施方案中,受体结合试剂可以具有单一第二结合位点,即,其可以是单价的。单价受体结合试剂的例子包括但不限于单价抗体片段、具有抗体样结合特性的蛋白质性结合分子或mhc分子。
合适的蛋白质性结合分子的又其他例子是egf样结构域、kringle结构域、纤连蛋白i型结构域、纤连蛋白ii型结构域、纤连蛋白iii型结构域、pan结构域、g1a结构域、srcr结构域、kunitz/牛胰腺胰蛋白酶抑制剂结构域、淀粉酶抑肽、kazal型丝氨酸蛋白酶抑制剂结构域、车轴草(p型)结构域、vonwillebrand因子c型结构域、过敏毒素样结构域、cub结构域、甲状腺球蛋白i型重复序列、ldl受体a类结构域、sushi结构域、link结构域、凝血酶敏感蛋白i型结构域、免疫球蛋白结构域或免疫球蛋白样结构域(例如,结构域抗体或骆驼重链抗体)、c型凝集素结构域、mam结构域、vonwillebrand因子a型结构域、生长调节素b结构域、wap型四二硫核心结构域、f5/8c型结构域、血液结合素结构域、sh2结构域、sh3结构域、层粘连蛋白型egf样结构域、c2结构域、“κ体(kappabody)”(参照ill.等人,proteineng(1997)10,949-57),所谓的“微型抗体”(martin等人,emboj(1994)13,5303-5309)、双抗体(参照holliger等人,pnasusa(1993)90,6444-6448)、所谓的“janusis”(参照traunecker等人,emboj(1991)10,3655-3659,或traunecker等人,intjcancer(1992)增刊7,51-52)、纳米抗体、微体、affilin、亲和体(affibody)、打结素(knottin)、泛素、锌指蛋白、自发荧光蛋白或富亮氨酸重复蛋白。具有抗体样功能的核酸分子的例子是适体。适体折叠为限定的三维基序,并显示对给定靶结构的高亲和力。
在特定方面,受体结合蛋白含有结合配偶体c。在一些方面,包括在受体结合试剂中的结合配偶体c可能例如是基于烃的(包括聚合的),并且包括氮基团、磷基团、硫基团、卡宾基团、卤素基团或拟卤素基团。它可以是醇、有机酸、无机酸、胺、膦、硫醇、二硫化物、烷烃、氨基酸、肽、寡肽、多肽、蛋白质、核酸、脂质、糖、寡糖或多糖。作为其他例子,它也可能是阳离子、阴离子、聚阳离子、聚阴离子、聚阳离子、电解质、聚电解质、碳纳米管或碳纳米泡沫。通常,这种结合配偶体具有比其他物质更高的对多聚化试剂的结合位点的亲和力。相应结合配偶体的例子包括但不限于冠醚、免疫球蛋白、其片段和具有抗体样功能的蛋白质性结合分子。
在一些实施方案中,包括在受体结合试剂中的结合配偶体c包括生物素,并且亲和试剂包括可逆地结合至生物素的链霉亲和素类似物或抗生物素蛋白类似物。在一些实施方案中,包括在受体结合试剂中的结合配偶体c包括可逆地结合至链霉亲和素或抗生物素蛋白的生物素类似物,并且亲和试剂包括可逆地结合至相应生物素类似物的链霉亲和素、抗生物素蛋白、链霉亲和素类似物或抗生物素蛋白类似物。在一些实施方案中,包括在受体结合试剂中的结合配偶体c包括链霉亲和素结合肽或抗生物素蛋白结合肽,并且亲和试剂包括可逆地结合至相应链霉亲和素结合肽或抗生物素蛋白结合肽的链霉亲和素、抗生物素蛋白、链霉亲和素类似物或抗生物素蛋白类似物。
在一些实施方案中,包括在受体结合试剂中的结合配偶体可以包括链霉亲和素结合肽。在一些实施方案中,肽序列含有具有通式his-pro-xaa的序列,其中xaa是谷氨酰胺、天冬酰胺或甲硫氨酸,如含于seqidno:78中所示的序列中。在一些实施方案中,肽序列具有seqidno:69中所示的通式,如seqidno:79中所示。在一个例子中,肽序列是trp-arg-his-pro-gln-phe-gly-gly(也称为
在一些实施方案中,受体结合试剂的结合配偶体c包括熟练技术人员已知为亲和标签的部分。在这种实施方案中,亲和试剂包括已知与亲和标签结合的相应结合配偶体,例如抗体或抗体片段。作为已知亲和标签的几个说明性例子,包括于受体结合试剂中的结合配偶体可以包括二硝基苯酚或地高辛、寡聚组氨酸、多组氨酸、免疫球蛋白结构域、麦芽糖结合蛋白、谷胱甘肽-s-转移酶(gst)、几丁质结合蛋白(cbp)或硫氧还蛋白、钙调蛋白结合肽(cbp)、flag'-肽、ha标签、vsv-g标签、hsv标签、t7表位、麦芽糖结合蛋白(mbp)、单纯疱疹病毒糖蛋白d的序列的hsv表位、序列的转录因子c-myc的“myc”表位、v5标签或谷胱甘肽-s-转移酶(gst)。在这种实施方案中,在亲和试剂(在该情况下是抗体或抗体片段)的一个或多个结合位点与抗原之间形成的复合物可以通过添加游离抗原(即,游离肽(表位标签)或游离蛋白(如mbp或cbp))而被竞争性地破坏。亲和标签也可以是寡核苷酸标签。这种寡核苷酸标签可以例如用于与具有互补序列的寡核苷酸杂交,连接至或包括于亲和试剂中。
根据国际专利申请公开号wo2013/011011(其全部内容出于所有目的通过引用并入本文),受体结合试剂与靶细胞上的受体分子之间的结合强度对于靶细胞经由受体结合试剂与亲和试剂结合的可逆性而言可能不是必需的。相反,不论结合强度如何,意味着不论受体结合试剂经由结合位点b与受体分子之间的结合的平衡解离常数(kd)具有低亲和力(例如,在约10-3至约10-7m的kd范围内)或具有高亲和力(例如,在约10-7至约1x10-10m的kd范围内),靶细胞都可以被可逆染色,只要受体结合试剂经由结合位点b与受体分子的结合的解离发生得足够快。就此而言,受体结合试剂经由结合位点b与受体分子之间的结合的解离速率常数(k解离)可以具有约3×10-5sec-1或更大的值(该解离速率常数是表征在受体结合试剂的结合位点b与靶细胞表面上的受体分子之间形成的复合物的解离反应的常数)。受体结合试剂的结合位点b与靶细胞表面上的受体分子之间的缔合反应的缔合速率常数(k缔合)可以具有任何值。为了确保受体分子与受体结合试剂之间的结合足够可逆,有利地选择结合平衡的k解离值以具有如下值:约3×10-5sec-1或更大、约5×10-5sec-1或更大,如为或为约1×10-4sec-1或更大、5×10-4sec-1或更大、1×10-3sec-1或更大、5×10-3sec-1或更大、1×10-2sec-1或更大、1×10-1sec-1或更大或者5×10-1sec-1或更大。此处应注意,如本文所用的动力学和热力学常数的值涉及大气压即1.013巴和室温即25℃的条件。
在一些实施方案中,受体结合试剂具有能够与受体分子特异性结合的单一(单价)结合位点b。在一些实施方案中,受体结合试剂具有能够与受体分子结合的至少两个(即,多个结合位点b,包括三个、四个或也包括五个相同的结合位点b)。在这些实施方案的任一个中,受体分子经由一个或多个结合位点b(中的每一个)的结合的k解离值可以为约3×10-5sec-1或更大。因此,受体结合试剂可以是单价的(例如单价抗体片段或单价人工结合分子(蛋白质性或其他),如基于脂质运载蛋白家族的多肽的突变蛋白(也称为
在本发明的一些实施方案中,在分子水平上,并非受体结合试剂经由至少结合位点b与靶细胞上的受体分子的结合的k解离速率(3×10-5sec-1或更大)提供生物材料经由本文所述的可逆细胞亲和色谱技术的(无痕)分离。相反,并且如例如美国专利7,776,562或国际专利申请wo02/054065中所述,受体分子与结合受体结合试剂的结合位点b之间的低亲和力结合与经由固定的亲和试剂介导的亲合力效应一起允许靶细胞的可逆无痕分离。在这些实施方案中,在亲和试剂的两个或更多个结合位点z与至少两种受体结合试剂的结合配偶体c之间可以形成复合物,从而允许靶细胞的可逆固定和随后从亲和色谱基质洗脱(经由添加竞争剂,所述竞争剂将破坏在结合配偶体c与结合位点z之间形成的结合(复合物),这又导致受体结合试剂从靶细胞解离)。如上文所提及,这种低结合亲和力的特征可能是受体结合试剂经由结合位点b与靶细胞表面上的受体分子的结合的解离常数(kd)在约1.0×10-3m至约1.0×10-7m的范围内。
在一些实施方案中,选择标记可以是cd57,并且受体结合剂特异性结合cd57。在一些方面,特异性结合cd3的受体结合剂可以选自抗cd57抗体、抗cd57抗体的二价抗体片段、抗cd57抗体的单价抗体片段和具有抗体样结合特性的蛋白质性cd57结合分子。在一些实施方案中,选择剂包含抗cd57fab片段。
在一些实施方案中,选择标记可以是cd4,并且受体结合剂特异性结合cd4。在一些方面,特异性结合cd4的受体结合剂可以选自抗cd4抗体、抗cd4抗体的二价抗体片段、抗cd4抗体的单价抗体片段和具有抗体样结合特性的蛋白质性cd4结合分子。在一些实施方案中,抗cd4抗体(如二价抗体片段或单价抗体片段(例如cd4fab片段))可以源自抗体13b8.2或13b8.2的保留与cd4的特异性结合的功能活性突变体。例如,抗体13b8.2的示例性突变体或m13b8.2描述于以下文献中:美国专利号7,482,000、美国专利申请号us2014/0295458或国际专利申请号wo2013/124474;以及bes,c,等人jbiolchem278,14265-14273(2003)。名为“ml3b8.2”的突变体fab片段携带cd4结合鼠抗体13b8.2的可变结构域,以及含有重链的γ型恒定人ch1结构域和κ型恒定人轻链结构域的恒定结构域,如美国专利7,482,000中所述。在一些实施方案中,抗cd4抗体(例如抗体13b8.2的突变体)含有可变轻链中的氨基酸替代h91a、可变轻链中的氨基酸替代y92a、可变重链中的氨基酸替代h35a和/或可变重链中的氨基酸替代r53a,其各自通过kabat编号。在一些方面,与ml3b8.2中13b8.2fab片段的可变结构域相比,轻链中位置91(seqidno:96中的位置93)的his残基突变为ala,并且重链中位置53(seqidno:95中的位置55)的arg残基突变为ala。在一些实施方案中,与抗cd4或其片段可逆地结合的试剂可商业购自或源自可商业购得的试剂(例如目录号6-8000-206或6-8000-205或6-8002-100;ibagmbh,哥廷根,德国)。在一些实施方案中,受体结合剂包含抗cd4fab片段。在一些实施方案中,所述抗cd4fab片段包含具有seqidno:95所示序列的可变重链和具有seqidno:96所示序列的可变轻链。在一些实施方案中,所述抗cd4fab片段包含具有seqidno:95所示序列的可变重链的cdr和具有seqidno:96所示序列的可变轻链的cdr。
在一些实施方案中,选择标记可以是cd8,并且受体结合剂特异性结合cd8。在一些方面,特异性结合cd8的受体结合剂可以选自抗cd8抗体、抗cd8抗体的二价抗体片段、抗cd8抗体的单价抗体片段和具有抗体样结合特性的蛋白质性cd8结合分子。在一些实施方案中,抗cd8抗体(如二价抗体片段或单价抗体片段(例如cd8fab片段))可以源自抗体okt8(例如atcccrl-8014)或其保留与cd8的特异性结合的功能活性突变体。在一些实施方案中,与抗cd8或其片段可逆地结合的试剂可商业购自或源自可商业购得的试剂(例如目录号6-8003或6-8000-201;ibagmbh,哥廷根,德国)。在一些实施方案中,受体结合剂包含抗cd8fab片段。在一些实施方案中,所述抗cd8fab片段包含具有seqidno:97所示序列的可变重链和具有seqidno:98所示序列的可变轻链。在一些实施方案中,所述抗cd8fab片段包含具有seqidno:97所示序列的可变重链的cdr和具有seqidno:98所示序列的可变轻链的cdr。
在一些实施方案中,选择标记可以是cd3,并且受体结合剂特异性结合cd3。在一些方面,特异性结合cd3的受体结合剂可以选自抗cd3抗体、抗cd3抗体的二价抗体片段、抗cd3抗体的单价抗体片段和具有抗体样结合特性的蛋白质性cd3结合分子。在一些实施方案中,抗cd3抗体(如二价抗体片段或单价抗体片段(例如cd3fab片段))可以源自抗体okt3(例如atcccrl-8001;参见例如,stemberger等人plosone.2012;7(4):e35798)或其保留对cd3的特异性结合的功能活性突变体。在一些实施方案中,与抗cd3或其片段可逆地结合的试剂可商业购自或源自可商业购得的试剂(例如目录号6-8000-201、6-8001-100;ibagmbh,哥廷根,德国)。在一些实施方案中,受体结合剂包含抗cd3fab片段。在一些实施方案中,所述抗cd3fab片段包含具有seqidno:93所示序列的可变重链和具有seqidno:94所示序列的可变轻链。在一些实施方案中,所述抗cd3fab片段包含具有seqidno:93所示序列的可变重链的cdr和具有seqidno:94所示序列的可变轻链的cdr。
在任何上文例子中,二价抗体片段可以是(fab)2'片段或二价单链fv片段,而单价抗体片段可以选自fab片段、fv片段和单链fv片段(scfv)。在任何上文例子中,具有抗体样结合特性的蛋白质性结合分子可以是适体、基于脂质运载蛋白家族的多肽的突变蛋白、格鲁体、基于锚蛋白支架的蛋白质、基于结晶支架的蛋白质、阿德奈汀蛋白和阿维莫蛋白。
在某些实施方案中,通过色谱分离进行的分离和/或选择得到富集的t细胞的一个或多个群体,所述群体包括至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%、至少99.9%或者为或为约100%cd57-cd3+t细胞。在特定实施方案中,富集的t细胞的群体基本上由cd57-cd3+t细胞组成。
在某些实施方案中,通过色谱分离进行的分离和/或富集得到富集的cd4+t细胞的群体,所述群体包括至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%、至少99.9%或者为或为约100%cd57-cd4+t细胞。在某些实施方案中,cd4+t细胞的输入组合物包括小于40%、小于35%、小于30%、小于25%、小于20%、小于15%、小于10%、小于5%、小于1%、小于0.1%或小于0.01%cd8+t细胞,和/或不含cd8+t细胞,和/或不含或基本上不含cd8+t细胞。在一些实施方案中,富集的t细胞的群体基本上由cd57-cd4+t细胞组成。
在某些实施方案中,通过色谱分离进行的分离和/或富集得到富集的cd57-cd8+t细胞的群体,所述群体包括至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%、至少99.9%或者为或为约100%cd57-cd8+t细胞。在某些实施方案中,cd8+t细胞的群体含有小于40%、小于35%、小于30%、小于25%、小于20%、小于15%、小于10%、小于5%、小于1%、小于0.1%或小于0.01%的cd4+t细胞,和/或不含cd4+t细胞,和/或不含或基本上不含cd4+t细胞。在一些实施方案中,富集的t细胞的群体基本上由cd57-cd8+t细胞组成。
d.输入组合物
在某些实施方案中,所提供的方法与产生或制备细胞的输入群体或组合物(输入组合物或输入群体在本文中可互换使用)结合使用。在一些实施方案中,细胞的输入组合物是遵循如例如下文所述用于从生物样品(例如含有原代t细胞的样品,如白细胞单采术或单采术样品)选择t细胞的任何所提供方法来生成。在某些实施方案中,输入细胞组合物包括用于基因工程化的细胞(例如,将进行基因工程化或将经历用于产生基因工程化细胞的过程的细胞)的群体。在某些实施方案中,将细胞用编码重组受体的核酸处理,与所述核酸接触,或者与所述核酸一起孵育。在某些实施方案中,输入组合物含有t细胞、活t细胞、cd57-t细胞、cd3+t细胞、cd4+t细胞、cd8+t细胞和/或其亚群。
在一些实施方案中,细胞活力是用如下测定来评估:其可以包括但不限于染料摄取测定(例如,钙黄绿素am测定)、xtt细胞活力测定和染料排除测定(例如,锥虫蓝、伊红或丙啶染料排除测定)。在特定实施方案中,活细胞具有一种或多种细胞凋亡标记(例如,膜联蛋白v或活性半胱天冬酶3)的阴性表达。在一些实施方案中,活细胞对一种或多种细胞凋亡标记的表达呈阴性,所述细胞凋亡标记可以包括但不限于半胱天冬酶或活性半胱天冬酶,例如,半胱天冬酶2、半胱天冬酶3、半胱天冬酶6、半胱天冬酶7、半胱天冬酶8、半胱天冬酶9或半胱天冬酶10;bcl-2家族成员,例如,bax、bad和bid;膜联蛋白v;或tunel染色。在特定实施方案中,活细胞是活性半胱天冬酶3阴性的。在某些实施方案中,活细胞是膜联蛋白v阴性的。
在一些实施方案中,输入组合物包含富集的cd57-t细胞(例如,活cd57-t细胞)的群体。在一些实施方案中,输入群体中至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%、至少99.9%或者为或为约100%的细胞是cd57-t细胞,例如,活cd57-t细胞。在一些实施方案中,输入群体基本上由cd57-t细胞(例如,活cd57-t细胞)组成。
在某些实施方案中,输入群体是富含富集的cd4+t细胞和cd8+t细胞(例如,cd4+t细胞和cd8+t细胞)的细胞群。在特定实施方案中,输入群体是或包括至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%、至少99.9%或者为或为约100%的作为cd3+t细胞的细胞。在特定实施方案中,输入群体是或包括至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%、至少99.9%或者为或为约100%的作为cd4+和cd8+t细胞的细胞。在一些实施方案中,输入群体基本上由cd4+和cd8+t细胞组成。在特定实施方案中,输入群体是或包括至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%、至少99.9%或者为或为约100%的作为cd57-(例如活cd57-t细胞)的cd3+t细胞(cd4+和cd8+t细胞)。
在某些实施方案中,输入群体是富集的cd4+t细胞的群体。在特定实施方案中,输入群体中至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%、至少99.9%或者为或为约100%的细胞是cd4+t细胞。在一些实施方案中,输入群体基本上由cd4+t细胞组成。在特定实施方案中,输入群体是或包括至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%、至少99.9%或者为或为约100%的作为cd57-(例如活cd57-t细胞)的cd4+t细胞。
在某些实施方案中,输入群体是富集的cd8+t细胞的群体。在特定实施方案中,输入群体中至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%、至少99.9%或者为或为约100%的细胞是cd8+t细胞。在一些实施方案中,输入群体基本上由cd8+t细胞组成。在特定实施方案中,输入群体是或包括至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%、至少99%、至少99.5%、至少99.9%或者为或为约100%的作为cd57-(例如活cd57-t细胞)的cd8+t细胞。
在一些实施方案中,将来自富集的cd57-cd4+t细胞的群体的细胞与来自富集的cd57-cd8+t细胞的群体的细胞混合、组合和/或合并,以产生含有cd57-cd4+t细胞和cd57-cd8+t细胞的输入群体。在某些实施方案中,在刺激细胞(例如,在刺激条件下培养细胞)之前,将富集的cd57-cd4+t细胞和cd57-cd8+t细胞的群体合并、混合和/或组合。在特定实施方案中,在冷冻(例如,低温保存)和解冻富集的cd57-cd4+和cd57-cd8+t细胞的群体之后,将富集的cd57-cd4+和cd57-cd8+t细胞的群体合并、混合和/或组合。
在某些实施方案中,通过将来自富集的cd57-cd4+细胞的群体的细胞与来自富集的cd57-cd8+细胞的群体的细胞混合、合并和/或组合来产生、生成或制备输入群体。在某些实施方案中,富集的cd57-cd4+t细胞的群体含有至少60%、65%、70%、75%、80%、85%、90%、95%、98%、99%或99.9%的cd57-cd4+t细胞。在特定实施方案中,富集的cd57-cd4+t细胞的群体含有100%的cd57-cd4+t细胞或含有约100%的cd57-cd4+t细胞。在某些实施方案中,富集的t细胞的群体包括或含有小于20%、小于10%、小于5%、小于1%、小于0.1%或小于0.01%的cd57-cd8+t细胞,和/或不含cd57-cd8+t细胞,和/或不含或基本上不含cd57-cd8+t细胞。在一些实施方案中,所述细胞群基本上由cd57-cd4+t细胞组成。在某些实施方案中,富集的cd57-cd8+t细胞的群体含有至少75%、80%、85%、90%、95%、98%、99%或99.9%的cd57-cd8+t细胞,或者含有或含有约100%的cd57-cd8+t细胞。在某些实施方案中,富集的cd57-cd8+t细胞的群体包括或含有小于20%、小于10%、小于5%、小于1%、小于0.1%或小于0.01%的cd57-cd4+t细胞,和/或不含cd57-cd4+t细胞,和/或不含或基本上不含cd57-cd4+t细胞。在一些实施方案中,所述细胞群基本上由cd57-cd8+t细胞组成。
在某些实施方案中,将cd4+t细胞和cd8+t细胞按cd4+t细胞与cd8+t细胞的以下比率合并、混合和/或组合:在1:10与10:1之间、在1:5与5:1之间、在4:1与1:4之间、在1:3与3:1之间、在2:1与1:2之间、在1.5:1与1:1.5之间、在1.25:1与1:1.25之间、在1.2:1与1:1.2之间、在1.1:1与1:1.1之间或者约1:1或1:1。在特定实施方案中,将活cd4+t细胞与活cd8+t细胞按cd4+t细胞与cd8+t细胞的以下比率合并、混合和/或组合:在1:10与10:1之间、在1:5与5:1之间、在4:1与1:4之间、在1:3与3:1之间、在2:1与1:2之间、在1.5:1与1:1.5之间、在1.25:1与1:1.25之间、在1.2:1与1:1.2之间、在1.1:1与1:1.1之间或者约1:1或1:1。
在特定实施方案中,输入组合物具有为、为约或为至少50×106、100×106、150×106、200×106、250×106、300×106、350×106、400×106、450×106、500×106、550×106、600×106、700×106、800×106、900×106、1,000×106、1,100×106或1,200×106的量的t细胞,如活t细胞、活cd3+t细胞或活的混合的cd4+和cd8+t细胞。在特定实施方案中,输入组合物具有为、为约或为至少50×106、100×106、150×106、200×106、250×106、300×106、350×106、400×106、450×106、500×106、550×106、600×106的量的cd4+t细胞,例如,活cd4+t细胞。在某些实施方案中,输入组合物具有为、为约或为至少50×106、100×106、150×106、200×106、250×106、300×106、350×106、400×106、450×106、500×106、550×106、600×106的量的cd8+t细胞,例如,活cd8+t细胞。在一些实施方案中,细胞的量是在同一组合物中合并、混合和/或组合在一起的活cd4+和cd8+t细胞的量。在此类实施方案中,cd4+和cd8+t细胞按cd4+t细胞与cd8+t细胞的以下比率存在:在1:3与3:1之间、在2:1与1:2之间、在1.5:1与1:1.5之间、在1.25:1与1:1.25之间、在1.2:1与1:1.2之间、在1.1:1与1:1.1之间或者约1:1或1:1。在一些实施方案中,细胞的量是以约1:1或1:1的cd4+t细胞与cd8+t细胞的比率合并、混合和/或组合在一起的活cd4+和cd8+t细胞的量。
在特定实施方案中,输入组合物具有在或在约300×106与600×106之间的量的t细胞,例如,活cd3+细胞,或混合的活cd4+和活cd8+细胞(例如,以为或为约1:1比率混合)。在一些实施方案中,输入群体具有为或为约300×106的量,例如,活cd3+细胞,或混合的活cd4+和活cd8+细胞(例如,以为或为约1:1比率混合)。在一些实施方案中,输入群体具有为或为约400×106的量,例如,活cd3+细胞或混合的活cd4+和活cd8+细胞(例如,以为或为约1:1比率混合)。在一些实施方案中,输入群体具有为或为约500×106的量,例如,活cd3+细胞或混合的活cd4+和活cd8+细胞(例如,以为或为约1:1比率混合)。在一些实施方案中,输入群体具有为或为约600×106的量,例如,活cd3+细胞或混合的活cd4+和活cd8+细胞(例如,以为或为约1:1比率混合)。在一些实施方案中,输入群体具有为或为约700×106的量,例如,活cd3+细胞或混合的活cd4+和活cd8+细胞(例如,以为或为约1:1比率混合)。在一些实施方案中,输入群体具有为或为约800×106的量,例如,活cd3+细胞或混合的活cd4+和活cd8+细胞(例如,以为或为约1:1比率混合)。在一些实施方案中,输入群体具有为或为约900×106的量,例如,活cd3+细胞或混合的活cd4+和活cd8+细胞(例如,以为或为约1:1比率混合)。在一些实施方案中,输入群体具有为或为约100×107的量,例如,活cd3+细胞或混合的活cd4+和活cd8+细胞(例如,以为或为约1:1比率混合)。在一些实施方案中,输入群体具有为或为约110×107的量,例如,活cd3+细胞或混合的活cd4+和活cd8+细胞(例如,以为或为约1:1比率混合)。在一些实施方案中,输入群体具有为或为约120×107的量,例如,活cd3+细胞或混合的活cd4+和活cd8+细胞(例如,以为或为约1:1比率混合)。
在某些实施方案中,将cd4+t细胞和cd8+t细胞合并、混合和/或组合,使得输入组合物具有多达或多达约目标数量(2n)的t细胞,如活t细胞、活cd3+t细胞或活的混合的cd4+和cd8+t细胞。在其中包含富集的cd4+t细胞的组合物含有至少n个cd4+t细胞并且包含富集的cd8+t细胞(例如,与cd4+t细胞组合物源自同一供体,例如,源自来自供体的相同单采术或白细胞单采术样品)的组合物含有至少n个cd8+t细胞的某些实施方案中,将来自cd4+t细胞组合物的n个cd4+t细胞和来自cd8+t细胞组合物的n个cd8+t细胞合并、混合和/或组合(即以1:1的cd4+与cd8+的比率),以生成含有目标数量(2n)的t细胞的输入组合物。在其中包含富集的cd4+t细胞的组合物含有不超过(例如,少于)n个cd4+t细胞并且包含富集的cd8+t细胞(例如,与cd4+t细胞组合物源自同一供体,例如,源自来自供体的相同单采术或白细胞单采术样品)的组合物含有不超过(例如,少于)n个cd8+t细胞的某些实施方案中,将cd4+t细胞组合物的所有细胞和cd8+t细胞组合物的所有细胞合并、混合和/或组合以生成输入组合物。在这些实施方案中,输入组合物可以含有少于目标数量(2n)的t细胞。在其中包含富集的cd4+t细胞的组合物含有少于n个cd4+t细胞并且包含富集的cd8+t细胞(例如,与cd4+t细胞组合物源自同一供体,例如,源自来自供体的相同单采术或白细胞单采术样品)的组合物含有超过n个cd8+t细胞或反之亦然的某些实施方案中,使用cd4+或cd8+t细胞组合物的细胞来补充替代性细胞类型,使得输入组合物含有多达目标数量(2n)的t细胞。在任何前述实施方案中,目标数量2n可以是300×106、350×106、400×106、450×106、500×106、550×106、600×106、700×106、800×106、900×106、1,000×106、1,100×106或1,200×106。
在某些实施方案中,将来自包含富集的cd4+t细胞的组合物的450×106个cd4+t细胞和来自包含富集的cd8+t细胞(例如,与cd4+t细胞组合物源自同一供体,例如,源自来自供体的相同单采术或白细胞单采术样品)的组合物的450×106个cd8+t细胞合并、混合和/或组合,以生成含有900×106个cd4+和cd8+t细胞的输入组合物。在某些实施方案中,在包含富集的cd4+t细胞的组合物含有少于450×106个cd4+t细胞并且包含富集的cd8+t细胞(例如,与cd4+t细胞组合物源自同一供体,例如,源自来自供体的相同单采术或白细胞单采术样品)的组合物含有少于450×106个cd8+t细胞时,将cd4+t细胞组合物的所有细胞和cd8+t细胞组合物的所有细胞合并、混合和/或组合以生成输入组合物。在某些实施方案中,在任一种组合物含有少于450×106个cd4+或cd8+细胞而另一种组合物含有超过450×106个cd8+细胞或cd4+细胞时,则将多达900×106个cd4+t细胞和cd8+t细胞组合以生成输入组合物。输入组合物中cd4+和cd8+t细胞的总数量可以低于900×106。换言之,可以使用包含富集的cd4+t细胞的组合物的细胞来补充包含富集的cd8+t细胞的组合物,或反之亦然,以生成包含多达目标数量(2n)的t细胞(例如,多达900×106个要经历刺激的t细胞)的输入组合物。
虽然在上文实施方案中,细胞选择、分离、分开、富集和/或纯化过程是在制备输入组合物的背景下讨论的,但应理解,本文公开的细胞选择、分离、分开、富集和/或纯化过程可以在任何后续步骤(例如,激活、刺激、工程化、转导、转染、孵育、培养、收获、配制和/或将配制的细胞群施用至受试者)期间、之前或之间以任何合适的组合和/或顺序使用。例如,t细胞选择、分离、分开、富集和/或纯化步骤可以在t细胞激活/刺激与t细胞转导之间进行。在另一例子中,t细胞选择、分离、分开、富集和/或纯化步骤可以在t细胞转导之后,但在收获之前、在收集之前和/或在配制细胞之前进行。在特定例子中,t细胞选择、分离、分开、富集和/或纯化步骤可以在即将收获细胞之前作为精制或澄清步骤来进行。在一些实施方案中,通过色谱进行的t细胞选择步骤在t细胞激活/刺激与t细胞转导之间进行。在一些实施方案中,通过色谱进行的t细胞选择步骤在t细胞转导之后,但在收获之前、在收集之前和/或在配制细胞之前进行。在一些实施方案中,通过色谱进行的t细胞选择步骤在即将收获细胞之前进行。
在一些实施方案中,在刺激细胞(例如,在刺激条件下培养细胞)之前,使输入组合物经历例如使用无血清培养基的一个或多个稀释和/或洗涤步骤。在一些实施方案中,稀释和/或洗涤步骤允许培养基交换为无血清培养基,如pct/us2018/064627中所述的无血清培养基,所述申请通过引用并入本文。
在一些实施方案中,无血清培养基包含补充有一种或多种补充剂的基础培养基(例如optmizertmt细胞扩增基础培养基(thermofisher))。在一些实施方案中,所述一种或多种补充剂不含血清。在一些实施方案中,无血清培养基包含补充有一种或多种另外的组分的基础培养基,所述另外的组分用于细胞(例如,t细胞)的维持、扩增和/或激活,如通过另外的补充剂(例如optmizertmt细胞扩增补充剂(thermofisher))所提供。在一些实施方案中,无血清培养基还包含血清替代物补充剂,例如,免疫细胞血清替代物,例如,thermofisher(#a2596101)、ctstm免疫细胞血清替代物或smith等人clintranslimmunology.2015年1月;4(1):e31中所述的免疫细胞血清替代物。在一些实施方案中,无血清培养基还包含游离形式的氨基酸,如l-谷氨酰胺。在一些实施方案中,无血清培养基还包含二肽形式的l-谷氨酰胺(例如,l-丙氨酰-l-谷氨酰胺),如glutamaxtm(thermofisher)中的二肽。在一些实施方案中,无血清培养基还包含一种或多种重组细胞因子,如重组人il-2、重组人il-7和/或重组人il-15。
在一些实施方案中,输入组合物是通过将从起始样品(如pbmc或白细胞单采术样品)产生的富含cd57-cd8+t细胞的群体与从所述起始样品产生的富含cd57-cd4+t细胞的群体混合、组合和/或合并来生成。在一些实施方案中,富含cd57-cd4+t细胞的群体是从在从起始样品生成富含cd8+t细胞的群体的过程期间生成的cd8阴性级分生成的。在特定实施方案中,输入组合物具有为或为约1:1的cd4+t细胞与cd8+t细胞的比率,并在刺激细胞(例如,在刺激条件下培养细胞)之前,使其经历一个或多个洗涤步骤,例如,使用pct/us2018/064627中所述的无血清培养基来进行。在一些实施方案中,一个或多个洗涤步骤允许从含有白蛋白的pbs/edta缓冲液培养基交换为无血清培养基,所述无血清培养基也用于细胞刺激中。
iii.用于基因工程化富集的cd57-细胞的群体的过程
所提供的方法包括用重组受体(如嵌合抗原受体(car))基因工程化t细胞的方法。在一些方面,所提供的方法可以包括刺激、激活、工程化、培育和/或扩增富集的cd57-t细胞的一个或多个群体的一个或多个步骤。在某些实施方案中,所述一个或多个群体是或包括本文例如在章节i中所述的cd57-t细胞的任何群体。在一些实施方案中,所述一个或多个群体是通过本文例如在章节ii中所述的任何方法或过程从生物样品分离、选择或富集。在一些实施方案中,刺激或激活富集的cd57-t细胞的一个或多个群体,如通过在刺激条件(如本文例如在章节iii.a中所述的任何刺激条件)下孵育群体的细胞。在某些实施方案中,基因工程化富集的cd57-t细胞的一个或多个群体,如通过将异源多核苷酸引入所述一个或多个群体的细胞中。在一些实施方案中,所述引入是通过本文例如在章节iii.b中提供的用于基因工程化的任何方法进行的。在一些方面,所提供的方法可以包括在允许将病毒载体整合至细胞基因组中的条件下孵育转导的t细胞。
所提供的方法可以包括如下方法:其中不会出于扩增细胞群的目的对工程化细胞进行进一步培育。例如,在一些方面,收获的细胞尚未经历任何孵育或培育,其中如与所述孵育或培育开始时总活细胞的数量相比,在所述孵育或培育结束时总活细胞的量增加。在一些实施方案中,收获的细胞尚未经历任何孵育或培育步骤,所述步骤明确用于与孵育或培育过程开始时相比,在所述孵育或培育过程结束时增加(例如,扩增)活细胞总数量的目的。在一些实施方案中,在可以导致扩增的条件下孵育或培育细胞,但是执行所述孵育或培育条件的目的并非扩增细胞群。在一些实施方案中,虽然是在不包括扩增步骤的过程中制造,但收获的细胞可能已经经历了扩增。在一些实施方案中,不包括扩增步骤的制造过程被称为非扩增或最小扩增的过程。“非扩增”过程也可以被称为“最小扩增”过程。在一些实施方案中,虽然过程不包括用于扩增的步骤,但非扩增或最小扩增过程可能得到已经经历扩增的细胞。在一些实施方案中,收获的细胞可能已经经历孵育或培育步骤,所述步骤包括设计用于降低、抑制、最小化或消除细胞群作为群体的扩增的培养基组合物。在一些实施方案中,收集、收获或配制的细胞先前尚未经历在如下生物反应器中或在如下条件下进行的孵育或培育:其中在孵育或培育的全部或一部分中摇摆、旋转、振荡或灌注细胞。
在某些实施方案中,培育富集的cd57-t细胞的一个或多个群体,例如,在促进或允许t细胞分裂、生长或扩增的条件下培育,如持续固定量的时间或直至达到扩增的阈值极限。在一些方面,所述培育是通过本文如在章节iii.c中所述的任何方法来进行。
在特定实施方案中,本文提供从cd57-t细胞的一个或多个初始(例如,输入)群体生成基因工程化t细胞组合物的方法。在一些实施方案中,在刺激条件下孵育富集的cd57-t细胞的群体,从而生成刺激的群体。在某些实施方案中,将刺激(例如,在刺激条件下培养细胞)进行设定或固定量的时间,如2天以内的时间量,或进行18小时与30小时之间的时间量。在一些方面,将用刺激试剂刺激进行为或约20小时±4小时。
在某些实施方案中,将异源多核苷酸引入刺激的群体的细胞中,从而生成转化的群体。在特定实施方案中,在基因工程化细胞期间或之后孵育所述细胞,例如,持续足以允许编码重组蛋白的异源或重组多核苷酸的整合或允许重组蛋白的表达的时间量。在某些实施方案中,将细胞孵育设定或固定量的时间,如大于18小时或小于4天,例如,72小时±6小时的时间量。在任何所提供实施方案中,所述引入可以在已经用刺激试剂刺激细胞之后对所述细胞进行。在一些实施方案中,在从开始或起始刺激时起设定量的时间内,如在从将刺激试剂添加、培养或与细胞接触时起30小时内,开始或起始工程化步骤。在特定实施方案中,在将刺激试剂添加、培养或与细胞接触之后18小时与30小时之间,如20小时±4小时,开始或起始工程化步骤。
在某些实施方案中,然后扩增转化的群体,如持续设定量的时间或直至达到阈值扩增,从而得到扩增的群体。在特定实施方案中,收获或收集转化的群体或扩增的群体,并且任选地进行配制,如用于施用至受试者或用于低温保存。在一些实施方案中,所述群体是或含有cd57-cd4+t细胞和cd57-cd8+t细胞。在一些实施方案中,所述群体是或含有cd57-cd3+t细胞。
在特定实施方案中,可以用于生成富集的表达重组受体的t细胞的工程化的群体的过程的任何阶段或步骤之前、期间或之后,收集富集的t细胞的群体,进行配制用于低温保护,冷冻(例如,低温保护)和/或储存在低于0℃、低于-20℃或者为或低于-70℃或-80℃。在一些实施方案中,可以将细胞储存1、2、3、4、5、6、7、8、9或10天以内的时间量,或1、2、3、4、5、6、7、8周以内的时间量,或至少1、2、3、4、5、6、7或8周的时间量,或者超过8周。在储存后,可以将富集的t细胞的群体解冻,并且可以从所述过程中的同一点恢复处理。在一些实施方案中,在进一步处理(例如,在刺激条件下孵育)之前,对富集的t细胞的输入群体进行低温保护和储存。在特定实施方案中,在例如作为自体细胞疗法被施用至受试者之前,对富集的t细胞的培育和/或配制的群体进行低温保护和储存。
在某些实施方案中,本文所提供的方法与借此通过如下过程生成工程化细胞的过程结合使用,所述过程包括用于以下的步骤:刺激细胞,然后将编码重组受体(例如,car)的多核苷酸引入细胞中。在特定实施方案中,所述刺激进行18小时与30小时之间,如进行约24小时,并且随后进行多核苷酸的引入。在某些实施方案中,在开始引入多核苷酸之后3天内,收获或收集细胞,例如以进行配制用于低温保存或施用至受试者。在各种实施方案中,在起始于刺激条件下孵育之后4天内,收获或收集细胞,例如以进行配制用于低温保存或施用至受试者。
在某些实施方案中,本文提供从cd57-t细胞的两个初始(例如,输入)群体生成基因工程化t细胞组合物的方法。在一些实施方案中,在刺激条件下单独孵育富集的cd57-t细胞的两个群体,从而生成两个单独的刺激的群体。在某些实施方案中,将异源多核苷酸引入两个单独的刺激的群体的细胞中,从而产生两个单独的转化的群体。在某些实施方案中,然后扩增两个单独的转化的群体,例如持续设定量的时间或直至达到阈值扩增,从而产生两个单独的扩增的群体。在特定实施方案中,收获或收集两个单独的转化的群体或两个单独的扩增的群体,并任选地配制,例如用于施用至受试者或用于低温保存。在特定实施方案中,两个单独群体源自或来源于相同的生物样品或来自相同个体受试者的不同的生物样品。在一些实施方案中,两个单独群体是或含有富集的cd57-cd4+t细胞的群体以及cd57-cd8+t细胞的单独群体。
还提供鉴定能够扩增或增殖(如在促进t细胞增殖或扩增的条件(如本文例如在章节iii.c中所述的任何此类条件)下孵育或培育期间)的细胞群的方法。在一些实施方案中,此类方法是或包括测量所述群体中cd57+细胞的频率,其中如果cd57+细胞的频率低于阈值频率,则所述群体能够扩增。在一些实施方案中,阈值频率小于30%、25%、20%、15%、10%、5%或1%。在一些实施方案中,阈值为或为约20%。在一些实施方案中,能够扩增的群体在促进增殖或扩增的条件下培育期间在10、11、12、13或14天内扩增至少2倍、3倍、4倍或5倍。在某些实施方案中,能够扩增的群体在培育(例如,本文如在章节iii.c中提供的培育)期间在11天内扩增至少4倍。
在一些实施方案中,所述方法是或包括测量t细胞群的与cd57表达相关的性状的值,其中如果所述性状的值小于所述性状的阈值,则所述t细胞群能够扩增细胞疗法。在一些实施方案中,所述性状是剂量的总t细胞、cd4+t细胞或cd8+t细胞中存在的cd57编码的多肽的水平或量。在某些实施方案中,所述性状是所述剂量的总t细胞、cd4+t细胞或cd8+t细胞的表面上存在的cd57编码的多肽的水平或量,在特定实施方案中,所述性状是对cd57的表达呈阳性的t细胞、cd4+t细胞或cd8+t细胞的频率、百分比或量。在一些实施方案中,所述性状是t细胞中存在的第二基因的mrna的水平或量。在特定实施方案中,cd57的可及性的水平或量。
在某些实施方案中,所述阈值低于多个参考t细胞群中与cd57表达相关的所述性状的平均或中位测量值25%、20%、15%、10%或5%,约25%、20%、15%、10%或5%,或25%内、20%内、15%内、10%内或5%内,和/或比所述平均或中位测量值小低于一个标准差。在某些实施方案中,所述阈值低于来自多个参考t细胞群的群体中与cd57表达相关的所述性状的最低测量值,任选地低于所述最低测量值50%内、25%内、20%内、15%内、10%内或5%内。在一些实施方案中,所述阈值低于从来自多个参考t细胞组合物的超过65%、75%、80%、85%的样品计算的与cd57表达相关的所述性状的平均或中位测量值。在特定实施方案中,所述多个参考t细胞群是当在促进t细胞的增殖或扩增的条件下培育时未扩增的多个群体,任选地其中在培育(例如,如本文如在章节iii.c中所述的培育)的10、11、12、13或14天内,所述细胞未扩增至少3倍、4倍或5倍。在一些实施方案中,在培育的11天内,参考t细胞群未扩增至少4倍。
在一些实施方案中,在t细胞的工程化的群体或扩增的群体包括阈值数量的t细胞、活t细胞、工程化t细胞或活工程化t细胞或者阈值浓度的t细胞、活t细胞、工程化t细胞或活工程化t细胞的时间或所述时间后,进行所述收获。在一些实施方案中,在起始刺激后为或约4、5、6或7天内,达到t细胞、活t细胞、工程化t细胞或活工程化t细胞的所述阈值数量或浓度。
在一些实施方案中,在多个工程化t细胞群体或扩增的t细胞群体之间,在所述多个的至少为或约或者至少为或约70%、80%、90%或95%中,在起始刺激后为或约5或6天内,达到t细胞、活t细胞、工程化t细胞或活工程化t细胞的所述阈值数量或浓度。在一些实施方案中,在起始刺激后为或约2、3、4或5次群体倍增内,达到t细胞、活t细胞、工程化t细胞或活工程化t细胞的所述阈值数量或浓度。
在一些实施方案中,所述方法还包括测量与第二基因的表达相关的性状的值,使得如果与cd57表达相关的所述性状的值低于阈值并且如果与第二基因的表达相关的性状大于第二阈值,则所述群体能够扩增。在一些实施方案中,第二基因是幼稚样细胞的标记,例如但不限于cd25、cd27、cd28、ccr7或cd45ra。在一些实施方案中,第二基因编码cd27。
a.刺激
在一些实施方案中,所提供的方法与在刺激条件下孵育细胞(例如,cd57-t细胞)结合使用。在一些实施方案中,刺激条件包括激活或刺激和/或能够激活或刺激细胞(例如,cd4+或cd8+t细胞)中的信号(如从tcr和/或共受体生成的信号)的条件。在一些实施方案中,刺激条件包括用刺激试剂(例如,激活或刺激和/或能够激活或刺激细胞中的信号的试剂)和/或在刺激试剂的存在下培养、培育、孵育、激活、繁殖细胞的一个或多个步骤。在一些实施方案中,刺激试剂刺激和/或激活tcr和/或共受体。在特定实施方案中,刺激试剂是章节iii.a.1中所述的试剂。
在某些实施方案中,在如通过章节iii.b中提供的技术基因工程化细胞(例如,转染和/或转导细胞)之前,在刺激条件下孵育富集的cd57-t细胞的一个或多个群体。在特定实施方案中,在已经从生物样品分离、选择、富集或获得一种或多种组合物之后,在刺激条件下孵育富集的cd57-t细胞的一个或多个群体。在特定实施方案中,富集的cd57-t细胞的一个或多个群体先前已经被低温保存和储存,并且在孵育前解冻。
在某些实施方案中,富集的cd57-t细胞的一个或多个群体是或包括富集的cd57-t细胞的两个单独群体。在特定实施方案中,在刺激条件下单独孵育富集的t细胞的两种单独组合物(例如,从相同生物样品选择、分离和/或富集的富集的t细胞的两种单独组合物)。在某些实施方案中,所述两种单独组合物包括富集的cd57-cd4+t细胞的组合物。在特定实施方案中,所述两种单独组合物包括富集的cd57-cd8+t细胞的组合物。在特定实施方案中,所述两种单独组合物包括富集的cd57-cd3+t细胞的组合物。在一些实施方案中,在刺激条件下单独孵育富集的cd57-cd4+t细胞和富集的cd57-cd8+t细胞的两种单独组合物。在一些实施方案中,在刺激条件下孵育富集的t细胞的单一组合物。在某些实施方案中,所述单一组合物是富集的cd57-cd4+t细胞的组合物。在某些实施方案中,所述单一组合物是富集的cd57-cd8+t细胞的组合物。在某些实施方案中,所述单一组合物是富集的cd57-cd3+t细胞的组合物。在一些实施方案中,所述单一组合物是富集的cd57-cd4+和cd57-cd8+t细胞的组合物,其是在孵育前从单独组合物组合而来。
在一些实施方案中,在刺激条件下孵育的富集的cd57-cd4+t细胞的群体包括至少为或约60%、至少为或约65%、至少为或约70%、至少为或约75%、至少为或约80%、至少为或约85%、至少为或约90%、至少为或约95%、至少为或约98%、至少为或约99%、至少为或约99.5%、至少为或约99.9%或者为或为约100%cd57-cd4+t细胞。在某些实施方案中,在刺激条件下孵育的富集的cd57-cd4+t细胞的组合物包括少于为或约40%、少于为或约35%、少于为或约30%、少于为或约25%、少于为或约20%、少于为或约15%、少于为或约10%、少于为或约5%、少于为或约1%、少于为或约0.1%或者少于为或约0.01%对cd57表达呈阳性或对cd4表达呈阴性的t细胞。
在某些实施方案中,在刺激条件下孵育的富集的cd57-cd8+t细胞的群体包括至少为或约60%、至少为或约65%、至少为或约70%、至少为或约75%、至少为或约80%、至少为或约85%、至少为或约90%、至少为或约95%、至少为或约98%、至少为或约99%、至少为或约99.5%、至少为或约99.9%或者为或为约100%cd57-cd8+t细胞。在某些实施方案中,在刺激条件下孵育的富集的cd57-cd4+t细胞的组合物包括少于为或约40%、少于为或约35%、少于为或约30%、少于为或约25%、少于为或约20%、少于为或约15%、少于为或约10%、少于为或约5%、少于为或约1%、少于为或约0.1%或者少于为或约0.01%对cd57表达呈阳性或对cd8表达呈阴性的t细胞。在某些实施方案中,在刺激条件下孵育的富集的cd57-cd8+t细胞的组合物包括少于为或约40%、少于为或约35%、少于为或约30%、少于为或约25%、少于为或约20%、少于为或约15%、少于为或约10%、少于为或约5%、少于为或约1%、少于为或约0.1%或者少于为或约0.01%对cd57表达呈阳性或对cd8表达呈阴性的t细胞。
在某些实施方案中,在刺激条件下孵育的富集的cd57-cd3+t细胞的群体包括至少为或约60%、至少为或约65%、至少为或约70%、至少为或约75%、至少为或约80%、至少为或约85%、至少为或约90%、至少为或约95%、至少为或约98%、至少为或约99%、至少为或约99.5%、至少为或约99.9%或者为或为约100%cd57-cd3+t细胞。在某些实施方案中,在刺激条件下孵育的富集的cd57-cd3+t细胞的组合物包括少于为或约40%、少于为或约35%、少于为或约30%、少于为或约25%、少于为或约20%、少于为或约15%、少于为或约10%、少于为或约5%、少于为或约1%、少于为或约0.1%或者少于为或约0.01%对cd57表达呈阳性或对cd3表达呈阴性的t细胞。
在某些实施方案中,将富集的cd57-cd4+和cd57-cd8+t细胞的单独组合物组合为单一组合物并在刺激条件下进行孵育。在某些实施方案中,在已经进行和/或完成孵育后,将富集的cd57-cd4+和富集的cd57-cd8+t细胞的单独的刺激的组合物组合为单一组合物。
在一些实施方案中,在刺激条件下孵育可以包括培养、培育、刺激、激活、繁殖,包括通过在刺激条件的存在下孵育,所述刺激条件例如设计为诱导群体中细胞的增殖、扩增、激活和/或存活,模拟抗原暴露和/或引发细胞用于基因工程化(如用于引入重组抗原受体)的条件。在特定实施方案中,刺激条件可以包括以下中的一种或多种:特定培养基、温度、氧含量、二氧化碳含量、时间、药剂(例如,营养素、氨基酸、抗生素、离子和/或刺激因子(如细胞因子、趋化因子、抗原、结合配偶体、融合蛋白、重组可溶性受体和设计为激活细胞的任何其他药剂))。
在一些方面,在刺激条件下刺激和/或孵育是根据多种技术进行,所述技术如以下文献中所述的那些:riddell等人的美国专利号6,040,177;klebanoff等人(2012)jimmunother.35(9):651-660;terakura等人(2012)blood.1:72-82;和/或wang等人(2012)jimmunother.35(9):689-701。
在一些实施方案中,通过以下方式扩增cd57-t细胞:向培养起始组合物中添加饲养细胞,如非分裂外周血单核细胞(pbmc)(例如,使得对于要扩增的初始群体中的每个t淋巴细胞,所得细胞群含有至少约5、10、20或40个或更多个pbmc饲养细胞);并且孵育培养物(例如,持续足以扩增t细胞数量的时间)。在一些方面,非分裂饲养细胞可以包含γ辐照的pbmc饲养细胞。在一些实施方案中,用约3000至3600拉德范围内的γ射线辐照pbmc以防止细胞分裂。在一些方面,在添加t细胞群之前,将饲养细胞添加至培养基。
在一些实施方案中,刺激条件包括适合人t淋巴细胞生长的温度,例如,至少约25℃,通常至少约30℃,并且通常为或约37℃。在一些实施方案中,在培养期间实现温度变动,如从37℃至35℃。任选地,孵育还可以包括添加非分裂的ebv转化的淋巴母细胞样细胞(lcl)作为饲养细胞。可以用约6000至10,000拉德范围内的γ射线辐照lcl。在一些方面,lcl饲养细胞是以任何合适的量来提供,如lcl饲养细胞与初始t淋巴细胞的比率为至少约10:1。
在特定实施方案中,刺激条件包括将细胞与刺激试剂一起孵育、培养和/或培育。在特定实施方案中,刺激试剂是章节iii.a.1中所述的试剂。在某些实施方案中,刺激试剂含有或包括珠。在特定实施方案中,刺激试剂含有或包括寡聚试剂,例如,寡聚链霉亲和素突变蛋白试剂。在某些实施方案中,当将细胞与刺激试剂接触和/或一起孵育时,发生在刺激条件下孵育、培养和/或培育细胞的开始和/或起始。在特定实施方案中,在将细胞进行基因工程化(例如将重组多核苷酸引入细胞中(例如通过转导或转染))之前、期间和/或之后孵育细胞。在一些实施方案中,以为或为约3:1、2.5:1、2:1、1.5:1、1.25:1、1.2:1、1.1:1、1:1、0.9:1、0.8:1、0.75:1、0.67:1、0.5:1、0.3:1或0.2:1的刺激试剂和/或珠与细胞的比率孵育富集的t细胞的组合物。在特定实施方案中,刺激试剂和/或珠与细胞的比率在2.5:1与0.2:1之间、在2:1与0.5:1之间、在1.5:1与0.75:1之间、在1.25:1与0.8:1之间、在1.1:1与0.9:1之间。在特定实施方案中,刺激试剂与细胞的比率为约1:1或为1:1。
在一些实施方案中,在每106个细胞为、为约或为至少0.01μg、0.02μg、0.03μg、0.04μg、0.05μg、0.1μg、0.2μg、0.3μg、0.4μg、0.5μg、0.75μg、1μg、2μg、3μg、4μg、5μg、6μg、7μg、8μg、9μg或10μg的刺激试剂的存在下刺激细胞。在一些实施方案中,在每106个细胞为或为约4μg的刺激试剂的存在下刺激细胞。在特定实施方案中,在每106个细胞为或为约0.8μg的刺激试剂的存在下刺激细胞。
在某些实施方案中,以以下密度对所述细胞(例如,输入群体的细胞)进行刺激或使其经历刺激(例如,在刺激条件下如在刺激试剂的存在下培养):为、为约或至少0.01x106个细胞/ml、0.1x106个细胞/ml、0.5x106个细胞/ml、1.0x106个细胞/ml、1.5x106个细胞/ml、2.0x106个细胞/ml、2.5x106个细胞/ml、3.0x106个细胞/ml、4.0x106个细胞/ml、5.0x106个细胞/ml、10x106个细胞/ml、或50x106个细胞/ml。在某些实施方案中,以为、为约或至少3.0x106个细胞/ml的密度对所述细胞(例如,输入群体的细胞)进行刺激或使其经历刺激(例如,在刺激条件下如在刺激试剂的存在下培养)。在某些实施方案中,输入的细胞是活细胞。
在一些实施方案中,在刺激条件或刺激剂的存在下孵育组合物或细胞。此类条件包括设计为诱导群体中细胞的增殖、扩增、激活和/或存活,模拟抗原暴露和/或引发细胞用于基因工程化(如用于引入重组抗原受体)的那些。示例性刺激试剂如下所述。
在一些实施方案中,在一种或多种刺激条件或刺激剂存在下进行的孵育的至少一部分是在离心室的内部空腔中进行,例如在离心旋转下进行,如国际公开号wo2016/073602中所述的。在一些实施方案中,在离心室中进行的孵育的至少一部分包括与一种或多种试剂混合以诱导刺激和/或激活。在一些实施方案中,将细胞(如选择的细胞)与刺激条件或刺激剂在离心室中混合。在此类过程的一些方面,将一定体积的细胞与一定量的一种或多种刺激条件或刺激剂混合,所述刺激条件或刺激剂远小于在细胞培养板或其他系统中进行类似刺激时通常使用的刺激条件或刺激剂。
在一些实施方案中,将刺激剂添加至室空腔中的细胞,所添加的量与例如在周期性振荡或旋转的管或袋中进行选择而不在离心室中混合时,实现相同数量的细胞或相同体积的细胞的大致相同或类似的选择效率通常使用或将需要的刺激剂的量相比显著较小(例如不大于所述量的5%、10%、20%、30%、40%、50%、60%、70%或80%)。在一些实施方案中,在向细胞和刺激剂中添加孵育缓冲液的情况下进行孵育,以实现例如10ml至200ml(如至少或约至少或为约或为10ml、20ml、30ml、40ml、50ml、60ml、70ml、80ml、90ml、100ml、150ml或200ml)试剂的孵育的目标体积。在一些实施方案中,将孵育缓冲液和刺激剂在添加至细胞之前预混合。在一些实施方案中,将孵育缓冲液和刺激剂单独添加至细胞中。在一些实施方案中,在周期性温和混合条件下进行刺激孵育,这可能有助于促进能量上有利的相互作用,并且从而允许在实现细胞的刺激和激活的同时使用较少的总体刺激剂。
在一些实施方案中,孵育通常在混合条件下进行,如在旋转的存在下,通常以相对低的力或速度旋转,如速度低于用于使细胞沉淀的速度,如为或为约600rpm至1700rpm(例如,为或约或至少600rpm、1000rpm或1500rpm或1700rpm),如在室或其他容器的样品或壁处的一定rcf下,所述rcf为或为约80g至100g(例如,为或约或至少80g、85g、90g、95g或100g)。在一些实施方案中,旋转是使用如下重复间隔来进行:以这种低速旋转,之后是休息时间段,如旋转和/或休息1、2、3、4、5、6、7、8、9或10秒,如旋转大约1或2秒,然后休息大约5、6、7或8秒。
在一些实施方案中,例如与刺激剂一起孵育的总持续时间在或在约1小时与96小时之间、1小时与72小时之间、1小时与48小时之间、4小时与36小时之间、8小时与30小时之间或12小时与24小时之间,例如至少或约至少6小时、12小时、18小时、24小时、36小时或72小时。在一些实施方案中,进一步孵育进行在或约在1小时与48小时之间、4小时与36小时之间、8小时与30小时之间或12小时与24小时之间并包含端值的时间。
在一些实施方案中,将刺激(例如,在刺激条件下培养细胞)进行为、为约或小于48小时、42小时、36小时、30小时、24小时、22小时、20小时、18小时、16小时或12小时。在一些实施方案中,将刺激(例如,在刺激条件下培养细胞)进行20±4小时或者在或在约16小时与24小时之间。在特定实施方案中,将刺激(例如,在刺激条件下培养细胞)进行在或在约36小时与12小时之间、30小时与18小时之间,或者为或为约24小时或22小时。在一些实施方案中,将刺激(例如,在刺激条件下培养细胞)进行为、为约或小于2天或一天。
在特定实施方案中,对输入群体中为、为约或为至少50x106、100x106、150x106、200x106、250x106、300x106、350x106、400x106、450x106、500x106、550x106、600x106、700x106、800x106、900x106、或1,000x106的量的细胞进行刺激或使其经历刺激,例如,在刺激条件下培养。在特定实施方案中,进行刺激(例如,在刺激条件下培养)的输入群体的量是为或约50x106个细胞、为或约100x106个细胞、为或约150x106个细胞、为或约200x106个细胞、为或约250x106个细胞、为或约300x106个细胞、为或约350x106个细胞、为或约400x106个细胞、为或约450x106个细胞、为或约500x106个细胞、为或约550x106个细胞、为或约600x106个细胞、为或约700x106个细胞、为或约800x106个细胞、为或约900x106个细胞、或为或约1,000x106个细胞,或者任何前述值之间的任何值。在特定实施方案中,对输入群体中为或为约900x106的量的细胞进行刺激,例如,在刺激条件下培养。
在特定实施方案中,输入组合物按活cd4+t细胞与活cd8+t细胞的以下比率包含活cd4+t细胞和活cd8+t细胞:在1:10与10:1之间、在1:5与5:1之间、在4:1与1:4之间、在1:3与3:1之间、在2:1与1:2之间、在1.5:1与1:1.5之间、在1.25:1与1:1.25之间、在1.2:1与1:1.2之间、在1.1:1与1:1.1之间、或约1:1、或1:1。在特定实施方案中,输入组合物以约1:1或1:1的活cd4+t细胞与活cd8+t细胞的比率包含活cd4+t细胞和活cd8+t细胞。在特定实施方案中,对输入群体为或为约450x106的量的cd4+细胞进行刺激,例如,在刺激条件下培养。在特定实施方案中,对输入群体中为或为约450x106的量的cd8+细胞进行刺激,例如,在刺激条件下培养。在特定实施方案中,对输入群体中为或为约450x106的量的cd4+t细胞和为或为约450x106的量的cd8+t细胞进行刺激,例如,在刺激条件下培养。
在特定实施方案中,刺激条件包括用一种或多种细胞因子和/或在一种或多种细胞因子存在下孵育、培养和/或培育富集的t细胞的组合物。在特定实施方案中,所述一种或多种细胞因子是重组细胞因子。在一些实施方案中,所述一种或多种细胞因子是人重组细胞因子。在某些实施方案中,所述一种或多种细胞因子结合和/或能够结合由t细胞表达的和/或对t细胞而言内源的受体。在特定实施方案中,所述一种或多种细胞因子是或包括细胞因子的4-α-螺旋束家族的成员。在一些实施方案中,细胞因子的4-α-螺旋束家族的成员包括但不限于白介素2(il-2)、白介素4(il-4)、白介素7(il-7)、白介素9(il-9)、白介素12(il-12)、白介素15(il-15)、粒细胞集落刺激因子(g-csf)和粒细胞巨噬细胞集落刺激因子(gm-csf)。在一些实施方案中,所述一种或多种细胞因子是或包括il-15。在特定实施方案中,所述一种或多种细胞因子是或包括il-7。在特定实施方案中,所述一种或多种细胞因子是或包括il-2。
在某些实施方案中,所述一种或多种细胞因子的量或浓度是用国际单位(iu)测量和/或定量的。国际单位可以用于定量维生素、激素、细胞因子、疫苗、血液制品和类似的生物活性物质。在一些实施方案中,iu是或包括通过与具有特定重量和强度的国际参考标准(例如,针对il-2的who第一国际标准(who1stinternationalstandardforhumanil-2),86/504)相比的生物制剂效力的度量单位。国际单位是报告生物活性单位的唯一公认且标准化的方法,所述生物活性单位公开和源自国际合作研究工作。在特定实施方案中,可以通过与类似的who标准产品进行产品比较测试来获得细胞因子的群体、样品或来源的iu。例如,在一些实施方案中,将人重组il-2、il-7或il-15的群体、样品或来源的iu/mg分别与who标准il-2产品(nibsc代码:86/500)、who标准il-17产品(nibsc代码:90/530)和who标准il-15产品(nibsc代码:95/554)进行比较。
在一些实施方案中,以iu/mg计的生物活性等同于(以ng/ml计的ed50)-1x106。在特定实施方案中,重组人il-2或il-15的ed50等同于使用ctll-2细胞的细胞增殖的半最大刺激(xtt切割)所需的浓度。在某些实施方案中,重组人il-7的ed50等同于pha激活的人外周血淋巴细胞增殖的半最大刺激所需的浓度。与il-2的iu的测定和计算相关的细节论述于wadhwa等人,journalofimmunologicalmethods(2013),379(1-2):1-7;和gearing和thorpe,journalofimmunologicalmethods(1988),114(1-2):3-9中;与il-15的iu的测定和计算相关的细节论述于soman等人journalofimmunologicalmethods(2009)348(1-2):83-94中。
在一些实施方案中,在如下浓度的细胞因子(例如,重组人细胞因子)的存在下对细胞(例如,输入细胞)进行刺激或使其经历刺激:在1iu/ml与1,000iu/ml之间、在10iu/ml与50iu/ml之间、在50iu/ml与100iu/ml之间、在100iu/ml与200iu/ml之间、在100iu/ml与500iu/ml之间、在250iu/ml与500iu/ml之间、或在500iu/ml与1,000iu/ml之间。
在一些实施方案中,在如下浓度的重组il-2(例如,人重组il-2)存在下对细胞(例如,输入细胞)进行刺激或使其经历刺激:在1iu/ml与500iu/ml之间、在10iu/ml与250iu/ml之间、在50iu/ml与200iu/ml之间、在50iu/ml与150iu/ml之间、在75iu/ml与125iu/ml之间、在100iu/ml与200iu/ml之间、或在10iu/ml与100iu/ml之间。在特定实施方案中,在如下浓度的重组il-2存在下对细胞(例如,输入群体的细胞)进行刺激或使其经历刺激:为或为约50iu/ml、60iu/ml、70iu/ml、80iu/ml、90iu/ml、100iu/ml、110iu/ml、120iu/ml、130iu/ml、140iu/ml、150iu/ml、160iu/ml、170iu/ml、180iu/ml、190iu/ml、或100iu/ml。在一些实施方案中,在为或为约100iu/ml重组il-2(例如,人重组il-2)的存在下对细胞(例如,输入细胞)进行刺激或使其经历刺激。
在一些实施方案中,在如下浓度的重组il-7(例如,人重组il-7)存在下对细胞(例如,输入细胞)进行刺激或使其经历刺激:在100iu/ml与2,000iu/ml之间、在500iu/ml与1,000iu/ml之间、在100iu/ml与500iu/ml之间、在500iu/ml与750iu/ml之间、在750iu/ml与1,000iu/ml之间、或在550iu/ml与650iu/ml之间。在特定实施方案中,在如下浓度的il-7存在下对细胞(例如,输入细胞)进行刺激或使其经历刺激:为或为约50iu/ml、100iu/ml、150iu/ml、200iu/ml、250iu/ml、300iu/ml、350iu/ml、400iu/ml、450iu/ml、500iu/ml、550iu/ml、600iu/ml、650iu/ml、700iu/ml、750iu/ml、800iu/ml、750iu/ml、750iu/ml、750iu/ml、或1,000iu/ml。在特定实施方案中,在为或为约600iu/ml重组il-7(例如,人重组il-7)的存在下对细胞(例如,输入细胞)进行刺激或使其经历刺激。
在一些实施方案中,在如下浓度的重组il-15(例如,人重组il-15)存在下对细胞(例如,输入细胞)进行刺激或使其经历刺激:在1iu/ml与500iu/ml之间、在10iu/ml与250iu/ml之间、在50iu/ml与200iu/ml之间、在50iu/ml与150iu/ml之间、在75iu/ml与125iu/ml之间、在100iu/ml与200iu/ml之间、或在10iu/ml与100iu/ml之间。在特定实施方案中,在如下浓度的重组il-15存在下对细胞(例如,输入群体的细胞)进行刺激或使其经历刺激:为或为约50iu/ml、60iu/ml、70iu/ml、80iu/ml、90iu/ml、100iu/ml、110iu/ml、120iu/ml、130iu/ml、140iu/ml、150iu/ml、160iu/ml、170iu/ml、180iu/ml、190iu/ml、或200iu/ml。在一些实施方案中,在为或为约100iu/ml重组il-15(例如,人重组il-15)的存在下对细胞(例如,输入细胞)进行刺激或使其经历刺激。
在特定实施方案中,在刺激条件下在il-2、il-7和/或il-15的存在下对细胞(例如,来自输入群体的细胞)进行刺激或使其经历刺激。在一些实施方案中,il-2、il-7和/或il-15是重组的。在某些实施方案中,il-2、il-7和/或il-15是人的。在特定实施方案中,一种或多种细胞因子是或包括人重组il-2、il-7和/或il-15。在某些实施方案中,在刺激条件下在重组il-2、il-7和il-15的存在下对所述细胞进行刺激或使其经历刺激。在某些实施方案中,在刺激条件下在为或为约100iu/ml的重组il-2、为或为约600iu/ml的重组il-7和为或为约100iu/ml的重组il-15的存在下对所述细胞进行刺激或使其经历刺激。
所述条件可以包括以下中的一种或多种:特定培养基、温度、氧含量、二氧化碳含量、时间、药剂(例如,营养素、氨基酸、抗生素、离子和/或刺激因子(如细胞因子、趋化因子、抗原、结合配偶体、融合蛋白、重组可溶受体和设计为激活细胞的任何其他药剂))。
在一些方面,根据多种技术进行刺激,所述技术如以下文献中所述的那些:riddell等人的美国专利号6,040,177;klebanoff等人(2012)jimmunother.35(9):651–660;terakura等人(2012)blood.1:72–82;和/或wang等人(2012)jimmunother.35(9):689-701。
在一些实施方案中,刺激是在无血清培养基中进行。在一些实施方案中,无血清培养基是定义的和/或明确定义的细胞培养基。在某些实施方案中,无血清培养基是受控培养基,其已经过处理,例如被过滤以去除抑制剂和/或生长因子。在一些实施方案中,无血清培养基含有蛋白质。在某些实施方案中,无血清培养基可含有血清白蛋白、水解产物、生长因子、激素、载体蛋白和/或附着因子。
在一些实施方案中,刺激是在本文或pct/us2018/064627中所述的无血清培养基中进行。在一些实施方案中,无血清培养基包含补充有一种或多种补充剂的基础培养基(例如optmizertmt细胞扩增基础培养基(thermofisher))。在一些实施方案中,所述一种或多种补充剂不含血清。在一些实施方案中,无血清培养基包含补充有一种或多种另外的组分的基础培养基,所述另外的组分用于细胞(例如,t细胞)的维持、扩增和/或激活,如通过另外的补充剂(例如optmizertmt细胞扩增补充剂(thermofisher))所提供。在一些实施方案中,无血清培养基还包含血清替代物补充剂,例如,免疫细胞血清替代物,例如,thermofisher(#a2596101)、ctstm免疫细胞血清替代物或smith等人clintranslimmunology.2015年1月;4(1):e31中所述的免疫细胞血清替代物。在一些实施方案中,无血清培养基还包含游离形式的氨基酸,如l-谷氨酰胺。在一些实施方案中,无血清培养基还包含二肽形式的l-谷氨酰胺(例如,l-丙氨酰-l-谷氨酰胺),如glutamaxtm(thermofisher)中的二肽。在一些实施方案中,无血清培养基还包含一种或多种重组细胞因子,如重组人il-2、重组人il-7和/或重组人il-15。在一些实施方案中,在一种或多种刺激条件或刺激试剂存在下进行的刺激的至少一部分是在离心室的内部空腔中例如在离心旋转下进行,如在通过引用并入的国际公开号wo2016/073602中所述。在一些实施方案中,在离心室中进行的刺激的至少一部分包括与一种或多种试剂混合以诱导刺激和/或激活。在一些实施方案中,将细胞(如选择的细胞)与刺激条件或刺激剂在离心室中混合。在此类过程的一些方面,将一定体积的细胞与一定量的一种或多种刺激条件或刺激剂混合,所述刺激条件或刺激剂远小于在细胞培养板或其他系统中进行类似刺激时通常使用的刺激条件或刺激剂。
在一些实施方案中,刺激通常在混合条件下进行,例如在旋转存在下,通常以相对低的力或速度旋转,例如速度低于用于使细胞沉淀的速度,例如为或为约600rpm至1700rpm(例如,为或为约或至少600rpm、1000rpm或1500rpm或1700rpm),例如在室或其他容器的样品或壁处的一定rcf下,所述rcf为或为约80g至100g(例如,为或为约或至少80g、85g、90g、95g或100g)。在一些实施方案中,旋转是使用如下重复间隔来进行:以这种低速旋转,之后是休息时间段,如旋转和/或休息1、2、3、4、5、6、7、8、9或10秒,如旋转大约1或2秒,然后休息大约5、6、7或8秒。
在某些实施方案中,刺激是在静态条件(如不涉及培养基的离心、振荡、旋转、摇摆或灌注(例如,连续或半连续灌注)的条件)下进行。在一些实施方案中,在开始之前或之后不久,例如,在5、15或30分钟内,将细胞转移(例如,在无菌条件下转移)至容器(如袋子或小瓶),并置于孵育器中。在特定实施方案中,将孵育器设定在为、为约或至少16℃、24℃或35℃。在一些实施方案中,将孵育器设定在37℃、在约37℃或37℃±2℃、±1℃、±0.5℃或±0.1℃。在特定实施方案中,在静态条件下的刺激是在置于孵育器中的细胞培养袋中进行。在一些实施方案中,所述培养袋由单一网状物聚烯烃透气性薄膜构成,从而使得单核细胞(如果存在)能够附着至袋表面。
在特定方面,所述方法采用可逆系统,其中能够与细胞表面上的分子(细胞表面分子)结合的至少一种试剂(例如,亲和试剂或刺激试剂)与试剂(例如,亲和试剂或刺激试剂)可逆缔合。在一些情况下,所述试剂含有能够与试剂(例如,亲和试剂或刺激试剂)可逆地结合的多个结合位点。在一些情况下,所述试剂(例如,亲和试剂或刺激试剂)是多聚化试剂。在一些实施方案中,至少一种试剂(例如,亲和试剂或刺激试剂)含有可以特异性结合分子的表位或区域的至少一个结合位点b,并且还含有与所述试剂(例如,亲和试剂或刺激试剂)的至少一个结合位点z特异性结合的结合配偶体c。在一些情况下,结合配偶体c与至少一个结合位点z之间的结合相互作用是非共价相互作用。在一些实施方案中,结合配偶体c与至少一个结合位点z之间的结合相互作用(如非共价相互作用)是可逆的。
在一些实施方案中,可以在物质的存在下介导所述可逆缔合(如竞争试剂),所述物质是或含有也能够与至少一个结合位点z结合的结合位点。通常,所述物质(例如竞争试剂)由于与结合配偶体c相比对所述试剂中存在的结合位点z的结合亲和力更高和/或由于以更高浓度存在,可以起竞争者的作用,从而使结合配偶体c从所述试剂脱附和/或解离。在一些实施方案中,所述物质(例如竞争试剂)对至少一个结合位点z的亲和力大于所述药剂(例如,亲和试剂或刺激试剂)的结合配偶体c对至少一个结合位点z的亲和力。因此,在一些情况下,所述试剂的结合位点z与试剂(例如,亲和试剂或刺激试剂)的结合配偶体c之间的键可以通过添加所述物质(例如竞争试剂)来破坏,从而使所述试剂(例如,亲和试剂或刺激试剂)与试剂(例如,亲和试剂或刺激试剂)的缔合是可逆的。
可以用于此类可逆系统中的试剂在本领域中已有描述并且是已知的,参见例如,美国专利号5,168,049;5,506,121;6,103,493;7,776,562;7,981,632;8,298,782;8,735,540;9,023,604;以及国际公开的pct申请号wo2013/124474和wo2014/076277。能够形成可逆相互作用的试剂和结合配偶体以及能够逆转这种结合的物质(例如竞争剂)的非限制性例子描述于下文中。
在一些实施方案中,例如,在转导前,刺激导致细胞的激活和/或增殖。
1.刺激试剂
在特定实施方案中,刺激条件包括将细胞与刺激试剂一起孵育、培养和/或培育。在某些实施方案中,刺激试剂含有或包括珠。在某些实施方案中,当将细胞与刺激试剂一起孵育或接触时,发生刺激的开始。在特定实施方案中,刺激试剂含有或包括寡聚试剂,例如,链霉亲和素突变蛋白寡聚物。在特定实施方案中,刺激试剂激活和/或能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和/或一种或多种共刺激分子的一个或多个细胞内信号传导结构域。
在一些实施方案中,刺激条件或刺激试剂包括能够激活tcr复合物的细胞内信号传导结构域的一种或多种药剂,例如,配体。在一些实施方案中,如本文设想的药剂可以包括但不限于rna、dna、蛋白质(例如,酶)、抗原、多克隆抗体、单克隆抗体、抗体片段、碳水化合物、脂质、凝集素或对所希望的靶标具有亲和力的任何其他生物分子。在一些实施方案中,期望的靶标是t细胞受体和/或t细胞受体的组分。在某些实施方案中,期望的靶标是cd3。在某些实施方案中,期望的靶标是t细胞共刺激分子,例如cd28、cd137(4-1-bb)、ox40或icos。所述一种或多种药剂可以通过多种已知方法直接或间接附着至珠。所述附着可以是共价的、非共价的、静电的或疏水的,并且可以通过各种附着手段(包括例如化学手段、机械手段或酶促手段)来实现。在一些实施方案中,所述药剂是抗体或其抗原结合片段,如fab。在一些实施方案中,生物分子(例如,生物素化的抗cd3抗体)可以经由直接附着至珠的另一种生物分子(例如,抗生物素抗体)间接附着至珠。
在一些实施方案中,刺激试剂含有一种或多种药剂(例如抗体),所述药剂附着至珠(例如,顺磁珠)并且与细胞(例如,t细胞)上的以下大分子中的一种或多种特异性结合:cd2、cd3、cd4、cd5、cd8、cd25、cd27、cd28、cd29、cd31、cd44、cd45ra、cd45ro、cd54(icam-1)、cd127、mhci、mhcii、ctla-4、icos、pd-1、ox40、cd27l(cd70)、4-1bb(cd137)、4-1bbl、cd30l、light、il-2r、il-12r、il-1r、il-15r;ifn-γr、tnf-αr、il-4r、il-10r、cd18/cdlla(lfa-1)、cd62l(l-选择素)、cd29/cd49d(vla-4)、notch配体(例如δ样1/4、jagged1/2等)、ccr1、ccr2、ccr3、ccr4、ccr5、ccr7和cxcr3或其片段,包括这些大分子或其片段的相应配体。在一些实施方案中,附着至珠的药剂(例如抗体)与细胞(例如t细胞)上的以下大分子中的一种或多种特异性结合:cd28、cd62l、ccr7、cd27、cd127、cd3、cd4、cd8、cd45ra和/或cd45ro。
在一些实施方案中,附着至珠的一种或多种药剂是抗体。所述抗体可以包括多克隆抗体、单克隆抗体(包括具有免疫球蛋白fc区的全长抗体)、具有多表位特异性的抗体组合物、多特异性抗体(例如,双特异性抗体、双抗体和单链分子)以及抗体片段(例如,fab、f(ab')2和fv)。在一些实施方案中,刺激试剂是抗体片段(包括抗原结合片段),例如fab、fab'-sh、fv、scfv或(fab')2片段。应理解,任何同种型的恒定区都可以用于本文设想的抗体,包括igg、igm、iga、igd和ige恒定区,并且此类恒定区可以从任何人或动物物种(例如,鼠物种)获得。
在一些实施方案中,所述药剂是结合和/或识别t细胞受体的一种或多种组分的抗体。在特定实施方案中,所述药剂是抗cd3抗体。在某些实施方案中,所述药剂是结合和/或识别共同受体的抗体。在一些实施方案中,刺激试剂包含抗cd28抗体。在一些实施方案中,刺激试剂包含抗cd28抗体和抗cd3抗体。在一些实施方案中,刺激试剂包含一种或多种刺激剂。在一些实施方案中,刺激试剂包含初级和次级刺激剂。在一些实施方案中,第一刺激剂是抗cd3抗体或其抗原结合片段,例如如本文所述,并且第二刺激剂是抗cd28抗体或其抗原结合片段,例如如本文所述。在一些实施方案中,第一刺激剂是抗cd3fab,例如如本文所述,并且第二刺激剂是抗cd28fab,例如如本文所述。
在一些实施方案中,在以下比率的刺激试剂与细胞的存在下刺激细胞(例如,输入组合物的细胞):为或为约3:1、2.5:1、2:1、1.5:1、1.25:1、1.2:1、1.1:1、1:1、0.9:1、0.8:1、0.75:1、0.67:1、0.5:1、0.3:1或0.2:1。在特定实施方案中,刺激试剂与细胞的比率为在2.5:1与0.2:1之间、在2:1与0.5:1之间、在1.5:1与0.75:1之间、在1.25:1与0.8:1之间、在1.1:1与0.9:1之间。在特定实施方案中,刺激试剂与细胞的比率为约1:1或为1:1。在特定实施方案中,刺激试剂与细胞的比率为约0.3:1或为0.3:1。在特定实施方案中,刺激试剂与细胞的比率为约0.2:1或为0.2:1。
在一些实施方案中,在每106个细胞为、为约或为至少0.01μg、0.02μg、0.03μg、0.04μg、0.05μg、0.1μg、0.2μg、0.3μg、0.4μg、0.5μg、0.75μg、1μg、2μg、3μg、4μg、5μg、6μg、7μg、8μg、9μg或10μg的刺激试剂的存在下刺激细胞。在一些实施方案中,在每106个细胞为或约4μg的存在下刺激细胞。在特定实施方案中,在每106个细胞为或为约3μg的存在下对所述细胞进行刺激或使其经历刺激。在特定实施方案中,在每106个细胞为或为约2.5μg的存在下对所述细胞进行刺激或使其经历刺激。在特定实施方案中,在每106个细胞为或为约2μg的存在下对所述细胞进行刺激或使其经历刺激。在特定实施方案中,在每106个细胞为或为约1.8μg的存在下对所述细胞进行刺激或使其经历刺激。在特定实施方案中,在每106个细胞为或为约1.6μg的存在下对所述细胞进行刺激或使其经历刺激。在特定实施方案中,在每106个细胞为或为约1.4μg的存在下对所述细胞进行刺激或使其经历刺激。在特定实施方案中,在每106个细胞为或为约1.2μg的存在下对所述细胞进行刺激或使其经历刺激。在特定实施方案中,在每106个细胞为或为约1μg的存在下对所述细胞进行刺激或使其经历刺激。在特定实施方案中,在每106个细胞为或约0.8μg的存在下刺激细胞。在各种实施方案中,在每106个细胞为或约0.8μg的存在下刺激细胞。
在一些实施方案中,刺激试剂与细胞表面上的分子结合,刺激试剂与分子之间的所述结合能够诱导、递送或调节细胞中刺激信号。在一些情况下,细胞表面分子(例如受体)是信号传导分子。在一些此类情况下,刺激试剂能够与一种或多种靶细胞(例如,t细胞)表达的信号传导分子特异性结合。在一些情况下,刺激试剂是在与细胞表面分子(如受体)结合后能够诱导或递送细胞(例如,t细胞)中的刺激信号的任何药剂。在一些实施方案中,刺激信号可以具有免疫刺激性,在这种情况下刺激剂能够诱导、递送或调节参与或刺激细胞(例如t细胞)的免疫应答(例如,增加免疫细胞增殖或扩增、免疫细胞激活、免疫细胞分化、细胞因子分泌、细胞毒性活性或者免疫细胞的一种或多种其他功能活性)的信号。在一些实施方案中,刺激信号可以具有抑制性,在这种情况下刺激试剂能够诱导、递送或调节细胞(例如t细胞)中的刺激信号,所述刺激信号参与或抑制免疫应答,例如抑制或降低免疫细胞增殖或扩增、免疫细胞激活、免疫细胞分化、细胞因子分泌、细胞毒性活性或者免疫细胞的一种或多种其他功能活性。
在一些实施方案中,刺激试剂包含初级刺激剂。在一些实施方案中,初级刺激剂与样品的所选细胞表面上的受体分子结合。因此,在一些情况下,初级刺激剂递送、诱导或调节刺激信号。在一些方面,初级刺激剂对刺激信号的递送、诱导或调节实现对细胞的刺激。因此,在一些情况下,初级刺激剂向细胞递送刺激信号或提供初级激活信号,从而刺激和/或激活所述细胞。在一些实施方案中,初级刺激剂进一步诱导选择标记的下调。如本文所用,下调可以涵盖与较早时间点相比,选择标记的表达(例如,细胞表面表达)的减少。
在一些实施方案中,靶细胞(例如,t细胞)包含tcr/cd3复合物和共刺激分子(如cd28)。在此情况下,初级刺激剂与tcr/cd3复合物结合,从而在t细胞中递送刺激信号(例如,初级信号,例如,初级激活信号),并且次级刺激剂与共刺激cd28分子结合。在特定方面,初级刺激剂和/或次级刺激剂进一步诱导选择标记(例如,用于固定靶细胞(例如,t细胞)的选择标记)的下调。
在一些实施方案中,初级刺激剂在细胞(例如,t细胞)中递送tcr/cd3复合物相关刺激信号(例如,初级信号)。在一些实施方案中,初级刺激剂与含有免疫受体酪氨酸激活基序或itam的分子特异性结合。在一些方面,初级刺激剂特异性结合cd3。在一些情况下,特异性结合cd3的初级刺激剂可以选自抗cd3抗体、抗cd3抗体的二价抗体片段、抗cd3抗体的单价抗体片段和具有抗体样结合特性的蛋白质性cd3结合分子。二价抗体片段可以是f(ab')2片段或二价单链fv片段,而单价抗体片段可以选自fab片段、fv片段和单链fv片段(scfv)。在一些情况下,具有抗体样结合特性的蛋白质性cd3结合分子可以是适体、基于脂质运载蛋白家族的多肽的突变蛋白、格鲁体、基于锚蛋白支架的蛋白质、基于结晶支架的蛋白质、阿德奈汀蛋白或阿维莫蛋白。
在一些实施方案中,抗cd3fab片段可以源自由杂交瘤细胞系okt3(
在一些实施方案中,刺激剂包含次级刺激剂。在一些实施方案中,次级刺激剂与细胞表面上的分子(如细胞表面分子,例如,受体分子)结合。在一些实施方案中,次级刺激剂能够增强、减弱或修饰经由第一刺激剂结合的分子递送的刺激信号。在一些实施方案中,次级刺激剂递送、诱导或调节刺激信号,例如,第二或另外的刺激信号。在一些方面,次级刺激剂增强或加强由初级刺激剂诱导的刺激信号。在一些实施方案中,次级刺激剂与辅助分子结合和/或可以刺激或诱导细胞中的辅助或次级刺激信号。在一些方面,次级刺激剂与共刺激分子结合和/或提供共刺激信号。
在一些实施方案中,可以包含次级刺激剂的刺激剂与第二分子结合(例如,特异性结合),所述第二分子可以是共刺激分子、辅助分子、细胞因子受体、趋化因子受体、免疫检查点分子或者tnf家族或tnf受体家族的成员。
在一些实施方案中,细胞(例如,t细胞)上的分子可以是cd28,并且次级刺激剂特异性结合cd28。在一些方面,特异性结合cd28的次级刺激剂可以选自抗cd28抗体、抗cd28抗体的二价抗体片段、抗cd28抗体的单价抗体片段和具有抗体样结合特性的蛋白质性cd28结合分子。二价抗体片段可以是f(ab')2片段或二价单链fv片段,而单价抗体片段可以选自fab片段、fv片段和单链fv片段(scfv)。具有抗体样结合特性的蛋白质性cd28结合分子可以是适体、基于脂质运载蛋白家族的多肽的突变蛋白、格鲁体、基于锚蛋白支架的蛋白质、基于结晶支架的蛋白质、阿德奈汀蛋白和阿维莫蛋白。
在一些实施方案中,抗cd28fab片段可以源自抗体cd28.3(作为合成单链fv构建体以genbank登录号af451974.1存放;还参见vanhove等人,blood,2003年7月15日,第102卷,第2期,第564-570页),其可变重链和轻链分别包含seqidno:91和92。在一些实施方案中,抗cd28fab包含seqidno:91和92中分别所示的可变重链和轻链的cdr。
在一些实施方案中,细胞(例如,t细胞)上的分子是cd90,并且次级刺激剂特异性结合cd90。在一些方面,特异性结合cd90的次级刺激剂可以选自抗cd90抗体、抗cd90抗体的二价抗体片段、抗cd90抗体的单价抗体片段和具有抗体样结合特性的蛋白质性cd90结合分子。抗体或抗原结合片段可以源自本领域中已知的任一种。参见例如,抗cd90抗体g7(biolegend,目录号105201)。
在一些实施方案中,细胞(例如,t细胞)上的分子是cd95,并且次级刺激剂特异性结合cd95。在一些方面,特异性结合cd95的次级刺激剂可以选自抗cd95抗体、抗cd95抗体的二价抗体片段、抗cd95抗体的单价抗体片段和具有抗体样结合特性的蛋白质性cd95结合分子。抗体或抗原结合片段可以源自本领域中已知的任一种。例如,在一些方面,抗cd90抗体可以是单克隆小鼠抗人cd95ch11(upstatebiotechnology,普莱西德湖,纽约州)或者可以是抗cd95mab7c11或抗apo-1,如paulsen等人celldeath&differentiation18.4(2011):619-631中所述。
在一些实施方案中,细胞(例如,t细胞或b细胞)上的分子可以是cd137,并且次级刺激剂特异性结合cd137。在一些方面,特异性结合cd137的次级刺激剂可以选自抗cd137抗体、抗cd137抗体的二价抗体片段、抗cd137抗体的单价抗体片段和具有抗体样结合特性的蛋白质性cd137结合分子。抗体或抗原结合片段可以源自本领域中已知的任一种。例如,抗cd137抗体可以是lob12、igg2a或lob12.3、如taraban等人eurjimmunol.2002年12月;32(12):3617-27中所述的igg1。还参见例如,us6569997、us6303121、mittler等人immunolres.2004;29(1-3):197-208。
在一些实施方案中,细胞(例如,b细胞)上的分子可以是cd40,并且次级刺激剂特异性结合cd40。在一些方面,特异性结合cd40的次级刺激剂可以选自抗cd40抗体、抗cd40抗体的二价抗体片段、抗cd40抗体的单价抗体片段和具有抗体样结合特性的蛋白质性cd40结合分子。
在一些实施方案中,细胞(例如,t细胞)上的分子可以是cd40l(cd154),并且次级刺激剂特异性结合cd40l。在一些方面,特异性结合cd40l的次级刺激剂可以选自抗cd40l抗体、抗cd40l抗体的二价抗体片段、抗cd40l抗体的单价抗体片段和具有抗体样结合特性的蛋白质性cd40l结合分子。抗体或抗原结合片段可以源自本领域中已知的任一种。例如,抗cd40l抗体在一些方面可以是hu5c8,如blair等人jem第191卷第4期651-660中所述。还参见例如wo1999061065、us20010026932、us7547438、wo2001056603。
在一些实施方案中,细胞(例如,t细胞)上的分子可以是诱导型t细胞共刺激物(icos),并且次级刺激剂特异性结合icos。在一些方面,特异性结合icos的次级刺激剂可以选自抗icos抗体、抗icos抗体的二价抗体片段、抗icos抗体的单价抗体片段和具有抗体样结合特性的蛋白质性icos结合分子。抗体或抗原结合片段可以源自本领域中已知的任一种。参见例如,us20080279851和deng等人hybridhybridomics.2004年6月;23(3):176-82。
在一些实施方案中,细胞(例如,t细胞)上的分子可以是t细胞的激活接头(lat),并且次级刺激剂特异性结合lat。在一些方面,特异性结合lat的次级刺激剂可以选自抗lat抗体、抗lat抗体的二价抗体片段、抗lat抗体的单价抗体片段和具有抗体样结合特性的蛋白质性lat结合分子。抗体或抗原结合片段可以源自本领域中已知的任一种。
在一些实施方案中,细胞(例如,t细胞)上的分子可以是cd27,并且次级刺激剂特异性结合cd27。在一些方面,特异性结合cd27的次级刺激剂可以选自抗cd27抗体、抗cd27抗体的二价抗体片段、抗cd27抗体的单价抗体片段和具有抗体样结合特性的蛋白质性cd27结合分子。抗体或抗原结合片段可以源自本领域中已知的任一种。参见例如,wo2008051424。
在一些实施方案中,细胞(例如,t细胞)上的分子可以是ox40,并且次级刺激剂特异性结合ox40。在一些方面,特异性结合ox40的次级刺激剂可以选自抗ox40抗体、抗ox40抗体的二价抗体片段、抗ox40抗体的单价抗体片段和具有抗体样结合特性的蛋白质性ox40结合分子。抗体或抗原结合片段可以源自本领域中已知的任一种。参见例如,wo2013038191;melero等人clincancerres.2013年3月1日;19(5):1044-53。
在一些实施方案中,细胞(例如,t细胞)上的分子可以是hvem,并且次级刺激剂特异性结合hvem。在一些方面,特异性结合hvem的次级刺激剂可以选自抗hvem抗体、抗hvem抗体的二价抗体片段、抗hvem抗体的单价抗体片段和具有抗体样结合特性的蛋白质性hvem结合分子。抗体或抗原结合片段可以源自本领域中已知的任一种。参见例如,wo2006054961、wo2007001459;park等人cancerimmunolimmunother.2012年2月;61(2):203-14。
在任何上文例子中,二价抗体片段可以是(fab)2'片段或二价单链fv片段,而单价抗体片段可以选自fab片段、fv片段和单链fv片段(scfv)。在任何上文例子中,具有抗体样结合特性的蛋白质性结合分子可以是适体、基于脂质运载蛋白家族的多肽的突变蛋白、格鲁体、基于锚蛋白支架的蛋白质、基于结晶支架的蛋白质、阿德奈汀蛋白和阿维莫蛋白。
在一些方面,刺激剂特异性靶向靶细胞表面上表达的分子,其中所述分子是tcr、嵌合抗原受体或者包含免疫受体酪氨酸激活基序或itam的分子。例如,靶细胞表面上表达的分子选自t细胞或b细胞抗原受体复合物、cd3链、cd3ζ、t细胞受体或b细胞受体的抗原结合部分、或者嵌合抗原受体。在一些情况下,刺激剂靶向肽:mhci类复合物。
在一些实施方案中,刺激剂与靶细胞表面上表达的分子的his标记的细胞外结构域结合。在一些情况下,刺激剂含有与带镍的三nta缀合的肽序列trp-ser-his-pro-gln-phe-glu-lys(也称为
在一些实施方案中,刺激剂与重组受体(例如,car)的抗体部分特异性结合。在一些情况下,重组受体的抗体部分包括免疫球蛋白恒定区的至少一部分,如铰链区(例如,igg4铰链区)和/或ch1/cl和/或fc区。在一些实施方案中,所述恒定区或部分是人igg(如igg4或igg1)的。在一些情况下,所述试剂加载有识别igg4间隔子的αigg。
在一些实施方案中,期望的靶标是t细胞受体和/或t细胞受体的组分。在某些实施方案中,期望的靶标是cd3。在某些实施方案中,期望的靶标是t细胞共刺激分子,例如cd28、cd137(4-1-bb)、ox40或icos。
在一些实施方案中,例如在刺激剂不与刺激试剂或受体结合剂试剂结合时,所述刺激剂是抗体、二价抗体片段、f(ab)2或二价单链fv片段。在一些实施方案中,在刺激剂不与所述试剂结合时,所述刺激剂不包括结合配偶体c。
a.珠试剂
在某些实施方案中,刺激试剂含有与能够激活和/或扩增细胞(例如,t细胞)的一种或多种药剂(例如,生物分子)缀合或连接的颗粒(例如,珠)。在一些实施方案中,一种或多种药剂与珠结合。在一些实施方案中,所述珠是生物相容的,即由适合于生物学用途的材料构成。在一些实施方案中,所述珠对培养的细胞(例如,培养的t细胞)是无毒的。在一些实施方案中,所述珠可以是任何颗粒,其能够以允许药剂与细胞之间相互作用的方式附着药剂。
在一些实施方案中,刺激试剂含有珠和直接与细胞表面上的大分子相互作用的一种或多种药剂。在某些实施方案中,所述珠(例如顺磁珠)经由对细胞上的一种或多种大分子(例如一种或多种细胞表面蛋白)具有特异性的一种或多种药剂(例如抗体)与细胞相互作用。在某些实施方案中,将珠(例如顺磁珠)用本文所述的第一药剂(例如一抗(例如抗生物素抗体)或其他生物分子)标记,然后添加第二药剂(例如二抗(例如,生物素化的抗cd3抗体)或其他第二生物分子(例如,链霉亲和素),由此所述二抗或其他第二生物分子与颗粒上的此类一抗或其他生物分子特异性结合。
在一些实施方案中,珠的直径大于约0.001μm、大于约0.01μm、大于约0.1μm、大于约1.0μm、大于约10μm、大于约50μm、大于约100μm或大于约1000μm且不超过约1500μm。在一些实施方案中,珠的直径为约1.0μm至约500μm、约1.0μm至约150μm、约1.0μm至约30μm、约1.0μm至约10μm、约1.0μm至约5.0μm、约2.0μm至约5.0μm、或约3.0μm至约5.0μm。在一些实施方案中,珠的直径为约3μm至约5μm。在一些实施方案中,珠的直径为至少或至少约或约0.001μm、0.01μm、0.1μm、0.5μm、1.0μm、1.5μm、2.0μm、2.5μm、3.0μm、3.5μm、4.0μm、4.5μm、5.0μm、5.5μm、6.0μm、6.5μm、7.0μm、7.5μm、8.0μm、8.5μm、9.0μm、9.5μm、10μm、12μm、14μm、16μm、18μm或20μm。在某些实施方案中,柱的直径是为或约4.5μm。在某些实施方案中,珠的直径是为或约2.8μm。
在一些实施方案中,珠的密度为大于0.001g/cm3、大于0.01g/cm3、大于0.05g/cm3、大于0.1g/cm3、大于0.5g/cm3、大于0.6g/cm3、大于0.7g/cm3、大于0.8g/cm3、大于0.9g/cm3、大于1g/cm3、大于1.1g/cm3、大于1.2g/cm3、大于1.3g/cm3、大于1.4g/cm3、大于1.5g/cm3、大于2g/cm3、大于3g/cm3、大于4g/cm3或大于5g/cm3。在一些实施方案中,珠的密度在约0.001g/cm3与约100g/cm3、约0.01g/cm3与约50g/cm3、约0.1g/cm3与约10g/cm3、约0.1g/cm3与约.5g/cm3、约0.5g/cm3与约1g/cm3、约0.5g/cm3与约1.5g/cm3、约1g/cm3与约1.5g/cm3、约1g/cm3与约2g/cm3或约1g/cm3与约5g/cm3之间。在一些实施方案中,珠的密度为约0.5g/cm3、约0.5g/cm3、约0.6g/cm3、约0.7g/cm3、约0.8g/cm3、约0.9g/cm3、约1.0g/cm3、约1.1g/cm3、约1.2g/cm3、约1.3g/cm3、约1.4g/cm3、约1.5g/cm3、约1.6g/cm3、约1.7g/cm3、约1.8g/cm3、约1.9g/cm3、或约2.0g/cm3。在某些实施方案中,住的密度为约1.6g/cm3。在特定实施方案中,珠或颗粒的密度为约1.5g/cm3。在某些实施方案中,颗粒的密度为约1.3g/cm3。
在某些实施方案中,多个珠具有均匀的密度。在某些实施方案中,均匀的密度包含平均珠密度的小于10%、小于5%或小于1%的密度标准差。
在一些实施方案中,珠在珠的表面处或附近含有可以与药剂偶联、连接或缀合的至少一种材料。在一些实施方案中,珠是表面官能化的,即包含能够与结合分子(例如,多核苷酸或多肽)形成共价键的官能团。在特定实施方案中,珠包含表面暴露的羧基、氨基、羟基、甲苯磺酰基、环氧基和/或氯甲基。在特定实施方案中,珠包含表面暴露的琼脂糖和/或琼脂糖凝胶。在某些实施方案中,珠表面包含附着的刺激试剂,所述刺激试剂可以结合或附着结合分子。在特定实施方案中,生物分子是多肽。在一些实施方案中,珠包含表面暴露的蛋白质a、蛋白质g或生物素。
在一些实施方案中,珠在磁场中反应。在一些实施方案中,珠是磁珠。在一些实施方案中,磁珠是顺磁性的。在特定实施方案中,磁珠是超顺磁性的。在某些实施方案中,珠不展示任何磁性特性,除非使它们暴露于磁场。
在特定实施方案中,珠包含磁核、顺磁核或超顺磁核。在一些实施方案中,磁核含有金属。在一些实施方案中,所述金属可以是但不限于铁、镍、铜、钴、钆、锰、钽、锌、锆或其任何组合。在某些实施方案中,磁核包含金属氧化物(例如,氧化铁)、铁氧体(例如,锰铁氧体、钴铁氧体、镍铁氧体等)、赤铁矿和金属合金(例如,cotazn)。在一些实施方案中,磁核包含铁氧体、金属、金属合金、氧化铁或二氧化铬中的一种或多种。在一些实施方案中,磁核包含元素铁或其化合物。在一些实施方案中,磁核包含磁铁矿(fe3o4)、磁赤铁矿(γfe2o3)或硫复铁矿(fe3s4)中的一种或多种。在一些实施方案中,内核包含氧化铁(例如,fe3o4)。
在某些实施方案中,珠含有被表面官能化的涂层(coat或coating)覆盖的磁核、顺磁核和/或超顺磁核。在一些实施方案中,涂层可以含有如下材料:其可以包括但不限于聚合物、多糖、二氧化硅、脂肪酸、蛋白质、碳、琼脂糖、琼脂糖凝胶或其组合。在一些实施方案中,聚合物可以是聚乙二醇、聚(乳酸-共-乙醇酸)、聚戊二醛、聚氨酯、聚苯乙烯或聚乙烯醇。在某些实施方案中,外涂层(coat或coating)包含聚苯乙烯。在特定实施方案中,外涂层是表面官能化的。
在一些实施方案中,刺激试剂包含珠,其含有金属氧化物核(例如,氧化铁核)和涂层,其中所述金属氧化物核包含至少一种多糖(例如,葡聚糖),并且其中所述涂层包含至少一种多糖(例如,氨基葡聚糖)、至少一种聚合物(例如,聚氨酯)和二氧化硅。在一些实施方案中,金属氧化物核是胶体氧化铁核。在某些实施方案中,一种或多种药剂包括抗体或其抗原结合片段。在特定实施方案中,一种或多种药剂包括抗cd3抗体和抗cd28抗体。在一些实施方案中,刺激试剂包含抗cd3抗体、抗cd28抗体和抗生物素抗体。在一些实施方案中,刺激试剂包含抗生物素抗体。在一些实施方案中,珠的直径为约3μm至约10μm。在一些实施方案中,珠的直径为约3μm至约5μm。在某些实施方案中,珠的直径为约3.5μm。
在一些实施方案中,刺激试剂包括附着至珠的一种或多种药剂,所述珠包含金属氧化物核(例如,氧化铁内核)和涂层(例如,保护涂层),其中所述涂层包含聚苯乙烯。在某些实施方案中,珠是单分散的顺磁(例如超顺磁)珠,其包含顺磁(例如超顺磁)铁核(例如,包含磁铁矿(fe3o4)和/或磁赤铁矿(γfe2o3)的核)和聚苯乙烯涂层(coat或coating)。在一些实施方案中,珠是无孔的。在一些实施方案中,珠含有一种或多种药剂附着的官能化表面。在某些实施方案中,一种或多种药剂与珠在表面上共价结合。在一些实施方案中,一种或多种药剂包括抗体或其抗原结合片段。在一些实施方案中,一种或多种药剂包括抗cd3抗体和抗cd28抗体。在一些实施方案中,一种或多种药剂包括抗cd3抗体和/或抗cd28抗体、以及能够结合标记的抗体(例如生物素化的抗体)(如标记的抗cd3或抗cd28抗体)的抗体或其抗原片段。在某些实施方案中,珠具有约1.5g/cm3的密度和约1m2/g至约4m2/g的表面积。在特定实施方案中;珠是单分散的超顺磁珠,其具有约4.5μm的直径和约1.5g/cm3的密度。在一些实施方案中,珠是具有约2.8μm的平均直径和约1.3g/cm3的密度的单分散的超顺磁珠。
在一些实施方案中,将富集的t细胞的群体与刺激试剂以如下珠与细胞的比率一起孵育:为或为约3:1、2.5:1、2:1、1.5:1、1.25:1、1.2:1、1.1:1、1:1、0.9:1、0.8:1、0.75:1、0.67:1、0.5:1、0.3:1、或0.2:1。在特定实施方案中,珠与细胞的比率在2.5:1与0.2:1之间、在2:1与0.5:1之间、在1.5:1与0.75:1之间、在1.25:1与0.8:1之间、在1.1:1与0.9:1之间。在特定实施方案中,珠与细胞的比率为约1:1或为1:1。
b.寡聚链霉亲和素突变蛋白试剂
在特定实施方案中,刺激试剂含有寡聚试剂(例如链霉亲和素突变蛋白试剂),所述寡聚试剂被缀合、连接或附着至一种或多种能够激活tcr复合物的细胞内信号传导结构域的药剂(例如配体)。在一些实施方案中,一种或多种药剂具有能够在特定的结合位点(例如结合位点z)上结合寡聚试剂的附着的结合结构域或结合配偶体(例如,结合配偶体c)。在一些实施方案中,多种药剂可逆地结合至寡聚试剂。在各种实施方案中,寡聚试剂具有多个特定结合位点,所述多个特定结合位点在某些实施方案中在结合结构域(例如,结合配偶体c)处可逆地结合多种药剂。在一些实施方案中,在竞争试剂(例如还能够结合特定结合位点(例如结合位点z)的试剂)的存在下结合药剂的量被降低或减少。
在一些实施方案中,刺激试剂是或包括可逆系统,其中至少一种药剂(例如,能够在细胞(如t细胞)中产生信号的药剂)与寡聚试剂缔合(例如可逆地缔合)。寡聚刺激试剂的非限制性例子可以发现于例如国际公开的pct申请号wo2018/197949中,所述申请的内容通过引用以其整体并入本文。在一些实施方案中,所述试剂含有能够与药剂结合(例如可逆地结合)的多个结合位点。在一些情况下,所述试剂是具有能够在细胞(如t细胞)中产生信号的至少一种附着的药剂的寡聚颗粒试剂。在一些实施方案中,所述药剂含有可以特异性结合分子的表位或区域的至少一个结合位点(例如结合位点b)并且还含有与试剂的至少一个结合位点(例如,试剂的结合位点z)结合的结合配偶体(在本文中也称为结合配偶体c)。在一些实施方案中,结合配偶体c与至少一个结合位点z之间的结合相互作用是非共价相互作用。在一些情况下,结合配偶体c与至少一个结合位点z之间的结合相互作用是共价相互作用。在一些实施方案中,结合配偶体c与至少一个结合位点z之间的结合相互作用(如非共价相互作用)是可逆的。
在此类可逆系统中可用作寡聚试剂的物质是已知的,参见例如美国专利号5,168,049;5,506,121;6,103,493;7,776,562;7,981,632;8,298,782;8,735,540;9,023,604;和国际公开pct申请号wo2013/124474和wo2014/076277。下文描述了能够形成可逆相互作用的试剂和结合配偶体以及能够逆转这种结合的物质(例如竞争试剂)的非限制性例子。
在一些实施方案中,寡聚试剂是链霉亲和素、链霉亲和素突变蛋白或类似物、抗生物素蛋白、抗生物素蛋白突变蛋白或类似物(如中性抗生物素蛋白)或其混合物的寡聚物,其中这种寡聚试剂含有用于与药剂的结合结构域(例如,结合配偶体c)可逆地缔合的一个或多个结合位点。在一些实施方案中,所述药剂的结合结构域可以是生物素、生物素衍生物或类似物、或链霉亲和素结合肽或能够特异性结合链霉亲和素、链霉亲和素突变蛋白或类似物、抗生物素蛋白或抗生物素蛋白突变蛋白或类似物的其他分子。
在某些实施方案中,一种或多种药剂(例如,能够在细胞如t细胞中产生信号的药剂)例如经由寡聚试剂上存在的多个特定结合位点(例如,结合位点z)与寡聚试剂缔合(如可逆地结合)。在一些情况下,这导致所述药剂彼此紧密地排列,使得如果使具有由所述药剂结合或识别的(至少两个拷贝的)细胞表面分子的靶细胞与所述药剂接触,则可以发生亲合力效应。
在一些实施方案中,寡聚试剂是链霉亲和素寡聚物、链霉亲和素突变蛋白寡聚物、链霉亲和素类似物寡聚物、抗生物素蛋白寡聚物、由抗生物素蛋白突变蛋白或抗生物素蛋白类似物(如中性抗生物素蛋白)构成的寡聚物或其混合物。在特定实施方案中,寡聚试剂含有能够与药剂的结合结构域(例如,结合配偶体c)结合的特定结合位点。在一些实施方案中,结合结构域可以是生物素、生物素衍生物或类似物、或链霉亲和素结合肽或能够与链霉亲和素、链霉亲和素突变蛋白或类似物、抗生物素蛋白或抗生物素蛋白突变蛋白或类似物特异性结合的其他分子。本文提供的方法还考虑,寡聚试剂可以包含能够与以下结合的分子:寡聚组氨酸亲和标签、谷胱甘肽-s-转移酶、钙调蛋白或其类似物、钙调蛋白结合肽(cbp)、flag-肽、ha标签、麦芽糖结合蛋白(mbp)、hsv表位、myc表位和/或生物素化的载体蛋白。
在一些实施方案中,链霉亲和素可以是野生型链霉亲和素、链霉亲和素突变蛋白或类似物(如链霉亲和素样多肽)。同样,在一些方面,抗生物素蛋白包括野生型抗生物素蛋白、或者抗生物素蛋白的突变蛋白或类似物(如中性抗生物素蛋白,所述中性抗生物素蛋白是具有修饰的精氨酸的去糖基化抗生物素蛋白,其通常展现更中性的pi并且可用作天然抗生物素蛋白的替代物)。通常,去糖基化的中性形式的抗生物素蛋白包括例如那些可商购获得的形式,如可通过sigmaaldrich公司获得的“extravidin”,或可从thermoscientific或invitrogen公司获得的“neutravidin”。
在一些实施方案中,所述试剂是链霉亲和素或链霉亲和素突变蛋白或类似物。在一些实施方案中,野生型链霉亲和素(wt-链霉亲和素)具有argarana等人,nucleicacidsres.14(1986)1871-1882中披露的氨基酸序列(seqidno:66)。通常,链霉亲和素在自然界中作为四个相同亚基的四聚体存在,即它是同四聚体,其中每个亚基含有针对生物素、生物素衍生物或类似物或生物素模拟物的单一结合位点。链霉亲和素亚基的示例性序列是seqidno:66所示的氨基酸序列,但是这个序列还可以包括在来自其他链霉菌属(streptomyces)物种的同源物中存在的序列。特定地,链霉亲和素的每个亚基可以展现对生物素的强结合亲和力,其平衡解离常数(kd)大致为约10-14m。在一些情况下,链霉亲和素可以作为单价四聚体存在,其中四个结合位点中仅一个具有功能性(howarth等人(2006)nat.methods,3:267-73;zhang等人(2015)biochem.biophys.res.commun.,463:1059-63);作为二价四聚体存在,其中四个结合位点中的两个具有功能性(fairhead等人(2013)j.mol.biol.,426:199-214);或者可以以单体或二聚形式存在(wu等人(2005)j.biol.chem.,280:23225-31;lim等人(2010)biochemistry,50:8682-91)。
在一些实施方案中,链霉亲和素可以是任何形式,如野生型或未经修饰的链霉亲和素,如来自链霉菌属物种的链霉亲和素或其功能活性片段,所述功能活性片段包括含有针对生物素、生物素衍生物或类似物或生物素模拟物的结合位点的至少一个功能性亚基,如通常含有seqidno:66所示的来自阿维丁链霉菌(streptomycesavidinii)的野生型链霉亲和素的至少一个功能性亚基或其功能活性片段。例如,在一些实施方案中,链霉亲和素可以包括野生型链霉亲和素的片段,所述片段在n末端和/或c末端被缩短。这种最小链霉亲和素包括在seqidno:66的氨基酸位置10至16的区域中的n末端开始并且在seqidno:66的氨基酸位置133至142的区域中的c末端终止的任何链霉亲和素。在一些实施方案中,链霉亲和素的功能活性片段含有在seqidno:67中所示的氨基酸序列。在一些实施方案中,如seqidno:67所示的链霉亲和素可以在对应于ala13(其编号示于seqidno:66中)的位置进一步含有n末端甲硫氨酸。提及链霉亲和素或链霉亲和素突变蛋白中残基的位置是参考在seqidno:66中残基的编号。
链霉亲和素或链霉亲和素突变蛋白的例子在例如wo86/02077、de19641876al、us6,022,951、wo98/40396或wo96/24606中有提及。链霉亲和素突变蛋白的例子是已知的,参见例如,美国专利号5,168,049;5,506,121;6,022,951;6,156,493;6,165,750;6,103,493;或6,368,813;或者国际公开的pct申请号wo2014/076277。
在一些实施方案中,链霉亲和素突变蛋白可以含有不是未经修饰的或野生型链霉亲和素的一部分的氨基酸,或者可以仅包括野生型或未经修饰的链霉亲和素的一部分。在一些实施方案中,链霉亲和素突变蛋白含有至少一个亚基,所述至少一个亚基与未经修饰的或野生型链霉亲和素的亚基相比(例如与在seqidno:66所示的野生型链霉亲和素亚基或例如在seqidno:67所示的其功能活性片段相比)可以具有一个或多个氨基酸取代(替代)。
在一些实施方案中,链霉亲和素或链霉亲和素突变蛋白对结合结构域的平衡解离常数(kd)小于1x10-4m、5x10-4m、1x10-5m、5x10-5m、1x10-6m、5x10-6m或1x10-7m,但通常大于1x10-13m、1x10-12m或1x10-11m。例如,如美国专利号5,506,121中披露的肽序列(strep-tag)可以用作生物素模拟物并显示对链霉亲和素的结合亲和力,例如,kd大约在10-4与10-5m之间。在一些情况下,结合亲和力可以通过在链霉亲和素分子内进行突变来进一步改进,参见例如,美国专利号6,103,493或国际公开的pct申请号wo2014/076277。在一些实施方案中,结合亲和力可以通过已知方法来确定,如本文所述的任何方法。
在一些实施方案中,所述试剂(如链霉亲和素或链霉亲和素突变蛋白)展现出对肽配体结合配偶体的结合亲和力,所述肽配体结合配偶体可以是药剂(例如受体结合剂或选择剂)中存在的结合配偶体c。在一些实施方案中,肽序列含有具有通式his-pro-xaa的序列,其中xaa是谷氨酰胺、天冬酰胺或甲硫氨酸,如含于seqidno:83中所示的序列中。在一些实施方案中,肽序列具有seqidno:83中所示的通式,如seqidno:74中所示。在一个例子中,肽序列是trp-arg-his-pro-gln-phe-gly-gly(也称为
在一些实施方案中,链霉亲和素突变蛋白是如美国专利号6,103,493中所述的突变体。在一些实施方案中,基于野生型链霉亲和素的氨基酸序列(如seqidno:66中所示),链霉亲和素突变蛋白在氨基酸位置44至53的区域内含有至少一个突变。在一些实施方案中,链霉亲和素突变蛋白在一个或多个残基44、45、46和/或47处含有突变。在一些实施方案中,链霉亲和素突变蛋白含有疏水性脂肪族氨基酸(例如val、ala、ile或leu)对野生型链霉亲和素的位置44处的glu的替代,位置45处的任何氨基酸,位置46处的脂肪族氨基酸(如疏水性脂肪族氨基酸),和/或碱性氨基酸(例如arg或lys,如通常arg)对位置47处的val的替代。在一些实施方案中,ala处于位置46和/或arg处于位置47和/或val或ile处于位置44。在一些实施方案中,链霉亲和素突变体含有残基val44-thr45-ala46-arg47,如含有seqidno:80或seqidno:81或82所示氨基酸序列的示例性链霉亲和素突变蛋白中所示(也称为链霉亲和素突变体1,sam1)。在一些实施方案中,链霉亲和素突变蛋白含有残基ile44-gly45-ala46-arg47,如含有seqidno:85、68或73所示氨基酸序列的示例性链霉亲和素突变蛋白中所示(也称为sam2)。在一些情况下,这种链霉亲和素突变蛋白描述于例如美国专利6,103,493中,并且可以在商标
在一些实施方案中,链霉亲和素突变蛋白展现特征为如下平衡解离常数(kd)的结合亲和力:对于肽配体(trp-arg-his-pro-gln-phe-gly-gly;也称为
在一些实施方案中,所得链霉亲和素突变蛋白展现特征为如下平衡缔合常数(ka)的结合亲和力:对于肽配体(trp-arg-his-pro-gln-phe-gly-gly;也称为
在特定实施方案中,本文提供了由多个链霉亲和素或链霉亲和素突变蛋白四聚体构成和/或含有多个链霉亲和素或链霉亲和素突变蛋白四聚体的寡聚颗粒试剂。在某些实施方案中,本文提供的寡聚颗粒试剂含有可逆地结合或能够可逆地结合一种或多种药剂(例如刺激剂和/或选择剂)的多个结合位点。在一些实施方案中,寡聚颗粒具有在70nm与125nm之间包含端值的半径(例如,平均半径);在1x107g/mol与1x109g/mol之间包含端值的分子量;和/或在1,000与5,000之间的链霉亲和素或链霉亲和素突变蛋白四聚体,包含端值。在一些实施方案中,寡聚颗粒试剂与一种或多种药剂结合(例如可逆地结合),所述一种或多种药剂例如为与细胞表面上的分子(例如受体)结合的药剂。在某些实施方案中,一种或多种药剂是本文(例如,在第ii.c.3部分中)所述的药剂。在一些实施方案中,所述药剂是抗cd3和/或抗cd28抗体或其抗原结合片段,如含有结合配偶体(例如,链霉亲和素结合肽,例如
在一些实施方案中,本文提供了由多个链霉亲和素或链霉亲和素突变蛋白四聚体构成和/或含有多个链霉亲和素或链霉亲和素突变蛋白四聚体的寡聚颗粒试剂。在某些实施方案中,本文提供的寡聚颗粒试剂含有可逆地结合或能够可逆地结合一种或多种药剂(例如刺激剂和/或选择剂)的多个结合位点。在一些实施方案中,寡聚颗粒具有在80nm与120nm之间且包含端值的半径(例如,平均半径);在7.5x106g/mol与2x108g/mol之间且包含端值的分子量(例如,平均分子量);和/或在500与10,000之间且包含端值的量(例如,平均量)的链霉亲和素或链霉亲和素突变蛋白四聚体。在一些实施方案中,寡聚颗粒试剂与一种或多种药剂结合(例如可逆地结合),所述一种或多种药剂例如为与细胞表面上的分子(例如受体)结合的药剂。在某些实施方案中,一种或多种药剂是本文(例如,在第ii.c.3部分中)所述的药剂。在一些实施方案中,所述药剂是抗cd3和/或抗cd28fab,例如含有结合配偶体(例如,链霉亲和素结合肽,例如
在一些实施方案中,在每106个细胞为、为约或为至少0.01μg、0.02μg、0.03μg、0.04μg、0.05μg、0.1μg、0.2μg、0.3μg、0.4μg、0.5μg、0.75μg、1μg、2μg、3μg、4μg、5μg、6μg、7μg、8μg、9μg或10μg的寡聚刺激试剂的存在下刺激细胞。在一些实施方案中,在每106个细胞为或约4μg的存在下刺激细胞。在一些实施方案中,在每106个细胞为或为约3μg的存在下对所述细胞进行刺激或使其经历刺激。在一些实施方案中,在每106个细胞为或为约2.75μg的存在下对所述细胞进行刺激或使其经历刺激。在一些实施方案中,在每106个细胞为或为约2.5μg的存在下对所述细胞进行刺激或使其经历刺激。在一些实施方案中,在每106个细胞为或为约2.25μg的存在下对所述细胞进行刺激或使其经历刺激。在一些实施方案中,在每106个细胞为或为约2μg的存在下对所述细胞进行刺激或使其经历刺激。在特定实施方案中,在每106个细胞为或为约1.8μg的存在下对所述细胞进行刺激或使其经历刺激。在特定实施方案中,在每106个细胞为或为约1.6μg的存在下对所述细胞进行刺激或使其经历刺激。在特定实施方案中,在每106个细胞为或为约1.4μg的存在下对所述细胞进行刺激或使其经历刺激。在特定实施方案中,在每106个细胞为或为约1.2μg的存在下对所述细胞进行刺激或使其经历刺激。在特定实施方案中,在每106个细胞为或为约1μg的存在下对所述细胞进行刺激或使其经历刺激。在特定实施方案中,在每106个细胞为或约0.8μg的存在下刺激细胞。在某些方面,4μg寡聚刺激试剂是或包括3μg寡聚颗粒和1μg附着药剂,例如,0.5μg抗cd3fab和0.5μg抗cd28fab。在一些实施方案中,在以下的存在下对细胞进行刺激或使其经历刺激:为或为约10x108、9x108、8x108、7x108、6x108、5x108、4x108、3x108、2x108、1x108寡聚试剂。在一些实施方案中,在以下的存在下对细胞进行刺激或使其经历刺激:为或为约7x108、6x108、5x108、4x108、3x108寡聚试剂。在一些实施方案中,在以下的存在下对细胞进行刺激或使其经历刺激:为或为约7x108至3x108寡聚试剂。在一些实施方案中,在以下的存在下对细胞进行刺激或使其经历刺激:为或为约6x108至4x108寡聚试剂。在一些实施方案中,在以下的存在下对细胞进行刺激或使其经历刺激:为或为约6x108至5x108寡聚试剂。在一些实施方案中,在以下的存在下对细胞进行刺激或使其经历刺激:为或为约5x108寡聚试剂。
在一些实施方案中,在以下比率的寡聚试剂与细胞的存在下对细胞(例如,样品的选择的细胞)进行刺激或使其经历刺激:为或为约3:1、2.5:1、2:1、1.5:1、1.25:1、1.2:1、1.1:1、1:1、0.9:1、0.8:1、0.75:1、0.67:1、0.5:1、0.3:1或0.2:1。在特定实施方案中,寡聚试剂与细胞的比率在2.5:1与0.2:1之间、在2:1与0.5:1之间、在1.5:1与0.75:1之间、在1.25:1与0.8:1之间、在1.1:1与0.9:1之间。在特定实施方案中,寡聚试剂与细胞的比率为约1:1或为1:1。在特定实施方案中,寡聚试剂与细胞的比率为约0.3:1或为0.3:1。在特定实施方案中,寡聚试剂与细胞的比率为约0.2:1或为0.2:1。
在某些方面,在寡聚试剂内,寡聚颗粒与附着药剂的质量比为约3:1。在某些方面,在寡聚试剂内,寡聚颗粒、附着的抗cd3fab与附着的抗cd28fab之间的质量比为约3:0.5:0.5。在某些方面,4μg寡聚试剂是或包括3μg寡聚颗粒和1μg附着药剂,例如,0.5μg抗cd3fab和0.5μg抗cd28fab。在其他例子中,每106个细胞的1.2μg寡聚试剂是或包括每106个细胞的0.9μg寡聚颗粒和0.3μg附着药剂,例如,0.15μg抗cd3fab和0.15μg抗cd28fab。在一些实施方案中,将寡聚试剂添加至无血清培养基,并且在无血清培养基中进行刺激,例如,如pct/us2018/064627中所述。
在一些实施方案中,无血清培养基包含补充有一种或多种补充剂的基础培养基(例如optmizertmt细胞扩增基础培养基(thermofisher))。在一些实施方案中,所述一种或多种补充剂不含血清。在一些实施方案中,无血清培养基包含补充有一种或多种另外的组分的基础培养基,所述另外的组分用于细胞(例如,t细胞)的维持、扩增和/或激活,如通过另外的补充剂(例如optmizertmt细胞扩增补充剂(thermofisher))所提供。在一些实施方案中,无血清培养基还包含血清替代物补充剂,例如,免疫细胞血清替代物,例如,thermofisher(#a2596101)、ctstm免疫细胞血清替代物或smith等人clintranslimmunology.2015年1月;4(1):e31中所述的免疫细胞血清替代物。在一些实施方案中,无血清培养基还包含游离形式的氨基酸,如l-谷氨酰胺。在一些实施方案中,无血清培养基还包含二肽形式的l-谷氨酰胺(例如,l-丙氨酰-l-谷氨酰胺),如glutamaxtm(thermofisher)中的二肽。在一些实施方案中,无血清培养基还包含一种或多种重组细胞因子,如重组人il-2、重组人il-7和/或重组人il-15。
2.刺激试剂的去除
在一些实施方案中,在收集、收获或配制细胞之前,从细胞或细胞群去除或分离刺激试剂。在一些实施方案中,在孵育(例如,本文如在章节i.d中所述的孵育)之后或期间,从细胞或细胞群去除或分离刺激试剂。在某些实施方案中,在孵育后但在用于收集、收获或配制细胞的步骤之前,细胞或细胞群经历过程、程序、步骤或技术以去除刺激试剂。在特定实施方案中,在孵育后,细胞或细胞群经历去除刺激试剂的过程、程序、步骤或技术。在一些方面,当在孵育期间从细胞分离或去除刺激试剂时,将细胞返回到与分离或去除之前相同的孵育条件,持续孵育的剩余持续时间。
在某些实施方案中,从细胞去除和/或分离刺激试剂。在不希望受理论束缚的情况下,特定的实施方案考虑,在一些情况下,在孵育期间,刺激试剂与细胞之间的结合和/或缔合可能随着时间而减少。在某些实施方案中,可以添加一种或多种药剂以减少刺激试剂与细胞之间的结合和/或缔合。在特定实施方案中,细胞培养条件的变化(例如,添加药剂)可以降低刺激试剂与细胞之间的结合和/或缔合。因此,在一些实施方案中,可以将刺激试剂与细胞分开地从孵育、细胞培养系统和/或溶液去除,例如,不会也将细胞从孵育、细胞培养系统和/或溶液去除。
在某些实施方案中,在一定时间量后将刺激试剂从细胞分离和/或去除。在特定实施方案中,时间量是从起始刺激起的时间量。在特定实施方案中,孵育的开始被认为是在或约在细胞与刺激试剂和/或含有刺激试剂的培养基或溶液接触的时候。在特定实施方案中,在起始刺激的为或约120小时、108小时、96小时、84小时、72小时、60小时、48小时、36小时、24小时或12小时(包含端值)内,将刺激试剂从细胞去除或分离。在特定实施方案中,在起始刺激后或在刺激后约48小时将刺激试剂从细胞中去除或分离。在某些实施方案中,在起始刺激后或在刺激后约72小时将刺激试剂从细胞中去除或分离。在一些实施方案中,在起始刺激后或在刺激后约96小时将刺激试剂从细胞中去除或分离。
a.珠试剂的去除
在某些实施方案中,将珠刺激试剂(例如,抗cd3/抗cd28抗体缀合的顺磁珠)从细胞或细胞群分离或去除。从细胞去除刺激试剂(例如是或含有颗粒如珠颗粒或可磁化颗粒的刺激试剂)的方法是已知的。在一些实施方案中,可以使用竞争性抗体(如未标记的抗体)的使用,其例如与刺激试剂的一抗结合,并改变所述一抗对细胞上其抗原的亲和力,从而允许温和脱附。在一些情况下,在脱附之后,竞争性抗体可以保持与颗粒(例如珠颗粒)缔合,而未反应的抗体被洗掉或可以被洗掉,并且细胞不含分离、选择、富集和/或激活抗体。这种试剂的例子是detacabead(friedl等人1995;entschladen等人1997)。在一些实施方案中,可以在可切割接头(例如dna接头)存在下去除颗粒(例如珠颗粒),由此使颗粒结合的抗体缀合至接头(例如,cellection,dynal)。在一些情况下,接头区提供了可切割位点,以在分离之后例如通过添加dna酶或其他释放缓冲液从细胞中去除颗粒(例如珠颗粒)。在一些实施方案中,还可以采用其他酶促方法从细胞释放颗粒(例如珠颗粒)。在一些实施方案中,颗粒(例如珠颗粒或可磁化颗粒)是可生物降解的。
在一些实施方案中,刺激试剂是磁性、顺磁性和/或超顺磁性的,和/或含有磁性、顺磁性或超顺磁性的珠,并且可以通过将细胞暴露于磁场从细胞去除刺激试剂。含有用于产生磁场的磁体的合适设备的例子包括dynamagcts(thermofisher)、磁分离器(takara)和easysep磁体(stemcelltechnologies)。
在特定实施方案中,在所提供的方法完成之前,例如,在收获、收集和/或配制通过本文所提供的方法产生的工程化细胞之前,将刺激试剂从细胞去除或分离。在一些实施方案中,在工程化(例如转导或转染)细胞之后,从细胞去除和/或分离刺激试剂。
在一些实施方案中,在收集、收获或配制细胞之前,将刺激性珠试剂(例如刺激性磁珠试剂)从细胞或细胞群中去除或分离。在一些实施方案中,通过在孵育(例如,本文如章节i-d中所述的孵育)期间或之后暴露于磁场,将刺激性珠试剂例如刺激性磁珠试剂从细胞或细胞群中去除或分离。在某些实施方案中,在孵育之后但在收集、收获或配制细胞的步骤之前,将细胞或细胞群暴露于磁场以去除刺激性珠试剂,例如刺激性磁珠试剂。在特定实施方案中,在孵育之后,将细胞或细胞群经历暴露于磁场以去除刺激性珠试剂,例如刺激性磁珠试剂。在一些方面,当在孵育期间将刺激性珠试剂从细胞或细胞群分离或去除时,使细胞或细胞群返回到与暴露于磁场之前相同的孵育条件,持续孵育的剩余持续时间。
在特定实施方案中,在孵育的为或为约120小时、108小时、96小时、84小时、72小时、60小时、48小时、36小时、24小时或12小时(包含端值)内,例如,通过暴露于磁场,从细胞去除或分离刺激性珠试剂(例如,刺激性磁珠试剂)。在某些实施方案中,在孵育的为或为约72小时后,例如,通过暴露于磁场,从细胞去除或分离刺激性珠试剂(例如,刺激性磁珠试剂)。在一些实施方案中,在孵育的为或为约96小时后,例如,通过暴露于磁场,从细胞去除或分离刺激性珠试剂(例如,刺激性磁珠试剂)。
b.寡聚试剂的去除
在一些实施方案中,根据本文所提供的任何方法产生或生成孵育的t细胞的群体,其中将物质(如竞争剂)添加至t细胞以破坏(如减少和/或终止)一种或多种刺激剂的信号传导。在一些实施方案中,所孵育的t细胞群体含有物质(如竞争剂,例如生物素或生物素类似物,例如d-生物素)的存在。在一些实施方案中,所述物质(如竞争剂,例如生物素或生物素类似物,例如d-生物素)以如下量存在:是其中在孵育期间没有外源性添加所述物质的培养t细胞的参考群体或制剂中所述物质的量的至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少10倍、至少100倍、至少1000倍或更多倍。在一些实施方案中,所述物质(如竞争剂,例如生物素或生物素类似物,例如d-生物素)在培养t细胞的群体中的量是从或从约10μμ至100μμ、100μμ至1mm、100μμ至500μμ或10μμ至100μμ。在一些实施方案中,将10μm或约10μm的生物素或生物素类似物(例如d-生物素)添加至细胞或细胞群,以从所述细胞或细胞群分离或去除寡聚刺激试剂。
在某些实施方案中,一种或多种药剂(例如刺激或激活tcr和/或共受体的药剂)如经由寡聚试剂上存在的多个特定结合位点(例如,结合位点z)与寡聚试剂缔合(如可逆地结合)。在一些情况下,这导致所述药剂彼此紧密地排列,使得如果使具有由所述药剂结合或识别的(至少两个拷贝的)细胞表面分子的靶细胞与所述药剂接触,则可以发生亲合力效应。在一些方面,受体结合试剂在结合位点b处对细胞的受体分子具有低亲和力,使得受体结合试剂在竞争试剂的存在下从细胞解离。因此,在一些实施方案中,在竞争试剂的存在下从细胞去除所述药剂。
在一些实施方案中,寡聚刺激试剂是具有可逆地附着的抗cd3和抗cd28fab的链霉亲和素突变蛋白寡聚物。在一些实施方案中,所附着的fab含有链霉亲和素结合结构域,例如,其允许可逆地附着至链霉亲和素突变蛋白寡聚物。在一些情况下,抗cd3和抗cd28fab彼此紧密地排列,使得如果使表达cd3和/或cd28的t细胞与具有可逆地附着的fab的寡聚刺激试剂接触,则可以发生亲合力效应。在一些方面,fab对cd3和cd28具有低亲和力,使得fab在竞争试剂(例如,生物素或生物素变体或类似物)的存在下从细胞解离。因此,在一些实施方案中,在竞争试剂(例如d-生物素)的存在下将fab从细胞去除或解离。
在一些实施方案中,在收集、收获或配制细胞之前,将刺激性寡聚试剂(例如刺激性寡聚链霉亲和素突变蛋白试剂)从细胞或细胞群中去除或分离。在一些实施方案中,在孵育(例如本文如在章节i.d中所述的孵育)之后或期间,通过接触或暴露于竞争试剂(例如,生物素或生物素类似物,如d-生物素),将刺激性寡聚试剂(例如,刺激性寡聚链霉亲和素突变蛋白试剂)从细胞或细胞群去除或分离。在某些实施方案中,在孵育之后但在用于收集、收获或配制细胞的步骤之前,将细胞或细胞群接触或暴露于竞争试剂(例如,生物素或生物素类似物,如d-生物素),以去除刺激性寡聚试剂,例如刺激性寡聚链霉亲和素突变蛋白试剂。在特定实施方案中,在孵育之后,将细胞或细胞群接触或暴露于竞争试剂(例如,生物素或生物素类似物,如d-生物素),以去除刺激性寡聚试剂(例如刺激性寡聚链霉亲和素突变蛋白试剂)。在一些方面,当在孵育期间,例如通过接触或暴露于竞争试剂(例如,生物素或生物素类似物,如d-生物素),从细胞分离或去除刺激性寡聚试剂(例如,刺激性寡聚链霉亲和素突变蛋白试剂)时,将细胞返回到与分离或去除之前相同的孵育条件,持续孵育的剩余持续时间。
在一些实施方案中,使细胞与为、为约或为至少0.01μm、0.05μm、0.1μm、0.5μm、1μm、2μm、3μm、4μm、5μm、10μm、100μm、500μm、0.01μm、1mm或10mm的竞争试剂接触,以从细胞去除或分离寡聚刺激试剂。在各种实施方案中,使细胞与为、为约或为至少0.01μm、0.05μm、0.1μm、0.5μm、1μm、2μm、3μm、4μm、5μm、10μm、100μm、500μm、0.01μm、1mm或10mm的生物素或生物素类似物(如d-生物素)接触,以从细胞去除或分离具有可逆地附着的抗cd3和抗cd28fab的刺激性链霉亲和素突变蛋白寡聚物。
在特定实施方案中,在孵育(例如,在刺激性寡聚链霉亲和素突变蛋白试剂的存在下)的为或为约120小时、108小时、96小时、84小时、72小时、60小时、48小时、36小时、24小时或12小时(包含端值)内,从细胞去除或分离刺激性寡聚试剂(例如,刺激性寡聚链霉亲和素突变蛋白试剂)。在特定实施方案中,在孵育(例如,在刺激性寡聚试剂的存在下)的为或为约48小时后,从细胞去除或分离刺激试剂。在某些实施方案中,在孵育的为或为约72小时后,从细胞去除或分离刺激性寡聚试剂(例如,刺激性寡聚链霉亲和素突变蛋白试剂)。在一些实施方案中,在孵育的为或为约96小时后,从细胞去除或分离刺激性寡聚试剂(例如,刺激性寡聚链霉亲和素突变蛋白试剂)。
b.基因工程化
在一些实施方案中,所提供的方法包括基因工程化细胞,例如,富集的cd57-t细胞的群体的细胞或源自所述群体的细胞,如通过引入编码重组蛋白的异源多核苷酸来进行。此类重组蛋白可以包括重组受体,如本文如在章节iv中所述的任一种。将编码重组蛋白的多核苷酸(例如,异源或重组多核苷酸)引入细胞中可以使用多种已知载体中的任一种来进行。此类载体包括病毒系统,包括慢病毒和γ逆转录病毒系统。示例性方法包括用于转移编码受体的异源多核苷酸的那些方法,包括经由病毒(例如,逆转录病毒或慢病毒)转导。在一些实施方案中,将刺激细胞群基因工程化,如以引入编码重组受体的异源或重组多核苷酸,从而产生转化的细胞的群体(本文中也称为转化的细胞群)。
在特定实施方案中,在将细胞在刺激条件下刺激、激活和/或孵育后,将细胞基因工程化、转化或转导,如通过本文例如在章节iii.a中提供的任何方法来进行。在特定实施方案中,一个或多个刺激的群体先前已经耗尽cd57+t细胞或与cd57+t细胞分离。
在某些实施方案中,用于基因工程化的方法是通过将群体的一个或多个细胞与编码重组蛋白(例如,重组受体)的多核苷酸接触或向所述细胞中引入所述多核苷酸来进行。在某些实施方案中,核酸分子或多核苷酸对于所述细胞是异源的。在特定实施方案中,异源多核苷酸对于所述细胞并非天然的。在某些实施方案中,异源多核苷酸对于递送它的任何载体(例如,病毒载体)并非天然的。在某些实施方案中,异源多核苷酸编码并非细胞天然表达的蛋白质,例如,重组蛋白。在特定实施方案中,异源核酸多核苷酸是或含有在引入前未在细胞中发现的核酸序列。
在一些实施方案中,在转导佐剂的存在下将所述细胞(例如,刺激的细胞)工程化(例如,转导)。示例性转导佐剂包括但不限于聚阳离子、纤连蛋白或纤连蛋白来源的片段或变体、以及retronectin。在某些实施方案中,在聚阳离子、纤连蛋白或纤连蛋白来源的片段或变体和/或retronectin的存在下将所述细胞工程化。在特定实施方案中,在聚阳离子的存在下将所述细胞工程化,所述聚阳离子是聚凝胺、deae-葡聚糖、硫酸鱼精蛋白、聚-l-赖氨酸或阳离子脂质体。在特定实施方案中,在硫酸鱼精蛋白的存在下将所述细胞工程化。
在一些实施方案中,基因工程化(例如,转导)是在无血清培养基中进行。在一些实施方案中,无血清培养基是定义的或明确定义的细胞培养基。在某些实施方案中,无血清培养基是受控培养基,其已经过处理,例如被过滤以去除抑制剂和/或生长因子。在一些实施方案中,无血清培养基含有蛋白质。在某些实施方案中,无血清培养基可含有血清白蛋白、水解产物、生长因子、激素、载体蛋白和/或附着因子。
在特定实施方案中,在一种或多种细胞因子的存在下将所述细胞工程化。在某些实施方案中,所述一种或多种细胞因子是重组细胞因子。在特定实施方案中,所述一种或多种细胞因子是人重组细胞因子。在某些实施方案中,所述一种或多种细胞因子结合和/或能够结合由t细胞表达的和/或对t细胞而言内源的受体。在特定实施方案中,所述一种或多种细胞因子是或包括细胞因子的4-α-螺旋束家族的成员。在一些实施方案中,细胞因子的4-α-螺旋束家族的成员包括但不限于白介素2(il-2)、白介素4(il-4)、白介素7(il-7)、白介素9(il-9)、白介素12(il-12)、白介素15(il-15)、粒细胞集落刺激因子(g-csf)和粒细胞巨噬细胞集落刺激因子(gm-csf)。在一些实施方案中,所述一种或多种细胞因子是或包括il-15。在特定实施方案中,所述一种或多种细胞因子是或包括il-7。在特定实施方案中,所述一种或多种细胞因子是或包括重组il-2。
在一些实施方案中,在与刺激期间存在的培养基相同或相似的培养基的存在下将细胞基因工程化、转化或转导。在一些实施方案中,在具有与刺激期间存在的培养基相同的细胞因子的培养基中将细胞基因工程化、转化或转导。在某些实施方案中,在以相同浓度具有与刺激期间存在的培养基相同的细胞因子的培养基中将细胞基因工程化、转化或转导。
在一些实施方案中,在与刺激期间存在的培养基相同或相似的培养基的存在下将细胞基因工程化、转化或转导。在一些实施方案中,在具有与刺激期间存在的培养基相同的细胞因子的培养基中将细胞基因工程化、转化或转导。在某些实施方案中,在以相同浓度具有与刺激期间存在的培养基相同的细胞因子的培养基中将细胞基因工程化、转化或转导。
1.转导
在一些实施方案中,将细胞基因工程化是或包括通过转导将多核苷酸(例如,异源多核苷酸)引入细胞中。在一些实施方案中,用病毒载体转导细胞。在一些实施方案中,所述病毒是逆转录病毒载体,如γ逆转录病毒载体或慢病毒载体。慢病毒转导的方法是已知的。示例性方法描述于例如以下文献中:wang等人(2012)j.immunother.35(9):689-701;cooper等人(2003)blood.101:1637-1644;verhoeyen等人(2009)methodsmolbiol.506:97-114;以及cavalieri等人(2003)blood.102(2):497-505。
在一些实施方案中,转导通过使群体的一个或多个细胞与编码重组蛋白(例如重组受体)的核酸分子接触来进行。在一些实施方案中,接触可以通过离心如旋转接种(例如离心接种)来实现。所述方法包括如国际公开号wo2016/073602中所述的任何方法。示例性离心室包括由biosafesa生产和销售的那些,包括用于
在一些实施方案中,所提供的方法与将含有编码重组受体的多核苷酸的病毒载体转导至、至约或至少于300x106个细胞(例如,受刺激细胞群的活t细胞)中结合使用。在某些实施方案中,转导为或约100x106个细胞(例如,刺激的细胞群的活t细胞)。
在一些实施方案中,转导在无血清培养基中进行。在一些实施方案中,转导在il-2、il-7和il-15的存在下进行。在特定实施方案中,所述细胞(例如,受刺激细胞群的细胞)含有至少80%、至少85%、至少90%或至少95%的作为cd4+t细胞或cd8+t细胞的细胞。在一些实施方案中,将转导进行持续24与48小时之间、36与12小时之间、18与30小时之间,或者进行或进行约24小时。在某些实施方案中,在开始或起始孵育(例如,在刺激条件下孵育)的两天内、36小时内或30小时内,起始转导步骤。
在一些实施方案中,将系统与其他仪器一起包括和/或置于与其他仪器相关联,所述其他仪器包括用于操作、自动化、控制和/或监测转导步骤以及在系统中执行的一个或多个各种其他处理步骤(例如,可以使用或结合如本文或在国际公开号wo2016/073602中描述的离心室系统进行的一个或多个处理步骤)的方面的仪器。在一些实施方案中,这种仪器容纳于机柜中。在一些实施方案中,仪器包括机柜,所述机柜包括外壳,所述外壳含有控制电路、离心机、罩、电机、泵、传感器、显示器和用户界面。示例性装置描述于美国专利号6,123,655、美国专利号6,733,433和us2008/0171951中。
在一些实施方案中,所述系统包含一系列容器,例如袋、管路、旋塞、夹子、连接器和离心室。在一些实施方案中,所述容器(如袋子)包括一个或多个容器(例如袋子),其在同一容器或单独容器(例如同一袋子或单独袋子)中含有要转导的细胞和病毒载体颗粒。在一些实施方案中,所述系统还包括一个或多个容器(例如袋子),所述容器含有介质,如稀释剂和/或洗涤溶液,在所述方法期间将所述介质抽入室和/或其他组件中以稀释、重悬和/或洗涤组分和/或群体。所述容器可以连接在系统中的一个或多个位置,例如连接在对应于输入管线、稀释剂管线、洗涤管线、废液管线和/或输出管线的位置。
在一些实施方案中,所述室与离心机相关联,离心机能够实现所述室的旋转,例如围绕其旋转轴旋转。结合细胞的转导和/或在一个或多个其他处理步骤中,旋转可以发生在孵育之前、期间和/或之后。因此,在一些实施方案中,各个处理步骤中的一个或多个在旋转下(例如在特定的力下)进行。所述室通常能够竖直或大致竖直地旋转,使得所述室在离心期间竖直放置,并且侧壁和轴是竖直或大致竖直的,且一个或多个端壁是水平或大致水平的。
在一些实施方案中,在将群体提供至空腔之前,可以将含有细胞的群体和含有病毒载体颗粒的群体和任选地空气组合或混合。在一些实施方案中,含有细胞的群体和含有病毒载体颗粒的群体和任选地空气是单独提供并且在空腔中组合并混合。在一些实施方案中,可以按任何顺序将含有细胞的群体、含有病毒载体颗粒的群体和任选地空气提供至内部空腔中。在此类一些实施方案中的任一个中,含有细胞和病毒载体颗粒的群体在组合或混合在一起后就是输入组合物,不论是在离心室内部还是外部组合或混合,和/或不论细胞和病毒载体颗粒是一起还是单独(如同时或依序)提供至离心室中。
在一些实施方案中,在转导方法中,在孵育细胞和病毒载体颗粒(如旋转)之前,进行一定体积的气体(如空气)的摄入。在一些实施方案中,在转导方法中,在细胞和病毒载体颗粒的孵育(如旋转)期间,进行一定体积的气体(如空气)的摄入。
在一些实施方案中,构成转导群体的细胞或病毒载体颗粒的液体体积、以及任选地空气的体积可以是预定体积。所述体积可以是被编程到与系统相关的电路中和/或由与所述系统相关的电路控制的体积。
在一些实施方案中,手动、半自动和/或自动地控制转导群体和任选地气体(如空气)的摄入,直到已经将所需或预定的体积摄入室的内部空腔中为止。在一些实施方案中,与系统相关的传感器可以例如经由液体和/或气体的颜色、流速和/或密度来检测流入和流出离心室的液体和/或气体,并且可以与相关电路通信,以按照需要停止或继续摄入,直到已经实现这种所需或预定体积的摄入为止。在一些方面,可以使被编程或仅能够检测系统中的液体而非气体(例如空气)的传感器能够在不停止摄入的情况下允许气体(如空气)通过进入系统中。在一些此类实施方案中,当需要气体(如空气)摄入时,可以将一条不透明的管道放置在传感器附近的线中。在一些实施方案中,可以手动地控制气体(如空气)的摄入。
在所提供的方法的方面,使离心室的内部空腔经历高速旋转。在一些实施方案中,在液体输入组合物和任选地空气的摄入之前、同时、之后或间歇地实现旋转。在一些实施方案中,在液体输入组合物和任选地空气的摄入之后实现旋转。在一些实施方案中,旋转通过离心室的离心来进行,其在内部空腔的侧壁内表面处和/或在细胞的表面层处的相对离心力为或约或者至少为或至少约200g、300g、400g、500g、600g、700g、800g、1000g、1100g、1500、1600g、1800g、2000g、2200g、2500g、3000g、3200g、3500g或4000g。在一些实施方案中,旋转通过离心进行,其力大于或大于约1100g,如大于或大于约1200g、大于或大于约1400g、大于或大于约1600g、大于或大于约1800g、大于或大于约2000g、大于或大于约2400g、大于或大于约2800g、大于或大于约3000g或者大于或大于约3200g。在特定实施方案中,通过离心进行的旋转的力在600g与800g之间。在特定实施方案中,通过离心进行的旋转的力为或为约693g。在一些实施方案中,旋转通过离心进行,其力为或为约1600g。
在一些实施方案中,将室的空腔中的气体(如空气)从室中排出。在一些实施方案中,将气体(如空气)排出到容器,所述容器作为封闭系统的一部分与离心室可操作地连接。在一些实施方案中,容器是自由或空的容器。在一些实施方案中,室的空腔中的空气(如气体)通过过滤器排出,所述过滤器经由无菌管组线与室的内部空腔可操作地连接。在一些实施方案中,使用手动、半自动或自动过程排出空气。在一些实施方案中,在从室的空腔中输送(express)含有孵育的细胞和病毒载体颗粒(如已经开始转导的细胞或已经用病毒载体转导的细胞)的输出群体之前、同时、间歇地或随后将空气从室中排出。
在一些实施方案中,转导和/或其他孵育作为连续或半连续过程或作为所述连续或半连续过程的一部分进行。在一些实施方案中,连续过程涉及连续摄入细胞和病毒载体颗粒,例如转导组合物(作为单一预先存在的组合物,或者通过连续抽入同一容器(例如空腔)中,从而混合其部分),和/或在孵育的至少一部分期间(例如,在离心的同时),从容器中连续输送或排出液体,以及任选地排出气体(例如空气)。在一些实施方案中,至少部分同时进行连续摄入和连续输送。在一些实施方案中,连续摄入发生在部分孵育期间,例如在部分离心期间,并且连续输送发生在孵育的单独部分期间。两者可以交替进行。因此,在进行孵育的同时,连续摄入和输送可以允许处理(例如转导)总体积更大的样品。
在一些实施方案中,孵育是连续过程的一部分,所述方法包括在孵育的至少一部分期间,实现在室旋转期间以及在孵育的一部分期间将所述转导组合物连续摄入空腔中,实现在室的旋转期间通过至少一个开口从空腔中连续输送液体并任选地排出气体(例如空气)。
在一些实施方案中,通过在以下步骤之间交替来进行半连续孵育:实现将组合物摄入空腔中,孵育,从空腔中输送液体和任选地从空腔中排出气体(例如空气),如到输出容器,然后摄入含有更多细胞和用于处理的其他试剂(例如,病毒载体颗粒)的后续(例如第二、第三等)组合物,并重复所述过程。例如,在一些实施方案中,孵育是半连续过程的一部分,所述方法包括在孵育之前,实现将转导组合物通过所述至少一个开口摄入空腔中,及在孵育之后,实现自空腔压出流体;实现将包含细胞和病毒载体颗粒的另一转导组合物摄入所述内部空腔中;以及在所述内部空腔中在一定条件下孵育另一转导组合物,由此使所述另一转导组合物中的所述细胞被所述载体转导。所述过程能以迭代的方式继续进行许多另外的回合。在此方面,半连续或连续方法可以允许产生甚至更大体积和/或数量的细胞。
在一些实施方案中,转导孵育的一部分在离心室中进行,在包括旋转或离心的条件下进行。
在特定实施方案中,用病毒载体转导细胞是或包括旋转接种,例如,含有细胞和病毒颗粒的混合物的离心。在一些实施方案中,可以使含有细胞和病毒颗粒的组合物旋转,通常以相对较低的力或速度旋转,如速度低于用于沉淀细胞的速度,如从或从约600rpm至1700rpm(例如,为或约或至少600rpm、1000rpm、或1500rpm、或1700rpm)。在一些实施方案中,旋转以如下力(例如,相对离心力)进行:从或从约100g至4000g(例如为或约或者至少为或至少约100g、200g、300g、400g、500g、600g、700g、800g、900g、1000g、1500g、2000g、2500g、3000g或3500g),如例如在室或空腔的内壁或外壁处所测量。
在一些实施方案中,将所述细胞用病毒载体以如下力(例如,相对离心力)旋转接种:在或在约100g与4000g之间、200g与1,000g之间、500g与1200g之间、1000g与2000g之间、600g与800g之间、1200g与1800g之间、或1500g与1800g之间。在某些实施方案中,将细胞用病毒载体颗粒以如下力旋转接种:为、为至少或为约100g、200g、300g、400g、500g、600g、700g、800g、900g、1000g、1200g、1500g、1600g、2000g、2500g、3000g、3200g、或3500g。在一些实施方案中,用病毒载体以为或为约692g的力对细胞进行转导。在特定实施方案中,用病毒载体以为或为约1600g的力对细胞进行转导。在一些实施方案中,所述力是在内部空腔的侧壁的内表面处和/或在细胞的表面层处的力。
在某些实施方案中,将所述细胞旋转接种,例如,使含有细胞和病毒载体的细胞组合物旋转,进行大于或大于约5分钟,如大于或大于约10分钟、大于或大于约15分钟、大于或大于约20分钟、大于或大于约30分钟、大于或大于约45分钟、大于或大于约60分钟、大于或大于约90分钟或者大于或大于约120分钟;或者在或在约5分钟与120分钟之间、30分钟与90分钟之间、15分钟与60分钟之间、15分钟与45分钟之间、30分钟与60分钟之间或45分钟与60分钟之间,每个都包含端值。在一些实施方案中,将所述细胞用病毒载体旋转接种,进行为或为约30分钟。在某些实施方案中,将所述细胞用病毒载体旋转接种,进行为或为约60分钟。
在一些实施方案中,转导方法包括转导组合物和任选地空气在离心室中的旋转接种(例如,旋转或离心),持续大于或大于约5分钟,如大于或大于约10分钟、大于或大于约15分钟、大于或大于约20分钟、大于或大于约30分钟、大于或大于约45分钟、大于或大于约60分钟、大于或大于约90分钟或者大于或大于约120分钟。在一些实施方案中,将转导组合物和任选地空气在离心室中旋转或离心,持续大于5分钟,但持续不超过60分钟、不超过45分钟、不超过30分钟或不超过15分钟。在特定实施方案中,转导包括旋转或离心持续或持续约60分钟。
在一些实施方案中,转导方法包括转导组合物和任选地空气在离心室中旋转或离心,进行在或在约10分钟与60分钟之间、15分钟与60分钟之间、15分钟与45分钟之间、30分钟与60分钟之间或45分钟与60分钟之间,每个都包含端值,并且其在内部空腔的侧壁的内表面处和/或在细胞的表面层处的力为、为约或在1000g、1100g、1200g、1400g、1500g、1600g、1800g、2000g、2200g、2400g、2800g、3200g或3600g。在特定实施方案中,转导方法包括转导组合物(例如,细胞和病毒载体颗粒)以为或为约1600g旋转或离心,进行为或为约60分钟。
2.病毒载体颗粒
在一些实施方案中,使用重组感染性病毒颗粒(如例如源自猿猴病毒40(sv40)、腺病毒、腺相关病毒(aav)的载体)将重组核酸转移至细胞中。在一些实施方案中,使用重组慢病毒载体或逆转录病毒载体(如γ-逆转录病毒载体)将重组核酸转移到t细胞中(参见例如,koste等人(2014)genetherapy2014年4月3日.doi:10.1038/gt.2014.25;carlens等人(2000)exphematol28(10):1137-46;alonso-camino等人(2013)molthernuclacids2,e93;park等人,trendsbiotechnol.2011年11月29日(11):550-557)。
在一些实施方案中,逆转录病毒载体具有长末端重复序列(ltr),例如源自莫洛尼鼠白血病病毒(momlv)、骨髓增生性肉瘤病毒(mpsv)、鼠胚胎干细胞病毒(mesv)、鼠干细胞病毒(mscv)或脾病灶形成病毒(sffv)的逆转录病毒载体。大多数逆转录病毒载体源自鼠逆转录病毒。在一些实施方案中,逆转录病毒包括源自任何禽类或哺乳动物细胞来源的那些。逆转录病毒通常是双嗜性的,这意味着它们能够感染包括人在内的若干种物种的宿主细胞。在一个实施方案中,要表达的基因替代逆转录病毒gag、pol和/或env序列。已经描述了许多例示性逆转录病毒系统(例如,美国专利号5,219,740;6,207,453;5,219,740;miller和rosman(1989)biotechniques7:980-990;miller,a.d.(1990)humangenetherapy1:5-14;scarpa等人(1991)virology180:849-852;burns等人(1993)proc.natl.acad.sci.usa90:8033-8037;以及boris-lawrie和temin(1993)cur.opin.genet.develop.3:102-109)。
病毒载体基因组通常以质粒形式构建,其可以转染到包装细胞系或生产细胞系中。在任何此类例子中,将编码重组蛋白(如重组受体)的核酸插入或定位在病毒载体的区域中,例如通常在病毒基因组的非必需区域中。在一些实施方案中,将核酸插入病毒基因组的某些病毒序列的位置中以产生具有复制缺陷的病毒。
可以使用多种已知方法中的任何一种来产生逆转录病毒颗粒,其基因组含有病毒载体基因组的rna拷贝。在一些实施方案中,至少两种组分参与制备基于病毒的基因传递系统:第一,包装质粒,包括生成病毒载体颗粒所必需的结构蛋白以及酶,第二,病毒载体本身,即,要转移的遗传物质。可以在设计这些组分之一或两者时引入生物安全保护措施。
在一些实施方案中,包装质粒可以含有除了包膜蛋白以外的所有逆转录病毒(如hiv-1)蛋白(naldini等人,1998)。在其他实施方案中,病毒载体可能缺乏另外的病毒基因(例如与毒力有关的那些,例如vpr、vif、vpu和nef和/或tat(hiv的主要反式激活因子))。在一些实施方案中,慢病毒载体(例如基于hiv的慢病毒载体)仅包含三种亲本病毒的基因:gag、pol和rev,这减少或消除了野生型病毒通过重组而重构的可能性。
在一些实施方案中,将病毒载体基因组引入包装细胞系中,所述细胞系含有将从病毒载体基因组转录的病毒基因组rna包装至病毒颗粒中所需的所有组分。可替代地,除了一种或多种目的序列(例如重组核酸)以外,病毒载体基因组可包含一种或多种编码病毒组分的基因。然而,在一些方面,为了防止基因组在靶标细胞中复制,去除复制所需的内源病毒基因,并在包装细胞系中单独提供。
在一些实施方案中,用含有产生颗粒所必需的组分的一种或多种质粒载体转染包装细胞系。在一些实施方案中,用含有病毒载体基因组(包括ltr、顺式作用包装序列和目的序列,即编码抗原受体(如car)的核酸)的质粒;以及编码病毒酶和/或结构组分(例如gag、pol和/或rev)的一种或多种辅助质粒转染包装细胞系。在一些实施方案中,利用多种载体分离产生逆转录病毒载体颗粒的各种遗传组分。在一些此类实施方案中,向包装细胞提供单独的载体减少了重组事件的可能性,否则可能产生有复制能力的病毒。在一些实施方案中,可以使用具有所有逆转录病毒组分的单一质粒载体。
在一些实施方案中,将逆转录病毒载体颗粒(例如慢病毒载体颗粒)假型化以增加宿主细胞的转导效率。例如,在一些实施方案中,将逆转录病毒载体颗粒(例如慢病毒载体颗粒)用vsv-g糖蛋白假型化,其提供宽细胞宿主范围,从而扩展可以转导的细胞类型。在一些实施方案中,用编码非天然包膜糖蛋白的质粒或多核苷酸转染包装细胞系,以例如包括嗜异性、多嗜性或双嗜性包膜,如辛德比斯病毒包膜、galv或vsv-g。
在一些实施方案中,包装细胞系提供将病毒基因组rna包装到慢病毒载体颗粒中反式需要的组分,包括病毒调节蛋白和结构蛋白。在一些实施方案中,包装细胞系可以是能够表达慢病毒蛋白并产生功能性慢病毒载体颗粒的任何细胞系。在一些方面,合适的包装细胞系包括293(atcccclx)、293t、hela(atccccl2)、d17(atccccl183)、mdck(atccccl34)、bhk(atccccl-10)和cf2th(atcccrl1430)细胞。
在一些实施方案中,包装细胞系稳定表达一种或多种病毒蛋白。例如,在一些方面,可以构建含有gag、pol、rev和/或其他结构基因但没有ltr和包装组分的包装细胞系。在一些实施方案中,可以用编码一种或多种病毒蛋白的核酸分子以及含有编码异源蛋白的核酸分子的病毒载体基因组和/或编码包膜糖蛋白的核酸对包装细胞系进行瞬时转染。
在一些实施方案中,将病毒载体以及包装质粒和/或辅助质粒经由转染或感染引入包装细胞系中。包装细胞系产生含有病毒载体基因组的病毒载体颗粒。用于转染或感染的方法是熟知的。非限制性例子包括磷酸钙、deae-葡聚糖和脂质转染方法、电穿孔和显微注射。
在将重组质粒和逆转录病毒ltr和包装序列引入特殊细胞系(例如,通过磷酸钙沉淀)中时,包装序列可以允许要包装至病毒颗粒中的重组质粒的rna转录,然后所述病毒颗粒可能会被分泌到培养基中。在一些实施方案中,随后收集含有重组逆转录病毒的培养基,任选地将其浓缩,并用于基因转移。例如,在一些方面,在将包装质粒和转移载体共转染至包装细胞系后,从培养基回收病毒载体颗粒,并通过本领域技术人员使用的标准方法进行滴定。
在一些实施方案中,可以通过引入质粒以允许产生慢病毒颗粒,而在包装细胞系(例如示例性hek293t细胞系)中产生逆转录病毒载体,例如慢病毒载体。在一些实施方案中,包装细胞被转染和/或含有编码gag和pol的多核苷酸,以及编码重组受体(例如抗原受体,例如car)的多核苷酸。在一些实施方案中,包装细胞系任选地和/或另外地被含有编码rev蛋白的多核苷酸转染和/或含有所述多核苷酸。在一些实施方案中,包装细胞系任选地和/或另外地被编码非天然包膜糖蛋白(例如vsv-g)的多核苷酸转染和/或含有所述多核苷酸。在一些此类实施方案中,在转染细胞(例如hek293t细胞)后大约两天,细胞上清液含有可以回收并滴定的重组慢病毒载体。
所回收和/或产生的逆转录病毒载体颗粒可以用于使用如所述的方法转导靶细胞。一旦进入靶细胞中,病毒rna就被逆转录,进入细胞核中并稳定整合到宿主基因组中。在病毒rna整合后一天或两天,可以检测到重组蛋白(例如抗原受体,如car)的表达。
3.与病毒载体一起孵育
在特定实施方案中,转化或转导细胞是或包括例如在病毒载体的存在下孵育细胞的一个或多个步骤。在一些实施方案中,在基因工程化、转化、转导或转染细胞后,孵育细胞(例如,转化的细胞群的细胞)。
在某些实施方案中,孵育是在静态条件(如不涉及培养基的离心、振荡、旋转、摇摆或灌注(例如,连续或半连续灌注)的条件)下进行。在一些实施方案中,在起始孵育之前或之后不久,例如,在5、15或30分钟内,将细胞转移(例如,在无菌条件下转移)至容器如袋子或小瓶中,并置于孵育器中。
在一些实施方案中,在无血清培养基中进行孵育。在一些实施方案中,无血清培养基是定义的和/或明确定义的细胞培养基。在某些实施方案中,无血清培养基是受控培养基,其已经过处理,例如被过滤以去除抑制剂和/或生长因子。在一些实施方案中,无血清培养基含有蛋白质。在某些实施方案中,无血清培养基可含有血清白蛋白、水解产物、生长因子、激素、载体蛋白和/或附着因子。
所述条件可以包括以下中的一种或多种:特定培养基、温度、氧含量、二氧化碳含量、时间、药剂(例如,营养素、氨基酸、抗生素、离子和/或刺激因子(如细胞因子、趋化因子、抗原、结合配偶体、融合蛋白、重组可溶受体和设计为激活细胞的任何其他药剂))。
在一些实施方案中,孵育的至少一部分在离心室的内部空腔中例如在离心旋转下进行,如在国际公开号wo2016/073602中所述。
在一些实施方案中,将细胞和任选地异源或重组多肽(例如,病毒载体)转移至用于孵育的容器中。在一些实施方案中,容器是小瓶。在特定实施方案中,容器是袋子。在一些实施方案中,将细胞和任选地异源或重组多肽在封闭或无菌条件下转移至容器中。在一些实施方案中,然后将容器(例如小瓶或袋子)置入孵育器中进行孵育的全部或一部分。在特定实施方案中,将孵育器设定在为、为约或至少16℃、24℃或35℃。在一些实施方案中,将孵育器设定在37℃、在约37℃或37℃±2℃、±1℃、±0.5℃或±0.1℃。
在特定实施方案中,在一种或多种细胞因子存在下孵育所述细胞。在某些实施方案中,所述一种或多种细胞因子是重组细胞因子。在特定实施方案中,所述一种或多种细胞因子是人重组细胞因子。在某些实施方案中,所述一种或多种细胞因子结合和/或能够结合由t细胞表达的和/或对t细胞而言内源的受体。在特定实施方案中,所述一种或多种细胞因子是或包括细胞因子的4-α-螺旋束家族的成员。在一些实施方案中,细胞因子的4-α-螺旋束家族的成员包括但不限于白介素2(il-2)、白介素4(il-4)、白介素7(il-7)、白介素9(il-9)、白介素12(il-12)、白介素15(il-15)、粒细胞集落刺激因子(g-csf)和粒细胞巨噬细胞集落刺激因子(gm-csf)。在一些实施方案中,所述一种或多种细胞因子是或包括il-15。在特定实施方案中,所述一种或多种细胞因子是或包括il-7。在特定实施方案中,所述一种或多种细胞因子是或包括重组il-2。
在一些实施方案中,在不存在重组细胞因子的情况下孵育细胞。
在一些实施方案中,在基础培养基中进行孵育的全部或一部分。在一些实施方案中,基础培养基是平衡盐溶液(例如,pbs、dpbs、hbss、ebss)。在一些实施方案中,基础培养基选自达尔伯克改良的伊格尔培养基(dmem)、最小必需培养基(mem)、伊格尔基础培养基(bme)、f-10、f-12、rpmi1640、格拉斯哥最小必需培养基(gmem)、α最小必需培养基(αmem)、伊斯科夫改良的达尔伯克培养基和m199。在一些实施方案中,基础培养基是复合培养基(例如,rpmi-1640、imdm)。在一些实施方案中,基础培养基是optmizertmctstmt细胞扩增基础培养基(thermofisher)。
在一些实施方案中,基础培养基含有无机盐、糖、氨基酸和任选地维生素、有机酸和/或缓冲液或其他熟知的细胞培养营养素的混合物。除了营养素外,所述培养基还有助于维持ph和渗透压。在一些方面,基础培养基的试剂支持细胞生长、增殖和/或扩增。多种可商业购得的基础培养基对本领域技术人员而言是熟知的,并且包括达尔伯克改良的伊格尔培养基(dmem)、罗斯威尔公园纪念学院培养基(roswellparkmemorialinstitutemedium,rpmi)、伊斯科夫改良的达尔伯克培养基和哈氏(hams)培养基。在一些实施方案中,基础培养基是伊斯科夫改良的达尔伯克培养基、rpmi-1640或α-mem。
在某些实施方案中,基础培养基补充有另外的添加剂。在一些实施方案中,基础培养基未补充任何另外的添加剂。细胞培养基的添加剂可以包括但不限于营养素、糖(例如,葡萄糖)、氨基酸、维生素或添加剂(如atp和nadh)。
在一些实施方案中,将细胞与异源多核苷酸(例如,病毒载体)一起培养。在某些实施方案中,将细胞与多核苷酸(例如,病毒载体)一起孵育为、为约或为至少18小时、24小时、30小时、36小时、40小时、48小时、54小时、60小时、72小时、84小时、96小时或超过96小时。在某些实施方案中,所述孵育的总持续时间为、为约或为至少12小时、18小时、24小时、30小时、36小时、42小时、48小时、54小时、60小时、72小时、84小时、96小时、108小时或120小时。在特定实施方案中,所述孵育在以下时间、在约以下时间或在以下时间内完成:120小时、108小时、96小时、84小时、72小时、60小时、54小时、48小时、42小时、36小时、30小时、24小时、18小时或12小时。在一些实施方案中,所述孵育的总持续时间在或在约12小时与120小时之间、18小时与96小时之间、24小时与72小时之间或24小时与48小时之间,包含端值。在一些实施方案中,所述孵育的总持续时间在或约在1小时与48小时之间、4小时与36小时之间、8小时与30小时之间或12小时与24小时之间,包含端值。
c.培育
在特定实施方案中,用于生成本文所提供工程化t细胞的组合物的过程是与任选的培育步骤或其中如在将异源多核苷酸引入细胞中之后使细胞在体外经历扩增或增殖的步骤结合进行。在一些实施方案中,所提供的方法包括用于培育细胞(例如,在促进增殖或扩增的条件下培育细胞)的一个或多个步骤。在一些实施方案中,在基因工程化(例如,通过转导或转染将重组多肽引入细胞)的步骤之后,在促进增殖或扩增的条件下培育细胞。在特定实施方案中,在已经在刺激条件下孵育细胞并用重组多核苷酸(例如,编码重组受体的多核苷酸)转导或转染之后,培育细胞。因此,在一些方面,培育富集的t细胞的转化的群体的细胞。在特定实施方案中,一个或多个转化的群体先前已经耗尽cd57+t细胞或与cd57+t细胞分离。
在一些实施方案中,用于生成本文所提供工程化t细胞的组合物的过程不需要培育步骤或其中在将异源多核苷酸引入细胞中之后使细胞在体外经历扩增或增殖的步骤。在一些实施方案中,用于生成或制造工程化细胞组合物的过程或方法不包括用于培育(例如,以扩增治疗组合物中工程化细胞的数量)的步骤。
在某些实施方案中,工程化t细胞的一个或多个群体是或包括富集的t细胞的两个单独群体。在特定实施方案中,在刺激条件下单独培育富集的t细胞的两个单独群体(例如,从相同生物样品选择、分离和/或富集的富集的t细胞的两个单独群体)。在某些实施方案中,所述两个单独群体包括富集的cd4+t细胞的群体,例如,富集的cd57-cd4+t细胞。在特定实施方案中,所述两个单独群体包括富集的cd8+t细胞的群体,例如,富集的cd57-cd8+t细胞。在一些实施方案中,例如在促进增殖和/或扩增的条件下单独培育富集的cd4+t细胞和富集的cd8+t细胞的两个单独群体(例如,富集的cd57-cd4+t细胞和富集的cd57-cd8+t细胞的两个单独群体)。在一些实施方案中,培育富集的t细胞的单一群体,例如,包括或含有cd57-cd4+t细胞和cd57-cd8+t细胞的单一群体。在某些实施方案中,所述单一群体是富集的cd4+t细胞的群体。在一些实施方案中,所述单一群体是在培育前已经从单独群体组合的富集的cd4+和cd8+t细胞的群体。
在一些实施方案中,例如在促进增殖和/或扩增的条件下培育的富集的cd4+t细胞(例如,cd57-cd4+t细胞)的群体包括至少为或约60%、至少为或约65%、至少为或约70%、至少为或约75%、至少为或约80%、至少为或约85%、至少为或约90%、至少为或约95%、至少为或约98%、至少为或约99%、至少为或约99.5%、至少为或约99.9%或者为或为约100%cd4+t细胞(例如,cd57-cd4+t细胞)。在一些实施方案中,所述群体包括至少为或约30%、至少为或约40%、至少为或约50%、至少为或约60%、至少为或约70%、至少为或约80%、至少为或约90%、至少为或约95%、至少为或约98%、至少为或约99%、至少为或约99.5%、至少为或约99.9%或者为或为约100%的表达重组受体和/或已经用重组多核苷酸转导或转染的cd4+t(例如,cd57-cd4+t细胞)细胞。在某些实施方案中,所培育的富集的cd4+t细胞(例如,cd57-cd4+t细胞)的群体包括少于为或约40%、少于为或约35%、少于为或约30%、少于为或约25%、少于为或约20%、少于为或约15%、少于为或约10%、少于为或约5%、少于为或约1%、少于为或约0.1%或者少于为或约0.01%cd8+t细胞,和/或不含cd8+t细胞,和/或不含或基本上不含cd8+t细胞。
在一些实施方案中,例如在促进增殖和/或扩增的条件下培育的富集的cd8+t细胞的群体包括至少为或约60%、至少为或约65%、至少为或约70%、至少为或约75%、至少为或约80%、至少为或约85%、至少为或约90%、至少为或约95%、至少为或约98%、至少为或约99%、至少为或约99.5%、至少为或约99.9%或者为或为约100%cd8+t细胞(例如,cd57-cd8+t细胞)。在特定实施方案中,所述群体包括至少为或约30%、至少为或约40%、至少为或约50%、至少为或约60%、至少为或约70%、至少为或约80%、至少为或约90%、至少为或约95%、至少为或约98%、至少为或约99%、至少为或约99.5%、至少为或约99.9%或者为或为约100%的表达重组受体和/或已经用重组多核苷酸转导或转染的cd8+t细胞(例如,cd57-cd8+t细胞)。在某些实施方案中,在刺激条件下孵育的富集的cd8+t细胞的群体包括少于为或约40%、少于为或约35%、少于为或约30%、少于为或约25%、少于为或约20%、少于为或约15%、少于为或约10%、少于为或约5%、少于为或约1%、少于为或约0.1%或者少于为或约0.01%cd4+t细胞,和/或不含cd4+t细胞,和/或不含或基本上不含cd4+t细胞。
在一些实施方案中,在如下条件下进行培育:所述条件通常包括适合于原代免疫细胞(如人t淋巴细胞)生长的温度,例如,至少为或约25摄氏度,通常至少为或约30度,且通常为或约37摄氏度。在一些实施方案中,在如下温度下孵育富集的t细胞的群体:25℃至38℃,如30℃至37℃,例如为或约37℃±2℃。在一些实施方案中,将孵育进行一段时间直至培养(例如,培育或扩增)得到所需或阈值密度、数量或剂量的细胞。在一些实施方案中,培育进行大于或大于约或者持续约或为24小时、48小时、72小时、96小时、5天、6天、7天、8天、9天或更长时间。
在一些实施方案中,培育细胞以实现阈值扩增,所述阈值扩增是如与培育开始时细胞的量、浓度或密度相比,大至少50%、至少为或约60%、至少为或约70%、至少为或约80%、至少为或约90%、至少为或约95%、至少为或约100%、至少为或约150%、至少为或约1倍、至少为或约2倍、至少为或约3倍、至少为或约4倍、至少为或约5倍、至少为或约10倍、至少为或约20倍、至少为或约50倍的细胞的量、浓度或密度。
如实施例中所述,群体倍增数与用治疗性t细胞组合物(例如,输出组合物)治疗的患者的无进展存活的概率呈负相关。因此,在一些实施方案中,群体倍增数不大于1、2、3、4、5、6、8、9或10次群体倍增。在一些实施方案中,群体倍增数不大于1、2、3、4、5或6次群体倍增。在一些实施方案中,减小的群体倍增数(例如,小于或等于6)是通过扩增t细胞组合物(例如,工程化的cd4+、cd+8t细胞)来实现,所述t细胞组合物包括至少或至少约55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%幼稚样和/或中枢记忆t细胞。在一些实施方案中,减小的群体倍增数(例如,小于或等于6)是通过扩增t细胞组合物(例如,工程化的cd4+、cd+8t细胞)来实现,所述t细胞组合物包括不超过45%、40%、35%、30%、25%、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%cd57+t细胞。在一些实施方案中,减小的群体倍增数(例如,小于或等于6)是通过使用如下接种密度来实现:大于0.05x10^6个细胞/ml、0.1x10^6个细胞/ml、0.15x10^6个细胞/ml、0.2x10^6个细胞/ml、0.25x10^6个细胞/ml、0.3x10^6个细胞/ml、0.35x10^6个细胞/ml、0.4x10^6个细胞/ml、0.45x10^6个细胞/ml或更多。
所述条件可以包括以下中的一种或多种:特定培养基、温度、氧含量、二氧化碳含量、时间、药剂(例如,营养素、氨基酸、抗生素、离子和/或刺激因子(如细胞因子、趋化因子、抗原、结合配偶体、融合蛋白、重组可溶受体和设计为激活细胞的任何其他药剂))。
在特定实施方案中,在一种或多种细胞因子的存在下培育富集的t细胞的组合物。在某些实施方案中,所述一种或多种细胞因子是重组细胞因子。在特定实施方案中,所述一种或多种细胞因子是人重组细胞因子。在某些实施方案中,所述一种或多种细胞因子结合和/或能够结合由t细胞表达的和/或对t细胞而言内源的受体。在特定实施方案中,所述一种或多种细胞因子是或包括细胞因子的4-α-螺旋束家族的成员。在一些实施方案中,细胞因子的4-α-螺旋束家族的成员包括但不限于白介素2(il-2)、白介素4(il-4)、白介素7(il-7)、白介素9(il-9)、白介素12(il-12)、白介素15(il-15)、粒细胞集落刺激因子(g-csf)和粒细胞巨噬细胞集落刺激因子(gm-csf)。在一些实施方案中,所述一种或多种细胞因子是或包括il-15。在特定实施方案中,所述一种或多种细胞因子是或包括il-7。在特定实施方案中,所述一种或多种细胞因子是或包括重组il-2。
在一些方面,孵育是根据多种技术来进行,例如以下文献中所述的那些技术:授予riddell等人的美国专利号6,040,177;klebanoff等人(2012)jimmunother.35(9):651-660;terakura等人(2012)blood.1:72-82;和/或wang等人(2012)jimmunother.35(9):689-701。
在一些实施方案中,培育的至少一部分在离心室的内部空腔中例如在离心旋转下进行,如在国际公开号wo2016/073602中所述。在一些实施方案中,在离心室中进行的孵育的至少一部分包括与一种或多种试剂混合以诱导刺激和/或激活。在一些实施方案中,将细胞(如选择的细胞)与刺激条件或刺激剂在离心室中混合。在此类过程的一些方面,将一定体积的细胞与一定量的一种或多种刺激条件或刺激剂混合,所述刺激条件或刺激剂远小于在细胞培养板或其他系统中进行类似刺激时通常使用的刺激条件或刺激剂。
在一些实施方案中,在向细胞和刺激剂添加培育缓冲液的情况下进行培育,以实现例如10ml至2,000ml的目标体积,如至少或约至少或约或为10ml、20ml、30ml、40ml、50ml、60ml、70ml、80ml、90ml、100ml、150ml、200ml、300ml、400ml、500ml、600ml、700ml、800ml、900ml、1,000ml、1,200ml、1,400ml、1,600ml、1,800ml、2,000ml、2,200ml或2,400ml。在一些实施方案中,将孵育缓冲液和刺激剂在添加至细胞之前预混合。在一些实施方案中,在周期性温和混合条件下进行刺激孵育,这可能有助于促进能量上有利的相互作用,并且从而允许在实现细胞的刺激和激活的同时使用较少的总体刺激剂。
在一些实施方案中,孵育通常在混合条件下进行,如在旋转的存在下,通常以相对低的力或速度旋转,如速度低于用于使细胞沉淀的速度,如为或为约600rpm至1700rpm(例如,为或约或至少600rpm、1000rpm或1500rpm或1700rpm),如在室或其他容器的样品或壁处的一定rcf下,所述rcf为或为约80g至100g(例如,为或约或至少80g、85g、90g、95g或100g)。在一些实施方案中,旋转是使用如下重复间隔来进行:以这种低速旋转,之后是休息时间段,如旋转和/或休息1、2、3、4、5、6、7、8、9或10秒,如旋转大约1或2秒,然后休息大约5、6、7或8秒。
在特定实施方案中,在封闭系统中进行培育。在某些实施方案中,在无菌条件下在封闭系统中进行培育。在特定实施方案中,在与所提供系统的一个或多个步骤相同的封闭系统中进行培育。在一些实施方案中,将富集的t细胞的群体从封闭系统去除并置于用于培育的生物反应器中和/或连接至所述生物反应器。用于培育的合适的生物反应器的例子包括但不限于gexuriw25、gexuriw5、sartoriusbiostatrm20|50、finessesmartrocker生物反应器系统和pallxrs生物反应器系统。在一些实施方案中,在培育步骤的至少一部分期间,使用生物反应器灌注和/或混合细胞。
在一些实施方案中,所述混合是或包括摇摆和/或运动。在一些情况下,生物反应器可以经历运动或摇摆,其在一些方面可以增加氧气传递。使生物反应器运动可以包括但不限于沿着水平轴线旋转、沿着竖直轴线旋转、沿着生物反应器的倾斜(tilted或inclined)的水平轴线的摇摆运动、或其任何组合。在一些实施方案中,在摇摆的情况下进行孵育的至少一部分。可以调整摇摆速度和摇摆角度以实现所需的搅动。在一些实施方案中,摇摆角度为20°、19°、18°、17°、16°、15°、14°、13°、12°、11°、10°、9°、8°、7°、6°、5°、4°、3°、2°或1°。在某些实施方案中,摇摆角度在6°-16°之间。在其他实施方案中,摇摆角度在7°-16°之间。在其他实施方案中,摇摆角度在8-12°之间。在一些实施方案中,摇摆速率为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40rpm。在一些实施方案中,摇摆速率在4rpm与12rpm之间,例如在4rpm与6rpm之间,包含端值。
在一些实施方案中,生物反应器维持等于或接近37℃的温度和等于或接近5%的co2水平,以及为、为约或至少0.01l/min、0.05l/min、0.1l/min、0.2l/min、0.3l/min、0.4l/min、0.5l/min、1.0l/min、1.5l/min、或2.0l/min或大于2.0l/min的稳定空气流动。在某些实施方案中,在灌注的情况下,如以290ml/天、580ml/天和/或1160ml/天的速率(例如,这取决于与培育开始相关的时间安排和/或经培育细胞的密度)进行培育的至少一部分。在一些实施方案中,细胞培养物扩增的至少一部分是在摇摆运动下进行,所述摇摆运动具有在5°与10°之间(如6°)的角度,以及恒定摇摆速度,如在5rpm与15rpm之间(如6rmp或10rpm)的速度。
在一些实施方案中,在恒定灌注(例如,慢稳定速率的灌注)下进行培育步骤的至少一部分。在一些实施方案中,灌注是或包括液体(例如,用过的培养基)的流出和新鲜培养基的流入。在某些实施方案中,灌注用新鲜培养基更换用过的培养基。在一些实施方案中,在如下稳定速率的灌注下进行培育的至少一部分:为或为约或为至少100ml/天、200ml/天、250ml/天、275ml/天、290ml/天、300ml/天、350ml/天、400ml/天、450ml/天、500ml/天、550ml/天、575ml/天、580ml/天、600ml/天、650ml/天、700ml/天、750ml/天、800ml/天、850ml/天、900ml/天、950ml/天、1000ml/天、1100ml/天、1160ml/天、1200ml/天、1400ml/天、1500ml天、1600ml/天、1800ml/天、2000ml/天、2200ml/天或2400ml/天。
d.收获、收集和配制细胞
在一些实施方案中,用于制造、产生或生产细胞疗法和/或工程化细胞的一个或多个处理步骤(例如在离心室和/或封闭系统中进行的)可以包括在培养(例如培育和扩增)和/或如所述的一个或多个其他处理步骤之前或之后配制细胞,例如配制由所提供的转导处理步骤产生的基因工程化细胞。在一些实施方案中,所提供的与细胞的配制相关的方法包括在封闭系统中处理转导的细胞,如使用上述处理步骤转导和/或扩增的细胞。
在一些实施方案中,在配制之前从细胞中去除和/或分离刺激试剂。在特定实施方案中,在培育之后从细胞中去除和/或分离刺激试剂。在某些实施方案中,例如在促进增殖和/或扩增的条件下,在培育之后和在配制培育的细胞之前,从细胞去除和/或分离刺激剂。在某些实施方案中,刺激试剂是本文例如在章节iii.a.1中所述的刺激试剂。在特定实施方案中,从细胞去除和/或分离刺激试剂,如本文例如在章节iii.a.2中所述。
在某些实施方案中,培育的细胞群的细胞。在一些实施方案中,在培育期间在细胞后在已经实现阈值细胞计数、密度和/或扩增后0天与10天之间、0与5天之间、2天与7天之间、0.5天与4天之间或1天与3天之间,配制细胞。在某些实施方案中,在培育期间已经实现阈值细胞计数、密度和/或扩增后为或为或约12小时、18小时、24小时、1天、2天或3天或在12小时、18小时、24小时、1天、2天或3天内,配制细胞。在一些实施方案中,在培育期间已经实现阈值细胞计数、密度和/或扩增后为或约1天内,配制细胞。
在某些实施方案中,从起始刺激到收集、收获或配制细胞的时间量为、为约或小于36小时、42小时、48小时、54小时、60小时、72小时、84小时、96小时、108小时或120小时。在某些实施方案中,从起始刺激到收集、收获或配制细胞的时间量为、为约或小于1.5天、2天、3天、4天或5天。在一些实施方案中,从起始刺激到收集、收获或配制细胞用于生成工程化细胞的时间量,从起始刺激到收集、收获或配制细胞为在或在约36小时与120小时之间、48小时与96小时之间或48小时与72小时之间,包含端值,或者在或在约1.5天与5天之间、2天与4天之间或2天与3天之间,包含端值。在特定实施方案中,从起始孵育到收获、收集或配制细胞的时间量为、为约或小于48小时、72小时或96小时。在特定实施方案中,从起始孵育到收获、收集或配制细胞的时间量为、为约或小于2天、3天或4天。在特定实施方案中,从起始孵育到收获、收集或配制细胞的时间量为48小时±6小时、72小时±6小时或96小时±6小时。在特定实施方案中,从起始孵育到收获、收集或配制细胞的时间量为或为约96小时或四天。
在某些实施方案中,至少在基因组中检测到整合载体时,收获或收集细胞。在一些实施方案中,在每个二倍体基因组的稳定的整合载体拷贝数(ivcn)之前,收获或收集细胞。在特定实施方案中,在基因组中检测到整合载体之后但在实现每个二倍体基因组的稳定ivcn时之前,收获或收集细胞。
在一些实施方案中,在ivcn达到、达到约或达到至少5.0、4.0、3.0、2.5、2.0、1.75、1.5、1.25、1.2、1.1、1.0、0.9、0.8、0.75、0.7、0.6、0.5、0.4、0.3或0.25个拷贝/二倍体基因组之前,收获或收集细胞。在特定实施方案中,在ivcn达到或达到约1.0个拷贝/二倍体基因组之前,收获或收集细胞。在一些实施方案中,在ivcn达到或达到约0.5个拷贝/二倍体基因组之前,收集或收获细胞。
在某些实施方案中,在细胞群的为、为约或为至少一次、两次、三次、四次、五次、六次、八次、十次、二十次或更多次细胞倍增(例如,在孵育期间发生的倍增)之前,收获细胞。
在特定实施方案中,在细胞的总数量(例如,孵育细胞或经历孵育的细胞的总数量)是输入群体的细胞数量(例如,与刺激试剂接触的细胞的总数量)的大于或大于约一倍、两倍、三倍、四倍、五倍、六倍、八倍、十倍、二十倍或超过二十倍之前的时间,收获或收集细胞。在一些实施方案中,在孵育细胞的总数量是转化、转导或旋转接种的细胞的总数量(例如,与病毒载体接触的细胞的总数量)的大于或大于约一倍、两倍、三倍、四倍、五倍、六倍、八倍、十倍、二十倍或超过二十倍之前的时间,收获或收集细胞。在某些实施方案中,所述细胞是t细胞、活t细胞、cd3+t细胞、cd4+t细胞、cd8+t细胞、表达car的t细胞、或任何前述的组合。在特定实施方案中,在细胞总数大于输入群体中细胞的总数量之前的时间,收获或收集细胞。在各种实施方案中,在活cd3+t细胞的总数量大于输入群体中活cd3+细胞的总数量之前的时间,收获或收集细胞。在特定实施方案中,在细胞总数大于转化、转导或旋转接种的细胞中细胞的总数量之前的时间,收获或收集细胞。在各种实施方案中,在活cd3+t细胞的总数量大于转化、转导或旋转接种的细胞中活cd3+细胞的总数量之前的时间,收获或收集细胞。在各种实施方案中,在活cd4+细胞和cd8+细胞的总数量大于输入群体中活cd4+细胞和cd8+细胞的总数量之前的时间,收获或收集细胞。在特定实施方案中,在细胞总数大于转化、转导或旋转接种的细胞中细胞的总数量之前的时间,收获或收集细胞。在各种实施方案中,在活cd4+细胞和cd8+细胞的总数量大于转化、转导或旋转接种的细胞中活cd4+细胞和cd8+细胞的总数量之前的时间,收获或收集细胞。
在一些实施方案中,所提供的用于制造、生成或产生细胞疗法和/或工程化细胞的方法可以包括在孵育、工程化和培育和/或如所述的一个或多个其他处理步骤之前或之后配制细胞,例如配制由所提供的处理步骤产生的基因工程化细胞。在一些实施方案中,所提供的与细胞的配制相关的方法包括在封闭系统中处理转导的细胞,如使用上述处理步骤转导和/或扩增的细胞。在一些实施方案中,提供包含用重组抗原受体(例如,car或tcr)工程化的细胞的细胞剂量作为组合物或配制品,如药物组合物或配制品。此类组合物可以根据所提供的方法使用,如用于预防或治疗疾病、病症和障碍,或用于检测、诊断和预后方法中。
在一些情况下,将细胞在用于制造、生成或产生细胞疗法和/或工程化细胞的一个或多个步骤(例如在离心室和/或封闭系统中进行)中处理可以包括在培养(例如培育和扩增)和/或一个或多个如所述的其他处理步骤之前或之后配制细胞,如配制由所提供的转导处理步骤产生的基因工程化细胞。在一些情况下,可以以用于剂量施用(例如用于单一单位剂量施用或多剂量施用)的量配制细胞。在一些实施方案中,所提供的与细胞的配制相关的方法包括在封闭系统中处理转导的细胞,如使用上述处理步骤转导和/或扩增的细胞。
在某些实施方案中,配制富集的t细胞的一种或多种组合物。在特定实施方案中,在一种或多种组合物已经被工程化和/或培育之后,配制富集的t细胞的一种或多种组合物。在特定实施方案中,一种或多种组合物是输入组合物。在一些实施方案中,一种或多种输入组合物先前已经进行低温保存和储存,并在孵育前解冻。
在某些实施方案中,配制细胞是输出细胞。在一些实施方案中,富集的t细胞的配制的组合物是富集的t细胞的输出组合物。在特定实施方案中,配制的cd4+t细胞和配制的cd8+t细胞是输出cd4+和cd8+t细胞。在特定实施方案中,所配制的细胞组合物(例如配制的富集cd4+和cd8+细胞的组合物)是输出细胞组合物,例如,富集cd4+和cd8+细胞的输出组合物。
在一些实施方案中,可以将细胞配制到容器如袋子或小瓶中。在一些实施方案中,在细胞后在培育期间已经实现阈值细胞计数、密度和/或扩增后0天与10天之间、0与5天之间、2天与7天之间、0.5天与4天之间或1天与3天之间,配制细胞。在某些实施方案中,在培育期间已经实现阈值细胞计数、密度和/或扩增后为或为或约12小时、18小时、24小时、1天、2天或3天或在12小时、18小时、24小时、1天、2天或3天内,配制细胞。在一些实施方案中,在培育期间已经实现阈值细胞计数、密度和/或扩增后为或约1天内,配制细胞。
在某些实施方案中,例如,将细胞培育最少的持续时间或最少的时间量,例如使得与如果将细胞在培育期间较早的时间点配制相比,以较低的激活状态收获所述细胞,而不管何时实现阈值。在一些实施方案中,在培育期间已经实现阈值细胞计数、密度和/或扩增之后,将细胞培育在0天与3天之间,例如在0天与3天之间、在1天与2天之间、为或为约1天、为或为约2天或者为或为约3天。在某些实施方案中,细胞达到阈值细胞计数、密度和/或扩增,并且在配制之前保持培育最少的时间或持续时间。在一些实施方案中,不配制已经实现阈值的细胞,直到它们已经被培育最少的持续时间和/或时间量,例如在1天与14天之间、2天与7天、或3天与6天之间的最少时间或持续时间、或者为或约2天、3天、4天、5天、6天、7天或超过7天的最少培育时间或持续时间为止。在一些实施方案中,最少的培育时间或持续时间在3天与6天之间。
在一些实施方案中,将细胞配制在药学上可接受的缓冲液中,所述药学上可接受的缓冲液在一些方面可以包括药学上可接受的载体或赋形剂。在一些实施方案中,处理包括将培养基交换成药学上可接受的或施用至受试者所需的培养基或配制缓冲液。在一些实施方案中,处理步骤可以涉及洗涤转导的和/或扩增的细胞以替代药学上可接受的缓冲液中的细胞,所述药学上可接受的缓冲液可以包括一种或多种任选的药学上可接受的载体或赋形剂。包括药学上可接受的载体或赋形剂的此类药物形式的例子可以是下文与将细胞和组合物施用至受试者可接受的形式结合描述的任何形式。在一些实施方案中,药物组合物以有效治疗或预防疾病或病症的量(如治疗有效量或预防有效量)含有细胞。
“药学上可接受的载体”是指药物配制品中除了活性成分之外对受试者无毒的成分。药学上可接受的载体包括但不限于缓冲液、赋形剂、稳定剂或防腐剂。
在一些方面,载体的选择部分取决于特定细胞和/或施用方法。因此,存在多种合适的配制品。例如,药物组合物可以含有防腐剂。合适的防腐剂可以包括例如对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲酸钠和苯扎氯铵。在一些方面,使用两种或更多种防腐剂的混合物。防腐剂或其混合物通常以总组合物重量的约0.0001%至约2%的量存在。载体描述于例如remington'spharmaceuticalsciences第16版,osol,a.编辑(1980)中。药学上可接受的载体在所用剂量和浓度下通常对接受者无毒,并且包括但不限于:缓冲液,如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(如十八烷基二甲基苄基氯化铵;六甲氯铵;苯扎氯铵;苄索氯铵;苯酚、丁醇或苄醇;烷基对羟基苯甲酸酯,如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,如edta;糖类,如蔗糖、甘露醇、海藻糖或山梨醇;成盐抗衡离子,如钠;金属络合物(例如锌-蛋白质络合物);和/或非离子表面活性剂,如聚乙二醇(peg)。
在一些方面,组合物中包括缓冲剂。合适的缓冲剂包括例如柠檬酸、柠檬酸钠、磷酸、磷酸钾以及各种其他酸和盐。在一些方面,使用两种或更多种缓冲剂的混合物。缓冲剂或其混合物通常以按总组合物的重量计约0.001%至约4%的量存在。用于制备可施用的药物组合物的方法是已知的。示例性方法更详细地描述于例如remington:thescienceandpracticeofpharmacy,lippincottwilliams&wilkins;第21版(2005年5月1日)中。
配制品可以包括水溶液。配制品或组合物还可含有可用于用细胞治疗的特定适应症、疾病或病症的多于一种活性成分,优选地活性与细胞互补的那些成分,其中相应活性不会相互产生不利影响。此类活性成分以对既定目的有效的量以合适的方式组合存在。因此,在一些实施方案中,药物组合物还包括其他药物活性药剂或药物,例如化学治疗剂,例如天冬酰胺酶、白消安、卡铂、顺铂、柔红霉素、多柔比星、氟尿嘧啶、吉西他滨、羟基脲、甲氨蝶呤、紫杉醇、利妥昔单抗、长春碱和/或长春新碱。
在一些实施方案中,组合物是作为无菌液体制剂(例如,等渗水性溶液、悬浮液、乳液、分散液或粘性组合物)来提供,在一些方面可以将其缓冲至所选ph。液体组合物可以包含载体,所述载体可以是溶剂或分散介质,所述溶剂或分散介质含有例如水、盐水、磷酸盐缓冲盐水、多元醇(例如,甘油、丙二醇、液体聚乙二醇)及其合适的混合物。无菌可注射溶液可以通过将细胞掺入溶剂中来制备,如与合适的载体、稀释剂或赋形剂(如无菌水、生理盐水、葡萄糖、右旋糖等)混合。组合物可以含有辅助物质,如润湿剂、分散剂或乳化剂(例如,甲基纤维素)、ph缓冲剂、胶凝或粘度增强添加剂、防腐剂、调味剂和/或颜料,这取决于施用途径和所需的制剂。在一些方面,可以参考标准文本来制备合适的制剂。
可以添加增强组合物的稳定性和无菌性的各种添加剂,包括抗微生物防腐剂、抗氧化剂、螯合剂和缓冲液。可以通过各种抗细菌和抗真菌剂(例如,对羟基苯甲酸酯、氯丁醇、苯酚和山梨酸)来确保防止微生物的作用。可以通过使用延迟吸收的药剂(例如,单硬脂酸铝和明胶)来实现可注射药物形式的延长吸收。
在一些实施方案中,配制缓冲液含有低温保存剂。在一些实施方案中,用含有1.0%至30%dmso溶液,如5%至20%dmso溶液或5%至10%dmso溶液的低温保存溶液来配制细胞。在一些实施方案中,低温保存溶液是或含有例如含有20%dmso和8%人血清白蛋白(hsa)的pbs,或其他合适的细胞冷冻介质。在一些实施方案中,低温保存溶液是或含有例如至少或约7.5%dmso。在一些实施方案中,处理步骤可以涉及洗涤转导的和/或扩增的细胞以替代在低温保存剂溶液中的细胞。在一些实施方案中,将细胞在介质和/或溶液中冷冻(例如,低温保存或低温保护),所述介质和/或溶液具有终浓度为或为约12.5%、12.0%、11.5%、11.0%、10.5%、10.0%、9.5%、9.0%、8.5%、8.0%、7.5%、7.0%、6.5%、6.0%、5.5%或5.0%的dmso,或者在1%与15%之间、在6%与12%之间、在5%与10%之间或在6%与8%之间的dmso。在特定实施方案中,将细胞在介质和/或溶液中冷冻,例如低温保存或低温保护,所述介质和/或溶液具有最终浓度为或为约5.0%、4.5%、4.0%、3.5%、3.0%、2.5%、2.0%、1.5%、1.25%、1.0%、0.75%、0.5%或0.25%的hsa,或在0.1%与-5%之间、在0.25%与4%之间、在0.5%与2%之间或在1%与2%之间的hsa。
在特定实施方案中,将富集的t细胞(例如已经进行刺激、工程化和/或培育的t细胞)的组合物配制,低温保存,然后储存一定时间量。在某些实施方案中,储存配制的低温保存的细胞,直至释放细胞用于输注。在特定实施方案中,将配制的低温保存的细胞储存1天与6个月之间、1个月与3个月之间、1天与14天之间、1天与7天之间、3天与6天之间、6个月与12个月之间、或长于12个月。在一些实施方案中,将细胞低温保存并储存以下时间、大约以下时间或少于以下时间:1天、2天、3天、4天、5天、6天或7天。在某些实施方案中,在储存后,将细胞解冻并施用至受试者。在某些实施方案中,将细胞储存持续或持续约5天。
在一些实施方案中,使用一个或多个处理步骤进行配制,所述步骤包括洗涤、稀释或浓缩细胞,如培养或扩增的细胞。在一些实施方案中,处理可以包括将细胞稀释或浓缩至所需浓度或数量,如包括用于以给定剂量或其部分用的细胞数量的单位剂型组合物。在一些实施方案中,处理步骤可以包括减小体积,从而根据需要增加细胞的浓度。在一些实施方案中,处理步骤可以包括增加体积,从而根据需要减小细胞的浓度。在一些实施方案中,处理包括向转导的和/或扩增的细胞添加一定体积的配制缓冲液。在一些实施方案中,配制缓冲液的体积是从或从约10ml至1000ml,如至少或约至少或为约或为50ml、100ml、200ml、300ml、400ml、500ml、600ml、700ml、800ml、900ml或1000ml。
在一些实施方案中,用于配制细胞组合物的此类处理步骤是在封闭系统中进行。此类处理步骤的例子可以使用结合与细胞处理系统有关的一个或多个系统或试剂盒的离心室(如由biosafesa生产和出售的离心室,包括与
在一些实施方案中,如与离心室或细胞处理系统相关联的封闭系统包括多端口输出试剂盒,所述试剂盒含有在管线的每个末端与端口相关联的多路歧管,所述端口可以连接至一个或多个容器以供输送配制的组合物。在一些方面,可以将所需数量或多个输出容器(例如,袋子)无菌地连接至多端口输出的一个或多个(通常两个或更多个,如至少3、4、5、6、7、8个或更多个)端口。例如,在一些实施方案中,可以将一个或多个容器(例如,袋子)附着到端口,或者附着到少于所有端口。因此,在一些实施方案中,所述系统可以实现将输出组合物输送到多个输出袋中。
在一些方面,可以将细胞以用于剂量施用(如用于单一单位剂量施用或多剂量施用)的量输送到多个输出袋中的一个或多个中。例如,在一些实施方案中,输出袋可以各自含有用于以给定剂量或其部分施用的细胞数量。因此,在一些方面,每个袋子可以含有用于施用的单一单位剂量或可以含有所需剂量的一部分,使得多个输出袋中的超过一个(例如两个输出袋、或3个输出袋)一起构成用于施用的剂量。
因此,容器(例如输出袋)通常含有要施用的细胞,例如,其一个或多个单位剂量。单位剂量可以是要施用至受试者的细胞的量或数量,或者是要施用的细胞的数量的两倍(或更多数量)。它可以是要施用至受试者的细胞的最低剂量或最低可能剂量。
在一些实施方案中,每个容器(例如,袋子)单独包含单位剂量的细胞。因此,在一些实施方案中,每个容器包含相同或大致或基本相同数量的细胞。在一些实施方案中,每个单位剂量含有至少或约至少1x106、2x106、5x106、1x107、5x107个或1x108个工程化细胞、总细胞、t细胞或pbmc。在一些实施方案中,每个袋中的经配制的细胞组合物的体积是10ml至100ml,如至少或约至少20ml、30ml、40ml、50ml、60ml、70ml、80ml、90ml或100ml。
在一些实施方案中,将通过所述方法产生的此类细胞或包含此类细胞的组合物施用至受试者以治疗疾病或病症。
e.顺序选择和平行选择
本文所提供的方法允许例如通过柱色谱进行多个选择步骤,以分离和/或富集靶细胞群(例如,t细胞、cd3+、cd4+、cd8+、cd57-t细胞)。在一些实施方案中,在用于产生输出治疗性细胞组合物的过程的一个或多个时间点或某些步骤之后,进行一个或多个选择步骤。在一些实施方案中,选择步骤包括多个选择步骤,其用于例如进一步纯化细胞组合物,选择特定细胞亚型,选择活细胞,选择工程化细胞,和/或调整细胞的比率、总数或浓度。在一些实施方案中,在孵育前进行选择步骤。在一些实施方案中,在收获和收集前进行选择步骤。
在一些方面,此类方法(例如,选择步骤)是通过单一过程物流如在封闭系统中通过采用顺序选择来实现,在所述顺序选择中富集和/或分离来自如本文所提供的样品(例如,刺激和/或工程化的细胞的输出组合物)的多个不同的细胞群。在一些方面,在同一容器或容器组(例如,管道组)中进行分开或分离是通过进行顺序阳性和阴性选择步骤来实现,后一步骤使来自前一步骤的阴性和/或阳性级分经历进一步选择,其中整个过程在同一管或管道组中进行。在一个实施方案中,使含有靶细胞的样品(例如,刺激和/或工程化的细胞的输出组合物)经历顺序选择,其中实现第一选择以富集cd4+或cd8+群体中的一种,并且使用第一选择中的未选择细胞作为第二选择的细胞来源,以富集cd4+或cd8+群体中的另一种。在一些实施方案中,可以实现一次或多次进一步选择以富集cd4+或cd8+群体中的一个或两个的亚群,例如,cd57-细胞。在一些实施方案中,使含有靶细胞的细胞群(例如,刺激和/或工程化的细胞的输出组合物)经历针对活细胞的顺序选择。在一些实施方案中,控制或调整含有靶细胞的细胞群(例如,刺激和/或工程化的细胞的输出组合物)中细胞的比率或总数。
在一些方面,此类方法(例如,选择步骤)是通过单一过程物流如在封闭系统中通过采用顺序选择来实现,在所述顺序选择中富集和/或分离来自如本文所提供的样品(例如,刺激和/或工程化的细胞的输出组合物)的多个不同的细胞群。在一些方面,在同一容器或容器组(例如,管道组)中进行分开或分离是通过进行顺序阴性和阳性选择步骤来实现,后一步骤使来自前一步骤的阴性和/或阳性级分经历进一步选择,其中整个过程在同一管或管道组中进行。在一个实施方案中,使含有靶细胞的样品(例如,刺激和/或工程化的细胞的输出组合物)经历顺序选择,其中实现第一选择以去除cd57+群体。在一些实施方案中,可以实现一次或多次进一步选择以富集cd4+或cd8+群体中的一个或两个,例如,cd57-cd4+或cd57-cd8+细胞。在一些实施方案中,使含有靶细胞的细胞群(例如,刺激和/或工程化的细胞的输出组合物)经历针对活细胞的顺序选择。在一些实施方案中,控制或调整含有靶细胞的细胞群(例如,刺激和/或工程化的细胞的输出组合物)中细胞的比率或总数。
在一个实施方案中,使含有靶细胞的样品(例如,刺激和/或工程化的细胞的输出组合物)经历顺序选择,其中实现第一选择以富集cd3+群体。在一些实施方案中,可以实现一次或多次进一步选择以富集cd3+群体的亚群,例如,cd57-细胞。在一些实施方案中,可以实现一次或多次进一步选择以富集活细胞。在一些实施方案中,可以实现一次或多次进一步选择以富集cd57-cd3+细胞的亚群,例如活的cd3+cd57-cd4+或cd57-cd3+cd8+细胞。在一些实施方案中,选择活细胞包括从细胞群(例如,刺激和/或工程化的细胞的输出组合物或其亚群)去除死细胞或由其组成。
在一个实施方案中,使含有靶细胞的样品(例如,刺激和/或工程化的细胞的输出组合物)经历顺序选择,其中实现第一选择以去除cd57+细胞。在一些实施方案中,可以实现一次或多次进一步选择以富集cd57-群体的亚群,例如,cd4+和/或cd8+细胞。在一些实施方案中,可以实现一次或多次进一步选择以富集活细胞。在一些实施方案中,选择活细胞包括从细胞群(例如,刺激和/或工程化的细胞的输出组合物或其亚群)去除死细胞或由其组成。
在一些实施方案中,本章节中公开的方法(例如,选择步骤)无需使用顺序选择技术来进行。在一些实施方案中,本章节中公开的方法(例如,选择步骤)可以使用与平行选择技术组合的顺序选择技术来进行。在一些实施方案中,选择步骤不采用顺序选择或者可以采用不在封闭系统中进行或不在使用相同管道的容器组中进行的顺序选择。在一些实施方案中,选择步骤在单一步骤中例如使用单一色谱柱来完成。在一些实施方案中,选择步骤是使用平行选择技术来完成。例如,选择步骤是通过例如在封闭系统中同时进行阳性和/或阴性选择步骤来实现,其中整个过程在相同管组或管道组中进行。在一些实施方案中,使含有靶细胞的样品(例如,刺激和/或工程化的细胞的输出组合物)经历平行选择,其中将样品(例如,刺激和/或工程化的细胞的输出组合物)加载至两个或更多个色谱柱上,其中每个柱实现细胞群的选择。在一些实施方案中,两个或更多个色谱柱单独实现cd57-、cd3+、cd4+或cd8+群体的选择。在一些实施方案中,两个或更多个色谱柱实现相同细胞群的选择。例如,两个或更多个色谱柱可以实现cd57-细胞的选择。在一些实施方案中,两个或更多个色谱柱(包括亲和色谱或凝胶渗透色谱)独立实现相同细胞群的选择。在一些实施方案中,两个或更多个色谱柱(包括亲和色谱或凝胶渗透色谱)独立实现不同细胞群的选择。在一些实施方案中,可以实现一次或多次进一步选择以富集经由平行选择而选择的一个或所有细胞群的亚群。在一些实施方案中,使含有靶细胞的样品(例如,刺激和/或工程化的细胞的输出组合物)(例如,cd57-细胞)经历平行选择,其中实现平行选择以富集cd4+群体和cd8+群体或cd3+群体。
在一些实施方案中,选择步骤可以使用以如本文所述的选择剂标记的珠来进行,并且可以保留第一选择步骤的阳性和阴性级分,之后如通过使用以第二选择剂标记的珠或通过使阳性级分经历如上所述的柱色谱来对阳性级分进行进一步阳性选择以富集第二选择标记。在一些实施方案中,一个或多个选择步骤使用如本文所述的柱色谱来进行。在一些实施方案中,选择步骤使用包括珠分离和柱色谱的一种或多种方法来完成。在一些实施方案中,选择使用柱色谱来完成。
在一些方面,在单一或同一分离或分开容器或容器组(如单一柱或柱组和/或同一管或管道组)中或使用相同分开基质或介质或试剂(如相同磁性基质、亲和力标记的固体支持物或者抗体或其他结合配偶体)分离多个群体包括精简所述分离的特征,例如,导致降低的成本、时间、复杂性、对样品操作的需要、对资源、试剂或设备的利用。在一些方面,此类特征的有利之处在于,它们使与所述方法相关的成本、效率、时间和/或复杂性降至最低,和/或避免对细胞产物的潜在损伤,如感染、污染和/或温度变化引起的损伤。本文所提供的方法允许在与柱上刺激组合的细胞选择之前或之后进行多个选择步骤来富集靶群体。
本文所提供的方法还允许选择并富集成功刺激和工程化的细胞。例如,在一些实施方案中,可以使用上述顺序选择、平行选择或单一选择程序来鉴定表达重组受体(例如,car、tcr)的刺激的细胞。在一些实施方案中,可以进一步富集表达重组受体(例如,car)的细胞中的亚群细胞,例如,cd4+car+t细胞、cd8+car+t细胞和/或活细胞。在一些实施方案中,选择步骤允许控制或调整表达重组受体(例如,car、tcr)的细胞和/或其亚群的比率、浓度或总数。在一些实施方案中,可以配制富集的群体以供用于(例如,施用)细胞疗法。
f.过程的示例性特征
在一些方面,所提供的方法和组合物涉及富集cd57-t细胞的t细胞群。特定实施方案涉及生成富集的cd57-t细胞的群体的方法,如通过cd57+细胞的阴性选择以及在一些方面,t细胞(如cd4+t细胞和/或cd8+t细胞)的阳性选择来进行。特定实施方案涉及生成富集的cd57-t细胞的群体的方法,如通过cd57+细胞的阴性选择以及在一些方面,t细胞(如cd3+t细胞)的阳性选择来进行。某些实施方案涉及孵育、刺激、激活、工程化、转导、培育和/或扩增富集的cd57-t细胞的群体的方法。在某些实施方案中,孵育、刺激、激活、工程化、转导、培育和/或扩增富集的cd57-t细胞的群体提供优于使用t细胞的替代性群体(如含有一定量或大量cd57+t细胞的群体)的此类步骤或过程的优点。此类优点包括但不限于改进的增殖或扩增和较低的分化,例如,终末分化。
在一些实施方案中,所提供的方法是或包括富集t细胞的步骤,如通过从含有原代人t细胞的生物样品选择cd57+t细胞以生成耗尽cd57+t细胞的t细胞群,例如,富集的cd57-t细胞的群体。在一些实施方案中,所述群体含有少于或少于约10%、5%、1%或0.1%cd57+t细胞。在特定实施方案中,所述群体含有存在于生物样品中的cd57+t细胞的频率的少于或少于约25%、20%、15%、10%或5%。在某些实施方案中,所述群体中至少85%、90%、95%或99%的cd4+t细胞是cd57-cd4+t细胞。在特定实施方案中,所述群体中至少85%、90%、95%或99%的cd8+t细胞是cd57-cd8+t细胞。在特定实施方案中,所述群体中至少85%、90%、95%或99%的cd3+t细胞是cd57-cd3+t细胞。
在某些实施方案中,富集t细胞包括从生物样品选择或去除cd57+细胞,然后从针对cd57进行阴性选择的群体单独选择cd4+t细胞和cd8+t细胞,如以生成富集的cd57-cd4+t细胞的群体和富集的cd57-cd8+t细胞的群体。在一些实施方案中,这些群体保持分离,如随后单独低温保护并储存,和/或单独工程化以表达重组受体。在特定实施方案中,如以1:1的cd57-cd4+t细胞与cd57-cd8+t细胞的比率组合所述单独群体。
在一些实施方案中,所提供的方法是或包括刺激富集的cd57-t细胞的群体。在某些实施方案中,所提供的方法包括用于刺激富集的cd57-cd4+t细胞的群体的一个或多个步骤。在特定实施方案中,所提供的方法包括用于刺激富集的cd57-cd8+t细胞的群体的一个或多个步骤。在某些实施方案中,刺激富集的cd57-cd4+t细胞的群体和富集的cd57-cd8+t细胞的群体,如通过在刺激条件(例如,本文如在章节iii.a中所述的任何刺激条件)下孵育细胞来进行。在特定实施方案中,刺激条件是或包括刺激试剂的存在。在某些实施方案中,单独刺激富集的cd57-cd4+t细胞和富集的cd57-cd8+t细胞的单独群体。在特定实施方案中,在进行刺激前,组合或混合富集的cd57-cd4+t细胞和富集的cd57-cd8+t细胞的单独群体,使得刺激富集的cd57-cd4+t细胞和cd57-cd8+t细胞的组合的组合物。
在某些实施方案中,用于刺激t细胞的方法或过程包括从生物样品选择或去除cd57+细胞,然后从针对cd57进行阴性选择的群体单独选择cd4+t细胞和cd8+t细胞,如以生成富集的cd57-cd4+t细胞的群体和富集的cd57-cd8+t细胞的群体。在某些实施方案中,在刺激条件下单独孵育富集的cd57-cd4+t细胞和富集的cd57-cd8+t细胞的单独群体。在特定实施方案中,组合富集的cd57-cd4+t细胞和富集的cd57-cd8+t细胞的单独群体,如在刺激条件下单独孵育。在一些实施方案中,刺激包括刺激试剂的存在。在某些实施方案中,刺激试剂是或包括与顺磁珠缀合的抗cd3和抗cd28抗体。在特定实施方案中,刺激试剂是或包括具有可逆地结合的抗cd3和抗cd28fab的链霉亲和素突变蛋白寡聚颗粒。
在特定实施方案中,所提供的方法是或包括基因工程化富集的cd57-t细胞的群体,如通过本文例如在章节iii.b中提供的任何方法。在一些方面,例如通过转导将异源多核苷酸引入群体的细胞中。在某些实施方案中,所提供的方法包括用于工程化富集的cd57-cd4+t细胞的群体或者源自或来源于此类细胞的细胞群的一个或多个步骤。在特定实施方案中,所提供的方法包括用于基因工程化富集的cd57-cd8+t细胞的群体的一个或多个步骤。在某些实施方案中,将富集的cd57-cd4+t细胞的群体和富集的cd57-cd8+t细胞的群体基因工程化,如通过用病毒载体转导来进行。在某些实施方案中,将富集的cd57-cd4+t细胞和富集的cd57-cd8+t细胞(例如,刺激的富集的cd57-cd4+t细胞和刺激的富集的cd57-cd8+t细胞)的单独群体基因工程化。在特定实施方案中,将富集的cd57-t细胞(例如,刺激的cd57-t细胞,包括cd57-cd4+t细胞和cd57-cd8+t细胞二者,例如,刺激的富集的cd57-cd4+t细胞和刺激的富集的cd57-cd8+t细胞)的单一群体基因工程化。
在特定实施方案中,用于基因工程化t细胞的方法是或包括以下步骤:从生物样品选择或去除cd57+细胞,然后从针对cd57进行阴性选择的群体单独选择cd4+t细胞和cd8+t细胞,如以生成富集的cd57-cd4+t细胞的群体和富集的cd57-cd8+t细胞的群体。在特定实施方案中,将富集的cd57-cd4+t细胞和富集的cd57-cd8+t细胞的单独群体单独基因工程化。在特定实施方案中,在用于基因工程化细胞的步骤之前,将富集的cd57-cd4+t细胞和富集的cd57-cd8+t细胞的单独群体组合。在一些方面,基因工程化是或包括引入例如编码重组受体的异源多核苷酸。在一些方面,所述引入是或包括用于转导的步骤,如进行旋转接种,并且随后任选地在病毒载体的存在下进行孵育。在一些实施方案中,通过本文例如在章节iii.b中提供的任何方法引入异源多核苷酸。在特定实施方案中,在进行基因工程化之前刺激cd57-cd4+t细胞和cd57-cd8+t细胞,例如,通过本文例如在章节iii.a中提供的任何方法。
在一些实施方案中,所述基因工程化通过以下方式来进行:(a)在能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域的刺激试剂的存在下孵育富集的cd57-t细胞的群体,从而生成刺激的t细胞;(b)通过用含有异源多核苷酸的病毒载体转导刺激的t细胞,将异源多核苷酸引入第一和第二富集的群体的刺激的t细胞中,以生成转化的t细胞;(c)在促进转化的t细胞增殖或扩增的条件下培育转化的t细胞;以及(d)收获或收集扩增的t细胞。
在一些实施方案中,用于基因工程化t细胞的方法是或包括以下步骤:从生物样品选择或去除cd57+细胞,然后从针对cd57进行阴性选择的群体单独选择cd4+t细胞和cd8+t细胞,如以生成富集的cd57-cd4+t细胞的群体和富集的cd57-cd8+t细胞的群体。在特定实施方案中,将富集的cd57-cd4+t细胞和富集的cd57-cd8+t细胞的单独群体单独基因工程化,或在用于基因工程化的一个或多个步骤之前组合。在某些实施方案中,在刺激试剂(例如,与顺磁珠缀合的抗cd3和抗cd28抗体)的存在下孵育cd57-cd4+t细胞和cd57-cd8+t细胞。在特定实施方案中,刺激试剂是或包括具有可逆地结合的抗cd3和抗cd28fab的链霉亲和素突变蛋白寡聚颗粒,以在用于引入编码重组受体的异源多核苷酸的步骤之前刺激t细胞。在一些实施方案中,将刺激的cd57-cd4+t细胞和cd57-cd8+t细胞用携带异源多核苷酸的病毒转导,如通过包括旋转接种和/或在所述病毒的存在下孵育的步骤来进行,如以生成转化的cd57-cd4+t细胞和cd57-cd8+t细胞。
在一些实施方案中,用于基因工程化t细胞的方法是或包括以下步骤:从生物样品选择或去除cd57+细胞,然后从针对cd57进行阴性选择的群体单独选择cd3+t细胞,如以生成富集的cd57-cd3+t细胞的群体。在某些实施方案中,在刺激试剂(例如,与顺磁珠缀合的抗cd3和抗cd28抗体)的存在下孵育cd57-cd3+t细胞。在特定实施方案中,刺激试剂是或包括具有可逆地结合的抗cd3和抗cd28fab的链霉亲和素突变蛋白寡聚颗粒,以在用于引入编码重组受体的异源多核苷酸的步骤之前刺激t细胞。在一些实施方案中,将刺激的cd57-cd3+t细胞用携带异源多核苷酸的病毒转导,如通过包括旋转接种和/或在所述病毒的存在下孵育的步骤来进行,如以生成转化的cd57-cd3+t细胞。
在一些实施方案中,在促进转化的t细胞增殖或扩增的条件下,例如,在细胞因子(如il-2、il-7或il-15)的存在下,培育转化的t细胞。在一些方面,培育细胞直至细胞实现至少3倍、4倍或5倍的扩增。
在某些实施方案中,收集或收获扩增的细胞,如以进行配制用于低温保护和储存,或者用于作为细胞疗法施用至受试者。在某些实施方案中,收集或收获转化的细胞。
在某些实施方案中,所提供的方法与成功生成或产生适合于在细胞疗法中使用的工程化细胞的输出组合物结合使用。在一些实施方案中,如果组合物的细胞在培育期间实现阈值细胞计数、密度和/或扩增,则成功生成输出组合物。在特定实施方案中,所提供的方法例如从富集的t细胞的初始群体或从生物样品成功生成或产生适合于细胞疗法的t细胞群的概率或可能性为至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%。
在某些实施方案中,用于细胞疗法中的从所提供的方法生成的富集的t细胞的群体在施用至受试者时,在体内具有活性并扩增,和/或在体内能够激活和扩增。在特定实施方案中,所述细胞展示指示体内功效、活性和/或扩增或者与其相关的特征和/或特性。例如,在一些实施方案中,此类特征或特性可以包括在施用至受试者后体内与激活、增殖和/或扩增相关的蛋白质(如表面蛋白)的表达。
在某些实施方案中,例如用于细胞疗法中的通过所提供的方法生成或产生的富集的t细胞的群体的cd25表达大于通过替代性和/或示例性过程(例如,刺激、工程化和/或培育含有更高频率的cd57+t细胞的t细胞群的过程)生成或产生的细胞。在一些实施方案中,通过所提供的方法生成或产生的群体的t细胞的cd25表达大于通过替代性和/或示例性过程生成或产生的t细胞。在一些实施方案中,通过所提供过程生成的群体中至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少100%的t细胞对cd25染色呈阳性,例如,表达可检测量的cd25。在特定实施方案中,输出组合物含有的对cd25呈阳性的细胞的频率大于通过替代性和/或示例性过程产生或生成的细胞的组合物。在一些实施方案中,例如,如与通过替代性和/或示例性过程产生或生成的细胞相比,所述群体的细胞表达多至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少100%、至少150%、至少1倍、至少2倍、至少3倍、至少4倍或至少5倍的cd25。
在某些实施方案中,例如用于细胞疗法中的通过所提供的方法生成或产生的富集的t细胞的群体的cd27表达大于通过替代性和/或示例性过程(例如,刺激、工程化和/或培育含有更高频率的cd57+t细胞的t细胞群的过程)生成或产生的细胞。在特定实施方案中,通过所提供的方法生成或产生的群体的t细胞的cd27表达大于通过替代性和/或示例性过程生成或产生的t细胞。在某些实施方案中,通过所提供过程生成的群体中至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少100%的t细胞对cd27染色呈阳性,例如,表达可检测量的cd27。在特定实施方案中,输出组合物含有的对cd27呈阳性的细胞的频率大于通过替代性和/或示例性过程产生或生成的细胞的组合物。在一些实施方案中,例如,如与通过替代性和/或示例性过程产生或生成的细胞相比,所述群体的细胞表达多至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少100%、至少150%、至少1倍、至少2倍、至少3倍、至少4倍或至少5倍的cd25。
在特定实施方案中,例如用于细胞疗法中的通过所提供的方法生成或产生的富集的t细胞的群体的cd28表达大于通过替代性和/或示例性过程(例如,刺激、工程化和/或培育含有更高频率的cd57+t细胞的t细胞群的过程)生成或产生的细胞。在一些实施方案中,通过所提供的方法生成或产生的群体的t细胞的cd28表达大于通过替代性和/或示例性过程生成或产生的t细胞。在某些实施方案中,通过所提供过程生成的群体中至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少100%的t细胞对cd28染色呈阳性,例如,表达可检测量的cd28。在特定实施方案中,输出组合物含有的对cd28呈阳性的细胞的频率大于通过替代性和/或示例性过程产生或生成的细胞的组合物。在一些实施方案中,例如,如与通过替代性和/或示例性过程产生或生成的细胞相比,所述群体的细胞表达多至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少100%、至少150%、至少1倍、至少2倍、至少3倍、至少4倍或至少5倍的cd28。
在某些实施方案中,所提供的方法与成功生成或产生适合用于细胞疗法中的工程化t细胞的组合物结合使用。在一些实施方案中,如果组合物的细胞在培育期间实现目标细胞计数、密度和/或扩增,则成功生成组合物。
在特定实施方案中,所提供的方法成功生成或产生适合于细胞疗法的富集的t细胞的群体的概率或可能性为至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%。在某些实施方案中,所述概率或可能性在85%与100%之间、在90%与95%之间或在92%与94%之间。在某些实施方案中,所提供的方法从至少70%、至少75%、至少80%、至少81%、至少82%、至少83%、至少84%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%或至少99%的样品或富集的cd57-t细胞的群体成功生成或产生适合于细胞疗法的富集的t细胞的群体。
在某些实施方案中,用于产生工程化细胞的所提供过程从起始刺激到收集、收获或配制细胞的总持续时间为、为约或小于36小时、42小时、48小时、54小时、60小时、72小时、84小时、96小时、108小时或120小时。在某些实施方案中,用于产生工程化细胞的所提供过程从起始刺激到收集、收获或配制细胞的总持续时间为、为约或小于1.5天、2天、3天、4天或5天。在一些实施方案中,用于产生工程化细胞的所提供过程从起始刺激到收集、收获或配制细胞的总持续时间在或在约36小时与120小时之间、48小时与96小时之间或48小时与72小时之间,包含端值,或者在或在约1.5天与5天之间、2天与4天之间或2天与3天之间,包含端值。在特定实施方案中,如从起始孵育到收获、收集或配制细胞所测量的完成所提供过程的时间量为、为约或小于48小时、72小时或96小时,或者为、为约或小于2天、3天或4天。在特定实施方案中,如从起始孵育到收获、收集或配制细胞所测量的完成所提供过程的时间量为48小时±6小时、72小时±6小时或96小时±6小时。
在一些实施方案中,所述孵育在起始刺激后的以下时间完成:在或在约24小时与120小时之间、36小时与108小时之间、48小时与96小时之间或48小时与72小时之间,包含端值。在一些实施方案中,所述孵育在从起始刺激起的以下时间、约以下时间或以下时间内完成:120小时、108小时、96小时、72小时、48小时或36小时。在特定实施方案中,所述孵育在24小时±6小时、48小时±6小时或72小时±6小时之后完成。在一些实施方案中,所述孵育在在起始刺激后的以下时间完成:在或在约一天与5天之间、1.5天与4.5天之间、2天与4天之间或2天与3天之间,包含端值。在一些实施方案中,所述孵育在从起始刺激起的以下时间、约以下时间或以下时间内完成:5天、4天、3天、2天或1.5天。
在一些实施方案中,整个过程用富集的t细胞(例如,cd4+和cd8+t细胞或cd3+细胞)的单一群体进行。在某些实施方案中,所述过程用富集的t细胞(例如,cd4和cd8细胞)的两种或更多种输入群体进行,所述两种或更多种输入群体在生成或产生富集的t细胞的单一输出群体的过程之前和/或期间进行组合。在一些实施方案中,富集的t细胞是或包含工程化的t细胞,例如,转导以表达重组受体的t细胞。
在一些实施方案中,输出群体(例如,工程化t细胞的群体)通过以下方式产生:(i)将t细胞的输入群体或含有t细胞的输入群体在刺激条件下孵育在或在约18小时与30小时之间,包含端值,(ii)将编码重组受体的异源或重组多核苷酸引入受刺激的群体的t细胞中,(iii)孵育所述细胞,然后(iv)收集或收获孵育的细胞。
在一些实施方案中,在起始于刺激条件下孵育之后36小时与108小时之间或1.5天与4.5天之间内,收集或收获细胞。在特定实施方案中,在转化的(例如,基因工程化、转导或转染的)t细胞达到稳定的每个基因组的整合载体拷贝数(ivcn)(其在24-48小时或一天至两天的跨度内增加或减少不超过20%)之后48小时或两天内,收集或收获细胞。在一些实施方案中,当所测量的细胞群的ivcn在所述群体中测量的总载体拷贝数(vcn)的为或为约20%、15%、10%或5%内时,认为整合是稳定的。特定实施方案考虑,为了实现稳定整合,在将病毒载体接触或引入细胞之后,必须将细胞孵育为、为约或为至少48小时、60小时或72小时或者一天、2天或3天。在一些实施方案中,稳定整合发生在孵育的为或为约72小时内。在一些实施方案中,在转化的t细胞的总数量为或小于输入群体中细胞的总数量时的时间,收集或收获细胞。在各种实施方案中,在输入群体的细胞已经倍增超过三次、两次或一次之前的时间,收集或收获细胞。
在某些实施方案中,通过以下方式生成输出群体(例如,工程化t细胞的群体):(i)将包含t细胞的输入群体在刺激试剂(例如,本文所述的刺激试剂)的存在下在刺激条件下孵育18小时与30小时之间,包含端值,(ii)用编码重组受体的病毒载体转导刺激的t细胞,如通过在所述病毒载体的存在下旋转接种刺激的t细胞来进行,(iii)将转导的t细胞在静态条件下孵育在或在18小时与96小时之间,包含端值,以及(iv)在起始于刺激条件下孵育之后在或在约36小时与108小时之间内,收获转化的群体的t细胞。
在一些实施方案中,将与所提供方法相关的过程与替代性过程进行比较。例如,在一些实施方案中,将本文所提供的方法与含有用于扩增细胞的步骤的替代性过程相比较。在特定实施方案中,替代性过程可以在一个或多个特定方面不同,但在其他方面含有与所提供方法相关的过程相似或相同的特征、方面、步骤、阶段、试剂和/或条件。在一些实施方案中,替代性过程类似于与所提供的方法相关的过程,例如,缺少或不包括扩增,但是不同之处包括但不限于以下中的一种或多种:不同的试剂和/或培养基配制品;在孵育、转导、转染和/或培育期间血清的存在;输入群体的不同的细胞组成,例如,cd4+与cd8+t细胞的比率;不同的刺激条件和/或不同的刺激试剂;不同的刺激试剂与细胞的比率;不同的转导载体和/或方法;不同的孵育、转导和/或转染细胞的时间安排或顺序;在孵育或转导期间存在的一种或多种重组细胞因子的不存在或差异(例如,不同的细胞因子或不同浓度);或者不同的收获或收集细胞的时间安排。
在一些实施方案中,如从分离、富集和/或选择来自生物样品的输入细胞(例如,cd4+或cd8+t细胞)至收集、配制和/或低温保护输出细胞的时间所测量,完成所提供过程所需的持续时间或时间量是为、为约或小于48小时、72小时、96小时、120小时、2天、3天、4天、5天、7天或10天。在一些实施方案中,分离、选择或富集的细胞在刺激之前未进行低温保护,并且如从分离、富集和/或选择输入细胞(至收集、配制和/或低温保护输出细胞的时间)所测量,完成所提供过程所需的持续时间或时间量是为、为约或小于48小时、72小时、96小时、或120小时、或2天、3天、4天、或5天。
在某些实施方案中,对从生物样品分离、富集或选择的细胞(例如,cd4+和cd8+t细胞或cd3+细胞)的群体进行所提供的过程。在一些方面,所提供的方法可以从自受试者收集生物样品时起,在如与其他方法或过程相比缩短的时间量内,产生或生成工程化t细胞的组合物。在一些实施方案中,所提供的方法可以从自受试者收集生物样品时至收集、收获或配制工程化t细胞(例如,用于低温保存或施用)时,在或在约10天、9天、8天、7天、6天、5天、4天、3天、2天内,或者在或在约120小时、96小时、72小时或48小时内,产生或生成工程化t细胞,包括在用于刺激或转导的步骤之前对生物样品或者富集、分离或选择的细胞进行低温保存和储存的任何或所有时间。在特定实施方案中,所提供的方法可以从自受试者收集生物样品时至收集、收获或配制工程化t细胞时,在或在约6天与8天之间(包含端值)内,产生或生成工程化t细胞,包括在用于刺激或转导的步骤之前对生物样品或者富集、分离或选择的细胞进行低温保存和储存的任何或所有时间。
iv.编码重组蛋白的异源多核苷酸
在一些实施方案中,所提供的方法是或包括将异源多核苷酸引入富集cd57-细胞的群体的细胞中。在一些实施方案中,所述异源多核苷酸编码重组蛋白。此类重组蛋白可以包括重组受体,如章节iii.a中所述的任一种。将编码重组蛋白的多核苷酸(例如,异源或重组多核苷酸)引入细胞中可以使用多种已知载体中的任一种来进行。此类载体包括病毒系统,包括慢病毒和γ逆转录病毒系统。示例性方法包括用于转移编码受体的异源多核苷酸的那些方法,包括经由病毒(例如,逆转录病毒或慢病毒)转导。在一些实施方案中,将刺激细胞群基因工程化,如以引入编码重组受体的异源或重组多核苷酸,从而产生转化的细胞的群体(本文中也称为转化的细胞群)。
在某些实施方案中,将编码重组蛋白(例如,重组受体)的多核苷酸引入细胞中。在某些实施方案中,多核苷酸或核酸分子对于所述细胞是异源的。在特定实施方案中,异源多核苷酸对于所述细胞并非天然的。在某些实施方案中,异源核酸分子或异源多核苷酸编码并非所述细胞天然表达的蛋白质,例如,重组蛋白。在特定实施方案中,异源核酸分子或多核苷酸是或含有在所述接触或引入之前未在所述细胞中发现的核酸序列。
在特定实施方案中,异源多核苷酸编码重组蛋白。在某些实施方案中,重组蛋白是重组受体。在一些实施方案中,重组蛋白是重组抗原受体,如重组tcr或嵌合抗原受体(car)。
a.重组受体
在一些实施方案中,提供表达或工程化以表达一种或多种重组受体的工程化细胞(如cd57-t细胞)。所述受体包括抗原受体和含有其一种或多种组分的受体。重组受体可以包括嵌合受体(如含有配体结合结构域或其结合片段以及细胞内信号传导结构域或区域的那些)、功能性非tcr抗原受体、嵌合抗原受体(car)、t细胞受体(tcr)(如重组或转基因tcr)、嵌合自身抗体受体(caar)及前述任一种的组分。重组受体(如car)通常包括(在一些方面经由接头和/或一个或多个跨膜结构域)与一个或多个细胞内信号传导组分连接的细胞外抗原(或配体)结合结构域。在一些实施方案中,所述工程化细胞表达含有不同组分、结构域或区域的两种或更多种受体。在一些方面,两种或更多种受体允许在空间或时间上调节或控制重组受体的特异性、活性、抗原(或配体)结合、功能和/或表达。
1.嵌合抗原受体(car)
在所提供的方法和用途的一些实施方案中,嵌合受体(如嵌合抗原受体)含有一个或多个结构域,所述一个或多个结构域将提供针对所期望抗原(例如肿瘤抗原)的特异性的配体结合结构域(例如抗体或抗体片段)与细胞内信号传导结构域组合。在一些实施方案中,所述细胞内信号传导结构域是刺激或激活细胞内结构域部分,如t细胞刺激或激活结构域,从而提供初级激活信号或初级信号。在一些实施方案中,所述细胞内信号传导结构域含有或另外含有共刺激信号传导结构域以促进效应子功能。在一些实施方案中,嵌合受体在被基因工程化至免疫细胞中时,可以调节t细胞活性,并且在一些情况下可以调节t细胞分化或稳态,由此产生在体内具有改善的寿命、存活和/或持久性的基因工程化细胞,如用于过继细胞治疗方法。
示例性抗原受体(包括car)以及将此类受体工程化并引入细胞中的方法包括例如以下文献中所述的那些:国际专利申请公开号wo200014257、wo2013126726、wo2012/129514、wo2014031687、wo2013/166321、wo2013/071154、wo2013/123061;美国专利申请公开号us2002131960、us2013287748、us20130149337;美国专利号:6,451,995、7,446,190、8,252,592、8,339,645、8,398,282、7,446,179、6,410,319、7,070,995、7,265,209、7,354,762、7,446,191、8,324,353和8,479,118;以及欧洲专利申请号ep2537416;和/或以下文献中所述的那些:sadelain等人,cancerdiscov.2013年4月;3(4):388-398;davila等人(2013)plosone8(4):e61338;turtle等人,curr.opin.immunol.,2012年10月;24(5):633-39;wu等人,cancer,2012年3月18日(2):160-75。在一些方面,抗原受体包括如美国专利号7,446,190中描述的car,以及国际专利申请公开号wo/2014055668a1中描述的那些。car的例子包括如前述出版物中任一项中披露的car,所述出版物如wo2014031687、us8,339,645、us7,446,179、us2013/0149337、美国专利号7,446,190、美国专利号8,389,282;kochenderfer等人,2013,naturereviewsclinicaloncology,10,267-276(2013);wang等人(2012)j.immunother.35(9):689-701;和brentjens等人,scitranslmed.20135(177)。还参见wo2014031687、us8,339,645、us7,446,179、us2013/0149337、美国专利号7,446,190和美国专利号8,389,282。
嵌合受体(如car)通常包括细胞外抗原结合结构域,如抗体分子的一部分,通常是抗体的可变重(vh)链区和/或可变轻(vl)链区,例如,scfv抗体片段。
在一些实施方案中,受体所靶向的抗原是多肽。在一些实施方案中,它是碳水化合物或其他分子。在一些实施方案中,与正常或非靶向细胞或组织相比,抗原在所述疾病或病症的细胞(例如,肿瘤或致病细胞)上选择性表达或过表达。在其他实施方案中,抗原在正常细胞上表达和/或在工程化细胞上表达。
在一些实施方案中,受体靶向的抗原是或包括αvβ6整合素(avb6整合素)、b细胞成熟抗原(bcma)、b7-h3、b7-h6、碳酸酐酶9(ca9,也称为caix或g250)、癌症-睾丸抗原、癌症/睾丸抗原1b(ctag,也称为ny-eso-1和lage-2)、癌胚抗原(cea)、细胞周期蛋白、细胞周期蛋白a2、c-c基序趋化因子配体1(ccl-1)、cd19、cd20、cd22、cd23、cd24、cd30、cd33、cd38、cd44、cd44v6、cd44v7/8、cd123、cd133、cd138、cd171、硫酸软骨素蛋白聚糖4(cspg4)、表皮生长因子蛋白(egfr)、表皮生长因子受体iii型突变体(egfrviii)、上皮糖蛋白2(epg-2)、上皮糖蛋白40(epg-40)、肝配蛋白b2、肝配蛋白受体a2(epha2)、雌激素受体、fc受体样蛋白5(fcrl5;也称为fc受体同源物5或fcrh5)、胎儿乙酰胆碱受体(胎儿achr)、叶酸结合蛋白(fbp)、叶酸受体α、神经节苷脂gd2、o-乙酰化gd2(ogd2)、神经节苷脂gd3、糖蛋白100(gp100)、磷脂酰肌醇蛋白聚糖-3(gpc3)、g蛋白偶联受体5d(gprc5d)、her2/neu(受体酪氨酸激酶erb-b2)、her3(erb-b3)、her4(erb-b4)、erbb二聚体、人高分子量黑色素瘤相关抗原(hmw-maa)、乙型肝炎表面抗原、人白细胞抗原a1(hla-a1)、人白细胞抗原a2(hla-a2)、il-22受体α(il-22rα)、il-13受体α2(il-13rα2)、激酶插入结构域受体(kdr)、κ轻链、l1细胞粘附分子(l1-cam)、l1-cam的ce7表位、含有富亮氨酸重复序列的蛋白8家族成员a(lrrc8a)、路易斯y、黑色素瘤相关抗原(mage)-a1、mage-a3、mage-a6、mage-a10、间皮素(msln)、c-met、鼠类巨细胞病毒(cmv)、粘蛋白1(muc1)、muc16、自然杀伤细胞2族成员d(nkg2d)配体、黑色素a(mart-1)、神经细胞粘附分子(ncam)、癌胚胎抗原、黑色素瘤优先表达抗原(prame)、孕酮受体、前列腺特异性抗原、前列腺干细胞抗原(psca)、前列腺特异性膜抗原(psma)、受体酪氨酸激酶样孤儿受体1(ror1)、存活蛋白、滋养层糖蛋白(tpbg,也称为5t4)、肿瘤相关糖蛋白72(tag72)、酪氨酸酶相关蛋白1(trp1,也称为tyrp1或gp75)、酪氨酸酶相关蛋白2(trp2,也称为多巴色素互变异构酶、多巴色素δ异构酶或dct)、血管内皮生长因子受体(vegfr)、血管内皮生长因子受体2(vegfr2)、肾母细胞瘤1(wt-1)、病原体特有的或病原体表达的抗原、或与通用标签相关的抗原、和/或生物素化分子、和/或由hiv、hcv、hbv或其他病原体表达的分子。在一些实施方案中,受体靶向的抗原包括与b细胞恶性肿瘤相关的抗原,如多种已知b细胞标记中的任一种。在一些实施方案中,抗原是或包括cd20、cd19、cd22、ror1、cd45、cd21、cd5、cd33、igκ、igλ、cd79a、cd79b或cd30。
在一些实施方案中,抗原是或包括病原体特有的或病原体表达的抗原。在一些实施方案中,抗原是病毒抗原(如来自hiv、hcv、hbv等的病毒抗原)、细菌抗原和/或寄生虫抗原。
在一些实施方案中,抗原或抗原结合结构域是cd19。在一些实施方案中,scfv含有源自对cd19具有特异性的抗体或抗体片段的vh和vl。在一些实施方案中,结合cd19的抗体或抗体片段是小鼠来源的抗体,如fmc63和sj25c1。在一些实施方案中,抗体或抗体片段是人抗体,例如如美国专利公开号us2016/0152723中所述。
在一些实施方案中,scfv源自fmc63。fmc63通常是指针对人来源的表达cd19的nalm-1和nalm-16细胞产生的小鼠单克隆igg1抗体(ling,n.r.等人(1987).leucocytetypingiii.302)。在一些实施方案中,fmc63抗体包含分别在seqidno:38和39中所示的cdrh1和h2,以及在seqidno:40或54中所示的cdrh3、和在seqidno:35中所示的cdrl1、和在seqidno:36或55中所示的cdrl2、和在seqidno:37或56中所示的cdrl3。在一些实施方案中,fmc63抗体包含含有seqidno:41的氨基酸序列的重链可变区(vh)和含有seqidno:42的氨基酸序列的轻链可变区(vl)。
在一些实施方案中,scfv包含含有seqidno:35的cdrl1序列、seqidno:36的cdrl2序列和seqidno:37的cdrl3序列的可变轻链和/或含有seqidno:38的cdrh1序列、seqidno:39的cdrh2序列和seqidno:40的cdrh3序列的可变重链。在一些实施方案中,scfv包含如seqidno:41所示的可变重链区和如seqidno:42所示的可变轻链区。在一些实施方案中,可变重链和可变轻链通过接头连接。在一些实施方案中,接头如seqidno:58中所示。在一些实施方案中,scfv依次包含vh、接头和vl。在一些实施方案中,scfv依次包含vl、接头和vh。在一些实施方案中,scfv由seqidno:43中所示的核苷酸序列或展现与seqidno:43至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的序列编码。在一些实施方案中,scfv包含seqidno:43中所示的氨基酸序列或展现与seqidno:43至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的序列。
在一些实施方案中,scfv源自sj25c1。sj25c1是针对人来源的表达cd19的nalm-1和nalm-16细胞产生的小鼠单克隆igg1抗体(ling,n.r.等人(1987).leucocytetypingiii.302)。在一些实施方案中,sj25c1抗体包含seqidno:47-49中分别所示的cdrh1、h2和h3,以及seqidno:44-46中分别所示的cdrl1、l2和l3序列。在一些实施方案中,sj25c1抗体包含含有seqidno:50的氨基酸序列的重链可变区(vh)和含有seqidno:51的氨基酸序列的轻链可变区(vl)。
在一些实施方案中,scfv包含含有seqidno:44的cdrl1序列、seqidno:45的cdrl2序列和seqidno:46的cdrl3序列的可变轻链和/或含有seqidno:47的cdrh1序列、seqidno:48的cdrh2序列和seqidno:49的cdrh3序列的可变重链。在一些实施方案中,scfv包含seqidno:50中所示的可变重链区和seqidno:51中所示的可变轻链区。在一些实施方案中,可变重链和可变轻链通过接头连接。在一些实施方案中,接头如seqidno:52中所示。在一些实施方案中,scfv依次包含vh、接头和vl。在一些实施方案中,scfv依次包含vl、接头和vh。在一些实施方案中,scfv包含seqidno:53中所示的氨基酸序列或展现与seqidno:53至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的序列。
在一些实施方案中,嵌合抗原受体包括含有抗体或抗体片段的细胞外部分。在一些方面,嵌合抗原受体包括含有抗体或片段的细胞外部分和细胞内信号传导结构域。在一些实施方案中,抗体或片段包括scfv。
在一些实施方案中,重组受体(例如,car)的抗体部分进一步包括免疫球蛋白恒定区的至少一部分,如铰链区,例如,igg4铰链区和/或ch1/cl和/或fc区。在一些实施方案中,所述恒定区或部分是人igg(如igg4或igg1)的。在一些方面,所述恒定区的部分用作抗原识别组分(例如,scfv)与跨膜结构域之间的间隔子区。与不存在间隔子的情况相比,间隔子的长度可以提供在抗原结合后增加的细胞反应性。示例性间隔子包括但不限于以下文献中所述的那些:hudecek等人(2013)clin.cancerres.,19:3153;国际专利申请公开号wo2014031687、美国专利号8,822,647或公开的申请号us2014/0271635。
在一些实施方案中,所述恒定区或部分是人igg(如igg4或igg1)的。在一些实施方案中,间隔子具有序列eskygppcppcp(seqidno:1中所示),并且由seqidno:2中所示的序列编码。在一些实施方案中,间隔子具有seqidno:3中所示的序列。在一些实施方案中,间隔子具有seqidno:4中所示的序列。在一些实施方案中,恒定区或部分是igd的。在一些实施方案中,间隔子具有seqidno:5中所示的序列。在一些实施方案中,间隔子具有展现与seqidno:1、3、4或5中的任一项至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列同一性的氨基酸序列。在一些实施方案中,间隔子具有seqidno:27-34中所示的序列。在一些实施方案中,间隔子具有展现与seqidno:27-34中的任一项至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列同一性的氨基酸序列。
在一些实施方案中,抗原受体包含与细胞外结构域直接或间接连接的细胞内结构域。在一些实施方案中,嵌合抗原受体包括连接细胞外结构域和细胞内信号传导结构域的跨膜结构域。在一些实施方案中,细胞内信号传导结构域包含itam。例如,在一些方面,抗原识别结构域(例如细胞外结构域)通常与一种或多种细胞内信号传导组分(如模拟在car的情况下通过抗原受体复合物(如tcr复合物)进行激活和/或通过另一种细胞表面受体传导信号的信号传导组分)连接。在一些实施方案中,嵌合受体包含在细胞外结构域(例如scfv)与细胞内信号传导结构域之间连接或融合的跨膜结构域。因此,在一些实施方案中,抗原结合组分(例如,抗体)与一种或多种跨膜结构域和细胞内信号传导结构域连接。
在一个实施方案中,使用与受体(例如,car)中的一个结构域天然地缔合的跨膜结构域。在一些情形中,通过氨基酸取代选择或修饰跨膜结构域,以避免此类结构域与相同或不同表面膜蛋白的跨膜结构域结合,以使与受体复合物的其他成员的相互作用最小化。
在一些实施方案中,跨膜结构域源自天然来源或合成来源。在来源是天然的情况下,所述结构域在一些方面源自任何膜结合蛋白或跨膜蛋白。跨膜区包括源自以下(即包含其至少一个或多个跨膜区)的那些:t细胞受体的α、β或ζ链、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154。可替代地,在一些实施方案中,跨膜结构域是合成的。在一些方面,合成跨膜结构域主要包含疏水性残基,如亮氨酸和缬氨酸。在一些方面,将在合成跨膜结构域的每个末端发现苯丙氨酸、色氨酸和缬氨酸的三联体。在一些实施方案中,连接是通过接头、间隔子和/或一个或多个跨膜结构域来实现。在一些方面,跨膜结构域含有cd28的跨膜部分。
在一些实施方案中,细胞外结构域和跨膜结构域可以直接或间接连接。在一些实施方案中,细胞外结构域和跨膜是通过间隔子(如本文所述的任一种)连接。在一些实施方案中,受体含有衍生跨膜结构域的分子的细胞外部分,如cd28细胞外部分。
细胞内信号传导结构域包括模拟或接近通过天然抗原受体的信号、通过这种受体与共刺激受体的组合的信号、和/或仅通过共刺激受体的信号的那些。在一些实施方案中,存在短的寡肽或多肽接头,例如长度在2与10个氨基酸之间的接头(如含有甘氨酸和丝氨酸的接头,例如甘氨酸-丝氨酸双联体),并且在car的跨膜结构域与胞质信号传导结构域之间形成连接。
在一些方面,将t细胞激活描述为由两个类别的胞质信号传导序列来介导:通过tcr起始抗原依赖性初级激活的那些(初级胞质信号传导序列),以及以非抗原依赖性方式作用以提供次级或共刺激信号的那些(次级胞质信号传导序列)。在一些方面,car包括此类信号传导组分中之一或两者。
受体(例如,car)通常包括至少一种或多种细胞内信号传导组分。在一些方面,car包括调节tcr复合物的初级激活的初级胞质信号传导序列。以刺激方式起作用的初级胞质信号传导序列可以含有信号传导基序(其被称为免疫受体酪氨酸激活基序或itam)。含有itam的初级胞质信号传导序列的例子包括源自cd3ζ链、fcrγ、cd3γ、cd3δ和cd3ε的那些。在一些实施方案中,car中的一种或多种胞质信号传导分子含有源自cd3ζ的胞质信号传导结构域、其部分或序列。
在一些实施方案中,受体包括tcr复合物的细胞内组分,如介导t细胞激活和细胞毒性的tcrcd3链,例如cd3ζ链。因此,在一些方面,抗原结合部分与一个或多个细胞信号传导模块连接。在一些实施方案中,细胞信号传导模块包括cd3跨膜结构域、cd3细胞内信号传导结构域和/或其他cd跨膜结构域。在一些实施方案中,受体(例如,car)还包括一种或多种另外的分子(如fc受体γ、cd8、cd4、cd25或cd16)的一部分。例如,在一些方面,car或其他嵌合受体包括cd3-zeta(cd3-ζ)或fc受体γ与cd8、cd4、cd25或cd16之间的嵌合分子。
在一些实施方案中,在连接car或其他嵌合受体后,所述受体的胞质结构域或细胞内信号传导结构域激活免疫细胞(例如工程化以表达所述car的t细胞)的正常效应子功能或应答中的至少一种。例如,在一些情况下,car诱导t细胞的功能,如细胞裂解活性或t辅助活性,如细胞因子或其他因子的分泌。在一些实施方案中,使用抗原受体组分或共刺激分子的细胞内信号传导结构域的截短部分代替完整的免疫刺激链,例如如果所述截短部分转导效应子功能信号的话。在一些实施方案中,一种或多种细胞内信号传导结构域包括t细胞受体(tcr)的胞质序列,在一些方面还包括共受体的那些胞质序列,所述共受体在天然情况下与此类受体协同作用以在抗原受体接合后起始信号转导。
在天然tcr的情况下,完全激活通常不仅需要经由tcr进行信号传导,还需要共刺激信号。因此,在一些实施方案中,为了促进完全激活,用于产生次级或共刺激信号的组分也被包括在car中。在其他实施方案中,所述car不包括用于产生共刺激信号的组分。在一些方面,另外的car在相同细胞中表达,并且提供用于产生次级或共刺激信号的组分。
在一些实施方案中,嵌合抗原受体含有t细胞共刺激分子的细胞内结构域。在一些实施方案中,car包括共刺激受体如cd28、4-1bb、ox40、dap10和icos的信号传导结构域和/或跨膜部分。在一些方面,相同的car包括激活和共刺激组分二者。在一些实施方案中,嵌合抗原受体含有源自t细胞共刺激分子或其功能变体的细胞内结构域,如位于跨膜结构域与细胞内信号传导结构域之间。在一些方面,t细胞共刺激分子是cd28或41bb。
在一些实施方案中,激活结构域被包括在一个car内,而共刺激组分由识别另一抗原的另一car提供。在一些实施方案中,car包括均在同一细胞上表达的激活或刺激car、共刺激car(参见wo2014/055668)。在一些方面,细胞包括一种或多种刺激或激活car和/或共刺激car。在一些实施方案中,细胞还包括抑制性car(icar,参见fedorov等人,sci.transl.medicine,5(215)(2013年12月)),如识别除了与疾病或病症相关和/或为所述疾病或病症特有的抗原以外的抗原的car,借此通过抑制性car与其配体的结合来减小或抑制通过靶向疾病的car递送的激活信号,例如,以减小脱靶效应。
在某些实施方案中,细胞内信号传导结构域包含与cd3(例如,cd3-ζ)细胞内结构域连接的cd28跨膜和信号传导结构域。在一些实施方案中,细胞内信号传导结构域包含与cd3ζ细胞内结构域连接的嵌合cd28和cd137(4-1bb,tnfrsf9)共刺激结构域。
在一些实施方案中,car在胞质部分中包含一个或多个(例如,两个或更多个)共刺激结构域和激活结构域(例如,初级激活结构域)。示例性car包括cd3-ζ、cd28和4-1bb的细胞内组分。
在一些实施方案中,抗原受体还包括标记,和/或表达car或其他抗原受体的细胞还包括替代标记(如细胞表面标记),所述替代标记可以用于确认细胞的转导或工程化以表达受体。在一些方面,所述标记包括cd34、ngfr或表皮生长因子受体的全部或部分(例如截短形式),如这种细胞表面受体的截短形式(例如,tegfr)。在一些实施方案中,编码标记的核酸可操作地连接至编码接头序列(如可切割接头序列,例如t2a)的多核苷酸。例如,标记和任选接头序列可以是如公开的专利申请号wo2014031687中所披露的任何一种。例如,标记可以是截短的egfr(tegfr),其任选地连接至接头序列,如t2a可切割接头序列。
截短的egfr(例如tegfr)的示例性多肽包含seqidno:7或16中所示的氨基酸序列或展现与seqidno:7或16至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列同一性的氨基酸序列。示例性t2a接头序列包含seqidno:6或17中所示的氨基酸序列或展现与seqidno:6或17至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列同一性的氨基酸序列。
在一些实施方案中,标记是并非在t细胞上天然发现的或并非在t细胞表面上天然发现的分子(例如,细胞表面蛋白)或其部分。在一些实施方案中,所述分子是非自身分子,例如,非自身蛋白,即不被宿主的免疫系统识别为“自身”的分子,将向所述宿主中过继转移细胞。
在一些实施方案中,标记不起治疗功能和/或不产生除了用作基因工程化的标记(例如,用于选择成功工程化的细胞)以外的作用。在其他实施方案中,标记可以是治疗性分子或以其他方式发挥一些所需作用的分子,如在体内会遇到的细胞的配体,如用于在过继转移和遇到配体时增强和/或减弱细胞应答的共刺激或免疫检查点分子。
在一些情况下,car被称为第一代、第二代和/或第三代car。在一些方面,第一代car是在抗原结合时仅提供cd3链诱导的信号的car;在一些方面,第二代car是提供这种信号和共刺激信号的car,如包括来自共刺激受体(如cd28或cd137)的细胞内信号传导结构域的信号;在一些方面,第三代car是包括不同共刺激受体的多个共刺激结构域的car。
例如,在一些实施方案中,car含有抗体例如抗体片段、跨膜结构域(其是cd28的跨膜部分或其功能变体或含有cd28跨膜部分或其功能变体)以及含有cd28的信号传导部分或其功能变体和cd3ζ的信号传导部分或其功能变体的细胞内信号传导结构域。在一些实施方案中,car含有抗体(例如,抗体片段)、跨膜结构域(其是或含有cd28的跨膜部分或其功能变体)以及细胞内信号传导结构域(含有4-1bb的信号传导部分或其功能变体和cd3ζ的信号传导部分或其功能变体)。在一些此类实施方案中,受体还包括含有ig分子(如人ig分子)的一部分(如ig铰链,例如igg4铰链)的间隔子,如仅铰链间隔子。
在一些实施方案中,重组受体(例如,car)的跨膜结构域是或包括人cd28(例如登录号p01747.1)的跨膜结构域或其变体,如包含seqidno:8中所示的氨基酸序列或展现与seqidno:8的至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列同一性的氨基酸序列的跨膜结构域;在一些实施方案中,重组受体的含有跨膜结构域的部分包含seqidno:9中所示的氨基酸序列或具有与seqidno:9的至少或至少约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列同一性的氨基酸序列。
在一些实施方案中,重组受体(例如,car)的一个或多个细胞内信号传导组分含有人cd28的细胞内共刺激信号传导结构域或其功能变体或部分,如在天然cd28蛋白的位置186-187处具有ll至gg取代的结构域。例如,细胞内信号传导结构域可以包含seqidno:10或11中所示的氨基酸序列或展现与seqidno:10或11的至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列同一性的氨基酸序列。在一些实施方案中,细胞内结构域包含4-1bb(例如,登录号q07011.1)的细胞内共刺激信号传导结构域或其功能变体或部分,如seqidno:12中所示的氨基酸序列或展现与seqidno:12的至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列同一性的氨基酸序列。
在一些实施方案中,重组受体(例如,car)的细胞内信号传导结构域包含人cd3ζ刺激信号传导结构域或其功能变体,如人cd3ζ(登录号:p20963.2)的同种型3的112个aa的胞质结构域或如美国专利号7,446,190或美国专利号8,911,993中所述的cd3ζ信号传导结构域。例如,在一些实施方案中,细胞内信号传导结构域包含如seqidno:13、14或15中所示的氨基酸序列或展现与seqidno:13、14或15至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列同一性的氨基酸序列。
在一些方面,间隔子仅含有igg的铰链区,如仅igg4或igg1的铰链,如seqidno:1中所示的仅铰链间隔子。在其他实施方案中,间隔子是或含有ig铰链,例如,igg4来源的铰链,其任选地连接至ch2和/或ch3结构域。在一些实施方案中,间隔子是与ch2和ch3结构域连接的ig铰链,例如igg4铰链,如seqidno:4中所示。在一些实施方案中,间隔子是仅与ch3结构域连接的ig铰链,例如igg4铰链,如seqidno:3中所示。在一些实施方案中,间隔子是或包含富含甘氨酸-丝氨酸的序列或其他柔性接头,如已知的柔性接头。
例如,在一些实施方案中,car包括抗体(如抗体片段,包括scfv)、间隔子(如含有免疫球蛋白分子的一部分(如铰链区和/或重链分子的一个或多个恒定区)的间隔子,如含有ig铰链的间隔子)、含有cd28来源的跨膜结构域的全部或一部分的跨膜结构域、cd28来源的细胞内信号传导结构域和cd3ζ信号传导结构域。在一些实施方案中,car包括抗体或片段(如scfv)、间隔子(如任何含ig铰链的间隔子)、cd28来源的跨膜结构域、4-1bb来源的细胞内信号传导结构域和cd3ζ来源的信号传导结构域。
在一些实施方案中,编码此类car构建体的核酸分子例如在编码car的序列的下游还包括编码t2a核糖体跳跃元件的序列和/或tegfr序列。在一些实施方案中,序列编码seqidno:6或17中所示的t2a核糖体跳跃元件,或展现与seqidno:6或17至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列同一性的氨基酸序列。在一些实施方案中,还可以生成表达抗原受体(例如car)的t细胞以表达作为非免疫原性选择表位的截短的egfr(egfrt)(例如通过引入编码被t2a核糖体开关隔开的car和egfrt,以从相同构建体表达两种蛋白质的构建体),然后所述非免疫原性选择表位可以用作检测此类细胞的标记(参见例如,美国专利号8,802,374)。在一些实施方案中,序列编码seqidno:7或16中所示的tegfr序列或展现与seqidno:7或16至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列同一性的氨基酸序列。在一些情况下,肽(如t2a)可导致核糖体跳过2a元件c末端处肽键的合成(核糖体跳跃),导致2a序列末端与下游的下一个肽之间分离(参见例如,defelipe.geneticvaccinesandther.2:13(2004)和defelipe等人traffic5:616-626(2004))。许多2a元件是已知的。可以用于本文公开的方法和核酸中的2a序列的例子包括但不限于来自口蹄疫病毒的2a序列(f2a,例如seqidno:21)、来自马鼻炎a病毒的2a序列(e2a,例如seqidno:20)、来自明脉扁刺蛾β四体病毒(thoseaasignavirus)的2a序列(t2a,例如seqidno:6或17)和来自猪捷申病毒(porcineteschovirus)-1的2a序列(p2a,例如seqidno:18或19),如美国专利公开号20070116690中所述。
由施用至受试者的细胞表达的重组受体(如car)通常识别或特异性结合至在所治疗的疾病或病症或其细胞中表达、与所治疗的疾病或病症或其细胞相关和/或为所治疗的疾病或病症或其细胞特有的分子。在与分子(例如抗原)特异性结合后,受体通常将免疫刺激信号(如itam转导的信号)递送到细胞中,从而促进靶向疾病或病症的免疫应答。例如,在一些实施方案中,细胞表达car,所述car与由疾病或病症的细胞或组织表达的或与所述疾病或病症相关的抗原特异性结合。
2.t细胞受体(tcr)
在一些实施方案中,与所提供的方法、用途、制品或组合物结合使用的工程化细胞(如t细胞)是表达t细胞受体(tcr)或其抗原结合部分的细胞,所述抗体或其抗原结合部分识别靶多肽(如肿瘤、病毒或自身免疫蛋白的抗原)的肽表位或t细胞表位。
在一些实施例中,“t细胞受体”或“tcr”是如下分子,所述分子含有可变α和β链(也分别称为tcrα和tcrβ)或可变γ和δ链(也分别称为tcrα和tcrβ)或其抗原结合部分,并且能够特异性结合与mhc分子结合的肽。在一些实施方案中,tcr呈αβ形式。通常,以αβ和γδ形式存在的tcr在结构上总体上相似,但是表达它们的t细胞可以具有不同的解剖学位置或功能。tcr可以在细胞的表面上发现或以可溶形式发现。通常,在t细胞(或t淋巴细胞)的表面上发现tcr,在此处它通常负责识别与主要组织相容性复合物(mhc)分子结合的抗原。
除非另有说明,否则术语“tcr”应当理解为涵盖完整的tcr以及其抗原结合部分或抗原结合片段。在一些实施方案中,tcr是完整或全长tcr,包括呈αβ形式或γδ形式的tcr。在一些实施方案中,tcr是小于全长tcr但结合至mhc分子中所结合的特定肽(如结合至mhc-肽复合物)的抗原结合部分。在一些情况下,tcr的抗原结合部分或片段可以仅含有全长或完整tcr的结构性结构域的一部分,但是仍能够结合与完整tcr结合的肽表位(如mhc-肽复合物)。在一些情况下,抗原结合部分含有tcr的可变结构域(如tcr的可变α链和可变β链),足以形成用于与特定mhc-肽复合物结合的结合位点。通常,tcr的可变链含有参与对肽、mhc和/或mhc-肽复合物的识别的互补决定区。
在一些实施方案中,tcr的可变结构域含有超变环或互补决定区(cdr),它们通常是抗原识别和结合能力和特异性的主要贡献者。在一些实施方案中,tcr的cdr或其组合形成给定tcr分子的全部或基本上全部的抗原结合位点。tcr链的可变区内的各个cdr通常由框架区(fr)隔开,与cdr相比,所述框架区通常在tcr分子之间展示较低变异性(参见例如,jores等人,proc.nat'lacad.sci.u.s.a.87:9138,1990;chothia等人,emboj.7:3745,1988;还参见lefranc等人,dev.comp.immunol.27:55,2003)。在一些实施方案中,cdr3是负责抗原结合或特异性的主要cdr,或者在给定tcr可变区上在三个cdr中对于抗原识别和/或对于与肽-mhc复合物的经处理肽部分的相互作用最重要。在一些背景下,α链的cdr1可以与某些抗原肽的n末端部分相互作用。在一些背景下,β链的cdr1可以与肽的c末端部分相互作用。在一些情境下,cdr2对与mhc-肽复合物的mhc部分的相互作用或识别具有最强的作用或者是主要的负责cdr。在一些实施方案中,β链的可变区可以含有另一高变区(cdr4或hvr4),所述高变区通常参与超抗原结合而非抗原识别(kotb(1995)clinicalmicrobiologyreviews,8:411-426)。
在一些实施方案中,tcr还可以含有恒定结构域、跨膜结构域和/或短细胞质尾(参见例如,janeway等人,immunobiology:theimmunesysteminhealthanddisease,第3版,currentbiologypublications,第4:33页,1997)。在一些方面,tcr的每条链可以具有一个n末端免疫球蛋白可变结构域、一个免疫球蛋白恒定结构域、跨膜区和位于c末端的短胞质尾。在一些实施方案中,tcr与参与介导信号转导的cd3复合物的不变蛋白质缔合。
在一些实施方案中,tcr链含有一个或多个恒定结构域。例如,给定tcr链(例如,α链或β链)的细胞外部分可以含有与细胞膜相邻的两个免疫球蛋白样结构域,如可变结构域(例如,vα或vβ;通常为基于kabat编号的氨基酸1至116,kabat等人,“sequencesofproteinsofimmunologicalinterest”,usdept.healthandhumanservices,publichealthservicenationalinstitutesofhealth,1991,第5版)和恒定结构域(例如,α链恒定结构域或cα,通常为基于kabat编号的链的位置117至259;或β链恒定结构域或cβ,通常为基于kabat的链的位置117至295)。例如,在一些情况下,由两条链形成的tcr的细胞外部分含有两个膜近端恒定结构域和两个膜远端可变结构域,所述可变结构域各自含有cdr。tcr的恒定结构域可以含有短连接序列,其中半胱氨酸残基形成二硫键,从而连接tcr的两条链。在一些实施方案中,tcr可以在α链和β链中的每一条链中具有另外的半胱氨酸残基,使得tcr在恒定结构域中含有两个二硫键。
在一些实施方案中,tcr链含有跨膜结构域。在一些实施方案中,跨膜结构域带正电荷。在一些情况下,tcr链含有胞质尾。在一些情况下,所述结构允许tcr与其他分子(像cd3)及其亚基缔合。例如,含有恒定结构域与跨膜区的tcr可以将蛋白质锚定在细胞膜中并与cd3信号传导设备或复合物的不变亚基缔合。cd3信号传导亚基(例如,cd3γ、cd3δ、cd3ε和cd3ζ链)的细胞内尾含有tcr复合物的信号传导能力中所涉及的一个或多个免疫受体酪氨酸激活基序或itam。
在一些实施方案中,tcr可以是两条链α和β(或者任选地γ和δ)的异二聚体,或者tcr可以是单链tcr构建体。在一些实施方案中,tcr是含有如通过一个或多个二硫键连接的两条单独链(α和β链或γ和δ链)的异二聚体。
在一些实施方案中,tcr可以从一个或多个已知的tcr序列(如vα,β链的序列)产生,所述一个或多个已知的tcr序列的基本上全长的编码序列是易于获得的。用于从细胞来源获得全长tcr序列(包括v链序列)的方法是熟知的。在一些实施方案中,编码tcr的核酸可以从多种来源获得,如通过一种或多种给定细胞内的或从所述一种或多种给定细胞中分离的编码tcr的核酸的聚合酶链式反应(pcr)扩增获得,或者通过公众可获得的tcrdna序列的合成获得。
在一些实施方案中,tcr是从生物来源获得,如来自细胞(如来自t细胞,例如细胞毒性t细胞)、t细胞杂交瘤或其他公众可获得的来源。在一些实施方案中,t细胞可以从体内分离的细胞获得。在一些实施方案中,tcr是胸腺选择的tcr。在一些实施方案中,tcr是新表位限制性tcr。在一些实施方案中,t细胞可以是经培养的t细胞杂交瘤或克隆。在一些实施方案中,tcr或其抗原结合部分或其抗原结合片段可以根据对所述tcr序列的知识以合成方式产生。
在一些实施方案中,tcr是从通过针对靶多肽抗原或其靶t细胞表位筛选候选tcr文库而鉴定或选择的tcr产生的。tcr文库可以通过扩增来自t细胞的vα和vβ库来产生,所述t细胞是从受试者中分离的,包括存在于pbmc、脾或其他淋巴器官中的细胞。在一些情况下,t细胞可以从肿瘤浸润淋巴细胞(til)扩增。在一些实施方案中,tcr文库可以从cd4+或cd8+细胞产生。在一些实施方案中,tcr可以从正常或健康受试者的t细胞来源扩增,即正常tcr文库。在一些实施方案中,tcr可以从患病受试者的t细胞来源扩增,即患病tcr文库。在一些实施方案中,使用简并引物扩增vα和vβ的基因库,如在从人获得的样品(如t细胞)中通过rt-pcr扩增。在一些实施方案中,sctv文库可以从天然vα和vβ文库组装,其中经扩增的产物被克隆或组装以由接头隔开。根据受试者和细胞的来源,所述文库可以是hla等位基因特异性的。可替代地,在一些实施方案中,tcr文库可以通过亲本或支架tcr分子的诱变或多样化产生。在一些方面,使tcr经历例如α或β链的定向进化,如通过诱变来进行。在一些方面,tcr的cdr内的特定残基被改变。在一些实施方案中,所选tcr可以通过亲和力成熟来修饰。在一些实施方案中,可以如通过筛选以评估针对肽的ctl活性来选择抗原特异性t细胞。在一些方面,可以选择例如存在于抗原特异性t细胞上的tcr,如通过结合活性,例如对抗原的特定亲和力或亲合力来选择。
在一些实施方案中,tcr或其抗原结合部分是已经修饰或工程化的。在一些实施方案中,使用定向进化方法来产生具有改变的特性(如对特定mhc-肽复合物具有较高亲和力)的tcr。在一些实施方案中,通过展示方法实现定向进化,所述展示方法包括但不限于酵母展示(holler等人(2003)natimmunol,4,55-62;holler等人(2000)procnatlacadsciusa,97,5387-92);噬菌体展示(li等人(2005)natbiotechnol,23,349-54)或t细胞展示(chervin等人(2008)jimmunolmethods,339,175-84)。在一些实施方案中,展示方法涉及工程化或修饰已知的亲本或参考tcr。例如,在一些情况下,野生型tcr可以用作模板以用于产生经诱变的tcr,其中cdr的一个或多个残基被突变,并且选择具有所需改变的特性(如对所需靶抗原具有更高的亲和力)的突变体。
在一些实施方案中,用于产生或产生目的tcr的靶多肽的肽是已知的或者可以容易地鉴定。在一些实施方案中,适用于产生tcr或抗原结合部分的肽可以基于目的靶多肽(如下文所述的靶多肽)中hla限制性基序的存在来确定。在一些实施方案中,使用可用的计算机预测模型来鉴定肽。在一些实施方案中,对于预测mhci类结合位点,此类模型包括但不限于propred1(singh和raghava(2001)bioinformatics17(12):1236-1237)和syfpeithi(参见schuler等人(2007)immunoinformaticsmethodsinmolecularbiology,409(1):75-932007)。在一些实施方案中,mhc限制性表位是hla-a0201,其在所有高加索人的大约39%-46%中表达,并且因此代表用于制备tcr或其他mhc-肽结合分子的mhc抗原的合适选择。
已知使用计算机预测模型的hla-a0201结合基序和蛋白酶体和免疫蛋白酶体的切割位点。对于预测mhci类结合位点,此类模型包括但不限于propred1(更详细地描述于以下文献中:singh和raghava,propred:predictionofhla-drbindingsites.bioinformatics17(12):1236-12372001)和syfpeithi(参见schuler等人syfpeithi,databaseforsearchingandt-cellepitopeprediction.,immunoinformaticsmethodsinmolecularbiology,第409卷(1):75-932007)。
在一些实施方案中,tcr或其抗原结合部分可以是重组产生的天然蛋白或其突变形式,其中一种或多种特性(如结合特征)已发生改变。在一些实施方案中,tcr可以源自多个动物物种之一,如人、小鼠、大鼠或其他哺乳动物。tcr可以是细胞结合的或呈可溶形式。在一些实施方案中,出于所提供的方法的目的,tcr呈在细胞表面上表达的细胞结合形式。
在一些实施方案中,tcr是全长tcr。在一些实施方案中,tcr是抗原结合部分。在一些实施方案中,tcr是二聚体tcr(dtcr)。在一些实施方案中,tcr是单链tcr(sc-tcr)。在一些实施方案中,dtcr或sctcr具有如wo03/020763、wo04/033685、wo2011/044186中所述的结构。
在一些实施方案中,tcr含有对应于跨膜序列的序列。在一些实施方案中,tcr确实含有对应于胞质序列的序列。在一些实施方案中,tcr能够与cd3形成tcr复合物。在一些实施方案中,任何tcr(包括dtcr或sctcr)可以与信号传导结构域连接,从而在t细胞表面上产生活性tcr。在一些实施方案中,tcr在细胞表面上表达。
在一些实施方案中,dtcr含有第一多肽(其中对应于tcrα链可变区序列的序列与对应于tcrα链恒定区细胞外序列的序列的n末端融合)和第二多肽(其中对应于tcrβ链可变区序列的序列与对应于tcrβ链恒定区细胞外序列的序列的n末端融合),所述第一和第二多肽通过二硫键连接。在一些实施方案中,所述键可以对应于天然二聚体αβtcr中存在的天然链间二硫键。在一些实施方案中,链间二硫键不存在于天然tcr中。例如,在一些实施方案中,可以将一个或多个半胱氨酸掺入dtcr多肽对的恒定区细胞外序列中。在一些情况下,可能需要天然和非天然二硫键二者。在一些实施方案中,tcr含有跨膜序列以锚定至膜。
在一些实施方案中,dtcr含有tcrα链,所述tcrα链含有可变α结构域、恒定α结构域和附接至恒定α结构域c末端的第一二聚化基序;以及tcrβ链,所述tcrβ链包含可变β结构域、恒定β结构域和附接至恒定β结构域c末端的第一二聚化基序,其中所述第一和第二二聚化基序易于相互作用以在第一二聚化基序的氨基酸与第二二聚化基序的氨基酸之间形成共价键,从而将tcrα链与tcrβ链连接在一起。
在一些实施方案中,tcr是sctcr。通常,可以使用已知的方法产生sctcr,参见例如,soohoo,w.f.等人pnas(usa)89,4759(1992);wülfing,c.和plückthun,a.,j.mol.biol.242,655(1994);kurucz,i.等人pnas(usa)903830(1993);国际公开的pct号wo96/13593、wo96/18105、wo99/60120、wo99/18129、wo03/020763、wo2011/044186;和schlueter,c.j.等人j.mol.biol.256,859(1996)。在一些实施方案中,sctcr含有引入的非天然链间二硫键以促进tcr链的缔合(参见例如,国际公开pct号wo03/020763)。在一些实施方案中,sctcr是非二硫键连接的截短的tcr,其中与其c末端融合的异源亮氨酸拉链促进链缔合(参见例如国际公开pct号wo99/60120)。在一些实施方案中,sctcr含有经由肽接头与tcrβ可变结构域共价连接的tcrα可变结构域(参见例如,国际公开的pct号wo99/18129)。
在一些实施方案中,sctcr含有第一区段(由对应于tcrα链可变区的氨基酸序列构成)、第二区段(由与对应于tcrβ链恒定结构域细胞外序列的氨基酸序列的n末端融合的对应于tcrβ链可变区序列的氨基酸序列构成)和接头序列(将第一区段的c末端连接至第二区段的n末端)。
在一些实施方案中,sctcr含有第一区段(由与α链细胞外恒定结构域序列的n末端融合的α链可变区序列构成)和第二区段(由与序列β链细胞外恒定和跨膜序列的n末端融合的β链可变区序列构成)以及任选接头序列(将第一区段的c末端连接至第二区段的n末端)。
在一些实施方案中,sctcr含有第一区段(由与β链细胞外恒定结构域序列的n末端融合的tcrβ链可变区序列构成)和第二区段(由与序列α链细胞外恒定和跨膜序列的n末端融合的α链可变区序列构成)以及任选接头序列(将第一区段的c末端连接至第二区段的n末端)。
在一些实施方案中,sctcr的连接第一和第二tcr区段的接头可以是能够形成单一多肽链同时保留tcr结合特异性的任何接头。在一些实施方案中,所述接头序列可以例如具有式-p-aa-p-,其中p是脯氨酸并且aa代表氨基酸序列,其中氨基酸是甘氨酸和丝氨酸。在一些实施方案中,第一和第二区段配对,使得其可变区序列定向用于这种结合。因此,在一些情况下,所述接头具有足够的长度以跨越所述第一区段的c末端与所述第二区段的n末端之间的距离,或反之亦然,但是不能太长以阻断或减少所述sctcr与所述靶配体的结合。在一些实施方案中,所述接头可以含有从或从约10至45个氨基酸,如10至30个氨基酸或26至41个氨基酸残基,例如29、30、31或32个氨基酸。在一些实施方案中,所述接头具有式-pggg-(sgggg)5-p-,其中p是脯氨酸,g是甘氨酸,并且s是丝氨酸(seqidno:22)。在一些实施方案中,所述接头具有序列gsaddakkdaakkdgks(seqidno:23)
在一些实施方案中,sctcr含有共价二硫键,其将α链的恒定结构域的免疫球蛋白区域的残基连接至β链的恒定结构域的免疫球蛋白区域的残基。在一些实施方案中,天然tcr中不存在链间二硫键。例如,在一些实施方案中,可以将一个或多个半胱氨酸掺入sctcr多肽的第一和第二区段的恒定区细胞外序列中。在一些情况下,可能需要天然和非天然二硫键二者。
在含有引入的链间二硫键的dtcr或sctcr的一些实施方案中,不存在天然二硫键。在一些实施方案中,形成天然链间二硫键的一个或多个天然半胱氨酸被取代为另一种残基,如丝氨酸或丙氨酸。在一些实施方案中,引入的二硫键可以通过使第一和第二区段上的非半胱氨酸残基突变为半胱氨酸来形成。tcr的示例性非天然二硫键描述于公开的国际pct号wo2006/000830中。
在一些实施方案中,tcr或其抗原结合片段展现的对靶抗原的亲和力具有如下平衡结合常数:在或在约10-5与10-12m之间以及其中的所有单独值和范围。在一些实施方案中,靶抗原是mhc-肽复合物或配体。
在一些实施方案中,编码tcr(如α和β链)的一种或多种核酸可以通过pcr、克隆或其他合适的方法扩增,并且克隆到一种或多种合适的表达载体中。所述表达载体可以是任何合适的重组表达载体,并且可以用于转化或转染任何合适的宿主。合适的载体包括设计用于繁殖和扩增或用于表达或用于两者的那些,如质粒和病毒。
在一些实施方案中,载体可以是以下系列的载体:puc系列(fermentaslifesciences)、pbluescript系列(stratagene,加利福尼亚州拉霍亚)、pet系列(novagen,威斯康星州麦迪逊)、pgex系列(pharmaciabiotech,瑞典乌普萨拉)或pex系列(clontech,加利福尼亚州帕洛阿尔托)。在一些情况下,也可以使用噬菌体载体,如λg10、λgt11、λzapii(stratagene)、λembl4和λnm1149。在一些实施方案中,可以使用植物表达载体,并且包括pbi01、pbi101.2、pbi101.3、pbi121和pbin19(clontech)。在一些实施方案中,动物表达载体包括peuk-cl、pmam和pmamneo(clontech)。在一些实施方案中,使用病毒载体,如逆转录病毒载体。
在一些实施方案中,可以使用标准重组dna技术来制备所述重组表达载体。在一些实施方案中,载体可以含有调节序列,如转录和翻译起始和终止密码子,其对引入载体的宿主(例如,细菌、真菌,植物或动物)的类型具特异性,酌情并考虑所述载体是基于dna还是基于rna。在一些实施方案中,载体可以含有非天然启动子,其与编码tcr或抗原结合部分(或其他mhc-肽结合分子)的核苷酸序列可操作地连接。在一些实施方案中,启动子可以是非病毒启动子或病毒启动子,如巨细胞病毒(cmv)启动子、sv40启动子、rsv启动子和在鼠干细胞病毒的长末端重复序列中发现的启动子。还设想其他已知的启动子。
在一些实施方案中,为了生成编码tcr的载体,将α和β链从自表达目的tcr的t细胞克隆分离的总cdna进行pcr扩增,并克隆至表达载体中。在一些实施方案中,将α和β链克隆至同一载体中。在一些实施方案中,将α和β链克隆至不同载体中。在一些实施方案中,将所产生的α和β链掺入逆转录病毒(例如,慢病毒)载体中。遗传工程化细胞和产生细胞的方法
在一些实施方案中,所提供的方法涉及向患有疾病或病症的受试者施用表达重组抗原受体的细胞。用于引入基因工程化组分例如重组受体(例如car或tcr)的各种方法是熟知的,并且可以与所提供的方法和组合物一起使用。示例性方法包括用于转移编码受体的核酸的那些,包括通过病毒(如逆转录病毒或慢病毒)、转导、转座子和电穿孔来进行。
表达受体并且通过所提供的方法施用的细胞包括工程化细胞。基因工程化通常涉及如通过逆转录病毒转导、转染或转化,将编码重组或工程化组分的核酸引入含有细胞的组合物中。
3.嵌合自身抗体受体(caar)
在一些实施方案中,由与所提供的方法、用途、制品和组合物结合使用的工程化细胞表达的重组受体是嵌合自身抗体受体(caar)。在一些实施方案中,caar对自身抗体具有特异性。在一些实施方案中,表达caar的细胞(如工程化以表达caar的t细胞)可以用于特异性地结合并杀伤表达自身抗体的细胞,但不杀伤表达正常抗体的细胞。在一些实施方案中,表达caar的细胞可以用于治疗与自身抗原的表达相关的自身免疫性疾病,例如自身免疫性疾病。在一些实施方案中,caar表达细胞可以靶向最终产生自身抗体并在其细胞表面上展示自身抗体的b细胞,将这些b细胞标记为用于治疗干预的疾病特异性靶标。在一些实施方案中,表达caar的细胞可以用于通过使用抗原特异性嵌合自身抗体受体靶向引起疾病的b细胞,有效靶向和杀伤自身免疫性疾病中的致病性b细胞。在一些实施方案中,重组受体是caar,如美国专利申请公开号us2017/0051035中所述的任一种。
在一些实施方案中,caar包含自身抗体结合结构域、跨膜结构域和细胞内信号传导区。在一些实施方案中,细胞内信号传导区包含细胞内信号传导结构域。在一些实施方案中,细胞内信号传导结构域是或包含初级信号传导结构域、能够在t细胞中诱导初级激活信号的信号传导结构域、t细胞受体(tcr)组分的信号传导结构域和/或包含免疫受体酪氨酸激活基序(itam)的信号传导结构域。在一些实施方案中,细胞内信号传导区包含次级或共刺激信号传导区(次级细胞内信号传导区)。
在一些实施方案中,自身抗体结合结构域包含自身抗原或其片段。自身抗原的选择可以取决于所靶向的自身抗体的类型。例如,可以因为自身抗原识别与特定疾病状态(例如自身免疫疾病,如自身抗体介导的自身免疫疾病)相关的靶细胞(如b细胞)上的自身抗体,而选择所述自身抗原。在一些实施方案中,所述自身免疫性疾病包括寻常型天疱疮(pv)。示例性自身抗原包括桥粒芯糖蛋白1(dsg1)和dsg3。
4.多靶向
在一些实施方案中,与所提供的方法、用途、制品和组合物结合使用的细胞包括采用多靶向策略的细胞,所述多靶向策略如在所述细胞上表达两种或更多种遗传工程化受体,每种遗传工程化受体识别相同或不同的抗原,并且通常各自包括不同的细胞内信号传导组分。此类多靶向策略描述于例如以下文献中:国际专利申请公开号wo2014055668a1(描述激活和共刺激car的组合,例如,靶向在脱靶(例如,正常细胞)上单独存在,但仅在要治疗的疾病或病症的细胞上一起存在的两种不同抗原)和fedorov等人,sci.transl.medicine,5(215)(2013)(描述表达激活和抑制性car的细胞,如其中激活car结合至在正常或未患病细胞和要治疗的疾病或病症的细胞二者都上表达的一种抗原,并且抑制性car结合至仅在正常细胞或不需要治疗的细胞上表达的另一种抗原的那些)。
例如,在一些实施方案中,细胞包括表达第一基因工程化抗原受体(例如,car或tcr)的受体,其通常在与由第一受体识别的抗原(例如,第一抗原)特异性地结合后能够诱导激活或刺激信号至所述细胞。在一些实施方案中,所述细胞还包括第二基因工程化抗原受体(例如,car或tcr),例如嵌合共刺激受体,所述受体通常在特异性结合至由第二受体识别的第二抗原后,能够将共刺激信号诱导至免疫细胞。在一些实施方案中,第一抗原与第二抗原是相同的。在一些实施方案中,第一抗原与第二抗原是不同的。
在一些实施方案中,第一和/或第二基因工程化抗原受体(例如car或tcr)能够诱导激活信号至所述细胞。在一些实施方案中,所述受体包括含有itam或itam样基序的细胞内信号传导组分。在一些实施方案中,由第一受体诱导的激活涉及信号转导或细胞中蛋白质表达的变化,导致启动免疫应答(例如itam磷酸化)和/或启动itam介导的信号转导级联、形成免疫突触和/或所结合受体(例如cd4或cd8等)附近的分子的聚簇、激活一种或多种转录因子(例如nf-κb和/或ap-1)、和/或诱导因子(如细胞因子)的基因表达、增殖和/或存活。
在一些实施方案中,第一和/或第二受体包括共刺激受体的细胞内信号传导结构域或区域,所述共刺激受体例如cd28、cd137(4-1bb)、ox40和/或icos。在一些实施方案中,第一和第二受体包括不同的共刺激受体的细胞内信号传导结构域。在一个实施方案中,第一受体含有cd28共刺激信号传导区域,并且第二受体含有4-1bb共刺激信号传导区域,或反之亦然。
在一些实施方案中,第一和/或第二受体包括含有itam或itam样基序的细胞内信号传导结构域和共刺激受体的细胞内信号传导结构域两者。
在一些实施方案中,第一受体包含含有itam或itam样基序的细胞内信号传导结构域,并且第二受体包含共刺激受体的细胞内信号传导结构域。与在同一细胞中诱导的激活信号组合的共刺激信号是导致免疫应答的共刺激信号,所述免疫应答是例如稳健且持续的免疫应答,如增加的基因表达、细胞因子和其他因子的分泌、以及t细胞介导的效应子功能(如细胞杀伤)。
在一些实施方案中,单独的第一受体的连接和单独的第二受体的连接都不会诱导稳健的免疫应答。在一些方面,如果仅连接一种受体,则细胞变得耐受抗原或对抗原无反应,或被抑制,和/或不被诱导增殖或分泌因子或执行效应子功能。然而,在一些此类实施方案中,在连接多个受体时,如在遇到表达第一和第二抗原的细胞时,实现所需应答,如完全免疫激活或刺激,例如如通过一种或多种细胞因子的分泌、增殖、持久性和/或执行免疫效应子功能(如靶细胞的细胞毒性杀伤)所指示。
在一些实施方案中,两种受体分别将激活和抑制信号诱导至细胞,使得一种受体与其抗原的结合激活细胞或诱导反应,但是第二抑制性受体与其抗原的结合诱导了抑制或减弱所述反应的信号。例子是激活car与抑制性car或icar的组合。例如,可以使用这种策略,其中激活car结合在疾病或病症中表达但也在正常细胞上表达的抗原,并且抑制性受体结合至在正常细胞上表达但不在疾病或病症的细胞上表达的单独抗原。
在一些实施方案中,多靶向策略用于以下情况:其中与特定疾病或病症相关的抗原在未患病细胞上表达和/或在工程化细胞本身上表达,所述表达为瞬时表达(例如,在与基因工程化相关的刺激后)或永久表达。在此类情况下,通过需要连接两个分开的和单独特异性抗原受体,可以改善特异性、选择性和/或功效。
在一些实施方案中,多种抗原(例如,第一和第二抗原)在所靶向的细胞、组织或者疾病或病症上(如在癌细胞上)表达。在一些方面,细胞、组织、疾病或病症是多发性骨髓瘤或多发性骨髓瘤细胞。在一些实施方案中,多种抗原中的一种或多种通常也在不需要用细胞疗法靶向的细胞(例如正常或未患病细胞或组织,和/或工程化细胞本身)上表达。在此类实施方案中,因为需要连接多种受体以实现细胞的反应,实现特异性和/或功效。
b.用于基因工程化的核酸、载体和方法
在一些实施方案中,将细胞(例如富集的cd57-t细胞的群体的细胞)基因工程化以表达重组受体。在一些实施方案中,工程化是通过引入编码重组受体或其部分或组分的一种或多种多核苷酸来进行。还提供编码重组受体的多核苷酸,以及含有此类核酸和/或多核苷酸的载体或构建体。
在一些实施方案中,编码重组受体的多核苷酸含有至少一个启动子,所述启动子可操作地连接以控制所述重组受体的表达。在一些例子中,多核苷酸含有两个、三个或更多个启动子,所述启动子可操作地连接以控制所述重组受体的表达。在一些实施方案中,多核苷酸可以含有对引入所述多核苷酸的宿主的类型(例如,细菌、真菌、植物或动物)具有特异性的调节序列(如转录和翻译起始和终止密码子),酌情并考虑所述多核苷酸是基于dna还是基于rna。在一些实施方案中,多核苷酸可以含有调节/控制元件,如启动子、增强子、内含子、多腺苷酸化信号、kozak共有序列、内部核糖体进入位点(ires)、2a序列和剪接受体或供体。在一些实施方案中,多核苷酸可以含有与编码重组受体和/或一种或多种另外的多肽的核苷酸序列可操作地连接的非天然启动子。在一些实施方案中,启动子选自rnapoli、polii或poliii启动子。在一些实施方案中,启动子由rna聚合酶ii识别(例如cmv、sv40早期区域或腺病毒主要晚期启动子)。在另一个实施方案中,启动子由rna聚合酶iii识别(例如u6或h1启动子)。在一些实施方案中,启动子可以是非病毒启动子或病毒启动子,如巨细胞病毒(cmv)启动子、sv40启动子、rsv启动子和在鼠干细胞病毒的长末端重复序列中发现的启动子。还设想其他已知的启动子。
在一些实施方案中,启动子是或包含组成型启动子。示例性组成型启动子包括例如猿病毒40早期启动子(sv40)、巨细胞病毒立即早期启动子(cmv)、人泛素c启动子(ubc)、人延伸因子1α启动子(ef1α)、小鼠磷酸甘油酸激酶1启动子(pgk)、和与cmv早期增强子偶联的鸡β-肌动蛋白启动子(cagg)。在一些实施方案中,组成型启动子是合成或修饰的启动子。在一些实施方案中,启动子是或包含mnd启动子,它是一种合成启动子,含有修饰的momulvltr的u3区和骨髓增生性肉瘤病毒增强子(参见challita等人(1995)j.virol.69(2):748-755)。在一些实施方案中,启动子是组织特异性启动子。在另一个实施方案中,启动子是病毒启动子。在另一个实施方案中,启动子是非病毒启动子。在一些实施方案中,示例性启动子可以包括但不限于人延伸因子1α(ef1α)启动子或其修饰形式或mnd启动子。
在另一个实施方案中,启动子是受调节的启动子(例如诱导型启动子)。在一些实施方案中,启动子是诱导型启动子或阻抑型启动子。在一些实施方案中,启动子包含lac操纵子序列、四环素操纵子序列、半乳糖操纵子序列或多西环素操纵子序列,或者是其类似物或能够由lac阻遏因子或四环素阻遏因子或其类似物结合或识别。在一些实施方案中,多核苷酸不包括调节元件,例如,启动子。
在一些情况下,编码所述重组受体的核酸序列含有编码信号肽的信号序列。在一些方面,信号序列可以编码源自天然多肽的信号肽。在其他方面,信号序列可以编码异源或非天然信号肽,例如seqidno:25中所示的并且由seqidno:24中所示的核苷酸序列编码的gmcsfrα链的示例性信号肽。在一些情况下编码重组受体(例如嵌合抗原受体(car))的核酸序列含有编码信号肽的信号序列。非限制性示例性的信号肽包括例如seqidno:25中所示的并且由seqidno:24中所示的核苷酸序列编码的gmcsfrα链信号肽,或seqidno:26中所示的cd8α信号肽。
在一些实施方案中,多核苷酸含有编码一种或多种另外的多肽(例如一种或多种标记和/或一种或多种效应分子)的核酸序列。在一些实施方案中,所述一种或多种标记包括转导标记、替代标记和/或选择标记。例如编码一种或多种另外的多肽的引入的另外的核酸序列包括可以例如通过促进存活力和/或转移细胞的功能改善疗法的功效的核酸序列;提供用于选择和/或评价细胞的遗传标记如以便在体内评估存活或定位的核酸序列;例如通过使细胞对体内阴性选择易感来提高安全性的核酸序列,如以下文献中所述:luptons.d.等人,mol.andcellbiol.,11:6(1991);和riddell等人,humangenetherapy3:319-338(1992);还参见wo1992008796和wo1994028143(描述了使用从融合显性的阳性选择标记与阴性选择标记来源的双功能选择融合基因)和美国专利号6,040,177。
在一些实施方案中,标记是转导标记或替代标记。转导标记或替代标记可用于检测已经引入多核苷酸(例如编码重组受体的多核苷酸)的细胞。在一些实施方案中,转导标记可以指示或确认对细胞的修饰。在一些实施方案中,替代标记是经制备在细胞表面上与重组受体(例如,car)共表达的蛋白质。在特定实施方案中,这种替代标记是已经修饰以具有极少或无活性的表面蛋白。在某些实施方案中,替代标记在编码重组受体的同一多核苷酸上编码。在一些实施方案中,编码重组受体的核酸序列与编码标记的核酸序列可操作地连接,任选地由内部核糖体进入位点(ires)或者编码自我切割肽或引起核糖体跳跃的肽如2a序列的核酸隔开。在一些情况下,外在标记基因可以与工程化细胞结合用于允许检测或选择细胞,并且在一些情况下还用于促进细胞消除和/或细胞自杀。
示例性替代标记可以包括细胞表面多肽的截短的形式,如以下截短的形式,其是非功能性的,并且不转导或不能转导信号或通常由细胞表面多肽的全长形式转导的信号,和/或不内化或不能内化。示例性截短的细胞表面多肽包括生长因子或其他受体的截短形式,如截短的人表皮生长因子受体2(ther2)、截短的表皮生长因子受体(tegfr,seqidno:7或16所示的示例性tegfr序列)或前列腺特异性膜抗原(psma)或其修饰形式(如截短的psma(tpsma))。在一些方面,tegfr可以含有抗体西妥昔单抗
在一些实施方案中,所述标记是或包含可检测蛋白,如荧光蛋白,如绿色荧光蛋白(gfp)、增强型绿色荧光蛋白(egfp)(如超折叠gfp(sfgfp))、红色荧光蛋白(rfp)(如tdtomato、mcherry、mstrawberry、asred2、dsred或dsred2)、青色荧光蛋白(cfp)、蓝绿色荧光蛋白(bfp)、增强型蓝色荧光蛋白(ebfp)和黄色荧光蛋白(yfp)及其变体,包括荧光蛋白的物种变体、单体变体、密码子优化的、稳定的和/或增强的变体。在一些实施方案中,所述标记是或包含酶(如萤光素酶)、来自大肠杆菌(e.coli)的lacz基因、碱性磷酸酶、分泌型胚胎碱性磷酸酶(seap)、氯霉素乙酰转移酶(cat)。示例性发光报告基因包括萤光素酶(luc)、β-半乳糖苷酶、氯霉素乙酰转移酶(cat)、β-葡糖醛酸糖苷酶(gus)或其变体。在一些方面,所述酶的表达可以通过添加底物来检测,所述底物可以根据所述酶的表达和功能活性来检测。
在一些实施方案中,所述标记是选择标记。在一些实施方案中,选择标记是或包含赋予针对外源药剂或药物的抗性的多肽。在一些实施方案中,选择标记是抗生素抗性基因。在一些实施方案中,选择标记是向哺乳动物细胞赋予抗生素抗性的抗生素抗性基因。在一些实施方案中,选择标记是或包含嘌呤霉素抗性基因、潮霉素抗性基因、杀稻瘟菌素抗性基因、新霉素抗性基因、遗传霉素抗性基因或博莱霉素抗性基因或其修饰形式。
本文所述的重组受体和/或一种或多种另外的多肽中的任一种可以由一种或多种多核苷酸编码,所述多核苷酸含有呈任何组合、定向或排列的编码重组受体的一个或多个核酸序列。例如,一种、两种、三种或更多种多核苷酸可以编码一种、两种、三种或更多种不同多肽(例如,重组受体或其部分或组分)和/或一种或多种另外的多肽(例如,标记和/或效应分子)。在一些实施方案中,一种多核苷酸含有编码重组受体(例如,car)或其部分或组分的核酸序列,以及编码一种或多种另外的多肽的核酸序列。在一些实施方案中,一种载体或构建体含有编码重组受体(例如,car)或其部分或组分的核酸序列,并且单独载体或构建体含有编码一种或多种另外的多肽的核酸序列。在一些实施方案中,编码重组受体的核酸序列和编码一种或多种另外的多肽的核酸序列可操作地连接至两种不同启动子。在一些实施方案中,编码重组受体的核酸存在于编码一种或多种另外的多肽的核酸的上游。在一些实施方案中,编码重组受体的核酸存在于编码一种或多种另外的多肽的核酸的下游。
在某些情况下,一种多核苷酸含有的核酸序列编码两种或更多种不同多肽链,例如,重组受体和一种或多种另外的多肽,例如,标记和/或效应分子。在一些实施方案中,编码两种或更多种不同多肽链(例如,重组受体和一种或多种另外的多肽)的核酸序列存在于两种单独多核苷酸中。例如,提供两种单独多核苷酸,并且每一种可以单独地转移至或引入细胞中以供在细胞中表达。在一些实施方案中,编码标记的核酸序列和编码重组受体的核酸序列存在于或插入于细胞基因组内的不同位置。在一些实施方案中,编码标记的核酸序列和编码重组受体的核酸序列可操作地连接至两种不同启动子。
在一些实施方案中,如多核苷酸含有第一和第二核酸序列的那些实施方案中,编码不同多肽链中的每一种的编码序列可以与相同或不同的启动子可操作地连接。在一些实施方案中,所述核酸分子可以含有驱动两条或更多条不同多肽链表达的启动子。在一些实施方案中,此类核酸分子可以是多顺反子的(双顺反子的或三顺反子的,参见例如,美国专利号6,060,273)。在一些实施方案中,编码重组受体的核酸序列和编码一种或多种另外的多肽的核酸序列可操作地连接至相同启动子,并且任选地由内部核糖体进入位点(ires)或者编码自我切割肽或引起核糖体跳跃的肽如2a元件的核酸隔开。例如,示例性标记和任选的核糖体跳跃序列可以是pct公开号wo2014031687中披露的任一种。
在一些实施方案中,可以将转录单元工程化为含有ires的双顺反子单元,其允许基因产物(例如编码重组受体和另外的多肽)通过来自单一启动子的信息共表达。可替代地,在一些情况下,单一启动子可引导rna的表达,所述rna在单一开放阅读框(orf)中含有两个或三个基因(例如编码标记和编码重组受体),所述基因由编码自切割肽(例如,2a序列)或蛋白酶识别位点(例如,弗林蛋白酶)的序列彼此隔开。orf由此编码单一多肽,所述多肽在翻译期间(在2a的情况下)或在翻译后被处理为单独蛋白质。在一些情况下,肽(如t2a)可以引起核糖体跳过2a元件c末端处肽键的合成(核糖体跳跃),从而导致2a序列末端与下游的下一个肽之间隔开(参见例如,defelipe,geneticvaccinesandther.2:13(2004)以及defelipe等人traffic5:616-626(2004))。各种2a元件是已知的。可以用于本文所公开的方法和系统中的2a序列的例子包括但不限于来自以下病毒的2a序列:口蹄疫病毒(f2a,例如,seqidno:21)、马鼻炎a病毒(e2a,例如,seqidno:20)、明脉扁刺蛾β四体病毒(t2a,例如,seqidno:6或17)和猪捷申病毒-1(p2a,例如,seqidno:18或19),如美国专利公开号20070116690中所述。
在一些实施方案中,编码重组受体和/或另外的多肽的多核苷酸含于载体中或可以被克隆至一种或多种载体中。在一些实施方案中,所述一种或多种载体可以用于转化或转染宿主细胞,例如用于工程化的细胞。示例性载体包括设计用于引入、增殖和扩增或用于表达或用于两者的载体,如质粒和病毒载体。在一些方面,所述载体是表达载体,例如重组表达载体。在一些实施方案中,可以使用标准重组dna技术来制备所述重组表达载体。
在一些实施方案中,所述载体可以是以下系列的载体:puc系列(fermentaslifesciences)、pbluescript系列(stratagene,加利福尼亚州拉霍亚)、pet系列(novagen,威斯康星州麦迪逊)、pgex系列(pharmaciabiotech,瑞典乌普萨拉)或pex系列(clontech,加利福尼亚州帕罗奥图)。在一些情况下,也可以使用噬菌体载体,如λg10、λgt11、λzapii(stratagene)、λembl4和λnm1149。在一些实施方案中,可以使用植物表达载体,并且包括pbi01、pbi101.2、pbi101.3、pbi121和pbin19(clontech)。在一些实施方案中,动物表达载体包括peuk-cl、pmam和pmamneo(clontech)。
在一些实施方案中,所述载体是病毒载体,如逆转录病毒载体。在一些实施方案中,将编码重组受体和/或一种或多种另外的多肽的多核苷酸经由逆转录病毒或慢病毒载体或者经由转座子引入细胞中(参见例如,baum等人(2006)moleculartherapy:thejournaloftheamericansocietyofgenetherapy.13:1050-1063;frecha等人(2010)moleculartherapy18:1748–1757;以及hackett等人(2010)moleculartherapy18:674–683)。
在一些实施方案中,使用重组感染性病毒颗粒(如例如,源自猿猴病毒40(sv40)、腺病毒、腺相关病毒(aav)的载体)将一种或多种多核苷酸引入细胞中。在一些实施方案中,使用重组慢病毒载体或逆转录病毒载体(如γ-逆转录病毒载体)将一种或多种多核苷酸引入t细胞中(参见例如,koste等人(2014)genetherapy2014年4月3日.doi:10.1038/gt.2014.25;carlens等人(2000)exphematol28(10):1137-46;alonso-camino等人(2013)molthernuclacids2,e93;park等人,trendsbiotechnol.2011年11月29日(11):550-557)。
在一些实施方案中,所述载体是逆转录病毒载体。在一些方面,逆转录病毒载体具有长末端重复序列(ltr),例如,源自莫洛尼鼠白血病病毒(momlv)、骨髓增生性肉瘤病毒(mpsv)、鼠胚胎干细胞病毒(mesv)、鼠干细胞病毒(mscv)、脾病灶形成病毒(sffv)或腺相关病毒(aav)的逆转录病毒载体。大多数逆转录病毒载体源自鼠逆转录病毒。在一些实施方案中,逆转录病毒包括源自任何禽类或哺乳动物细胞来源的那些。逆转录病毒通常是双嗜性的,这意味着它们能够感染包括人在内的若干种物种的宿主细胞。在一个实施方案中,要表达的基因替代逆转录病毒gag、pol和/或env序列。已经描述了许多例示性逆转录病毒系统(例如,美国专利号5,219,740;6,207,453;5,219,740;miller和rosman(1989)biotechniques7:980-990;miller,a.d.(1990)humangenetherapy1:5-14;scarpa等人(1991)virology180:849-852;burns等人(1993)proc.natl.acad.sci.usa90:8033-8037;以及boris-lawrie和temin(1993)cur.opin.genet.develop.3:102-109)。
慢病毒转导的方法是已知的。示例性方法描述于例如以下文献中:wang等人(2012)j.immunother.35(9):689-701;cooper等人(2003)blood.101:1637-1644;verhoeyen等人(2009)methodsmolbiol.506:97-114;以及cavalieri等人(2003)blood.102(2):497-505。在一些实施方案中,如通过逆转录病毒转导、转染或转化将编码重组受体和/或一种或多种另外的多肽的多核苷酸引入含有培养细胞的群体中。
在一些实施方案中,使用电穿孔将一种或多种多核苷酸引入t细胞中(参见例如,chicaybam等人,(2013)plosone8(3):e60298;以及vantedeloo等人(2000)genetherapy7(16):1431-1437)。在一些实施方案中,通过转座将重组核酸转移至t细胞中(参见例如,manuri等人(2010)humgenether21(4):427-437;sharma等人(2013)molecthernuclacids2,e74;以及huang等人(2009)methodsmolbiol506:115-126)。在免疫细胞中引入并表达遗传物质(例如,多核苷酸和/或载体)的其他方法包括磷酸钙转染(例如,如currentprotocolsinmolecularbiology,johnwiley&sons,纽约,纽约州中所述)、原生质体融合、阳离子脂质体介导的转染;钨粒子促进的微粒轰击(johnston,nature,346:776-777(1990));以及磷酸锶dna共沉淀(brash等人,mol.cellbiol.,7:2031-2034(1987))以及例如国际专利申请公开号wo2014055668和美国专利号7,446,190中所述的其他方法。
在一些实施方案中,可以在扩增期间或之后将编码重组受体和/或一种或多种另外的多肽的一种或多种多核苷酸或载体引入细胞(例如,t细胞)中。例如,一种或多种多核苷酸或载体的该引入可以用任何合适的逆转录病毒载体来进行。然后可以使所得基因工程化细胞摆脱初始刺激物(例如,抗cd3/抗cd28刺激物),随后用第二种类型的刺激物(例如,经由从头引入的重组受体)进行刺激。该第二种类型的刺激物可以包括呈肽/mhc分子形式的抗原刺激物、遗传引入的受体的同源(交联)配体(例如car的天然抗原和/或配体)或在新受体的框架内直接结合(例如通过识别受体内的恒定区)的任何配体(如抗体)。参见例如,cheadle等人,“chimericantigenreceptorsfort-cellbasedtherapy”methodsmolbiol.2012;907:645-66;或barrett等人,chimericantigenreceptortherapyforcancerannualreviewofmedicine第65卷:333-347(2014)。
在一些情况下,可以使用不需要激活细胞(例如,t细胞)的载体。在一些这样的情况下,可以在激活之前选择和/或转导细胞。因此,可以在培养细胞之前或之后将细胞工程化,并且在一些情况下在培养的至少一部分的同时或期间将细胞工程化。
c.用于基因工程化的细胞和细胞的制备
在一些实施方案中,提供工程化细胞,例如,基因工程化的或修饰的细胞,以及工程化细胞的方法。在一些实施方案中,将例如编码重组受体和/或一种或多种另外的多肽(如本文所述的任一种)的一种或多种多核苷酸引入用于工程化的细胞中。在一些方面,所述多核苷酸和/或或其部分是异源的,即,通常在细胞或从细胞获得的样品中不存在,如从另一种生物体或细胞获得的多核苷酸,所述多核苷酸通常不在进行工程化的细胞中和/或衍生出这种细胞的生物体中被发现。在一些实施方案中,所述核酸序列不是天然存在的,如在自然界中没有发现的核酸序列,或者从在自然界中发现的核酸序列进行修饰,包括包含编码来自多种不同细胞类型的各种结构域的核酸的嵌合组合的核酸序列。
所述细胞通常是真核细胞,如哺乳动物细胞,并且通常是人细胞。在一些实施方案中,所述细胞源自血液、骨髓、淋巴或淋巴器官,是免疫系统的细胞,如先天免疫或适应性免疫的细胞,例如骨髓或淋巴样细胞(包括淋巴细胞,通常是t细胞和/或nk细胞)。其他示例性细胞包括干细胞,如多潜能干细胞和多能干细胞,包括诱导多能干细胞(ipsc)。所述细胞通常是原代细胞,如直接从受试者分离和/或从受试者分离并冷冻的那些。在一些实施方案中,所述细胞包括t细胞或其他细胞类型的一个或多个子集,如整个t细胞群体、cd4+细胞、cd8+细胞及其亚群,如由以下所定义的那些亚群:功能、激活状态、成熟度、分化的可能性、扩增、再循环、定位和/或持久能力、抗原特异性、抗原受体类型、在特定器官或区室中的存在、标记或细胞因子分泌特征和/或分化程度。关于要治疗的受试者,所述细胞可以是同种异体的和/或自体的。所述方法包括现成的方法。在一些方面,如对于现成的技术,所述细胞是多能的和/或多潜能的,如干细胞,如ipsc。在一些实施方案中,所述方法包括从受试者分离细胞、将其制备、处理、培养和/或工程化,并在低温保存之前或之后将它们重新引入同一受试者体内。
t细胞和/或cd4+和/或cd8+t细胞的亚型和亚群包括幼稚t(tn)细胞、效应t细胞(teff)、记忆t细胞及其亚型(如干细胞记忆t(tscm)、中枢记忆t(tcm)、效应记忆t(tem)或终末分化的效应记忆t细胞)、肿瘤浸润淋巴细胞(til)、不成熟t细胞、成熟t细胞、辅助t细胞、细胞毒性t细胞、粘膜相关不变t(mait)细胞、天然存在和适应性调节t(treg)细胞、辅助t细胞(如th1细胞、th2细胞、th3细胞、th17细胞、th9细胞、th22细胞、滤泡性辅助t细胞)、α/βt细胞和δ/γt细胞。
在一些实施方案中,细胞是自然杀伤(nk)细胞。在一些实施方案中,细胞是单核细胞或粒细胞,例如骨髓细胞、巨噬细胞、嗜中性粒细胞、树突细胞、肥大细胞、嗜酸性粒细胞和/或嗜碱性粒细胞。
在一些实施方案中,所述细胞包括经由基因工程化引入的一种或多种核酸,并且由此表达此类核酸的重组或基因工程化的产物。在一些实施方案中,核酸是异源的,即通常不存在于细胞或从细胞获得的样品中,如从另一种生物体或细胞获得的核酸,例如,所述核酸通常不在被工程化的细胞和/或衍生出这种细胞的生物体中发现。在一些实施方案中,核酸不是天然存在的,如在自然界中未发现的核酸,包括包含编码来自多种不同细胞类型的多种结构域的核酸的嵌合组合的核酸。
在一些实施方案中,工程化细胞的制备包括一个或多个培养和/或制备步骤。用于引入编码转基因受体(如car)的核酸的细胞可以从样品分离,所述样品如生物样品,例如,从受试者获得或源自受试者的样品。在一些实施方案中,从中分离细胞的受试者是患有疾病或病症或需要细胞疗法或将被施用细胞疗法的受试者。在一些实施方案中,受试者是需要特定治疗性干预(如所分离、处理和/或工程化的细胞所用于的过继细胞疗法)的人。
因此,在一些实施方案中,细胞是原代细胞,例如原代人细胞。样品包括直接取自受试者的组织、流体和其他样品、以及来源于一个或多个处理步骤(如分离、离心、基因工程化(例如用病毒载体转导)、洗涤和/或孵育)的样品。生物样品可以是直接从生物来源获得的样品或经过处理的样品。生物样品包括但不限于体液(如血液、血浆、血清、脑脊液、滑液、尿液和汗液)、组织和器官样品,包括源自它们的被处理样品。
在一些方面,衍生或分离出细胞的样品是血液或血液来源的样品,或者是或源自单采术或白细胞单采术产物。示例性样品包括全血、外周血单核细胞(pbmc)、白细胞、骨髓、胸腺、组织活检、肿瘤、白血病、淋巴瘤、淋巴结、肠相关淋巴组织、粘膜相关淋巴组织、脾、其他淋巴组织、肝、肺、胃、肠、结肠、肾、胰腺、乳房、骨、前列腺、子宫颈、睾丸、卵巢、扁桃体或其他器官和/或源自它们的细胞。在细胞疗法(例如,过继细胞疗法)的背景下,样品包括来自自体和同种异体来源的样品。
在一些实施方案中,细胞源自细胞系,例如t细胞系。在一些实施方案中,细胞从异种来源(例如,从小鼠、大鼠、非人灵长类动物和猪)获得。
在一些实施方案中,细胞的分离包括一个或多个制备步骤和/或非基于亲和力的细胞分离步骤。在一些例子中,将细胞在一种或多种试剂的存在下洗涤、离心和/或孵育,例如以去除不需要的组分、富集所需组分、裂解或去除对特定试剂敏感的细胞。在一些例子中,基于一种或多种特性(如密度、粘附特性、大小、对特定组分的敏感性和/或抗性)分离细胞。
在一些例子中,例如通过单采术或白细胞单采术获得来自受试者的循环血液的细胞。在一些方面,样品含有淋巴细胞,包括t细胞、单核细胞、粒细胞、b细胞、其他有核白细胞、红细胞和/或血小板,并且在一些方面含有除了红细胞和血小板以外的细胞。
在一些实施方案中,洗涤从受试者收集的血细胞,例如以去除血浆级分并将细胞置于适当的缓冲液或介质中以用于后续处理步骤。在一些实施方案中,用磷酸盐缓冲盐水(pbs)洗涤细胞。在一些实施方案中,洗涤溶液缺少钙和/或镁和/或多种或全部二价阳离子。在一些方面,根据制造商的说明书,通过半自动“流通式”离心机(例如,cobe2991细胞处理器,baxter)完成洗涤步骤。在一些方面,洗涤步骤是通过切向流过滤(tff)根据制造商的说明书完成的。在一些实施方案中,在洗涤后将细胞重悬于多种生物相容性缓冲液中,所述缓冲液如例如不含ca++/mg++的pbs。在某些实施方案中,去除血细胞样品的组分并将细胞直接重悬于培养基中。
在一些实施方案中,所述方法包括基于密度的细胞分离方法,如通过裂解红细胞并通过percoll或ficoll梯度离心而从外周血制备白细胞。
在一些实施方案中,分离方法包括基于一种或多种特定分子(如表面标记(例如,表面蛋白)、细胞内标记或核酸)在细胞中的表达或存在分离不同细胞类型。在一些实施方案中,可以使用任何已知的基于此类标记的分离方法。在一些实施方案中,分离是基于亲和力或基于免疫亲和力的分离。例如,在一些方面,分离包括基于一种或多种标记(通常是细胞表面标记)在细胞中的表达或表达水平来分离细胞和细胞群,例如通过与特异性结合至此类标记的抗体或结合配偶体一起孵育,之后通常进行洗涤步骤并将已结合所述抗体或结合配偶体的细胞与尚未结合至所述抗体或结合配偶体的那些细胞分离。
此类分离步骤可以基于阳性选择(其中保留已经结合所述试剂的细胞以供进一步使用)和/或阴性选择(其中保留尚未结合至所述抗体或结合配偶体的细胞)。在一些例子中,保留两种级分以供进一步使用。在一些方面,在无法获得专门鉴定异质性群体中的细胞类型的抗体,使得最好基于除了所需群体以外的细胞表达的标记来进行分离的情况下,阴性选择可以特别有用。
分离无需导致特定细胞群或表达特定标记的细胞的100%富集或去除。例如,针对特定类型的细胞(如表达标记的那些)的阳性选择或富集是指增加此类细胞的数量或百分比,但不需要导致不表达所述标记的细胞的完全不存在。同样,特定类型的细胞(如表达标记的那些)的阴性选择、去除或耗尽是指减少此类细胞的数量或百分比,但不需要导致所有此类细胞的完全去除。
在一些例子中,进行多轮分离步骤,其中使来自一个步骤的阳性或阴性选择的级分经历另一分离步骤,如后续阳性或阴性选择。在一些例子中,单一分离步骤可以同时耗尽表达多种标记的细胞,如通过将细胞与多种抗体或结合配偶体(每种抗体或结合配偶体对被靶向用于阴性选择的标记具有特异性)一起孵育。同样,通过将细胞与在各种细胞类型上表达的多种抗体或结合配偶体一起孵育,可以同时对多个细胞类型进行阳性选择。
例如,在一些方面,t细胞的特定亚群(如对一种或多种表面标记呈阳性或高水平表达的细胞(例如,cd28+、cd62l+、ccr7+、cd27+、cd127+、cd4+、cd8+、cd45ra+和/或cd45ro+t细胞))通过阳性或阴性选择技术来分离。
例如,可以使用抗cd3/抗cd28缀合的磁珠(例如,
在一些实施方案中,通过以下方式进行分离:通过阳性选择富集特定细胞群,或通过阴性选择耗尽特定细胞群。在一些实施方案中,阳性或阴性选择通过将细胞与一种或多种抗体或其他结合剂一起孵育来完成,所述一种或多种抗体或其他结合剂与分别在阳性或阴性选择的细胞上表达(标记+)或以相对较高水平表达(标记高)的一种或多种表面标记特异性结合。
在一些实施方案中,通过阴性选择在非t细胞(如b细胞、单核细胞或其他白细胞)上表达的标记(如cd14),将t细胞与pbmc样品分离。在一些方面,使用cd4+或cd8+选择步骤分离cd4+辅助t细胞与cd8+细胞毒性t细胞。可以通过对在一种或多种幼稚、记忆和/或效应t细胞亚群上表达或以相对较高的程度表达的标记进行阳性或阴性选择,将此类cd4+和cd8+群体进一步分选为亚群。
在一些实施方案中,如通过基于与相应亚群相关的表面抗原进行阳性或阴性选择,进一步富集或耗尽cd8+细胞中的幼稚、中枢记忆、效应记忆和/或中枢记忆干细胞。在一些实施方案中,进行中枢记忆t(tcm)细胞的富集以增加功效,如以改进施用后的长期存活、扩增和/或移植物植入,这在一些方面在此类亚群中特别稳健。参见terakura等人(2012)blood.1:72-82;wang等人.(2012)jimmunother.35(9):689-701。在一些实施方案中,组合富集tcm的cd8+t细胞与cd4+t细胞进一步增强功效。
在实施方案中,记忆t细胞存在于cd8+外周血淋巴细胞的cd62l+和cd62l-两个子集中。可以例如使用抗cd8和抗cd62l抗体将pbmc针对cd62l-cd8+和/或cd62l+cd8+级分进行富集或耗尽。
在一些实施方案中,中枢记忆t(tcm)细胞的富集是基于cd45ro、cd62l、ccr7、cd28、cd3和/或cd127的阳性或高表面表达;在一些方面,其是基于表达或高表达cd45ra和/或颗粒酶b的细胞的阴性选择。在一些实施方案中,中枢记忆t(tcm)细胞的富集是基于cd45ro、cd62l、ccr7、cd28、cd3、cd27和/或cd127的阳性或高表面表达。在一些实施方案中,中枢记忆t(tcm)细胞的富集是基于cd62l、ccr7、cd28和/或cd27的阳性或高表面表达。在一些实施方案中,中枢记忆t(tcm)细胞的富集是基于ccr7、cd28和/或cd27的阳性或高表面表达。在一些实施方案中,中枢记忆t(tcm)细胞的富集是基于cd28和cd27的阳性或高表面表达。在一些方面,通过耗尽表达cd4、cd14、cd45ra的细胞以及阳性选择或富集表达cd62l的细胞来进行富集tcm细胞的cd8+群体的分离。在一些方面,通过耗尽表达cd4、cd14、cd45ra的细胞以及阳性选择或富集表达cd27和cd28的细胞来进行富集tcm细胞的cd8+群体的分离。在一方面,中枢记忆t(tcm)细胞的富集从基于cd4表达所选择的阴性细胞级分开始进行,对所述阴性细胞级分基于cd14和cd45ra的表达进行阴性选择且基于cd62l进行阳性选择。在一些方面,此类选择是同时进行的,并且在其他方面,是以任何顺序依序进行的。在一些方面,将用于制备cd8+细胞群或亚群的基于cd4表达的相同选择步骤也用于生成cd4+细胞群或亚群,使得来自基于cd4的分离的阳性和阴性级分二者都被保留并用于所述方法的后续步骤中,任选地在一个或多个其他阳性或阴性选择步骤之后。
在特定例子中,使pbmc样品或其他白细胞样品经历cd4+细胞的选择,其中保留了阴性和阳性两种级分。然后使阴性级分经历基于cd14和cd45ra或cd19的表达的阴性选择以及基于中枢记忆t细胞所特有的标记(如cd62l或ccr7)的阳性选择,其中所述阳性和阴性选择是以任何顺序来进行。
通过鉴定具有细胞表面抗原的细胞群体,将cd4+t辅助细胞分类为幼稚、中枢记忆和效应细胞。cd4+淋巴细胞可以通过标准方法获得。在一些实施方案中,幼稚cd4+t淋巴细胞是cd45ro-、cd45ra+、cd62l+、cd4+t细胞。在一些实施方案中,中枢记忆cd4+细胞是cd62l+且cd45ro+。在一些实施方案中,效应cd4+细胞是cd62l-且cd45ro-。
在一个例子中,为了通过阴性选择富集cd4+细胞,单克隆抗体混合剂通常包括针对cd14、cd20、cd11b、cd16、hla-dr和cd8的抗体。在一些实施方案中,抗体或结合配偶体与固体支持物或基质(如磁珠或顺磁珠)结合,以允许分离细胞用于阳性和/或阴性选择。例如,在一些实施方案中,使用免疫磁性(或亲和磁性)分离技术来分开或分离细胞和细胞群(综述于以下文献中:methodsinmolecularmedicine,第58卷:metastasisresearchprotocols,第2卷:cellbehaviorinvitroandinvivo,第17-25页s.a.brooks和u.schumacher编辑
在一些方面,将要分离的细胞的样品或群体与小的可磁化或磁响应材料(如磁响应颗粒或微粒,如顺磁珠(例如,如dynabeads或macs珠))一起孵育。磁响应材料(例如,颗粒)通常直接或间接地附着至结合配偶体(例如,抗体),所述结合配偶体与期望分离(例如,期望阴性或阳性选择)的一个细胞、多个细胞或细胞群上存在的分子(例如,表面标记)特异性结合。
在一些实施方案中,磁粒或磁珠包含与特异性结合成员(如抗体或其他结合配偶体)结合的磁响应材料。存在多种熟知的用于磁分离方法的磁响应材料。合适的磁性颗粒包括在molday的美国专利号4,452,773和欧洲专利说明书ep452342b中所述的那些,所述专利通过引用特此并入。胶体大小的颗粒(例如在owen的美国专利号4,795,698;和liberti等人的美国专利号5,200,084中所述的那些)是其他的例子。
通常在如下条件下进行孵育,借此附着至磁粒或磁珠的抗体或结合配偶体或者与此类抗体或结合配偶体特异性结合的分子(如二抗或其他试剂)与样品内细胞上的细胞表面分子(如果存在)特异性结合。
在一些方面,将样品置于磁场中,并且附着有磁响应或可磁化颗粒的那些细胞将被吸引到磁体并与未标记的细胞分离。对于阳性选择,保留被吸引至磁体的细胞;对于阴性选择,保留未被吸引的细胞(未标记的细胞)。在一些方面,在同一选择步骤期间进行阳性与阴性选择的组合,其中保留阳性和阴性级分并将其进一步处理或使其经历进一步分离步骤。
在某些实施方案中,将磁响应颗粒包被在一抗或其他结合配偶体、二抗、凝集素、酶或链霉亲和素中。在某些实施方案中,磁粒经由对一种或多种标记具有特异性的一抗的包被而附着至细胞。在某些实施方案中,用一抗或结合配偶体标记细胞而不是珠,然后添加细胞类型特异性二抗或其他结合配偶体(例如,链霉亲和素)包被的磁粒。在某些实施方案中,链霉亲和素包被的磁粒是与生物素化的一抗或二抗结合使用。
在一些实施方案中,磁响应颗粒保持附着至细胞,所述细胞随后被孵育、培养和/或工程化;在一些方面,颗粒保持附着至用于施用至患者的细胞。在一些实施方案中,从细胞中去除可磁化或磁响应颗粒。从细胞中去除可磁化颗粒的方法是已知的,并且包括例如使用竞争性非标记抗体和与可切割接头缀合的可磁化颗粒或抗体。在一些实施方案中,可磁化颗粒是可生物降解的。
在一些实施方案中,基于亲和力的选择是经由磁激活细胞分选(macs)(miltenyibiotec,加利福尼亚州奥本)来进行。磁激活细胞分选(macs)系统能够高纯度选择具有附着至其上的磁化颗粒的细胞。在某些实施方案中,macs以如下模式操作,其中在施加外部磁场后依序洗脱非靶种类和靶种类。也就是说,附着至磁化颗粒的细胞被保持在适当的位置,而未附着的种类被洗脱。然后,在完成这个第一洗脱步骤后,以某种方式释放被捕获在磁场中并被阻止洗脱的种类,使得它们可以被洗脱和回收。在某些实施方案中,标记非靶细胞并将其从异质性细胞群中耗尽。
在某些实施方案中,使用进行所述方法的分离、细胞制备、分开、处理、孵育、培养和/或配制步骤中的一个或多个的系统、装置或设备进行分离或分开。在一些方面,使用所述系统在封闭或无菌环境中进行这些步骤中的每一个,例如以使错误、用户操作和/或污染降至最低。在一个例子中,所述系统是如国际专利申请公开号wo2009/072003或us20110003380中所述的系统。
在一些实施方案中,所述系统或设备在集成或独立系统中和/或以自动化或可编程方式进行分离、处理、工程化和配制步骤中的一个或多个(例如,全部)。在一些方面,所述系统或设备包括与所述系统或设备通信的计算机和/或计算机程序,其允许用户对处理、分离、工程化和配制步骤的各个方面进行编程、控制、评估其结果和/或调整。
在一些方面,所述分离和/或其他步骤是使用clinimacs系统(miltenyibiotec)来进行的,例如用于在封闭且无菌的系统中以临床规模水平自动化分离细胞。部件可以包括集成微计算机、磁分离单元、蠕动泵和各种夹管阀。在一些方面,集成计算机控制仪器的全部部件并指示所述系统以标准化顺序执行重复程序。在一些方面,磁分离单元包括可移动的永磁体和用于选择柱的支架。蠕动泵控制整个管组的流速,并且与夹紧阀一起确保经过所述系统的缓冲液的受控流动和细胞的连续悬浮。
在一些方面,clinimacs系统使用在无菌、无热原溶液中供应的抗体偶联的可磁化颗粒。在一些实施方案中,在用磁粒标记细胞之后,洗涤细胞以去除过量的颗粒。然后将细胞制备袋连接到管组,所述管组又连接到含有缓冲液的袋和细胞收集袋。所述管组由预装配的无菌管(包括预柱和分离柱)组成,并且仅供一次性使用。在启动分离程序后,系统将细胞样品自动施加到分离柱上。标记的细胞保留在柱内,而未标记的细胞通过一系列洗涤步骤去除。在一些实施方案中,用于与本文所述的方法一起使用的细胞群体未被标记并且不保留在柱中。在一些实施方案中,用于与本文所述的方法一起使用的细胞群体被标记并保留在柱中。在一些实施方案中,用于与本文所述方法一起使用的细胞群体在去除磁场之后从柱中洗脱,并收集在细胞收集袋内。
在某些实施方案中,使用clinimacsprodigy系统(miltenyibiotec)进行分离和/或其他步骤。在一些方面,clinimacsprodigy系统配备有细胞处理联合体,其允许通过离心自动化洗涤和分级细胞。clinimacsprodigy系统还可以包括机载相机和图像识别软件,其通过辨识源细胞产品的宏观层来确定最佳细胞分级终点。例如,将外周血自动分离为红细胞、白细胞和血浆层。clinimacsprodigy系统还可以包括集成细胞培育室,其实现细胞培养方案,如例如细胞分化和扩增、抗原负载和长期细胞培养。输入端口可以允许无菌移除和补充培养基,并且可以使用集成显微镜监测细胞。参见例如,klebanoff等人(2012)jimmunother.35(9):651-660;terakura等人(2012)blood.1:72–82;和wang等人(2012)jimmunother.35(9):689-701。
在一些实施方案中,经由流式细胞术收集并富集(或耗尽)本文所述的细胞群体,其中流体流中携载针对多种细胞表面标记染色的细胞。在一些实施方案中,经由制备规模(facs)分选来收集并富集(或耗尽)本文所述的细胞群体。在某些实施方案中,通过使用微机电系统(mems)芯片结合基于facs的检测系统来收集和富集(或耗尽)本文所述的细胞群(参见例如,wo2010/033140,cho等人(2010)labchip10,1567-1573;和godin等人(2008)jbiophoton.1(5):355–376。在两种情况下,可以用多种标记来标记细胞,从而允许以高纯度分离明确限定的t细胞子集。
在一些实施方案中,用一种或多种可检测的标记来标记抗体或结合配偶体,以促进用于阳性和/或阴性选择的分离。例如,分离可以是基于与荧光标记的抗体的结合。在一些例子中,基于对一种或多种细胞表面标记具有特异性的抗体或其他结合配偶体的结合来分离细胞携载于流体流中,如通过荧光激活细胞分选(facs)(包括制备规模(facs))和/或微机电系统(mems)芯片,例如与流式细胞检测系统组合。此类方法允许基于多种标记同时进行阳性和阴性选择。
在一些实施方案中,制备方法包括在分离、孵育和/或工程化之前或之后冷冻(例如,低温保存)所述细胞的步骤。在一些实施方案中,所述冷冻和后续解冻步骤去除所述细胞群中的粒细胞,并且在一定程度上去除单核细胞。在一些实施方案中,例如,在洗涤步骤去除血浆和血小板之后,使所述细胞悬浮于冷冻溶液中。在一些方面,可以使用多种已知的冷冻溶液和参数中的任一种。一个例子包括使用含有20%dmso和8%人血清白蛋白(hsa)的pbs,或其他合适的细胞冷冻培养基。然后用培养基将其1:1稀释,使得dmso和hsa的最终浓度分别为10%和4%。然后通常将所述细胞以1°/分钟的速率冷冻至-80℃并储存在液氮储罐的气相中。
在一些实施方案中,在基因工程化之前或结合基因工程化孵育和/或培养所述细胞。孵育步骤可以包括培养、培育、刺激、激活和/或繁殖。孵育和/或工程化可以在培养容器中进行,所述培养容器如单元、室、孔、柱、管、管组、阀、小瓶、培养皿、袋子或用于培养或培育细胞的其他容器。在一些实施方案中,在刺激条件或刺激剂的存在下孵育所述群体或细胞。此类条件包括设计为诱导群体中细胞的增殖、扩增、激活和/或存活,模拟抗原暴露和/或引发细胞用于基因工程化(如用于引入重组抗原受体)的那些。
所述条件可以包括以下中的一种或多种:特定培养基、温度、氧含量、二氧化碳含量、时间、药剂(例如,营养素、氨基酸、抗生素、离子和/或刺激因子(如细胞因子、趋化因子、抗原、结合配偶体、融合蛋白、重组可溶受体和设计为激活细胞的任何其他药剂))。
在一些实施方案中,刺激条件或药剂包括一种或多种药剂(例如配体),其能够激活tcr复合物的细胞内信号传导结构域。在一些方面,所述药剂在t细胞中开启或启动tcr/cd3细胞内信号传导级联。此类药剂可以包括抗体,如对tcr具有特异性的那些,例如抗cd3。在一些实施方案中,刺激条件包括能够刺激共刺激受体的一种或多种药剂(例如配体),例如抗cd28。在一些实施方案中,此类药剂和/或配体可以与固体支持物(如珠)和/或一种或多种细胞因子结合。任选地,扩增方法还可以包括向培养基中(例如,以至少约0.5ng/ml的浓度)添加抗cd3和/或抗cd28抗体的步骤。在一些实施方案中,刺激剂包括il-2、il-15和/或il-7。在一些方面,il-2浓度为至少约10单位/ml。
在一些方面,根据多种技术进行孵育,如以下文献中所述的那些:美国专利号6,040,177;klebanoff等人(2012)jimmunother.35(9):651-660;terakura等人(2012)blood.1:72-82;和/或wang等人(2012)jimmunother.35(9):689-701。
在一些实施方案中,通过以下方式扩增t细胞:向培养起始群体中添加饲养细胞,如非分裂外周血单核细胞(pbmc)(例如,使得对于要扩增的初始群体中的每个t淋巴细胞,所得细胞群体含有至少约5、10、20或40个或更多个pbmc饲养细胞);并且孵育培养物(例如,持续足以扩增t细胞数量的时间)。在一些方面,非分裂饲养细胞可以包含γ辐照的pbmc饲养细胞。在一些实施方案中,用约3000至3600拉德范围内的γ射线辐照pbmc以防止细胞分裂。在一些方面,在添加t细胞群之前,将饲养细胞添加至培养基。
在一些实施方案中,刺激条件包括适合于人t淋巴细胞生长的温度,例如至少约25摄氏度,通常为至少约30摄氏度,并且通常为或为约37摄氏度。任选地,所述孵育可以还包括添加非分裂ebv转化的类淋巴母细胞(lcl)作为饲养细胞。可以用约6000至10,000拉德范围内的γ射线辐照lcl。在一些方面,lcl饲养细胞是以任何合适的量来提供,如lcl饲养细胞与初始t淋巴细胞的比率为至少约10:1。
在实施方案中,通过用抗原刺激幼稚或抗原特异性t淋巴细胞获得抗原特异性t细胞如抗原特异性cd4+和/或cd8+t细胞。例如,可以通过从感染的受试者分离t细胞并用相同的抗原在体外刺激细胞,针对巨细胞病毒抗原生成抗原特异性t细胞系或克隆。
v.组合物和配制品
在一些实施方案中,本文提供通过本文公开的任何制造过程生成的治疗组合物(例如,治疗性t细胞组合物),例如,含有工程化(表达重组受体的)t细胞的输出组合物。在一些实施方案中,本文提供治疗组合物(例如,治疗性t细胞组合物),其具有本文例如在章节iii-f中公开的任何一种或多种特征。在一些实施方案中,提供包含用重组抗原受体(例如car或tcr)工程化的细胞的细胞剂量作为组合物或配制品,如药物组合物或配制品。此类组合物可以根据所提供的方法来使用和/或与所提供的制品或组合物一起使用,如用于预防或治疗疾病、病症和障碍,或者用于检测、诊断和预后方法中。
在一些实施方案中,治疗性t细胞组合物含有表达重组受体的cd4+t细胞和表达重组受体的cd8+t细胞,其中所述组合物中至少80%的总受体+/cd8+细胞是cd57-,并且所述组合物中至少80%的总受体+/cd4+细胞是cd57-。在一些实施方案中,治疗性t细胞组合物是如下组合物:其中所述组合物中至少或至少约80%、至少或至少约85%、至少或至少约90%、至少或至少约95%、至少或至少约96%、至少或至少约97%、至少或至少约98%、至少或至少约99%、约100%或100%的细胞是cd4+t细胞和cd8+t细胞。
在一些实施方案中,治疗性t细胞组合物包括表达重组受体的cd3+t细胞,其中所述组合物中至少80%的总受体+/cd3+细胞是cd57-。在一些实施方案中,治疗性t细胞组合物是如下组合物:其中所述组合物中至少或至少约80%、至少或至少约85%、至少或至少约90%、至少或至少约95%、至少或至少约96%、至少或至少约97%、至少或至少约98%、至少或至少约99%、约100%或100%的细胞是cd3+t细胞。
在一些实施方案中,治疗性t细胞组合物含有定义比率的cd4和cd8t细胞。在一些实施方案中,所述组合物中受体+/cd4+t细胞与受体+/cd8+t细胞的比率在约1:3与约3:1之间,如是为或约1:1。
在一些实施方案中,重组受体是如章节iv.a中所述的任一种。在一些实施方案中,重组受体能够与靶蛋白结合,所述靶蛋白与疾病、障碍或病症相关,为疾病、障碍或病症所特有,和/或在疾病、障碍或病症的细胞或组织上表达。在一些实施方案中,重组受体是嵌合抗原受体(car)。
在一些实施方案中,所提供的治疗组合物中活t细胞的数量在为或约10x106个细胞与为或约200x106个细胞之间。在一些实施方案中,所提供的治疗组合物中活t细胞的数量在为或约10x106个细胞与为或约100x106个细胞之间。在一些实施方案中,所提供的治疗组合物中活t细胞的数量在为或约10x106个细胞与为或约70x106个细胞之间。在一些实施方案中,所提供的治疗组合物中活t细胞的数量在为或约10x106个细胞与为或约50x106个细胞之间。在一些实施方案中,所提供的治疗组合物中活t细胞的数量在为或约50x106个细胞与为或约200x106个细胞之间。在一些实施方案中,所提供的治疗组合物中活t细胞的数量在为或约50x106个细胞与为或约100x106个细胞之间。在一些实施方案中,所提供的治疗组合物中活t细胞的数量在为或约50x106个细胞与为或约70x106个细胞之间。在一些实施方案中,所提供的治疗组合物中活t细胞的数量在为或约70x106个细胞与为或约200x106个细胞之间。在一些实施方案中,所提供的治疗组合物中活t细胞的数量在为或约70x106个细胞与为或约100x106个细胞之间。在一些实施方案中,所提供的治疗组合物中活t细胞的数量在为或约100x106个细胞与为或约200x106个细胞之间。在一些方面,所述组合物的体积在1.0ml与10ml之间。在一些实施方案中,所述体积是为或约2ml、为或约3ml、为或约4ml、为或约5ml、为或约6ml、为或约7ml、为或约8ml、为或约9ml或者为或约10ml,或任何前述值之间的任何值。
术语“药物配制品”是指如下制剂,其呈如下形式以允许其中所含活性成分的生物学活性有效,并且其不含对会被施用所述配制品的受试者具有不可接受的毒性的另外的组分。
“药学上可接受的载体”是指药物配制品中除了活性成分之外对受试者无毒的成分。药学上可接受的载体包括但不限于缓冲液、赋形剂、稳定剂或防腐剂。
在一些方面,载体的选择部分取决于特定细胞或药剂和/或施用方法。因此,存在多种合适的配制品。例如,药物组合物可以含有防腐剂。合适的防腐剂可以包括例如对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲酸钠和苯扎氯铵。在一些方面,使用两种或更多种防腐剂的混合物。防腐剂或其混合物通常以总组合物重量的约0.0001%至约2%的量存在。载体描述于例如remington'spharmaceuticalsciences第16版,osol,a.编辑(1980)中。药学上可接受的载体在所用剂量和浓度下通常对接受者无毒,并且包括但不限于:缓冲液,如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(如十八烷基二甲基苄基氯化铵;六甲氯铵;苯扎氯铵;苄索氯铵;苯酚、丁醇或苄醇;烷基对羟基苯甲酸酯,如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,如edta;糖类,如蔗糖、甘露醇、海藻糖或山梨醇;成盐抗衡离子,如钠;金属络合物(例如锌-蛋白质络合物);和/或非离子表面活性剂,如聚乙二醇(peg)。
在一些方面,组合物中包括缓冲剂。合适的缓冲剂包括例如柠檬酸、柠檬酸钠、磷酸、磷酸钾以及各种其他酸和盐。在一些方面,使用两种或更多种缓冲剂的混合物。缓冲剂或其混合物通常以按总组合物的重量计约0.001%至约4%的量存在。用于制备可施用的药物组合物的方法是已知的。示例性方法更详细地描述于例如remington:thescienceandpracticeofpharmacy,lippincottwilliams&wilkins;第21版(2005年5月1日)中。
配制品或组合物还可以含有多于一种活性成分,所述活性成分可用于用细胞或药剂预防或治疗的特定适应症、疾病或病症,其中相应活性不会相互产生不利影响。此类活性成分以对既定目的有效的量以合适的方式组合存在。因此,在一些实施方案中,药物组合物还包含其他药物活性剂或药物,如化学治疗剂,例如天冬酰胺酶、白消安、卡铂、顺铂、道诺霉素、多柔比星、氟尿嘧啶、吉西他滨、羟基脲、甲氨蝶呤、紫杉醇、利妥昔单抗、长春碱、长春新碱等。在一些实施方案中,将药剂或细胞以盐(例如,药学上可接受的盐)的形式施用。合适的药学上可接受的酸加成盐包括源自无机酸(如盐酸、氢溴酸、磷酸、偏磷酸,硝酸和硫酸)和有机酸(如酒石酸、乙酸、柠檬酸、苹果酸、乳酸、富马酸、苯甲酸、乙醇酸、葡萄糖酸、琥珀酸和芳基磺酸,例如对甲苯磺酸)的那些盐。
在一些实施方案中,药物组合物以有效治疗或预防疾病或病症的量(如治疗有效量或预防有效量)含有药剂或细胞。在一些实施方案中,通过定期评估所治疗的受试者来监测治疗或预防功效。对于在数天或更长时间内重复施用,根据病症,重复治疗直到出现对疾病症状的所需抑制为止。然而,其他剂量方案可能有用并且可以被确定。所需剂量可以通过单次推注施用组合物、通过多次推注施用组合物或通过连续输注施用组合物来递送。
药剂或细胞可以通过任何合适的方式施用,例如,通过推注输注,通过注射,例如,静脉内或皮下注射、眼内注射、眼周注射、视网膜下注射、玻璃体内注射、经中隔注射、巩膜下注射、脉络膜内注射、前房注射、结膜下(subconjectval)注射、结膜下(subconjuntival)注射、眼球筋膜囊下(sub-tenon)注射、眼球后注射、眼球周注射或后近巩膜(posteriorjuxtascleral)递送。在一些实施方案中,它们通过肠胃外、肺内和鼻内以及(如果局部治疗需要)病灶内施用来施用。肠胃外输注包括肌肉内、静脉内、动脉内、腹膜内或皮下施用。在一些实施方案中,给定剂量是通过细胞或药剂的单次推注施用来施用。在一些实施方案中,给定剂量是通过细胞或药剂例如在不超过3天的时间段中多次推注施用来施用,或者通过细胞或药剂的连续输注施用来施用。
对于疾病的预防或治疗,适当的剂量可取决于要治疗的疾病类型、一种或多种药剂的类型、细胞或重组受体的类型、疾病的严重程度和病程、施用药剂或细胞用于预防性目的还是治疗性目的、先前疗法、受试者的临床病史和对药剂或所述细胞的反应、以及主治医师的决断。在一些实施方案中,将组合物一次性或在一系列治疗中合适地施用至受试者。
细胞或药剂可以使用标准施用技术、配制品和/或装置来施用。提供了用于储存和施用组合物的配制品和装置(如注射器和小瓶)。关于细胞,施用可以是自体的或异源的。例如,免疫反应性细胞或祖细胞可以从一名受试者获得,并将其施用至同一受试者或不同但相容的受试者。源自外周血的免疫应答细胞或其后代(例如,体内、离体或体外衍生的)可以经由局部注射施用,包括导管施用、全身注射、局部注射、静脉内注射或肠胃外施用。当施用治疗组合物(例如,含有基因修饰的免疫应答细胞或者治疗或改善神经毒性症状的药剂的药物组合物)时,通常将其配制成单位剂量可注射形式(溶液、悬浮液、乳液)。
配制品包括用于口服、静脉内、腹膜内、皮下、经肺、透皮、肌内、鼻内、经颊、舌下或栓剂施用的那些。在一些实施方案中,药剂或细胞群是肠胃外施用。如本文所用的术语“肠胃外”包括静脉内、肌内、皮下、直肠、阴道和腹膜内施用。在一些实施方案中,将药剂或细胞群通过静脉内、腹膜内或皮下注射使用外周全身递送施用至受试者。
在一些实施方案中,组合物是作为无菌液体制剂(例如,等渗水性溶液、悬浮液、乳液、分散液或粘性组合物)来提供,在一些方面可以将其缓冲至所选ph。液体制剂通常比凝胶、其他粘性组合物和固体组合物更容易制备。另外,液体组合物稍微更方便施用,特别是通过注射。另一方面,粘性组合物可以在适当的粘度范围内配制,以提供与特定组织的更长的接触时间段。液体或粘性组合物可以包含载体,所述载体可以是溶剂或分散介质,所述溶剂或分散介质含有例如水、盐水、磷酸盐缓冲盐水、多元醇(例如,甘油、丙二醇、液体聚乙二醇)及其合适的混合物。
无菌可注射溶液可以通过以下方式来制备:将药剂或细胞掺入溶剂中,如掺入与合适的载体、稀释剂或赋形剂(如无菌水、生理盐水、葡萄糖、右旋糖等)的混合物中。
用于体内施用的配制品通常是无菌的。可以例如通过经无菌滤膜过滤容易地实现无菌性。
vi.治疗方法
本文提供治疗方法,例如,包括施用任何本文所述的工程化细胞或含有工程化细胞的组合物。在一些方面,还提供将任何本文所述的工程化细胞或含有工程化细胞的组合物施用至受试者(如患有疾病或障碍的受试者)的方法。在一些方面,还提供任何本文所述的工程化细胞或含有工程化细胞的组合物用于治疗疾病或障碍的用途。在一些方面,还提供任何本文所述的工程化细胞或含有工程化细胞的组合物用于制造用以治疗疾病或障碍的药物的用途。在一些方面,还提供任何本文所述的工程化细胞或含有工程化细胞的组合物,用于治疗疾病或障碍,或者用于施用至患有疾病或障碍的受试者。
用于过继细胞疗法的细胞的施用方法是已知的,并且可以与所提供的方法和组合物结合使用。例如,过继t细胞治疗方法描述于例如以下文献中:gruenberg等人的美国专利申请公开号2003/0170238;rosenberg的美国专利号4,690,915;rosenberg(2011)natrevclinoncol.8(10):577-85。参见例如,themeli等人(2013)natbiotechnol.31(10):928-933;tsukahara等人(2013)biochembiophysrescommun438(1):84-9;davila等人(2013)plosone8(4):e61338。
在一些实施方案中,向受试者(例如,患有或怀疑患有疾病或障碍的受试者)施用具有低量或降低量的cd57+t细胞的细胞疗法。在特定实施方案中,在施用前测量细胞疗法中cd57+细胞的量或频率。在某些实施方案中,细胞疗法具有少于或少于约50%、40%、30%、25%、20%、15%、10%、5%或1%cd57+t细胞。在某些实施方案中,测量细胞疗法中cd57+细胞的量或频率,并且如果细胞疗法具有少于或少于约50%、40%、30%、25%、20%、15%、10%、5%或1%cd57+t细胞,则将所述细胞疗法施用至受试者。在一些实施方案中,细胞疗法具有少于或少于约25%cd57t细胞。在特定实施方案中,细胞疗法具有少于或少于约10%cd57t细胞。在某些实施方案中,细胞疗法具有少于或少于约阈值量的cd57+t细胞。
在特定实施方案中,向受试者(例如,患有或怀疑患有疾病或障碍的受试者)施用细胞疗法,所述细胞疗法具有低量或降低量的对cd57表达呈阳性的t细胞或者低量或降低量的与cd57表达相关的性状。在一些实施方案中,在将细胞疗法施用至受试者之前,在细胞疗法的细胞中测量与cd57表达相关的性状。在特定实施方案中,在细胞疗法中测量与cd57表达相关的性状,并且如果细胞疗法具有低于阈值的与cd57表达相关的性状,则将所述细胞疗法施用至受试者。
在特定实施方案中,阈值是预定值。在一些实施方案中,阈值是实验得到的。在一些实施方案中,阈值是在多种细胞疗法中测量的性状的平均值、中值或均值。在一些实施方案中,阈值是从多种细胞疗法(例如,参考细胞疗法)的测量实验得到的。在一些实施方案中,参考细胞疗法是t细胞的参考组合物,例如,包括表达重组受体的t细胞的t细胞组合物。在特定实施方案中,在施用至受试者之前测量t细胞(例如,表达重组受体的t细胞)的参考组合物。
在特定实施方案中,参考细胞疗法或参考t细胞组合物是包含t细胞(例如,包括表达重组受体的t细胞)的细胞疗法的组合物,所述t细胞来自继续接受所述细胞疗法用于治疗相同的疾病、障碍或病症的受试者组。在一些实施方案中,参考细胞疗法或参考t细胞组合物是施用至继续发展部分反应或疾病进展的受试者的t细胞组合物。
在一些实施方案中,与cd57表达相关的性状是总t细胞、总cd4+t细胞或总cd8+t细胞中存在的cd57多肽的水平或量。在特定实施方案中,所述性状是剂量的总t细胞、cd4+t细胞或cd8+t细胞中存在的cd57多肽的水平或量。在一些实施方案中,所述性状是总t细胞、cd4+t细胞或cd8+t细胞的表面上存在的cd57多肽的水平或量。在各种实施方案中,所述性状是cd57+t细胞、cd57+cd4+t细胞或cd57+cd8+t细胞的频率、百分比或量。在某些实施方案中,所述性状是剂量的t细胞中存在的cd57mrna的水平或量。在一些实施方案中,所述性状是编码cd57的基因(b3gat1)的可及性的水平或量。
在一些实施方案中,与cd57表达相关的性状是总cd3+t细胞中存在的cd57多肽的水平或量。在特定实施方案中,所述性状是剂量的总cd3+t细胞中存在的cd57多肽的水平或量。在一些实施方案中,所述性状是总cd3+t细胞的表面上存在的cd57多肽的水平或量。在各种实施方案中,所述性状是cd57+cd3+t细胞的频率、百分比或量。在某些实施方案中,所述性状是剂量的t细胞中存在的cd57mrna的水平或量。在一些实施方案中,所述性状是编码cd57的基因(b3gat1)的可及性的水平或量。
在特定实施方案中,所述阈值比多种参考细胞疗法或参考t细胞组合物中与cd57表达相关的性状的平均、均值或中位测量值低75%、60%、50%、40%、30%、25%、20%、15%、10%、5%、1%,低约75%、60%、50%、40%、30%、25%、20%、15%、10%、5%、1%,或低75%、60%、50%、40%、30%、25%、20%、15%、10%、5%、1%内,或者低小于1%内。所述量比所述性状的平均、均值或中位测量值小低于一个、二分之一、三分之一、四分之一、五分之一、六分之一、八分之一或十分之一的标准差。在特定实施方案中,所述阈值低于来自多个参考t细胞组合物或参考细胞疗法的组合物中与cd57表达相关的性状的最低测量值。在一些实施方案中,所述阈值比在多种参考细胞疗法或参考t细胞组合物中测量的性状的最低测量值低为或为约50%、40%、35%、30%、25%、20%、15%、10%、5%、1%内,或者低小于1%内。在某些实施方案中,阈值低于从参考t细胞组合物或参考细胞疗法中的频率计算的与cd57表达相关的性状的平均、中位或均值测量值。在一些实施方案中,所述阈值是从多种参考t细胞组合物获取的测量值的为、为约或为至少25%、33%、50%、60%、65%、70%、75%、80%、85%、90%或95%的平均、中位或均值测量值。
在特定实施方案中,在将细胞疗法施用至受试者之前,在细胞疗法中测量与cd57表达相关的性状。在一些实施方案中,使用所述测量来评估受试者不会经历完全反应的风险、概率或可能性。在某些实施方案中,使用所述测量来评估受试者在施用细胞疗法后将经历部分反应或疾病进展结果的风险、概率或可能性。在特定实施方案中,如果所述性状的值大于所述性状的阈值,则确定受试者不能在施用细胞疗法后经历完全反应的风险、可能性或概率增加。在一些实施方案中,如果所述性状的值大于所述性状的阈值,则确定受试者在施用细胞疗法后经历部分反应或疾病进展的风险、可能性或概率增加。在一些实施方案中,所述阈值是本文所述的与cd57相关的性状的任何阈值。
在一些实施方案中,被认为不能在施用细胞疗法后实现完全反应的风险增加的受试者在施用一定剂量的细胞疗法后继续实现完全反应的频率小于或小于约50%、40%、30%、25%、20%、15%、10%或小于10%。在一些实施方案中,被认为不能实现完全反应的风险增加的受试者在施用一定剂量的细胞疗法后继续实现完全反应的频率小于20%。在各种实施方案中,被认为不能实现完全反应的风险增加的受试者在施用一定剂量的细胞疗法后继续实现完全反应的频率为或为约0%。
在某些实施方案中,被认为在施用细胞疗法后实现部分反应或疾病进展结果的风险增加的受试者在施用一定剂量的细胞疗法后继续实现完全反应的频率小于或小于约50%、40%、30%、25%、20%、15%、10%或小于10%。在各种实施方案中,被认为实现部分反应或疾病进展结果的风险增加的受试者在施用一定剂量的细胞疗法后继续实现完全反应的频率小于20%。在各种实施方案中,被认为实现部分反应或疾病进展结果反应的风险增加的受试者在施用一定剂量的细胞疗法后继续实现完全反应的频率为或为约0%。
在特定实施方案中,被认为不能实现完全反应的风险增加的受试者接受增加剂量的细胞疗法,例如以提高受试者将继续实现完全反应的可能性或概率。在一些实施方案中,被认为实现部分反应或疾病进展结果的风险增加的受试者接受增加剂量的细胞疗法,例如以提高受试者将继续实现完全反应的可能性或概率。
所治疗的疾病或病症可以是任何疾病或病症,其中抗原的表达与疾病、病症或障碍的病因相关和/或参与所述病因,例如引起、加重或以其他方式参与这种疾病、病症或障碍。示例性疾病和病症可以包括与恶性肿瘤或细胞转化(例如癌症)、自身免疫性疾病或炎性疾病或例如由细菌、病毒或其他病原体引起的感染性疾病相关的疾病或病症。上文描述了示例性抗原,其包括与可以治疗的各种疾病和病症相关的抗原。在特定实施方案中,嵌合抗原受体或转基因tcr特异性结合至与所述疾病或病症相关的抗原。
疾病、病症和障碍包括肿瘤,包括实体瘤、血液恶性肿瘤和黑色素瘤,并且包括局部和转移性肿瘤;感染性疾病,如病毒或其他病原体的感染,例如hiv、hcv、hbv、cmv、hpv和寄生虫病;以及自身免疫性和炎性疾病。在一些实施方案中,疾病、障碍或病症是肿瘤、癌症、恶性肿瘤、肿疡或其他增殖性疾病或障碍。此类疾病包括但不限于白血病、淋巴瘤,例如,急性髓样(或髓性)白血病(aml)、慢性髓样(或髓性)白血病(cml)、急性淋巴细胞(或成淋巴细胞)白血病(all)、慢性淋巴细胞白血病(cll)、毛细胞白血病(hcl)、小淋巴细胞淋巴瘤(sll)、套细胞淋巴瘤(mcl)、边缘区淋巴瘤、伯基特淋巴瘤、霍奇金淋巴瘤(hl)、非霍奇金淋巴瘤(nhl)、间变性大细胞淋巴瘤(alcl)、滤泡性淋巴瘤、难治性滤泡性淋巴瘤、弥漫性大b细胞淋巴瘤(dlbcl)和多发性骨髓瘤(mm)。在一些实施方案中,疾病或病症是选自以下的b细胞恶性肿瘤:急性成淋巴细胞性白血病(all)、成人all、慢性成淋巴细胞性白血病(cll)、非霍奇金淋巴瘤(nhl)和弥漫性大b细胞淋巴瘤(dlbcl)。在一些实施方案中,疾病或病症是nhl,并且nhl选自侵袭性nhl、弥漫性大b细胞淋巴瘤(dlbcl)nos型(从头的和从惰性转化的)、原发性纵隔大b细胞淋巴瘤(pmbcl)、富含t细胞/组织细胞的大b细胞淋巴瘤(tchrbcl)、伯基特淋巴瘤、套细胞淋巴瘤(mcl)和/或滤泡性淋巴瘤(fl)(任选地3b级滤泡性淋巴瘤(fl3b))。
在一些实施方案中,疾病或病症是感染性疾病或病症,例如但不限于病毒、逆转录病毒、细菌和原生动物感染、免疫缺陷、巨细胞病毒(cmv)、eb病毒(ebv)、腺病毒、bk多瘤病毒。在一些实施方案中,疾病或病症是自身免疫性或炎性疾病或病症,如关节炎(例如类风湿性关节炎(ra))、i型糖尿病、系统性红斑狼疮(sle)、炎性肠病、银屑病、硬皮病、自身免疫性甲状腺疾病、格雷夫斯病、克罗恩病、多发性硬化症、哮喘和/或与移植相关的疾病或病症。
在一些实施方案中,与疾病或障碍相关的抗原是或包括αvβ6整合素(avb6整合素)、b细胞成熟抗原(bcma)、b7-h3、b7-h6、碳酸酐酶9(ca9,也称为caix或g250)、癌症-睾丸抗原、癌症/睾丸抗原1b(ctag,也称为ny-eso-1和lage-2)、癌胚抗原(cea)、细胞周期蛋白、细胞周期蛋白a2、c-c基序趋化因子配体1(ccl-1)、cd19、cd20、cd22、cd23、cd24、cd30、cd33、cd38、cd44、cd44v6、cd44v7/8、cd123、cd133、cd138、cd171、表皮生长因子蛋白(egfr)、截短的表皮生长因子蛋白(tegfr)、表皮生长因子受体iii型突变体(egfrviii)、上皮糖蛋白2(epg-2)、上皮糖蛋白40(epg-40)、肝配蛋白b2、肝配蛋白受体a2(epha2)、雌激素受体、fc受体样蛋白5(fcrl5;也称为fc受体同源物5或fcrh5)、胎儿乙酰胆碱受体(胎儿achr)、叶酸结合蛋白(fbp)、叶酸受体α、神经节苷脂gd2、o-乙酰化gd2(ogd2)、神经节苷脂gd3、糖蛋白100(gp100)、磷脂酰肌醇蛋白聚糖-3(gpc3)、g蛋白偶联受体5d(gpcr5d)、her2/neu(受体酪氨酸激酶erb-b2)、her3(erb-b3)、her4(erb-b4)、erbb二聚体、人高分子量黑色素瘤相关抗原(hmw-maa)、乙型肝炎表面抗原、人白细胞抗原a1(hla-a1)、人白细胞抗原a2(hla-a2)、il-22受体α(il-22rα)、il-13受体α2(il-13rα2)、激酶插入结构域受体(kdr)、κ轻链、l1细胞粘附分子(l1-cam)、l1-cam的ce7表位、含有富亮氨酸重复序列的蛋白8家族成员a(lrrc8a)、路易斯y、黑色素瘤相关抗原(mage)-a1、mage-a3、mage-a6、mage-a10、间皮素(msln)、c-met、鼠类巨细胞病毒(cmv)、粘蛋白1(muc1)、muc16、自然杀伤细胞2族成员d(nkg2d)配体、黑色素a(mart-1)、神经细胞粘附分子(ncam)、癌胚胎抗原、黑色素瘤优先表达抗原(prame)、孕酮受体、前列腺特异性抗原、前列腺干细胞抗原(psca)、前列腺特异性膜抗原(psma)、受体酪氨酸激酶样孤儿受体1(ror1)、存活蛋白、滋养层糖蛋白(tpbg,也称为5t4)、肿瘤相关糖蛋白72(tag72)、酪氨酸酶相关蛋白1(trp1,也称为tyrp1或gp75)、酪氨酸酶相关蛋白2(trp2,也称为多巴色素互变异构酶、多巴色素δ异构酶或dct)、血管内皮生长因子受体(vegfr)、血管内皮生长因子受体2(vegfr2)、肾母细胞瘤1(wt-1)、病原体特有的或病原体表达的抗原、或与通用标签相关的抗原、和/或生物素化分子、和/或由hiv、hcv、hbv或其他病原体表达的分子。在一些实施方案中,受体靶向的抗原包括与b细胞恶性肿瘤相关的抗原,如多种已知b细胞标记中的任一种。在一些实施方案中,抗原是或包括cd20、cd19、cd22、ror1、cd45、cd21、cd5、cd33、igκ、igλ、cd79a、cd79b或cd30。在一些实施方案中,抗原是或包括病原体特有的或病原体表达的抗原,如病毒抗原(例如,来自hiv、hcv、hbv的病毒抗原)、细菌抗原和/或寄生虫抗原。
在一些实施方案中,抗体或抗原结合片段(例如scfv或vh结构域)特异性识别抗原,如cd19。在一些实施方案中,抗体或抗原结合片段源自与cd19特异性结合的抗体或抗原结合片段或者是其变体。在一些实施方案中,细胞疗法(例如,过继t细胞疗法)通过自体转移进行,其中从接受细胞疗法的受试者或从源自这种受试者的样品中分离和/或以其他方式制备细胞。因此,在一些方面,细胞源自需要治疗的受试者(例如,患者),并且在分离和处理后将所述细胞施用至同一受试者。
在一些实施方案中,细胞疗法(例如,过继t细胞疗法)通过同种异体转移进行,其中从将要接受或最终接受细胞疗法的受试者以外的受试者(例如,第一受试者)分离和/或以其他方式制备细胞。在此类实施方案中,然后将细胞施用至相同物种的不同受试者,例如第二受试者。在一些实施方案中,第一和第二受试者在遗传上是相同的。在一些实施方案中,第一和第二受试者在遗传上是相似的。在一些实施方案中,第二受试者表达与第一受试者相同的hla类别或超型。
细胞可以通过任何合适的方式施用,例如通过推注输注,通过注射例如静脉内或皮下注射、眼内注射、眼周注射、视网膜下注射、玻璃体内注射、经中隔注射、巩膜下注射、脉络膜内注射、前房注射、结膜下(subconjectval)注射、结膜下(subconjuntival)注射、眼球筋膜囊下(sub-tenon)注射、眼球后注射、眼球周注射或后近巩膜(posteriorjuxtascleral)递送。在一些实施方案中,它们通过肠胃外、肺内和鼻内以及(如果局部治疗需要)病灶内施用来施用。肠胃外输注包括肌肉内、静脉内、动脉内、腹膜内或皮下施用。在一些实施方案中,给定剂量是通过细胞的单次推注施用来施用。在一些实施方案中,给定剂量通过例如在不超过3天的时间段内细胞的多次推注施用,或通过细胞的连续输注施用来施用。在一些实施方案中,细胞剂量或任何其他疗法(例如,淋巴细胞清除疗法、干预疗法和/或组合疗法)的施用是通过门诊递送进行的。
对于疾病的预防或治疗,适当的剂量可取决于要治疗的疾病类型、细胞或重组受体的类型、疾病的严重程度和病程、是针对预防目的还是针对治疗目的而施用细胞、先前治疗、受试者的临床病史和对细胞的反应以及主治医师的决断。在一些实施方案中,将组合物和细胞以合适的方式一次或经一系列治疗施用至受试者。
在一些实施方案中,将细胞作为组合治疗的一部分施用,如与另一种治疗性干预(如抗体或工程化细胞或受体或药剂(如细胞毒性剂或治疗剂))同时施用或以任何顺序依序施用。在一些实施方案中,细胞与一种或多种另外的治疗剂共施用或与另一种治疗性干预联合施用(同时或以任何顺序依序施用)。在一些情况下,将细胞与另一种疗法在时间上足够接近地共施用,使得细胞群增强一种或多种另外的治疗剂的效果,或反之亦然。在一些实施方案中,在一种或多种另外的治疗剂之前施用细胞。在一些实施方案中,在一种或多种另外的治疗剂之后施用细胞。在一些实施方案中,一种或多种另外的药剂包括细胞因子(例如il-2),例如以增强持久性。在一些实施方案中,所述方法包括施用化学治疗剂。
在一些实施方案中,所述方法包括在所述施用之前施用化学治疗剂(例如,调理性化学治疗剂),例如以减小肿瘤负荷。
在一些方面,用免疫清除(例如,淋巴细胞清除)疗法预调理受试者可以改善过继细胞疗法(act)的效果。
因此,在一些实施方案中,所述方法包括在开始所述细胞疗法之前将预调理剂施用至受试者,所述预调理剂如淋巴细胞清除剂或化学治疗剂,如环磷酰胺、氟达拉滨或其组合。例如,可以在起始细胞疗法之前至少2天(如之前至少3、4、5、6或7天),向受试者施用预调理剂。在一些实施方案中,在起始细胞疗法之前不超过7天(如之前不超过6、5、4、3或2天),向受试者施用预调理剂。
在一些实施方案中,用环磷酰胺以在或在约20mg/kg与100mg/kg之间,如在或在约40mg/kg与80mg/kg之间的剂量对受试者进行预调理。在一些方面,用或用约60mg/kg的环磷酰胺对受试者进行预调理。在一些实施方案中,可以将环磷酰胺按单一剂量施用或者可以按多个剂量施用,如每天施用、每隔一天施用或每三天施用。在一些实施方案中,每天一次施用环磷酰胺,持续一天或两天。在一些实施方案中,在淋巴细胞清除剂包含环磷酰胺的情况下,以在或在约100mg/m2与500mg/m2之间,如在或在约200mg/m2与400mg/m2之间或250mg/m2与350mg/m2之间(包含端值)的剂量向受试者施用环磷酰胺。在一些情形中,向受试者施用约300mg/m2的环磷酰胺。在一些实施方案中,可以将环磷酰胺按单一剂量施用或者可以按多个剂量施用,如每天施用、每隔一天施用或每三天施用。在一些实施方案中,每天施用环磷酰胺,如持续1-5天,例如持续3至5天。在一些情形中,在开始细胞疗法之前,每天向受试者施用约300mg/m2的环磷酰胺,持续3天。
在一些实施方案中,当淋巴细胞清除剂包含氟达拉滨时,向受试者施用剂量在或在约1mg/m2与100mg/m2之间、如在或在约10mg/m2与75mg/m2之间、15mg/m2与50mg/m2之间、20mg/m2与40mg/m2之间或24mg/m2与35mg/m2之间的氟达拉滨(包含端值)。在一些情形中,向受试者施用约30mg/m2的氟达拉滨。在一些实施方案中,氟达拉滨可以按单一剂量施用或者可以按多个剂量施用,如每天施用、每隔一天施用或每三天施用。在一些实施方案中,每天施用氟达拉滨,如持续1-5天,例如持续3至5天。在一些情形中,在开始细胞疗法之前,每天向受试者施用约30mg/m2的氟达拉滨,持续3天。
在一些实施方案中,淋巴细胞清除剂包含药剂的组合,如环磷酰胺与氟达拉滨的组合。因此,所述药剂组合可以包括任何剂量或施用时间表(如上文所述的那些)的环磷酰胺,以及任何剂量或施用时间表(如上文所述的那些)的氟达拉滨。例如,在一些方面,在第一剂量或后续剂量之前,向受试者施用60mg/kg(约2g/m2)的环磷酰胺和3至5次剂量的25mg/m2氟达拉滨。
在一些实施方案中,在施用细胞后,例如通过许多已知方法中的任一种测量工程化细胞群的生物学活性。要评估的参数包括工程化或天然t细胞或其他免疫细胞与抗原的特异性结合,其在体内例如通过成像进行评估,或离体例如通过elisa或流式细胞术进行评估。在某些实施方案中,工程化细胞破坏靶细胞的能力可以使用任何合适的已知方法来测量,所述方法例如描述于例如以下文献中的细胞毒性测定:kochenderfer等人,j.immunotherapy,32(7):689-702(2009),以及herman等人j.immunologicalmethods,285(1):25-40(2004)。在某些实施方案中,通过测定一种或多种细胞因子(如cd107a、ifnγ、il-2和tnf)的表达和/或分泌来测量细胞的生物学活性。在一些方面,生物学活性是通过评估临床结果(如肿瘤负荷或负担的减少)来测量。
在某些实施方案中,将工程化细胞以任何数量的方式进一步修饰,使得其治疗或预防功效增加。例如,可以将所述群体表达的工程化car或tcr直接或通过接头间接缀合至靶向部分。将化合物(例如,car或tcr)与靶向部分缀合的实践是已知的。参见例如,wadwa等人,j.drugtargeting3:111(1995)和美国专利5,087,616。
在一些实施方案中,将细胞作为组合治疗的一部分施用,如与另一种治疗性干预(如抗体或工程化细胞或受体或药剂(如细胞毒性剂或治疗剂))同时施用或以任何顺序依序施用。在一些实施方案中,细胞与一种或多种另外的治疗剂共施用或与另一种治疗性干预联合施用(同时或以任何顺序依序施用)。在一些情况下,将细胞与另一种疗法在时间上足够接近地共施用,使得细胞群增强一种或多种另外的治疗剂的效果,或反之亦然。在一些实施方案中,在一种或多种另外的治疗剂之前施用细胞。在一些实施方案中,在一种或多种另外的治疗剂之后施用细胞。在一些实施方案中,所述一种或多种另外的药剂包括细胞因子(如il-2)例如以增强持久性。
a.给药
在一些实施方案中,根据所提供方法和/或用所提供制品或组合物将一定剂量的细胞施用至受试者。在一些实施方案中,所述剂量的大小或时间安排是根据受试者的特定疾病或病症来确定。在一些情况下,可以根据所提供的描述凭经验确定用于特定疾病的剂量的大小或时间安排。
在一些实施方案中,细胞的所述剂量包含在2x105或约2x105个细胞/kg与2x106或约2x106个细胞/kg之间,如在4x105或约4x105个细胞/kg与1x106或约1x106个细胞/kg之间或在6x105或约6x105个细胞/kg与8x105或约8x105个细胞/kg之间。在一些实施方案中,细胞的所述剂量包含不超过2x105个细胞(例如抗原表达细胞,如car表达细胞)/公斤受试者体重(细胞/kg),如不超过或不超过约3x105个细胞/kg、不超过或不超过约4x105个细胞/kg、不超过或不超过约5x105个细胞/kg、不超过或不超过约6x105个细胞/kg、不超过或不超过约7x105个细胞/kg、不超过或不超过约8x105个细胞/kg、不超过或不超过约9x105个细胞/kg、不超过或不超过约1x106个细胞/kg、或不超过或不超过约2x106个细胞/kg。在一些实施方案中,细胞的所述剂量包含至少或至少约或为或约2x105个细胞(例如抗原表达细胞,如car表达细胞)/公斤受试者体重(细胞/kg),如至少或至少约或为或约3x105个细胞/kg、至少或至少约或为或约4x105个细胞/kg、至少或至少约或为或约5x105个细胞/kg、至少或至少约或为或约6x105个细胞/kg、至少或至少约或为或约7x105个细胞/kg、至少或至少约或为或约8x105个细胞/kg、至少或至少约或为或约9x105个细胞/kg、至少或至少约或为或约1x106个细胞/kg、或至少或至少约或为或约2x106个细胞/kg。
在某些实施方案中,细胞或细胞的亚型的单独群体是以约100万至约1000亿个细胞和/或按每公斤体重该细胞量的范围施用至受试者,如例如100万至约500亿个细胞(例如,约500万个细胞、1000万个细胞、约1500万个细胞、约2000万个细胞、约2500万个细胞、约5亿个细胞、约10亿个细胞、约50亿个细胞、约200亿个细胞、约300亿个细胞、约400亿个细胞或由任两个前述值定义的范围),如约1000万至约1000亿个细胞(例如,约2000万个细胞、约3000万个细胞、约4000万个细胞、约6000万个细胞、约7000万个细胞、约8000万个细胞、约9000万个细胞、约100亿个细胞、约250亿个细胞、约500亿个细胞、约750亿个细胞、约900亿个细胞或由任两个前述值定义的范围),并且在一些情况下约1亿个细胞至约500亿个细胞(例如,约1.2亿个细胞、约2.5亿个细胞、约3.5亿个细胞、约4.5亿个细胞、约6.5亿个细胞、约8亿个细胞、约9亿个细胞、约30亿个细胞、约300亿个细胞、约450亿个细胞)或在这些范围和/或每公斤体重的这些范围之间的任何值。剂量可以根据疾病或障碍和/或患者和/或其他治疗所特有的属性而变化。
在一些实施方案中,细胞的所述剂量是细胞的平坦剂量或细胞的固定剂量,使得细胞的所述剂量与受试者的体表面积或体重无关或不基于受试者的体表面积或体重。
在一些实施方案中,例如,在受试者是人的情况下,剂量包括少于约5x108个总重组受体(例如car)表达细胞、t细胞或外周血单核细胞(pbmc),例如在约1x106到5x108个此类细胞的范围内,如2x106、5x106、1x107、5x107、1x108或5x108个总此类细胞,或任两个前述值之间的范围。
在一些实施方案中,基因工程化细胞的剂量包含从或从约1x105至5x108个总car表达t细胞、1x105至2.5x108个总car表达t细胞、1x105至1x108个总car表达t细胞、1x105至5x107个总car表达t细胞、1x105至2.5x107个总car表达t细胞、1x105至1x107个总car表达t细胞、1x105至5x106个总car表达t细胞、1x105至2.5x106个总car表达t细胞、1x105至1x106个总car表达t细胞、1x106至5x108个总car表达t细胞、1x106至2.5x108个总car表达t细胞、1x106至1x108个总car表达t细胞、1x106至5x107个总car表达t细胞、1x106至2.5x107个总car表达t细胞、1x106至1x107个总car表达t细胞、1x106至5x106个总car表达t细胞、1x106至2.5x106个总car表达t细胞、2.5x106至5x108个总car表达t细胞、2.5x106至2.5x108个总car表达t细胞、2.5x106至1x108个总car表达t细胞、2.5x106至5x107个总car表达t细胞、2.5x106至2.5x107个总car表达t细胞、2.5x106至1x107个总car表达t细胞、2.5x106至5x106个总car表达t细胞、5x106至5x108个总car表达t细胞、5x106至2.5x108个总car表达t细胞、5x106至1x108个总car表达t细胞、5x106至5x107个总car表达t细胞、5x106至2.5x107个总car表达t细胞、5x106至1x107个总car表达t细胞、1x107至5x108个总car表达t细胞、1x107至2.5x108个总car表达t细胞、1x107至1x108个总car表达t细胞、1x107至5x107个总car表达t细胞、1x107至2.5x107个总car表达t细胞、2.5x107至5x108个总car表达t细胞、2.5x107至2.5x108个总car表达t细胞、2.5x107至1x108个总car表达t细胞、2.5x107至5x107个总car表达t细胞、5x107至5x108个总car表达t细胞、5x107至2.5x108个总car表达t细胞、5x107至1x108个总car表达t细胞、1x108至5x108个总car表达t细胞、1x108至2.5x108个总car表达t细胞或2.5x108至5x108个总car表达t细胞。
在一些实施方案中,基因工程化细胞的剂量包含至少或至少约1x105个表达car的细胞、至少或至少约2.5x105个表达car的细胞、至少或至少约5x105个表达car的细胞、至少或至少约1x106个表达car的细胞、至少或至少约2.5x106个表达car的细胞、至少或至少约5x106个表达car的细胞、至少或至少约1x107个表达car的细胞、至少或至少约2.5x107个表达car的细胞、至少或至少约5x107个表达car的细胞、至少或至少约1x108个表达car的细胞、至少或至少约2.5x108个表达car的细胞、或者至少或至少约5x108个表达car的细胞。
在一些实施方案中,细胞疗法包括施用一定剂量,所述剂量包含如下细胞数量:从或从约1x105至5x108个总重组受体表达细胞、总t细胞或总外周血单核细胞(pbmc),从或从约5x105至1x107个总重组受体表达细胞、总t细胞或总外周血单核细胞(pbmc)或者从或从约1x106至1x107个总重组受体表达细胞、总t细胞或总外周血单核细胞(pbmc),每个都包含端值。在一些实施方案中,细胞疗法包括施用一定剂量的细胞,所述剂量包含如下细胞数量:至少或至少约1x105个总重组受体表达细胞、总t细胞或总外周血单核细胞(pbmc),如至少或至少1x106、至少或至少约1x107、至少或至少约1x108个此类细胞。在一些实施方案中,所述数量是关于cd3+或cd8+的总数,在一些情况下也是关于重组受体表达(例如car+)细胞。在一些实施方案中,细胞疗法包括施用一定剂量,所述剂量包含如下细胞数量:从或从约1x105至5x108个cd3+或cd8+总t细胞或者cd3+或cd8+重组受体表达细胞、从或从约5x105至1x107个cd3+或cd8+总t细胞或者cd3+或cd8+重组受体表达细胞或者从或从约1x106至1x107个cd3+或cd8+总t细胞或者cd3+或cd8+重组受体表达细胞,每个都包含端值。在一些实施方案中,细胞疗法包括施用一定剂量,所述剂量包含如下细胞数量:从或从约1x105至5x108个总cd3+/car+或cd8+/car+细胞、从或从约5x105至1x107个总cd3+/car+或cd8+/car+细胞、或从或从约1x106至1x107个总cd3+/car+或cd8+/car+细胞,每个都包含端值。
在一些实施方案中,所述剂量的t细胞包括cd4+t细胞、cd8+t细胞或cd4+和cd8+t细胞。
在一些实施方案中,例如,如果受试者是人,那么所述剂量(包括在包括cd4+和cd8+t细胞的剂量中)的cd8+t细胞包括在约1x106与5x108个之间的总重组受体(例如car)表达cd8+细胞,例如,在约5x106至1x108个此类细胞的范围内,例如1x107、2.5x107、5x107、7.5x107、1x108或5x108个总此类细胞,或在任两个前述值之间的范围。在一些实施方案中,向患者施用多个剂量,并且每个剂量或总剂量可以在任何前述值内。在一些实施方案中,细胞剂量包括施用从或从约1x107至0.75x108个总重组受体表达cd8+t细胞、1x107至2.5x107个总重组受体表达cd8+t细胞、从或从约1x107至0.75x108个总重组受体表达cd8+t细胞,每个都包含端值。在一些实施方案中,细胞剂量包括施用为或约1x107、2.5x107、5x107、7.5x107、1x108或5x108个总重组受体表达cd8+t细胞。
在一些实施方案中,细胞(例如,重组受体表达t细胞)的所述剂量是作为单一剂量施用至受试者,或者在两周、一个月、三个月、六个月、1年或更长的时间段内仅施用一次。
在过继细胞疗法的情况下,施用给定“剂量”涵盖施用作为单一组合物和/或单次不间断施用(例如,作为单次注射或连续输注)的给定量或数量的细胞,并且还涵盖在指定时间段中(如在不超过3天中)施用在多种单独组合物或输注中提供的作为分割剂量或作为多种组合物的给定量或数量的细胞。因此,在一些情况下,所述剂量是在单一时间点给予或起始的指定数量的细胞的单次或连续施用。然而,在一些情况下,所述剂量是在不超过三天的时间段内以多次注射或输注来施用,如每天一次持续三天或持续两天,或者在单日时间段内多次输注。
因此,在一些方面,所述剂量的细胞以单一药物组合物施用。在一些实施方案中,所述剂量的细胞以共同含有所述剂量的细胞的多个组合物施用。
在一些实施方案中,术语“分割剂量”是指被分割从而可在超过一天中施用的剂量。这种类型的给药包括在本发明方法中并且被认为是单一剂量。
因此,所述细胞剂量可以作为分割剂量施用,例如随时间施用的分割剂量。例如,在一些实施方案中,所述剂量可以在2天或3天内施用至受试者。用于分割给药的示例性方法包括在第一天施用25%的剂量并在第二天施用剩余的75%的剂量。在其他实施方案中,可以在第一天施用33%的剂量,并且在第二天施用剩余的67%。在一些方面,在第一天施用10%的剂量,在第二天施用30%的剂量,并且在第三天施用60%的剂量。在一些实施方案中,所述分割剂量的分布不超过3天。
在一些实施方案中,所述剂量的细胞可以通过施用多种组合物或溶液(如第一和第二,任选地更多)来施用,每种组合物或溶液含有所述剂量的一些细胞。在一些方面,任选地在某一时间段内,分开地或独立地施用各自含有不同细胞群和/或细胞亚型的多个组合物。例如,细胞群体或细胞亚型可以分别包括cd8+和cd4+t细胞,和/或分别包含富集cd8+和cd4+的群体,例如cd4+和/或cd8+t细胞,其各自单独地包括基因工程化以表达重组受体的细胞。在一些实施方案中,所述剂量的施用包括施用第一组合物,其包含cd8+t细胞的剂量或cd4+t细胞的剂量;以及施用第二组合物,其包含cd4+t细胞和cd8+t细胞的剂量中的另一者。
在一些实施方案中,所述组合物或剂量的施用(例如,所述多种细胞组合物的施用)涉及分开施用所述细胞组合物。在一些方面,分开施用是同时或以任何顺序依次进行。在一些实施方案中,所述剂量包含第一组合物和第二组合物,并且所述第一组合物和第二组合物的施用相隔0至12小时,相隔0至6小时或相隔0至2小时。在一些实施方案中,第一组合物的施用的起始与第二组合物的施用的起始是相隔不超过2小时、不超过1小时或不超过30分钟,相隔不超过15分钟、不超过10分钟或不超过5分钟进行。在一些实施方案中,第一组合物的施用的起始和/或完成与第二组合物的施用的完成和/或起始是相隔不超过2小时、不超过1小时或不超过30分钟,相隔不超过15分钟、不超过10分钟或不超过5分钟进行。
在一些组合物中,第一组合物(例如,所述剂量的第一组合物)包含cd4+t细胞。在一些组合物中,第一组合物(例如,所述剂量的第一组合物)包含cd8+t细胞。在一些实施方案中,第一组合物是在第二组合物之前施用。
在一些实施方案中,细胞的剂量或组合物包括限定或目标比率的表达重组受体的cd4+细胞与表达重组受体的cd8+细胞和/或cd4+细胞与cd8+细胞,所述比率任选地为大约1:1,或者在大约1:3与大约3:1之间,如大约1:1。在一些方面,具有目标或所需比率的不同细胞群(例如cd4+:cd8+比率或car+cd4+:car+cd8+比率,例如1:1)的组合物或剂量的施用涉及施用含有一种群体的细胞组合物,和随后施用包含另一种群体的单独细胞组合物,其中所述施用为或大约为目标或所需比率。在一些方面,定义比率的细胞的剂量或组合物的施用导致改善t细胞疗法的扩增、持久性和/或抗肿瘤活性。
在一些实施方案中,受试者接受细胞的多个剂量,例如两个或更多个剂量或多个连续剂量。在一些实施方案中,向受试者施用两个剂量。在一些实施方案中,受试者接受连续剂量,例如,第二剂量是在第一剂量后大约4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天或21天施用。在一些实施方案中,在第一剂量后施用多个连续剂量,使得在施用所述连续剂量后施用另外一个或多个剂量。在一些方面,以另外的剂量施用至受试者的细胞数量与第一剂量和/或连续剂量相同或相似。在一些实施方案中,一个或多个另外的剂量大于先前剂量。
在一些方面,第一和/或连续剂量的大小基于一个或多个标准来确定,如受试者对先前治疗(例如化学疗法)的反应、受试者的疾病负荷(如肿瘤负担、体积、大小或程度)、转移的范围或类型、分期和/或受试者发生毒性结果(例如crs、巨噬细胞激活综合征、肿瘤溶解综合征、神经毒性和/或针对所施用的细胞和/或重组受体的宿主免疫应答)的可能性或发生率。
在一些方面,第一剂量的施用与连续剂量的施用之间的时间为约9至约35天、约14至约28天或15至27天。在一些实施方案中,施用连续剂量是在施用第一剂量后大于约14天且在施用第一剂量后小于约28天的某个时间点进行。在一些方面,第一剂量与连续剂量之间的时间为约21天。在一些实施方案中,在施用连续剂量后施用另外一个或多个剂量(例如连续剂量)。在一些方面,在施用先前剂量后至少约14天且小于约28天施用另外一个或多个连续剂量。在一些实施方案中,在先前剂量后小于约14天(例如,在先前剂量后4、5、6、7、8、9、10、11、12或13天)施用另外的剂量。在一些实施方案中,在先前剂量后小于约14天不施用剂量,和/或在先前剂量后超过约28天不施用剂量。
在一些实施方案中,细胞(例如,重组受体表达细胞)的所述剂量包含两个剂量(例如,双剂量),包含t细胞的第一剂量和t细胞的连续剂量,其中第一剂量和第二剂量中之一或两者包括施用t细胞的分割剂量。
在一些实施方案中,所述剂量的细胞通常足够大以有效减轻疾病负荷。
在一些实施方案中,将所述细胞以所需剂量施用,所述所需剂量在一些方面包括细胞或一种或多种细胞类型的所需剂量或数量和/或细胞类型的所需比率。因此,在一些实施方案中,细胞的剂量是基于细胞总数(或每kg体重的数量)和单独群体或亚型的所需比率,如cd4+与cd8+的比率。在一些实施方案中,细胞的所述剂量是基于单独群体中的细胞或单独细胞类型的所需总数(或每kg体重的数量)。在一些实施方案中,所述剂量是基于此类特征的组合,如总细胞的所需数量、所需比率和单独群体中细胞的所需总数量。
在一些实施方案中,以总细胞的所需剂量(如t细胞的所需剂量)的容忍差异或在所述容忍差异内施用细胞的群体或亚型(如cd8+和cd4+t细胞)。在一些方面,所需剂量是所需细胞数量或被施用细胞的受试者的每单位体重的所需细胞数量,例如细胞/kg。在一些方面,所需剂量等于或高于最小细胞数量或每单位体重的最小细胞数量。在一些方面,在以所需剂量施用的总细胞中,单独群体或亚型以等于或接近所需输出比率(如cd4+与cd8+的比率)存在,例如在这种比率的一定容忍差异或误差内。
在一些实施方案中,细胞以所需剂量的一种或多种单独细胞群或亚型(如所需剂量的cd4+细胞和/或所需剂量的cd8+细胞)的容忍差异或在所述容忍差异之内施用。在一些方面,所需剂量是亚型或群体的细胞的所需数量,或被施用所述细胞的受试者的每单位体重的此类细胞的所需数量,例如细胞/kg。在一些方面,所需剂量等于或高于群体或亚型的最小细胞数量或每单位体重的所述群体或亚型的最小细胞数量。
因此,在一些实施方案中,所述剂量是基于所需的总细胞的固定剂量和所需比率,和/或基于所需的一种或多种单独亚型或亚群(例如,各自)的固定剂量。因此,在一些实施方案中,所述剂量是基于t细胞的所需固定或最小剂量和cd4+与cd8+细胞的所需比率,和/或是基于cd4+和/或cd8+细胞的所需固定或最小剂量。
在一些实施方案中,所述细胞以多种细胞群或亚型(如cd4+和cd8+细胞或亚型)的所需输出比率的容忍范围或在所述容忍范围内施用。在一些方面,所需比率可以是特定比率或可以是一系列比率。例如,在一些实施方案中,所需比率(例如,cd4+与cd8+细胞的比率)是在为或约1:5与为或约5:1之间(或大于约1:5且小于约5:1)、或在为或约1:3与为或约3:1之间(或大于约1:3且小于约3:1),如在为或约2:1与为或约1:5之间(或大于约1:5且小于约2:1,如为或约5:1、4.5:1、4:1、3.5:1、3:1、2.5:1、2:1、1.9:1、1.8:1、1.7:1、1.6:1、1.5:1、1.4:1、1.3:1、1.2:1、1.1:1、1:1、1:1.1、1:1.2、1:1.3、1:1.4、1:1.5、1:1.6、1:1.7、1:1.8、1:1.9、1:2、1:2.5、1:3、1:3.5、1:4、1:4.5或1:5。在一些方面,容忍差异在所需比率的约1%、约2%、约3%、约4%、约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%内,包括这些范围之间的任何值。
在特定实施方案中,细胞的数量和/或浓度是指重组受体(例如,car)表达细胞的数量。在其他实施方案中,细胞的数量和/或浓度是指施用的所有细胞、t细胞或外周血单核细胞(pbmc)的数量或浓度。
在一些方面,剂量的大小基于一个或多个标准来确定,如受试者对先前治疗(例如化学疗法)的反应、受试者的疾病负荷(如肿瘤负担、体积、尺寸或程度)、转移的程度或类型、分期和/或受试者发生毒性结果(例如,crs、巨噬细胞激活综合征、肿瘤溶解综合征、神经毒性和/或针对所施用的细胞和/或重组受体的宿主免疫应答)的可能性或发生率。
在一些实施方案中,所述方法还包括施用一个或多个另外的剂量的表达嵌合抗原受体(car)的细胞和/或淋巴细胞清除疗法,和/或重复所述方法的一个或多个步骤。在一些实施方案中,一个或多个另外的剂量与初始剂量相同。在一些实施方案中,一个或多个另外的剂量不同于初始剂量,例如更高,如是初始剂量的2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍高或更高;或者更低,如是初始剂量的2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍低或更低。在一些实施方案中,基于以下确定一个或多个另外的剂量的施用:受试者对初试治疗或任何先前治疗的反应、受试者的疾病负荷(如肿瘤负担、体积、尺寸或程度)、转移的程度或类型、分期和/或受试者发生毒性结果(例如,crs、巨噬细胞激活综合征、肿瘤溶解综合征、神经毒性和/或针对所施用的细胞和/或重组受体的宿主免疫应答)的可能性或发生率。
vii.组合物和配制品
在一些实施方案中,提供包含用重组抗原受体(例如,car或tcr)工程化的细胞的细胞剂量作为组合物或配制品,如药物组合物或配制品。此类组合物可以根据所提供的方法来使用和/或与所提供的制品或组合物一起使用,如用于预防或治疗疾病、病症和障碍,或者用于检测、诊断和预后方法中。
术语“药物配制品”是指如下制剂,其呈如下形式以允许其中所含活性成分的生物学活性有效,并且其不含对会被施用所述配制品的受试者具有不可接受的毒性的另外的组分。
“药学上可接受的载体”是指药物配制品中除了活性成分之外对受试者无毒的成分。药学上可接受的载体包括但不限于缓冲液、赋形剂、稳定剂或防腐剂。
在一些方面,载体的选择部分取决于特定细胞或药剂和/或施用方法。因此,存在多种合适的配制品。例如,药物组合物可以含有防腐剂。合适的防腐剂可以包括例如对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲酸钠和苯扎氯铵。在一些方面,使用两种或更多种防腐剂的混合物。防腐剂或其混合物通常以总组合物重量的约0.0001%至约2%的量存在。载体描述于例如remington'spharmaceuticalsciences第16版,osol,a.编辑(1980)中。药学上可接受的载体在所用剂量和浓度下通常对接受者无毒,并且包括但不限于:缓冲液,如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(如十八烷基二甲基苄基氯化铵;六甲氯铵;苯扎氯铵;苄索氯铵;苯酚、丁醇或苄醇;烷基对羟基苯甲酸酯,如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,如edta;糖类,如蔗糖、甘露醇、海藻糖或山梨醇;成盐抗衡离子,如钠;金属络合物(例如锌-蛋白质络合物);和/或非离子表面活性剂,如聚乙二醇(peg)。
在一些方面,组合物中包括缓冲剂。合适的缓冲剂包括例如柠檬酸、柠檬酸钠、磷酸、磷酸钾以及各种其他酸和盐。在一些方面,使用两种或更多种缓冲剂的混合物。缓冲剂或其混合物通常以按总组合物的重量计约0.001%至约4%的量存在。用于制备可施用的药物组合物的方法是已知的。示例性方法更详细地描述于例如remington:thescienceandpracticeofpharmacy,lippincottwilliams&wilkins;第21版(2005年5月1日)中。
配制品或组合物还可以含有多于一种活性成分,所述活性成分可用于用细胞或药剂预防或治疗的特定适应症、疾病或病症,其中相应活性不会相互产生不利影响。此类活性成分以对既定目的有效的量以合适的方式组合存在。因此,在一些实施方案中,药物组合物还包含其他药物活性剂或药物,如化学治疗剂,例如天冬酰胺酶、白消安、卡铂、顺铂、道诺霉素、多柔比星、氟尿嘧啶、吉西他滨、羟基脲、甲氨蝶呤、紫杉醇、利妥昔单抗、长春碱、长春新碱等。在一些实施方案中,将药剂或细胞以盐(例如,药学上可接受的盐)的形式施用。合适的药学上可接受的酸加成盐包括源自无机酸(如盐酸、氢溴酸、磷酸、偏磷酸,硝酸和硫酸)和有机酸(如酒石酸、乙酸、柠檬酸、苹果酸、乳酸、富马酸、苯甲酸、乙醇酸、葡萄糖酸、琥珀酸和芳基磺酸,例如对甲苯磺酸)的那些盐。
在一些实施方案中,药物组合物以有效治疗或预防疾病或病症的量(如治疗有效量或预防有效量)含有药剂或细胞。在一些实施方案中,通过定期评估所治疗的受试者来监测治疗或预防功效。对于在数天或更长时间内重复施用,根据病症,重复治疗直到出现对疾病症状的所需抑制为止。然而,其他剂量方案可能有用并且可以被确定。所需剂量可以通过单次推注施用组合物、通过多次推注施用组合物或通过连续输注施用组合物来递送。
药剂或细胞可以通过任何合适的方式施用,例如,通过推注输注,通过注射,例如,静脉内或皮下注射、眼内注射、眼周注射、视网膜下注射、玻璃体内注射、经中隔注射、巩膜下注射、脉络膜内注射、前房注射、结膜下(subconjectval)注射、结膜下(subconjuntival)注射、眼球筋膜囊下(sub-tenon)注射、眼球后注射、眼球周注射或后近巩膜(posteriorjuxtascleral)递送。在一些实施方案中,它们通过肠胃外、肺内和鼻内以及(如果局部治疗需要)病灶内施用来施用。肠胃外输注包括肌肉内、静脉内、动脉内、腹膜内或皮下施用。在一些实施方案中,给定剂量是通过细胞或药剂的单次推注施用来施用。在一些实施方案中,给定剂量是通过细胞或药剂例如在不超过3天的时间段中多次推注施用来施用,或者通过细胞或药剂的连续输注施用来施用。
对于疾病的预防或治疗,适当的剂量可取决于要治疗的疾病类型、一种或多种药剂的类型、细胞或重组受体的类型、疾病的严重程度和病程、施用药剂或细胞用于预防性目的还是治疗性目的、先前疗法、受试者的临床病史和对药剂或所述细胞的反应、以及主治医师的决断。在一些实施方案中,将组合物一次性或在一系列治疗中合适地施用至受试者。
细胞或药剂可以使用标准施用技术、配制品和/或装置来施用。提供了用于储存和施用组合物的配制品和装置(如注射器和小瓶)。关于细胞,施用可以是自体的或异源的。例如,免疫反应性细胞或祖细胞可以从一名受试者获得,并将其施用至同一受试者或不同但相容的受试者。源自外周血的免疫应答细胞或其后代(例如,体内、离体或体外衍生的)可以经由局部注射施用,包括导管施用、全身注射、局部注射、静脉内注射或肠胃外施用。当施用治疗组合物(例如,含有基因修饰的免疫应答细胞或者治疗或改善神经毒性症状的药剂的药物组合物)时,通常将其配制成单位剂量可注射形式(溶液、悬浮液、乳液)。
配制品包括用于口服、静脉内、腹膜内、皮下、经肺、透皮、肌内、鼻内、经颊、舌下或栓剂施用的那些。在一些实施方案中,药剂或细胞群是肠胃外施用。如本文所用的术语“肠胃外”包括静脉内、肌内、皮下、直肠、阴道和腹膜内施用。在一些实施方案中,将药剂或细胞群通过静脉内、腹膜内或皮下注射使用外周全身递送施用至受试者。
在一些实施方案中,组合物是作为无菌液体制剂(例如,等渗水性溶液、悬浮液、乳液、分散液或粘性组合物)来提供,在一些方面可以将其缓冲至所选ph。液体制剂通常比凝胶、其他粘性组合物和固体组合物更容易制备。另外,液体组合物稍微更方便施用,特别是通过注射。另一方面,粘性组合物可以在适当的粘度范围内配制,以提供与特定组织的更长的接触时间段。液体或粘性组合物可以包含载体,所述载体可以是溶剂或分散介质,所述溶剂或分散介质含有例如水、盐水、磷酸盐缓冲盐水、多元醇(例如,甘油、丙二醇、液体聚乙二醇)及其合适的混合物。
无菌可注射溶液可以通过以下方式来制备:将药剂或细胞掺入溶剂中,如掺入与合适的载体、稀释剂或赋形剂(如无菌水、生理盐水、葡萄糖、右旋糖等)的混合物中。
用于体内施用的配制品通常是无菌的。可以例如通过经无菌滤膜过滤容易地实现无菌性。
viii.制品和试剂盒
还提供用于进行所提供的方法的制品、系统、设备和试剂盒。还提供制品,其包括(i)对cd57、cd4和/或cd8具有特异性的用于细胞的基于免疫亲和力的选择的一种或多种试剂;以及(ii)所述一种或多种试剂用于进行本文所述的任何方法的使用说明。
还提供制品,其包括:(i)对cd57、cd4和/或cd8具有特异性的用于细胞的基于免疫亲和力的选择的一种或多种试剂;(ii)能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域的一种或多种刺激试剂;以及(iii)所述一种或多种试剂用于进行本文所述的任何方法的使用说明。
在一些任何此类实施方案中,用于基于免疫亲和力的选择的所述试剂是或包括能够与cd57、cd4或cd8特异性结合的抗体。在一些任何此类实施方案中,用于基于免疫亲和力的选择的所述试剂是或包括能够与cd57特异性结合的抗体。在一些任何此类实施方案中,将所述抗体固定在磁粒上或者固定在亲和色谱基质上或附着至亲和色谱基质。
在一些任何此类实施方案中,所述刺激试剂包括(i)一级药剂,所述一级药剂与tcr复合物的成员特异性结合,任选地与cd3特异性结合,以及(ii)二级药剂,所述二级药剂与t细胞共刺激分子特异性结合,任选地其中所述共刺激分子选自cd28、cd137(4-1-bb)、ox40或icos。在一些任何此类实施方案中,所述一级和二级药剂中的一种或两种包括抗体或其抗原结合片段。在一些任何此类实施方案中,所述一级和二级药剂包括抗体,任选地其中所述刺激试剂包括与抗cd3抗体和抗cd28抗体或其抗原结合片段一起孵育。在一些任何此类实施方案中,所述一级药剂和二级药剂存在于或附着在固体支持物的表面上。在一些任何此类实施方案中,所述固体支持物是或包括珠,任选地顺磁珠。在一些任何此类实施方案中,所述一级药剂和二级药剂可逆地结合在包括多个链霉亲和素或链霉亲和素突变蛋白分子的寡聚颗粒试剂的表面上。
还提供制品,其包括(i)本文所述的任何组合物;以及(ii)用于将所述组合物施用至受试者的说明书。
在一些实施方案中,制品或试剂盒包括一个或多个容器(通常是多个容器)、包装材料以及位于一个或多个容器和/或包装上或与其相连的标签或包装说明书,所述标签或包装说明书通常包括使用说明,例如,试剂用于特定细胞的基于免疫亲和力的选择(例如,表达cd57、cd4和/或cd8的细胞的阳性或阴性选择)的说明,以及进行本文提供的任何方法如用于工程化t细胞以生成用于细胞疗法的组合物(如治疗组合物)的说明。在一些方面,所提供的制品含有用于例如在制造过程的一个或多个步骤中刺激和/或培育细胞的试剂,如在章节ii和章节iii的任何步骤中所述的任何试剂。
还提供制品和试剂盒,其含有表达重组受体的工程化细胞或其组合物,如使用本文提供的方法生成的那些,以及任选地使用说明,例如,施用说明。在一些实施方案中,所述说明书为评估受试者在接受细胞疗法之前是否可能或被怀疑可能反应和/或在施用用于治疗疾病或障碍的表达重组受体的工程化细胞后的反应程度或水平提供指导或指定方法。在一些方面,所述制品可以含有工程化细胞的剂量或组合物。
本文提供的制品含有包装材料。用于包装所提供材料的包装材料是本领域技术人员所熟知的。参见例如,美国专利号5,323,907、5,052,558和5,033,252,其各自以其整体并入本文。包装材料的例子包括但不限于泡罩包装、瓶子、管、吸入器、泵、袋子、小瓶、容器、注射器、一次性实验室用品(例如,移液管尖端和/或塑料板)或瓶子。制品或试剂盒可以包括装置,以便有助于分配材料或有助于以高通量或大规模方式使用,例如以有助于在机器人设备中使用。通常,包装不与其中所含的组合物反应。
在一些实施方案中,试剂和/或细胞组合物是分开包装的。在一些实施方案中,每个容器可以具有单一区室。在一些实施方案中,制品或试剂盒的其他组分是分开包装的,或者一起包装于单一区室中。
ix.定义
除非另有定义,否则本文使用的所有技术术语、符号和其他技术和科学术语或用辞旨在具有与所要求保护的主题所属领域的普通技术人员通常理解的含义相同的含义。在一些情况下,为了清楚和/或为了便于引用而在本文中定义具有通常理解的含义的术语,并且本文中包含此类定义不应一定被解释为代表与本领域通常所理解的含义有实质性差异。
除非上下文另有明确规定,否则如本文所用,单数形式“一个/一种(a)”、“一个/一种(an)”和“所述(the)”包括复数指代物。例如,“一个/一种(a)”或“一个/一种(an)”意指“至少一个/至少一种”或“一个或多个/一种或多种”。应理解,本文描述的方面和变化包括“由方面和变化组成”和/或“基本上由方面和变化组成”。
在整个本公开文本中,要求保护的主题的各个方面以范围形式呈现。应理解,以范围形式描述仅仅是为了方便和简洁,并且不应被解释为对所要求保护的主题的范围的僵硬限制。因此,应当将范围的描述视为已明确公开该范围内所有可能的子范围以及单独数值。例如,在提供值的范围的情况下,应理解,在该范围的上限和下限之间的每个中间值以及在所陈述范围内的任何其他所述值或中间值都涵盖在所要求保护的主题内。这些较小范围的上限和下限可以独立地包括在所述较小范围内,并且也涵盖在所要求保护的主题内,受制于所陈述范围内任何明确排除的限值。在所陈述范围包括所述限值中的之一或两者的情况下,排除那些所包括限值中的任何一个或两个的范围也被包括在所要求保护的主题内。无论范围的宽度为多少,此均适用。
如本文所用术语“约”是指容易知道的相应值的通常误差范围。本文提及“约”某一值或参数时包括(并描述)涉及该值或参数本身的实施方案。例如,提及“约x”的描述包括“x”的描述。在某些实施方案中,“约x”是指x的±25%、±10%、±5%、±2%、±1%、±0.1%或±0.01%的值。
如本文所用,叙述核苷酸或氨基酸位置“对应于”所公开序列中的核苷酸或氨基酸位置(例如序列表中所述)是指,在使用标准比对算法(例如gap算法)与所公开序列比对以使同一性最大化之后,所鉴定的核苷酸或氨基酸位置。通过比对序列,可以例如使用保守且相同的氨基酸残基作为指导来鉴定相应残基。通常,为了鉴定对应位置,比对氨基酸序列使得获得最高阶匹配(参见例如:computationalmolecularbiology,lesk,a.m.编辑,oxforduniversitypress,纽约,1988;biocomputing:informaticsandgenomeprojects,smith,d.w.编辑,academicpress,纽约,1993;computeranalysisofsequencedata,parti,griffin,a.m.和griffin,h.g.编辑,humanapress,新泽西州,1994;sequenceanalysisinmolecularbiology,vonheinje,g.,academicpress,1987;和sequenceanalysisprimer,gribskov,m.和devereux,j.编辑,mstocktonpress,纽约,1991;carrillo等人(1988)siamjappliedmath48:1073)。
如本文所用,术语“载体”是指能够传播与其连接的另一核酸的核酸分子。所述术语包括作为自我复制核酸结构的载体以及掺入已引入其的宿主细胞的基因组中的载体。某些载体能够引导与它们操作性地连接的核酸的表达。此类载体在本文中称为“表达载体”。所述载体包括病毒载体,如逆转录病毒(例如,γ逆转录病毒)和慢病毒载体。
术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可互换使用,并且是指已引入外源核酸的细胞,包括此类细胞的后代。宿主细胞包括“转化体”和“转化细胞”,其包括原代转化细胞和源自其的后代,不考虑传代次数。后代在核酸含量上可能与亲代细胞不完全相同,但可能含有突变。本文包括如在初始转化细胞中所筛选或选择的具有相同功能或生物学活性的突变体后代。
如本文所用,细胞或细胞群针对特定标记呈“阳性”的陈述是指,特定标记(通常是表面标记)在细胞上或细胞中的可检测存在。当提及表面标记时,所述术语是指如通过流式细胞术检测到的,表面表达的存在,例如通过用与所述标记特异性地结合的抗体进行染色并检测所述抗体,其中所述染色通过流式细胞术以如下水平是可检测的,所述水平基本上高于在其他方面相同的条件下用同种型匹配对照进行相同程序检测到的染色,和/或所述水平与已知对所述标记呈阳性的细胞的水平基本上相似,和/或所述水平基本上高于已知对所述标记呈阴性的细胞的水平。
如本文所用,细胞或细胞群对特定标记呈“阴性”的陈述是指,特定标记(通常是表面标记)在细胞上或细胞中不存在基本上可检测的存在。当提及表面标记时,所述术语是指如通过流式细胞术所检测的表面表达的不存在,例如通过用与所述标记特异性结合的抗体进行染色并检测所述抗体,其中所述染色在如下水平下通过流式细胞术没有被检测到,所述水平基本上高于在其他方面相同的条件下用同种型匹配对照进行相同程序检测到的染色,和/或所述水平基本上低于已知对所述标记呈阳性的细胞的水平,和/或所述水平与已知对所述标记呈阴性的细胞的水平相比基本上相似。
如本文所用,在关于氨基酸序列(参考多肽序列)使用时,“氨基酸序列同一性百分比(%)”和“同一性百分比”定义为,在比对序列并在必要时引入空位以实现最大序列同一性百分比之后,并且不将任何保守取代视作序列同一性的一部分的情况下,候选序列(例如,主题抗体或片段)中与参考多肽序列中的氨基酸残基相同的氨基酸残基的百分比。用于确定氨基酸序列同一性百分比的目的的比对可以以各种已知方式来实现,例如使用公众可获得的计算机软件,如blast、blast-2、align或megalign(dnastar)软件。可以确定用于比对序列的适当参数,包括在所比较的序列的全长上实现最大比对所需的任何算法。
氨基酸取代可以包括用一个氨基酸替代多肽中的另一个氨基酸。取代可以是保守氨基酸取代或非保守氨基酸取代。可以将氨基酸取代引入目的结合分子(例如,抗体)和针对所需活性(例如保留/改善的抗原结合、降低的免疫原性或改善的adcc或cdc)筛选的产物中。
通常可以根据以下常见的侧链特性将氨基酸进行分组:
(1)疏水性:正亮氨酸、met、ala、val、leu、ile;
(2)中性亲水性:cys、ser、thr、asn、gln;
(3)酸性:asp、glu;
(4)碱性:his、lys、arg;
(5)影响链取向的残基:gly、pro;
(6)芳香族:trp、tyr、phe。
在一些实施方案中,保守取代可能包括将这些类别之一的成员交换为同一类别的另一个成员。在一些实施方案中,非保守氨基酸取代可能涉及将这些类别之一的成员交换为另一个类别。
如本文所用,组合物是指两种或更多种产物、物质或化合物(包括细胞)的任何混合物。它可以是溶液、悬浮液、液体、粉末、糊剂、水性、非水性或其任何组合。
如本文所用,“受试者”是哺乳动物,如人或其他动物,并且通常是人。
x.示例性实施方案
所提供的实施方案包括:
1.一种富集t细胞的方法,所述方法包括:(a)进行第一选择,所述第一选择包括从含有包含原代人t细胞的单采术产物或白细胞单采术产物的生物样品富集cd57-或cd3+t细胞,从而生成富集的t细胞群;以及(b)对来自所述富集的t细胞群的细胞进行第二选择,其中:所述第一选择包括从所述富集的群体富集cd57-t细胞并且所述第二选择包括富集cd3+t细胞;或者所述第一选择包括从所述富集的t细胞群富集cd3+t细胞并且所述第二选择包括去除cd57+t细胞,其中所述方法生成耗尽的群体,所述耗尽的群体包含的cd57+t细胞少于所述生物样品并且富集cd3+t细胞。
2.一种富集t细胞的方法,所述方法包括(a)进行第一选择,所述第一选择包括从包含原代人t细胞的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体包含的cd57+t细胞少于所述生物样品;以及(b)对来自所述耗尽的群体的细胞进行第二选择,所述第二选择包括从所述耗尽的群体富集cd3+t细胞,所述富集由此生成cd57-cd3+t细胞的富集的群体。
3.一种富集t细胞的方法,所述方法包括:(a)进行第一选择,所述第一选择包括从包含原代人t细胞的生物样品富集cd3+t细胞,从而生成富集的t细胞群;以及(b)对来自所述富集的t细胞群的细胞进行第二选择,所述第二选择包括从富集的样品细胞群去除cd57+t细胞,从而生成耗尽的群体,其中所述耗尽的群体包含的cd57+t细胞少于所述生物样品和/或少于所述富集的t细胞群,并且富集cd3+t细胞。
4.一种富集t细胞的方法,所述方法包括:
(a)进行第一选择,所述第一选择包括从包含原代人t细胞的生物样品去除cd57+t细胞,从而生成第一耗尽的群体,所述第一耗尽的群体包含的cd57+t细胞少于所述生物样品;
(b)对来自所述第一耗尽的群体的细胞进行第二选择,所述第二选择包括从所述第一耗尽的群体富集(i)cd4+t细胞和(ii)cd8+t细胞中的一种,所述富集由此生成富集(i)cd4+t细胞和(ii)cd8+t细胞中的一种的第二耗尽的群体以及未选择的群体;以及
(c)进行第三选择,所述第三选择包括从所述未选择的群体富集(i)cd4+细胞和(ii)cd8+细胞中的另一种,所述富集由此生成富集(i)cd4+t细胞和(ii)cd8+t细胞中的另一种的第三耗尽的群体。
5.根据实施方案1-4中任一项所述的方法,其中所述耗尽的群体(任选地所述第一耗尽的群体、所述第二耗尽的群体或所述第三耗尽的群体)包含以下中的至少一种:
(i)少于为或约5%cd57+t细胞;
(ii)一定频率的cd57+t细胞,所述频率是所述生物样品中存在的cd57+t细胞的频率的少于为或约35%;
(iii)cd4+t细胞,其中至少为或约95%的所述cd4+t细胞是cd57-;以及
(iv)cd8+t细胞,其中至少为或约95%的所述cd8+t细胞是cd57-。
6.根据实施方案1-5中任一项所述的方法,其中所述生物样品包含单采术产物或白细胞单采术产物。
7.一种富集t细胞的方法,所述方法包括从含有包含原代人t细胞的单采术产物或白细胞单采术产物的生物样品去除cd57+t细胞,从而生成t细胞的耗尽的群体,其中所述耗尽的群体包含的cd57+t细胞少于所述生物样品,并且其中所述耗尽的群体包含:
(i)少于为或约5%cd57+t细胞;
(ii)一定频率的cd57+t细胞,所述频率是所述生物样品中存在的cd57+t细胞的频率的少于为或约35%;
(iii)cd4+t细胞,其中至少为或约95%的所述cd4+t细胞是cd57-;和/或
(iv)cd8+t细胞,其中至少为或约95%的所述cd8+t细胞是cd57-。
8.根据实施方案7所述的方法,其中所述耗尽的群体中至少为或约95%的cd4+t细胞包含cd57-cd4+t细胞。
9.根据实施方案7所述的方法,其中所述耗尽的群体中至少为或约95%的cd8+t细胞包含cd57-cd8+t细胞。
10.根据实施方案7-9中任一项所述的方法,其中所述耗尽的群体中至少为或约95%的cd4+t细胞和cd8+t细胞包含cd57-cd4+t细胞和cd57-cd8+t细胞。
11.根据实施方案1-10中任一项所述的方法,其中所述耗尽的群体中至少为或约95%的cd3+t细胞包含cd57-cd3+t细胞。
12.根据实施方案7-10中任一项所述的方法,其中所述耗尽的群体是第一耗尽的群体,并且所述方法还包括从所述第一耗尽的群体选择cd4+t细胞,从而生成作为cd57-cd4+t细胞的富集的群体的第二耗尽的群体和未选择的群体。
13.根据实施方案12所述的方法,其中所述方法还包括从所述未选择的群体选择cd8+t细胞,从而生成作为cd57-cd8+t细胞的富集的群体的第三耗尽的群体和第二未选择的群体。
14.根据实施方案7-10中任一项所述的方法,其中所述耗尽的群体是第一耗尽的群体,并且所述方法还包括从所述第一耗尽的群体选择cd8+t细胞,从而生成作为cd57-cd8+t细胞的富集的群体的第二耗尽的群体和未选择的群体。
15.根据实施方案14所述的方法,其中所述方法还包括从所述未选择的群体选择cd4+t细胞,从而生成作为cd57-cd4+t细胞的富集的群体的第三耗尽的群体和第二未选择的群体。
16.根据实施方案7-11中任一项所述的方法,其中所述耗尽的群体是第一耗尽的群体,并且所述方法还包括从所述第一耗尽的群体选择cd3+t细胞,从而生成作为cd57-cd3+t细胞的富集的群体的第二耗尽的群体和未选择的群体。
17.根据实施方案16所述的方法,其中所述耗尽的群体(任选地所述第一耗尽的群体)包含以下中的至少一种:
(i)少于为或约5%cd57+t细胞;
(ii)一定频率的cd57+t细胞,所述频率是所述生物样品中存在的cd57+t细胞的频率的少于为或约35%;
(iii)cd4+t细胞,其中至少为或约95%的所述cd4+t细胞是cd57-;以及
(iv)cd8+t细胞,其中至少为或约95%的所述cd8+t细胞是cd57-。
18.根据实施方案17所述的方法,其中所述耗尽的群体中至少为或约95%的cd3+t细胞包含cd57-cd3+t细胞。
19.根据实施方案17或实施方案18所述的方法,其还包括在去除cd57+t细胞之前从所述生物样品富集cd3+t细胞,从而生成富集的cd3+t细胞生物样品用于去除cd57+t细胞。
20.根据实施方案17或实施方案18所述的方法,其中所述耗尽的群体是第一耗尽的群体,并且所述方法还包括从所述第一耗尽的群体富集cd3+t细胞,从而生成cd57-cd3+t细胞的富集的群体。
21.一种富集t细胞的方法,所述方法包括:
(a)进行第一选择,所述第一选择包括从含有包含原代人t细胞的单采术产物或白细胞单采术产物的生物样品去除cd57+t细胞,从而生成第一耗尽的群体,所述第一耗尽的群体包含的cd57+t细胞少于所述生物样品;以及
(b)对来自所述第一耗尽的群体的细胞进行第二选择,所述第二选择包括从所述第一耗尽的群体富集cd3+t细胞,所述富集由此生成cd57-cd3+t细胞的富集的群体。
22.一种富集t细胞的方法,所述方法包括:
(a)进行第一选择,所述第一选择包括从含有包含原代人t细胞的单采术产物或白细胞单采术产物的生物样品富集cd3+t细胞,从而生成富集的生物样品;以及
(b)对来自所述富集的生物样品的细胞进行第二选择,所述第二选择包括从所述富集的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体是cd57-cd3+t细胞的富集的群体。
23.根据实施方案1-22中任一项所述的方法,其中所述耗尽的群体(任选地所述第一耗尽的群体、所述第二耗尽的群体或所述第三耗尽的群体)中cd57+t细胞的频率是所述生物样品中cd57+t细胞的频率的少于为或约35%、30%、20%、10%、5%、1%或0.1%。
24.根据实施方案1-23中任一项所述的方法,其中所述耗尽的群体(任选地所述第一耗尽的群体、所述第二耗尽的群体或所述第三耗尽的群体)包含少于为或约3%、少于为或约2%、少于为或约1%、少于为或约0.1%或少于为或约0.01%cd57+t细胞。
25.根据实施方案1-24中任一项所述的方法,其中所述耗尽的群体(任选地所述第一耗尽的群体、所述第二耗尽的群体或所述第三耗尽的群体)不含或基本上不含cd57+t细胞。
26.根据实施方案1-25中任一项所述的方法,其中所述耗尽的群体(任选地所述第一耗尽的群体、所述第二耗尽的群体或所述第三耗尽的群体)中幼稚样细胞的频率比所述生物样品中幼稚样细胞的频率大至少为或约10%、20%、30%、40%或50%。
27.根据实施方案1-26中任一项所述的方法,其中所述耗尽的群体(任选地所述第一耗尽的群体、所述第二耗尽的群体或所述第三耗尽的群体)中cd25+t细胞、cd27+t细胞、cd28+t细胞、ccr7+t细胞或cd45ra+t细胞中的一种或多种的频率比所述生物样品中相应细胞的频率大至少为或约10%、20%、30%、40%或50%。
28.根据实施方案1-27中任一项所述的方法,其中所述耗尽的群体(任选地所述第一耗尽的群体、所述第二耗尽的群体或所述第三耗尽的群体)中cd28+t细胞的频率比所述生物样品中相应细胞的频率大至少约或约10%、20%、30%、40%或50%。
29.根据实施方案1-27中任一项所述的方法,其中所述耗尽的群体(任选地所述第一耗尽的群体、所述第二耗尽的群体或所述第三耗尽的群体)中cd27+/cd28+t细胞的频率比所述生物样品中相应细胞的频率大至少约或约10%、20%、30%、40%或50%。
30.根据实施方案1-27中任一项所述的方法,其中:
所述耗尽的群体(任选地所述第一耗尽的群体、所述第二耗尽的群体或所述第三耗尽的群体)包含至少为或约15%、20%、25%、30%、35%或40%cd27+t细胞;或者
所述耗尽的群体(任选地所述第一耗尽的群体、所述第二耗尽的群体或所述第三耗尽的群体)包含至少为或约10%、15%、20%、25%、25%、30%、35%或40%cd28+t细胞。
31.根据实施方案1-30中任一项所述的方法,其中所述耗尽的群体(任选地所述第一耗尽的群体、所述第二耗尽的群体或所述第三耗尽的群体)包含至少为或约10%、15%、20%、25%、30%、35%、40%、50%、60%、70%或80%cd27+cd28+t细胞。
32.根据实施方案1-31中任一项所述的方法,其中所述耗尽的群体(任选地所述第一耗尽的群体、所述第二耗尽的群体或所述第三耗尽的群体)包含至少为或约70%或80%cd27+cd28+t细胞。
33.根据实施方案1-32中任一项所述的方法,其中所述耗尽的群体(任选地所述第一耗尽的群体、所述第二耗尽的群体或所述第三耗尽的群体)包含至少为或约10%、15%、20%或25%ccr7+t细胞。
34.根据实施方案13或15-33中任一项所述的方法,其还包括将所述第二耗尽的群体和所述第三耗尽的群体任选地以为或约1:3与为或约3:1之间、任选地为或约1:1的比率组合,从而生成包含所述第二耗尽的群体和所述第三耗尽的群体的耗尽的群体。
35.一种刺激t细胞的方法,所述方法包括在刺激条件下孵育输入组合物的t细胞,从而生成t细胞的刺激的群体,其中所述输入组合物包含通过根据实施方案1-34中任一项所述的方法生成的耗尽的群体(任选地所述第一耗尽的群体、所述第二耗尽的群体或所述第三耗尽的群体)。
36.根据实施方案1-35中任一项所述的方法,其中所述方法产生t细胞组合物,所述t细胞组合物包含至少为或约90%、至少为或约95%、至少为或约97%、至少为或约99%或至少为或约99.9%cd57-cd4+t细胞。
37.根据实施方案1-35中任一项所述的方法,其中所述方法产生t细胞组合物,所述t细胞组合物包含至少为或约90%、至少为或约95%、至少为或约97%、至少为或约99%或者至少为或约99.9%cd57-cd8+t细胞。
38.根据实施方案1-35中任一项所述的方法,其中所述方法产生t细胞组合物,所述t细胞组合物包含至少为或约90%、至少为或约95%、至少为或约97%、至少为或约99%或者至少为或约99.9%cd57-cd3+t细胞。
39.根据实施方案38所述的方法,其中所述组合物中cd4+与cd8+t细胞的比率在3:1与1:3之间、在2:1与1:2之间、在1.5:1与1:1.5之间或在1.2:1与1:1.2之间,每个都包含端值。
40.根据实施方案38或实施方案39所述的方法,其中所述组合物中cd4+与cd8+t细胞的比率是为或约1:1cd4+。
41.根据实施方案1-40中任一项所述的方法,其中所述原代t细胞来自人受试者。
42.根据实施方案1-41中任一项所述的方法,其中所述原代t细胞来自患有疾病或病症的受试者。
43.根据实施方案42所述的方法,其中所述疾病或病症是癌症。
44.根据实施方案1-41中任一项所述的方法,其中所述原代t细胞来自健康受试者。
45.根据实施方案1-44中任一项所述的方法,其中去除所述cd57+t细胞包括基于免疫亲和力的选择。
46.根据实施方案45所述的方法,其中所述基于免疫亲和力的选择包括使细胞与能够与cd57特异性结合的抗体接触并回收未与所述抗体结合的细胞,从而实现阴性选择,其中使回收的细胞耗尽cd57+细胞。
47.根据实施方案45所述的方法,其中所述第一、第二和/或第三选择富集cd4或cd8t细胞,并且所述基于免疫亲和力的选择是通过以下方式来实现:使细胞分别与能够与cd4或cd8特异性结合的抗体接触,并回收与所述抗体结合的细胞,从而实现阳性选择,其中使回收的细胞富集cd4+细胞或cd8+细胞;并且其中所述选择富集cd3t细胞,并且所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与能够与cd3特异性结合的抗体接触,并回收与所述抗体结合的细胞,从而实现阳性选择,其中使回收的细胞富集cd3+细胞。
48.根据实施方案46或实施方案47所述的方法,其中将所述抗体固定在固体表面上,任选地其中所述固体表面是磁粒。
49.根据实施方案48所述的方法,其中将所述抗体固定在亲和色谱基质上或附着至亲和色谱基质;并且其中所述抗体还包含能够与固定在所述基质上的结合试剂形成可逆键的一种或多种结合配偶体,借此所述抗体在所述接触期间与色谱基质可逆地结合。
50.根据实施方案49所述的方法,其中所述结合试剂是与所述结合配偶体可逆地结合的链霉亲和素突变蛋白。
51.根据实施方案50所述的方法,其中:
参考seqidno:66中所示氨基酸序列中的链霉亲和素中的位置,在对应于位置44至47的序列位置,所述链霉亲和素突变蛋白包含氨基酸序列lle44-gly45-ala46-arg47;或者
参考seqidno:66中所示氨基酸序列中的链霉亲和素中的位置,在对应于位置44至47的序列位置,所述链霉亲和素突变蛋白包含氨基酸序列va144-thr45-ala46-arg47。
52.根据实施方案49-51中任一项所述的方法,其中所述结合配偶体是链霉亲和素结合肽。
53.根据实施方案52所述的方法,其中所述链霉亲和素结合肽选自trp-ser-his-pro-gln-phe-glu-lys(seqidno:69)、ser-ala-trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)3-trp-ser-his-pro-gln-phe-glu-lys(seqidno:78)、sawshpqfekgggsgggsggsawshpqfek(seqidno:79)、trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)3-trp-ser-his-pro-gln-phe-glu-lys(seqidno:70)、trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)2-trp-ser-his-pro-gln-phe-glu-lys(seqidno:71)和trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)2gly-gly-ser-ala-trp-ser-his-pro-gln-phe-glu-lys(seqidno:72)。
54.根据实施方案52或实施方案53所述的方法,其中所述链霉亲和素结合肽具有序列sawshpqfekgggsgggsggsawshpqfek(seqidno:79)。
55.根据实施方案49-54中任一项所述的方法,其还包括在使所述样品中的细胞与所述亲和色谱基质接触后,施加竞争试剂以破坏所述结合配偶体与结合试剂之间的键,从而回收与所述抗体结合的细胞。
56.根据实施方案55所述的方法,其中所述竞争试剂是生物素或生物素类似物。
57.根据实施方案48-55中任一项所述的方法,其中所述色谱基质填充于分离容器中,所述分离容器是柱。
58.根据实施方案1-57中任一项所述的方法,其中包含原代t细胞的所述生物样品是用低温保护剂配制的样品。
59.根据实施方案13-58中任一项所述的方法,其中所述单采术或白细胞单采术样品是用低温保护剂配制的样品。
60.一种刺激t细胞的方法,所述方法包括在刺激条件下孵育输入组合物的t细胞,从而生成t细胞的刺激的群体,其中所述输入组合物是通过根据实施方案1-59中任一项所述的方法产生的。
61.一种刺激t细胞的方法,所述方法包括在刺激条件下孵育输入组合物的t细胞,其中所述输入组合物中cd57+t细胞的百分比低于cd57+t细胞的阈值百分比,其中所述阈值是不超过为或约30%cd57+t细胞。
62.根据实施方案61所述的方法,其中所述阈值百分比是不超过为或约25%、20%、15%、10%、5%或1%cd57+t细胞。
63.根据实施方案60-62中任一项所述的方法,其中所述输入组合物包含:
(i)少于为或约5%cd57+t细胞;
(ii)至少为或约95%cd57-t细胞;
(iii)至少为或约90%cd57-cd4+t细胞;或
(iv)至少为或约90%cd57-cd8+t细胞。
64.一种刺激t细胞的方法,其包括在刺激条件下孵育输入组合物的t细胞,从而生成t细胞的刺激的群体,其中所述输入组合物包含:
(i)少于约或约5%cd57+t细胞
(ii)至少约或约95%cd57-t细胞;
(iii)至少约或约90%cd57-cd4+t细胞;或
(iv)至少约或约90%cd57-cd8+t细胞。
65.根据实施方案60-64中任一项所述的方法,其中所述输入组合物包含从含有包含原代人t细胞的单采术产物或白细胞单采术产物的生物样品获得的细胞。
66.根据实施方案65所述的方法,其还包括从所述生物样品去除cd57+t细胞,从而生成包含t细胞的耗尽的群体的输入组合物。
67.一种刺激t细胞的方法,所述方法包括:
(a)进行第一选择,所述第一选择包括从包含原代人t细胞的生物样品去除cd57+t细胞,从而生成第一耗尽的群体,所述耗尽的群体包含的cd57+t细胞少于所述生物样品;
(b)对来自所述第一耗尽的群体的细胞进行第二选择,所述第二选择包括从所述第一耗尽的群体富集(i)cd4+t细胞和(ii)cd8+t细胞中的一种,所述富集由此生成富集(i)cd57-cd4+t细胞和(ii)cd57-cd8+t细胞中的一种的第二耗尽的群体以及未选择的群体;
(c)对来自所述未选择的群体的细胞进行第三选择,所述第三选择包括从所述未选择的群体富集(i)cd4+细胞和(ii)cd8+细胞中的另一种,所述富集由此生成富集(i)cd57-cd4+t细胞和(ii)cd57-cd8+t细胞中的另一种的第三耗尽的群体;以及
(d)在刺激条件下孵育一种或多种输入组合物,所述一种或多种输入组合物包含来自所述第二耗尽的群体或所述第三耗尽的群体的t细胞。
68.根据实施方案67所述的方法,其中在步骤(d)之前,所述方法包括组合所述第二耗尽的群体和所述第三耗尽的群体,从而生成包含cd4+t细胞和cd8+t细胞的输入组合物。
69.根据实施方案67所述的方法,其中步骤(d)包括单独孵育第一输入组合物和第二输入组合物,
所述第一输入组合物包含来自所述第二耗尽的群体的t细胞,并且所述第二输入组合物包含来自所述第三耗尽的群体的t细胞。
70.根据实施方案67-69中任一项所述的方法,其中:
所述第二选择包括富集(i)cd4+t细胞,从而生成富集(i)cd57-cd4+t细胞的第二耗尽的群体,并且其中所述第一输入组合物包含所述富集的cd57-cd4+t细胞;并且
所述第三选择包括富集(ii)cd8+t细胞,从而生成富集(ii)cd57-cd8+t细胞的第三耗尽的群体,并且其中所述第二输入组合物包含富集的cd57-cd8+t细胞。
71.根据实施方案67-69中任一项所述的方法,其中:
所述第二选择包括富集(ii)cd8+t细胞,从而生成富集(ii)cd57-cd8+t细胞的第二耗尽的群体,并且其中所述第一输入组合物包含富集的cd57-cd8+t细胞;并且
所述第三选择包括富集(i)cd4+t细胞,从而生成富集(i)cd57-cd4+t细胞的第三耗尽的群体,并且其中所述第二输入组合物包含富集的cd57-cd4+t细胞。
72.一种刺激t细胞的方法,所述方法包括:
(a)进行第一选择,所述第一选择包括从包含原代人t细胞的生物样品去除cd57+t细胞,从而生成第一耗尽的群体,所述耗尽的群体包含的cd57+t细胞少于所述生物样品;
(b)对来自所述第一耗尽的群体的细胞进行第二选择,所述第二选择包括从所述第一耗尽的群体富集cd3+t细胞,所述富集由此生成富集cd3+t细胞的第二耗尽的群体;以及
(c)在刺激条件下孵育一种或多种输入组合物,所述一种或多种输入组合物包含来自所述第二耗尽的群体的t细胞。
73.一种刺激t细胞的方法,所述方法包括:
(a)对来自生物样品的细胞进行第一选择,所述第一选择包括从所述生物样品富集cd3+t细胞,所述富集由此生成富集cd3+t细胞的富集的生物样品;
(b)进行第二选择,所述第二选择包括从包含原代人t细胞的所述富集的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体包含的cd57+细胞少于所述富集的生物样品;以及
(c)在刺激条件下孵育一种或多种输入组合物,所述一种或多种输入组合物包含来自所述耗尽的群体的t细胞。
74.根据实施方案60-73中任一项所述的方法,其中所述输入组合物包含少于为或约5%cd57+t细胞。
75.根据实施方案60-74中任一项所述的方法,其中所述输入组合物包含少于为或约3%、少于为或约2%、少于为或约1%、少于为或约0.1%或少于为或约0.01%cd57+t细胞。
76.根据实施方案60-75中任一项所述的方法,其中输入组合物中cd57+细胞的频率是所述生物样品中存在的cd57+t细胞的频率的少于为或约35%、30%、25%、20%、10%、5%、1%或0.1%。
77.根据实施方案60-76中任一项所述的方法,其中所述输入组合物不含或基本上不含cd57+t细胞。
78.根据实施方案60-77中任一项所述的方法,其中所述输入组合物包含至少为或约95%cd57-t细胞。
79.根据实施方案60-78中任一项所述的方法,其中所述输入组合物中的cd4+t细胞包含至少为或约90%、至少为或约95%、至少为或约97%、至少为或约99%或者至少为或约99.9%cd57-cd4+t细胞。
80.根据实施方案60-79中任一项所述的方法,其中所述输入组合物中的cd8+t细胞包含至少为或约90%、至少为或约95%、至少为或约97%、至少为或约99%或者至少为或约99.9%cd57-cd8+t细胞。
81.根据实施方案60-80中任一项所述的方法,其中所述输入组合物中的cd3+t细胞包含至少约或约90%、至少约或约95%、至少约或约97%、至少约或约99%或者至少约或约99.9%cd57-cd3+t细胞。
82.根据实施方案60-81中任一项所述的方法,其中所述cd57-t细胞包含cd57-cd4+t细胞和cd57-cd8+t细胞。
83.根据实施方案60-82中任一项所述的方法,其中所述输入组合物包含比率在3:1与1:3之间、在2:1与1:2之间、在1.5:1与1:1.5之间或在1.2:1与1:1.2之间的cd4+t细胞与cd8+t细胞,每个都包含端值。
84.根据实施方案60-83中任一项所述的方法,其中所述输入组合物包含比率为或为约1:1的cd4+t细胞与cd8+t细胞。
85.根据实施方案60-84中任一项所述的方法,其中所述输入组合物中幼稚样细胞的频率比为或约所述生物样品中幼稚样细胞的频率大至少为或约10%、20%、30%、40%或50%。
86.根据实施方案60-85中任一项所述的方法,其中所述输入组合物中cd25+t细胞、cd27+t细胞、cd28+t细胞、ccr7+t细胞或cd45ra+t细胞中的一种或多种的频率比所述生物样品中相应细胞的频率大至少为或约10%、20%、30%、40%或50%。
87.根据实施方案60-86中任一项所述的方法,其中所述输入组合物包含至少为或约15%、20%、25%、30%、35%或40%cd27+t细胞。
88.根据实施方案60-87中任一项所述的方法,其中所述输入组合物包含至少为或约10%、15%、20%、25%、25%、30%、35%或40%cd28+t细胞。
89.根据实施方案60-88中任一项所述的方法,其中所述输入组合物包含至少为或约10%、15%、20%、25%、30%、35%、40%、50%、60%、70%或80%cd27+cd28+t细胞。
90.根据实施方案60-89中任一项所述的方法,其中所述输入组合物包含至少为或约70%或80%cd27+cd28+t细胞。
91.根据实施方案20-47中任一项所述的方法,其中所述输入组合物包含至少为或约10%、15%、20%或25%ccr7+t细胞。
92.根据实施方案1-91中任一项所述的方法,其中所述第一和/或第二选择中的从所述生物样品去除cd57+t细胞和/或富集细胞包括基于免疫亲和力的选择。
93.根据实施方案92所述的方法,其中所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与能够与cd57、cd4或cd8特异性结合的抗体接触并回收未与所述抗体结合的细胞,从而实现阴性选择,或者回收与所述抗体结合的细胞,从而实现阳性选择,其中使回收的细胞耗尽cd57+细胞和/或富集cd4+细胞或cd8+细胞,并且将所述抗体固定在磁粒上。
94.根据实施方案92所述的方法,其中所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与固定在亲和色谱基质上或附着至亲和色谱基质的抗体接触,所述抗体能够与cd57、cd4或cd8特异性结合,以实现cd57+细胞的阴性选择或cd4+或cd8+细胞的阳性选择。
95.根据实施方案60-94中任一项所述的方法,其中所述刺激条件包括刺激试剂的存在,所述刺激试剂能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域。
96.根据实施方案95中任一项所述的方法,其中所述刺激试剂包含(i)一级药剂,所述一级药剂与tcr复合物的成员特异性结合,任选地与cd3特异性结合,以及(ii)二级药剂,所述二级药剂与t细胞共刺激分子特异性结合,任选地其中所述共刺激分子选自cd28、cd137(4-1-bb)、ox40或icos。
97.根据实施方案96所述的方法,其中所述一级和二级药剂中的一种或两种包含抗体或其抗原结合片段。
98.根据实施方案96或实施方案97所述的方法,其中所述一级药剂和所述二级药剂包含抗体,任选地其中所述刺激条件包括与抗cd3抗体或其抗原结合片段和抗cd28抗体或其抗原结合片段一起孵育。
99.根据实施方案97或实施方案98所述的方法,其中所述抗原结合片段是选自以下的单价抗体片段:fab片段、fv片段和单链fv片段(scfv)。
100.根据实施方案96-99中任一项所述的方法,其中所述一级药剂是抗cd3fab,并且所述二级药剂包含抗cd28fab。
101.根据实施方案96-100中任一项所述的方法,其中所述一级药剂和所述二级药剂各自存在于或附着在固体支持物的表面上。
102.根据实施方案101所述的方法,其中所述固体支持物是或包含珠,任选地顺磁珠。
103.根据实施方案102所述的方法,其中所述刺激条件包括包含具有表面附着的抗cd3和抗cd28抗体的顺磁珠的刺激试剂的存在,所述刺激试剂是以少于为或约3:1的珠与细胞的比率存在。
104.根据实施方案103所述的方法,其中所述刺激试剂是以为或为约1:1的珠与细胞的比率存在。
105.根据实施方案102-104中任一项所述的方法,其还包括从所述细胞分离所述刺激试剂,所述分离包括使所述细胞暴露于磁场。
106.根据实施方案96-100中任一项所述的方法,其中所述一级药剂和所述二级药剂可逆地结合在包含多个链霉亲和素或链霉亲和素突变蛋白分子的寡聚颗粒试剂的表面上。
107.根据实施方案106所述的方法,其中所述链霉亲和素或链霉亲和素突变蛋白分子结合至或能够结合至生物素、抗生物素蛋白、生物素类似物或生物素突变蛋白、抗生物素蛋白类似物或突变蛋白和/或其生物活性片段。
108.根据实施方案106或实施方案107所述的方法,其中参考seqidno:66中所示氨基酸序列中的链霉亲和素中的位置,在对应于位置44至47的序列位置,所述链霉亲和素突变蛋白分子包含氨基酸序列val44-thr45-ala46-arg47或ile44-gly45-ala46-arg47。
109.根据实施方案106-108中任一项所述的方法,其中所述链霉亲和素突变蛋白分子包含:
a)seqidno:70-73、78、85-89中的任一项中所示的氨基酸序列;
b)如下氨基酸序列:其展现与seqidno:70-73、78、85-89中任一项的至少为或约85%、86%、87%、88%、89%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高序列同一性,并且含有对应于val44-thr45-ala46-arg47或ile44-gly45-ala46-arg47的氨基酸序列,和/或与生物素、生物素类似物或链霉亲和素结合肽可逆地结合;或者
c)a)或b)的与生物素、生物素类似物或链霉亲和素结合肽可逆地结合的功能片段。
110.根据实施方案106-109中任一项所述的方法,其中所述链霉亲和素突变蛋白分子包含seqidno:73或78中所示的氨基酸序列。
111.根据实施方案106-110中任一项所述的方法,其中所述链霉亲和素突变蛋白分子包含seqidno:73中所示的氨基酸序列。
112.根据实施方案106-110中任一项所述的方法,其中所述链霉亲和素突变蛋白分子包含seqidno:78中所示的氨基酸序列。
113.根据实施方案106-112中任一项所述的方法,其中所述一级药剂和所述二级药剂各自包含链霉亲和素结合肽。
114.根据实施方案113所述的方法,其中所述链霉亲和素结合肽选自trp-ser-his-pro-gln-phe-glu-lys(seqidno:69)、trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)3-trp-ser-his-pro-gln-phe-glu-lys(seqidno:70)、trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)2-trp-ser-his-pro-gln-phe-glu-lys(seqidno:71)和trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)2gly-gly-ser-ala-trp-ser-his-pro-gln-phe-glu-lys(seqidno:89)。
115.根据实施方案106-114中任一项所述的方法,其中所述一级药剂包含抗cd3fab,并且其中所述二级药剂包含抗cd28fab。
116.根据实施方案106-115中任一项所述的方法,其中所述寡聚颗粒试剂包含大于为或约60nm、大于为或约70nm、大于为或约80nm或者大于为或约90nm的半径。
117.根据实施方案106-116中任一项所述的方法,其中所述寡聚颗粒试剂包含如下分子量:至少为或约5x107g/mol或者至少为或约1x108g/mol;或者在5x107g/mol与5x108g/mol之间、在1x108g/mol与5x108g/mol之间或者在1x108g/mol与2x108g/mol之间,每个都包含端值。
118.根据实施方案106-117中任一项所述的方法,其中所述寡聚颗粒试剂包含至少为或约500个链霉亲和素或链霉亲和素突变蛋白四聚体、至少为或约1,000个链霉亲和素或链霉亲和素突变蛋白四聚体、至少为或约1,500个链霉亲和素或链霉亲和素突变蛋白四聚体或者至少为或约2,000个链霉亲和素或链霉亲和素突变蛋白四聚体;或者;在1,000与20,000之间的链霉亲和素或链霉亲和素突变蛋白四聚体、在1,000与10,000之间的链霉亲和素或链霉亲和素突变蛋白四聚体或者在2,000与5,000之间的链霉亲和素或链霉亲和素突变蛋白四聚体。
119.根据实施方案106-118中任一项所述的方法,其还包括从所述细胞分离所述刺激试剂,所述分离包括使所述细胞与物质接触,所述物质能够逆转所述一级和二级药剂与所述寡聚颗粒试剂之间的键。
120.根据实施方案119所述的方法,其中所述物质是游离结合配偶体和/或是竞争剂。
121.根据实施方案119或实施方案120所述的方法,其中所述物质的存在终止或减少所述一级药剂和所述二级药剂在所述t细胞中诱导或调节的信号。
122.根据实施方案119-121中任一项所述的方法,其中所述物质是或包含链霉亲和素结合肽、生物素或其生物活性片段或者生物素类似物或其生物活性片段。
123.根据实施方案119-122中任一项所述的方法,其中所述物质是或包含生物素类似物。
124.根据实施方案122所述的方法,其中所述物质是或包含链霉亲和素结合肽,并且所述链霉亲和素结合肽选自trp-ser-his-pro-gln-phe-glu-lys(seqidno:69)、trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)3-trp-ser-his-pro-gln-phe-glu-lys(seqidno:70)、trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)2-trp-ser-his-pro-gln-phe-glu-lys(seqidno:71)和trp-ser-his-pro-gln-phe-glu-lys-(glyglyglyser)2gly-gly-ser-ala-trp-ser-his-pro-gln-phe-glu-lys(seqidno:89)。
125.根据实施方案122所述的方法,其中所述物质是或包含生物素或生物活性片段或者生物素类似物或生物活性片段。
126.根据实施方案60-125中任一项所述的方法,其中所述刺激条件包括一种或多种重组细胞因子的存在。
127.根据实施方案60-126中任一项所述的方法,其中所述刺激条件包括重组il-2、il-7和il-15中的一种或多种的存在。
128.一种基因工程化t细胞的方法,所述方法包括将编码重组受体的异源多核苷酸引入来自通过根据实施方案1-59中任一项所述的方法产生的t细胞组合物的t细胞群中,从而生成t细胞的工程化的群体。
129.一种基因工程化t细胞的方法,所述方法包括将编码重组受体的异源多核苷酸引入来自实施方案73-127中任一项的刺激的t细胞群的t细胞群中,从而生成t细胞的工程化的群体。
130.根据实施方案1-127中任一项所述的方法,其还包括将编码重组受体的异源多核苷酸引入从所述耗尽的群体或所述输入组合物或所述刺激的群体获得的t细胞群中,从而生成t细胞的工程化的群体。
131.一种基因工程化t细胞的方法,所述方法包括将编码重组受体的异源多核苷酸引入t细胞的刺激的群体中,所述t细胞的刺激的群体是通过如果所述输入组合物中cd57+t细胞的百分比低于cd57+t细胞的阈值百分比,则在刺激条件下孵育输入组合物的t细胞生成的,其中所述阈值是不超过为或约30%,从而生成t细胞的工程化的群体。
132.根据实施方案131所述的方法,其中所述阈值是不超过为或约25%、20%、15%、10%、5%或1%。
133.一种基因工程化t细胞的方法,其包括将编码重组受体的异源多核苷酸引入来自输入组合物的t细胞中,从而生成t细胞的工程化的群体,
其中所述输入组合物包含以下中的一种或多种:
(i)少于为或约5%cd57+t细胞
(ii)至少为或约95%cd57-t细胞;
(iii)至少为或约90%cd57-cd4+t细胞;或者
(iv)至少为或约90%cd57-cd8+t细胞。
134.一种基因工程化t细胞的方法,所述方法包括:
(a)进行第一选择,所述第一选择包括从包含原代人t细胞的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体包含的cd57+t细胞少于所述生物样品;
(b)对来自所述耗尽的群体的细胞进行第二选择,所述第二选择包括从包含原代人t细胞的所述生物样品富集(i)cd4+t细胞和(ii)cd8+t细胞中的一种,所述富集由此生成富集(i)cd57-cd4+t细胞和(ii)cd57-cd8+t细胞中的一种的第一富集的群体以及未选择的群体;
(c)对来自所述未选择的群体的细胞进行第三选择,所述第三选择包括从所述未选择的群体富集(i)cd4+细胞和(ii)cd8+细胞中的另一种,所述富集由此生成富集(i)cd57-cd4+t细胞和(ii)cd57-cd8+t细胞中的另一种的第二富集的群体;以及
(d)将编码重组受体的异源多核苷酸引入来自所述第一和第二富集的群体中的一个或两个的t细胞中,从而生成t细胞的第一和第二工程化的群体。135.根据实施方案130-134中任一项所述的方法,其中在所述引入前,在刺激条件下孵育所述输入组合物或所述富集的群体。
136.根据实施方案134或实施方案135所述的方法,其中所述步骤(d)包括将所述异源多核苷酸引入包含来自所述第一和第二富集的群体的cd4+t细胞和cd8+t细胞的细胞群中。
137.根据实施方案134或实施方案135所述的方法,其中步骤(d)包括将所述异源多核苷酸单独引入所述第一富集的群体的细胞和所述第二富集的群体的细胞中。
138.根据实施方案134-137中任一项所述的方法,其中:
所述第二选择包括富集(i)cd4+t细胞,从而生成富集(i)cd57-cd4+t细胞的第一富集的群体,并且其中所述第一工程化的群体包含cd57-cd4+t细胞;并且
所述第三选择包括富集(ii)cd8+t细胞,从而生成富集(ii)cd57-cd8+t细胞的第二富集的群体,并且其中所述第二工程化的群体包含cd57-cd8+t细胞。
139.根据实施方案134-137中任一项所述的方法,其中:
所述第二选择包括富集(ii)cd8+t细胞,从而生成富集(ii)cd57-cd8+t细胞的第一富集的群体,并且其中所述第一工程化的群体包含cd57-cd8+t细胞;并且
所述第三选择包括富集(i)cd4+t细胞,从而生成富集(i)cd57-cd4+t细胞的第二工程化的群体,并且其中所述第二输入群体包含cd57-cd4+t细胞。
140.一种基因工程化t细胞的方法,所述方法包括:
(a)进行第一选择,所述第一选择包括从包含原代人t细胞的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体包含的cd57+t细胞少于所述生物样品;
(b)对来自所述耗尽的群体的细胞进行第二选择,所述第二选择包括从包含原代人t细胞的所述生物样品富集cd3+t细胞,所述富集由此生成富集cd57-cd3+t细胞的第一富集的群体;以及
(c)将编码重组受体的异源多核苷酸引入来自所述第一富集的群体的t细胞中,从而生成t细胞的第一工程化的群体。
141.根据实施方案140所述的方法,其中在所述引入前,在刺激条件下孵育所述第一富集的群体。
142.一种基因工程化t细胞的方法,所述方法包括:
(a)进行第一选择,所述第一选择包括从包含原代人t细胞的生物样品富集cd3+t细胞,所述富集由此生成富集cd3+t细胞的富集的生物样品;
(b)对来自所述富集的生物样品的细胞进行第二选择,所述第二选择包括从包含原代人t细胞的所述富集的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体包含的cd57+t细胞少于所述富集的生物样品;以及
(c)将编码重组受体的异源多核苷酸引入来自所述耗尽的群体的t细胞中,从而生成t细胞的第一工程化的群体。
143.根据实施方案142所述的方法,其中在所述引入前,在刺激条件下孵育所述耗尽的群体。
144.根据实施方案134-143中任一项所述的方法,其中在所述引入前,在刺激条件下孵育所述第一和第二富集的群体中的一个或两个的细胞。
145.根据实施方案128-144中任一项所述的方法,其中所述引入包括用转导
146.根据实施方案145所述的方法,其中所述病毒载体是γ逆转录病毒载体或慢病毒载体。
147.根据实施方案145或实施方案146所述的方法,其中所述病毒载体是慢病毒载体。
148.根据实施方案128-147中任一项所述的方法,其还包括在所述引入之后将包含转导的细胞的组合物孵育长达96小时,任选地在为或约37°±2℃的温度下孵育。
149.根据实施方案148所述的方法,其中在所述引入之后,所述孵育进行长达72小时。
150.根据实施方案148所述的方法,其中在所述引入之后,所述孵育进行长达48小时。
151.根据实施方案148所述的方法,其中在所述引入之后,所述孵育进行长达24小时。
152.根据实施方案148-151中任一项所述的方法,其中所述孵育导致将所述病毒载体整合至所述t细胞的基因组中。
153.根据实施方案128-147中任一项所述的方法,其任选地还包括在促进工程化细胞的增殖或扩增的条件下培育所述工程化的群体的细胞,从而生成扩增的细胞群。
154.根据实施方案153所述的方法,其中所述培育是在一种或多种重组细胞因子的存在下进行。
155.根据实施方案153所述的方法,其中所述培育是在一种或多种重组细胞因子的存在下进行,所述重组细胞因子任选地包括il-2、il-7和il-15中的一种或多种。
156.根据实施方案153-155中任一项所述的方法,其中所述增殖或扩增导致包含所述异源多核苷酸的活t细胞的数量的约或至少为或约2倍、3倍、4倍、5倍或大于为或约5倍增加。
157.一种收获或收集细胞的方法,所述方法包括收获或收集通过根据实施方案1-156中任一项所述的方法产生的细胞群。
158.一种基因工程化t细胞的方法,所述方法包括:
(a)在刺激条件下孵育来自通过根据实施方案1-19中任一项所述的方法生成的耗尽的群体(任选地所述第一耗尽的群体、所述第二耗尽的群体或所述第三耗尽的群体)的t细胞,所述刺激条件包括能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域的刺激试剂的存在,从而生成刺激的t细胞;以及
(b)将异源多核苷酸引入所述刺激的t细胞中,所述引入包括用包含编码重组受体的所述异源多核苷酸的病毒载体转导所述刺激的t细胞,从而生成t细胞的工程化的群体。
159.一种基因工程化t细胞的方法,所述方法包括:
(a)进行第一选择,所述第一选择包括从包含原代人t细胞的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体包含的cd57+t细胞少于所述生物样品;
(b)对来自所述耗尽的群体的细胞进行第二选择,所述第二选择包括从包含原代人t细胞的所述生物样品富集(i)cd4+t细胞和(ii)cd8+t细胞中的一种,所述富集由此生成富集(i)cd57-cd4+t细胞和(ii)cd57-cd8+t细胞中的一种的第一富集的群体以及未选择的群体;
(c)对来自所述未选择的群体的细胞进行第三选择,所述第三选择包括从所述未选择的群体富集(i)cd4+细胞和(ii)cd8+细胞中的另一种,所述富集由此生成富集(i)cd57-cd4+t细胞和(ii)cd57-cd8+t细胞中的另一种的第二富集的群体;
(d)在刺激条件下孵育来自所述第一富集的群体和所述第二富集的群体的t细胞,所述刺激条件包括能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域的刺激试剂的存在,从而生成所述第一和第二富集的群体的刺激的t细胞;以及
(e)将编码重组受体的异源多核苷酸引入所述第一和第二富集的群体的刺激的t细胞中,所述引入包括用包含所述异源多核苷酸的病毒载体转导所述刺激的t细胞,从而生成来自所述第一和第二富集的群体的t细胞的工程化的群体。
160.根据实施方案158或实施方案159所述的方法,其还包括:
(i)在促进所述工程化的群体的增殖或扩增的条件下培育工程化t细胞的所述群体,从而生成t细胞的扩增的群体;以及
(ii)收获或收集所述扩增的群体。
161.根据实施方案159或160所述的方法,其中在所述孵育前,所述第一富集的群体和所述第二富集的群体包含以下中的一种或多种:
(i)少于为或约5%cd57+t细胞
(ii)一定频率的cd57+t细胞,所述频率是所述生物样品中存在的cd57+t细胞的频率的少于为或约35%;或者
(iii)至少为或约95%cd57-t细胞。
162.根据实施方案159所述的方法,其中在所述孵育前,所述第一富集的群体和所述第二富集的群体包含少于为或约5%cd57+t细胞。
163.根据实施方案159-162中任一项所述的方法,其中在所述孵育前,所述第一富集的群体和所述第二富集的群体各自包含少于为或约3%、少于为或约2%、少于为或约1%、少于为或约0.1%或少于为或约0.01%cd57+t细胞。
164.根据实施方案159-163中任一项所述的方法,其中在所述孵育前,所述第一富集的群体和所述第二富集的群体中cd57+细胞的频率包含所述生物样品中cd57+t细胞的频率的少于为或约35%、30%、20%、10%、5%、1%或0.1%。
165.根据实施方案159-164中任一项所述的方法,其中在所述引入前,所述第一富集的群体和所述第二富集的群体不含或基本上不含cd57+t细胞。
166.根据实施方案159-165中任一项所述的方法,其中将所述第一富集的组合物和所述第二组合物的细胞在单一混合群体中一起孵育和/或培育。
167.根据实施方案166所述的方法,其中在所述引入前,所述单一混合群体包含比率在3:1与1:3之间、2:1与1:2之间、1.5:1与1:1.5之间或1.2:1与1:1.2之间的cd4+t细胞与cd8+t细胞,包含端值。
168.根据实施方案166或实施方案167所述的方法,其中在所述引入前,所述单一混合群体包含比率为或为约1:1的cd4+t细胞与cd8+t细胞。
169.根据实施方案159-168中任一项所述的方法,其中将所述第一富集的群体和所述第二富集的群体的细胞单独孵育和/或培育。
170.一种基因工程化t细胞的方法,所述方法包括:
(a)进行第一选择,所述第一选择包括从包含原代人t细胞的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体包含的cd57+t细胞少于所述生物样品;
(b)对来自所述耗尽的群体的细胞进行第二选择,所述第二选择包括从包含原代人t细胞的所述生物样品富集cd3+t细胞,所述富集由此生成富集cd57-cd3+t细胞的富集的群体;
(c)在刺激条件下孵育来自所述富集的群体的t细胞,所述刺激条件包括能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域的刺激试剂的存在,从而生成所述富集的群体的刺激的t细胞;以及
(d)将编码重组受体的异源多核苷酸引入所述富集的群体的刺激的t细胞中,所述引入包括用包含所述异源多核苷酸的病毒载体转导所述刺激的t细胞,从而生成来自所述富集的群体的t细胞的工程化的群体。
171.一种基因工程化t细胞的方法,所述方法包括:
(a)进行第一选择,所述第一选择包括从包含原代人t细胞的生物样品富集cd3+t细胞,所述富集由此生成富集cd3+t细胞的富集的生物样品;
(b)对来自所述富集的生物样品的细胞进行第二选择,所述第二选择包括从包含原代人t细胞的所述富集的生物样品去除cd57+t细胞,从而生成耗尽的群体,所述耗尽的群体包含的cd57+t细胞少于所述富集的生物样品;
(c)在刺激条件下孵育来自所述耗尽的群体的t细胞,所述刺激条件包括能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域的刺激试剂的存在,从而生成所述耗尽的群体的刺激的t细胞;以及
(d)将编码重组受体的异源多核苷酸引入所述耗尽的群体的刺激的t细胞中,所述引入包括用包含所述异源多核苷酸的病毒载体转导所述刺激的t细胞,从而生成来自所述耗尽的群体的t细胞的工程化的群体。
172.根据实施方案170或实施方案171所述的方法,其还包括:
(i)在促进所述工程化的群体的增殖或扩增的条件下培育工程化t细胞的所述群体,从而生成t细胞的扩增的群体;以及
(ii)收获或收集所述扩增的群体。
173.根据实施方案158-172中任一项所述的方法,其中所述刺激试剂包含具有表面附着的抗cd3和抗cd28抗体的顺磁珠。
174.根据实施方案158-172中任一项所述的方法,其中所述刺激试剂包含含有多个链霉亲和素或链霉亲和素突变蛋白分子和可逆地结合的抗cd3和抗cd28fab的寡聚颗粒试剂。
175.根据实施方案159-174中任一项所述的方法,其中所述第一和/或第二选择中的从所述生物样品去除cd57+t细胞和/或富集细胞包括基于免疫亲和力的选择。
176.根据实施方案175所述的方法,其中所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与能够与cd57、cd4或cd8特异性结合的抗体接触,并回收未与所述抗体结合的细胞,从而实现阴性选择,或者回收与所述抗体结合的细胞,从而实现阳性选择,其中使回收的细胞耗尽cd57+细胞和/或富集cd4+细胞或cd8+细胞,并且将抗体固定在磁粒上。
177.根据实施方案175所述的方法,其中所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与能够与cd57、cd3、cd4或cd8特异性结合的抗体接触,并回收未与所述抗体结合的细胞,从而实现阴性选择,或者回收与所述抗体结合的细胞,从而实现阳性选择,其中使回收的细胞耗尽cd57+细胞和/或富集cd3+细胞、cd4+细胞或cd8+细胞,并且其中将所述抗体固定在磁粒上。
178.根据实施方案175所述的方法,其中所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与固定在亲和色谱基质上或附着至亲和色谱基质的抗体接触,所述抗体能够与cd57、cd4或cd8特异性结合,以实现cd57+细胞的阴性选择或cd4+或cd8+细胞的阳性选择。
179.根据实施方案175所述的方法,其中所述基于免疫亲和力的选择是通过以下方式来实现:使细胞与固定在亲和色谱基质上或附着至亲和色谱基质的抗体接触,所述抗体能够与cd57、cd3、cd4或cd8特异性结合,以实现cd57+细胞的阴性选择或cd3、cd4+、cd8+细胞的阳性选择。
180.根据实施方案157、160或161-179中任一项所述的方法,其中在t细胞的工程化的群体或扩增的群体包含阈值数量的t细胞、活t细胞、工程化t细胞或活工程化t细胞或者阈值浓度的t细胞、活t细胞、工程化t细胞或活工程化t细胞的时间或所述时间后,进行所述收获。
181.根据实施方案180中任一项所述的方法,其中在起始刺激后为或约为或约4、5、6或7天内,达到t细胞、活t细胞、工程化t细胞或活工程化t细胞的所述阈值数量或浓度。
182.根据实施方案181中任一项所述的方法,其中在多个工程化t细胞群体或扩增的t细胞群体之间,在所述多个的至少为或约70%、80%、90%或95%中,在起始刺激后为或约为或约5或6天内,达到t细胞、活t细胞、工程化t细胞或活工程化t细胞的所述阈值数量或浓度。
183.根据实施方案180-182中任一项所述的方法,其中在起始刺激后为或约为或约2、3、4或5次群体倍增内,达到t细胞、活t细胞、工程化t细胞或活工程化t细胞的所述阈值数量或浓度。
184.根据实施方案80-118中任一项所述的方法,其中所述工程化的群体或所述扩增的群体包含少于为或约3%、少于为或约2%、少于为或约1%、少于为或约0.1%或少于为或约0.01%cd57+t细胞。
185.根据实施方案128-184中任一项所述的方法,其中所述工程化的群体或所述扩增的群体不含或基本上不含cd57+t细胞。
186.根据实施方案128-185中任一项所述的方法,其中所述工程化的群体或所述扩增的群体中幼稚样细胞的频率是所述群体中所述细胞的至少为或约10%、20%、30%、40%或50%。
187.根据实施方案128-186中任一项所述的方法,其中所述工程化的群体或所述扩增的群体中cd25+t细胞、cd27+t细胞、cd28+t细胞、ccr7+t细胞或cd45ra+t细胞中的一种或多种的频率比为或约所述群体中相应细胞的频率大至少为或约10%、20%、30%、40%或50%。
188.根据实施方案128-187中任一项所述的方法,其中所述工程化的群体或所述扩增的群体包含至少为或约15%、20%、25%、30%、35%或40%cd27+t细胞。
189.根据实施方案128-188中任一项所述的方法,其中所述工程化的群体或所述扩增的群体包含至少为或约10%、15%、20%、25%、25%、30%、35%或40%cd28+t细胞。
190.根据实施方案128-189中任一项所述的方法,其中所述工程化的群体或所述扩增的群体包含至少为或约10%、15%、20%、25%、30%、35%、40%、50%、60%、70%或80%cd27+cd28+t细胞。
191.根据实施方案128-190中任一项所述的方法,其中所述工程化的群体或所述扩增的群体包含至少为或约70%或80%cd27+cd28+t细胞。
192.根据实施方案128-191中任一项所述的方法,其中所述工程化的群体或所述扩增的群体包含至少为或约10%、15%、20%或25%ccr7+t细胞。
193.根据实施方案157、160或161-192中任一项所述的方法,其中收获细胞包括通过冲洗或洗涤所述细胞来去除细胞碎片。
194.根据实施方案157、160或161-193中任一项所述的方法,其中所述收获或收集还包括配制所述细胞用于低温保存或施用至受试者。
195.根据实施方案194所述的方法,其中在药学上可接受的赋形剂的存在下配制所述收获或收集的细胞。
196.根据实施方案194或实施方案195所述的方法,其中配制收获或收集的细胞用于在低温保护剂的存在下进行低温保存。
197.根据实施方案196所述的方法,其中所述低温保护剂包含dmso。
198.根据实施方案129194-197中任一项所述的方法,其中在容器、任选地小瓶或袋子中配制所述收获或收集的细胞。
199.根据实施方案105或119-131中任一项所述的方法,其中在所述收获前进行所述分离。
200.根据实施方案105、119-131或199中任一项所述的方法,其中在所述培育前或期间进行所述分离。
201.根据实施方案105、119-131、199或200中任一项所述的方法,其中在所述引入后进行所述分离。
202.根据实施方案128-201中任一项所述的方法,其中所述重组受体能够与靶抗原结合,所述靶抗原与疾病、障碍或病症相关,为疾病、障碍或病症所特有,和/或在疾病、障碍或病症的细胞或组织上表达。
203.根据实施方案202所述的方法,其中所述疾病、障碍或病症是感染性疾病或障碍、自身免疫性疾病、炎性疾病、或者肿瘤或癌症。
204.根据实施方案202或实施方案203所述的方法,其中所述靶抗原是肿瘤抗原。
205.根据实施方案202-204中任一项所述的方法,其中所述靶抗原选自αvβ6整合素(avb6整合素)、b细胞成熟抗原(bcma)、b7-h3、b7-h6、碳酸酐酶9(ca9,也称为caix或g250)、癌症-睾丸抗原、癌症/睾丸抗原1b(ctag,也称为ny-eso-1和lage-2)、癌胚抗原(cea)、细胞周期蛋白、细胞周期蛋白a2、c-c基序趋化因子配体1(ccl-1)、cd19、cd20、cd22、cd23、cd24、cd30、cd33、cd38、cd44、cd44v6、cd44v7/8、cd123、cd133、cd138、cd171、硫酸软骨素蛋白聚糖4(cspg4)、表皮生长因子蛋白(egfr)、表皮生长因子受体iii型突变体(egfrviii)、上皮糖蛋白2(epg-2)、上皮糖蛋白40(epg-40)、肝配蛋白b2、肝配蛋白受体a2(epha2)、雌激素受体、fc受体样蛋白5(fcrl5;也称为fc受体同源物5或fcrh5)、胎儿乙酰胆碱受体(胎儿achr)、叶酸结合蛋白(fbp)、叶酸受体α、神经节苷脂gd2、o-乙酰化gd2(ogd2)、神经节苷脂gd3、糖蛋白100(gp100)、磷脂酰肌醇蛋白聚糖-3(gpc3)、g蛋白偶联受体5d(gprc5d)、her2/neu(受体酪氨酸激酶erb-b2)、her3(erb-b3)、her4(erb-b4)、erbb二聚体、人高分子量黑色素瘤相关抗原(hmw-maa)、乙型肝炎表面抗原、人白细胞抗原a1(hla-a1)、人白细胞抗原a2(hla-a2)、il-22受体α(il-22rα)、il-13受体α2(il-13rα2)、激酶插入结构域受体(kdr)、κ轻链、l1细胞粘附分子(l1-cam)、l1-cam的ce7表位、含有富亮氨酸重复序列的蛋白8家族成员a(lrrc8a)、路易斯y、黑色素瘤相关抗原(mage)-a1、mage-a3、mage-a6、mage-a10、间皮素(msln)、c-met、鼠类巨细胞病毒(cmv)、粘蛋白1(muc1)、muc16、自然杀伤细胞2族成员d(nkg2d)配体、黑色素a(mart-1)、神经细胞粘附分子(ncam)、癌胚胎抗原、黑色素瘤优先表达抗原(prame)、孕酮受体、前列腺特异性抗原、前列腺干细胞抗原(psca)、前列腺特异性膜抗原(psma)、受体酪氨酸激酶样孤儿受体1(ror1)、存活蛋白、滋养层糖蛋白(tpbg,也称为5t4)、肿瘤相关糖蛋白72(tag72)、酪氨酸酶相关蛋白1(trp1,也称为tyrp1或gp75)、酪氨酸酶相关蛋白2(trp2,也称为多巴色素互变异构酶、多巴色素δ异构酶或dct)、血管内皮生长因子受体(vegfr)、血管内皮生长因子受体2(vegfr2)、肾母细胞瘤1(wt-1)、病原体特异性或病原体表达的抗原、或与通用标签相关的抗原、和/或生物素化分子、和/或由hiv、hcv、hbv或其他病原体表达的分子。
206.根据实施方案202-204中任一项所述的方法,其中所述重组受体是或包含功能性非tcr抗原受体或tcr或其抗原结合片段。
207.根据实施方案202-205中任一项所述的方法,其中所述重组受体是嵌合抗原受体(car)。
208.根据实施方案202-205或207中任一项所述的方法,其中所述重组受体是抗bcmacar。
209.根据实施方案202-205或207中任一项所述的方法,其中所述重组受体是抗cd19car。
210.根据实施方案202-209中任一项所述的方法,其中所述重组受体包含:包含抗原结合结构域、间隔子和/或铰链区的细胞外结构域、跨膜结构域,以及包含共刺激信号传导区的细胞内信号传导结构域。
211.根据实施方案210所述的方法,其中所述细胞外结构域包含含有scfv的抗原结合结构域。
212.根据实施方案210或实施方案211所述的方法,其中所述细胞内信号传导结构域是或包含初级信号传导结构域、能够在t细胞中诱导初级激活信号的信号传导结构域、t细胞受体(tcr)组分的信号传导结构域和/或包含免疫受体酪氨酸激活基序(itam)的信号传导结构域。
213.根据实施方案210-212中任一项所述的方法,其中所述细胞内信号传导结构域是或包含cd3链、任选地cd3-zeta(cd3ζ)链的细胞内信号传导结构域或其信号传导部分。
214.根据实施方案210-213中任一项所述的方法,其中所述共刺激信号传导区包含cd28、4-1bb或icos的细胞内信号传导结构域或其信号传导部分。
215.一种鉴定能够扩增的t细胞群的方法,所述方法包括测量所述群体中cd57+细胞的频率,其中如果cd57+细胞的频率低于阈值频率,则将所述细胞群鉴定为能够扩增。
216.根据实施方案215所述的方法,其中所述阈值频率是少于为或约35%、30%、20%、10%、5%、1%或0.1%的百分比。
217.根据实施方案215或实施方案216所述的方法,其中在促进增殖或扩增的条件下培育的为或约4、5、6、7或8天内,能够扩增的细胞群扩增至少为或约2倍、4倍、8倍或16倍。
218.一种确定t细胞群的扩增能里的方法,所述方法包括测量t细胞群中与cd57表达相关的性状的值,其中如果所述性状的值少于为或约所述性状的阈值,则将所述t细胞群确定为能够扩增。
219.根据实施方案218所述的方法,其中所述阈值:
i)低于多个参考t细胞群中与cd57表达相关的所述性状的平均或中位测量值25%、20%、15%、10%或5%,约25%、20%、15%、10%或5%,或约或约25%内、约或约20%内、约或约15%内、约或约10%内或约或约5%内,和/或比约或约所述平均或中位测量值小低于一个标准差;
ii)低于来自多个参考t细胞群的群体中与cd57表达相关的所述性状的最低测量值,任选地低于所述最低测量值约或约50%内、约或约25%内、约或约20%内、约或约15%内、约或约10%内或者约或约5%内;
iii)低于从来自多个参考t细胞组合物的超过65%、75%、80%、85%的样品计算的与cd57表达相关的所述性状的平均或中位测量值;
其中所述多个参考t细胞群是当在促进t细胞的增殖或扩增的条件下培育时未扩增的多个群体,任选地其中在培育的为或约4、5、6、7或8天内,所述细胞未扩增至少约或约2倍、3倍、4倍或5倍。
220.根据实施方案217-219中任一项所述的方法,其中所述性状是在总t细胞、cd4+t细胞或cd8+t细胞中表达的cd57蛋白的水平或量。
221.根据实施方案217-220中任一项所述的方法,其中所述性状是所述细胞群中存在的cd57+t细胞、cd57+cd4+t细胞或cd57+cd8+t细胞的频率、百分比或量。
222.根据实施方案217-221中任一项所述的方法,其中所述性状是所述细胞群中的总t细胞中存在的cd57mrna的水平或量。
223.根据实施方案217-221中任一项所述的方法,其中所述性状是所述细胞群中的总t细胞、cd4+t细胞或cd8+t细胞中存在的cd57mrna的水平或量。
224.根据实施方案217-221中任一项所述的方法,其中所述性状是编码cd57的基因(b3gat1)的染色质可及性的水平或量。
225.根据实施方案215-224中任一项所述的方法,其中所述方法还包括测量t细胞群中与一种或多种第二基因产物的表达相关的第二性状的第二值,
其中如果所述性状的值少于为或约所述性状的阈值并且如果所述第二性状的第二值大于为或约所述第二性状的第二阈值,则所述群体能够扩增。
226.根据实施方案225所述的方法,其中所述第二基因产物是与幼稚样t细胞相关的标记。
227.根据实施方案225或实施方案226所述的方法,其中所述一种或多种第二基因产物选自cd27、cd28、ccr7或cd45ra。
228.根据实施方案225-227中任一项所述的方法,其中所述一种或多种第二基因产物是cd27和cd28。
229.根据实施方案225-228中任一项所述的方法,其中第二阈值:
i)高于所述多个第二参考t细胞组合物中与所述第二基因的表达相关的性状的平均或中位测量值25%、20%、15%、10%或5%,约25%、20%、15%、10%或5%,或约25%内、约或约20%内、约或约15%内、约或约10%内或约或约5%内,和/或比为或约所述平均或中位测量值大高于一个标准差;
ii)高于来自所述多个参考t细胞组合物的组合物中与所述第二基因的表达相关的所述第二性状的最高测量值,任选地高于所述最高测量值约或约50%内、约或约25%内、约或约20%内、约或约15%内、约或约10%内或者约或约5%内;
iii)低于从来自所述多个参考t细胞组合物的超过65%、75%、80%、85%的样品计算的与所述第二基因的表达相关的性状的平均或中位测量值。
230.根据实施方案225-229中任一项所述的方法,其中所述第二性状是:
(i)总t细胞、cd4+t细胞或cd8+t细胞中存在的所述第二基因编码的多肽的水平或量;
(ii)是总t细胞、cd4+t细胞或cd8+t细胞的表面上存在的所述第二基因编码的多肽的水平或量;
(iii)是如下性状,其是对所述第二基因的表达呈阳性的t细胞、cd4+t细胞或cd8+t细胞的频率、百分比或量;
(iv)是所述t细胞中存在的所述第二基因的mrna的水平或量;或者
(v)是所述第二基因的可及性的水平或量。
231.一种基因工程化t细胞的方法,所述方法包括:
(a)在刺激条件下孵育来自通过根据实施方案215-230中任一项所述的方法鉴定或确定的t细胞群的t细胞,所述刺激条件包括能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域的刺激试剂的存在,从而生成刺激的t细胞;以及
(b)将编码重组受体的异源多核苷酸引入所述刺激的t细胞中,所述引入包括用包含所述异源多核苷酸的病毒载体转导所述刺激的t细胞,从而生成t细胞的工程化的群体。
232.一种细胞组合物,其包含通过根据实施方案1-34中任一项所述的方法产生的缺失的群体的cd57-t细胞。
233.一种细胞组合物,其包含通过根据实施方案1-59中任一项所述的方法产生的缺失的群体的cd57-t细胞。
234.根据实施方案233所述的组合物,其中所述细胞包含cd57-cd4+t细胞。
235.根据实施方案233所述的组合物,其中所述细胞包含cd57-cd8+t细胞。
236.根据实施方案233所述的组合物,其中所述细胞包含cd57-cd3+t细胞。
237.一种富集的cd57-cd4+t细胞的组合物,其包含通过根据实施方案12、13或15-34中任一项所述的方法产生的cd57-cd4+t细胞的富集的群体的cd57-cd4+t细胞。
238.一种富集的cd57-cd8+t细胞的组合物,其包含通过根据实施方案13-34中任一项所述的方法产生的cd57-cd8+t细胞的富集的群体的cd57-cd8+t细胞。
239.一种富集的cd57-cd3+t细胞的组合物,其包含通过根据实施方案20-33中任一项所述的方法产生的cd57-cd3+t细胞的富集的群体的cd57-cd3+t细胞。
240.一种细胞组合物,其包含通过根据实施方案35-127中任一项所述的方法产生的刺激的t细胞的群体。
241.一种组合物,其包含通过根据实施方案128-152中任一项所述的方法产生的t细胞的工程化的群体的细胞。
242.一种组合物,其包含通过根据实施方案153-157、160、161、163-198和202-214中任一项所述的方法产生的t细胞的扩增的群体的细胞。
243.一种组合物,其包含通过根据实施方案215-230中任一项所述的方法鉴定或确定为能够扩增的t细胞群。
244.一种治疗患有或怀疑患有疾病、障碍或病症的受试者的方法,所述方法包括向所述受试者施用一定剂量的t细胞,所述t细胞来自通过根据实施方案130-151中任一项所述的方法产生的工程化t细胞或者通过根据实施方案154-157、160、161、163-198和202-214中任一项所述的方法产生的t细胞的扩增的群体。
245.一种治疗患有或怀疑患有疾病、障碍或病症的受试者的方法,所述方法包括向所述受试者施用一定剂量的t细胞,所述t细胞来自通过根据实施方案128-214中任一项所述的方法产生的工程化t细胞的群体。
246.通过根据实施方案128-152中任一项所述的方法产生的工程化t细胞的群体或者通过根据实施方案153-157、160、161、163-198和202-214中任一项所述的方法产生的t细胞的扩增的群体用于治疗受试者的疾病、障碍或病症的用途。
247.通过根据实施方案128-152中任一项所述的方法产生的工程化t细胞的群体或者通过根据实施方案153-157、160、161、163-198和202-214中任一项所述的方法产生的t细胞的扩增的群体用于制造用于治疗受试者的疾病、障碍或病症的药物的用途。
248.通过根据实施方案135-174中任一项所述的方法产生的工程化t细胞的群体或者根据实施方案232-244中任一项所述的组合物用于治疗受试者的疾病、障碍或病症的用途。
249.通过根据实施方案135-174中任一项所述的方法产生的工程化t细胞的群体用于制造用于治疗受试者的疾病、障碍或病症的药物的用途。
250.根据实施方案232-244中任一项所述的组合物,用于治疗受试者的疾病、障碍或病症。
251.根据实施方案248-250中任一项所述的用途或用于所述用途的组合物,其中所述重组受体,任选地所述car,特异性识别或特异性结合至与所述疾病或病症相关或者在所述疾病或病症的细胞上表达或存在的抗原。
252.根据实施方案248-251中任一项所述的用途或用于所述用途的组合物,其中所述疾病或病症是癌症。
253.根据实施方案248-252中任一项所述的用途或用于所述用途的组合物,其对于所述受试者是自体的。
254.根据实施方案248-253中任一项所述的用途或用于所述用途的组合物,其对于所述受试者是同种异体的。
255.一种制品,其包含:
(i)对cd57、cd3、cd4和/或cd8具有特异性的用于细胞的基于免疫亲和力的选择的一种或多种试剂;以及
(ii)所述一种或多种试剂用于进行根据实施方案1-245中任一项所述的方法的使用说明。
256.一种制品,其包含:
(i)对cd57、cd4和/或cd8具有特异性的用于细胞的基于免疫亲和力的选择的一种或多种试剂;
(ii)能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域的一种或多种刺激试剂;以及
(iii)所述一种或多种试剂用于进行根据实施方案1-245中任一项所述的方法的使用说明。
257.一种制品,其包含:
(i)对cd57以及cd3、cd4和/或cd8中的一种或多种具有特异性的用于细胞的基于免疫亲和力的选择的一种或多种试剂;
(ii)能够激活tcr复合物的一种或多种组分的一个或多个细胞内信号传导结构域和一种或多种共刺激分子的一个或多个细胞内信号传导结构域的一种或多种刺激试剂;以及
(iii)所述一种或多种试剂用于进行根据实施方案1-245中任一项所述的方法的使用说明。
258.根据实施方案255-257中任一项所述的制品,其中用于基于免疫亲和力的选择的所述试剂是或包含能够与cd57、cd4或cd8特异性结合的抗体。
259.根据实施方案255-257中任一项所述的制品,其中用于基于免疫亲和力的选择的所述试剂是或包含能够与cd57、cd3、cd4或cd8特异性结合的抗体。
260.根据实施方案255-259中任一项所述的制品,其中用于基于免疫亲和力的选择的所述试剂是或包含能够与cd57特异性结合的抗体。
261.根据实施方案260所述的制品,其中将所述抗体固定在磁粒上。
262.根据实施方案260所述的制品,其中将所述抗体固定在亲和色谱基质上或附着至亲和色谱基质。
263.根据实施方案256-262中任一项所述的制品,其中所述刺激试剂包含(i)一级药剂,所述一级药剂与tcr复合物的成员特异性结合,任选地与cd3特异性结合,以及(ii)二级药剂,所述二级药剂与t细胞共刺激分子特异性结合,任选地其中所述共刺激分子选自cd28、cd137(4-1-bb)、ox40或icos。
264.根据实施方案263所述的制品,其中所述一级和二级药剂中的一种或两种包含抗体或其抗原结合片段。
265.根据实施方案263或实施方案264所述的制品,其中所述一级和二级药剂包含抗体,任选地其中所述刺激试剂包括与抗cd3抗体和抗cd28抗体或其抗原结合片段一起孵育。
266.根据实施方案263-265中任一项所述的制品,其中所述一级药剂和二级药剂存在于或附着在固体支持物的表面上。
267.根据实施方案266所述的制品,其中所述固体支持物是或包含珠,任选地顺磁珠。
268.根据实施方案263-267中任一项所述的制品,其中所述一级药剂和二级药剂可逆地结合在包含多个链霉亲和素或链霉亲和素突变蛋白分子的寡聚颗粒试剂的表面上。
269.一种制品,其包含:
(i)根据实施方案241或实施方案242所述的组合物;以及
(ii)用于将所述组合物施用至受试者的说明书。
270.一种治疗性t细胞组合物,其包含表达重组受体的cd4+t细胞和表达重组受体的cd8+t细胞,其中所述组合物中至少80%的总受体+/cd8+细胞是cd57-,并且所述组合物中至少80%的总受体+/cd4+细胞是cd57-。
271.根据实施方案270所述的治疗性t细胞组合物,其中所述组合物中至少或至少约80%、至少或至少约85%、至少或至少约90%、至少或至少约95%、至少或至少约96%、至少或至少约97%、至少或至少约98%、至少或至少约99%、约100%或100%的细胞是cd4+t细胞和cd8+t细胞。
272.一种治疗性t细胞组合物,其包含表达重组受体的cd3+t细胞,其中所述组合物中至少80%的总受体+/cd3+细胞是cd57-。
273.根据实施方案272所述的治疗性t细胞组合物,其中所述组合物中至少或至少约80%、至少或至少约85%、至少或至少约90%、至少或至少约95%、至少或至少约96%、至少或至少约97%、至少或至少约98%、至少或至少约99%、约100%或100%的细胞是cd3+t细胞。
274.根据实施方案270-273中任一项所述的治疗性t细胞组合物,其中所述组合物中受体+/cd4+t细胞与受体+/cd8+t细胞的比率在约1:3与约3:1之间。
275.根据实施方案270-274中任一项所述的治疗性t细胞组合物,其中所述组合物中受体+/cd4+t细胞与受体+/cd8+t细胞的比率是为或约1:1。
276.根据实施方案270-275中任一项所述的治疗组合物,其中所述重组蛋白是或包含能够与靶蛋白结合的重组受体,所述靶蛋白与疾病、障碍或病症相关,为疾病、障碍或病症所特有,和/或在疾病、障碍或病症的细胞或组织上表达。
277.根据实施方案270-276中任一项所述的治疗组合物,其中所述重组蛋白是嵌合抗原受体(car)。
278.根据实施方案270-277中任一项所述的治疗组合物,其中所述组合物中活t细胞的数量在为或约10x106个细胞与为或约200x106个细胞之间,任选地其中所述组合物中活t细胞的数量在为或约10x106个细胞与为或约100x106个细胞之间、为或约10x106个细胞与为或约70x106个细胞之间、为或约10x106个细胞与为或约50x106个细胞之间、为或约50x106个细胞与为或约200x106个细胞之间、为或约50x106个细胞与为或约100x106个细胞之间、为或约50x106个细胞与为或约70x106个细胞之间、为或约70x106个细胞与为或约200x106个细胞之间、为或约70x106个细胞与为或约100x106个细胞之间或者为或约100x106个细胞与为或约200x106个细胞之间,每个都包含端值。
279.根据实施方案270-278中任一项所述的治疗组合物,其中所述组合物的体积在1.0ml与10ml之间,包含端值,任选地为或约2ml、为或约3ml、为或约4ml、为或约5ml、为或约6ml、为或约7ml、为或约8ml、为或约9ml或者为或约10ml,或任何前述值之间的任何值。
xi.实施例
本文仅出于说明性目的包括以下实施例,并不意图限制本发明的范围。
实施例1:对工程化t细胞的过程期间的t细胞扩增、细胞活力和细胞周期进入的变异性的评估
从七个示例性供体(供体a-g)获得cd8+t细胞,并且通过涉及刺激、用编码car构建体的慢病毒载体转导和用于扩增的培育的制造过程将其工程化以表达嵌合抗原受体(car),或者使其经历用于刺激和培育的类似过程。评估刺激并培育的细胞的细胞扩增、细胞活力和细胞周期进入。
为了生成工程化细胞组合物,通过基于免疫亲和力的富集从人供体白细胞单采术样品分离cd8+细胞,并进行低温保存。随后使低温保存的细胞组合物解冻,并通过在刺激条件下在抗cd3/抗cd28抗体缀合的顺磁珠和重组细胞因子(例如il-2、il-7和il-15)的存在下将细胞孵育大约24小时来进行刺激。然后用含有编码嵌合抗原受体(car)的核酸的病毒制剂转导来自四个供体(供体d-g)的细胞。转导后,在重组细胞因子(例如il-2、il-7和il-15)的存在下在孵育器中在37摄氏度下培育细胞,并每天补充培养基。来自三个供体(供体a-c)的细胞不经历转导,并且在刺激后在重组细胞因子的存在下进行培育。
在开始刺激后监测细胞的总细胞数长达大约240小时,并且确定随时间变化的倍数扩增。评估活力并将细胞针对指示细胞分裂的标记(ki-67)进行染色,并且在开始刺激后72小时通过流式细胞术加以分析。
如图1a-图1d中所示,在来自不同供体的cd8+t细胞之间观察t细胞扩增(图1a和图1b)、细胞活力(图1c)和细胞周期进入(图1d)的变异性。
实施例2:在细胞制造期间刺激供体来源的细胞后对cd57+和cd57-群体的表征
在示例性细胞制造过程期间对cd57+和cd57-细胞的表型进行表征,以将细胞工程化以表达嵌合抗原受体(car)。
使来自三个示例性供体(供体a-c)的cd8+和cd4+t细胞经历示例性过程,所述示例性过程与实施例1中所述的过程类似,但不进行细胞转导。在即将开始刺激前,以及在刺激期间的各个时间点,在开始刺激后长达大约216小时中,收集细胞样品。将细胞针对各种标记进行染色以供通过流式细胞术加以分析,所述标记包括与激活(cd25和cd69)、增殖能力(cd57)、细胞分裂(ki-67)相关的标记,以及与t细胞分化表型(例如,幼稚样t细胞、效应t(teff)细胞、记忆t细胞、中枢记忆t细胞(tcm)、效应记忆t(tem)细胞、效应记忆rat(temra)细胞)相关的各种表面标记。进行层次聚类分析以评估cd57表达、ki-67表达与t细胞分化表型之间的关联。
如图2a-图2c中所示,cd57+t细胞在开始刺激时存在于所述群体中,并且在刺激和培育期间,所述群体中cd57+细胞的百分比降低(参见图2a和图2b)。在开始刺激后大约48小时,cd57+t细胞的频率降低,这与t细胞扩增和增加的活力大体上一致。在刺激后,基于ki-67的表达,仅cd8+t细胞的子集进入细胞周期。在刺激后,在cd57+细胞之间,ki-67的表达没有显著增加。相比之下,在cd57-细胞之间,ki-67+细胞的百分比显著增加(参见图2a和图2c)。与cd8+细胞区室明显不同,在cd4+细胞之间,cd57+细胞在开始刺激时以低水平存在,并且cd57+细胞的百分比在刺激和培育过程临近结束时增加(图2d)。该结果与如下观察一致:cd8+细胞区室的同质性可能高于cd4+细胞区室。
值得注意,供体来源的组合物展现达到用于收获的示例性阈值细胞数量(收获标准)所需时间的变异性,这与各种免疫表型标记的表达的变异性相对应。一种供体来源的组合物仅需7天的培育时间即可达到收获标准。相比之下,另一种供体来源的组合物需要8天的培育时间才能达到收获标准。对两种供体组合物之间cd57、ki-67、cd45ra和cd27表达的分析(如通过流式细胞术所确定)显示于图2e和图2f中。在时间点t=0开始分析表达,所述时间点表示即将刺激之前的时间。如图2e中所示,在所评估的所有时间点,与需要7天以达到收获标准(“7d至收获”)的供体细胞组合物相比,在需要8天以达到收获标准(“8d至收获”)的供体细胞组合物中观察到显著更更高的cd57表达。如图2f中所示,在所评估的所有时间点,与来自需要8天的组合物的细胞相比,来自需要7天的组合物的细胞展现更高的cd27+cd45ra+频率。在所评估的所有时间点,来自需要8天的组合物的细胞展现显著更低的cd27+细胞频率。这些观察与如下发现一致:在开始材料中展现更高cd27+细胞频率的细胞组合物在培育过程结束时展现更好的扩增和更高的此类细胞的频率。
如图3a中所示,观察到cd57+t细胞在刺激后表达指示激活的标记(cd69和cd25)。cd57+细胞展现与激活相关的表型,并且在整个早期过程阶段期间持续存在。层次聚类分析显示,与cd57-和ki67+细胞(图3c)相比,cd57+和ki67-t细胞展现与分化程度更高的效应细胞群相关的表型特征(图3b)。ki-67+群体主要包括呈cd27+cd28+的细胞,并且ki67-群体富集cd57+细胞并且与cd27-cd28-表型相对应。
所述结果与如下观察一致:虽然能够被刺激,但是cd57+t细胞展现与终末分化程度更高的细胞和降低的增殖能力相关的表型。在一些方面,观察到cd27+t细胞在cart细胞制造过程期间贡献大部分扩增的细胞。相比之下,cd57+t细胞未扩增,并且对最终制造的cart细胞组合物中的细胞贡献最小。在一些方面,细胞群中可能展现降低的增殖能力的cd57+细胞的存在可以在经历t细胞制造过程的细胞群中促进变异和异质性。
实施例3:输入组合物中cd57+细胞的频率以及对细胞扩增、活力、刺激试剂和细胞因子的作用
将含有供体匹配的cd57+和cd57-细胞的输入组合物以特定比率混合并使其经历示例性制造过程。评估细胞组合物的细胞扩增和活力。
通过基于免疫亲和力的富集对cd57+细胞进行阳性选择,从自供体受试者获得的cd8+t细胞的组合物分离cd57+cd8+t细胞和cd57-cd8+t细胞。通过流式细胞术确定所分离群体的纯度。为了评估cd57+t细胞的不同频率对所述制造过程的影响,在刺激前通过混合所分离的cd57+和cd57-群体来生成含有以下频率的cd57+细胞的输入组合物:(1)100%cd57+细胞;(2)75%cd57+细胞;(3)25%cd57+细胞;以及(4)0%cd57+细胞。使不同滴定的输入组合物经历用于car表达细胞的示例性制造过程,所述示例性制造过程与如实施例1中所述的过程类似,包括通过与抗cd3/抗cd28缀合的珠和重组细胞因子一起孵育进行刺激,以及用含有编码car的核酸的病毒制剂进行转导。在开始刺激后监测细胞随时间变化的总细胞数和活力长达大约288小时。在开始刺激后48小时获得细胞培养板的孔的图像,并且在刺激试剂的存在下评估细胞聚簇。在开始刺激后24和48小时评估培养基中il-2的浓度。
如图4a中所示,与含有更低频率的cd57+细胞的输入组合物相比,含有更高频率的cd57+细胞的输入组合物展现更慢的细胞扩增,需要更长的培育时间才能达到用于收获的示例性阈值细胞数量(收获标准),并且展现更低的细胞活力。在含有100%cd57+细胞的组合物中观察到极低或无扩增。通常,观察到输入组合物中cd57+细胞的频率与实现收获标准所需的培养持续时间相关。如图4b中所示,含有更高频率的cd57+细胞的输入组合物还在刺激试剂(抗cd3/抗cd28抗体缀合的顺磁珠)的存在下在48小时形成细胞簇,表明所述细胞对刺激有反应。观察到在开始刺激后24和48小时,与含有更低频率的cd57+细胞的输入组合物的培养物相比,在含有更高频率的cd57+细胞的输入组合物的培养物中,培养基中il-2的浓度更低(图4c)。
所述结果与如下观察一致:输入组合物中cd57+细胞的频率可以影响总细胞扩增和细胞活力。具有更高频率的cd57+细胞的输入组合物需要更长的培育时间才能达到收获标准。在一些方面,观察到能够被刺激并且占据或使用刺激试剂的cd57+细胞消耗培育条件中存在的il-2,并且对培养中的细胞计数数量作出贡献。这表明,在制造过程期间,cd57+细胞的存在可以影响群体中的其他细胞。
实施例4:输入组合物中cd57+细胞的耗尽以及对培养持续时间的作用
使耗尽cd57+细胞的输入组合物经历示例性制造过程,并且评估细胞表型和达到收获标准之前的培育持续时间。
从四个不同的受试者获得cd8+细胞,并将其各自分为两个组。在一个组中,从细胞组合物耗尽cd57+细胞以生成输入组合物(耗尽的),并通过流式细胞术评估纯度。在另一个组中,使用cd8+细胞作为没有耗尽cd57+细胞的输入组合物(未耗尽的)。使耗尽的和未耗尽的输入组合物经历通过病毒转导进行的用于car表达细胞的示例性制造过程,所述示例性制造过程与如实施例1中所述的过程类似,包括通过与抗cd3/抗cd28缀合的珠和重组细胞因子一起孵育进行刺激,用含有编码car的核酸的病毒制剂进行转导,以及在用于扩增的条件下进行培育。在即将开始刺激前,将细胞组合物的样品针对ki67、cd3、cd57、cd27和cd28进行染色。评估耗尽的和未耗尽的培养物达到示例性收获标准的持续时间。收获标准表示细胞的大约10倍扩增。
如图5a中所示,未耗尽的输入组合物展现cd57细胞的变化频率。如图5b中所示,与未耗尽的输入组合物相比,在耗尽的输入组合物之间,cd27+cd28+细胞的频率更高并且更一致。在四个供体的未耗尽的和耗尽的输入组合物之间cd27表达的流量图显示于图5c中。图5c的上图显示,来自四个供体的未耗尽的样品的cd8+t细胞展现变化的cd27表达程度。相比之下,如图5c的下图中所示,从输入组合物耗尽cd8+cd57+细胞改进供体之间的开始材料一致性,如类似的一致性cd27表达所证实。综上所述,这些结果显示在开始供体白细胞单采术样品中供体细胞之间的幼稚样或中枢记忆细胞中的变异性,其可以通过耗尽cd57+细胞而改进。
在开始刺激后72小时,在供体输入组合物中的总cd3+t细胞之间评估ki67(t细胞增殖和生长的标记)的表达。如图5d中所示,如与未耗尽的组合物相比,在耗尽的输入组合物中ki67表达更高。
如图5e中所示,与未耗尽的输入组合物相比,在耗尽的输入组合物之间,培育至收获(从开始刺激至达到收获标准的时间)的持续时间通常更短并且更一致。如通过在刺激后不同天数的总t细胞所评估,来自一个示例性供体的细胞扩增显示于图5f中。结果显示,观察到在刺激后的多个时间点,从耗尽的输入组合物扩增的细胞的总数量高于从未耗尽的输入组合物扩增的细胞的总数量(图5f)。这些发现与如下观察一致:由于更大的分裂细胞和总细胞的数量,耗尽的群体可以展现更短的至收获标准的持续时间。
在用示例性嵌合抗原受体(car)转导耗尽的和未耗尽的细胞后,评估表达car的细胞的百分比。如图5g中所示,耗尽的供体组合物中表达car的细胞的百分比比未耗尽的供体组合物中表达抗cd19car的细胞的百分比更一致。该结果与如下观察一致:耗尽cd57+细胞可以改进t细胞的car表达的一致性。
综上所述,所述结果与如下观察一致:选择性耗尽cd57+细胞改进扩增并缩短达到收获标准所需的培育持续时间。此外,所述发现表明,耗尽cd57+细胞可以降低各种输入组合物之间开始材料中细胞表型(例如cd27+细胞)的变异性。在一些方面,各种输入组合物之间cd57+t细胞的存在和频率的变异性可能影响cart细胞制造过程,并且可能导致培育持续时间和细胞组合物属性的变异性。在一些方面,耗尽输入组合物中的cd57+t细胞可以改进制造的cart细胞组合物的过程控制和一致性。
实施例5:非霍奇金淋巴瘤(nhl)患者的外周血中的cd57+cd8+t细胞频率
评估来自非霍奇金淋巴瘤(nhl)患者的外周血的细胞的cd57+表达以及与t细胞分化表型相关的各种表面标记。
通过基于免疫亲和力的富集来分离临床研究中来自nhl患者的白细胞单采术样品的cd4+和cd8+细胞的单独组合物,并进行低温保存。随后使来自每种分离的细胞组合物的细胞解冻,并且通过在刺激条件下在抗cd3/抗cd28抗体缀合的顺磁珠和重组细胞因子(例如il-2、il-7和il-15)的存在下将所述细胞单独孵育48小时来进行刺激。在开始刺激后48小时,将来自细胞组合物的样品针对各种标记进行染色以供通过流式细胞术进行分析,所述标记包括与连接(cd4和cd8)、增殖能力(cd57)、细胞分裂(ki-67)和t细胞分化表型(例如,幼稚样t细胞、效应t(teff)细胞、记忆t细胞、中枢记忆t(tcm)细胞)相关的标记。进行层次聚类以评估cd57+表达与有关t细胞分化表型的多种标记之间的关联。
如图6a中所示,输入组合物中cd57+细胞的频率在来自不同nhl患者的cd8+细胞之间变化。如图6b中所示,在开始刺激后48小时观察到cd57+cd8+细胞的百分比与ki67+细胞的百分比之间的一般反比关系。如图6c中所示,层次聚类按照记忆和效应t细胞分化表型来区别的簇,并且这些表型簇将具有高或低频率的cd57+t细胞的样品进一步聚类。
对来自供体输入组合物的cd57+细胞的分析揭示,ki67表达在具有不同t细胞分化免疫表型的细胞之间变化。如图6d中所示,表达ki67的活cd57+细胞在cd27-cd45ra+细胞中最低,并且在cd27-cd45ra-细胞、cd27+cd45ra+和cd27+cd45ra-细胞中更高。
分析单独cd4+和cd8+供体细胞组合物中ki67、cd27、cd45ra和cd57的表达。如图6e中所示,大部分cd8+cd57+细胞是cd27-cd45ra+,表明这些t细胞是终末分化的效应记忆ra(temra)t细胞。大部分cd4+cd57+细胞是cd27-cd45ra-,与这些细胞是效应记忆(em)t细胞一致。这些发现表明,cd57+t细胞是各种免疫表型的分化的效应t细胞。
所述结果与nhl受试者的外周循环中cd57+t细胞的可变频率的观察一致。与使用从供体细胞生成的细胞组合物的发现(如先前实施例中所述)类似,观察到高cd57表达与指示具有降低的增殖能力的分化程度更高的细胞的表型相关。
实施例6:倍增数和细胞分化与患者反应的关系
生成含有表达对cd19具有特异性的嵌合抗原受体(car)的自体t细胞的示例性治疗性t细胞组合物。抗cd19car含有源自鼠抗体的抗cd19scfv(源自fmc63的可变区)、免疫球蛋白来源的间隔子、源自cd28的跨膜结构域、源自4-1bb的共刺激区和cd3-ζ细胞内信号传导结构域。
对于用于施用至患有复发性和难治性非霍奇金淋巴瘤(nhl)的受试者的细胞组合物的生成,经由白细胞单采术从所述受试者分离自体细胞。使白细胞单采术样品经历用于生成car表达细胞的过程。所述过程涉及使用自动化洗涤来洗涤细胞和基于免疫亲和的选择来纯化cd4+和cd8+t细胞,从而得到分别富含cd8+(其中中值为99%(四分位距(iqr)98%-100%)的细胞是cd8+)和cd4+(其中中值为99%(iqr99%-100%)的细胞是cd4+)细胞的两种组合物。
将富集cd4+和cd8+组合物的细胞用抗cd3/抗cd28顺磁珠激活,然后使其单独经历用编码具有4-1bb共刺激结构域的抗cd19car的载体进行的慢病毒转导。car含有源自鼠抗体的抗cd19scfv、免疫球蛋白间隔子、源自cd28的跨膜结构域、源自4-1bb的共刺激区和cd3-ζ细胞内信号传导结构域。然后在重组il-2和il-15细胞因子(以及另外的重组il-7用于cd4+t细胞组合物)的存在下单独孵育转导的群体用于细胞扩增。在摇摆运动生物反应器中在用于扩增的条件下进行孵育,直至达到约4倍扩增的阈值。在施用前,将扩增的cd8+和cd4+细胞单独配制并低温保存,并且储存。为了使批次和/或源自不同患者的细胞组合物(如具有不同患者属性的那些)之间指示细胞健康的参数的变化降至最低,在批次之间将细胞以恒定的体积来保持。细胞产物展现活细胞浓度的窄范围(基于对一组受试者的细胞组合物的评估,cd8+:中值为31x106个细胞/ml,iqr为28-40x106个细胞/ml,n=38;cd4+:中值为35x106个细胞/ml,iqr为31-40x106,n=36)。
使用生成的t细胞组合物在如下文所述的患有复发性和难治性非霍奇金淋巴瘤(nhl)的受试者中施用。
a.治疗性t细胞组合物的示例性属性
使用流式细胞术来评估用于在下文所述患有复发性和难治性非霍奇金淋巴瘤(nhl)的受试者中施用的所生成治疗性t细胞组合物ccr7和cd27。还评估用作替代标记的cd4和截短的受体的表面表达水平。
对于生成的每种治疗组合物,还基于细胞的总核计数(tnc),通过以吖啶橙(ao)和碘化丙啶(pi)或dapi进行的双重荧光染色,使用以下公式来确定所生成细胞组合物的倍增数:
图7显示用于产生治疗组合物的过程中的倍增数与cd4+car+细胞中cd27+细胞的百分比之间的关联。对于cd8+t细胞,观察到类似结果。结果显示,通常,在用于生成治疗性t细胞组合物的过程期间较低的倍增数与增加的cd27+细胞的水平相关。不希望受限于理论,所述结果与如下观察一致:用于产生工程化t细胞的过程中增加的cd27+细胞的百分比可能受所述过程中有限的倍增影响。
对基本上与上述相同的过程中扩增步骤期间的过程中接种密度进行建模的研究显示,预期与较低接种密度(例如,0.05x10^6个细胞/ml或更低)相比,相对较高的接种密度(例如,0.35x10^6个细胞/ml或更高)会降低实现收获标准的群体倍增数(图8a)。建模还揭示,预期与较低接种密度或较长过程持续时间相比,相对较高的接种密度(图8b)或较短的过程持续时间(图8c)也会分别导致输出治疗性t细胞组合物(例如,药物产品)中对cd27呈阳性的cd8+car+t细胞的百分比增加。这些数据与如下发现一致:在扩增步骤起始时较高的细胞接种密度或较短过程持续时间可以导致工程化治疗性t细胞组合物中中枢记忆细胞的比例增加。
b.抗cd19car+t细胞组合物的施用
在临床研究中,将上述治疗性car+t细胞组合物施用至患有复发性或难治性(r/r)侵袭性非霍奇金淋巴瘤(nhl)的受试者。具体地,向患有r/rnhl的成年人类受试者群组施用抗cd19car表达t细胞组合物,所述r/rnhl包括从头的或从惰性淋巴瘤转化的(nos)弥漫性大b细胞淋巴瘤(dlbcl)、高级别b细胞淋巴瘤(包括双/三打击)、从慢性淋巴细胞白血病(cll)或边缘区淋巴瘤(mzl)转化的dlbcl、原发性纵膈大b细胞淋巴瘤(pmbcl)和3b级滤泡性淋巴瘤(flg3b)。单独评估完整群组内核心子集的受试者(不包括患有较差体能状态(ecog2)、从边缘区淋巴瘤(mzl)和/或慢性淋巴细胞白血病(cll,里希特氏)转化的dlbcl的那些受试者,并且不包括患有原发性纵隔大b细胞淋巴瘤(pmbcl)和3b级滤泡性淋巴瘤(flg3b)的那些受试者(核心群组))的结果。核心群组包括如下受试者:患有dlbcl(nos)和转化的滤泡性淋巴瘤(tfl),或者高级别b细胞淋巴瘤(双/三打击)或具有myc和bcl2和/或bcl6重排与dlbcl组织学的高级别b细胞淋巴瘤(双/三打击),且东部肿瘤协作组体能状态(ecogps)为0或1。这个实施例中呈现的所述时间点的分析是基于对完整群组中已经施用抗cd19car表达细胞的总计91名受试者(88名(65名来自核心群组)针对反应进行评估,且91名(67名来自核心群组)针对安全性进行评估)的评估。
在静脉内施用之前,将含有抗cd19car表达细胞的低温保存的细胞组合物解冻。通过施用以大约1:1的目标比率单独施用的配制的cd4+car+细胞群和配制的cd8+car+群体,将治疗性t细胞剂量作为限定的细胞组合物来施用。向受试者施用car表达t细胞的单剂量或双剂量(每个单剂量通过分别单独输注cd4+car表达t细胞和cd8+car表达t细胞来施用),如下:剂量水平1(dl1)的单剂量含有5x107个总car表达t细胞,或者剂量水平2(dl2)的单剂量含有1x108个总car表达t细胞。在一些情况下,向受试者施用dl1的双剂量,其中每个剂量相隔大约十四(14)天施用,在第1天和第14天施用,包括由于给药错误无意间按照双剂量时间表接受了两个dl2剂量的一名受试者。以dl1和dl2施用的组合物的t细胞子集的剂量水平和目标数量示于表e1中。在核心群组中,向34名受试者施用dl1,并且向27名受试者施用dl2。
表e2显示了在两个剂量水平下完整群组和核心群组的总体反应和安全性结果。客观反应率(orr)为74%,包括52%显示完全反应(cr)的受试者。任何等级的细胞因子释放综合征(crs)的发生率为35%,其中有1%严重crs;并且任何等级的神经毒性(nt)的发生率为19%,其中有1%严重nt。
a四名以dl1d(剂量水平1,双剂量时间表)治疗的患者具有类似结果。
b包括具有pd、死亡或28天重分期扫描事件的患者。一名患者未能进行重分期扫描。
c包括在数据快照日期前28天已接受至少一个剂量的合规car表达细胞产物或者死亡的所有受试者。
c.抗cd19car表达t细胞的细胞属性与反应之间的关联
评估治疗组合物中car+t细胞的某些表型属性与有关临床反应结果的参数之间的关系。组合物中的记忆表型与功能之间的相关性被转换为中枢记忆子集组合物与所观察到的car+细胞的峰值体内扩增(ρ=0.42,p=0.002)和无进展存活期(pfs)(卡普兰-迈耶存活期估计,p=0.0164)之间的正相关性。图9a至图9d显示被施用car+t细胞组合物的受试者的卡普兰-迈耶存活曲线,将所述受试者分为施用含有在cd4+car+t细胞中(图9a关于无进展存活期,图9c关于反应持续时间)和在cd8+car+t细胞中(图9b关于无进展存活期,图9d关于反应持续时间)频率高于或低于某个阈值水平的ccr7+cd27+car+t细胞的组合物的组。观察到组合物中ccr7+cd27+记忆细胞的更高频率与更长的无进展存活期相关联。
单变量分析揭示了在用于产生治疗性t细胞组合物的过程期间的t细胞群倍增(pdl)与非霍奇金淋巴瘤(nhl)患者中无进展存活(pfs)的概率之间的负相关性。图10显示对于在cd8+/car+t细胞中具有“高”(>6pdl)或“低”(<6pdl)pdl数的患者,基于最佳分割对数秩检验的pfs曲线。该结果与如下发现一致:在用于产生治疗性t细胞组合物的过程中可能限制t细胞的群体倍增数的因素可以提高受试者展现持久无进展存活的可能性。
实施例7:对用于产生治疗性细胞组合物的过程中的选择的(输入)细胞组合物的特征的评估。
评估在通过实施例6中所述的过程用抗cd19car工程化之前从患有复发性和难治性非霍奇金淋巴瘤(nhl)的受试者选择的t细胞的表型属性。通过基于免疫亲和力的富集从来自多名受试者的人外周血单核细胞(pbmc)的白细胞单采术选择cd4+和cd8+t细胞。评估此类所选t细胞的组合物(在基因工程化之前,命名为“工程化前组合物”)中指示某些t细胞亚型(如效应记忆或中枢记忆细胞亚型)的细胞表面标记(包括c-c趋化因子受体7型(ccr7)、cd27和cd45ra)的表达。还评估cd4或cd8的表面表达。
对富集的cd4+和cd8+组合物(例如,输入组合物)的评估揭示,对如存在于中枢记忆t细胞子集上的幼稚样标记呈阳性的t细胞(例如cd27+cd28+t细胞)的百分比在nhl患者之间高度可变(图11)。这些数据表明,在用于生成car+t细胞治疗性t细胞组合物的选择的(输入)t细胞组合物中存在中枢记忆t细胞子集的患者间t细胞异质性。
基本上如实施例6中所述使用选择的(输入)t细胞组合物来生成cd4+和cd8+治疗性t细胞组合物。还如实施例6中所述基于细胞的总核计数(tnc)来确定生成的细胞组合物的倍增数。确定选择的(输入)t细胞组合物中细胞的表型属性与用于产生治疗组合物的过程中的倍增数之间的相关性。如图12中所示,富集的cd4+(输入)组合物中依照针对cd45ra和ccr7的阴性染色(cd45ra-ccr7-)鉴定的效应记忆cd4+t细胞的较高百分比与治疗性t细胞组合物的产生期间的群体倍增数正相关。对于cd8+t细胞,观察到类似结果。
上文结果支持如下方式:其包括在用于产生工程化t细胞组合物的过程中使用的输入组合物中降低效应记忆t细胞的百分比和/或富集对幼稚样或中枢记忆细胞子集的标记呈阳性的t细胞。与上文结果一致,这种方式可以改进工程化治疗性t细胞组合物的一种或多种特征,如降低患者间变异性,降低用于产生工程化治疗性t细胞组合物的过程中的群体倍增数,和/或增加受试者可以展现持久pfs的可能性。
实施例8:非扩增和扩增工程化过程的动力学
通过多种制造过程用嵌合抗原受体(car)将人t细胞(cd4+和cd8+)工程化,所述制造过程包括不包括用于扩增的培育步骤的过程(非扩增群组)和包括用于扩增的培育步骤的过程(扩增群组)。对在通过各种过程进行的制造运行期间和之后产生的细胞进行综合分析。用于产生工程化t细胞组合物的制造运行包括如实施例8中所述的大规模(at-scale)运行以及如下文所述的过程。所述制造运行还包括规模缩小(scale-down)模型(sdm),所述模型与所述制造运行基本上相同,但其中在用于工程化细胞的过程中使用更低数量的t细胞。通常,规模缩小制造运行共享表e3中所述的过程活动。
在所分析的过程中,用抗cd19car或抗bcmacar将t细胞工程化。示例性抗cd19car含有源自鼠抗体fmc63的抗cd19scfv、免疫球蛋白间隔子、源自cd28的跨膜结构域、源自4-1bb的共刺激区和cd3-ζ细胞内信号传导结构域。载体还编码截短的受体分子,所述截短的受体分子用作car表达的替代标记并且通过t2a序列与car构建体隔开。示例性抗bcmacar含有对bcma具有特异性的scfv抗原结合结构域、cd28跨膜区、4-1bb共刺激信号传导区和cd3-ζ来源的细胞内信号传导结构域。载体还编码截短的受体分子,所述截短的受体分子用作car表达的替代标记并且通过t2a序列与car构建体隔开。
所述过程包括用抗cd3/抗cd28顺磁珠或用抗cd3/抗cd28fab缀合的寡聚链霉亲和素突变蛋白试剂刺激t细胞。所述寡聚试剂含有命名为
在制造运行期间的不同时间和结束时收集细胞,并且在用识别表面标记(包括cd4、cd8、ccr7、cd27和cd45ra)的抗体染色后通过流式细胞术对其进行计数,并评估所述细胞的活力。
a.t细胞工程化过程
比较使用不同非扩增过程产生的t细胞组合物,所述非扩增过程在多种特征方面不同,所述特征包括细胞的开始来源(低温保存的单采术或新鲜单采术)、寡聚刺激试剂的浓度和用于刺激的细胞数量。还产生t细胞组合物,其中进一步培育细胞以供扩增。对健康供体或对患者供体进行所述过程。
1.非扩增过程
从人供体收集白细胞单采术样品并洗涤。通过基于免疫亲和力的选择从没有被低温保存的白细胞单采术样品直接选择cd4+和cd8+细胞。在选择后,将单独cd4+和cd8+t细胞组合物低温保存,然后解冻,然后将选择的cd4+和cd8+t细胞以1:1的活cd4+t细胞与活cd8+t细胞的比率混合以产生输入组合物。通过与每1x106个细胞0.8μg如上文在此实施例中所述生成的抗cd3/抗cd28fab缀合的寡聚链霉亲和素突变蛋白试剂一起孵育,刺激来自混合的输入细胞组合物的约600x106个细胞(约300x106个cd4+和300x106个cd8+)。所述刺激在无血清完全培养基中进行18-30小时(24±6小时),所述无血清完全培养基含有基础培养基(例如,ctstmoptmizer基础培养基,thermofisher)、t细胞补充剂(例如,2.6%
在旋转接种后,将细胞洗涤并以高达约0.75x106个细胞/ml的密度重悬于含有2mm谷氨酰胺但不添加重组细胞因子的基础培养基(例如,ctstmoptmizer基础培养基,thermofisher)中,并且在约37.0℃下在孵育器中进行孵育。在起始刺激后约48小时±6小时后(在开始孵育后约24小时),添加1.0mmd-生物素并与细胞混合,以将抗cd3和抗cd28fab试剂从寡聚链霉亲和素试剂解离。将细胞再孵育另外约48小时(在起始刺激后约96小时±6小时或直至过程的第5天),然后用低温保护剂进行配制。
在另一过程中,从人供体收集白细胞单采术样品,洗涤并低温保存。使低温保存的白细胞单采术样品解冻,并且通过基于免疫亲和力的选择从每个样品选择cd4+和cd8+细胞的单独组合物,然后将cd4+和cd8+t细胞混合,目的是产生多达约900x106个活cd4+和cd8+t细胞的输入组合物,其中活cd4+t细胞与活cd8+t细胞的比率是变化的。通过与每1x106个细胞1.2μg如上文在此实施例中所述生成的抗cd3/抗cd28fab缀合的寡聚链霉亲和素突变蛋白试剂(其中1.2μg寡聚刺激试剂包括0.9μg寡聚颗粒和0.15μg抗cd3fab和0.15μg抗cd28fab)一起孵育,刺激混合的输入细胞组合物。将所述刺激在上述相同的无血清完全培养基中进行16-24小时之间(20±4小时)。在刺激后,通过用编码car(在此情况下是上述相同的示例性抗bcmacar或示例性抗cd19car)的慢病毒载体旋转接种来转导多达约600x106个细胞。在此研究中,与较高浓度的寡聚链霉亲和素突变蛋白试剂一起孵育的细胞展现改进的转导效率(数据未显示)。在此过程中旋转接种后,将细胞洗涤并以0.75x106个细胞/ml的密度重悬于含有2mm谷氨酰胺和2.6%t细胞补充剂(例如2.6%
2.扩增过程
在一种过程中,通过上述非扩增过程将抗cd19cart细胞工程化。
在另一过程中,从人白细胞单采术样品选择cd4+和cd8+细胞的单独组合物并将其低温冷冻。随后使选择的细胞组合物解冻并以1:1的活cd4+t细胞与活cd8+t细胞的比率混合。在附着有抗cd3和抗cd28抗体的顺磁性聚苯乙烯包被的珠以1:1的珠与细胞的比率的存在下,在含有重组il-2、il-7和il-15的无血清培养基中,将混合组合物的大约300x106个t细胞(150x106个cd4和150x106个cd8+t细胞)刺激18至30小时之间。在所述孵育后,将来自刺激的细胞组合物的大约100x106个活细胞在含有重组il-2、il-7和il-15的无血清培养基中浓缩。通过用编码示例性car(在此情况下是上述示例性抗bcmacar)的慢病毒载体以大约1600g旋转接种60分钟来转导细胞。在旋转接种后,将细胞重悬于含有重组il-2、il-7和il-15的无血清培养基中,并且在约37℃下孵育约18至30小时。然后,通过转移到生物反应器(例如摇摆运动生物反应器)中的约500ml示例性无血清培养基中来培育细胞以进行扩增,所述无血清培养基含有两倍于在孵育和转导步骤期间所用的浓度的il-2、il-7和il-15。当实现设定的活细胞密度时,起始灌注,其中在持续混合下通过半连续灌注更换培养基。第二天在生物反应器中培育细胞,直至实现约3x106个细胞/ml的阈值细胞密度为止,这通常发生在涉及6-7天扩增的过程中。通过暴露于磁场从细胞组合物去除抗cd3和抗cd28抗体缀合的顺磁珠。然后收集细胞,进行配制并低温保存。
b.过程度量
在制造运行期间监测过程度量,如总活细胞(图13a)和活力(图13b)。如图13a中所示,在第5天时间点观察到细胞的最小扩增,且稳健扩增在第5天之后开始。图13b显示制造运行中的细胞活力最初下降,并在所述过程的第5天之后随着细胞开始扩增而开始增加。
在制造运行中的不同时间点比较记忆/分化表型的结果显示于图13c(依据cd5ra和ccr7表达)和图13d(依据cd27和ccr7表达)中。如图所示,对制造运行期间早期的细胞的评估显示,与所述过程中的更早时间(例如第1天或第2天)或所述过程中的更晚时间(例如第9天)两者的细胞相比,约第5天的细胞显著更多地富集分化程度更低的细胞类型,如ccr7+cd45ra-或ccr7+cd27+细胞。在制造过程的持续时间中分析cd57+细胞的数量。如图14中所示,在制造过程的过程中cd8+cd57+细胞的数量降低,而cd4+cd57+细胞的数量始终保持较低。
本发明的范围并不意图受限于具体公开的实施方案,所提供的实施方案例如是为了说明本发明的各个方面。根据本文的描述和传授,对所述组合物和方法的各种修改将变得清楚。此类变化可以在不背离本公开文本的真实范围和精神的情况下实践,并且旨在落入本公开文本的范围内。
序列
序列表
<110>朱诺治疗学股份有限公司
<120>产生基因工程化细胞的方法
<130>735042017640
<140>尚未分配
<141>同时随同提交
<150>62/756,571
<151>2018-11-06
<150>62/798,457
<151>2019-01-29
<160>98
<170>patentin3.5版
<210>1
<211>12
<212>prt
<213>人工序列
<220>
<221>尚未归类的特征
<223>间隔子(igg4铰链)
<400>1
gluserlystyrglyproprocysproprocyspro
1510
<210>2
<211>36
<212>dna
<213>人工序列
<220>
<221>尚未归类的特征
<223>间隔子(igg4铰链)
<400>2
gaatctaagtacggaccgccctgccccccttgccct36
<210>3
<211>119
<212>prt
<213>人工序列
<220>
<221>尚未归类的特征
<223>铰链-ch3间隔子
<400>3
gluserlystyrglyproprocysproprocysproglyglnproarg
151015
gluproglnvaltyrthrleuproproserglngluglumetthrlys
202530
asnglnvalserleuthrcysleuvallysglyphetyrproserasp
354045
ilealavalglutrpgluserasnglyglnprogluasnasntyrlys
505560
thrthrproprovalleuaspseraspglyserphepheleutyrser
65707580
argleuthrvalasplysserargtrpglngluglyasnvalpheser
859095
cysservalmethisglualaleuhisasnhistyrthrglnlysser
100105110
leuserleuserleuglylys
115
<210>4
<211>229
<212>prt
<213>人工序列
<220>
<221>尚未归类的特征
<223>铰链-ch2-ch3-间隔子
<400>4
gluserlystyrglyproprocysproprocysproalaprogluphe
151015
leuglyglyproservalpheleupheproprolysprolysaspthr
202530
leumetileserargthrprogluvalthrcysvalvalvalaspval
354045
serglngluaspprogluvalglnpheasntrptyrvalaspglyval
505560
gluvalhisasnalalysthrlysproargglugluglnpheasnser
65707580
thrtyrargvalvalservalleuthrvalleuhisglnasptrpleu
859095
asnglylysglutyrlyscyslysvalserasnlysglyleuproser
100105110
serileglulysthrileserlysalalysglyglnproargglupro
115120125
glnvaltyrthrleuproproserglngluglumetthrlysasngln
130135140
valserleuthrcysleuvallysglyphetyrproseraspileala
145150155160
valglutrpgluserasnglyglnprogluasnasntyrlysthrthr
165170175
proprovalleuaspseraspglyserphepheleutyrserargleu
180185190
thrvalasplysserargtrpglngluglyasnvalphesercysser
195200205
valmethisglualaleuhisasnhistyrthrglnlysserleuser
210215220
leuserleuglylys
225
<210>5
<211>282
<212>prt
<213>人工序列
<220>
<221>尚未归类的特征
<223>igd-铰链-fc
<400>5
argtrpprogluserprolysalaglnalaserservalprothrala
151015
glnproglnalagluglyserleualalysalathrthralaproala
202530
thrthrargasnthrglyargglyglygluglulyslyslysglulys
354045
glulysglugluglnglugluarggluthrlysthrproglucyspro
505560
serhisthrglnproleuglyvaltyrleuleuthrproalavalgln
65707580
aspleutrpleuargasplysalathrphethrcysphevalvalgly
859095
seraspleulysaspalahisleuthrtrpgluvalalaglylysval
100105110
prothrglyglyvalglugluglyleuleugluarghisserasngly
115120125
serglnserglnhisserargleuthrleuproargserleutrpasn
130135140
alaglythrservalthrcysthrleuasnhisproserleupropro
145150155160
glnargleumetalaleuarggluproalaalaglnalaprovallys
165170175
leuserleuasnleuleualaserseraspproproglualaalaser
180185190
trpleuleucysgluvalserglypheserproproasnileleuleu
195200205
mettrpleugluaspglnarggluvalasnthrserglyphealapro
210215220
alaargproproproglnproglyserthrthrphetrpalatrpser
225230235240
valleuargvalproalaproproserproglnproalathrtyrthr
245250255
cysvalvalserhisgluaspserargthrleuleuasnalaserarg
260265270
serleugluvalsertyrvalthrasphis
275280
<210>6
<211>24
<212>prt
<213>人工序列
<220>
<223>t2a
<400>6
leugluglyglyglygluglyargglyserleuleuthrcysglyasp
151015
valglugluasnproglyproarg
20
<210>7
<211>357
<212>prt
<213>人工序列
<220>
<223>tegfr
<400>7
metleuleuleuvalthrserleuleuleucysgluleuprohispro
151015
alapheleuleuileproarglysvalcysasnglyileglyilegly
202530
gluphelysaspserleuserileasnalathrasnilelyshisphe
354045
lysasncysthrserileserglyaspleuhisileleuprovalala
505560
pheargglyaspserphethrhisthrproproleuaspproglnglu
65707580
leuaspileleulysthrvallysgluilethrglypheleuleuile
859095
glnalatrpprogluasnargthraspleuhisalaphegluasnleu
100105110
gluileileargglyargthrlysglnhisglyglnpheserleuala
115120125
valvalserleuasnilethrserleuglyleuargserleulysglu
130135140
ileseraspglyaspvalileileserglyasnlysasnleucystyr
145150155160
alaasnthrileasntrplyslysleupheglythrserglyglnlys
165170175
thrlysileileserasnargglygluasnsercyslysalathrgly
180185190
glnvalcyshisalaleucysserprogluglycystrpglyproglu
195200205
proargaspcysvalsercysargasnvalserargglyargglucys
210215220
valasplyscysasnleuleugluglygluproarggluphevalglu
225230235240
asnserglucysileglncyshisproglucysleuproglnalamet
245250255
asnilethrcysthrglyargglyproaspasncysileglncysala
260265270
histyrileaspglyprohiscysvallysthrcysproalaglyval
275280285
metglygluasnasnthrleuvaltrplystyralaaspalaglyhis
290295300
valcyshisleucyshisproasncysthrtyrglycysthrglypro
305310315320
glyleugluglycysprothrasnglyprolysileproserileala
325330335
thrglymetvalglyalaleuleuleuleuleuvalvalalaleugly
340345350
ileglyleuphemet
355
<210>8
<211>27
<212>prt
<213>智人(homosapiens)
<220>
<221>尚未归类的特征
<223>cd28
<300>
<308>p10747
<309>1989-07-01
<313>(153)..(179)
<400>8
phetrpvalleuvalvalvalglyglyvalleualacystyrserleu
151015
leuvalthrvalalapheileilephetrpval
2025
<210>9
<211>66
<212>prt
<213>智人(homosapiens)
<220>
<221>尚未归类的特征
<223>cd28
<300>
<308>p10747
<309>1989-07-01
<313>(114)..(179)
<400>9
ilegluvalmettyrproproprotyrleuaspasnglulysserasn
151015
glythrileilehisvallysglylyshisleucysproserproleu
202530
pheproglyproserlysprophetrpvalleuvalvalvalglygly
354045
valleualacystyrserleuleuvalthrvalalapheileilephe
505560
trpval
65
<210>10
<211>41
<212>prt
<213>智人(homosapiens)
<220>
<221>尚未归类的特征
<223>cd28
<300>
<308>p10747
<309>1989-07-01
<313>(180)..(220)
<400>10
argserlysargserargleuleuhisserasptyrmetasnmetthr
151015
proargargproglyprothrarglyshistyrglnprotyralapro
202530
proargaspphealaalatyrargser
3540
<210>11
<211>41
<212>prt
<213>智人(homosapiens)
<220>
<221>尚未归类的特征
<223>cd28(ll至gg)
<400>11
argserlysargserargglyglyhisserasptyrmetasnmetthr
151015
proargargproglyprothrarglyshistyrglnprotyralapro
202530
proargaspphealaalatyrargser
3540
<210>12
<211>42
<212>prt
<213>智人(homosapiens)
<220>
<221>尚未归类的特征
<223>4-1bb
<300>
<308>q07011.1
<309>1995-02-01
<313>(214)..(255)
<400>12
lysargglyarglyslysleuleutyrilephelysglnprophemet
151015
argprovalglnthrthrglnglugluaspglycyssercysargphe
202530
proglugluglugluglyglycysgluleu
3540
<210>13
<211>112
<212>prt
<213>智人(homosapiens)
<220>
<221>尚未归类的特征
<223>cd3ζ
<400>13
argvallyspheserargseralaaspalaproalatyrglnglngly
151015
glnasnglnleutyrasngluleuasnleuglyargarggluglutyr
202530
aspvalleuasplysargargglyargaspproglumetglyglylys
354045
proargarglysasnproglngluglyleutyrasngluleuglnlys
505560
asplysmetalaglualatyrsergluileglymetlysglygluarg
65707580
argargglylysglyhisaspglyleutyrglnglyleuserthrala
859095
thrlysaspthrtyraspalaleuhismetglnalaleuproproarg
100105110
<210>14
<211>112
<212>prt
<213>智人(homosapiens)
<220>
<221>尚未归类的特征
<223>cd3ζ
<400>14
argvallyspheserargseralagluproproalatyrglnglngly
151015
glnasnglnleutyrasngluleuasnleuglyargarggluglutyr
202530
aspvalleuasplysargargglyargaspproglumetglyglylys
354045
proargarglysasnproglngluglyleutyrasngluleuglnlys
505560
asplysmetalaglualatyrsergluileglymetlysglygluarg
65707580
argargglylysglyhisaspglyleutyrglnglyleuserthrala
859095
thrlysaspthrtyraspalaleuhismetglnalaleuproproarg
100105110
<210>15
<211>112
<212>prt
<213>智人(homosapiens)
<220>
<221>尚未归类的特征
<223>cd3ζ
<400>15
argvallyspheserargseralaaspalaproalatyrlysglngly
151015
glnasnglnleutyrasngluleuasnleuglyargarggluglutyr
202530
aspvalleuasplysargargglyargaspproglumetglyglylys
354045
proargarglysasnproglngluglyleutyrasngluleuglnlys
505560
asplysmetalaglualatyrsergluileglymetlysglygluarg
65707580
argargglylysglyhisaspglyleutyrglnglyleuserthrala
859095
thrlysaspthrtyraspalaleuhismetglnalaleuproproarg
100105110
<210>16
<211>335
<212>prt
<213>人工序列
<220>
<221>尚未归类的特征
<223>tegfr
<400>16
arglysvalcysasnglyileglyileglygluphelysaspserleu
151015
serileasnalathrasnilelyshisphelysasncysthrserile
202530
serglyaspleuhisileleuprovalalapheargglyaspserphe
354045
thrhisthrproproleuaspproglngluleuaspileleulysthr
505560
vallysgluilethrglypheleuleuileglnalatrpprogluasn
65707580
argthraspleuhisalaphegluasnleugluileileargglyarg
859095
thrlysglnhisglyglnpheserleualavalvalserleuasnile
100105110
thrserleuglyleuargserleulysgluileseraspglyaspval
115120125
ileileserglyasnlysasnleucystyralaasnthrileasntrp
130135140
lyslysleupheglythrserglyglnlysthrlysileileserasn
145150155160
argglygluasnsercyslysalathrglyglnvalcyshisalaleu
165170175
cysserprogluglycystrpglyprogluproargaspcysvalser
180185190
cysargasnvalserargglyargglucysvalasplyscysasnleu
195200205
leugluglygluproarggluphevalgluasnserglucysilegln
210215220
cyshisproglucysleuproglnalametasnilethrcysthrgly
225230235240
argglyproaspasncysileglncysalahistyrileaspglypro
245250255
hiscysvallysthrcysproalaglyvalmetglygluasnasnthr
260265270
leuvaltrplystyralaaspalaglyhisvalcyshisleucyshis
275280285
proasncysthrtyrglycysthrglyproglyleugluglycyspro
290295300
thrasnglyprolysileproserilealathrglymetvalglyala
305310315320
leuleuleuleuleuvalvalalaleuglyileglyleuphemet
325330335
<210>17
<211>18
<212>prt
<213>人工序列
<220>
<223>t2a
<400>17
gluglyargglyserleuleuthrcysglyaspvalglugluasnpro
151015
glypro
<210>18
<211>22
<212>prt
<213>人工序列
<220>
<223>p2a
<400>18
glyserglyalathrasnpheserleuleulysglnalaglyaspval
151015
glugluasnproglypro
20
<210>19
<211>19
<212>prt
<213>人工序列
<220>
<223>p2a
<400>19
alathrasnpheserleuleulysglnalaglyaspvalglugluasn
151015
proglypro
<210>20
<211>20
<212>prt
<213>人工序列
<220>
<223>e2a
<400>20
glncysthrasntyralaleuleulysleualaglyaspvalgluser
151015
asnproglypro
20
<210>21
<211>22
<212>prt
<213>人工序列
<220>
<223>f2a
<400>21
vallysglnthrleuasnpheaspleuleulysleualaglyaspval
151015
gluserasnproglypro
20
<210>22
<211>10
<212>prt
<213>人工序列
<220>
<223>接头
<220>
<221>重复
<222>(5)..(9)
<223>sgggg重复5次
<220>
<221>尚未归类的特征
<222>(5)..(9)
<223>其中p是脯氨酸,g是甘氨酸并且s是丝氨酸
<400>22
proglyglyglyserglyglyglyglypro
1510
<210>23
<211>17
<212>prt
<213>人工序列
<220>
<223>接头
<400>23
glyseralaaspaspalalyslysaspalaalalyslysaspglylys
151015
ser
<210>24
<211>66
<212>dna
<213>人工序列
<220>
<223>gmcsfrα链信号序列
<400>24
atgcttctcctggtgacaagccttctgctctgtgagttaccacacccagcattcctcctg60
atccca66
<210>25
<211>22
<212>prt
<213>人工序列
<220>
<223>gmcsfrα链信号序列
<400>25
metleuleuleuvalthrserleuleuleucysgluleuprohispro
151015
alapheleuleuilepro
20
<210>26
<211>18
<212>prt
<213>人工序列
<220>
<223>cd8α信号肽
<400>26
metalaleuprovalthralaleuleuleuproleualaleuleuleu
151015
hisala
<210>27
<211>15
<212>prt
<213>人工序列
<220>
<223>铰链
<400>27
gluprolyssercysasplysthrhisthrcysproprocyspro
151015
<210>28
<211>12
<212>prt
<213>人工序列
<220>
<223>铰链
<400>28
gluarglyscyscysvalglucysproprocyspro
1510
<210>29
<211>61
<212>prt
<213>人工序列
<220>
<223>铰链
<400>29
gluleulysthrproleuglyaspthrhisthrcysproargcyspro
151015
gluprolyssercysaspthrproproprocysproargcysproglu
202530
prolyssercysaspthrproproprocysproargcysproglupro
354045
lyssercysaspthrproproprocysproargcyspro
505560
<210>30
<211>12
<212>prt
<213>人工序列
<220>
<223>铰链
<400>30
gluserlystyrglyproprocysprosercyspro
1510
<210>31
<211>5
<212>prt
<213>人工序列
<220>
<223>铰链
<220>
<221>变体
<222>(1)..(1)
<223>xaa是甘氨酸、半胱氨酸或精氨酸
<220>
<221>变体
<222>(4)..(4)
<223>xaa是半胱氨酸或苏氨酸
<400>31
xaaproproxaapro
15
<210>32
<211>9
<212>prt
<213>人工序列
<220>
<223>铰链
<400>32
tyrglyproprocysproprocyspro
15
<210>33
<211>10
<212>prt
<213>人工序列
<220>
<223>铰链
<400>33
lystyrglyproprocysproprocyspro
1510
<210>34
<211>14
<212>prt
<213>人工序列
<220>
<223>铰链
<400>34
gluvalvalvallystyrglyproprocysproprocyspro
1510
<210>35
<211>11
<212>prt
<213>人工序列
<220>
<223>cdrl1
<400>35
argalaserglnaspileserlystyrleuasn
1510
<210>36
<211>7
<212>prt
<213>人工序列
<220>
<223>cdrl2
<400>36
serargleuhisserglyval
15
<210>37
<211>9
<212>prt
<213>人工序列
<220>
<223>cdrl3
<400>37
glyasnthrleuprotyrthrphegly
15
<210>38
<211>5
<212>prt
<213>人工序列
<220>
<223>cdrh1
<400>38
asptyrglyvalser
15
<210>39
<211>16
<212>prt
<213>人工序列
<220>
<223>cdrh2
<400>39
valiletrpglysergluthrthrtyrtyrasnseralaleulysser
151015
<210>40
<211>7
<212>prt
<213>人工序列
<220>
<223>cdrh3
<400>40
tyralametasptyrtrpgly
15
<210>41
<211>120
<212>prt
<213>人工序列
<220>
<223>vh
<400>41
gluvallysleuglngluserglyproglyleuvalalaprosergln
151015
serleuservalthrcysthrvalserglyvalserleuproasptyr
202530
glyvalsertrpileargglnproproarglysglyleuglutrpleu
354045
glyvaliletrpglysergluthrthrtyrtyrasnseralaleulys
505560
serargleuthrileilelysaspasnserlysserglnvalpheleu
65707580
lysmetasnserleuglnthraspaspthralailetyrtyrcysala
859095
lyshistyrtyrtyrglyglysertyralametasptyrtrpglygln
100105110
glythrservalthrvalserser
115120
<210>42
<211>107
<212>prt
<213>人工序列
<220>
<223>vl
<400>42
aspileglnmetthrglnthrthrserserleuseralaserleugly
151015
aspargvalthrilesercysargalaserglnaspileserlystyr
202530
leuasntrptyrglnglnlysproaspglythrvallysleuleuile
354045
tyrhisthrserargleuhisserglyvalproserargphesergly
505560
serglyserglythrasptyrserleuthrileserasnleuglugln
65707580
gluaspilealathrtyrphecysglnglnglyasnthrleuprotyr
859095
thrpheglyglyglythrlysleugluilethr
100105
<210>43
<211>245
<212>prt
<213>人工序列
<220>
<223>scfv
<400>43
aspileglnmetthrglnthrthrserserleuseralaserleugly
151015
aspargvalthrilesercysargalaserglnaspileserlystyr
202530
leuasntrptyrglnglnlysproaspglythrvallysleuleuile
354045
tyrhisthrserargleuhisserglyvalproserargphesergly
505560
serglyserglythrasptyrserleuthrileserasnleuglugln
65707580
gluaspilealathrtyrphecysglnglnglyasnthrleuprotyr
859095
thrpheglyglyglythrlysleugluilethrglyserthrsergly
100105110
serglylysproglyserglygluglyserthrlysglygluvallys
115120125
leuglngluserglyproglyleuvalalaproserglnserleuser
130135140
valthrcysthrvalserglyvalserleuproasptyrglyvalser
145150155160
trpileargglnproproarglysglyleuglutrpleuglyvalile
165170175
trpglysergluthrthrtyrtyrasnseralaleulysserargleu
180185190
thrileilelysaspasnserlysserglnvalpheleulysmetasn
195200205
serleuglnthraspaspthralailetyrtyrcysalalyshistyr
210215220
tyrtyrglyglysertyralametasptyrtrpglyglnglythrser
225230235240
valthrvalserser
245
<210>44
<211>11
<212>prt
<213>人工序列
<220>
<223>cdrl1
<400>44
lysalaserglnasnvalglythrasnvalala
1510
<210>45
<211>7
<212>prt
<213>人工序列
<220>
<223>cdrl2
<400>45
seralathrtyrargasnser
15
<210>46
<211>9
<212>prt
<213>人工序列
<220>
<223>cdrl3
<400>46
glnglntyrasnargtyrprotyrthr
15
<210>47
<211>5
<212>prt
<213>人工序列
<220>
<223>cdrh1
<400>47
sertyrtrpmetasn
15
<210>48
<211>17
<212>prt
<213>人工序列
<220>
<223>cdrh2
<400>48
glniletyrproglyaspglyaspthrasntyrasnglylysphelys
151015
gly
<210>49
<211>13
<212>prt
<213>人工序列
<220>
<223>cdrh3
<400>49
lysthrileserservalvalaspphetyrpheasptyr
1510
<210>50
<211>122
<212>prt
<213>人工序列
<220>
<223>vh
<400>50
gluvallysleuglnglnserglyalagluleuvalargproglyser
151015
servallysilesercyslysalaserglytyralaphesersertyr
202530
trpmetasntrpvallysglnargproglyglnglyleuglutrpile
354045
glyglniletyrproglyaspglyaspthrasntyrasnglylysphe
505560
lysglyglnalathrleuthralaasplysserserserthralatyr
65707580
metglnleuserglyleuthrsergluaspseralavaltyrphecys
859095
alaarglysthrileserservalvalaspphetyrpheasptyrtrp
100105110
glyglnglythrthrvalthrvalserser
115120
<210>51
<211>108
<212>prt
<213>人工序列
<220>
<223>vl
<400>51
aspilegluleuthrglnserprolysphemetserthrservalgly
151015
aspargvalservalthrcyslysalaserglnasnvalglythrasn
202530
valalatrptyrglnglnlysproglyglnserprolysproleuile
354045
tyrseralathrtyrargasnserglyvalproaspargphethrgly
505560
serglyserglythraspphethrleuthrilethrasnvalglnser
65707580
lysaspleualaasptyrphecysglnglntyrasnargtyrprotyr
859095
thrserglyglyglythrlysleugluilelysarg
100105
<210>52
<211>15
<212>prt
<213>人工序列
<220>
<223>接头
<400>52
glyglyglyglyserglyglyglyglyserglyglyglyglyser
151015
<210>53
<211>245
<212>prt
<213>人工序列
<220>
<223>scfv
<400>53
gluvallysleuglnglnserglyalagluleuvalargproglyser
151015
servallysilesercyslysalaserglytyralaphesersertyr
202530
trpmetasntrpvallysglnargproglyglnglyleuglutrpile
354045
glyglniletyrproglyaspglyaspthrasntyrasnglylysphe
505560
lysglyglnalathrleuthralaasplysserserserthralatyr
65707580
metglnleuserglyleuthrsergluaspseralavaltyrphecys
859095
alaarglysthrileserservalvalaspphetyrpheasptyrtrp
100105110
glyglnglythrthrvalthrvalserserglyglyglyglysergly
115120125
glyglyglyserglyglyglyglyseraspilegluleuthrglnser
130135140
prolysphemetserthrservalglyaspargvalservalthrcys
145150155160
lysalaserglnasnvalglythrasnvalalatrptyrglnglnlys
165170175
proglyglnserprolysproleuiletyrseralathrtyrargasn
180185190
serglyvalproaspargphethrglyserglyserglythraspphe
195200205
thrleuthrilethrasnvalglnserlysaspleualaasptyrphe
210215220
cysglnglntyrasnargtyrprotyrthrserglyglyglythrlys
225230235240
leugluilelysarg
245
<210>54
<211>12
<212>prt
<213>人工序列
<220>
<223>hc-cdr3
<400>54
histyrtyrtyrglyglysertyralametasptyr
1510
<210>55
<211>7
<212>prt
<213>人工序列
<220>
<223>lc-cdr2
<400>55
histhrserargleuhisser
15
<210>56
<211>9
<212>prt
<213>人工序列
<220>
<223>lc-cdr3
<400>56
glnglnglyasnthrleuprotyrthr
15
<210>57
<211>735
<212>dna
<213>人工序列
<220>
<223>编码scfv的序列
<400>57
gacatccagatgacccagaccacctccagcctgagcgccagcctgggcgaccgggtgacc60
atcagctgccgggccagccaggacatcagcaagtacctgaactggtatcagcagaagccc120
gacggcaccgtcaagctgctgatctaccacaccagccggctgcacagcggcgtgcccagc180
cggtttagcggcagcggctccggcaccgactacagcctgaccatctccaacctggaacag240
gaagatatcgccacctacttttgccagcagggcaacacactgccctacacctttggcggc300
ggaacaaagctggaaatcaccggcagcacctccggcagcggcaagcctggcagcggcgag360
ggcagcaccaagggcgaggtgaagctgcaggaaagcggccctggcctggtggcccccagc420
cagagcctgagcgtgacctgcaccgtgagcggcgtgagcctgcccgactacggcgtgagc480
tggatccggcagccccccaggaagggcctggaatggctgggcgtgatctggggcagcgag540
accacctactacaacagcgccctgaagagccggctgaccatcatcaaggacaacagcaag600
agccaggtgttcctgaagatgaacagcctgcagaccgacgacaccgccatctactactgc660
gccaagcactactactacggcggcagctacgccatggactactggggccagggcaccagc720
gtgaccgtgagcagc735
<210>58
<211>18
<212>prt
<213>人工序列
<220>
<223>接头
<400>58
glyserthrserglyserglylysproglyserglygluglyserthr
151015
lysgly
<210>59
<211>326
<212>prt
<213>智人(homosapiens)
<220>
<223>人igg2fc(uniprotp01859)
<400>59
alaserthrlysglyproservalpheproleualaprocysserarg
151015
serthrsergluserthralaalaleuglycysleuvallysasptyr
202530
pheprogluprovalthrvalsertrpasnserglyalaleuthrser
354045
glyvalhisthrpheproalavalleuglnserserglyleutyrser
505560
leuserservalvalthrvalproserserasnpheglythrglnthr
65707580
tyrthrcysasnvalasphislysproserasnthrlysvalasplys
859095
thrvalgluarglyscyscysvalglucysproprocysproalapro
100105110
provalalaglyproservalpheleupheproprolysprolysasp
115120125
thrleumetileserargthrprogluvalthrcysvalvalvalasp
130135140
valserhisgluaspprogluvalglnpheasntrptyrvalaspgly
145150155160
valgluvalhisasnalalysthrlysproargglugluglnpheasn
165170175
serthrpheargvalvalservalleuthrvalvalhisglnasptrp
180185190
leuasnglylysglutyrlyscyslysvalserasnlysglyleupro
195200205
alaproileglulysthrileserlysthrlysglyglnproargglu
210215220
proglnvaltyrthrleuproproserarggluglumetthrlysasn
225230235240
glnvalserleuthrcysleuvallysglyphetyrproseraspile
245250255
servalglutrpgluserasnglyglnprogluasnasntyrlysthr
260265270
thrproprometleuaspseraspglyserphepheleutyrserlys
275280285
leuthrvalasplysserargtrpglnglnglyasnvalphesercys
290295300
servalmethisglualaleuhisasnhistyrthrglnlysserleu
305310315320
serleuserproglylys
325
<210>60
<211>327
<212>prt
<213>智人(homosapiens)
<220>
<223>人igg4fc(uniprotp01861)
<400>60
alaserthrlysglyproservalpheproleualaprocysserarg
151015
serthrsergluserthralaalaleuglycysleuvallysasptyr
202530
pheprogluprovalthrvalsertrpasnserglyalaleuthrser
354045
glyvalhisthrpheproalavalleuglnserserglyleutyrser
505560
leuserservalvalthrvalproserserserleuglythrlysthr
65707580
tyrthrcysasnvalasphislysproserasnthrlysvalasplys
859095
argvalgluserlystyrglyproprocysprosercysproalapro
100105110
glupheleuglyglyproservalpheleupheproprolysprolys
115120125
aspthrleumetileserargthrprogluvalthrcysvalvalval
130135140
aspvalserglngluaspprogluvalglnpheasntrptyrvalasp
145150155160
glyvalgluvalhisasnalalysthrlysproargglugluglnphe
165170175
asnserthrtyrargvalvalservalleuthrvalleuhisglnasp
180185190
trpleuasnglylysglutyrlyscyslysvalserasnlysglyleu
195200205
proserserileglulysthrileserlysalalysglyglnproarg
210215220
gluproglnvaltyrthrleuproproserglngluglumetthrlys
225230235240
asnglnvalserleuthrcysleuvallysglyphetyrproserasp
245250255
ilealavalglutrpgluserasnglyglnprogluasnasntyrlys
260265270
thrthrproprovalleuaspseraspglyserphepheleutyrser
275280285
argleuthrvalasplysserargtrpglngluglyasnvalpheser
290295300
cysservalmethisglualaleuhisasnhistyrthrglnlysser
305310315320
leuserleuserleuglylys
325
<210>61
<211>107
<212>prt
<213>人工序列
<220>
<223>fkbp
<400>61
glyvalglnvalgluthrileserproglyaspglyargthrphepro
151015
lysargglyglnthrcysvalvalhistyrthrglymetleugluasp
202530
glylyslysmetaspserserargaspargasnlysprophelysphe
354045
metleuglylysglngluvalileargglytrpglugluglyvalala
505560
glnmetservalglyglnargalalysleuthrileserproasptyr
65707580
alatyrglyalathrglyhisproglyileileproprohisalathr
859095
leuvalpheaspvalgluleuleulysleuglu
100105
<210>62
<211>107
<212>prt
<213>人工序列
<220>
<223>fkbp12v36
<400>62
glyvalglnvalgluthrileserproglyaspglyargthrphepro
151015
lysargglyglnthrcysvalvalhistyrthrglymetleugluasp
202530
glylyslysvalaspserserargaspargasnlysprophelysphe
354045
metleuglylysglngluvalileargglytrpglugluglyvalala
505560
glnmetservalglyglnargalalysleuthrileserproasptyr
65707580
alatyrglyalathrglyhisproglyileileproprohisalathr
859095
leuvalpheaspvalgluleuleulysleuglu
100105
<210>63
<211>16
<212>prt
<213>人工序列
<220>
<223>酰化基序
<400>63
metglyserasnlysserlysprolysaspalaserglnargargarg
151015
<210>64
<211>5
<212>prt
<213>人工序列
<220>
<223>双重酰化区
<220>
<221>变体
<222>(4)..(4)
<223>xaa是任何氨基酸
<400>64
metglycysxaacys
15
<210>65
<211>4
<212>prt
<213>人工序列
<220>
<223>caax盒
<220>
<221>变体
<222>(4)..(4)
<223>xaa是任何氨基酸
<400>65
cysalaalaxaa
1
<210>66
<211>159
<212>prt
<213>阿维丁链霉菌(streptomycesavidinii)
<400>66
aspproserlysaspserlysalaglnvalseralaalaglualagly
151015
ilethrglythrtrptyrasnglnleuglyserthrpheilevalthr
202530
alaglyalaaspglyalaleuthrglythrtyrgluseralavalgly
354045
asnalagluserargtyrvalleuthrglyargtyraspseralapro
505560
alathraspglyserglythralaleuglytrpthrvalalatrplys
65707580
asnasntyrargasnalahisseralathrthrtrpserglyglntyr
859095
valglyglyalaglualaargileasnthrglntrpleuleuthrser
100105110
glythrthrglualaasnalatrplysserthrleuvalglyhisasp
115120125
thrphethrlysvallysproseralaalaserileaspalaalalys
130135140
lysalaglyvalasnasnglyasnproleuaspalavalglngln
145150155
<210>67
<211>126
<212>prt
<213>阿维丁链霉菌(streptomycesavidinii)
<220>
<221>尚未归类的特征
<223>最小链霉亲和素
<400>67
glualaglyilethrglythrtrptyrasnglnleuglyserthrphe
151015
ilevalthralaglyalaaspglyalaleuthrglythrtyrgluser
202530
alavalglyasnalagluserargtyrvalleuthrglyargtyrasp
354045
seralaproalathraspglyserglythralaleuglytrpthrval
505560
alatrplysasnasntyrargasnalahisseralathrthrtrpser
65707580
glyglntyrvalglyglyalaglualaargileasnthrglntrpleu
859095
leuthrserglythrthrglualaasnalatrplysserthrleuval
100105110
glyhisaspthrphethrlysvallysproseralaalaser
115120125
<210>68
<211>126
<212>prt
<213>人工序列
<220>
<221>尚未归类的特征
<223>突变蛋白链霉亲和素ile44-gly45-ala-46-arg47
<400>68
glualaglyilethrglythrtrptyrasnglnleuglyserthrphe
151015
ilevalthralaglyalaaspglyalaleuthrglythrtyrilegly
202530
alaargglyasnalagluserargtyrvalleuthrglyargtyrasp
354045
seralaproalathraspglyserglythralaleuglytrpthrval
505560
alatrplysasnasntyrargasnalahisseralathrthrtrpser
65707580
glyglntyrvalglyglyalaglualaargileasnthrglntrpleu
859095
leuthrserglythrthrglualaasnalatrplysserthrleuval
100105110
glyhisaspthrphethrlysvallysproseralaalaser
115120125
<210>69
<211>8
<212>prt
<213>人工序列
<220>
<223>strep-tagii
<400>69
trpserhisproglnpheglulys
15
<210>70
<211>28
<212>prt
<213>人工序列
<220>
<223>twin-strep-tag
<400>70
trpserhisproglnpheglulysglyglyglyserglyglyglyser
151015
glyglyglysertrpserhisproglnpheglulys
2025
<210>71
<211>24
<212>prt
<213>人工序列
<220>
<223>twin-strep-tag
<400>71
trpserhisproglnpheglulysglyglyglyserglyglyglyser
151015
trpserhisproglnpheglulys
20
<210>72
<211>28
<212>prt
<213>人工序列
<220>
<223>twin-strep-tag
<400>72
trpserhisproglnpheglulysglyglyglyserglyglyglyser
151015
glyglyseralatrpserhisproglnpheglulys
2025
<210>73
<211>127
<212>prt
<213>人工序列
<220>
<221>尚未归类的特征
<223>突变蛋白链霉亲和素ile44-gly45-ala-46-arg47
<400>73
metglualaglyilethrglythrtrptyrasnglnleuglyserthr
151015
pheilevalthralaglyalaaspglyalaleuthrglythrtyrile
202530
glyalaargglyasnalagluserargtyrvalleuthrglyargtyr
354045
aspseralaproalathraspglyserglythralaleuglytrpthr
505560
valalatrplysasnasntyrargasnalahisseralathrthrtrp
65707580
serglyglntyrvalglyglyalaglualaargileasnthrglntrp
859095
leuleuthrserglythrthrglualaasnalatrplysserthrleu
100105110
valglyhisaspthrphethrlysvallysproseralaalaser
115120125
<210>74
<211>8
<212>prt
<213>人工序列
<220>
<223>链霉亲和素结合肽
<220>
<221>变体
<222>(2)..(2)
<223>xaa是任何氨基酸
<220>
<221>变体
<222>(7)..(7)
<223>xaa是gly或glu
<220>
<221>变体
<222>(8)..(8)
<223>xaa是gly、lys或arg
<400>74
trpxaahisproglnphexaaxaa
15
<210>75
<211>8
<212>prt
<213>人工序列
<220>
<223>链霉亲和素结合肽,strep-tag
<400>75
trparghisproglnpheglygly
15
<210>76
<211>17
<212>prt
<213>人工序列
<220>
<223>链霉亲和素结合肽的顺序模块
<220>
<221>变体
<222>(9)..(9)
<223>xaa是任何氨基酸
<220>
<221>重复
<222>(9)..(9)
<223>xaa重复8或12次
<400>76
trpserhisproglnpheglulysxaatrpserhisproglnpheglu
151015
lys
<210>77
<211>20
<212>prt
<213>人工序列
<220>
<223>链霉亲和素结合肽的顺序模块
<220>
<221>重复
<222>(9)..(12)
<223>gggs重复2或3次
<400>77
trpserhisproglnpheglulysglyglyglysertrpserhispro
151015
glnpheglulys
20
<210>78
<211>30
<212>prt
<213>人工序列
<220>
<223>twin-strep-tag
<400>78
seralatrpserhisproglnpheglulysglyglyglyserglygly
151015
glyserglyglyglysertrpserhisproglnpheglulys
202530
<210>79
<211>30
<212>prt
<213>人工序列
<220>
<223>twin-strep-tag
<400>79
seralatrpserhisproglnpheglulysglyglyglyserglygly
151015
glyserglyglyseralatrpserhisproglnpheglulys
202530
<210>80
<211>159
<212>prt
<213>人工序列
<220>
<223>突变蛋白链霉亲和素val44-thr45-ala46-arg47
<400>80
aspproserlysaspserlysalaglnvalseralaalaglualagly
151015
ilethrglythrtrptyrasnglnleuglyserthrpheilevalthr
202530
alaglyalaaspglyalaleuthrglythrtyrvalthralaarggly
354045
asnalagluserargtyrvalleuthrglyargtyraspseralapro
505560
alathraspglyserglythralaleuglytrpthrvalalatrplys
65707580
asnasntyrargasnalahisseralathrthrtrpserglyglntyr
859095
valglyglyalaglualaargileasnthrglntrpleuleuthrser
100105110
glythrthrglualaasnalatrplysserthrleuvalglyhisasp
115120125
thrphethrlysvallysproseralaalaserileaspalaalalys
130135140
lysalaglyvalasnasnglyasnproleuaspalavalglngln
145150155
<210>81
<211>126
<212>prt
<213>人工序列
<220>
<223>突变蛋白链霉亲和素val44-thr45-ala46-arg47
<400>81
glualaglyilethrglythrtrptyrasnglnleuglyserthrphe
151015
ilevalthralaglyalaaspglyalaleuthrglythrtyrvalthr
202530
alaargglyasnalagluserargtyrvalleuthrglyargtyrasp
354045
seralaproalathraspglyserglythralaleuglytrpthrval
505560
alatrplysasnasntyrargasnalahisseralathrthrtrpser
65707580
glyglntyrvalglyglyalaglualaargileasnthrglntrpleu
859095
leuthrserglythrthrglualaasnalatrplysserthrleuval
100105110
glyhisaspthrphethrlysvallysproseralaalaser
115120125
<210>82
<211>127
<212>prt
<213>人工序列
<220>
<221>尚未归类的特征
<223>突变蛋白链霉亲和素val44-thr45-ala46-arg47
<400>82
metglualaglyilethrglythrtrptyrasnglnleuglyserthr
151015
pheilevalthralaglyalaaspglyalaleuthrglythrtyrval
202530
thralaargglyasnalagluserargtyrvalleuthrglyargtyr
354045
aspseralaproalathraspglyserglythralaleuglytrpthr
505560
valalatrplysasnasntyrargasnalahisseralathrthrtrp
65707580
serglyglntyrvalglyglyalaglualaargileasnthrglntrp
859095
leuleuthrserglythrthrglualaasnalatrplysserthrleu
100105110
valglyhisaspthrphethrlysvallysproseralaalaser
115120125
<210>83
<211>4
<212>prt
<213>人工序列
<220>
<223>链霉亲和素结合肽
<400>83
hisproglnphe
1
<210>84
<211>8
<212>prt
<213>人工序列
<220>
<223>链霉亲和素结合肽
<220>
<221>变体
<222>(1)..(1)
<223>xaa是trp、lys或arg
<220>
<221>变体
<222>(2)..(2)
<223>xaa是任何氨基酸
<220>
<221>变体
<222>(7)..(7)
<223>xaa是gly或glu
<220>
<221>变体
<222>(8)..(8)
<223>xaa是gly、lys或arg
<400>84
xaaxaahisproglnphexaaxaa
15
<210>85
<211>159
<212>prt
<213>人工序列
<220>
<221>尚未归类的特征
<223>突变蛋白链霉亲和素ile44-gly45-ala-46-arg47
<400>85
aspproserlysaspserlysalaglnvalseralaalaglualagly
151015
ilethrglythrtrptyrasnglnleuglyserthrpheilevalthr
202530
alaglyalaaspglyalaleuthrglythrtyrileglyalaarggly
354045
asnalagluserargtyrvalleuthrglyargtyraspseralapro
505560
alathraspglyserglythralaleuglytrpthrvalalatrplys
65707580
asnasntyrargasnalahisseralathrthrtrpserglyglntyr
859095
valglyglyalaglualaargileasnthrglntrpleuleuthrser
100105110
glythrthrglualaasnalatrplysserthrleuvalglyhisasp
115120125
thrphethrlysvallysproseralaalaserileaspalaalalys
130135140
lysalaglyvalasnasnglyasnproleuaspalavalglngln
145150155
<210>86
<211>126
<212>prt
<213>人工序列
<220>
<221>尚未归类的特征
<223>突变蛋白链霉亲和素ile44-gly45-ala-46-arg47和glu117、gly120、try121(突变蛋白m1-9)
<400>86
glualaglyilethrglythrtrptyrasnglnleuglyserthrphe
151015
ilevalthralaglyalaaspglyalaleuthrglythrtyrvalthr
202530
alaargglyasnalagluserargtyrvalleuthrglyargtyrasp
354045
seralaproalathraspglyserglythralaleuglytrpthrval
505560
alatrplysasnasntyrargasnalahisseralathrthrtrpser
65707580
glyglntyrvalglyglyalaglualaargileasnthrglntrpleu
859095
leuthrserglythrthrglugluasnalaglytyrserthrleuval
100105110
glyhisaspthrphethrlysvallysproseralaalaser
115120125
<210>87
<211>139
<212>prt
<213>人工序列
<220>
<221>尚未归类的特征
<223>突变蛋白链霉亲和素ile44-gly45-ala-46-arg47和glu117、gly120、try121(突变蛋白m1-9)
<400>87
aspproserlysaspserlysalaglnvalseralaalaglualagly
151015
ilethrglythrtrptyrasnglnleuglyserthrpheilevalthr
202530
alaglyalaaspglyalaleuthrglythrtyrvalthralaarggly
354045
asnalagluserargtyrvalleuthrglyargtyraspseralapro
505560
alathraspglyserglythralaleuglytrpthrvalalatrplys
65707580
asnasntyrargasnalahisseralathrthrtrpserglyglntyr
859095
valglyglyalaglualaargileasnthrglntrpleuleuthrser
100105110
glythrthrglugluasnalaglytyrserthrleuvalglyhisasp
115120125
thrphethrlysvallysproseralaalaser
130135
<210>88
<211>127
<212>prt
<213>阿维丁链霉菌(streptomycesavidinii)
<220>
<221>尚未归类的特征
<223>最小链霉亲和素
<400>88
metglualaglyilethrglythrtrptyrasnglnleuglyserthr
151015
pheilevalthralaglyalaaspglyalaleuthrglythrtyrglu
202530
seralavalglyasnalagluserargtyrvalleuthrglyargtyr
354045
aspseralaproalathraspglyserglythralaleuglytrpthr
505560
valalatrplysasnasntyrargasnalahisseralathrthrtrp
65707580
serglyglntyrvalglyglyalaglualaargileasnthrglntrp
859095
leuleuthrserglythrthrglualaasnalatrplysserthrleu
100105110
valglyhisaspthrphethrlysvallysproseralaalaser
115120125
<210>89
<211>24
<212>prt
<213>人工序列
<220>
<223>突变蛋白链霉亲和素
<220>
<221>重复
<222>(9)..(12)
<223>gggs重复2次
<400>89
trpserhisproglnpheglulysglyglyglyserglyglyserala
151015
trpserhisproglnpheglulys
20
<210>90
<211>9
<212>prt
<213>人工序列
<220>
<223>strep-tag
<400>90
alatrpalahisproglnpheglygly
15
<210>91
<211>116
<212>prt
<213>人工序列
<220>
<223>vh抗cd28抗体cd28.3
<400>91
leuglnglnserglyalagluleuvallysproglyalaservalarg
151015
leusercyslysalaserglytyrthrphethrglutyrileilehis
202530
trpilelysleuargserglyglnglyleuglutrpileglytrpphe
354045
tyrproglyserasnaspileglntyrasnalalysphelysglylys
505560
alathrleuthralaasplysserserserthrvaltyrmetgluleu
65707580
thrglyleuthrsergluaspseralavaltyrphecysalaargarg
859095
aspasppheserglytyraspalaleuprotyrtrpglyglnglythr
100105110
metvalthrval
115
<210>92
<211>108
<212>prt
<213>人工序列
<220>
<223>vl抗cd28抗体cd28.3
<400>92
aspileglnmetthrglnserproalaserleuservalservalgly
151015
gluthrvalthrilethrcysargthrasngluasniletyrserasn
202530
leualatrptyrglnglnlysglnglylysserproglnleuleuile
354045
tyralaalathrhisleuvalgluglyvalproserargphesergly
505560
serglyserglythrglntyrserleulysilethrserleuglnser
65707580
gluasppheglyasntyrtyrcysglnhisphetrpglythrprocys
859095
thrpheglyglyglythrlysleugluilelysarg
100105
<210>93
<211>119
<212>prt
<213>人工序列
<220>
<223>vh抗cd3抗体okt3
<400>93
glnvalglnleuglnglnserglyalagluleualaargproglyala
151015
servallysmetsercyslysalaserglytyrthrphethrargtyr
202530
thrmethistrpvallysglnargproglyglnglyleuglutrpile
354045
glytyrileasnproserargglytyrthrasntyrasnglnlysphe
505560
lysasplysalathrleuthrthrasplysserserserthralatyr
65707580
metglnleuserserleuthrsergluaspseralavaltyrtyrcys
859095
alaargtyrtyraspasphistyrcysleuasptyrtrpglyglngly
100105110
thrthrleuthrvalserser
115
<210>94
<211>106
<212>prt
<213>人工序列
<220>
<223>vl抗cd3抗体okt3
<400>94
glnilevalleuthrglnserproalailemetseralaserprogly
151015
glulysvalthrmetthrcysseralaserserservalsertyrmet
202530
asntrptyrglnglnlysserglythrserprolysargtrpiletyr
354045
aspthrserlysleualaserglyvalproalahispheargglyser
505560
glyserglythrsertyrserleuthrileserglymetglualaglu
65707580
aspalaalathrtyrtyrcysglnglntrpserserasnprophethr
859095
pheglyserglythrlysleugluileasn
100105
<210>95
<211>248
<212>prt
<213>人工序列
<220>
<223>fab片段m13b8.2的可变重链
<400>95
alametglnvalglnleulysglnserglyproglyleuvalglnpro
151015
serglnserleuserilethrcysthrvalserglypheserleuthr
202530
thrpheglyvalhistrpvalargglnserproglylysglyleuglu
354045
trpleuglyvaliletrpalaserglyilethrasptyrasnvalpro
505560
phemetserargleuserilethrlysaspasnserlysserglnval
65707580
phephelysleuasnserleuglnproaspaspthralailetyrtyr
859095
cysalalysasnaspproglythrglyphealatyrtrpglnglythr
100105110
leuvalthrvalserserthrlysglyproservalpheproalapro
115120125
serserlysserthrserglyglythralaalaleuglycysleuval
130135140
lysasptyrpheprogluprovalthrvalsertrpasnserglyala
145150155160
leuthrserglyvalhisthrpheproalavalleuglnserserleu
165170175
tyrserleuserservalvalthrvalproserserserleuglythr
180185190
glnthrtyrilecysasnvalasnhislysproserasnthrlysval
195200205
asplyslysvalgluprolyssercysglyseralatrpserhispro
210215220
glnpheglulysglyglyglyserglyglyglyserglyglyserala
225230235240
trpserhisproglnpheglulys
245
<210>96
<211>218
<212>prt
<213>人工序列
<220>
<223>fab片段m13b8.2的可变轻链
<400>96
alametaspileglnmetthrglnserproalaserleuseralaser
151015
valglygluthrvalthrphethrcysargalaserglumetiletyr
202530
sertyrleualatrptyrglnglnlysglnglylysserproglnleu
354045
leuvalhisaspalalysthrleualagluglyvalproserargphe
505560
serglyglyglyserglythrglnpheserleulysileasnthrleu
65707580
glnprogluasppheglythrtyrtyrcysglnalahistyrglyasn
859095
proprothrpheglyglyglythrlysleugluilelysargglyile
100105110
alaalaproservalpheilepheproproseraspgluglnleulys
115120125
serglythralaservalvalcysleuleuasnasnphetyrproarg
130135140
glualalysvalglntrplysvalaspasnalaleuglnserglyasn
145150155160
serglngluservalthrgluglnaspserlysaspserthrtyrser
165170175
leuserserthrleuthrleuserlysalaasptyrglulyshislys
180185190
valtyralacysgluvalthrhisglnglyleuserserprovalthr
195200205
lysserpheasnargglyglucysglyser
210215
<210>97
<211>118
<212>prt
<213>人工序列
<220>
<223>huokt8的可变重链
<400>97
glnvalglnleuvalglnserglyalagluvallyslysproglyala
151015
thrvallysilesercyslysvalserglypheasnilelysaspthr
202530
tyrilehistrpvalglnglnalaproglylysglyleuglutrpmet
354045
glyargileaspproalaasnaspasnthrleutyralaserlysphe
505560
glnglyargvalthrilethralaaspthrserthraspthralatyr
65707580
metgluleuserserleuargsergluaspthralavaltyrtyrcys
859095
alaargglytyrglytyrtyrvalpheasphistrpglyglnglythr
100105110
leuvalthrvalserser
115
<210>98
<211>107
<212>prt
<213>人工序列
<220>
<223>huokt8的可变轻链
<400>98
aspvalglnilethrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargthrserargserileserglntyr
202530
leualatrptyrglnglnlysproglylysvalprolysleuleuile
354045
tyrserglyserthrleuglnserglyvalproserargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnpro
65707580
gluaspvalalathrtyrtyrcysglnglnhisasngluasnproleu
859095
thrpheglyglyglythrlysvalgluilelys
100105
- 还没有人留言评论。精彩留言会获得点赞!