用于治疗子宫内膜异位症的组合物和方法与流程
用于治疗子宫内膜异位症的组合物和方法
交叉引用
1.本技术要求2018年11月21日提交的美国临时申请号62/770,601的权益,该临时申请的全部内容通过引用并入本文。
技术领域
2.本公开涉及药剂和用于施用此类药剂以治疗受试者的疾病或病况的方法、制剂和装置。提供的药剂之中包括可以抑制某些细胞蛋白质或功能的那些,包括β
‑
连环蛋白和wnt的抑制剂。药剂可以包括治疗性肽和拟肽类药剂。所述方法的特征为治疗诸如子宫内膜异位症的病况提供各种优势,例如能够治疗或逆转子宫内膜异位症的根本病因并减少或消除施用激素疗法以改善与子宫内膜异位症相关的症状的需要。
背景技术:
3.子宫内膜异位症(ems)影响约10%的女性和青少年:美国有超过740万女性,全世界有超过1.76亿女性。ems是育龄期女性残疾和不孕的第一大原因;40%的不孕妇女患有ems。诊断时的平均年龄为28岁。使人衰弱的症状包括痛经、慢性疼痛、性交疼痛和不孕症(giudice,l.c.&kao,l.c.,lancet 364,1789
‑
1799)。除了人类的痛苦之外,对于美国的与症状相关的生产力损失和直接医疗成本每年超过900亿美元。ems通过经血倒流发生,其中有活力的子宫内膜组织通过输卵管回流并进入腹膜腔。在那里,它附着在多个异体部位(例如输卵管、卵巢窝、腹膜壁、韧带和肠)并响应于激素(sampson,j.a.,am j pathol3,93
‑
110 143,1927)。目前的疗法只能抑制症状,不能治愈。复发很常见,并且如果中止治疗,复发可能会很快发生。
4.基于激素的疗法用于改变排卵周期以减少经血倒流和治疗ems症状。这些疗法包括雌激素/孕酮联合疗法、仅孕激素治疗或gnrh拮抗剂/激动剂(即“医学更年期”),这会降低激素激活以抑制排卵;然而,这些疗法只会抑制ems症状,并不能治愈疾病。停止治疗后,症状复发率为约70%(selcuk,i.等人,ger gynecol assoc 14,98
‑
103,2013)。通过激素调节管理ems无法逆转现有的病变;不会阻碍由其他因素(例如,氧化应激或遗传)引起的病变的生长;受大多数患有ems女性中发现的孕酮受体(pgr)耐药性的阻碍;并且伴随着不利的副作用。ems的激素疗法的局限性导致疗效有限、对方案的依从性低以及需要进行侵入性手术。
5.虽然手术仍然是诊断和管理子宫内膜异位症的基本工具,但即使是手术也不能治愈;手术干预的主要目的是防止复发和减轻症状,从而消除对额外手术的需要或延长额外手术之间的时间。
6.因此,对于ems需要非激素、非手术性的治疗。
技术实现要素:
7.本文提供了包含具有式x1‑
x2‑
x3‑
x4‑
x5‑
x6‑
x7‑
x8‑
x9‑
x
10
‑
x
11
‑
x
12
‑
x
13
‑
x
14
‑
x
15
‑
x
16
的
氨基酸序列的肽和拟肽类药剂,其中:x1为m或空;x2为s、i、g、t、a、l或空;x3为r、k或空;x4为带正电荷的氨基酸、瓜氨酸、orn、d、e、8
‑
氨基辛酸或具有4至12个碳的氨基羧酸;x5为m、正亮氨酸、orn、d、e、k、h、r、k、8
‑
氨基辛酸、具有4至12个碳的氨基羧酸或空;x6为w、y、f或n
‑
甲基a;x7为f、i、l、chg、cha或tle;x8为l、i或a;x9为l、i或a;x
10
为c、s、a、abu、c(me)或s(bzl);x
11
为f、h、a、k、e、chg、cng或orn;x
12
为w、y、a或f;且x
13
为g、gaba或空。
8.本文提供了包含具有式r
‑
x1‑
x2‑
x3‑
x4‑
x5‑
x6‑
x7‑
x8‑
x9‑
x
10
‑
x
11
‑
x
12
‑
x
13
‑
x
14
‑
x
15
‑
x
16
的氨基酸序列的肽和拟肽类药剂,其中:r是nh2、乙酰化物、硬脂酸、棕榈酸、肉豆蔻酸、月桂酸、c1‑
c8烃、c1‑
c8脂肪酸或空;x1为m、g、β丙氨酸、正亮氨酸、正缬氨酸或空;x2为w、n
‑
甲基w、r、y、f、瓜氨酸或k;x3为p、w、n
‑
甲基
‑
w、n
‑
乙基
‑
w、n
‑
甲基a、n
‑
乙基a、l、pip、aib、y或f;x4为e、q、n或d;x5为s、α甲基s、k、d、orn、t或e;x6为i、chg、h或l;x7为l或i;x8为d、n、e或q;x9为d、e、k、q或orn;x
10
为h或甲基
‑
h;x
11
为v、α甲基v、chg、l、i或正缬氨酸;x
12
为q、aib、s、r或n;x
13
为r、k、瓜氨酸、orn、d或e;x
14
为v、i、l或正缬氨酸;x
15
为w、y或f;且x
16
为r、g或空。
9.本文提供了包含seq id no:1
‑
seq id no:500中任一个的氨基酸序列的肽和拟肽类药剂。
10.本文提供了肽和拟肽类药剂,其包含与seq id no:1
‑
seq id no:500中任一个具有至少80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。
11.在一些实施方案中,肽结合β
‑
连环蛋白。在一些实施方案中,肽是β
‑
连环蛋白抑制剂。在一些实施方案中,肽是β
‑
连环蛋白易位至细胞核的抑制剂。在一些实施方案中,肽防止β
‑
连环蛋白充当为致癌基因、基质金属蛋白酶9(mmp9)或氯化物c3通道(clc
‑
3)的转录因子。在一些实施方案中,肽防止子宫内膜异位症(ems)细胞的转化、侵入、迁移、纤维化或其任何组合。在一些实施方案中,肽阻止β
‑
连环蛋白与雌激素受体(esr1)结合。在一些实施方案中,肽不降低β
‑
连环蛋白的膜活性。在一些实施方案中,肽不降低β
‑
连环蛋白e
‑
钙粘蛋白结合。在一些实施方案中,肽防止致癌转录因子活性。在一些实施方案中,肽以小于50um、小于30um、小于10um、5um、1um、500nm、400nm、300nm、200nm、100nm、50nm、30nm、10nm、5nm、3nm、1nm、800pm、600pm、400pm、200pm、100pm、50pm、30pm、20pm、10pm、或5pm或小于约10um、约5um、约1um、约500nm、约400nm、约300nm、约200nm、约100nm、约50nm、约30nm、约10nm、约5nm、约3nm、约1nm、约800pm、约600pm、约400pm、约200pm、约100pm、约50pm、约30pm、约20pm、约10pm或约5pm的ec
50
抑制wnt通路活性。在一些实施方案中,肽以小于50um、30um、10um k
d
、5um、1um、500nm、400nm、300nm、200nm、100nm、50nm、30nm、10nm、5nm、3nm、1nm、800pm、600pm、400pm、200pm、100pm、50pm、30pm、20pm、10pm、或5pm或小于约10um、约5um、约1um、约500nm、约400nm、约300nm、约200nm、约100nm、约50nm、约30nm、约10nm、约5nm、约3nm、约1nm、约800pm、约600pm、约400pm、约200pm、约100pm、约50pm、约30pm、约20pm、约10pm或约5pm的kd
50
结合亲和力结合β
‑
连环蛋白。在一些实施方案中,肽是非天然存在的。在一些实施方案中,肽是环化肽。在一些实施方案中,肽是双环肽。在一些实施方案中,肽用cys
‑
cys二硫键环化。在一些实施方案中,肽用酰胺键环化。在一些实施方案中,酰胺键在n
‑
末端和c
‑
末端之间是头到尾的。在一些实施方案中,酰胺键n
‑
末端和内部cooh之间是头到侧链的。在一些实施方案中,酰胺键在内部nh2和c
‑
末端之间是侧链到尾的。在一些实施方案中,酰胺键在内部nh2和内部cooh之间是侧链到侧链的。在一些实施方案中,使用烃钉合使肽环化。在一些实施方案中,使用点击化学使肽环化。在一些实施方案中,肽是至少3、至少4、至少5、至少6、
至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26、至少27、至少28、至少29、至少30、至少31、至少32、至少33、至少34、至少35、至少36、至少37、至少38、至少39、至少40、至少41、至少42、至少43、至少44、至少45、至少46、至少47、至少48、至少49、至少50、至少51、至少52、至少53、至少54、至少55、至少56、至少57、至少58、至少59、至少60、至少61、至少62、至少63、至少64、至少65、至少66、至少67、至少68、至少69、至少70、至少71、至少72、至少73、至少74、至少75、至少76、至少77、至少78、至少79、至少80或至少81个氨基酸残基。在一些实施方案中,肽是少于4、少于5、少于6、少于7、少于8、少于9、少于10、少于11、少于12、少于13、少于14、少于15、少于16、少于17、少于18、少于19、少于20、少于21、少于22、少于23、少于24、少于25、少于26、少于27、少于28、少于29、少于30、少于31、少于32、少于33、少于34、少于35、少于36、少于37、少于38、少于39、少于40、少于41、少于42、少于43、少于44、少于45、少于46、少于47、少于48、少于49、少于50、少于51、少于52、少于53、少于54、少于55、少于56、少于57、少于58、少于59、少于60、少于61、少于62、少于63、少于64、少于65、少于66、少于67、少于68、少于69、少于70、少于71、少于72、少于73、少于74、少于75、少于76、少于77、少于78、少于79、少于80或少于81个氨基酸残基。在一些实施方案中,肽包含一种或多种非天然氨基酸。在一些实施方案中,一种或多种非天然氨基酸是n
‑
甲基氨基酸。
12.本文提供了药物组合物,其包含:β
‑
连环蛋白抑制剂;和药学上可接受的载体。
13.本文提供了药物组合物,其包含:具有对β
‑
连环蛋白的结合特异性的肽;和药学上可接受的载体。
14.本文提供了药物组合物,其包含:包含肽的β
‑
连环蛋白抑制剂;和药学上可接受的载体。
15.本文提供了药物组合物,其包含:如本文所述的肽;和药学上可接受的载体。在一些实施方案中,肽是环化肽。在一些实施方案中,组合物包含吸收或渗透促进剂。在一些实施方案中,吸收促进剂包含亚砜,例如二甲基亚砜(dmso);月桂氮革酮(laurocapran)(1
‑
十二烷基氮杂环庚烷
‑2‑
酮);吡咯烷酮,例如n
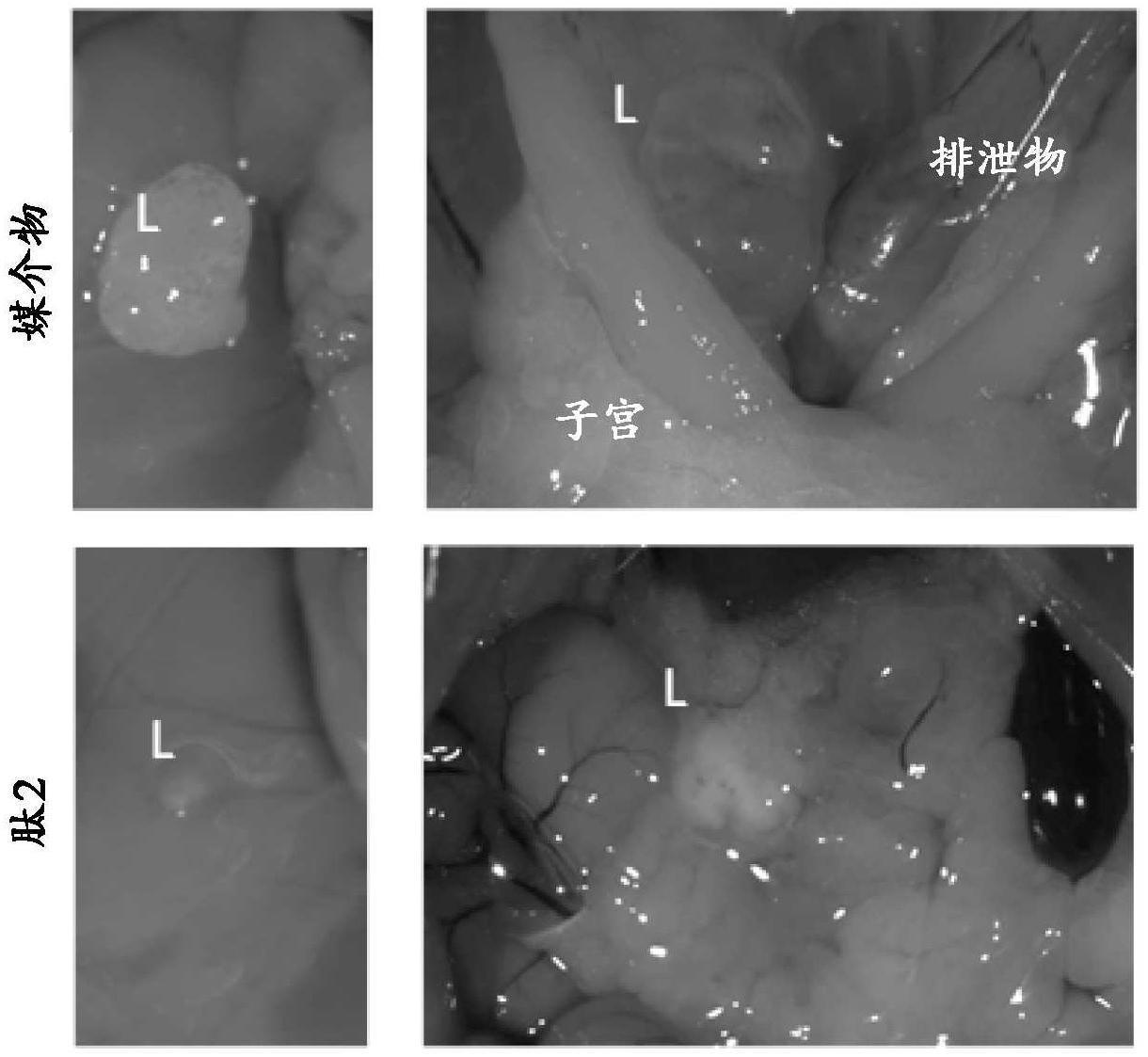
‑
甲基
‑2‑
吡咯烷酮;萜烯和萜类化合物;精油;噁唑烷酮,例如4
‑
去环噁唑烷
‑2‑
酮;尿素;环十五内酯;n
‑
[8
‑
(2
‑
羟基苯甲酰基)氨基]辛酸钠(snac);8
‑
(n
‑2‑
羟基
‑5‑
氯
‑
苯甲酰基)
‑
氨基
‑
辛酸(5
‑
cnac);中链脂肪酸、盐和衍生物;癸酸钠;辛酸钠;蛋白酶抑制剂和ω
‑
3脂肪酸;液体混合胶束喷雾;脂质聚合物胶束;烷基糖苷;壳聚糖;十二烷基
‑2‑
n,n
‑
二甲氨基丙酸酯(ddaip);细胞膜脂质组分;纳米颗粒剂;脂质体、配体;和亲脂性修饰物中的一种或多种。在一些实施方案中,吸收促进剂是癸酸钠。
[0016]
本文提供了包含如本文所述的肽或药物组合物的制剂,其中所述制剂包括溶液剂、洗剂、振荡洗剂、乳膏剂、软膏剂、凝胶剂、泡沫剂、散剂、固体剂、糊剂、酊剂、微粒剂、微胶囊剂、纳米颗粒剂、脂质体、乳剂、或冻干剂。本文还描述了制剂,其中凝胶剂是热可逆凝胶剂。本文还描述了制剂,其中所述制剂包含一种或多种粘膜粘附聚合物。本文还描述了制剂,其中所述制剂用于局部施用。
[0017]
本文提供了包含如本文所述的肽或药物组合物的阴道内装置。在一些实施方案中,阴道内装置是栓剂、透皮贴剂、海绵、胶带、膜、阴道内环、阴道棉塞、阴道环、阴道条、阴道胶囊、阴道片剂、阴道子宫托、阴道杯、阴道海绵或宫内节育器。在一些实施方案中,将肽或药物组合物配制成选自溶液剂、洗剂、振荡洗剂、乳膏剂、软膏剂、凝胶剂、泡沫剂、粘膜粘
附组合物、包衣、核、基质、乳剂、脂质体、或冻干剂的制剂,其中阴道内装置包含该制剂。在一些实施方案中,阴道内装置包含约0.01mg至约5000mg的抑制剂。在一些实施方案中,阴道内装置包含约0.01mg、约0.05mg、约0.1mg、约0.5mg、约1mg、约5mg、约10mg、约20mg、约40mg、约60mg、约80mg、约100mg、约150mg、约200mg、约400mg、约600mg、约800mg、约1000mg、约1200mg、约1400mg、约1600mg、约1800mg、约2000mg、约2500mg、约3000mg、约3500mg、约4000mg、约4500mg或约5000mg的抑制剂。在一些实施方案中,阴道内装置被配置成经粘膜递送抑制剂。在一些实施方案中,阴道内装置被配置为在1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、1天、2天、3天、4天、5天、6天、7天、1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、1年、2年、3年、4年、5年、6年、7年、8年、9年、10年、11年或12年内递送抑制剂。在一些实施方案中,阴道内装置被配置为递送约0.01mg至约1000mg抑制剂/天。在一些实施方案中,阴道内装置被配置为递送约0.01mg、约0.05mg、约0.1mg、约0.5mg、约1mg、约5mg、约10mg、约20mg、约40mg、约60mg、约80mg、约100mg、约150mg、约200mg、约400mg、约600mg、约800mg或约1000mg抑制剂/天。在一些实施方案中,装置是栓剂。在一些实施方案中,装置是透皮贴剂。在一些实施方案中,装置是海绵。在一些实施方案中,装置是胶带。本文还提供了阴道内装置,其中所述装置是阴道内环。在一些实施方案中,阴道内环包括有机硅插入物、压制片剂或冻干凝胶剂。在一些实施方案中,将肽或组合物掺入整个有机硅插入物、压制片剂或冻干凝胶剂中。在一些实施方案中,装置是阴道棉塞。在一些实施方案中,装置是阴道环。在一些实施方案中,装置是阴道条。在一些实施方案中,装置是阴道胶囊。在一些实施方案中,装置是阴道片剂。在一些实施方案中,装置是阴道子宫托。在一些实施方案中,装置是阴道杯。在一些实施方案中,装置是阴道海绵。在一些实施方案中,装置是宫内节育器。
[0018]
本文提供了包含如本文所述的肽或药物组合物的制剂,其中所述制剂用于口服施用。本文还提供了制剂,其中所述制剂是片剂或胶囊剂。在一些实施方案中,制剂是液体。
[0019]
本文提供了在受试者中抑制β
‑
连环蛋白的方法,其包括将如本文所述的装置插入受试者的阴道中。
[0020]
本文提供了抑制β
‑
连环蛋白的方法,其包括使细胞与本文所述的肽或药物组合物接触。
[0021]
本文提供了治疗子宫内膜异位症的方法,其包括向有需要的受试者施用治疗有效量的如本文所述的肽或药物组合物。
[0022]
本文提供了减轻与子宫内膜异位症相关的症状的方法,其包括向有需要的受试者施用治疗有效量的如本文所述的肽或药物组合物。在一些实施方案中,所述症状包括选自慢性疼痛、中枢敏化、肌筋膜疼痛、附件肿块、不孕症、痛经、遗传易感性、非经期盆腹疼痛、性交困难、肠症状(腹泻、痉挛、便秘)、排便痛(大便困难)、卵巢肿块或肿瘤、膀胱疼痛症状和排尿困难中的至少一种。
[0023]
本文提供了用于治疗病况的方法,其包括向受试者施用治疗有效量的如本文所述的肽或药物组合物。在一些实施方案中,所述病况是组织浸润病况、组织迁移病况、组织侵入病况或其组合。在一些实施方案中,病况包括癌症。在一些实施方案中,癌症包括结直肠
癌、鳞状细胞癌、头颈癌、胰腺癌、乳腺癌、髓性白血病、基底细胞癌、滑膜肉瘤、非小细胞肺癌、实体瘤或前列腺癌。在一些实施方案中,病况包括子宫内膜异位症。在一些实施方案中,肽结合β
‑
连环蛋白。在一些实施方案中,肽抑制β
‑
连环蛋白。在一些实施方案中,肽结合细胞质β
‑
连环蛋白。在一些实施方案中,肽与细胞质β
‑
连环蛋白结合以抑制β
‑
连环蛋白向细胞核的易位。在一些实施方案中,肽结合细胞质β
‑
连环蛋白以维持或增加膜结合的β
‑
连环蛋白。在一些实施方案中,肽结合细胞质β
‑
连环蛋白以减少核β
‑
连环蛋白。在一些实施方案中,肽结合细胞质β
‑
连环蛋白以防止β
‑
连环蛋白充当致癌基因、基质金属蛋白酶9(mmp9)或氯化物c3通道(clc
‑
3)的转录因子。在一些实施方案中,肽与细胞质β
‑
连环蛋白结合以防止ems细胞的转化、侵入、迁移、纤维化或其任何组合。在一些实施方案中,肽与细胞质β
‑
连环蛋白结合以防止β
‑
连环蛋白与雌激素受体(esr1)结合。在一些实施方案中,肽结合细胞质β
‑
连环蛋白并且β
‑
连环蛋白的膜活性没有降低。在一些实施方案中,肽结合细胞质β
‑
连环蛋白并且β
‑
连环蛋白
‑
e
‑
钙粘蛋白结合没有降低。在一些实施方案中,肽防止致癌转录因子活性。在一些实施方案中,游离细胞质β
‑
连环蛋白的减少是相对于在不同时间点取自受试者的细胞而言。在一些实施方案中,受试者细胞中膜结合的细胞质β
‑
连环蛋白的量增加至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至少100%。在一些实施方案中,膜结合细胞质β
‑
连环蛋白的增加是相对于未施用治疗有效量的药物组合物的对照受试者的细胞而言。在一些实施方案中,膜结合β
‑
连环蛋白的增加是相对于在受试者发展病况之前获取的受试者的细胞而言。在一些实施方案中,膜结合β
‑
连环蛋白的增加是相对于在不同时间点取自受试者的细胞而言。在一些实施方案中,受试者的细胞中的核β
‑
连环蛋白的量减少至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至少100%。在一些实施方案中,核β
‑
连环蛋白的减少是相对于未施用治疗有效量的药物组合物的对照受试者的细胞而言。在一些实施方案中,核β
‑
连环蛋白的减少是相对于在受试者发展病况之前获取的受试者的细胞而言。在一些实施方案中,核β
‑
连环蛋白的减少是相对于在不同时间点取自受试者的细胞而言。
[0024]
在一些实施方案中,治疗有效量为约0.01mg至约1000mg。
[0025]
本文提供了预防病况的方法,其包括向受试者施用治疗有效量的如本文所述的肽或药物组合物。在一些实施方案中,所述病况是组织浸润病况、组织迁移病况、组织侵入病况或其组合。在一些实施方案中,病况包括癌症。在一些实施方案中,癌症包括结直肠癌、鳞状细胞癌、头颈癌、胰腺癌、乳腺癌、髓性白血病、基底细胞癌、滑膜肉瘤、非小细胞肺癌、实体瘤或前列腺癌。在一些实施方案中,病况包括子宫内膜异位症。在一些实施方案中,肽结合β
‑
连环蛋白。在一些实施方案中,肽抑制β
‑
连环蛋白。在一些实施方案中,肽结合细胞质β
‑
连环蛋白。在一些实施方案中,肽与细胞质β
‑
连环蛋白结合以抑制β
‑
连环蛋白向细胞核的易位。在一些实施方案中,肽结合细胞质β
‑
连环蛋白以维持或增加膜结合的β
‑
连环蛋白的量。在一些实施方案中,肽结合细胞质β
‑
连环蛋白以防止β
‑
连环蛋白充当致癌基因、基质金属蛋白酶9(mmp9)或氯化物c3通道(clc
‑
3)的转录因子。在一些实施方案中,肽防止ems细
胞的转化、侵入、迁移、纤维化或其任何组合。在一些实施方案中,肽阻止β
‑
连环蛋白与雌激素受体(esr1)结合。在一些实施方案中,肽结合细胞质β
‑
连环蛋白并且β
‑
连环蛋白的膜活性没有降低。在一些实施方案中,肽结合细胞质β
‑
连环蛋白并且β
‑
连环蛋白
‑
e
‑
钙粘蛋白结合不受影响。在一些实施方案中,肽防止致癌转录因子活性。在一些实施方案中,受试者的细胞中的核β
‑
连环蛋白的量减少至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至少100%。在一些实施方案中,核β
‑
连环蛋白的减少是相对于未施用治疗有效量的药物组合物的对照受试者的细胞而言。在一些实施方案中,核β
‑
连环蛋白的减少是相对于在受试者发展子宫内膜异位症或组织浸润病况之前获取的受试者细胞而言。在一些实施方案中,核β
‑
连环蛋白的减少是相对于在不同时间点取自受试者的细胞而言。在一些实施方案中,治疗有效量为约0.01mg至约1000mg。在一些实施方案中,静脉内施用肽或药物组合物。在一些实施方案中,肌内施用肽或药物组合物。在一些实施方案中,肽或药物组合物与治疗骨质疏松症的药物的施用同时施用。在一些实施方案中,治疗骨质疏松症的药物包括阿仑膦酸盐、伊班膦酸盐、利塞膦酸盐、唑来膦酸、地诺单抗、降钙素、雌激素、雷洛昔芬、巴多西酚(bazodoxifene)、特立帕肽、阿巴帕肽或其任何组合。在一些实施方案中,治疗骨质疏松症的药物是唑来膦酸。
[0026]
本文提供了一种被配制为以时间控制的方式释放肽的包含肽的阴道内装置,该肽包含seq id no:215或393的氨基酸序列,其中所述肽结合β
‑
连环蛋白,其中所述肽抑制β
‑
连环蛋白向细胞核的易位,其中所述肽不降低β
‑
连环蛋白在膜中结合e
‑
钙粘蛋白;并且其中所述肽减小有需要的受试者的子宫内膜异位症病变的大小或严重程度或与子宫内膜异位症相关的其他症状。援引并入
[0027]
本说明书中提到的所有出版物、专利和专利申请都通过引用并入本文,其程度如同每个单独的出版物、专利或专利申请被明确地并单独地指示通过引用并入一样。
附图说明
[0028]
图1显示了在“关”和“开”状态下的wnt/β
‑
连环蛋白信号传导通路。
[0029]
图2a显示了受与β
‑
连环蛋白抑制肽一起温育的wnt应答型启动子控制的转染的报告细胞中的萤光素酶表达。
[0030]
图2b显示了在与β
‑
连环蛋白抑制肽(seq id no:264和seq id no:396)一起温育后β
‑
连环蛋白表达的细胞系中的细胞增殖。
[0031]
图3显示了在对应于seq id no:42的β
‑
连环蛋白抑制肽的存在下的e
‑
钙粘蛋白结合。
[0032]
图4a
‑
4c显示了β
‑
连环蛋白的肽抑制剂导致病变消退。图4a显示了对每日阴道涂片的分析以评估发情周期阶段。图4b显示了肽2(seq id no:215)表明病变消退。图4c显示了用媒介物或肽2治疗的病变的图像。每次治疗都显示了两个病变(l)图像。供体小鼠表达绿色荧光蛋白,且病变呈绿色。放大倍数=7.5倍。
[0033]
图5a显示了取自仅用媒介物处理的小鼠中ems病变的样本的组织学。图5b显示了
取自用肽2处理的小鼠中ems病变的样本的组织学。
[0034]
图6a显示了染色的小鼠模型子宫内膜异位病变的放大20倍的代表性载玻片,显示β
‑
连环蛋白在用治疗性肽治疗后未定位于细胞核,并且该肽抑制剂遵循β
‑
连环蛋白定位模式。图6b显示了染色的小鼠模型子宫内膜异位病变放大120倍的代表性载玻片,显示β
‑
连环蛋白在肽治疗的样本中比在对照处理的小鼠中更多地定位在膜中。
[0035]
图7a比较了用治疗性肽治疗的病变与未治疗的对照中膜结合β
‑
连环蛋白的定量。图7b比较了用治疗性肽治疗的病变与未治疗的对照中核β
‑
连环蛋白的定量。
[0036]
图8a和图8b显示了治疗性肽比已知阳性对照(icg001)更大程度地抑制wnt通路中的基因转录物。
[0037]
图9显示了使用具有seq id no:404的肽的荧光偏振测定的结果。
具体实施方式
[0038]
本文提供了与例如用于治疗各种疾病和病况的治疗疗法结合使用的药剂、组合物、方法和制品。在一些情况下,疾病和病况可包括子宫内膜异位症。所述方法可包括向受试者施用抑制剂或包含抑制剂的组合物、制剂或装置。示例性抑制剂包括β
‑
连环蛋白抑制剂。抑制剂可以是或可以包括肽,例如分离的肽或肽的组合。i.定义
[0039]
除非另有定义,否则本文中使用的所有专门术语、符号和其他技术和科学术语或用辞旨在具有与要求保护的主题所属领域的普通技术人员通常理解的相同的含义。在一些情况下,为了清楚和/或便于参考,本文定义了具有普遍理解的含义的术语,并且本文中包含的此类定义不必被解释为相对于本领域通常理解的定义代表实质性差异。
[0040]
遍及整个申请,可以范围格式呈现各个实施方案。应当理解,范围格式的描述仅仅是为了方便和简洁,而不应理解为对本公开范围的非弹性限制。因此,应该认为对范围的描述已经具体公开了所有可能的子范围以及该范围内的单个数值。例如,对诸如1至6的范围的描述应被认为已经具体公开了例如1至3、1至4、1至5、2至4、2至6、3至6等的子范围,以及该范围内的单个数字,例如1、2、3、4、5和6。无论范围的广度如何,这都适用。
[0041]
如说明书和权利要求书中所使用的,单数形式的“一个(a)”、“一种(an)”和“所述(the)”包括复数引用,除非上下文另外明确指出。例如,术语“一个样本”包括多个样本,包括其混合物。
[0042]
术语“确定”、“测量”、“评价”、“评估”、“测定”和“分析”在本文中通常互换使用,指的是测量形式,包括确定元素是否存在(例如,检测)。这些术语可以包括定量、定性或定量和定性确定。评估备选地是相对的,或者是绝对的。“检测
…
的存在”包括确定某物的存在量,以及确定它是否存在。
[0043]
术语“受试者”、“个体”或“患者”在本文中通常互换使用。“受试者”可以是包含表达的遗传物质的生物实体。生物实体可以是植物、动物或微生物,包括例如,细菌、病毒、真菌和原生动物。受试者可以是体内获得或体外培养的生物实体的组织、细胞及其后代。受试者可以是哺乳动物。哺乳动物可以是人。受试者可能被诊断或疑似处于疾病的高风险中。该疾病可以是子宫内膜异位症。在一些情况下,受试者不一定被诊断或疑似处于该疾病的高风险中。
[0044]
术语“体内”用于描述在受试者体内发生的事件。
[0045]
术语“离体”用于描述在受试者体外发生的事件。不在受试者上进行“离体”测定。相反,它是在与受试者分开的样本上进行的。对样本进行的“离体”测定的示例是“体外”测定。
[0046]
术语“体外”用于描述在用于容纳实验室试剂的容器中发生的事件,从而使其与从中获得材料的活生物源有机体分离。体外测定可以包括基于细胞的测定,其中使用活细胞或死细胞。体外测定还可以包括不使用完整细胞的无细胞测定。
[0047]
如本文所用,术语“约”一数字是指该数字加上或减去该数字的10%。术语“约”一范围是指该范围减去其最低值的10%,再加上其最大值的10%。
[0048]
如本文所用,术语“治疗”用于指代用于在接受者中获得有益或期望结果的药物或其他干预方案。有益的或期望的结果包括但不限于治疗益处和/或预防益处。治疗益处可以指根除或改善症状或正在治疗的基础病症。而且,通过根除或改善与基础病症相关的一种或更多种生理症状可获得治疗益处,使得尽管受试者仍可能患有基础疾病,但在受试者中观察到了改善。预防作用包括延迟、预防或消除疾病或病况的出现,延迟或消除疾病或病况的症状发作,减缓、停止或逆转疾病或病况的进展,或其任何组合。为了预防益处,即使可能尚未做出该疾病的诊断,处于发展特定疾病的风险中的受试者或报告一种或多种疾病生理症状的受试者也可以接受治疗。
[0049]
表1中定义了本文序列中使用的许多术语的缩写。表1
[0050]
本文使用的章节标题仅用于组织目的,不应被解释为限制所描述的主题。ii.wnt典型通路/β
‑
连环蛋白
[0051]
wnt通路参与基因表达、细胞行为、细胞粘附和细胞极性的控制。典型(β
‑
连环蛋白依赖性)wnt信号传导通路是wnt通路中研究得最好的通路,并且在整个进化中高度保守。在该通路中,wnt信号传导抑制β
‑
连环蛋白的降解,其可以调节许多基因的转录。wnt信号传导通过wnt蛋白与其各自的二聚体细胞表面受体连接而激活,该二聚体细胞表面受体由七种跨膜卷曲蛋白和lrp5/6组成。与其受体连接后,细胞质蓬乱蛋白(dvl)被募集、磷酸化和激活。dvl的激活诱导gsk
‑
3β从轴蛋白(axin)解离并导致gsk
‑
3β的抑制。接下来,由于“破坏复合物”失活,β
‑
连环蛋白的磷酸化和降解受到抑制。随后,稳定的β
‑
连环蛋白易位到细胞核中,导致不同靶基因表达的变化。
[0052]
在健康细胞中,β
‑
连环蛋白通常与细胞膜处的e
‑
钙粘蛋白结合,并受wnt通路调节,如图1所示。在健康的妇科上皮细胞中,高浓度的β
‑
连环蛋白通常在细胞质和细胞核中以低浓度存在于膜处(aberle,h.等人,embo j 16,3797
‑
3804,1997;jha,r.k.等人,febs lett 580,5653
‑
5660,2006;lee,k.y.等人,trends endocrinol metab 18,234
‑
239,2007;jeong,j.w.等人,oncogene 28,31
‑
40,2009,其各自通过引用并入本文以用于此公开)。wnt/β
‑
连环蛋白信号传导通路被“关闭”,β
‑
连环蛋白与破坏复合物相互作用,该破坏复合物使β
‑
连环蛋白磷酸化并将其靶向进行蛋白酶体降解。
[0053]
相反,在wnt通路失调中,β
‑
连环蛋白通常从膜上解离并在细胞质中积累。一旦进入细胞质,β
‑
连环蛋白通常能够易位到细胞核中,在那里它可以充当致癌基因(clevers,h.,cell 127,469
‑
480,2006)、基质金属蛋白酶9(mmp9)、氯化物3通道(clc
‑
3)和其他wnt通路激活蛋白的转录因子。这些蛋白质被认为能够启动ems细胞的转化、侵入、迁移和纤维化(guan,y.t.等人,hum reprod 31,986
‑
998,2016)(matsuzaki,s.等人,mol cell ther 2,36,2014)(zhang,l.等人,biol reprod 94,70,2016)(zhang,l.等人,mol hum reprod 22,526
‑
535,2016)。当转导通路处于“开启”状态时,细胞质β
‑
连环蛋白可累积,易位至细胞核,并与转录因子(包括er
‑
α)结合以刺激wnt靶基因的转录,从而产生clc3、mmp9和sox。
[0054]
在ems中,β
‑
连环蛋白通常通过受体失调或体细胞突变从膜分离。它被认为与雌激素受体(esr1)结合并易位到细胞核中,在那里它被认为激活致癌基因/内基因体并引起病变(valentijn,a.j.等人,hum reprod 28,2695
‑
2708,2013)(kouzmenko,a.p.等人,j biol chem 279,40255
‑
40258,2004)。
[0055]
维持β
‑
连环蛋白的膜活性被认为是健康细胞的标志;破坏β
‑
连环蛋白膜与e
‑
钙粘蛋白结合的wnt拮抗剂被认为会增加细胞质β
‑
连环蛋白的浓度和细胞迁移率。这会导致不希望的原癌基因样效应(onder,t.t.等人,cancer res 68,3645
‑
3654,2008)。因此,能够抑制β
‑
连环蛋白核易位和致癌转录因子活性的细胞质β
‑
连环蛋白特异性wnt拮抗剂是治疗ems的一种有吸引力的方法(matsuzaki,s.等人,mol cell ther 2,36,2014;xiong,w.等人,reproduction 150,507
‑
516,2015;pazhohan,a.等人,eur j obstet gynecol reprod biol 220,1
‑
5,2018,其各自均通过引用并入本文用于此公开)。
[0056]
wnt通路的失调被认为存在于ems的所有病变亚型中。例如,细胞质β
‑
连环蛋白易位至细胞核并激活靶基因。防止β
‑
连环蛋白易位到细胞核靶向ems的下游启动子,而不会引起靶向上游受体的不期望的副作用。wnt拮抗剂可以逆转子宫内膜异位病变。迄今为止,四种wnt拮抗剂(pkf 115
‑
584、cgp049090、氯硝柳胺和β
‑
连环蛋白sirna)已成功逆转ems亚型上的ems病变进展;由于脱靶效应,没有一个发展到临床试验。抑制过量细胞质β
‑
连环蛋白的易位并抑制其转录因子活性而不干扰β
‑
连环蛋白:e
‑
钙粘蛋白相互作用以维持膜蛋白功能的治疗剂将是对本领域当前考虑的治疗剂的显著改进。
[0057]
正常子宫功能通常包括失活的典型wnt通路和主要与e
‑
钙粘蛋白膜复合物相关的β
‑
连环蛋白(图1)。wnt通路的激素激活将β
‑
连环蛋白释放到细胞质中以易位至细胞核,激活核转录活性并导致ems发病机制。a.β
‑
连环蛋白抑制剂
[0058]
在一些实施方案中,本文提供的组合物包括β
‑
连环蛋白抑制剂。β
‑
连环蛋白抑制剂可用于多种治疗环境,包括例如治疗、抑制、预防或减轻ems及其相关症状。此类抑制剂可能够直接解决ems病因、逆转疾病进展并预防或延迟ems复发。在一些情况下,β
‑
连环蛋白抑制剂可以缩小现有的ems病变。在一些情况下,β
‑
连环蛋白抑制剂可以抑制wnt通路的失调,这被认为是ems的根本原因之一。β
‑
连环蛋白抑制剂有时可以通过预防子宫内膜细胞侵入来限制ems发病机制。或者或此外,β
‑
连环蛋白抑制剂可以抑制上皮细胞间质转型(emt)。这种抑制可以限制子宫内膜异位病变的增殖。或者或此外,β
‑
连环蛋白抑制剂有时可以减少tgf
‑
β1和wnt1的旁分泌产生,这进而可以减少卵巢子宫内膜瘤的纤维化。此外,β
‑
连环蛋白抑制剂有时可以降低mmp9表达,其可以导致减少的血管生成。抑制或减少血管生成可以抑制子宫内膜细胞在子宫外生长的能力。
[0059]
作为示例性优点,靶向β
‑
连环蛋白可以减少与靶向上游受体相关的不期望的副作用。在一些情况下,这些副作用可能包括过多的雌激素产生。在一些情况下,抑制剂优选抑制β
‑
连环蛋白从细胞质易位到细胞核的能力。在一些情况下,抑制剂优选抑制β
‑
连环蛋白的转录活性。这些示例性特征可以有利地使β
‑
连环蛋白的膜功能大部分或完全完整,这在一些情况下可以减少与抑制wnt功能相关的副作用。因此,在一些情况下,抑制剂不会抑制β
‑
连环蛋白与细胞膜的结合。
[0060]
在一些情况下,抑制剂不会干扰β
‑
连环蛋白与结合因子结合的能力,这可能导致副作用。例如,在一些方面,抑制剂可能不会干扰β
‑
连环蛋白与e
‑
钙粘蛋白或腺瘤性结肠息肉病(apc)之间的结合或相互作用,或者可能不会破坏核tcf与dna的结合。1.肽
[0061]
在一些实施方案中,β
‑
连环蛋白抑制剂包含肽。在一些情况下,肽对应于,例如基于或衍生自结合β
‑
连环蛋白的蛋白质或肽。在一些情况下,肽含有合成肽序列。
[0062]
本文所述的肽可针对其期望靶标的亲和力、吸收或细胞摄取、稳定性、蛋白酶抗性和其他因素进行优化。可以使用多种方法改变肽对其预期靶标的亲和力。例如,可以通过氨基酸替换提高亲和力。此外,改变肽的大小、改变环化位置、增加疏水性以及修饰氨基酸或将人工氨基酸掺入肽的结构都可能影响肽的亲和力。示例性修饰包括掺入n
‑
甲基和α
‑
甲基氨基酸。
[0063]
所提供的实施方案之中包括与本文所述的肽具有相同或相似结构和特性的拟肽
类药剂。此类拟肽类药剂包括设计用于模拟肽的小蛋白样链。这些包括包含肽的修饰的拟肽类药剂,或通过设计模拟肽的类似系统,例如类肽和β
‑
肽。
[0064]
示例性肽包括seq id no:1
‑
seq id no:500,如表4所列。肽通常被鉴定为两个家族之一:1,与tcf4/β
‑
连环蛋白结合区具有同源性,和2,与β
‑
连环蛋白结合装订肽具有相似的序列。在一些情况下,肽包含与seq id no:1
‑
seq id no:500中任一个具有至少80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。
[0065]
或者或另外,肽可包含具有式x1‑
x2‑
x3‑
x4‑
x5‑
x6‑
x7‑
x8‑
x9‑
x
10
‑
x
11
‑
x
12
‑
x
13
‑
x
14
‑
x
15
‑
x
16
的序列。在一些实施方案中,x1为m或空。在一些实施方案中,x2为s、i、g、t、a、l或空;x3为r、k或空。在一些实施方案中,x4为带正电荷的氨基酸、瓜氨酸、orn、d、e、8
‑
氨基辛酸或具有4至12个碳的氨基羧酸。在一些实施方案中,x5为m、正亮氨酸、orn、d、e、k、h、r、k、8
‑
氨基辛酸、具有4至12个碳原子的氨基羧酸或空。在一些实施方案中,x6为w、y、f或n
‑
甲基a。在一些实施方案中,x7为f、i、l、chg、cha或tle。在一些实施方案中,x8为l、i或a。在一些实施方案中,x9为l、i或a。在一些实施方案中,x
10
为c、s、a、abu、c(me)或s(bzl)。在一些实施方案中,x
11
为f、h、a、k、e、chg、cng或orn。在一些实施方案中,x
12
为w、y、a或f。在一些实施方案中,x
13
为g、gaba或空。在一些实施方案中,x1为m或空;x2为s、i、g、t、a、l或空;x3为r、k或空;x4为带正电荷的氨基酸、瓜氨酸、orn、d、e、8
‑
氨基辛酸或具有4至12个碳的氨基羧酸;x5为m、正亮氨酸、orn、d、e、k、h、r、k、8
‑
氨基辛酸、具有4至12个碳的氨基羧酸或空;x6为w、y、f或n
‑
甲基a;x7为f、i、l、chg、cha或tle;x8为l、i或a;x9为l、i或a;x
10
为c、s、a、abu、c(me)或s(bzl);x
11
为f、h、a、k、e、chg、cng或orn;x
12
为w、y、a或f;且x
13
为g、gaba或空。
[0066]
或者或另外,肽可包含具有式r
‑
x1‑
x2‑
x3‑
x4‑
x5‑
x6‑
x7‑
x8‑
x9‑
x
10
‑
x
11
‑
x
12
‑
x
13
‑
x
14
‑
x
15
‑
x
16
的序列。在一些实施方案中,r为nh2、乙酰化物、硬脂酸、棕榈酸、肉豆蔻酸、月桂酸、c1
‑
c8烃、c1
‑
c8脂肪酸、或空)。在一些实施方案中,x1为m、g、β丙氨酸、正亮氨酸、正缬氨酸、或空)。在一些实施方案中,x2为w、n
‑
甲基w、r、y、f、瓜氨酸、或k)。在一些实施方案中,x3为p、w、n
‑
甲基
‑
w、n
‑
乙基
‑
w、n
‑
甲基a、n
‑
乙基a、l、pip、aib、y或f)。在一些实施方案中,x4为e、q、n或d)。在一些实施方案中,x5为s、α甲基s、k、d、orn、t或e)。在一些实施方案中,x6为i、chg、h或l)。在一些实施方案中,x7为l或i)。在一些实施方案中,x8为d、n、e或q)。在一些实施方案中,x9为d、e、k、q或orn)。在一些实施方案中,x
10
为h或甲基
‑
h)。在一些实施方案中,x
11
为v、α甲基v、chg、l、i或正缬氨酸)。在一些实施方案中,x
12
为q、aib、s、r、或n)。在一些实施方案中,x
13
为r、k、瓜氨酸、orn、d或e)。在一些实施方案中,x
14
为v、i、l或正缬氨酸)。在一些实施方案中,x
15
为w、y或f)。在一些实施方案中,x
16
为r、g、或空。在一些实施方案中,r为nh2、乙酰化物、硬脂酸、棕榈酸、肉豆蔻酸、月桂酸、c1‑
c8烃、c1‑
c8脂肪酸或空;x1为m、g、β丙氨酸、正亮氨酸、正缬氨酸或空;x2为w、n
‑
甲基w、r、y、f、瓜氨酸或k;x3为p、w、n
‑
甲基
‑
w、n
‑
乙基
‑
w、n
‑
甲基a、n
‑
乙基a、l、pip、aib、y或f;x4为e、q、n或d;x5为s、α甲基s、k、d、orn、t或e;x6为i、chg、h或l;x7为l或i;x8为d、n、e或q;x9为d、e、k、q或orn;x
10
为h或甲基
‑
h;x
11
为v、α甲基v、chg、l、i或正缬氨酸;x
12
为q、aib、s、r或n;x
13
为r、k、瓜氨酸、orn、d或e;x
14
为v、i、l或正缬氨酸;x
15
为w、y或f;且x
16
为r、g或空。
[0067]
在一些情况下,可以从肽中去除极性或带电基团以增加亲和力或渗透性。例如,亮氨酸或异亮氨酸通常可用环己基甘氨酸代替。
[0068]
在一些实施方案中,肽的长度可为3至80个氨基酸。在一些实施方案中,肽的长度
为至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26、至少27、至少28、至少29、至少30、至少31、至少32、至少33、至少34、至少35、至少36、至少37、至少38、至少39、至少40、至少41、至少42、至少43、至少44、至少45、至少46、至少47、至少48、至少49、至少50、至少51、至少52、至少53、至少54、至少55、至少56、至少57、至少58、至少59、至少60、至少61、至少62、至少63、至少64、至少65、至少66、至少67、至少68、至少69、至少70、至少71、至少72、至少73、至少74、至少75、至少76、至少77、至少78、至少79、至少80或至少81个氨基酸残基。
[0069]
在一些实施方案中,肽的长度少于4、少于5、少于6、少于7、少于8、少于9、少于10、少于11、少于12、少于13、少于14、少于15、少于16、少于17、少于18、少于19、少于20、少于21、少于22、少于23、少于24、少于25、少于26、少于27、少于28、少于29、少于30、少于31、少于32、少于33、少于34、少于35、少于36、少于37、少于38、少于39、少于40、少于41、少于42、少于43、少于44、少于45、少于46、少于47、少于48、少于49、少于50、少于51、少于52、少于53、少于54、少于55、少于56、少于57、少于58、少于59、少于60、少于61、少于62、少于63、少于64、少于65、少于66、少于67、少于68、少于69、少于70、少于71、少于72、少于73、少于74、少于75、少于76、少于77、少于78、少于79、少于80或少于81个氨基酸残基。
[0070]
在一些实施方案中,肽可以显示与tcf4的同源性。在一些实施方案中,肽显示与tcf4具有约10%至约100%的同源性。在一些实施方案中,肽显示与tcf4具有约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%的同源性。
[0071]
在一些实施方案中,肽可以显示与轴蛋白的同源性。在一些实施方案中,肽显示与轴蛋白具有约10%至约100%的同源性。在一些实施方案中,肽显示与轴蛋白具有约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%或约100%的同源性。a.肽合成方法
[0072]
本文所述的肽可以通过合成方法产生。
[0073]
例如,固相肽合成(spps)允许通过氨基酸衍生物在不溶性多孔支持物上的连续反应快速组装肽链。
[0074]
固体支持物通常包括用连接到新生肽链的反应基团(例如胺或羟基)官能化的小的聚合树脂珠。由于肽在整个合成过程中保持共价连接到支持物上,因此可以通过洗涤和过滤去除多余的试剂和副产物。
[0075]
与肽链n端偶联的每个氨基酸都可以在其n端和侧链上使用适当的保护基团(例如boc(酸不稳定性的)或fmoc(碱不稳定性的))进行保护,这取决于侧链和使用的保护策略(见下文)。
[0076]
一般的spps程序通常是交替的n端脱保护和偶联反应的重复循环之一。可以在每个步骤之间洗涤树脂。首先,氨基酸通常与树脂偶联。随后,胺通常被脱保护,然后与第二氨基酸的游离酸偶联。这个循环可以重复,直到合成期望的序列。spps循环还可包括封端步骤,其阻止未反应的氨基酸末端发生反应。在合成结束时,可以将粗肽从固体支持物上切割下来。该步骤通常可以包括使用强酸(如三氟乙酸或)亲核试剂同时去除所有保护基团。可以将粗肽从非极性溶剂如乙醚中沉淀出来,以去除有机可溶性副产物。可以使用反相hplc纯化粗肽。可以使用连续色谱法(例如mcsgp)去除副产物,以在不牺牲纯度水平的情况下最
大化产率。b.用于环化肽的方法
[0077]
本文所述的肽可以是环肽。环肽通常是稳定的肽类似物,其具有很强的构象稳定性和生物稳定性。在某些情况下,环肽可以提供多种优势。例如,由于它们对蛋白酶的抗性高于非环状对应物,环肽通常代谢较慢;另一方面,与其相应的线性对应物相比,它们具有更长效的药效持久性效果。它们可用于模拟生物活性肽(例如,肽激素)的结构,并能够在体内结合药物靶标。1)二硫桥cys
‑
cys硫醇氧化
[0078]
本文所述的肽可以使用二硫桥环化。肽二硫桥可以连接来自半胱氨酸或半胱氨酸类似物侧链的两个硫醇(sh)基团。通过使用适当的保护基化学来实现特定的分子内或分子间氧化,可以防止不期望的键合。一般来说,二硫桥可以如下形成:分子间(两个肽分子通过二硫桥连接),导致:同源二聚体(两个相同的肽)或异源二聚体(两个不同的肽),或分子内(一个肽分子内的环化)。2)酰胺键形成,内酰胺形成
[0079]
环肽也可以通过将肽的氨基(n)末端经由酰胺键连接到羧基(c)末端来合成。lys和orn的氨基侧链以及asp和glu的羧基侧链也可用于通过酰胺键构建环肽。根据肽的官能团,环肽合成通常使用四种不同方法中的一种:n
‑
末端和c
‑
末端之间的头到尾;n
‑
末端和内部cooh(例如,asp的β
‑
cooh
‑
基团或glu的γ
‑
cooh
‑
基团)之间的头到侧链;内部nh2和c末端之间的侧链到尾(例如,lys的ε
‑
nh2
‑
基团);内部nh2和内部cooh之间的侧链到侧链(例如,lys的ε
‑
nh2
‑
基团与asp的β
‑
cooh
‑
基团或glu的γ
‑
cooh
‑
基团)。3)装订肽合成
[0080]
本文所述的肽可以使用装订肽合成进行环化。肽装订通常通过掺入带有不同长度的末端烯烃系链的α,α二取代的非天然氨基酸来实现。随后的烯烃复分解在氨基酸侧链之间产生碳
‑
碳键系链以环化肽。或者,可以使用本领域通常已知的fmoc固相合成化学来产生装订肽。装订肽具有化学锁定的构象结构,其可以模拟通常在蛋白质
‑
蛋白质相互作用界面处发现的分子结构。当锁定在这种稳定配置中时、约束肽能够穿透细胞并对细胞内蛋白质靶标发挥其作用。肽的大表面积使它们在通过抑制靶向蛋白质
‑
蛋白质相互作用破坏特定信号传导通路的能力方面优于小分子。4)点击化学用于肽环化
[0081]
本文所述的肽也可以使用点击化学进行环化。可以在合成时使用用炔基修饰的受保护氨基酸的不同组合将可点击的官能团并入肽中,然后与叠氮基酸进行点击反应。将所得肽从树脂上分离,得到含三唑的肽。这些官能团也可以通过合成后修饰引入,以产生结构约束肽。c.增加肽稳定性的方法
[0082]
本文所述的肽可以具有修饰以增加稳定性。普遍表明,n
‑
甲基修饰可以增加肽配体的功能和稳定性(fiacco等人,chembiochem 2008,9(14):2200;fiacco等人,chembiochem 2016,17(17):1643,其各自通过引用并入本文以用于此公开)。在本文所述的一些实施方案中,用一种或多种天然氨基酸的n
‑
甲基类似物修饰肽。与由天然残基组成的肽的抗性相比,结合一种或多种n
‑
甲基氨基酸可以将蛋白水解抗性提高10至10000倍。在一
些实施方案中,含有一种或多种n
‑
甲基氨基酸的肽的蛋白水解抗性是由天然残基组成的肽的抗性的至少10倍、至少20倍、至少30倍、至少40倍、至少50倍、至少60倍、至少70倍、至少80倍、至少90倍、至少100倍、至少200倍、至少400倍、至少500倍,至少600倍、至少700倍、至少800倍、至少900倍、至少1000倍、至少2000倍、至少3000倍、至少4000倍、至少5000倍、至少6000倍、至少7000倍、至少8000倍、至少9000倍、至少10,000倍。iii.表征测定a.表面等离子体共振
[0083]
表面等离子体共振(spr)是一种光学现象,其能够实时检测未标记的相互作用物。基于spr的生物传感器,例如t100系统(uppsala,sweden),可用于确定活性浓度以及进行在亲和力和化学动力学方面的分子相互作用的表征。可以使用系统(ge)说明计算表面的最大结合容量(饱和时响应)。结合水平是在表面饱和度为至少20%至80%的分析物浓度范围内确定的。使用insight评价软件(ge)计算的开启率(on rate)、关闭率(off rate)和kd。50%的饱和浓度是从这些系列的稀释中计算的,并表示为k
d
50。来自本文所述的文库的所选肽的结合动力学和热力学显示在表5中。示例性方法在实施例11中描述。
[0084]
在一些情况下,本文描述的肽具有大于约30um的结合亲和力(k
d
)。在一些情况下,本文所述的肽具有小于约30um、小于约10um、小于约5um、小于约1um、小于约500nm、小于约400nm、小于约300nm、小于约200nm、小于约150nm、小于约100nm、小于约50nm、或小于约10nm的结合亲和力(k
d
)。b.荧光偏振(fp)
[0085]
荧光偏振(fp)是用于分析蛋白质
‑
配体相互作用的另一种方法。该方法测量由游离的相比于与溶液中的另一种化合物共轭的经标记化合物发出的荧光的变化。当荧光分子与复合物结合时,由于荧光示踪剂的旋转受限,极化增加。竞争性fp通常用于药物筛选,因为它被格式化用于板格式的高通量筛选。这种免疫测定通过引入非偶联药物来竞争与标记的竞争者
‑
配体复合物结合,从而导致极化减少来进行。tcf4蛋白用于竞争性测定,因为(1)该蛋白影响wnt通路的完全激活和(2)与β
‑
连环蛋白抑制剂具有同源性。示例性方法在实施例13中描述。数据在microsoft excel(microsoft,redmond,wa)中进行分析和绘制。如表5所示计算所得kd50。c.wnt依赖性荧光素酶报告基因测定
[0086]
荧光素酶报告基因测定通常用作在转录水平研究基因表达的工具。来自本文所述文库的肽的特征在于抑制细胞中转录的能力,其中荧光素酶表达受wnt响应型启动子控制。将肽添加到用wnt响应型启动子下游的荧光素酶基因转染的细胞中。用wnt3a蛋白刺激细胞并与来自本文所述文库的肽一起温育。记录发光以确定具有最高β
‑
连环蛋白抑制活性的肽。ec50值是基于发光抑制计算的,并表示为表5中的浓度(um)。d.细胞增殖测定
[0087]
抑制β
‑
连环蛋白的肽会导致结肠癌细胞系(sw480)以及从疾病动物模型中切除的子宫内膜异位症病变中细胞活力降低。来自本文所述的文库的肽的特征在于它们对细胞活力的影响,如使用发光细胞活力测定法(cellpromega,madison,wi)测量的,
并在表5中表示为ic
50
。
[0088]
在一些情况下,本文描述的肽具有大于30um的ic
50
。在一些情况下,本文所述的肽具有小于约30um、小于约25um、小于约22.5um、小于约20um、小于约15um、小于约10um、小于约7.5um、小于约5um、或小于约1um的ic
50
。iv.施用a.给药方法和治疗方案
[0089]
在一个实施方案中,本文所述的抑制剂组合物用于制备用于治疗哺乳动物的疾病、病况或症状的药物,所述哺乳动物将受益于β
‑
连环蛋白
‑
抑制剂的施用。用于在需要此类治疗的哺乳动物中治疗本文所述的任何疾病或病况的方法包括以治疗有效量向所述哺乳动物施用包含至少一种本文所述的抑制剂的药物组合物。
[0090]
可受益于用本文所述的组合物治疗的疾病、病况或症状包括但不限于子宫内膜异位症、子宫内膜异位症病变、子宫内膜瘤、浅表子宫内膜异位植入物、深度浸润性子宫内膜异位症、慢性疼痛、中枢敏化、肌筋膜疼痛、附件肿块、不孕症、痛经、遗传易感性、非经期盆腹疼痛、性交困难、肠症状(腹泻、痉挛、便秘)、排便痛(大便困难)、卵巢肿块或肿瘤、膀胱疼痛症状和排尿困难。
[0091]
在某些实施方案中,施用包含本文所述抑制剂(多种)的组合物用于预防性和/或治疗性治疗。在某些治疗应用中,将组合物以足以治愈或至少部分阻止疾病或病况的至少一种症状的量施用给已经患有疾病或病况的患者。这种用途的有效量取决于疾病或病况的严重程度和病程、既往治疗、患者的健康状况、体重和对药物的反应,以及治疗医生的判断。治疗有效量任选地通过包括但不限于剂量递增和/或剂量范围临床试验的方法确定。
[0092]
在预防性应用中,将含有本文所述抑制剂的组合物施用于易患特定疾病、病症或病况或否则处于特定疾病、病症或病况风险中的患者。将该量定义为“预防有效量或剂量”。在这种用途中,精确的量还取决于患者的健康状况、体重等。当用于患者时,该用途的有效量将取决于疾病、病症或病况的严重程度和病程、既往治疗、患者的健康状况和对药物的反应以及治疗医师的判断。一方面,预防性治疗包括向哺乳动物施用包含本文所述抑制剂的药物组合物以防止疾病或病况的症状复发,所述哺乳动物先前经历过所治疗疾病的至少一种症状并且目前处于缓解期。
[0093]
在某些实施方案中,其中患者的病况没有改善,根据医生的判断,抑制剂长期施用,即持续延长的时间段(包括在患者的整个生命期间),以改善或以其他方式控制或限制患者疾病或病况的症状。
[0094]
在某些实施方案中,其中患者的状态确实有所改善,所施用的药物剂量被暂时减少或暂时暂停一段时间(即,“药物假期”)。在具体的实施方案中,药物假期的长度在2天至1年之间,仅作为示例包括2天、3天、4天、5天、6天、7天、10天、12天、15天、20天、28天或多于28天。仅作为示例,药物假期期间的剂量减少了10%
‑
100%,仅作为示例包括10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%和100%。
[0095]
一旦患者的病况出现改善,必要时施用维持剂量。随后,在具体的实施方案中,根据症状,将施用剂量或频率或两者降低至保持改善的疾病、病症或病况的水平。然而,在某些实施方案中,患者在任何症状复发时都需要长期的间歇性治疗。
[0096]
对应于这样的量的给定药剂的量根据诸如特定抑制剂、疾病病况及其严重性、需要治疗的受试者或宿主的属性(例如,体重、性别)的因素而变化,但无论如何是根据围绕病例的具体情况确定,包括例如施用的特定药剂、施用途径、受治疗的病况和受治疗的受试者或宿主。
[0097]
一般而言,用于成人治疗的剂量通常在每天约0.01mg至约5000mg的范围内。在一些方面,用于成人治疗的剂量为每天约0.01mg至约1000mg。在一些实施方案中,期望的剂量方便地以单剂量呈递或以分剂量同时或以适当的间隔施用,例如每天两个、三个、四个或更多个子剂量。在其他实施方案中,本文所述的组合物被配制用于在数小时、数天或数月的时间段内延长释放。在一些实施方案中,组合物被配制用于在1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、1天、2天、3天、4天、5天、6天、7天、1周、2周、3周、4周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、1年、2年、3年、4年、5年、6年、7年、8年、9年、10年、11年、12年内递送。
[0098]
在一些实施方案中,适用于本文所述抑制剂的每日剂量为约0.01至约50mg/kg体重。在一些实施方案中,基于关于个体治疗方案的许多变量,每日剂量或剂型中活性物质的量低于或高于本文所示的范围。在各种实施方案中,每日和单位剂量根据许多变量而改变,包括但不限于所用抑制剂的活性、待治疗的疾病或病况、施用方式、个体受试者的要求、待治疗的疾病或病况的严重程度,以及执业医生的判断。
[0099]
此类治疗方案的毒性和治疗功效由细胞培养物或实验动物中的标准药学程序确定,包括但不限于ld50和ed50的确定。毒性作用与治疗作用之间的剂量比为治疗指数,并且以ld50与ed50之间的比值表示。在某些实施方案中,从细胞培养测定和动物研究获得的数据用于配置用于哺乳动物,包括人类的治疗有效日剂量范围和/或治疗有效单位剂量。在一些实施方案中,本文所述抑制剂的日剂量在包括具有最小毒性的ed50的循环浓度范围内。在某些实施方案中,日剂量范围和/或单位剂量在该范围内变化,这取决于所采用的剂型和所采用的施用途径。
[0100]
在任何上述方面中是另外的实施方案,其中本文所述的抑制剂的有效量是:(a)对哺乳动物全身施用;和/或(b)对哺乳动物口服施用;和/或(c)对哺乳动物静脉内施用;和/或(d)通过注射施用于哺乳动物;和/或(e)对哺乳动物局部施用;和/或(f)对哺乳动物非全身或局部施用。
[0101]
在任何上述方面是另外的实施方案,包括单次施用有效量的抑制剂,包括另外的实施方案,其中(i)每天施用一次抑制剂;或(ii)在一天的跨度内多次向哺乳动物施用抑制剂。在另外的方面是其中在一段时间内连续施用抑制剂的实施方案。
[0102]
在任何上述方面中,另外的实施方案包括多次施用有效量的抑制剂,包括另外的实施方案,其中(i)连续或间歇施用抑制剂:如以单剂量形式;(ii)多次施用之间的时间间隔为每6小时;(iii)每8小时向哺乳动物施用抑制剂;(iv)每12小时向哺乳动物施用抑制剂;(v)每24小时向哺乳动物施用抑制剂。
[0103]
在任何上述方面中,另外的实施方案包括将抑制剂掺入递送媒介物中以提供抑制剂的持续递送。在一些实施方案中,递送持续约1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、18小时、19小
时、20小时、21小时、22小时、23小时、24小时、1天、2天、3天、4天、5天、6天、7天、1周、2周、3周、4周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、1年、2年、3年、4年、5年、6年、7年、8年、9年、10年、11年、12年。在一些实施方案中,将抑制剂掺入到透皮贴剂、胶带、栓剂、阴道栓剂、阴道棉塞、阴道环、阴道条、阴道胶囊、阴道片剂、阴道子宫托、阴道杯、阴道海绵或宫内节育器中。
[0104]
在另外或替代的实施方案中,该方法包括药物假期,其中抑制剂的施用被暂时中止或被施用的抑制剂的剂量被暂时减少;在药物假期结束时,恢复抑制剂的给药。在一个实施方案中,药物假期的长度从2天到1年不等。
[0105]
在某些情况下,将至少一种本文所述的抑制剂与一种或多种其他治疗剂组合施用是合适的。示例性的另外的治疗剂可以包括但不限于,激素治疗剂,包括节育、联合节育、选择性孕酮受体拮抗剂、选择性孕酮受体激动剂、促性腺激素释放型激素受体拮抗剂、促性腺激素释放型激素受体激动剂、抗逆转录病毒药剂、抗肿瘤药剂、抗炎剂、非甾体抗炎剂或其任何组合。
[0106]
在一个实施方案中,本文所述抑制剂之一的治疗有效性通过施用佐剂而增强(即,佐剂本身具有最小的治疗益处,但与另一种治疗剂组合,对患者的总体治疗益处增强)。或者,在一些实施方案中,通过将本文所述的抑制剂之一与同样具有治疗益处的另一种药剂(其还包括治疗方案)一起施用来增加患者所经历的益处。
[0107]
在一个具体的实施方案中,本文所述的抑制剂与第二治疗剂共同施用。在一些情况下,本文所述的抑制剂和第二治疗剂调节受治疗的疾病、病症或病况的不同方面,从而提供比单独施用任一治疗剂更大的总体益处。在任何情况下,无论受治疗的疾病、病症或病况如何,患者经历的总体益处可以是两种治疗剂的相加或患者可能经历协同益处。
[0108]
在某些实施方案中,当本文公开的抑制剂与一种或多种另外的药剂例如另外的治疗有效药物、佐剂等联合施用时,本文公开的抑制剂的不同治疗有效剂量将用于配制药物组合物和/或用于治疗方案。用于联合治疗方案的药物和其他药剂的治疗有效剂量任选地通过与上文针对活性物质本身所述的那些相似的手段来确定。此外,本文所述的预防/治疗方法包括节拍式给药的使用,即提供更频繁、更低的剂量以最小化毒副作用。在一些实施方案中,联合治疗方案包括如下治疗方案:其中在用本文所述的第二药剂治疗之前、期间或之后开始施用本文所述的抑制剂,并持续到用第二药剂治疗期间的任何时间或在用第二药剂治疗终止后。它还包括如下治疗:其中在治疗期间同时或在不同时间和/或以减少或增加的间隔施用本文所述的抑制剂和组合使用的第二药剂。联合治疗还包括在不同时间开始和停止以协助患者的临床管理的定期治疗。
[0109]
应当理解,用于治疗、预防或改善寻求缓解的病况(多种)的给药方案可以根据多种因素(例如,受试者所患的疾病、病症或病况;受试者的年龄、体重、性别、饮食和医疗状况)而改变。因此,在某些情况下,实际采用的给药方案会有所不同,并且在一些方案实施中,偏离了本文所述的给药方案。
[0110]
对于本文所述的联合疗法,共同施用的抑制剂的剂量根据所采用的联合药物的类型、所采用的具体药物、受治疗的疾病或病况等而变化。在另外的实施方案中,当与一种或多种其他治疗剂共同施用时,本文提供的抑制剂与一种或多种其他治疗剂同时施用或序贯施用。
[0111]
在联合疗法中,多种治疗剂(其中一种是本文所述的抑制剂之一)以任何顺序或甚至同时施用。如果施用是同时的,则仅作为示例,多种治疗剂以单一、统一的形式或多种形式(例如,作为单个丸剂或作为两个单独的丸剂)提供。
[0112]
本文所述的抑制剂以及联合疗法在疾病或病况发生之前、期间或之后施用,并且施用包含抑制剂的组合物的时机不同。因此,在一个实施方案中,本文所述的抑制剂用作预防剂并连续施用于具有发展病况或疾病倾向的受试者以防止疾病或病况的发生。在另一个实施方案中,在症状出现期间或在症状出现后尽快将抑制剂和组合物施用于受试者。在具体的实施方案中,在检测到或怀疑疾病或病况的发作后,在可行的情况下尽快施用本文所述的抑制剂,并持续治疗疾病所需的时间长度。在一些实施方案中,治疗所需的时间长度不同,调整治疗时间长度以适应每个受试者的具体需求。例如,在具体的实施方案中,本文所述的抑制剂或含有该抑制剂的制剂施用至少2周、约1个月至约5年。b.药物组合物
[0113]
在一些实施方案中,将本文所述的抑制剂配制成药物组合物。使用一种或多种药学上可接受的无活性成分以常规方式配制药物组合物,所述一种或多种药学上可接受的无活性成分有助于将活性抑制剂加工成药学上使用的制剂。适当的制剂取决于所选择的施用途径。本文描述的药物组合物的概述在例如,remington:the science and practice of pharmacy,第19版(easton,pa.:mack publishing company,1995);hoover,john e.,remington’s pharmaceutical sciences,mack publishing co.,easton,pennsylvania 1975;liberman,h.a.和lachman,l.编著,pharmaceutical dosage forms,marcel decker,new york,n.y.,1980;和pharmaceutical dosage forms and drug delivery systems,第17版(lippincott williams&wilkins1999)中获悉,其通过引用并入本文用于此公开。
[0114]
在一些实施方案中,本文所述的抑制剂单独施用或与在药物组合物中药学上可接受的载体、赋形剂或稀释剂组合施用。本文所述的抑制剂和组合物的施用可以受到能够将抑制剂递送至作用部位的任何方法影响。这些方法包括但不限于通过肠内途径(包括口服、胃或十二指肠饲管、直肠栓剂和直肠灌肠剂)、肠胃外途径(注射或输注,包括动脉内、心内、皮内、十二指肠内、髓内、肌肉内、骨内、腹膜内、鞘内、血管内、静脉内、玻璃体内、硬膜外和皮下)、吸入、透皮、跨粘膜、舌下、口腔和局部(包括表皮、真皮、灌肠、滴眼剂、滴耳剂、鼻内、阴道和子宫内)施用,但最合适的途径可能取决于例如,接受者的病况和病症。仅作为示例,本文所述的抑制剂可以通过例如手术期间的局部输注、局部应用例如乳膏或软膏、注射、导管、植入物或插入装置而局部施用于需要治疗的区域。施用也可以通过直接注射到患病组织或器官的部位。
[0115]
在一些实施方案中,适合口服施用的药物组合物以离散单位形式呈递,例如以胶囊剂、扁囊剂或片剂,其各自含有预定量的活性成分;以散剂或颗粒剂;以水性液体或非水性液体中的溶液剂或混悬剂;或以水包油液体乳剂或油包水液体乳剂。在一些实施方案中,活性成分以大丸剂、药糖剂或糊剂形式存在。
[0116]
可口服使用的药物组合物包括片剂、由明胶制成的推入配合胶囊剂,以及由明胶和增塑剂例如甘油或山梨糖醇制成的软密封胶囊剂。片剂可以通过压制或模制制成,任选地与一种或多种辅助成分一起使用。压制片剂可以通过在合适的机器中压制自由流动形式的活性成分例如粉末或颗粒来制备,活性成分任选地与粘合剂、惰性稀释剂或润滑剂、表面
活性剂或分散剂混合。模制片剂可以通过在合适的机器中模制用惰性液体稀释剂润湿的粉末状抑制剂的混合物来制备。在一些实施方案中,对片剂进行包衣或刻痕并配制以提供其中活性成分的缓释或控释。用于口服施用的所有制剂可以是适合这种施用的剂量。推入配合胶囊剂可包含与填充剂例如乳糖、粘结剂例如淀粉和/或润滑剂如滑石或硬脂酸镁以及任选的稳定剂混合的活性成分。在软胶囊剂中,活性抑制剂可以溶解或悬浮在合适的液体中,例如脂肪油、液体石蜡或液体聚乙二醇。在一些实施方案中,加入了稳定剂。糖衣丸核具有合适的包衣。为了该目的,可使用浓缩的糖溶液,其可任选地包含阿拉伯树胶、滑石、聚乙烯吡咯烷酮、卡波姆凝胶、聚乙二醇和/或二氧化钛、漆涂溶液和合适的有机溶剂或溶剂混合物。染料或颜料可以添加到片剂或糖衣丸包衣中,用于鉴定或表征活性抑制剂剂量的不同组合。
[0117]
在一些实施方案中,药物组合物被配制用于通过注射进行肠胃外施用,例如通过快速浓注或连续输注。注射制剂可以单位剂型呈递,例如在安瓿或多剂量容器中,并添加防腐剂。组合物可以采用在油性或水性媒介物中的混悬剂、溶液剂或乳剂的形式,并且可以包含配制剂,例如悬浮剂、稳定剂和/或分散剂。组合物可以存在于单位剂量或多剂量容器中,例如密封的安瓿和小瓶,并且可以散剂形式或以仅需要添加无菌液体载体的冷冻干燥(冻干)条件中储存,例如,在即将使用前用盐水或无菌无热原水。临时注射溶液剂和混悬剂可以由前述种类的无菌散剂、颗粒剂和片剂制备。
[0118]
用于肠胃外施用的药物组合物包括活性抑制剂的水性和非水性(油性)无菌注射液,其可含有抗氧化剂、缓冲剂、抑菌剂和使制剂与预期接受者的血液等渗的溶质;以及可包含悬浮剂和增稠剂的水性和非水性无菌混悬剂。合适的亲脂性溶剂或媒介物包括脂肪油例如芝麻油,或合成脂肪酸酯,如油酸乙酯或甘油三酯,或脂质体。水性注射混悬剂可含有增加混悬剂粘度的物质,例如羧甲基纤维素钠、山梨糖醇或葡聚糖。任选地,混悬剂还可以包含合适的稳定剂或增加抑制剂溶解度以允许制备高浓度溶液的试剂。
[0119]
药物组合物也可配制成药性持久的制剂。这种长效制剂可以通过植入(例如皮下或肌内)或通过肌内注射施用。因此,例如,抑制剂可以与合适的聚合物或疏水材料(例如,作为可接受的油中的乳剂)或离子交换树脂一起配制,或作为微溶衍生物,例如作为微溶盐。
[0120]
对于口腔或舌下施用,组合物可以采用以常规方式配制的片剂、锭剂、糖果锭剂或凝胶剂。此类组合物可包含在调味基材例如蔗糖和阿拉伯胶或黄蓍胶中的活性成分。
[0121]
药物组合物也可以配制成直肠或阴道组合物,例如栓剂或保留灌肠剂,例如含有常规栓剂基材,例如可可脂、聚乙二醇或其他甘油酯。当插入时,栓剂基材在体温下液化或变得与水混溶,从而使组分与粘膜接触足够长的时间段以产生治疗效果。栓剂基材的重量百分比取决于人和/或动物体孔口的大小、产生治疗效果所需的剂量组成以及使其在室温或低于室温下保持固体的理化特性。在一些实施方案中,栓剂包含约50%至大于99%,或约75%至大于99wt%的栓剂基材。在一些实施方案中,栓剂包含约75%至约98wt%的聚乙二醇。在一些实施方案中,栓剂包含约2%至约25wt%的聚山梨醇酯。栓剂基质具有约400至约5000,或约950至约3700范围内的分子量(us2009/0311290,其通过引用并入本文用于此公开)。
[0122]
在一些情况下,药物组合物包含吸收增强剂,例如癸酸钠。一些这样的情况包括用
于如本文所述的直肠或阴道中的组合物和剂型。
[0123]
药物组合物可以局部或直肠施用,即通过非全身施用。这包括将本公开的抑制剂在表皮或口腔外部应用,并将这种抑制剂滴注到直肠或阴道中,使得抑制剂不会显著进入血流。相反,全身施用是指口服、静脉内、腹膜内和肌肉内施用。
[0124]
适用于局部施用的药物组合物包括适用于穿透皮肤的液体或半液体制剂,例如溶液剂、洗剂、振荡洗剂、乳膏剂、软膏剂、凝胶剂、泡沫剂、透皮贴剂、散剂、固体剂、海绵、胶带、蒸气、糊剂、酊剂、微粒剂、微胶囊剂、纳米颗粒剂、脂质体或乳剂,包括适合递送至阴道或直肠的那些。对于局部施用,活性成分可以占制剂重量的0.001%至10%w/w,例如1%至2%。
[0125]
用于吸入施用的药物组合物可方便地从吹入器、雾化器加压包或递送气溶胶喷雾剂的其他方便的装置递送。加压包可包含合适的推进剂,例如二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其他合适的气体。在加压气雾剂的情况下,可以通过提供阀门以递送计量的量来确定剂量单位。或者,对于通过吸入或吹入施用,药物制剂可以采用干粉组合物的形式,例如抑制剂和合适的散剂基材例如乳糖或淀粉的粉末混合物。粉末组合物可以单位剂型存在于例如胶囊、药盒、明胶或泡罩包装中,粉末可以在吸入器或吹入器的帮助下从中施用。
[0126]
在一些实施方案中,本文公开的抑制剂以实现将抑制剂递送至胃肠道的特定区域的方式配制。例如,将本文公开的抑制剂与生物粘附聚合物、ph敏感性包衣、时间依赖性的生物降解性聚合物、微生物群激活体系等一起配制用于口服递送,以实现抑制剂向胃肠道的特定区域的递送。
[0127]
在一些实施方案中,本文公开的抑制剂以实现将抑制剂递送至泌尿生殖或肛门直肠粘膜的特定区域的方式配制。例如,将本文公开的抑制剂与生物粘附聚合物、ph敏感性包衣、时间依赖性的生物可降解聚合物、微生物群激活体系等一起配制用于阴道内递送,以实现抑制剂向泌尿生殖系统的特定区域的递送。在一些实施方案中,将本文公开的抑制剂配制成提供抑制剂的控释。控释是指本文所述的抑制剂根据期望的特性(profile)在延长的时间段内从其所掺入的剂型的释放。控释特性包括例如,持续释放、延长释放、脉冲式释放和延迟释放特性。与立即释放组合物相反,控释组合物允许根据预定特性在延长的时间段内向受试者递送药剂。与常规快速释放剂型相比,这种释放速率可以在延长的时间段内提供治疗有效水平的药剂,从而提供更长时间段的药理反应同时最小化副作用。这种较长的反应时间段提供许多用相应的短效、立即释放制剂无法实现的固有益处。
[0128]
将完整的治疗性抑制剂递送至泌尿生殖系统(例如阴道)或胃肠道(例如结肠)的特定区域的方法包括:(i)用聚合物包衣:通过用仅在结肠中降解的合适聚合物将药物分子包衣,可以将完整分子递送至结肠而不会在肠的上部吸收。此外,聚合物包衣可为阴道制剂提供保护或控释特性。(ii)用ph敏感性聚合物包衣:肠、结肠和阴道靶向递送系统可以基于被填充到传统的硬明胶胶囊中的片剂或丸剂的包衣。最常用的ph依赖性包衣聚合物是甲基丙烯酸共聚物,通常称为s,更具体地为l和s。l100和s 100是甲基丙烯酸和甲基丙烯酸甲酯的共聚物。
(iii)用生物可降解聚合物包衣;(iv)包埋入基质中;(v)包埋入可生物降解的基质和水凝胶中;(vi)包埋入ph敏感性基质中;(vii)定时释放系统;(viii)氧化还原敏感性聚合物;(ix)生物粘附系统;(x)用微粒包衣;(xi)渗透控制型药物递送;
[0129]
另一种针对阴道和结肠靶向的药物递送或控释系统的方法包括将药物包埋入聚合物基质中以将其捕获并在阴道或结肠中释放。这些基质可以是ph敏感性的或可生物降解的。基于基质的系统,例如基于多基质(mmx)的缓释片,确保药物在阴道或结肠中释放。c.剂型
[0130]
本文所述的组合物和方法可包括通过多种剂型和装置递送治疗剂,包括下文所述的那些。下面描述的许多剂型提供了多个优点。这些可以包括治疗性抑制剂的局部递送。局部递送可以减少有时与全身递送和脱靶效应相关的副作用。在一些情况下,本文所述的剂型和装置可增加患者依从性,包括例如通过提供本文所述抑制剂的长期或连续递送。在一些情况下,这些剂型和装置还可以提高耐受性和安全性。1.阴道内环
[0131]
本文所述的肽和组合物可以掺入用于递送的阴道内环中。通过阴道内环(ivr)递送治疗剂允许局部递送,增加了治疗物质的安全性和耐受性。ivr另外可提供多种优势:绕过胃肠道吸收和肝/肾首过代谢、较低的有效剂量、持续递送和/或控释特性、剂量间隔时间延长、减少的副作用、低血清药物浓度、患者自行施用和提高的患者的满意度。ivr可以成功地将药物,包括亲水性和大分子药剂,递送到受ems(包括深部浸润性ems(die))影响的器官。阴道环递送系统的生物分布是通过组织吸收而不是血清,并且可以到达腹膜腔中受ems影响的所有器官。
[0132]
阴道环通常由惰性弹性体环组成,该环由另一层含有待递送药物的弹性体涂覆。环可以很容易地插入,留在适当位置持续期望的时间段,然后由用户取出。该环可以是含有治疗组分的实心或空心环,或者它可以是从中释放药物的多孔材料。该环可任选地包括不含药物的第三、外部、速率控制型弹性体层。任选地,第三环可包含用于双重释放环的第二药物。药物可以掺入聚乙二醇中,贯穿整个有机硅弹性体环,以充当用于待递送的药物的贮库。在一些情况下,ivr可包含有机硅、压制片剂或冻干凝胶剂。
[0133]
子宫托、杯、条、片剂和栓剂是可用于本公开的药物递送系统的其他示例。这些系统已用于递送阴道避孕药,并已在文献中广泛描述。
[0134]
递送系统的另一个示例是阴道海绵和泡沫。如文献中所述,可将期望的药剂掺入有机硅基质中,该有机硅基质涂覆在圆柱形无药物聚氨酯阴道海绵上。
[0135]
在一些实施方案中,ivr包含如本文所述的肽或组合物,其被配制成栓剂、溶液剂、洗剂、振荡洗剂、乳膏剂、软膏剂、凝胶剂、泡沫剂、透皮贴剂、散剂、固体剂、海绵、胶带、糊剂、酊剂、乳剂、微粒剂、微胶囊剂、纳米颗粒剂、脂质体或含有微粒、微胶囊、纳米颗粒剂或
脂质体的胶囊剂。ivr已被进一步改性为包含各种递送媒介物,例如有机硅插入物、压制片剂或冻干凝胶剂,以优化亲水性或高分子量抑制剂(例如肽、蛋白质或抗体)的释放曲线(morrow等人,eur j pharm biopharm,2011年1月;77(1):3
‑
10,其通过引用并入本文以用于此公开)。ivr还可以包含一种或多种吸收促进剂,例如癸酸钠。
[0136]
在一些实施方案中,本文所述的ivr被配制成包含约0.01mg至约5000mg的抑制剂。在一些实施方案中,ivr可以含有约0.01mg、约0.05mg、约0.1mg、约0.5mg、约1mg、约5mg、约10mg、约20mg、约40mg、约60mg、约80mg、约100mg、约150mg、约200mg、约400mg、约600mg、约800mg、约1000mg、约1200mg、约1400mg、约1600mg、约1800mg、约2000mg、约2500mg、约3000mg、约3500mg、约4000mg、约4500mg或约5000mg的抑制剂。
[0137]
在一些实施方案中,本文所述的ivr被配制成递送约0.01mg至约1000mg抑制剂/天。在一些实施方案中,ivr被配制为递送约0.01mg、约0.05mg、约0.1mg、约0.5mg、约1mg、约5mg、约10mg、约20mg、约40mg、约60mg、约80mg、约100mg、约150mg、约200mg、约400mg、约600mg、约800mg或约1000mg抑制剂/天。2.阴道棉塞
[0138]
本文所述的肽和组合物可掺入用于递送的棉塞装置中。棉塞装置通常包括具有近端和远端的阴道棉塞。远端的杯状多孔泡沫部分贴合在子宫颈周围并含有如本文所述的用于递送的肽或组合物。该装置还可包括非吸收性轴向管,该非吸收性轴向管具有远侧开口并延伸穿过多孔泡沫杯进入棉塞以将血流引导至吸收性材料。任选地,还包括连接到棉塞装置的取回绳或带。吸收性阴道棉塞包含如本文所述的肽或组合物,或者可以用如本文所述的肽或组合物涂覆并用作用于递送的含药棉塞。3.子宫托/栓剂/压制片剂
[0139]
可将本文所述的肽和组合物掺入到固体中以用于局部递送。固体可以是子宫托或阴道或直肠栓剂的形式。固体剂型在其达到体温时可以熔化。或者,固体可保持其结构并释放本文所述的掺入组合物。固体可以是设计用于在阴道内提供支撑的子宫托。阴道海绵可以包埋有本文所述的用于阴道内递送的组合物。4.局部药物
[0140]
本文所述的肽和组合物可掺入用于递送的局部制剂中。局部药物应用于身体表面,例如皮肤或粘膜。在一些情况下,身体表面包括但不限于上皮组织、粘膜组织、腹膜、子宫外膜和子宫内膜。抑制剂通过身体表面吸收以达到局部或全身作用。局部药物任选地按以下类别配制:局部溶液剂;洗剂;振荡洗剂;乳膏剂;软膏剂;凝胶剂;泡沫剂;透皮贴剂;散剂;固体剂;海绵;胶带;蒸气;糊剂;或酊剂。局部溶液剂可以作为冲洗剂、喷雾剂或滴剂施用,通常具有低粘度,基材中含有水或酒精。洗剂可以比溶液剂更稠、更润肤。它通常是一种混合在水中的油,并可具有比溶液剂少的酒精。振荡洗剂是一种混合物,其随着时间的推移分成两到三个部分。它可以是一种与水基溶液混合的油,在使用前需要振荡成悬浮液。乳膏剂是油和水的比例大致相等的乳液。软膏剂是一种均质、粘稠的半固体制剂,最常见的是高粘度的油性稠油(油80%
‑
水20%)。软膏剂可包含烃基材、吸收基材、水溶性基材、乳化基材或植物油,或其任何组合。软膏剂在基材中配制,基材可包括但不限于烃基材,例如硬石蜡、软石蜡、微晶蜡或地蜡;吸收基材,例如羊毛脂或蜂蜡;水溶性基材,例如聚乙二醇200、300或400;乳化基材,例如乳化蜡或溴棕三甲铵;或植物油,例如橄榄油、椰子油、芝麻油、杏仁
油或花生油。
[0141]
凝胶剂是半固体乳液。可用乳化剂的非限制性示例包括丙烯酸聚合物(例如,卡波姆牌增稠剂,例如卡波姆934p,由voveon,inc.制造)、聚氧乙烯
‑
10
‑
硬脂基醚、聚氧乙烯
‑
20
‑
硬脂基醚、鲸蜡硬脂醇、鲸蜡醇、胆甾醇、硬脂酸二甘醇酯、单硬脂酸甘油酯、硬脂酸甘油酯、聚甘油基
‑3‑
油酸酯、羟丙基纤维素、羟丙基甲基纤维素、羊毛脂、聚氧乙烯月桂基醚、甲基纤维素、聚氧乙烯硬脂酸酯、聚山梨醇酯、单硬脂酸丙二醇酯、脱水山梨糖醇酯、硬脂酸或其两种或更多种的混合物。
[0142]
基于局部制剂的总重量,局部制剂中乳化剂的量范围可为约1至约40wt%,并且在一些实施方案中为约5至约30wt%。
[0143]
如本文所述的凝胶制剂可包括一种或多种胶凝剂。可用胶凝剂的非限制性示例包括羧酸聚合物,包括用交联键交联的丙烯酸聚合物,例如蔗糖的烯丙醚(例如卡波姆牌增稠剂)、鲸蜡硬脂醇、羟甲基纤维素、聚氧乙烯
‑
聚氧丙烯共聚物、羧甲基纤维素钠、聚乙烯吡咯烷酮、或其两种或更多种的混合物。
[0144]
基于局部制剂的总重量,局部凝胶制剂中胶凝剂的量的范围可为约0.1至约10wt%,并且在一些实施方案中为约0.1至约1wt%。
[0145]
本文所述的凝胶制剂还可包含一种或多种碱化剂,例如氢氧化钠,其量小于约2wt%作为胶凝活化剂。
[0146]
制剂可以包含一种或多种本领域公知的附加赋形剂,例如水和增稠剂,例如胶态二氧化硅。
[0147]
热可逆凝胶剂是液体制剂,其一旦插入直肠或阴道就会变成凝胶。与传统栓剂或子宫托相比,热可逆凝胶剂更易于施用和定位,并可防止剂型泄漏。它被配制成由热可逆聚合物(例如,泊洛沙姆,与使凝胶附着在粘膜上的粘膜粘附聚合物组合)组成的聚合物溶液。原位热可逆液体凝胶制剂,也称为热可逆“液体栓剂”,在低温(<10℃)下为液体,并且在体温下变成凝胶。
[0148]
可以将活性剂掺入用于封闭敷料的外科胶带中。药物可以作为软膏剂或凝胶剂使用,通过蒸发到达粘膜。糊剂结合油、水和粉末。酊剂通常含有高百分比的酒精,用于涂抹在皮肤上。5.透皮贴剂和膜
[0149]
本文所述的肽和组合物可掺入透皮贴剂递送。透皮贴剂通过覆盖药物贮库的多孔膜或通过包埋入贴剂粘合剂中的药物的身体热熔化薄层来提供药物的受控释放。
[0150]
本文所述的组合物可掺入用于递送的膜中。膜是薄而小的聚合物制剂,其无需涂抹器即可轻松插入阴道腔,也不会引起不适。阴道膜比其他类型的阴道制剂如子宫托、泡沫剂和凝胶剂更容易应用(rohan lc等人,aaps journal 2009;11:78
–
87,其通过引用并入本文用于此公开)。6.宫内节育器
[0151]
本文所述的肽和组合物可掺入宫内节育器(iud)中,宫内节育器是为递送插入子宫中的通常为t形的小装置。宫内节育器通常含有铜、孕激素或左炔诺孕酮。将本文所述的组合物掺入iud装置中以随时间缓慢释放。7.全身递送(注射)
[0152]
本文所述的肽和组合物可配制用于全身递送。
[0153]
肠胃外注射剂可以被配制用于快速浓注或连续输注。药物组合物可以是适合肠胃外注射的形式,作为在油性或水性媒介物中的无菌混悬剂、溶液剂或乳剂,并且可以包含配制剂,例如悬浮剂、稳定剂和/或分散剂。用于肠胃外施用的药物制剂包括水溶性形式的本文所述肽的水溶液剂。本文所述肽的混悬剂可以被制备为油性注射混悬剂。合适的亲脂性溶剂或媒介物包括脂肪油例如芝麻油,或合成脂肪酸酯,如油酸乙酯或甘油三酯,或脂质体。水性注射混悬剂可含有增加混悬剂粘度的物质,例如羧甲基纤维素钠、山梨糖醇或葡聚糖。混悬剂还可包含合适的稳定剂或试剂,其增加溶解度和/或减少本文所述的此类肽的聚集以允许制备高度浓缩的溶液剂。或者,本文所述的肽可以被冻干或呈散剂形式,以便在使用前用合适的媒介物例如无菌无热原水重新配制。在一些实施方案中,静脉施用纯化的肽。8.丸剂
[0154]
本文所述的肽和组合物可配制用于口服递送。可口服使用的药物组合物包括片剂、由明胶制成的推入配合胶囊剂,以及由明胶和增塑剂如甘油或山梨糖醇制成的软密封胶囊剂。片剂可以通过压制或模制而制成,任选地与一种或多种辅助成分一起使用。压制片剂可以通过在合适的机器中压制自由流动形式的活性成分例如粉末或颗粒来制备,所述活性成分任选地与粘合剂、惰性稀释剂或润滑剂、表面活性剂或分散剂混合。模制片剂可以通过在合适的机器中模制用惰性液体稀释剂润湿的粉末状抑制剂的混合物来制成。在一些实施方案中,对片剂进行包衣或刻痕并配制以提供其中活性成分的缓释或控释。用于口服施用的制剂可以是以适合这种施用的剂量。推入配合胶囊剂可包含与填充剂例如乳糖、粘结剂例如淀粉和/或润滑剂如例滑石或硬脂酸镁以及任选的稳定剂混合的活性成分。在软胶囊剂中,活性抑制剂可以溶解或悬浮在合适的液体,例如脂肪油、液体石蜡或液体聚乙二醇中。在一些实施方案中,加入了稳定剂。糖衣丸核具有合适的包衣。为了该目的,可使用浓缩的糖溶液,其可任选地包含阿拉伯树胶、滑石、聚乙烯吡咯烷酮、卡波姆凝胶、聚乙二醇和/或二氧化钛、漆涂溶液和合适的有机溶剂或溶剂混合物。染料或颜料可以添加到片剂或糖衣丸包衣中,用于鉴定或表征活性抑制剂剂量的不同组合。
[0155]
将治疗剂靶向递送至胃肠道的特定区域的其他药学方法是已知的。chourasia mk,jain sk,pharmaceutical approaches to colon targeted drug delivery systems.,j pharm sci.2003年1月
‑
4月;6(1):33
‑
66.patel m,shah t,amin a.therapeutic opportunities in colon
‑
specific drug
‑
delivery systems crit rev ther drug carrier syst.2007;24(2):147
‑
202.kumar p,mishra b.colon targeted drug delivery systems
‑‑
an overview.curr drug deliv.2008年7月;5(3):186
‑
98.van den mooter g.colon drug delivery.expert opin drug deliv.2006年1月;3(1):111
‑
25.seth amidon,jack e.brown和vivek s.dave,colon
‑
targeted oral drug delivery systems:design trends and approaches,aaps pharmscitech.2015年8月;16(4):731
–
741。这些参考文献中的每一个都通过引用并入本文以用于此公开。
[0156]
应当理解,除了上面特别提到的成分之外,考虑到所讨论的制剂的类型,本文所述的抑制剂和组合物可以包括本领域中的其他常规试剂。例如,适合口服施用的药剂可包括调味剂。d.制剂
[0157]
本文所述的肽和组合物可包含另外的赋形剂以改善治疗剂的性能。组合物可包含吸收促进剂或渗透促进剂,以改善穿过表皮或粘膜表面的吸收和膜渗透。配制在本文所述的组合物中的增强剂可包括但不限于亚砜,例如二甲基亚砜(dmso);月桂氮革酮(1
‑
十二烷基氮杂环庚烷
‑2‑
酮);吡咯烷酮,例如n
‑
甲基
‑2‑
吡咯烷酮;萜烯和萜类化合物;精油;噁唑烷酮,例如4
‑
去环噁唑烷
‑2‑
酮;尿素;环十五内酯;n
‑
[8
‑
(2
‑
羟基苯甲酰基)氨基]辛酸钠(snac);8
‑
(n
‑2‑
羟基
‑5‑
氯
‑
苯甲酰基)
‑
氨基
‑
辛酸(5
‑
cnac);中链脂肪酸、盐和衍生物;癸酸钠;辛酸钠;蛋白酶抑制剂和ω
‑
3脂肪酸;液体混合胶束喷雾;脂质聚合物胶束;烷基糖苷;壳聚糖;十二烷基
‑2‑
n,n
‑
二甲氨基丙酸酯(ddaip);细胞膜脂质组分;纳米颗粒;脂质体、配体;和亲脂性修饰物中的一种或多种。
[0158]
本文所述的肽和组合物可配制成溶液剂、洗剂、振荡洗剂、乳膏剂、软膏剂、凝胶剂、泡沫剂、粘膜粘附组合物、乳剂、脂质体、包衣、核、基质、冻干剂。e.受治疗的病况
[0159]
本文所述的方法可用于治疗或预防组织浸润病况。如本文所用,组织浸润病况包括任何疾病、病症、恶性肿瘤、转移、突变、病况等,其中细胞迁移、浸润、转移或以某种方式在一位置或以某种方式生长的程度对细胞在其中生长的受试者是致病的或以其他方式有害的。在一些实施方案中,组织浸润病况包括子宫内膜异位症。在另外的实施方案中,组织浸润病况包括癌症。癌症可以包括结直肠癌、鳞状细胞癌、头颈癌、胰腺癌、乳腺癌、髓性白血病、基底细胞癌、滑膜肉瘤、非小细胞肺癌、实体瘤或前列腺癌。在另外的实施方案中,组织浸润病况包括纤维化。纤维化可包括甲型肝炎、乙型肝炎、丙型肝炎、子宫腺肌症、肺纤维化、囊性纤维化、特发性肺纤维化、辐射诱导的肺损伤、肝硬化、心房纤维化、心内膜心肌纤维化、陈旧性心肌梗死、神经胶质瘢痕、动脉僵硬、关节纤维化、克罗恩病、杜普伊特伦挛缩、瘢痕疙瘩、纵隔纤维化、骨髓纤维化、派罗尼病、肾原性全身性纤维化、进行性块状纤维化、腹膜后纤维化、硬皮病/全身性硬化症或粘连性关节囊炎。f.共同施用
[0160]
本文所述的肽和组合物可以与其他治疗剂共同施用。在本文所述的实施方案中,环状肽组合物可以与治疗骨质疏松症的药物一起施用,包括但不限于阿仑膦酸盐、伊班膦酸盐、利塞膦酸盐、唑来膦酸、地诺单抗、降钙素、雌激素、雷洛昔芬、巴多西酚、特立帕肽、阿巴帕肽或任何其组合。v.示例性实施方案1.一种肽,其包含具有式x1‑
x2‑
x3‑
x4‑
x5‑
x6‑
x7‑
x8‑
x9‑
x
10
‑
x
11
‑
x
12
‑
x
13
‑
x
14
‑
x
15
‑
x
16
的氨基酸序列,其中:x1为m或空;x2为s、i、g、t、a、l或空;x3为r、k或空;x4为带正电荷的氨基酸、瓜氨酸、orn、d、e、8
‑
氨基辛酸或具有4至12个碳的氨基羧酸;x5为m、正亮氨酸、orn、d、e、k、h、r、k、8
‑
氨基辛酸、具有4至12个碳的氨基羧酸或空;x6为w、y、f或n
‑
甲基a;x7为f、i、l、chg、cha或tle;x8为l、i或a;x9为l、i或a;x
10
为c、s、a、abu、c(me)或s(bzl);x
11
为f、h、a、k、e、chg、cng或orn;x
12
为w、y、a或f;且x
13
为g、gaba或空。2.一种肽,其包含具有式r
‑
x1‑
x2‑
x3‑
x4‑
x5‑
x6‑
x7‑
x8‑
x9‑
x
10
‑
x
11
‑
x
12
‑
x
13
‑
x
14
‑
x
15
‑
x
16
的氨基酸序列,其中:r为nh2、乙酰化物、硬脂酸、棕榈酸、肉豆蔻酸、月桂酸、c1‑
c8烃、c1‑
c8脂肪酸或空;x1为m、g、β丙氨酸、正亮氨酸、正缬氨酸或空;x2为w、n
‑
甲基w、r、y、f、瓜氨酸或k;x3为p、w、n
‑
甲基
‑
w、n
‑
乙基
‑
w、n
‑
甲基a、n
‑
乙基a、l、pip、aib、y或f;x4为e、q、n或d;x5为s、α
甲基s、k、d、orn、t或e;x6为i、chg、h或l;x7为l或i;x8为d、n、e或q;x9为d、e、k、q或orn;x
10
为h或甲基
‑
h;x
11
为v、α甲基v、chg、l、i或正缬氨酸;x
12
为q、aib、s、r或n;x
13
为r、k、瓜氨酸、orn、d或e;x
14
为v、i、l或正缬氨酸;x
15
为w、y或f;且x
16
为r、g或空。3.一种肽,其包含seq id no:1
‑
seq id no:500中任一项的氨基酸序列。4.一种肽,其包含与seq id no:1
‑
seq id no:500中任一项具有至少80%、85%、90%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。5.根据实施方案1
‑
4所述的肽,其中所述肽结合β
‑
连环蛋白。6.根据实施方案1
‑
4所述的肽,其中所述肽是β
‑
连环蛋白抑制剂。7.根据实施方案1
‑
4所述的肽,其中所述肽是β
‑
连环蛋白易位至细胞核的抑制剂。8.根据实施方案1
‑
4所述的肽,其中所述肽防止β
‑
连环蛋白充当为致癌基因、基质金属蛋白酶9(mmp9)或氯化物c3通道(clc
‑
3)的转录因子。9.根据实施方案1
‑
4所述的肽,其中所述肽防止ems细胞的转化、侵入、迁移、纤维化或其任何组合。10.根据实施方案1
‑
4所述的肽,其中所述肽防止β
‑
连环蛋白与雌激素受体(esr1)结合。11.根据实施方案1
‑
4所述的肽,其中所述肽不影响β
‑
连环蛋白的膜活性。12.根据实施方案1
‑
4所述的肽,其中所述肽不影响β
‑
连环蛋白e
‑
钙粘蛋白结合。13.根据实施方案1
‑
4所述的肽,其中所述肽防止致癌转录因子活性。14.根据实施方案1
‑
13所述的肽,其中所述肽以小于50um、小于30um、小于10um、5um的ec50、1um、500nm、400nm、300nm、200nm、100nm、50nm、30nm、10nm、5nm、3nm、1nm、800pm、600pm、400pm、200pm、100pm、50pm、30pm、20pm、10pm、或5pm或小于约10um、约5um、约1um、约500nm、约400nm、约300nm、约200nm、约100nm、约50nm、约30nm、约10nm、约5nm、约3nm、约1nm、约800pm、约600pm、约400pm、约200pm、约100pm、约50pm、约30pm、约20pm、约10pm、或约5pm的ec
50
抑制wnt通路活性和/或其中所述肽以小于约50um、约30um、10um、约5um、约1um、约500nm、约400nm、约300nm、约200nm、约100nm、约50nm、约30nm、约10nm、约5nm、约3nm、约1nm、约800pm、约600pm、约400pm、约200pm、约100pm、约50pm、约30pm、约20pm、约10pm、或约5pm或小于10um、5um、1um、500nm、400nm、300nm、200nm、100nm、50nm、30nm、10nm、5nm、3nm、1nm、800pm、600pm、400pm、200pm、100pm、50pm、30pm、20pm、10pm或5pm的kd
50
结合亲和力结合β
‑
连环蛋白。15.根据前述实施方案中任一项所述的肽,其中所述肽是非天然存在的。16.根据前述实施方案中任一项所述的肽,其中所述肽是环化肽。17.根据实施方案1
‑
15所述的肽,其中所述肽是双环肽。18.根据实施方案16或17中任一项所述的肽,其中所述肽用cys
‑
cys二硫键环化。19.根据实施方案16或17中任一项所述的肽,其中所述肽用酰胺键环化。20.根据实施方案19所述的肽,其中所述酰胺键在n
‑
末端和c
‑
末端之间是头到尾的。21.根据实施方案19所述的肽,其中所述酰胺键在n
‑
末端和内部cooh之间是头到侧链的。22.根据实施方案19所述的肽,其中所述酰胺键在内部nh2和c
‑
末端之间是侧链到尾的。23.根据实施方案19所述的肽,其中所述酰胺键在内部nh2和内部cooh之间是侧链到侧链的。24.根据实施方案16或17所述的肽,其中所述肽使用烃钉合环化。25.根据实施方案16或17所述的肽,其中所述肽使用点击化学环化。26.根据前述实施方案中任一项所述的肽,其中所述肽是至少3、至少4、至少5、至少6、至少7、至少8、至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26、至少27、至少28、至少29、至少30、至少31、至少32、至少33、至少34、至少35、至少36、至少37、至少38、至少39、至少40、至少41、至少42、至少43、至少44、至少45、至少46、至少47、至少48、至少49、至少50、至少51、至少52、至少53、至少54、至少55、至少56、至少57、至少58、至少59、
至少60、至少61、至少62、至少63、至少64、至少65、至少66、至少67、至少68、至少69、至少70、至少71、至少72、至少73、至少74、至少75、至少76、至少77、至少78、至少79、至少80或至少81个氨基酸残基。27.根据前述实施方案中任一项所述的肽,其中所述肽少于4、少于5、少于6、少于7、少于8、少于9、少于10、少于11、少于12、少于13、少于14、少于15、少于16、少于17、少于18、少于19、少于20、少于21、少于22、少于23、少于24、少于25、少于26、少于27、少于28、少于29、少于30、少于31、少于32、少于33、少于34、少于35、少于36、少于37、少于38、少于39、少于40、少于41、少于42、少于43、少于44、少于45、少于46、少于47、少于48、少于49、少于50、少于51、少于52、少于53、少于54、少于55、少于56、少于57、少于58、少于59、少于60、少于61、少于62、少于63、少于64、少于65、少于66、少于67、少于68、少于69、少于70、少于71、少于72、少于73、少于74、少于75、少于76、少于77、少于78、少于79、少于80或少于81个氨基酸残基。28.根据前述实施方案中任一项所述的肽,其中所述肽包含一个或多个非天然氨基酸。29.根据实施方案28所述的肽,其中所述一个或多个非天然氨基酸是n
‑
甲基氨基酸。30.一种药物组合物,其包含:β
‑
连环蛋白抑制剂;和药学上可接受的载体。31.一种药物组合物,其包含:具有对β
‑
连环蛋白的结合特异性的肽;和药学上可接受的载体。32.一种药物组合物,其包含:包含肽的β
‑
连环蛋白抑制剂;和药学上可接受的载体。33.一种药物组合物,其包含:根据实施方案1
‑
29中任一项所述的肽;和药学上可接受的载体。34.根据实施方案30
‑
33中任一项所述的药物组合物,其中所述肽是环化肽。35.根据实施方案30
‑
33所述的药物组合物,其中所述组合物包含吸收或渗透促进剂。36.根据实施方案35所述的药物组合物,其中所述吸收促进剂包含亚砜,例如二甲基亚砜(dmso);月桂氮革酮(1
‑
十二烷基氮杂环庚烷
‑2‑
酮);吡咯烷酮,例如n
‑
甲基
‑2‑
吡咯烷酮;萜烯和萜类化合物;精油;噁唑烷酮,例如4
‑
去环噁唑烷
‑2‑
酮;尿素;环十五内酯;n
‑
[8
‑
(2
‑
羟基苯甲酰基)氨基]辛酸钠(snac);8
‑
(n
‑2‑
羟基
‑5‑
氯
‑
苯甲酰基)
‑
氨基
‑
辛酸(5
‑
cnac);中链脂肪酸、盐和衍生物;癸酸钠;辛酸钠;蛋白酶抑制剂和ω
‑
3脂肪酸;液体混合胶束喷雾;脂质聚合物胶束;烷基糖苷;壳聚糖;十二烷基
‑2‑
n,n
‑
二甲氨基丙酸酯(ddaip);细胞膜脂质组分;纳米颗粒;脂质体、配体;和亲脂性修饰物中的一种或多种。37.根据实施方案36所述的药物组合物,其中所述吸收促进剂是癸酸钠。38.一种制剂,其包含根据实施方案1
‑
29中任一项所述的肽或根据实施方案30
‑
37中任一项所述的药物组合物的,其中所述制剂包括溶液剂、洗剂、振荡洗剂、乳膏剂、软膏剂、凝胶剂、泡沫剂、散剂、固体剂、糊剂、酊剂、微粒剂、微胶囊剂、纳米颗粒剂、脂质体、乳剂或冻干剂。39.根据实施方案38所述的制剂,其中所述凝胶剂是热可逆凝胶剂。40.根据实施方案38所述的制剂,其中所述制剂包含一种或多种粘膜粘附聚合物。41.根据实施方案38所述的制剂,其中所述制剂用于局部施用。42.一种阴道内装置,其包含根据实施方案1
‑
29中任一项所述的肽或根据实施方案30
‑
37中任一项所述的药物组合物。43.根据实施方案42所述的阴道内装置,其中所述阴道内装置是栓剂、透皮贴剂、海绵、胶带、膜、阴道内环、阴道棉塞、阴道环、阴道条、阴道胶囊、阴道片剂、阴道子宫托、阴道杯、阴道海绵或宫内节育器。44.根据实施方案42所述的阴道内装置,其中所述肽或所述药物组合物被配制成选自溶液剂、洗剂、振荡洗剂、乳膏剂、软
膏剂、凝胶剂、泡沫剂、粘膜粘附组合物、包衣、核、基质、乳剂、脂质体、或冻干剂的制剂,其中所述阴道内装置包含所述制剂。45.根据实施方案42所述的阴道内装置,其中所述阴道内装置包含约0.01mg至约5000mg的抑制剂。46.根据实施方案42所述的阴道内装置,其中所述阴道内装置包含约0.01mg、约0.05mg、约0.1mg、约0.5mg、约1mg、约5mg、约10mg、约20mg、约40mg、约60mg、约80mg、约100mg、约150mg、约200mg、约400mg、约600mg、约800mg、约1000mg、约1200mg、约1400mg、约1600mg、约1800mg、约2000mg、约2500mg、约3000mg、约3500mg、约4000mg、约4500mg或约5000mg的抑制剂。47.根据实施方案42所述的阴道内装置,其中所述阴道内装置被配置成跨粘膜递送所述抑制剂。48.根据实施方案42所述的阴道内装置,其中所述阴道内装置被配置为在1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、1天、2天、3天、4天、5天、6天、7天、1周、2周、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、13周、14周、15周、16周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月、1年、2年、3年、4年、5年、6年、7年、8年、9年、10年、11年或12年内递送抑制剂。49.根据实施方案42所述的阴道内装置,其中所述阴道内装置被配置为递送约0.01mg至约1000mg抑制剂/天。50.根据实施方案42所述的阴道内装置,其中所述阴道内装置被配置为递送约0.01mg、约0.05mg、约0.1mg、约0.5mg、约1mg、约5mg、约10mg、约20mg、约40mg、约60mg、约80mg、约100mg、约150mg、约200mg、约400mg、约600mg、约800mg或约1000mg抑制剂/天。51.根据实施方案43所述的阴道内装置,其中所述装置是所述栓剂。52.根据实施方案43所述的阴道内装置,其中所述装置是所述透皮贴剂。53.根据实施方案43所述的阴道内装置,其中所述装置是所述海绵。54.根据实施方案43所述的阴道内装置,其中所述装置是所述胶带。55.根据实施方案43所述的阴道内装置,其中所述装置是所述阴道内环。56.根据实施方案55所述的阴道内装置,其中所述阴道内环包括有机硅插入物、压制片剂或冻干凝胶剂。57.根据实施方案56所述的阴道内装置,其中所述肽或所述组合物掺入整个所述有机硅插入物、所述压制片剂或所述冻干凝胶剂中。58.根据实施方案43所述的阴道内装置,其中所述装置是所述阴道棉塞。59.根据实施方案43所述的阴道内装置,其中所述装置是所述阴道环。60.根据实施方案43所述的阴道内装置,其中所述装置是所述阴道条。61.根据实施方案43所述的阴道内装置,其中所述装置是所述阴道胶囊。62.根据实施方案43所述的阴道内装置,其中所述装置是所述阴道片剂。63.根据实施方案43所述的阴道内装置,其中所述装置是所述阴道子宫托。64.根据实施方案43所述的阴道内装置,其中所述装置是所述阴道杯。65.根据实施方案43所述的阴道内装置,其中所述装置是所述阴道海绵。66.根据实施方案43所述的阴道内装置,其中所述装置是所述宫内节育器。67.一种制剂,其包含根据实施方案1
‑
29中任一项所述的肽或根据实施方案30
‑
37中任一项所述的药物组合物,其中所述制剂用于口服施用。68.根据实施方案67所述的制剂,其中所述制剂是片剂或胶囊剂。69.根据实施方案67所述的制剂,其中所述制剂是液体剂。70.一种抑制受试者的β
‑
连环蛋白的方法,包括将根据实施方案42
‑
66中任一项所述的装置插入所述受试者的阴道中。71.一种抑制β
‑
连环蛋白的方法,包括使细胞与根据实施方案1
‑
29中任一项所述的肽或根据实施方案30
‑
37中任一项所述的药物组合物接触。72.一种治疗子宫内膜异位症的方法,包括向有需要的受试者施用治疗有效量的
根据实施方案1
‑
29中任一项所述的肽或根据实施方案30
‑
37中任一项所述的药物组合物。73.一种减轻与子宫内膜异位症相关的症状的方法,包括向有需要的受试者施用治疗有效量的根据实施方案1
‑
29中任一项所述的肽或根据实施方案30
‑
37中任一项所述的药物组合物。74.根据实施方案73所述的方法,其中所述症状包括选自慢性疼痛、中枢敏化、肌筋膜疼痛、附件肿块、不孕症、痛经、遗传易感性、非经期盆腹疼痛、性交困难、肠症状(腹泻、痉挛、便秘)、排便痛(大便困难)、卵巢肿块或肿瘤、膀胱疼痛症状和排尿困难中的至少一种。75.一种治疗病况的方法,包括向受试者施用治疗有效量的根据实施方案1
‑
29中任一项所述的肽或根据实施方案30
‑
37中任一项所述的药物组合物。76.根据实施方案75所述的方法,其中所述病况是组织浸润病况、组织迁移病况、组织侵入病况或其组合。77.根据实施方案75所述的方法,其中所述病况包括癌症。78.根据实施方案77所述的方法,其中所述癌症包括结直肠癌、鳞状细胞癌、头颈癌、胰腺癌、乳腺癌、髓性白血病、基底细胞癌、滑膜肉瘤、非小细胞肺癌、实体瘤或前列腺癌。79.根据实施方案75所述的方法,其中所述病况包括子宫内膜异位症。80.根据实施方案71
‑
79中任一项所述的方法,其中所述肽结合β
‑
连环蛋白。81.根据实施方案71
‑
80中任一项所述的方法,其中所述肽抑制β
‑
连环蛋白。82.根据实施方案80所述的方法,其中所述肽结合细胞质β
‑
连环蛋白。83.根据实施方案82所述的方法,其中所述肽与细胞质β
‑
连环蛋白结合以抑制β
‑
连环蛋白向细胞核的易位。84.根据实施方案82所述的方法,其中所述肽结合细胞质β
‑
连环蛋白以减少游离核β
‑
连环蛋白的量。85.根据实施方案82所述的方法,其中所述肽结合细胞质β
‑
连环蛋白以防止β
‑
连环蛋白充当致癌基因、基质金属蛋白酶9(mmp9)或氯化物c3通道(clc
‑
3)的转录因子。86.根据实施方案82所述的方法,其中所述肽与细胞质β
‑
连环蛋白结合以防止ems细胞的转化、侵入、迁移、纤维化或其任何组合。87.根据实施方案82所述的方法,其中所述肽与细胞质β
‑
连环蛋白结合以防止β
‑
连环蛋白与雌激素受体(esr1)结合。88.根据实施方案82所述的方法,其中所述肽结合细胞质β
‑
连环蛋白并且β
‑
连环蛋白的膜活性没有降低。89.根据实施方案82所述的方法,其中所述肽结合细胞质β
‑
连环蛋白并且β
‑
连环蛋白
‑
e
‑
钙粘蛋白结合没有降低。90.根据实施方案76所述的肽,其中所述肽防止致癌转录因子活性。91.根据实施方案84所述的方法,其中所述受试者细胞中的膜β
‑
连环蛋白的量增加至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至少100%。92.根据实施方案91所述的方法,其中所述膜β
‑
连环蛋白的增加是相对于未施用治疗有效量的所述药物组合物的对照受试者的细胞而言。93.根据实施方案91所述的方法,其中膜细胞质β
‑
连环蛋白的增加是相对于在所述受试者发展所述病况之前获取的所述受试者的细胞而言。94.根据实施方案91所述的方法,其中所述膜结合β
‑
连环蛋白的增加是相对于在不同时间点取自受试者的细胞而言。95.根据实施方案72至94中任一项所述的方法,其中所述治疗有效量为约0.01mg至约1000mg。96.一种预防病况的方法,包括向受试者施用治疗有效量的根据实施方案1
‑
29中任一项所述的肽或根据实施方案30
‑
37中任一项所述的药物组合物。97.根据实施方案96所述的方法,其中所述病况是组织浸润病况、组织迁移病况、组织侵入病况或其组合。98.根据实施方案96所述的方法,其中所述病况包括癌症。99.根据实施方案98所述的方法,其中所
述癌症包括结直肠癌、鳞状细胞癌、头颈癌、胰腺癌、乳腺癌、髓性白血病、基底细胞癌、滑膜肉瘤、非小细胞肺癌、实体瘤或前列腺癌。100.根据实施方案98所述的方法,其中所述病况包括子宫内膜异位症。101.根据实施方案96
‑
100中任一项所述的方法,其中所述肽结合β
‑
连环蛋白。102.根据实施方案96
‑
101中任一项所述的方法,其中所述肽抑制β
‑
连环蛋白。103.根据实施方案101所述的方法,其中所述肽结合细胞质β
‑
连环蛋白。104.根据实施方案103所述的方法,其中所述肽与细胞质β
‑
连环蛋白结合以抑制β
‑
连环蛋白向细胞核的易位。105.根据实施方案103所述的方法,其中所述肽结合细胞质β
‑
连环蛋白以减少游离核β
‑
连环蛋白的量。106.根据实施方案103所述的方法,其中所述肽结合细胞质β
‑
连环蛋白以防止β
‑
连环蛋白充当致癌基因、基质金属蛋白酶9(mmp9)或氯化物c3通道(clc
‑
3)的转录因子。107.根据实施方案103所述的方法,其中所述肽防止ems细胞的转化、侵入、迁移、纤维化或其任何组合。108.根据实施方案103所述的肽,其中所述肽防止β
‑
连环蛋白与雌激素受体(esr1)结合。109.根据实施方案103所述的方法,其中所述肽结合细胞质β
‑
连环蛋白并且β
‑
连环蛋白的膜活性没有降低。110.根据实施方案103所述的方法,其中所述肽结合细胞质β
‑
连环蛋白并且β
‑
连环蛋白
‑
e
‑
钙粘蛋白结合不受影响。111.根据实施方案96所述的方法,其中所述肽防止致癌转录因子活性。112.根据实施方案105所述的方法,其中所述受试者细胞中的游离核β
‑
连环蛋白的量减少至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、至少99%或至少100%。113.根据实施方案112所述的方法,其中所述游离细胞质β
‑
连环蛋白的减少是相对于未施用治疗有效量的所述药物组合物的对照受试者的细胞而言。114.根据实施方案112所述的方法,其中所述游离核β
‑
连环蛋白的减少是相对于在所述受试者发展为所述子宫内膜异位症或组织浸润型病况之前获取的所述受试者的细胞而言。115.根据实施方案112所述的方法,其中所述游离细胞质β
‑
连环蛋白的减少是相对于在不同时间点取自所述受试者的细胞而言。116.根据实施方案96至115中任一项所述的方法,其中所述治疗有效量为约0.01mg至约1000mg。117.根据实施方案72
‑
116中任一项所述的方法,其中静脉内施用所述肽或药物组合物。118.根据实施方案72
‑
116中任一项所述的方法,其中肌内施用所述肽或药物组合物。119.根据实施方案72
‑
116中任一项所述的方法,其中所述肽或药物组合物与治疗骨质疏松症的药物的施用同时施用。120.根据实施方案119所述的方法,其中所述治疗骨质疏松症的药物包括阿仑膦酸盐、伊班膦酸盐、利塞膦酸盐、唑来膦酸、地诺单抗、降钙素、雌激素、雷洛昔芬、巴多西酚、特立帕肽、阿巴帕肽或其任何组合。121.根据实施方案119所述的方法,其中所述治疗骨质疏松症的药物是唑来膦酸。vi.实施例
[0161]
包括以下实施例仅用于说明目的并且不旨在限制本公开的范围。实施例1肽合成
[0162]
反义met
‑
x1‑
x2‑
x3‑
x4‑
x5‑
x6‑
x7‑
x8‑
x9‑
x
10
‑
lys单链dna模板在凯克寡核苷酸合成设施(yale)合成,且序列为5
′…
gccagaccccgatttsnnsnnsnnsnnsnnsnnsnnsnnsnnsnncattgtaattgtaaata
‑
gtaattg
…3′
,其中n=a、t、c、g且s=g、c。用于“n”位的试剂瓶由a:c:g:t以3:3:2:2的比例混合制成。用于“s”位的试剂瓶由c:g以3:2的比例混合制成。使用正向引物gen
‑
fp(5
′‑
taatacgactcactatagggacaattactatttacaatta ca
‑3′
)和反向引物mk
10
k
‑
rp
(5
′…
accgctgccagaccccgatt t
…3′
)通过五个循环的聚合酶链反应(pcr)扩增mx10k文库双链dna。由t7失控转录产生第0轮mrna库,并通过尿素
‑
page纯化。通过寡核苷酸夹板(mx
10
k
‑
夹板:5
′…
tttttttttttttaccgctgccagac
…3′
)将纯化的mrna连接到f30p(5
′‑
da21[c9]3dadcdc
‑
p;c9=三(乙二醇)磷酸酯(glen research),p=嘌呤霉素(glen research))。在连接反应的page纯化后,将模板溶解在水中并通过在260nm下的吸光度进行定量。实施例2肽的合成和环化
[0163]
含有n
‑
甲基氨基酸的肽显示增加的蛋白酶抗性。此外,肽的环化已显示增加配体肽的结合亲和力。
[0164]
所有溶剂均购自sigma。除n
‑
me
‑
l14外的所有肽均通过手动固相肽合成用预加载的leu
‑2‑
氯三苯甲基树脂(250mg,0.15mmol;anaspec)合成。n
‑
me
‑
l14是在2
‑
氯三苯甲基树脂(anaspec)上加载fmoc
‑
n
‑
甲基亮氨酸(fmoc=9
‑
芴基甲氧基羰基;anaspec)后合成的。添加了五个n末端asn残基以提高肽溶解度。通过在n,n二异丙基乙胺(diea;5当量)存在下将fmocn
‑
me
‑
l14添加到在dmf中的2
‑
氯三苯甲基树脂(5当量;250mg,0.35mmol)2小时来完成加载。在室温下,用单体(5当量;novabiochem)的hatu(2ml,0.6mmol;novabiochem)溶液,hoat(1.2mmol;genescript)的dmf溶液以及diea(1.8mmol)进行标准偶联,持续15分钟。与n
‑
甲基氨基酸的偶联遵循相同的程序,其中偶联时间为30分钟。fmoc脱保护在室温下用20%哌啶(anaspec)进行15分钟。在脱保护,用95%tfa切割、过滤和醚萃取之后,将粗产物在vydac c
‑
18反相柱上使用梯度洗脱(0%b 5分钟,10
‑
50%b 40分钟。溶剂a:含0.1%tfa的h2o,溶剂b:含0.035%tfa的ch3cn)纯化。将冻干固体在dmso中重构,并通过280nm下的吸光度进行定量(ε280=12490l mol
‑1cm
‑1)。产率=20
–
25%。
[0165]
通过将在50mm的磷酸盐缓冲液(ph=8)中的190μl的dt纯化的融合蛋白加入到50μl的dsg(1mg/ml的dmf溶液)来环化肽。使反应进行1小时,将融合蛋白通过dt
‑
纤维素再纯化,并经乙醇沉淀。该过程产生环肽。实施例3核β
‑
连环蛋白抑制和wnt信号传导
[0166]
评估肽抑制wnt信号传导的能力。在增加肽抑制剂浓度的情况下,用wnt3a(命中(hit)1:seq id no:217,命中2:seq id no:224,命中3:seq id no:228,命中4:seq id no:227,命中5:seq id no:220,命中6:seq id no:168。命中7:seq id no:226)或用媒介物对照刺激在wnt响应型启动子(tcf/lef)(enzo life sciences,farmingdale,ny)下表达荧光素酶的鼠3t3成纤维细胞(图2a)。优化的化合物显示ec
50
值在500
–
999nm范围内,且荧光素酶水平降低到未刺激(
‑
wnt3a)对照的水平。荧光素酶活性不受添加乱序肽(以乱序方式包含相同氨基酸)、非功能性肽(肽不靶向β
‑
连环蛋白)或非渗透性肽(没有渗透性增强特征的肽)的影响。结果表明本文描述的肽对wnt响应型启动子具有浓度依赖性抑制(conc dep supp.)。实施例4肽不抑制膜结合β
‑
连环蛋白或阻止进入e
‑
钙粘蛋白上的结合位点
[0167]
进行了竞争性结合测定(图3),其中将生物素化的β
‑
连环蛋白固定在链霉亲和素板上,并在不同量的肽抑制剂(seq id no:42)存在下添加50nm的e
‑
钙粘蛋白
‑
fc融合物。测试的剂量均不抑制β
‑
连环蛋白和e
‑
钙粘蛋白相互作用。结果表明,这些肽不会抑制膜结合的β
‑
连环蛋白或阻止进入e
‑
钙粘蛋白上的结合位点。
实施例5β
‑
连环蛋白抑制剂引起病变消退
[0168]
进行一项研究以评估β
‑
连环蛋白对子宫内膜异位症小鼠模型的影响。通过将来自小鼠的切碎的gfp+子宫组织经腹膜内注射到野生型c57/bl6小鼠中,在子宫内膜异位症的ems小鼠模型中建立病变。该小鼠模型的病变模拟在人类中发现的附着位点。病变组织有明确的上皮腺结构、组织化基质和载有含铁血黄素的巨噬细胞。病变对激素有响应并表达β
‑
连环蛋白、mmp、wnt4、pgr和esr。在小鼠中建立子宫内膜疾病并在治疗开始前允许其进展三周。
[0169]
在该建立阶段后,对小鼠每天进行媒介物(pbs+0.5%dmso阴性对照)或大环肽环乙酰基
‑
k*nle
‑
w
‑3‑
环己基
‑
l
‑
丙氨酸
‑
li
‑
(氨基丁酸
‑
awd*
‑
cooh)(seq id no:215)、“肽2”(pbs+5mg/kg肽2的0.5%dmso溶液)ip治疗,持续三周。每天取阴道涂片,这表明用媒介物或肽2治疗的小鼠经历了发情周期的4个阶段。图4a显示了小鼠每4
‑
5天循环一次通过发情前期(p)、发情期(e)、间情期(d)和动情后期(m)阶段。媒介物和肽2的发情模式是正常的。表明对下丘脑性腺轴的子宫没有不良影响。
[0170]
然后在发情期间对小鼠实施安乐死;测量小鼠体重、卵巢重量和子宫重量并确定在治疗方案中是一致的(图4b)。与单独的媒介物相比时,经肽2治疗的小鼠中ems病变的大小减小(图4b和图4c)。与单独的媒介物相比时,在肽2治疗的小鼠中也观察到激活的巨噬细胞的相对增加。图5显示了如通过组织学评估的,与单独媒介物相比,在用肽2(seq id no:215)治疗的病变部位处激活的巨噬细胞、泡沫细胞、多形核嗜中性粒细胞、b细胞和t细胞的相对数量增加。不期望受理论束缚,这些结果可表明免疫细胞正在吞噬子宫组织。
[0171]
从该实验可以得出结论,肽2是β
‑
连环蛋白的抑制剂,可在不改变发情周期性、小鼠体重、卵巢重量或子宫重量的情况下导致病变消退。总之,这些数据表明肽2:(1)具有膜渗透性,并以剂量依赖的方式干扰β
‑
连环蛋白的核转录功能,(2)表现出对蛋白酶的稳定性和持续的半衰期,(3)不影响β
‑
连环蛋白膜与e
‑
钙粘蛋白结合,(4)抑制具有病理性和异常wnt依赖性生长的细胞的细胞增殖,(5)不影响健康细胞的生长或破坏膜结合的β
‑
连环蛋白活性,和(6)在不改变子宫周期性或子宫重量的情况下使ems病变消退。实施例6肽的治疗效力
[0172]
测试肽抑制剂抑制包括人类子宫内膜基质细胞(hesc)和/或来自不同病变亚型(基于位置和严重程度)的原代ems细胞的一组细胞类型的细胞增殖的能力。将源自小鼠子宫的小鼠子宫细胞用作对照细胞系,以证明肽不会抑制正常的细胞行为。根据世界子宫内膜异位症研究基金会子宫内膜异位症表型组学和生物库协调项目(ephect)标准协议,从不同患者切除原代ems细胞并收集。将所有细胞系铺板(5
‑
10
×
104细胞/24孔板,一式四份),将每种肽以10种不同浓度(10
‑
50,000nm)连同一系列对照每天施用,持续5天(参见表2)。第5天后,使用luminescent cell viability assay(promega)检测活细胞。基于细胞活力读数,使用prism软件(graphpad)绘制和计算ic50值。表2.
实施例7体外细胞迁移和侵入的治疗抑制
[0173]
如matsuzaki等人,c.plos one 8,e61690所概述,使用未涂覆的或基质胶涂覆的24孔室或微滤器(becton dickinson)分别分析hesc、小鼠ems病变细胞和人ems病变细胞的体外细胞迁移和侵入。在使用相同的对照刺激并随后施用在实施例3和6中确定的最佳化合物后,通过在24小时内迁移到室的未填充区域的细胞数计算细胞运动和迁移,并且通过24小时内侵入微孔过滤器的细胞数计算细胞侵入。这些实验重复进行四次,并用计算机化的光学显微镜进行定量分析。结果用于评估肽抑制细胞迁移和侵入的能力。实施例8确认细胞系中治疗分子的中靶(on
‑
target)活性
[0174]
使用人wnt信号传导通路rt2分析器pcr阵列(qiagen,venlo,netherlands)通过>80wnt的通路基因的转录活性来评估每个肽的中靶活性。对原代细胞施用500nm的选定肽,持续48小时。从收获的细胞中提取rna并使用rtpcr在阵列上进行分析。阵列中包括84个与wnt介导的信号传导相关的基因,包括配体、受体、下游信号传导分子和wnt典型通路、两个非典型通路、平面细胞极性和钙离子依赖性通路的调节因子。clc
‑
3的蛋白质印迹分析和mmp
‑
9活性的酶谱法用于确认所选蛋白质已降低≥性的酶的初始水平。将细胞染色以通过免疫荧光进行β
‑
连环蛋白定位。对照如表2所列。实施例9体内病变的治疗消退
[0175]
选择化合物以使用ems小鼠模型进一步测试其治疗潜力。根据burns,等人,endocrinology 153,3960
‑
3971,用ems诱导小鼠。将激素完整的同基因小鼠用怀孕母马血清促性腺激素(pmsg
‑
5iu)同步。41小时后取出子宫,此时激素水平和阴道组织学模拟动情后期/发情期(数据未显示)。剥去外层子宫肌层和附接的血液供给,纵向切开子宫,在无菌盐水中切碎成1
‑
2mm的块。将切碎的子宫组织通过5mm的背侧侧孔注入腹膜腔中(第0天)。在腹膜内引入肽之前,允许切碎的子宫组织附着并生长3周。将小鼠每天用5mg/kg、10mg/kg和20mg/kg的肽治疗,持续6周。在ems开始后第9周,将小鼠在发情期安乐死。以前的数据用作均值和标准偏差的初步估计,以确定数值(表3)。
[0176]
在尸检时,通过腹膜灌洗收集腹膜细胞和流体。将病变与周围组织一起去除(记录重量、体积和位置)以进行组织学/免疫组织化学(ihc)或不进行通过实时pcr的基因表达分
析。将小鼠在尸检前20分钟注射凝集素(100μg)和硫酸肝素(100u),以便在组织学上使血管可视化。在组织学上分析病变的血管密度、组织化/胶原蛋白(masson三色染色法)、白细胞浸润(即,ly6g的嗜中性粒细胞、f4/80的巨噬细胞)、增殖(ki67)、β
‑
连环蛋白定位和wnt信号传导分子。病变进一步用于使用mmp酶谱法检查wnt/β
‑
连环蛋白水平,以及基质金属蛋白酶(mmp)活性。分析腹膜流体细胞的巨噬细胞和嗜中性粒细胞。使用实时
‑
pcr分析病变以靶向实施例4中在wnt信号传导pcr阵列中受影响最大的基因。来自对照治疗的病变用作基线。
[0177]
选择降低wnt信号传导、降低病变重量或体积、降低mmp活性水平、减少纤维化、增加病变中白细胞浸润、相对于对照降低核β
‑
连环蛋白的量或其任何组合的化合物用于进一步测试。表3.实施例10定位的免疫组化
[0178]
在小鼠疾病模型中建立子宫内膜异位症。使小鼠建立子宫内膜异位症,持续3周。在前3周后,对小鼠随后每天用对应于seq id no:215或393的治疗肽或未处理的阴性对照经腹膜内治疗3周。为了评估肽和β
‑
连环蛋白的定位,评估子宫内膜异位症小鼠模型的病变。在治疗的最后一天,为了使肽对病变(多个)的定位可视化,向小鼠给药生物素化标记肽治疗剂或对照。将小鼠安乐死,移除病变,并固定在福尔马林中进行组织学和免疫组织化学。将固定和切片的病变与β
‑
连环蛋白特异性抗体(cell signaling,1:100,二抗(secondary):fisher scientific,山羊抗兔
‑
647 1:200)、用于生物素化治疗的链霉亲和素(fisher scientific,sa
‑
405 1:100)以及用于细胞核的sytox绿(fisher scientific,1:300)一起温育。使用igg非特异性抗体(兔
‑
igg,abcam1:100)对来自所有治疗组的病变切片进行免疫组化阴性对照。
[0179]
定性地,如图6a所示,当用治疗肽治疗时,显然地靶标β
‑
连环蛋白未定位于细胞核。此外,治疗肽也遵循β
‑
连环蛋白的定位模式,β
‑
连环蛋白在细胞核中减少并且在膜中得以保持/增加。这意味着该肽是膜可溶性的,与细胞质β
‑
连环蛋白结合,并且不会破坏膜中β
‑
连环蛋白之间的结合。治疗性肽结合可增加β
‑
连环蛋白与e
‑
钙粘蛋白的结合亲和力。相反,经对照治疗的病变在膜、细胞质和细胞核上有更多的弥漫性染色。此外,如图6b所示,正交切片显示与经对照处理的病变相比,经肽治疗的病变中的β
‑
连环蛋白更具有膜性。如预期的那样,治疗肽的定位与β
‑
连环蛋白染色相关。在经肽治疗的病变中,肽的定位主要是跨膜可视化的。
[0180]
使用zeiss blue软件通过阈值化进行β
‑
连环蛋白定位的量化。阈值化允许软件使用像素强度计算染色面积;因此,可以为不同的细胞区室推断染色的定量数(参见表6)。
表6.染色面积阈值数据表6.染色面积阈值数据
[0181]
编辑的面积阈值化数据显示,当与经对照治疗的病变相比时,来自接受治疗剂治疗的病变的β
‑
连环蛋白具有更多的膜结合(参见图7a)。此外,与经对照治疗的病变相比,用治疗剂治疗的病变中核β
‑
连环蛋白水平降低(参见图7b)。
[0182]
总之,这些数据表明治疗肽维持或增加β
‑
连环蛋白与膜的结合并抑制核β
‑
连环蛋白定位。实施例11使用表面等离子体共振(spr)的kd50测量
[0183]
将生物素化蛋白(β
‑
连环蛋白)固定在高亲和力链霉亲和素(sa)传感器芯片(ge)上。根据制造商的说明,在室温下使浓度增加的肽流过hbsep+缓冲液中。使用系统(ge)说明计算表面的最大结合容量(饱和响应),并在每个浓度下测量结合作为数据点。在表面饱和度为至少20%至80%的分析物浓度范围内确定结合水平。使用洞察评价软件(ge)计算开启率、关闭率和kd。从这些系列稀释中计算50%的饱和浓度,并在表5中表示为kd50。qpcr证实了细胞系中治疗分子的中靶活性。
[0184]
使用qiagen的人wnt信号传导通路rt2分析器pcr阵列)通过wnt通路基因的转录活性来评估每个肽的中靶活性。给原代细胞施用对应于seq id no:42的治疗肽48小时。从收获的细胞中提取rna并使用rtpcr在阵列上进行分析。阵列包括84个与wnt介导的信号传导相关的基因,包括配体、受体、下游信号传导分子和wnt典型通路、两个非典型通路、平面细胞极性和钙离子依赖性通路的调节因子,在此处评估了其中的38个。icg001(一种已知的wnt抑制剂)的阳性对照也在rna阵列上运行以用作比较。
[0185]
结果描绘在图8a和图8b中,其显示了对应于seq id no:42的治疗肽通过抑制wnt通路中的多个关键基因转录物而优于已知的阳性对照。具体地,下游wnt标志物和靶基因,包括axin1、axin2、ccnd1、ctnnb1、cxxc4、dkk1、dkk3、dvl1、dvl2、frat1、lef1、mmp7、myc、nfatc1、rhoa、rhou、tcf7、tcf7l1、wnt9a和wnt受体和配体,包括fzd3、fzd4、fzd6、fzd8、wnt10a、want11、want2b、wnt4、wnt5a、wnt5b、wnt6、wnt7a在施用治疗肽时被下调。(参见图8a和8b)。这些关键转录物的下调可有助于在子宫内膜异位症细胞中观察到的治疗剂的抗增殖作用。此外,多个wnt受体和配体被上调,这可能是这些经治疗的细胞的细胞凋亡的结果。上调的wnt受体和配体包括fzd5、fzd9、wnt3。总之,这些结果表明对应于seq id no:42的治疗肽是有效且特异性的wnt抑制剂。实施例12使用荧光偏振(fp)的kd50测量
[0186]
将5nm标记的tcf4蛋白加入100nm的β
‑
连环蛋白的溶液中,并在96孔板(greiner 96平坦透明板,millipore sigma,carlsbad ca)中在室温温育。然后,将不同浓度的β
‑
连环蛋白抑制剂候选物(seq id no:404)以从10nm到30um抑制剂的一系列系列稀释加入板的不同孔中。荧光偏振由infinite m1000(tecan,baldwin park ca)在470nm的激发波长下读取,并在520nm发射波长下测量。空白背景噪声的校正的偏振测量对于每个数据点产生偏振强度读数。实验进行3次,在microsoft excel(microsoft,redmond,wa)中分析数据并绘图。显示seq id no:404的结果的示例示于图9中。结果表明抑制剂以浓度依赖性方式结合β
‑
连环蛋白。实施例13肽对细胞增殖的影响
[0187]
测试了肽抑制剂抑制2种不同的表达β
‑
连环蛋白的致病细胞系的细胞增殖的能力:结肠癌细胞系(sw480)和/或源自小鼠疾病模型的小鼠ems病变细胞。众所周知,这两种细胞系都表达高水平的β
‑
连环蛋白。将细胞系与不同浓度的肽浓度一起温育,并在5天和7天后评估活力。使用发光细胞活力测定(promega)检测活细胞。基于细
胞活力读数,使用prism软件(graphpad)绘制和计算ic50值。ic50用于评估肽浓度对细胞增殖的抑制,并用于计算每个肽对每个系的抑制作用。结果用于评估肽的治疗效力。
[0188]
在sw480细胞系中,每天将来自家族1(seq id no:264)和家族2(seq id no:396)的肽抑制剂添加到细胞生长培养基中。7天后,用cell
‑
titer glo试剂盒(promega,madison,wi)评估细胞活力。7天后,两种肽均以浓度依赖性方式抑制细胞生长(图2b)。在源自疾病小鼠模型的小鼠ems病变细胞中,每天将肽抑制剂(seq id no:465)以25um、12.5um、6.25um、3.125um、1.56um、0.78um、0.39um、0.195um、0.098um、0.049um、0.024um和0um(阴性对照)的浓度添加到细胞生长培养基中。5天后,评估细胞活力,5天后肽以剂量依赖性方式抑制细胞生长。根据观察到50%存活率时的浓度计算肽的ic
50
(表5)。实施例14说明性化合物
[0189]
说明性肽如下所示。如实施例1和实施例2中所述合成肽。肽33:环
‑
n3*
‑
wesildehvqrvw
‑
pra*
‑
conh2(seq id no:33)
肽148:h2n
‑
mwflica(2
‑
pyr)wg
‑
cooh(seq id no:148)肽190:环
‑
ado*
‑
mwflicfwd*
‑
cooh(seq id no:190)
肽193:环
‑
ado*
‑
mwflicawd*
‑
cooh(seq id no:193)肽224:(ppa
‑
mwilisfwg
‑
cooh(seq id no:224)肽264:me2n
‑
mwilisfwg
‑
cooh(seq id no:264)
肽144:h2n
‑
mwili
‑
hs
‑
fwg
‑
cooh(seq id no:144)肽242:ac
‑
mwilisfw
‑
aβ
‑
cooh(seq id no:242)肽234:环
‑
h2n
‑
k*wflicaw
‑
aβ*(seq id no 234)肽235:ac
‑
kwflicaw
‑
aβ(seq id no:235)
肽248:环
‑
h2n
‑
k(ava*)wflicawd*
‑
cooh(seq id no:248)肽249:环
‑
h2n
‑
k(ahx*)wflicawd*
‑
cooh(seq id no:249)
[0190]
尽管已经在本文中示出和描述了本公开的优选实施方案,但是对于本领域技术人员而言显而易见的是,这些实施方案仅作为示例提供。在不脱离本公开的情况下,本领域技术人员现在将想到许多变化、改变和替换。应该理解的是,本文描述的本公开的实施方案的各种替代方案可以用于实施本公开。意图是,所附权利要求限定本公开的范围,并且由此涵盖这些权利要求范围内的方法和结构及其等同方案。表4.序列
表5:表征β
‑
连环蛋白k
d
范围:a=0
‑
400nmb=>400至1000nmc=>1000至10,000nmd=>10,000至30,000nme=>30,000nmwnt报告基因ec
50
范围:f=>0至7.5umg=>7.5至15um
h=>15至22.5umi=>22.5至30umj=>30um
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1