乙型肝炎病毒疫苗及其用途的制作方法
乙型肝炎病毒疫苗及其用途
1.相关申请的交叉引用
2.本技术要求于2018年12月12日提交的美国临时专利申请号62/778,549的权益,其全部内容通过引用的方式并入本文。
3.引用合并
4.本文引用的所有专利、专利申请和文章的全部内容通过引用的方式整体并入。
技术领域
5.本发明涉及乙型肝炎病毒(hbv)疫苗。
背景技术:
6.慢性乙型肝炎病毒(hbv)感染仍然是全球公共卫生保健管理的一个挑战。全世界有高于3.5亿患者受到慢性乙型肝炎感染的影响,每年导致高于100万人死亡。参见,例如,kane,m.,1995.global programme for control of hepatitis b infection.vaccine,13,pp.s47
‑
s49;lavanchy,d.,2004.hepatitis b virus epidemiology,disease burden,treatment,and current and emerging prevention and control measures.journal of viral hepatitis,11(2),pp.97
‑
107;以及maddrey,w.c.,2001.hepatitis b
‑‑
an important public health issue.clinical laboratory,47(1
‑
2),pp.51
‑
55。特别是在中国等发展中国家,近10%的人口受到影响(参见,例如,yao,j.l.,1996.perinatal transmission of hepatitis b virus infection and vaccination in china.gut,38(suppl 2),pp.s37
‑
s38;liang,x.,et al.,2009,epidemiological serosurvey of hepatitis b in china—declining hbv prevalence due to hepatitis b vaccination.vaccine,27(47),pp.6550
‑
6557)。此外,很大比例的慢性病携带患者会发展为肝细胞癌。参见,例如,bosch,f.x.,ribes,j.and borr
à
s,j.,1999,epidemiology of primary liver cancer,in seminars in liver disease,vol.19,no.03,pp.271
‑
285,thieme medical publishers,inc.;bosch,f.x.,ribes,j.,cl
é
ries,r.and d
í
az,m.,2005,epidemiology of hepatocellular carcinoma,clinics in liver disease,9(2),pp.191
‑
211;ribes,j.,cl
è
ries,r.,rubi
ó
,a.,hern
á
ndez,j.m.,mazzara,r.,madoz,p.,casanovas,t.,casanova,a.,gallen,m.,rodr
í
guez,c.and moreno,v.,2006,cofactors associated with liver disease mortality in an hbsag
‑
positive mediterranean cohort:20years of follow
‑
up,international journal of cancer,119(3),pp.687
‑
694。
7.目前的治疗方法,例如,使用核苷抑制剂,其不会抑制共价闭合环状dna(cccdna)的转录,并且通常会导致耐药性。干扰素α的治疗会导致难以忍受的副作用(lok,a.s.and mcmahon,b.j.,2007.chronic hepatitis b.hepatology,45(2),pp.507
‑
539),并且最多只有10%的治疗患者实现血清转换。因此,仍然需要更有效的治疗方案来解决当前的医疗保健问题。
8.乙型肝炎病毒的表面包膜包含三种蛋白质,分别命名为l、m和s。这三种蛋白质具有共同的c端,而m型与s相比包含一个另外的n端pres2序列,而l
‑
型与m和s相比包含一个另外的pres1序列(ganem,d.and varmus,h.e.,1987.the molecular biology of the hepatitis b viruses.annual review of biochemistry,56(1),pp.651
‑
693)。据报道,pres1序列包含一个受体结合序列(aa 21
‑
47),负责将病毒与肝细胞特异性结合。参见,例如,barrera,a.,guerra,b.,notvall,l.and lanford,r.e.,2005,mapping of the hepatitis b virus pre
‑
s1 domain involved in receptor recognition,journal of virology,79(15),pp.9786
‑
9798;neurath,a.r.,kent,s.b.h.,strick,n.and parker,k.,1986,identification and chemical synthesis of a host cell receptor binding site on hepatitis b virus,cell,46(3),pp.429
‑
436;neurath,a.r.,seto,b.and strick,n.,1989,antibodies to synthetic peptides from the pres1region of the hepatitis b virus(hbv)envelope(env)protein are virus
‑
neutralizing and protective,vaccine,7(3),pp.234
‑
236;以及dash,s.,rao,k.v.and panda,s.k.,1992,receptor for pre
‑
sl(21
–
47)component of hepatitis b virus on the liver cell:role in virus cell interaction,journal of medical virology,37(2),pp.116
‑
121。最近,牛磺胆酸钠共转运多肽已被确定为人类乙型肝炎病毒的功能性受体。参见,例如,yan,h.,et al.,2012,sodium taurocholate cotransporting polypeptide is afunctional receptor for human hepatitis b and d virus.elife,1,p.e00049;ni,y.,et al.,2014,hepatitis b and d viruses exploit sodium taurocholate co
‑
transporting polypeptide for species
‑
specific entry into hepatocytes.gastroenterology,146(4),pp.1070
‑
1083。
9.现在仍需要有效的hbv疫苗。
技术实现要素:
10.一方面,公开了乙型肝炎病毒(hbv)疫苗颗粒,其包含重组hbv表面抗原,所述重组hbv表面抗原包含:
11.l表面蛋白;
12.任选地,m表面蛋白;以及
13.任选地,s表面蛋白;
14.其中,所述l、m和s表面蛋白中l表面蛋白的百分比为至少约1mol%。
15.在本文公开的任一实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为至少约2mol%、3mol%、4mol%、5mol%、6mol%、7mol%或8mol%。
16.在本文公开的任一实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比高于约8mol%。
17.在本文公开的任一实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比高于约9mol%、10mol%、11mol%、12mol%、13mol%、14mol%、15mol%、16mol%、17mol%、18mol%、19mol%、20mol%、21mol%、22mol%、23mol%、24mol%、25mol%、26mol%、27mol%、28mol%、29mol%、30mol%、31mol%、32mole%、33mol%、34mol%、35mol%、36mol%、37mol%、38mol%、39mol%、40mol%、41mol%、42mol%、43mol%、44mol%、
45mol%、46mol%、47mol%、48mol%、49mol%或50mol%。
18.在本文公开的任一实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为至少约60mol%、70mol%、80mol%、90mol%或100mol%。
19.在本文公开的任一实施方案中,所述hbv疫苗颗粒不包含m或s蛋白。
20.在本文公开的任一实施方案中,所述hbv疫苗颗粒是病毒样颗粒。
21.在本文公开的任一实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约10mol%至约40mol%,5
‑
15mol%、15
‑
25mol%、25
‑
40mol%、或40
‑
60mol%。
22.在本文公开的任一实施方案中,所述hbv疫苗颗粒包括克隆a4或51,如图9所示。
23.在本文公开的任一实施方案中,所述l表面蛋白由不具有内部顺式元件的重组核酸序列编码。在一些实施方案中,l表面蛋白由不具有驱动s蛋白表达的内部顺式元件的重组核酸序列编码。在一些实施方案中,l表面蛋白由不具有驱动m蛋白表达的内部顺式元件的重组核酸序列编码。在一些实施方案中,l表面蛋白由不具有驱动m或s蛋白表达的内部顺式元件的重组核酸序列编码。
24.另一方面,公开了一种hbv疫苗,包括任一实施方案的hbv疫苗颗粒和佐剂。
25.在本文公开的任一实施方案中,所述佐剂选自由明矾、toll样受体和胶体金所组成的组。
26.另一方面,公开了一种在有需要的受试者中治疗或预防hbv感染的方法,包括向受试者施用有效量的本文公开的任一实施方案的hbv疫苗。
27.在本文公开的任一实施方案中,所述受试者是人类。
28.另一方面,公开了编码l表面蛋白的重组核酸序列,其中所述重组核酸序列不具有内部顺式元件。
29.另一方面,公开了一种用于表达l表面蛋白的重组表达载体,其包含本文公开的任一实施方案的重组核酸序列。
30.另一方面,描述了一种细胞,其中所述细胞用本文公开的任一实施方案的重组表达载体转化。
31.在本文公开的任一实施方案中,所述细胞另外被以下所转化:
32.包含编码s表面蛋白的第二重组核酸序列的第二重组表达载体,和
33.包含编码m表面蛋白的第三重组核酸序列的第三重组表达载体。
34.在本文公开的任一实施方案中,所述细胞另外被一种或多种另外的重组表达载体转化。
35.在本文公开的任一实施方案中,所述细胞另外被包含编码hbv核心抗原的第四重组核酸序列的第四表达载体转化。
36.在本文公开的任一实施方案中,所述细胞源自昆虫或哺乳动物的蛋白质表达宿主。在本文公开的任一实施方案中,所述细胞源自大肠杆菌或真菌。
37.在本文公开的任一实施方案中,所述细胞源自hek
‑
293细胞或cho细胞。
38.另一方面,描述了一种制备hbv疫苗颗粒的方法,包括:
39.a)提供包含分别编码l、m和s表面蛋白的第一、第二和第三重组核酸序列的重组表达载体;并且其中第一、第二和第三重组核酸序列不具有内部顺式元件;
40.b)用重组表达载体转化细胞;和
41.c)培养和选择细胞以共表达l、m和s表面蛋白。
42.在本文公开的任一实施方案中,所述l、s和m表面蛋白中的每一个都在一个单独的表达载体中。
43.在本文公开的任一实施方案中,所述方法进一步包括选择细胞以表达l表面蛋白,所述l表面蛋白在l、m和s表面蛋白中的百分比为至少约1mol%、2mol%、3mol%、4mol%、5mol%、6mol%、7mol%、8mol%、9mol%、10mol%、11mol%、12mol%、13mol%、14mol%、15mol%、16mol%、17mol%、18mol%、19mol%、20mol%、21mol%、22mol%、23mol%、24mol%、25mol%、26mol%、27mol%、28mol%、29mol%、30mol%、31mol%、32mol%、33mol%、34mol%、35mol%、36mol%、37mol%、38mol%、39mol%、40mol%、41mol%、42mol%、43mol%、44mol%、45mol%、46mol%、47mol%、48mol%、49mol%或50mol%。
44.在本文公开的任一实施方案中,所述方法进一步包括选择细胞以表达l表面蛋白,所述l表面蛋白在l、m和s表面蛋白中的百分比为至少约60mol%、70mol%、80mol%、90mol%或100mol%。
45.在本文公开的任一实施方案中,所述重组表达载体还包含编码hbv核心抗原的第四重组核酸序列;并且步骤c)包括培养和选择细胞以共表达l、m和s表面蛋白和hbv核心抗原。
46.在本文公开的任一实施方案中,所述细胞源自昆虫或哺乳动物蛋白质表达宿主。在本文公开的任一实施方案中,所述细胞源自大肠杆菌或真菌。在本文公开的任一实施方案中,所述细胞源自hek
‑
293细胞或cho细胞。
47.本文公开的任何方面或实施方案可以与本文公开的另一个方面或实施方案组合。明确考虑本文描述的一个或多个实施方案与本文描述的其他一个或多个实施方案的组合。
48.除非另有定义,本文使用的所有技术和科学术语与本发明所属领域的普通技术人员通常理解的含义相同。尽管在本发明的实践或测试中可以使用与本文所述的那些方法和材料相似或等效的方法和材料,但下文描述了合适的方法和材料。在此提及的所有出版物、专利申请、专利和其他参考文献均通过引用整体并入。此外,材料、方法和实施方案仅是说明性的,并不旨在进行限制。
附图说明
49.参考以下附图描述本发明,这些附图仅用于说明的目的而不是限制性的。
50.附图中:
51.图1描述了l蛋白表达的蛋白质印迹(western blot)分析:泳道1:分子量阶梯;泳道2:mock转染;泳道3:l型;泳道4:l型,带有另外的n端信号肽。请注意,分泌的l蛋白可视化为49kda
‑
60kda的蛋白质。
52.图2显示了单独或组合的s、m和l蛋白的瞬时表达(通过elisa分析检测条件培养基中hbsag颗粒的存在;共转染s+m+l显示hbsag颗粒水平低但可检测,证实l蛋白的高表达抑制m或s蛋白的分泌)。
53.图3显示了在核心蛋白存在下l、m和s蛋白瞬时表达的elisa检测,表明核心蛋白不影响颗粒的分泌。
54.图4a显示了表达被抗pres2单克隆抗体s26(左图)和抗s多克隆抗体(右图)识别的
蛋白质的293f稳定克隆16、23、50、51和12的蛋白质印迹筛选。72小时后收集条件培养基,并使用pres2特异性单克隆抗体s26(左图)和抗s多克隆抗体(右图)通过蛋白质印迹分析筛选l、m和s型的存在。
55.图4b显示了表达被抗pres2单克隆抗体s26(左图)和抗s多克隆抗体(右图)识别的蛋白质的cho稳定克隆7c8和10e3的蛋白质印迹筛选。
56.图5显示了表达被抗s多克隆抗体(左图)和抗pres2单克隆抗体s26(右图)识别的蛋白质的293f稳定克隆a4和51的蛋白质印迹筛选。72小时后收获条件培养基,并通过蛋白质印迹分析筛选l、m和s型的存在。
57.图6显示了针对l、m和s蛋白的存在筛选了另外的稳定表达克隆26、43、88。单个克隆在293freestyle表达培养基中生长。72小时后收集条件培养基,并使用pres2特异性单克隆抗体s26(左图)和针对s的多克隆抗体(右图)通过蛋白质印迹分析筛选l、m和s型的存在。
58.图7显示了克隆51的最终sec纯化的银染法分析片段。克隆51的条件培养基被浓缩、由羟基磷灰石捕获并通过尺寸排阻色谱分级分离。最后两条泳道是作为参考蛋白质分级分离的bsa蛋白质。
59.图8显示了克隆a4的最终sec纯化的银染法分析片段。克隆a4的条件培养基被浓缩,hbsag颗粒被羟基磷灰石捕获并通过尺寸排阻色谱分级分离。
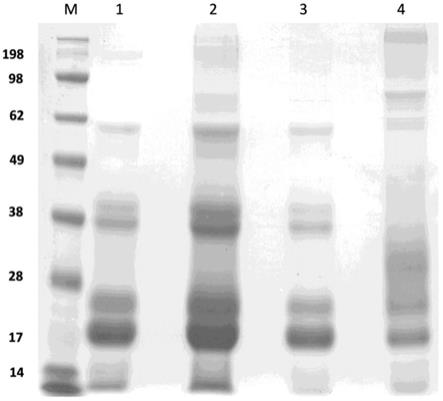
60.图9显示了来自克隆a4和51的纯化hbsag蛋白的考马斯亮蓝染色。通过bca估算,每个泳道加载大约10μg蛋白质。在凝胶肽后,通过蛋白质印迹和质谱法验证蛋白质身份。泳道1、2、3是克隆a4的三种不同制剂。第4道是克隆51的代表性制剂之一。
61.图10显示了使用抗s多克隆抗体(左图)、抗pres2单克隆抗体s26(中图)和抗pres1单克隆抗体ap1(右图)对纯化的hbsag颗粒进行的蛋白质印迹分析。左边和中间的泳道是克隆a4的两种不同的制剂。右侧泳道是来自克隆51的纯化蛋白质制剂。
62.图11显示l、m和s形式至少有部分糖基化。纯化的蛋白质用png酶处理,聚糖的去除通过sds page和蛋白质印迹分析监测。
63.图12显示了来自克隆16的纯化hbsag颗粒的电子显微镜图。
64.图13显示了来自克隆51的纯化hbsag颗粒的电子显微镜图。
65.图14显示了使用纯化的lms病毒样颗粒免疫两只小鼠时的小鼠血清滴度。酵母来源的hbsag用作免疫对照。初次免疫后35天,通过连续稀释确定针对病毒样颗粒的抗体反应滴度。hbsag
‑
1、hbsag
‑
2:使用酵母中产生的s
‑
型hbsag对小鼠进行免疫。#16
‑
1、#16
‑
2:用源自克隆16的纯化lms hbsag免疫小鼠。#51
‑
1、#51
‑
2:用源自克隆#51的纯化lms hbsag免疫小鼠。
66.图15显示了通过使用纯化的hbsag颗粒测定的抗体滴度。每个条柱代表一只balb c品系小鼠的抗体滴度。
67.图16显示了使用纯化的线性pres2肽测试针对pres2区域的抗体反应。所有四只小鼠的血清都对pres2肽有反应,但对bsa对照没有反应。
68.图17显示了从所有四只免疫小鼠中取出脾脏,并使用来自小鼠的b细胞生成杂交瘤。对纯化的hbsag颗粒具有反应性的克隆被分组于s、pres2、pres1或未知区。
具体实施方式
69.hbv疫苗
70.一方面,公开了乙型肝炎病毒(hbv)疫苗颗粒,其包含重组hbv表面抗原,所述重组hbv表面抗原包含:
71.l表面蛋白;
72.任选地,m表面蛋白;以及
73.任选地,s表面蛋白;
74.其中,所述l、m和s表面蛋白中l表面蛋白的百分比为至少约1mol%。
75.在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为至少约2mol%、3mol%、4mol%、5mol%、6mol%、7mol%或8mol%。
76.在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比高于约8mol%。
77.在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比高于约9mol%或10mol%。在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比高于约9mol%、10mol%、11mol%、12mol%、13mol%、14mol%、15mol%、16mol%、17mol%、18mol%、19mol%、20mol%、21mol%、22mol%、23mol%、24mol%、25mol%、26mol%、27mol%、28mol%、29mol%、30mol%、31mol%、32mole%、33mol%、34mol%、35mol%、36mol%、37mol%、38mol%、39mol%、40mol%、41mol%、42mol%、43mol%、44mol%、45mol%、46mol%、47mol%、48mol%、49mol%或50mol%,或在本文公开的任何两个值的范围内。
78.在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为至少约15mol%、20mol%、25mol%、30mol%或40mol%。在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为至少约60mol%、70mol%、80mol%、90mol%或100mol%。在一些实施方案中,所述hbv疫苗颗粒不包含m或s蛋白。在一些实施方案中,所述hbv疫苗颗粒是病毒样颗粒。
79.在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约10mol%至约40mol%。在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约5
‑
15mol%、15
‑
25mol%、25
‑
40mol%、或40
‑
60mol%。在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约1mol%至约40mol%。在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约2mol%至约40mol%。在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约4mol%至约40mol%。在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约5mol%至约40mol%。在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约6mol%至约40mol%。在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约7mol%至约40mol%。
80.在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约8mol%至约40mol%。在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约9mol%至约40mol%。在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约10mol%至约40mol%。在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约15mol%至约40mol%。在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约20mol%至约40mol%。在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约25mol%至约40mol%。在一些实施方案中,所述l、m和s表面蛋白中l表面蛋白的百分比为约30mol%至约
40mol%。
81.在本文公开的任一实施方案中,l表面蛋白由不具有内部顺式元件的重组核酸序列编码。申请人出奇地发现,通过去除顺式元件,可以表达高于一定百分比的l表面蛋白(例如,高于8mol%或10mol%)。在本文公开的任一实施方案中,内部顺式元件包括用于m和/或s形式的转录起始的启动子。因此,在一些实施方案中,l表面蛋白由不具有驱动s蛋白表达的内部顺式元件的重组核酸序列编码。在一些实施方案中,l表面蛋白由不具有驱动m蛋白表达的内部顺式元件的重组核酸序列编码。在一些实施方案中,l表面蛋白由不具有驱动m或s蛋白表达的内部顺式元件的重组核酸序列编码。
82.另一方面,公开了一种hbv疫苗,包括任一实施方案的hbv疫苗颗粒和佐剂。任何能够刺激和/或增强免疫反应的佐剂都被考虑在内。佐剂的非限制性实例包括明矾、toll样受体和胶体金。
83.另一方面,公开了在有需要的受试者中治疗或预防hbv感染的方法,包括向受试者施用有效量的本文公开的任一实施方案的hbv疫苗。受试者的非限制性实例包括人、猴、牛、马、狗、猫和其他哺乳动物。
84.在本文公开的任一实施方案中,所述受试者是人。
85.另一方面,公开了编码l表面蛋白的重组核酸序列,其中所述重组核酸序列不具有内部顺式元件。
86.另一方面,公开了一种用于表达l表面蛋白的重组表达载体,其包含本文公开的任一实施方案的重组核酸序列。
87.另一方面,描述了一种细胞,其中所述细胞用本文公开的任一实施方案的重组表达载体转化。细胞的非限制性实例包括cho和hek
‑
293细胞。
88.在本文公开的任一实施方案中,细胞另外被以下所转化:
89.包含编码s表面蛋白的第二重组核酸序列的第二重组表达载体,和
90.包含编码m表面蛋白的第三重组核酸序列的第三重组表达载体。
91.在本文公开的任一实施方案中,细胞另外被包含编码hbv核心抗原的第四重组核酸序列的第四表达载体转化。在本文公开的任一实施方案中,细胞另外被一种或多种另外的重组表达载体转化。
92.在本文公开的任一实施方案中,细胞源自昆虫或哺乳动物蛋白质表达宿主,例如hek
‑
293细胞或cho细胞。在本文公开的任一实施方案中,细胞源自大肠杆菌或真菌。
93.制备方法
94.另一方面,描述了一种制备hbv疫苗颗粒的方法,包括:
95.a)提供包含分别编码l、m和s表面蛋白的第一、第二和第三重组核酸序列的重组表达载体;并且其中第一、第二和第三重组核酸序列不具有内部顺式元件;
96.b)用重组表达载体转化细胞;和
97.c)培养和选择细胞以共表达l、m和s表面蛋白。
98.在本文公开的任一个实施方案中,l、m和s表面蛋白中的每一个在单独的表达载体中。
99.在本文公开的任一实施方案中,所述方法进一步包括选择细胞以表达l表面蛋白,其在l、m和s表面蛋白中的百分比为至少约1mol%、2mol%、3mol%、4mol%、5mol%、
6mol%、7mol%、8mol%、9mol%、10mol%、11mol%、12mol%、13mol%、14mol%、15mol%、16mol%、17mol%、18mol%、19mol%、20mol%、21mol%、22mol%、23mol%、24mol%、25mol%、26mol%、27mol%、28mol%、29mol%、30mol%、31mol%、32mol%、33mol%、34mol%、35mol%、36mol%、37mol%、38mol%、39mol%、40mol%、41mol%、42mol%、43mol%、44mol%、45mol%、46mol%、47mol%、48mol%、49mol%或50mol%,或在本文公开的任何两个值的范围内。
100.在本文公开的任一实施方案中,所述方法进一步包括选择细胞以表达l表面蛋白,其在l、m和s表面蛋白中的百分比为至少约15mol%、20mol%、25mol%、30mol%、40mol%、50mol%、60mol%、70mol%、80mol%、90mol%或100mol%。
101.在本文公开的任一实施方案中,所述重组表达载体还包含编码hbv核心抗原的第四重组核酸序列;以及步骤c)包括培养和选择细胞以共表达l、m和s表面蛋白和hbv核心抗原。
102.在本文公开的任一实施方案中,所述细胞源自昆虫或哺乳动物蛋白质表达宿主,例如hek
‑
293细胞或cho细胞。在本文公开的任一实施方案中,所述细胞源自大肠杆菌或真菌。
103.药物组合物
104.本发明还提供了一种药物组合物,其包含本文所述的hbv疫苗颗粒或hbv疫苗中的至少一种或其药学上可接受的盐或溶剂化物,以及药学上可接受的载体。
105.如本文所用的短语“佐剂”是指本领域已知的任何佐剂。
106.如本文所用的短语―药学上可接受的载体”是指药学上可接受的材料、组合物或媒介物,例如液体或固体填充剂、稀释剂、赋形剂、溶剂或包封材料,涉及将受试药剂从身体的一个器官或一部分携带或运输到身体的另一个器官或一部分。每种载体必须是“可接受的”,即与制剂的其他成分相容并且对患者没有伤害。一些可用作药学上可接受的载体的材料的实例包括:糖类,例如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,如羧甲基纤维素钠、乙基纤维素、醋酸纤维素;黄芪胶粉;麦芽;明胶;滑石粉;赋形剂,如可可脂和栓剂蜡;油类,如花生油、棉花籽油、红花油、芝麻油、橄榄油、玉米油和豆油;二醇类,例如丁二醇;多元醇,例如甘油、山梨糖醇、甘露糖醇和聚乙二醇;酯类,例如油酸乙酯和月桂酸乙酯;琼脂;缓冲剂,例如氢氧化镁和氢氧化铝;海藻酸;无热原水;等渗盐水;林格氏(ringer’s)液;乙醇;磷酸盐缓冲液;和其他用于药物制剂的无毒相容物质。
107.润湿剂、乳化剂和润滑剂,例如十二烷基硫酸钠、硬脂酸镁和聚环氧乙烷
‑
聚环氧丁烷共聚物,以及着色剂、脱模剂、涂层剂、甜味剂、调味剂和加香剂、防腐剂和抗氧化剂也可以存在于组合物中。
108.本发明的制剂包括那些适合于口服、鼻腔、局部(包括口腔和舌下)、直肠、阴道和/或肠胃外给药的制剂。所述制剂可以方便地以单位剂型存在并且可以通过药学领域中众所周知的任何方法来制备。可与载体材料组合以产生单一剂型的活性成分的量将根据被治疗的宿主和特定的给药方式而变化。可与载体材料组合以产生单一剂型的活性成分的量通常是产生治疗效果的hbv疫苗颗粒或hbv疫苗的量。通常,在100%的范围中,所述的量将在活性成分的约1%至约99%之间,优选约5%至约70%,最优选约10%至约30%。
109.制备这些制剂或组合物的方法包括将本发明的hbv疫苗颗粒或hbv疫苗与载体和
任选的一种或多种辅助成分结合的步骤。通常,通过将本发明的hbv疫苗颗粒或hbv疫苗与液体载体或精细分割的固体载体或两者均匀且紧密地结合来制备制剂,然后如果有必要,对产品进行成型加工。
110.本发明的适合口服给药的制剂可以是胶囊、扁囊剂、丸剂、片剂、锭剂(使用调味剂,通常是蔗糖和阿拉伯胶或黄芪胶)、粉剂、颗粒剂,或作为在水性或非水性液体中的溶液或悬浮液,或作为水包油或油包水液体乳液,或作为酏剂或糖浆,或作为糖果锭剂(使用惰性基质,例如明胶和甘油,或蔗糖和阿拉伯胶)和/或作为漱口水等,各自含有预定量的本发明的hbv疫苗颗粒或hbv疫苗作为活性成分。本发明的hbv疫苗颗粒或hbv疫苗也可以作为大丸剂、药糖剂或糊剂施用。
111.在本发明的口服给药的固体剂型(胶囊、片剂、丸剂、糖衣丸、粉剂、颗粒剂等)中,活性成分与一种或多种药学上可接受的载体混合,例如柠檬酸钠或磷酸二钙,和/或以下任何一项:填充剂或增量剂,例如淀粉、乳糖、蔗糖、葡萄糖、甘露醇和/或硅酸;粘合剂,例如,例如羧甲基纤维素、海藻酸盐、明胶、聚乙烯吡咯烷酮、蔗糖和/或阿拉伯胶;保湿剂,如甘油;崩解剂,例如琼脂、碳酸钙、马铃薯或木薯淀粉、海藻酸、某些硅酸盐、碳酸钠和羟基乙酸淀粉钠;溶解阻滞剂,例如石蜡;吸收促进剂,例如季铵化合物;润湿剂,例如,例如鲸蜡醇、单硬脂酸甘油酯和聚环氧乙烷
‑
聚环氧丁烷共聚物;吸收剂,如高岭土和膨润土;润滑剂,例如滑石粉、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠及其混合物;和着色剂。对于胶囊、片剂和丸剂,药物组合物还可包含缓冲剂。类似类型的固体组合物也可用作软和硬填充明胶胶囊的填充剂,使用赋形剂如乳糖或牛奶糖,以及高分子量聚乙二醇等。
112.片剂可通过任选地与一种或多种辅助成分压制或模制制成。压制片剂可以使用粘合剂(例如,明胶或羟丁基甲基纤维素)、润滑剂、惰性稀释剂、防腐剂、崩解剂(例如,羟基乙酸淀粉钠或交联羧甲基纤维素钠)、表面活性剂或分散剂来制备。模制片剂可以通过在合适的机器中将用惰性液体稀释剂润湿的粉状化合物的混合物进行模制来制备。
113.本发明药物组合物的片剂和其他固体剂型,如糖衣丸、胶囊、丸剂和颗粒剂,可以任选地被刻痕或制备有包衣和外壳,例如药物配制领域众所周知的肠溶衣和其他包衣。它们还可以被配制成提供其中活性成分的缓慢或受控释放,例如使用不同剂量的羟丁基甲基纤维素以提供所需的释放曲线、其他聚合物基质、脂质体和/或微球。它们可以通过,例如,通过保留细菌的过滤器过滤,或通过加入无菌固体组合物形式的灭菌剂进行灭菌,所述组合物可以在使用前立即溶解在无菌水或一些其他无菌可注射介质中。这些组合物还可以任选地包含遮光剂并且可以是这样的一种组合物,即它们只在或者优选地在胃肠道的特定部分中,任选地以延迟方式释放活性成分。实例是包埋组合物,其可以使用包括聚合物物质和蜡。如果合适的话,活性成分也可以是含有一种或多种上述赋形剂的微胶囊形式。
114.除惰性稀释剂外,口腔用组合物还可包括佐剂,例如润湿剂、乳化剂和悬浮剂、甜味剂、调味剂、着色剂、加香剂和防腐剂。
115.悬浮液可包含悬浮剂,例如乙氧基化异硬脂醇、聚氧乙烯山梨糖醇和脱水山梨糖醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂和黄芪胶,以及它们的混合物。
116.用于直肠或阴道给药的本发明的药物组合物的制剂可以作为栓剂存在,其可以通过将一种或多种本发明的hbv疫苗颗粒或hbv疫苗与一种或多种合适的非刺激性赋形剂或载体混合来制备,所述赋形剂或载体包括:例如,可可脂、聚乙二醇、栓剂蜡或水杨酸盐,所
述栓剂在室温下为固体,但在体温下为液体,因此将在直肠或阴道腔中融化并释放本发明的活性药剂。
117.适用于阴道给药的本发明的制剂还包括子宫托、棉塞、乳膏、凝胶、糊剂、泡沫或喷雾制剂,其含有本领域已知的载体如apbutriate。
118.粉剂和喷雾剂可含有赋形剂,例如乳糖、滑石粉、硅酸、氢氧化铝、硅酸钙和聚酰胺粉剂,或这些物质的混合物。喷雾剂可另外包含常规丁烷剂,例如氯氟烃和挥发性未取代烃,例如丁烷和异丁烷。
119.眼用制剂、眼膏、粉剂、溶液等也被认为在本发明的范围内。
120.适合肠胃外给药的本发明的药物组合物包含一种或多种本发明的hbv疫苗颗粒或hbv疫苗,其与以下组合:一种或多种药学上可接受的无菌等渗水性或非水性溶液、分散剂、悬浮液或乳液或可在使用前重新配制为无菌可注射溶液或分散剂的无菌粉末,所述组合物可能含有抗氧化剂、缓冲剂、抑菌剂、使制剂与预期接受者的血液等渗的溶质,或悬浮剂或增稠剂。
121.在某些情况下,为了延长药物的作用,需要减缓药物从皮下或肌肉内注射的吸收。这可以通过使用水溶性差的结晶或无定形材料的液体悬浮液来实现。药物的吸收速率取决于其溶解速率,而溶解速率又可能取决于晶体大小和晶型。或者,肠胃外给药的药物形式的延迟吸收是通过将药物溶解或悬浮在油性载体中来实现的。长效注射的一种策略包括使用聚环氧乙烷
‑
聚环氧丁烷共聚物,其中该载体在室温下为液体,在体温下固化。
122.可注射的长效形式是通过在可生物降解的聚合物如聚乳酸
‑
聚羟基乙酸中形成主题hbv疫苗颗粒或hbv疫苗的微囊基质来制备的。根据药物与聚合物的比例以及所用特定聚合物的性质,可以控制药物释放速率。其他生物可降解聚合物的例子包括聚(原酸酯)和聚(酸酐)。长效注射制剂也可通过将药物包裹在与身体组织相容的脂质体或微乳液中来制备。
123.当本发明的hbv疫苗颗粒或hbv疫苗作为药物对人和动物给药时,它们可以单独或作为含有以下物质的药物组合物给药,例如,与药学上可接受的载体组合的0.1%
‑
99.5%(更优选地,0.5%
‑
90%)的活性成分。
124.本发明的hbv疫苗颗粒或hbv疫苗和药物组合物可用于联合治疗,即,hbv疫苗颗粒或hbv疫苗和药物组合物可以与一种或多种其他的期望的治疗剂或医疗程序同时施用、在其之前或之后施用。在联合方案中采用的治疗方法(治疗剂或程序)的特定组合将考虑期望的治疗剂和/或程序的相容性以及要实现的期望的治疗效果。还应理解,所采用的疗法可实现对相同病症的期望效果(例如,本发明的hbv疫苗颗粒或hbv疫苗可与另一种抗hbv剂同时施用),或者它们可能会产生不同的效果(例如,控制任意副作用)。
125.本发明的hbv疫苗颗粒或hbv疫苗可以静脉内、肌肉内、腹膜内、皮下、局部、口服或通过其他可接受的方式施用。在一些具体实施方案中,本文公开的hbv疫苗颗粒或hbv疫苗通过鼻腔给药。
126.本发明还提供了一种药物包装或试剂盒,包括一个或多个装有本发明药物组合物的一种或多种成分的容器。任选地,与此类容器相关联的可以是由管理药品或生物产品的制造、使用或销售的政府机构规定的形式的通知,所述通知反映了所述机构批准制造、使用或销售以用于对人类施用。
127.等价物
128.下面的代表性实施例旨在帮助说明本发明,并不旨在也不应被解释为限制本发明的范围。实际上,从本文件的全部内容,包括以下实施例以及本文引用的科学和专利文献的参考文献,本文所示和描述的那些之外的本发明的各种修改及其许多其他的实施方案,对于本领域技术人员来说将变得显而易见。还应该理解,这些引用的参考文献的内容通过引用并入本文以帮助说明现有技术。以下实施例包含重要的附加信息、示例和指导,它们可适用于本发明的各种实施方案及其等价物的实践。
129.实施例
130.结果
131.为了表达hbsag颗粒,鉴定了乙型肝炎病毒分离株gz
‑
dyh(adw2亚型,基因型b2,genbank id dq448619)的基因表达。基于蛋白质序列,我们优化了哺乳动物蛋白质表达的编码dna序列。去除了驱动s和m蛋白表达的内部顺式元件。合成含有l、m和s蛋白开放性阅读框的dna片段,并将其亚克隆到不同的哺乳动物表达载体中。
132.l蛋白的野生型编码序列包含一个内部顺式元件,可响应内质网中l的积累;所述顺式元件参与l、m和s蛋白表达的严格调控。这种控制机制导致表面蛋白的差异表达,其中s是最丰富的,而m和l的表达水平要低得多,分别约为5
‑
15mol%和1
‑
2mol%。没有报道通过单独的表达载体分析l蛋白的表达率。单独表达l
‑
型导致分泌形式大于传统报道的42dka l蛋白(泳道2,图1)。为了促进l
‑
型蛋白的分泌,在l蛋白的n端添加了分泌信号,分泌型(泳道3,图1)显示出与天然蛋白相似的糖基化模式,表明单独的l蛋白在高尔基体中经历了复杂的糖基化。然而,单独表达的l在条件培养基中显示出很少的量并且在电子显微镜观察下不形成颗粒(未示出)。
133.发现l
‑
型的表达依赖于s
‑
型和m
‑
型的表达,或仅在s
‑
型或m
‑
型存在时才分泌l
‑
型。此外,l
‑
型的存在抑制了s
‑
型的表达(图2、3)。l
‑
型分泌对s
‑
型和m
‑
型的依赖性表明l组装成由s或m折叠驱动的结构,尽管确切机制尚不清楚。然而,该特征可用于识别积累s
‑
型和l
‑
型蛋白的表达克隆。
134.早期的策略是利用hbsag编码序列中的顺式元件来驱动s型和m型的表达,从而产生含有所有三种形式的hbsag颗粒。鉴于这些顺式元件的启动子强度是确定的,因此无法筛选出可能以不同比例表达l、m和s形式的克隆。研究发现,通过使用组合表达载体产生的hbv颗粒具有可变的l、m和s组成,从而为选择可以以不同比例稳定表达l
‑
型hbv颗粒的克隆提供了可能性。
135.对源自293f的数百个阳性表达hbv颗粒的克隆进行了筛选。阳性克隆是根据识别s中三维表位的抗体选择的。这些克隆中的大多数仅表达s蛋白。使用抗l
‑
型抗体,然后使用抗s抗体,通过蛋白质印迹法筛选单个克隆。克隆16和克隆51显示出大约26kda的s
‑
型表达,以及包含pres2抗体表位的其他蛋白质,范围为30
‑
38kda和51
‑
60kda(图4a)。糖基化的异质性表明含有pres2表位的蛋白质在高尔基体中经历了复杂的糖基化。除了抗pres2抗体识别的42kda和39kda蛋白质外,克隆12和克隆a4还包含26kda和22kda的s
‑
型蛋白质的强信号(图5)。同样的表达策略也适用于使用cho表达宿主。同样地,源自cho细胞的克隆7c8、10e3表达了26kda和22kda s蛋白(图4b,右图),以及被抗pres2抗体识别的42kda和39kda蛋白(图4b,左图)。在cho表达系统中,上面的42kda的l蛋白也被抗s多克隆抗体识别。在这两种
表达系统中,对应于l
‑
型的42kda和39kda蛋白条带显示出明显的、更清晰的条带,表明这些蛋白在高尔基体中没有经历复杂的糖基化。另一个克隆43也显示检测到42kda和39kda蛋白条带,与克隆a4相似(图6)。总而言之,克隆16和克隆51可能代表在质膜上形成颗粒,而克隆12和a4 hbsag颗粒的分泌显示出一种独特的机制,涉及从内质网出芽(patient,r.,hourioux,c.,sizaret,p.y.,trassard,s.,sureau,c.and roingeard,p.,2007.hepatitis b virus subviral envelope particle morphogenesis and intracellular trafficking.journal of virology,81(8),pp.3842
‑
3851)。克隆16和51都含有大量30
‑
38kda的蛋白质,所述蛋白质被识别为抗pres1抗体(图4a),表明l
‑
型蛋白质可能大量存在。纯化的克隆51颗粒含有更多的30
‑
38kda蛋白质(图7)。
136.总之,在293f和cho表达系统中的组合表达策略产生了以前没有表征过的hbsag颗粒,可用于生产具有所需l、m和s比率的hbsag颗粒。选择l和s表达量显著的克隆进行扩增和进一步表征。
137.克隆16、51、a4,生产规模扩大、纯化和蛋白质表征
138.稳定的细胞系16、51和a4表达s型蛋白,此外还表达了由pres2特异性抗体s26检测到的l型蛋白。细胞在293freestyle表达培养基(thermo fisher)中摇瓶培养生长。在生长72或96小时后,收集条件培养基并通过离心和过滤去除细胞碎片。病毒样颗粒使用sephacryl 400树脂通过两次连续的尺寸排阻色谱,或用羟基磷灰石吸附和之后的尺寸排阻色谱的组合进行纯化。
139.克隆a4纯化的蛋白质颗粒分别含有38kda和42kda的两种l蛋白(图8、9)。经png酶处理后,42kda的蛋白降低到38kda(图11),证实42kda是38kda的糖基化形式。l蛋白的身份通过专门针对pres1抗体ap1产生的抗体(图10)以及肽质谱法(表1)进行了验证。此外,表达了两种s蛋白,由27和24kda蛋白表示(图10)。两种s蛋白均通过n端测序(未示出)和肽质谱法(表1)进行了验证。与克隆51不同,a4 l蛋白在sds page中迁移为不同的条带,表明蛋白质糖基化在高尔基体中没有进一步修饰,并模拟了发生在内质网中的体内颗粒组装。
140.克隆51纯化的蛋白颗粒包含介于28kda和38kda分子量标记之间的l和m蛋白。通过pres1特异性抗体ap1检测该范围内的蛋白质(图10)表明该范围内的蛋白质混合物中至少有一部分是l蛋白,尽管其分子量比预期的要小。经png酶处理后,l/m蛋白混合物被降低为28kda分子量标记处的离散条带。此外,通过质谱法进行的肽图分析表明,该范围内的部分蛋白质混合物包含pres2序列(表1)。从克隆16和克隆51中纯化的蛋白质形成了颗粒(图12、13),然而,需要更详细的分析来分辨颗粒的l和m蛋白。
141.克隆a4和51均含有27kda和24kda的s蛋白(图10)。png酶处理将27kda s蛋白带降低到24kda,证实27kda是24kda s蛋白的糖基化形式(图11)。
142.正如sds page和考马斯亮蓝染色所示(图10),a4和51的纯化hbsag颗粒中的l蛋白高于总蛋白的10%。
143.表1.肽的质谱确认(列出了通过质量比较确定的肽)。
[0144][0145][0146]
克隆16和51产生的蛋白质的免疫
[0147]
分别使用源自克隆16和克隆51的纯化lms病毒样颗粒对两只小鼠进行免疫接种。使用源自酵母的hbsag注射到两只小鼠中作为参考。在所有实验中,使用小鼠品系balb c。14天后对所有小鼠进行强化注射。初次免疫35天后,从小鼠身上抽取血液,通过连续稀释确定针对病毒样颗粒的抗体反应滴度(图14)。与背景相比出现明显反应的最终稀释度被确定为滴度。酵母来源的hbsag的抗体滴度为2e6,lms hbsag的抗体滴度为8e6(图14、15)。总之,使用克隆16和克隆51hbsag颗粒的免疫接种产生的抗体滴度比使用基于酵母的抗原获得的抗体滴度高约四倍(图15)。为了表征针对hbsag蛋白的免疫反应,使用了纯化的hbsag蛋白、酵母来源的s抗原和大肠杆菌来源的pres1、pres2肽序列。将这些抗原包被到聚苯乙烯96孔微量滴定板上,并温育连续稀释的血清,然后检测结合的小鼠igg1抗体。最强的免疫反应是针对s抗原,其次是pres2和pres1抗原(图16)。
[0148]
为了了解哪个表位负责引发小鼠的免疫反应,使用来自免疫小鼠的脾细胞生成杂交瘤。总共发现102个杂交瘤与纯化的hbsag颗粒发生反应(图17)。使用各种抗原对杂交瘤进行分类,我们发现来自35个杂交瘤的抗体对s抗原反应,26个和10个杂交瘤分别对pres2和pres1肽反应(图17)。此外,31个杂交瘤对纯化的hbsag颗粒有反应,但对s或源自pres1和pres2序列的线性肽抗原没有反应,这表明这些抗体可能识别纯化hbsag抗原的pres区域中存在的非线性表位。然而,用于分析血清中抗体滴度的pres2和pres1肽抗原缺乏二级或三
级结构,并且无法描绘针对pres区域三维表位的反应。
[0149]
材料与方法
[0150]
克隆和细胞系的选择
[0151]
hbv表面抗原的编码序列基于乙型肝炎病毒分离株gz
‑
dyh(genbank登录号dq448619,血清型adw2)。对于蛋白质表达,开放性阅读框针对哺乳动物表达系统进行了密码子优化。内部顺式元件,例如m和s形式转录起始的启动子,被沉默取代废除。在genewiz(south plainfield,nj)分别合成编码l、m和s形式的基因,并将dna片段分别亚克隆到表达载体中。将表达质粒构建体转染到先前适应无血清生长的hek293细胞中。使用流式细胞仪通过在96孔培养板中进行单细胞克隆来选择稳定表达的细胞系。大约10%的单细胞产生细胞系并产生表达克隆。基于elisa筛选选择表达克隆,然后使用针对pres2(novusbio,littleton,co)、pres1(prospecbio,east brunswick,nj)和hbsag s蛋白(creative diagnostics,shirley,ny)的抗体进行蛋白质印迹分析。
[0152]
freestyletm293表达培养基(thermo fisher scientific,waltham,ma)用于所有细胞系克隆和放大程序。使用抗pres2单克隆抗体s26、抗pres1单克隆抗体ap1、ap2(santa cruz biotechnology,dallas,tx)和兔抗hbsag s多克隆抗体(fitzgerald industries international,acton,ma)对重组hbv表面抗原进行蛋白质印迹分析。hbsag elisa试剂盒购自creative diagnostics(shirley,ny)。
[0153]
hbsag颗粒的生产
[0154]
摇瓶培养物用于hbsag颗粒的小规模生产。收获稳定转染细胞系的条件培养基,通过切向流过滤和浓缩、羟基磷灰石吸附尺寸排阻色谱和阴离子交换色谱的组合纯化hbv病毒样颗粒。使用电子扫描显微镜将纯化颗粒的形态可视化。纯化的hbsag颗粒的蛋白质组成通过银染法和蛋白质印迹法或考马斯亮蓝染色然后进行胰蛋白酶消化和肽质谱进行分析。通过bca法测定蛋白质浓度。
[0155]
根据制造商的说明书(new england biolab,ipswich,ma),通过png酶处理对hbv表面抗原进行去糖基化。
[0156]
对于n端测序,蛋白质通过sds page分离并通过蛋白质印迹程序转移到pvdf膜上。pvdf膜用考马斯亮蓝染色,切出蛋白质条带并进行edman降解,然后进行hplc分析。
[0157]
使用vydac 214tp c4柱(10μm,4.6x 150mm)进行反相hplc。流动相是流速为1ml/min的20%
‑
80%梯度的乙腈/水。
[0158]
通过质谱进行肽图分析
[0159]
纯化的蛋白质通过sds page分离,然后用考马斯亮蓝染色。蛋白质条带被切下,使用切下的凝胶进行凝胶内胰蛋白酶消化,然后进行lc
‑
ms分析。将肽的质量与数据库中已知的肽序列进行比较,并通过质量比较确认识别。由质谱确认的肽列于表1。
[0160]
小鼠的免疫和抗体反应的测定
[0161]
balb c品系小鼠购自charles river laboratories。小鼠分成每组两只。在与铝佐剂混合后注射10μg酵母来源的hbsag,或10μg来自克隆#16或#51的纯化蛋白质,然后在14天后强化注射。初次免疫35天后,从小鼠身上抽取血液,通过连续稀释确定针对病毒样颗粒的抗体反应滴度(图16)。通过使用酵母来源的s抗原、pres1肽、pres2肽或包被到hi
‑
binding 96孔检测板上的纯化lms hbsag来测定抗体滴度。student t
‑
检验用于确定抗体
滴度的显著性。
[0162]
杂交瘤和表位鉴定
[0163]
在最终注射后一天,取出免疫小鼠的脾脏。根据标准程序分离脾细胞并与小鼠骨髓瘤细胞融合。测试杂交瘤克隆对含有pres区域的纯化hbsag颗粒的反应性(图17)。为了确定表位的区域,将基于酵母的hbsag s、pres1肽和pres2肽包被到聚苯乙烯96孔微量滴定板上。将杂交瘤的条件培养基与结合的抗原一起温育,然后进行抗小鼠igg检测。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1