人工心脏瓣膜组件的制作方法
1.本发明涉及一种医疗器械,更具体地,本发明涉及一种人工心脏瓣膜组件。
背景技术:
2.多年来,人工心脏瓣膜已被用于治疗心脏瓣膜疾病。在主动脉瓣狭窄(一种心脏瓣膜疾病)的自然病程中,可能会出现不同程度的心脏阻塞。心脏阻塞可能是由于自体心脏瓣膜附近例如自体心脏瓣膜的瓣环处的钙沉积所导致的。所述钙沉积物可以从左心室流出道(lvot)逐渐扩展到患者的动脉
‑
心室传导系统(arterio
‑
ventricular conduction system)。为了克服上述情况,人工心脏瓣膜以塌缩状态(crimped condition)在目标位置(即患者的病变的心脏瓣膜)处部署在患者内腔内。传统人工心脏瓣膜会阻塞左心室流出道(lvot)并且无法准确地贴合在目标位置。此外,在传统人工心脏瓣膜的径向塌缩和径向膨胀过程中,会出现径向力的不均匀分布,这可能导致所述瓣膜的不均匀膨胀。
3.所述传统的瓣膜具有较大的直径,并且因此在目标位置会发生所述瓣膜的不均匀膨胀。传统人工心脏瓣膜的尺寸可能与自体病变瓣膜的尺寸不同,从而影响室间隔附近的壁和/或自体瓣膜附近的乳头肌。由于这些区域的肌肉挤压或收缩,在上述情况下会产生应力。所述传统的瓣膜可能在部署过程中影响病变的心脏瓣膜的附近位置,即左心室流出道(lvot)和冠状动脉口。所述传统的瓣膜在部署过程中激发患者的心脏传导系统并诱发新的左束支传导阻滞(lbbb)。由于传统人工心脏瓣膜的上述缺点,有时在部署过程之后,使用诸如起搏器(临时/永久型)的外部辅助装置来起搏心脏并保持其节律状态。
4.近来,经导管主动脉瓣植入(tavi)或置换(tavr)手术被用于为患有重度主动脉瓣狭窄的中危患者植入人工心脏瓣膜。实施tavi手术以在输送导管的帮助下植入人工心脏瓣膜,该输送导管可以包括球囊、一个或多个止动件等。在tavi手术中,瓣膜安装在位于导管上的球囊上并处于塌缩位置。球囊从股动脉部署到患者的目标位置。安装在球囊上的瓣膜通过在球囊内部提供膨胀流体并且在目标位置扩张所述瓣膜进而被膨胀。
5.然而,在传统的输送导管中,人工心脏瓣膜的精确定位以及该瓣膜的贴合面临很大的挑战。上述情况可能会导致部署过程中和部署后的严重的并发症。严重的并发症可能包括瓣膜栓塞和冠状动脉闭塞。此外,传统的输送导管的设计和尺寸无法在部署过程中保持人工心脏瓣膜的设计完整性和一致性。上述偏差可能是由多种原因造成的,例如由于受到动脉状况、动脉尺寸、动脉闭塞所限引起的推动阻力;或者人工心脏瓣膜膨胀过程中流体不均匀可能会导致传导障碍进而导致lbb,这会增加在部署过程后需要使用临时或永久起搏器设备的几率。传统的输送导管可能无法均匀地使人工心脏瓣膜膨胀,并且可能无法保持输送导管的外部轮廓尺寸小。此外,在将人工心脏瓣膜部署到目标位置之前,所述传统导管可能无法保持人工心脏瓣膜在塌缩阶段的线性度和重心位置。
6.例如,专利ep2736457b1和us9119716公开了包括一个或多个槽的一个或多个止动件。塌缩的人工心脏瓣膜由于这些槽失去其精确定位,从而影响其线性度并因此影响其重心位置。在部署过程中施加会影响人工心脏瓣膜的柔性的较大推力时,重心位置也会受到
影响。此外,在现有技术中,内轴/内管穿过所述止动件。当止动件塌缩时,槽也被塌缩,从而内轴和止动件的槽之间的间隙变得不均匀。上述情况导致流体的不均匀流动,从而改变其流体动力学的均匀性。因此,常规的止动件使得导管不均匀膨胀,这导致目标位置附近的阻塞。
7.因此,需要设计能够克服传统系统的缺陷的包括人工心脏瓣膜的输送导管。
技术实现要素:
8.人工心脏瓣膜组件包括安装在球囊上的人工心脏瓣膜。人工心脏瓣膜部署在目标位置,即病变的自体瓣膜内。在实施例中,人工心脏瓣膜的尺寸模拟自体心脏瓣膜的解剖结构。
9.输送导管用于部署人工心脏瓣膜。输送导管包括外轴。外轴还包括外轴第一端、外轴第二端和内腔。
10.在实施例中,外轴第一端的直径大于外轴第二端的直径。外轴包括一个或多个层,即内层、中层和外层。
11.内轴设置在外轴的内腔中。内轴包括内轴第一端和内轴第二端。内轴包括一个或多个层,即第一层、中间层和第二层。
12.支撑管设置在内轴的内轴第二端上。支撑管包括一个或多个用于使膨胀流体通过的孔。球囊设置在支撑管的外表面上。
13.在输送导管的端部提供手柄。一个或多个止动件设置在支撑管上和球囊内。一个或多个止动件包括第一部分和第二部分。
附图说明
14.结合附图可以更好地理解上述发明内容以及以下具体实施方式。为了说明本公开,附图中示出了本公开的示例性构造。然而,本公开并不限于本文所公开的特定的方法和手段。此外,本领域技术人员应理解附图不是按比例绘制的。
15.图1示出了根据本发明的实施例的人工心脏瓣膜。
16.图1a示出了根据本发明实施例的输送导管。
17.图1b示出了根据本发明的实施例的输送导管的外轴。
18.图1c示出了根据本发明的实施例的输送导管的内轴。
19.图1d
‑
图1e中示出了根据本发明的实施例的内轴的一个或多个层。
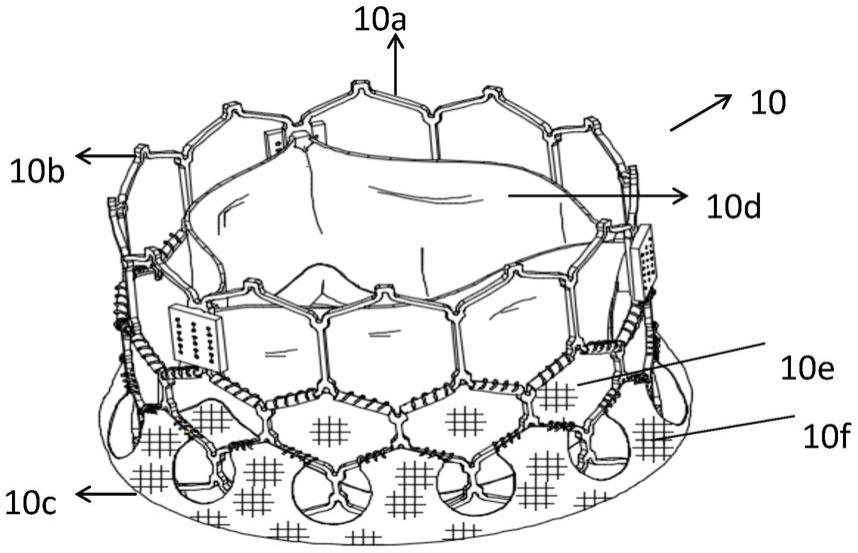
20.图1f示出了根据本发明的实施例的输送导管的部件的放大视图。
21.图1g和图1h示出了根据本发明的实施例的球囊和一个或多个止动件的透视图。
22.图1i
‑
图1k示出了根据本发明实施例的一个或多个止动件的不同的实施方式。
23.图2图示了根据本发明的实施例的人工心脏瓣膜的部署过程的流程图。
具体实施方式
24.在详细描述本发明之前,在此限定本专利文件全文中使用的某些词或短语的定义:术语“包括”和“包含”,以及它们的衍生词,表示包括但不限于;术语“或”是包含性的,表示和/或;短语“与
…
偶联”和“与
…
关联”及其衍生词可以表示包括、被包括在
…
内、与
…
互
连、包含、被包含在
…
内、连接到或与
…
连接、偶联到或与
…
偶联、与
…
连通、与
…
配合、交替、并置、与
…
接近、连接至或与
…
连接、具有...的性质等。在本专利文件全文中提供了某些词和短语的定义,并且本领域的普通技术人员应理解,在很多情况下(如果不是最多的情况),这类定义适用于先前和未来使用的如此定义的词和短语。
25.下面参照附图描述本公开的具体的实施例,然而,应当理解的是所公开的实施例仅是本公开的示例,其可以以各种形式体现。此处不再详细描述众所周知的功能或构造,以避免由于不必要的细节而掩盖了本公开的内容。因此,此处公开的具体结构和功能的细节不应被解释为限制性的,而是仅作为权利要求的基础以及作为代表性基础用于教导本领域技术人员在实际上任何适当的具体结构中以各种方式应用本公开。
26.应注意的是,在本公开中,术语“瓣膜”、“心脏瓣膜”、“人工心脏瓣膜”和“人工瓣膜”可互换使用以指代人工心脏瓣膜,因此,所有上述短语都应有相同的解释。
27.根据本公开,公开了一种人工心脏瓣膜以及输送导管(统称为“人工心脏瓣膜组件”)。本发明的人工心脏瓣膜在输送导管的帮助下在目标位置(例如在病变的自体瓣膜内)部署。本发明的人工心脏瓣膜的尺寸(即,包括预设的高度、直径和表面积)调节为使其模拟自体心脏瓣膜的自体解剖结构。因此,该人工心脏瓣膜不会破坏心脏的自体解剖结构和功能,这使得在手术后不需要外部辅助装置例如起搏器来维持患者体内的血液循环。在实施例中,本发明的人工心脏瓣膜不会破坏位于人体心脏中的左心室流出道(lvot)。所述人工心脏瓣膜确保靠近自体心脏瓣膜的所有小间隙都被完全覆盖,这进一步有助于防止瓣周漏。
28.本发明的输送导管使得人工心脏瓣膜部署容易且准确。本发明的输送导管可以包括一个或多个部件。该一个或多个部件可以包括球囊、外轴、内轴、支撑管、一个或多个止动件等(以下详述)。在将所述瓣膜从患者的股动脉切入点递送到目标位置的过程中,设置在输送导管中的一个或多个止动件确保了人工心脏瓣膜的准确定位。本发明的一个或多个止动件可以具有用于空气移动和/或流体均匀进入球囊腔内的至少一个孔。
29.本发明的输送导管和人工心脏瓣膜不会影响、挤压和/或妨碍目标位置附近的肌肉和左心室流出道(lvot)。此外,本发明的输送导管和人工心脏瓣膜并不阻塞冠状动脉口,因此不需要外部的临时/永久性起搏装置(起搏器)。
30.以下具体参考附图,图1示出了本发明的人工心脏瓣膜10。人工心脏瓣膜10部署在病变的自体瓣膜内,即部署在目标位置。人工心脏瓣膜10可以是球囊膨胀瓣膜,即通过将所述瓣膜置于球囊上而使得人工心脏瓣膜10可被膨胀。在实施例中,人工心脏瓣膜10以塌缩状态部署至目标位置。在植入目标位置之前,人工心脏瓣膜10可以被塌缩设置在输送导管上的球囊上。人工心脏瓣膜10的塌缩轮廓尺寸可以在6.8
‑
8.0mm的范围内,更优选地在7.0
‑
7.6mm的范围内。在实施例中,人工心脏瓣膜10的塌缩轮廓尺寸是7.3mm。
31.人工心脏瓣膜10可以以预设的尺寸形成。人工心脏瓣膜10的预设尺寸可以包括但不限于表面积、直径和高度。在实施例中,人工心脏瓣膜10的预设尺寸选自逐渐增加的大小。由于人工心脏瓣膜10的尺寸(表面积、直径和高度)的上述逐渐增加的大小,所述瓣膜10可以有效地植入具有260mm2至850mm2范围的尺寸的瓣环的自体心脏瓣膜中。
32.人工心脏瓣膜10的表面积逐渐增加的大小可以为280mm2‑
900mm2。人工心脏瓣膜10的表面积的逐渐增加的幅度范围为30mm2到90mm2。
33.人工心脏瓣膜10的直径的逐渐增加的大小可以为18mm至33.5mm。人工心脏瓣膜10的直径的逐渐增加的幅度范围为1mm
‑
2mm。
34.人工心脏瓣膜10的高度的逐渐增加的大小可以为14mm至28mm,更优选为17
‑
25mm。人工心脏瓣膜10的高度的逐渐增加的幅度范围为0.2mm
‑
1mm。
35.人工心脏瓣膜10的逐渐增加的尺寸大小的选择使得人工心脏瓣膜10模拟病变的自体瓣膜的自体解剖结构。在所述瓣膜10的部署期间,从逐渐增加的尺寸大小中所选择的合适大小的人工心脏瓣膜10不会影响室间隔附近的壁和/或自体瓣膜附近的乳头肌。从逐渐增加的尺寸大小中选择的合适大小的人工心脏瓣膜10不会因为室间隔区域的肌肉和/或自体心脏瓣膜的附近区域的乳头肌受压或收缩而产生任何应力。
36.本发明的人工心脏瓣膜10在部署过程中并不影响患病自体心脏瓣膜的位置,并且不阻塞患者的左心室流出道(lvot)和冠状动脉口。人工心脏瓣膜10的逐渐增加的可选择尺寸大小确保在部署过程中瓣膜不会激发患者的心脏传导系统并且不会诱发新的左束支传导阻滞(lbbb)。因此,人工心脏瓣膜10消除了在其植入后需要使用临时起搏器和/或永久起搏器(ppm)的可能性。在实施例中,部署人工心脏瓣膜10之后的临床结果表明,本发明的人工心脏瓣膜10植入后需要临时/永久性起搏装置(起搏器)的可能性低于2%,相比之下,在传统的经导管主动脉瓣膜植入系统中,植入后需要临时/永久性起搏器(起搏器)的可能性为12%至15%。
37.下面提供了示例人工心脏瓣膜10的逐渐增加的可选择尺寸大小的表格:表1序号瓣膜面积(mm2)瓣膜直径(mm)瓣膜高度(mm)13142017.35236321.517.6034152317.85447124.518.3555312618.85659427.519.6076612920.35873130.521.1598043222.01088133.522.8
38.人工心脏瓣膜10可以包括但不限于框架10a、流出端10b、流入端10c、至少一个瓣叶10d、内裙10e和外裙10f。
39.以下示出的实施例展示了使用模拟自体心脏瓣膜的人工心脏瓣膜10的优点。实施例1:患者的主动脉瓣环的面积为545mm2,需要植入经导管主动脉瓣。根据可用的人工心脏瓣膜的常规尺寸,医生选择的心脏瓣膜的表面积为649mm2或660mm2(参考:eur heart j cardiovasc imaging.2016sep;17(9):1054
‑
1062),直径为28mm和框架高度为20.35mm。然而,按照本发明的人工心脏瓣膜10的尺寸参数,医生可以选择更接近的可用的面积为594mm2的人工瓣膜。
40.传统人工心脏瓣膜占据的多余面积为104mm2至110mm2(高出所需面积19.08%至20.18%)。与传统人工心脏瓣膜所占据的更大的多余面积相反,本发明的人工心脏瓣膜10仅超出了所需面积8.80%。因此,传统的瓣膜很可能会阻碍患者整个的自体心脏血液循环。因此,室间隔附近的壁和/或病变的自体心脏瓣膜附近的乳头肌会受到干扰,从而影响心电脉冲。
41.传统瓣膜可能由于血流的阻塞而引起若干其他问题,这可能会影响相邻瓣膜例如二尖瓣的功能。此外,由于目标位置的过多区域被覆盖,需要植入永久和/或临时起搏器以调节人工心脏瓣膜的正常功能的几率增加。通过植入模拟自体心脏瓣膜的自体解剖结构的本发明的人工心脏瓣膜10,使得上述问题被最小化。因此,消除了植入永久和/或临时起搏器的需要,进而解决了上述问题。
42.图1a示出了本发明的输送导管100。输送导管100用于在病变的自体瓣膜内即目标位置部署人工心脏瓣膜(例如,人工心脏瓣膜10)。输送导管100使得在目标位置能够容易和准确地部署人工心脏瓣膜10。输送导管100的长度可以为1300
‑
1700mm的范围,更优选为1450
‑
1550mm的范围。在实施例中,输送导管100的长度是1500mm。
43.输送导管100的工作长度或可用长度可以在1000
‑
1400mm的范围内,更优选地在1150
‑
1250mm的范围内。在实施例中,输送导管100的工作长度或可用长度是1200mm。
44.输送导管100包括初级端(在图1a中标记为a)和次级端(在图1a中标记为b)。输送导管100还包括一个或多个组件。一个或多个组件可包括但不限于外轴/外腔/外鞘1、内轴或内腔3、球囊5、支撑管7、一个或多个止动件9、手柄11和软尖端13。
45.外轴1用作输送导管100的顶层。外轴1可以包括外轴第一端1a、外轴第二端1b、牵拉线1c(如图1b所示)和毂(hub)1d(如图1a所示)。在实施例中,外轴第一端1a设置在输送导管100的球囊5的近端附近,而外轴第二端1b设置在毂11附近。外轴1的总长度可以为1100
‑
1600mm,更优选1300
‑
1400mm的范围。在实施例中,外轴1的外轴第一端1a的直径可以不同于外轴第二端1b的直径。
46.外轴1的外轴第一端1a具有的外径可以为2.5
‑
6.5mm、更优选4.0
‑
5.0mm的范围,以及内径为0.5
‑
4.5mm、更优选为2.0
‑
3.0mm的范围。外轴1的外轴第二端1b具有的外径可以为1.5
‑
5.5mm,更优选地在3.0
‑
4.0mm的范围,以及内径为0.5
‑
4.5mm、更优选为2.0
‑
3.0mm的范围。
47.在实施例中,毂1d用于使膨胀流体通过以使球囊5膨胀。
48.外轴1可以为包括内腔(未示出)的中空管的形式。在实施例中,外轴1作为具有拉放线机构的可转向机构,该拉放线机构通过牵拉线1c(在图2示出)执行。所述可转向机构在人工心脏瓣膜10行进/植入至目标位置的期间提供合适的屈曲。
49.外轴1可以是单层轴或多层轴。在实施例中,外轴1为多层轴。外轴1可以包括但不限于内层、中层和外层(未示出)。外轴1的内层可以由以下材料制成:聚四氟乙烯(ptfe)、尼龙或任何其他聚合物,但不限于此。
50.外轴1的内层可以被中间层覆盖。在实施例中,外轴1的中层编织在内层上,以便在部署过程中在不同位置提供柔性。外轴1的中层可以使用但不限于不锈钢、镍钛诺或钴铬的扁线或圆线来编织。编织过程使用多根金属线进行。金属线可以是4根至32根线,更优选8根线至24根线的范围内。
51.在实施例中,外轴1的外轴第一端1a使用前述线中的任一种进行编织。外轴1的外轴第一端1a的长度可以为950
‑
1300mm的范围,更优选1100
‑
1150mm的范围。编织在外轴1的外轴第一端1a处进行,以便为外轴1提供足够的强度、柔性和抗扭结特性。此外,不同级别的聚合物在外轴1中的特定位置焊接在一起以便于使外轴1转向。
52.在实施例中,外轴1的外轴第二端1b并未被编织。外轴1的外轴第二端lb的长度可以为5
‑
200mm的范围,更优选50
‑
120mm的范围。
53.在实施例中,在可转向机构中使用的牵拉线1c使用外轴1的中层所使用的多根金属线编织。牵拉线1c可以是单丝线(monofilament wire)或复丝线(multifilament wire)。在实施例中,牵拉线1c是单丝线。牵拉线1c还可以包括拉环(未示出),其有助于向外轴1提供可转向机构。与拉环连接的牵拉线1c设置在外轴1的外轴第一端1a上。牵拉线1c的长度可以为1000
‑
1600mm的范围,更优选1200
‑
1400mm的范围。
54.外轴1的中层可以进一步被外轴1的外层覆盖以便在部署过程中保持外轴1在不同位置处的柔性。外轴1的外层可以由以下多种高分子材料制成:尼龙、聚四氟乙烯(ptfe)、改性尼龙(pebax)、聚酰胺、聚醚醚酮(peek)、硅胶以及其它衍生物等,但不限于此。在实施例中,外轴1由改性尼龙(pebax)和聚酰胺树脂制成。用于形成外轴1的改性尼龙(pebax)的产品级别包括改性尼龙(pebax)2533、改性尼龙(pebax)3533、改性尼龙(pebax)4033、改性尼龙(pebax)5533、改性尼龙(pebax)6333、改性尼龙(pebax)7033、改性尼龙(pebax)7233和改性尼龙(pebax)7433。外轴1由改性尼龙(pebax)制成,因为该材料具有生物相容性。改性尼龙(pebax)具有高效的机械性能,例如重量轻、柔性高、物理性能优异和耐化学性。也可以使用具有类似特性的其他材料来形成外轴1的外层。
55.内轴3设置在外轴1的内腔内(如图1c所示)。内轴3可以包括内轴第一端3a和内轴第二端3b。在实施例中,内轴第一端3a设置在输送导管100的初级端a附近,并且内轴第二端3b设置在输送导管100的次级端b附近。内轴3在外轴1的内腔中设置为从输送导管的第一端a延伸至外轴1的外轴第二端1b。内轴3从外轴1的外轴第一端1a穿过支撑管7的内腔进入球囊5内部,并延伸到输送导管100的第二端b,在该第二端b处设置了内轴3的内轴第二端3b。内轴3还包括内腔(未示出)。内轴3的所述内腔用作导丝的通道。导丝可以是本领域已知的任何导丝。
56.内轴3可以是单层轴或多层轴。在实施例中,内轴3为多层轴。内轴3可包括但不限于第一层、中间层和第二层(如图1d中所示)。内轴3的第一层作为内轴3的基础层(base layer)。内轴3的第一层可以由以下材料制成:尼龙、ptfe、改性尼龙(pebax)、聚酰亚胺、peek、硅胶等,但不限于此。在实施例中,内轴3的第一层由聚酰亚胺制成,该聚酰亚胺提供光滑的表面以减少导丝运动时的摩擦。
57.内轴3的第一层被中间层覆盖。在实施例中,内轴3的中间层具有编织构造(如图1e所示)。中间层可以使用圆形或扁平的金属线编织。圆形或扁平的金属线可以由以下材料制成:镍钛诺、钴铬或不锈钢(ss)材料,但不限于此。在实施例中,编织是用不锈钢丝完成的。编织可以在编织角为60
°
至120
°
、更优选80
°
至100
°
的条件下进行。
58.内轴3的中间层被第二层覆盖。在实施例中,内轴3的第二层可以作为内轴3的覆盖层。内轴3的第二层可以由以下材料制成:尼龙、聚四氟乙烯(ptfe)、聚酰亚胺、改性尼龙(pebax)、聚醚醚酮(peek)、硅树脂和其他衍生物,但不限于此。在实施例中,内轴3的第二层
由聚酰亚胺制成,该聚酰亚胺为内轴3的第一层提供柔性。
59.内轴3的长度可以为1200
‑
1800mm,更优选1400
‑
1600mm的范围。内轴3具有的外径可以为0.1
‑
2.5mm、更优选1.0
‑
1.5mm的范围,以及内径为0.1
‑
2.0mm、更优选在0.6
‑
1.2mm的范围。
60.球囊5朝向输送导管100的次级端b设置。球囊5包括近端5a、远端5b和中间部分5c(如图1f所示)。在实施例中,球囊5的近端5a与外轴1的外轴第二端1b连接,球囊5的远端5b与软尖端13连接。球囊5可以是单层构件或多层构件。在实施例中,球囊5是单层构件。在实施例中,球囊5的中间部分5c为中空的圆柱形。球囊5的近端5a和远端5b呈圆锥形。
61.球囊5可以由包括但不限于以下各项的多种聚合材料制成:尼龙、改性尼龙(pebax)、聚对苯二甲酸乙二醇酯(pet)、聚酰胺、聚氨酯、聚氯乙烯、聚乙烯等。在实施例中,球囊5是由聚酰胺树脂制成,但不限于此。
62.球囊5可用于使人工心脏瓣膜10膨胀。在实施例中,人工心脏瓣膜10被置于球囊5之上。因此,当球囊5膨胀时,人工心脏瓣膜10也膨胀。在实施例中,球囊5连同人工心脏瓣膜10以塌缩状态部署,并且一旦球囊5和人工心脏瓣膜10到达目标位置就对其进行膨胀。在实施例中,一旦球囊5和人工心脏瓣膜10在目标位置完全膨胀,球囊5就被从目标位置撤回。球囊5连同人工心脏瓣膜10的膨胀是在膨胀流体作用下进行。膨胀流体可以包括但不限于生理盐水溶液。在实施例中,填充球囊5所需的膨胀流体的量取决于球囊5的直径。填充于球囊5内的膨胀流体的体积可以为5至100ml,更优选15至60ml的范围。
63.球囊5的近端和远端(5a和5b)可包括内腔,该内腔包括支撑管7(如下所述)。
64.在实施例中,球囊5包括至少两个标记物(未示出)。该至少两个标记物可以由不透射线的材料制成。该至少两个标记有助于在部署过程期间在患者的主动脉孔腔(aortic orifice lumen)内对人工心脏瓣膜10进行定位。该至少两个标记物设置在球囊5的工作长度内(即,在球囊5这一部件之内)。球囊5的工作长度可以为15
‑
45mm,更优选25
‑
45mm的范围。在实施例中,球囊5的工作长度为35mm。
65.球囊5的外径范围为16
‑
36mm,更优选为20
‑
32mm。在实施例中,球囊5的外径取决于人工心脏瓣膜10的直径,以便为人工心脏瓣膜10提供均匀膨胀。
66.支撑管7设置在球囊5的内腔内部(如图1f所示),并且设置在内轴3的内轴第二端3b上。支撑管7包括内腔,其在人工心脏瓣膜10的膨胀和收缩期间支撑球囊5。所述内腔还有助于将膨胀流体输送到球囊5内,以膨胀球囊5,这进而使人工心脏瓣膜10膨胀。支撑管7还包括远端开口和近端开口(未示出)。在实施例中,近端开口设置在球囊5的近端5a附近并且远端开口设置在球囊5的远端5b附近。
67.支撑管7可以包括靠近远端开口和/或近端开口的一个或多个孔7a。在实施例中,一个或多个孔设置在支撑管7的近端开口附近。远端开口和设置在支撑管7的近端开口处的一个或多个孔7a用作膨胀流体的通道。在实施例中,膨胀流体经由支撑管7进入球囊5。远端开口和设置在支撑管7的近端开口处的一个或多个孔7a确保球囊5的均匀膨胀,进而确保了人工心脏瓣膜10在目标位置部署时均匀膨胀。
68.支撑管7可以由任何聚合物材料制成。聚合物材料可以包括但不限于尼龙、聚四氟乙烯(ptfe)、改性尼龙(pebax)、聚醚醚酮(peek)、硅树脂和其他衍生物。在实施例中,支撑管7由聚酰胺制成。支撑管7的长度可以为40
‑
100mm,更优选50
‑
80mm的范围。在实施例中,支
撑管7连同一个或多个止动件9的长度为65
‑
80mm。支撑管的长度取决于球囊5的长度。
69.支撑管7还包括外径和内径。支撑管7的外径可以为0.5
‑
4.5mm,更优选2.0
‑
3.0mm的范围。支撑管7的内径可以为0.1
‑
4.0mm,更优选在1.5
‑
2.5mm的范围。
70.一个或多个止动件9设置于球囊5内的近端和远端(5a和5b)处,并安装在支撑管7的外表面(未示出)上。在实施例中,如图1f、图1g和图1h所示,一个或多个止动件9包括两个止动件(近端止动件9a和远端止动件9b)。近端止动件9a设置在球囊5的近端5a处。远端止动件9b设置在球囊5的远端5b处。当近端止动件9a和远端止动件9b安装在支撑管7的外表面上时,二者之间的距离可以为15
‑
50mm,更优选18
‑
40mm的范围。
71.一个或多个止动件9可以由以下材料制成:医用级聚氨酯、硅树脂、聚酰亚胺、尼龙、聚四氟乙烯(ptfe)和其他聚合物组合,但不限于此。在实施例中,一个或多个止动件9由聚氨酯制成。
72.一个或多个止动件9可以包括第一部分(在图1i
‑
1k中标记为c)和第二部分(在图1i
‑
1k中标记为d)。第一部分c和第二部分d可以具有预设的厚度。第一部分c的厚度可以为0.10
‑
1.20mm,更优选地为0.45
‑
0.65mm的范围,并且第二部分d的厚度可以为0.05
‑
3.5mm,更优选地为1.0
‑
2.0mm的范围。一个或多个止动件9的厚度对于保持其所需柔性具有重要作用。具有较厚的厚度的一个或多个止动件9具有较小的柔性,但如果厚度太薄,该一个或多个止动件9的破损率变高。因此,本发明的一个或多个止动件9具有中间值的厚度以克服上述问题。
73.如图1i
‑
图1k所示,一个或多个止动件9的第一部分c为圆锥形且包括下端(在图1i
‑
图1k中标记为c1)和上端(在图1i
‑
图1k中标记为c2)。
74.在实施例中,下端c1包括如图1i
‑
图1k所示的均匀的外周。下端c1可以永久地和/或临时地附接到第二部分d。在实施例中,下端c1包括预设的内径和外径。下端c1的外径可以为1.5mm至6.5mm的范围,更优选3.5mm至4.5mm的范围。下端c1的内径可以为0.5mm至5.0mm的范围,更优选地在2.0mm至3.5mm的范围。
75.在实施例中,上端c2是自由端。上端c2可以具有如图1i
‑
图1k所示的各种形状。在实施例中,如图1i所示,上端c2是具有可延伸部分(在图1i中标记为
′
e
′
)的轮缘形结构(rim
‑
shaped structure)。当由于患者的动脉狭窄而在部署过程中需要高推力时,所述轮缘形结构是高效的。所述轮缘形结构还有助于在部署过程期间保持人工心脏瓣膜10的塌缩位置并引导输送导管100穿过导引鞘(introducer sheath)(未示出)。所述结构还有助于塌缩的人工心脏瓣膜10的均匀膨胀。图1g示出了具有轮缘形结构的一个或多个止动件9的透视图,该止动件9的轮缘形结构具有设置在球囊5内部的可延伸部分e。
76.在另一实施例中,如以下图1j所示,上端c2是具有交替的峰和谷的皇冠形结构。所述皇冠形结构在球囊5的膨胀/收缩期间提供较大的灵活性。所述皇冠形结构还允许额外的膨胀流体进入球囊5内部以使球囊5膨胀/收缩。图1h示出了设置在球囊5内的具有交替的峰和谷的皇冠形结构的一个或多个止动件9的透视图。
77.在又一实施例中,如以下图1k所示,上端c2包括均匀的外周。第二端c2的均匀外周有助于减小人工心脏瓣膜10的塌缩轮廓尺寸。所述均匀外周还减小了塌缩的人工心脏瓣膜10的整体直径,以便在部署过程中易于行进。图1f示出了设置在球囊5内的具有均匀的外周的一个或多个止动件9的透视图。
78.在实施例中,上端c2包括预设的内径和外径。上端c2的外径可以为在4.5mm至9.5mm的范围,更优选6.5mm至7.5mm的范围。上端“c2”的内径可以为1.5mm至6.5mm的范围,更优选3.5mm至4.5mm的范围。
79.在实施例中,如图1i
‑
图1k所示,一个或多个止动件9的第二部分d为圆柱形。第二部分d的预设直径可以为3.5mm至4.5mm的范围。第二部分d的预设长度可以为3.3mm至5.0mm的范围。第二部分d可以包括至少一个孔(在图1i
‑
图1k中标记为d1)。在实施例中,第二部分d的至少一个孔d1用于将一个或多个止动件9与支撑管7连接。第二部分d的至少一个孔d1可以为本领域已知的任何形状。在实施例中,该至少一个孔d1为圆形。至少一个孔d1的直径可以为0.1
‑
2.0mm的范围,更优选0.5
‑
1.5mm的范围。
80.在实施例中,当第一部分c和第二部分d连接在一起时,形成了一个或多个止动件9的漏斗形状(如图1i、图1j和图1k所示)。
81.一个或多个止动件9用于在人工心脏瓣膜10从股动脉通路递送到目标位置的期间避免所述瓣膜发生移位。在实施例中,人工心脏瓣膜10被放置在一个或多个止动件9之间。一个或多个止动件9之间的长度可以为8
‑
20mm的范围,更优选12
‑
16mm的范围。在实施例中,一个或多个止挡件9之间的长度为16mm。
82.手柄11设置在输送导管100的近端a附近。手柄11可以包括但不限于螺纹主轴(未示出)。手柄11用于引导外轴1的推拉机构或可转向机构。手柄11的长度可以为80
‑
220mm的范围,更优选120
‑
180mm的范围。
83.在实施例中,手柄11以具有外壳的形式提供,螺纹主轴设置在该外壳内。手柄11的外壳的长度可以在60
‑
160mm、更优选100
‑
120mm的范围。
84.手柄11的螺纹主轴的长度可以为50
‑
100mm、更优选60
‑
80mm的范围。
85.软尖端13设置于输送导管100的次级端b处,并且连接至球囊5的远端5b(如图1c所示)。设置软尖端13以在部署过程期间有助于输送导管100的推进。软尖端13还有助于引导输送导管100穿过弯曲的血管,而不刺破或损坏血管,因为软尖端13在部署过程中发生弯曲以穿过患者的血管系统。
86.软尖端13可以由以下材料制成:改性尼龙(pebax)、聚合物、聚氨酯等,但不限于此。在实施例中,软尖端13由低硬度聚合物制成。在实施例中,软尖端13为圆锥形。软尖端13的外径可以为4
‑
8mm的范围。软尖端13的总长度可以为10
‑
20mm的范围。
87.可选地/另外地,输送导管100可以包括导引鞘(未示出)。导引鞘用于将塌缩的人工心脏瓣膜10部署至目标位置。
88.图2图示了人工心脏瓣膜10在输送导管100的帮助下部署至目标位置处的部署过程。部署过程从步骤201开始。
89.在步骤201,输送导管100被推入患者的脉管系统中。执行所述步骤以将人工心脏瓣膜10部署至患者病变的自体瓣膜(即目标位置)处。在实施例中,人工心脏瓣膜10连同球囊5以塌缩状态部署。上述步骤通过利用外轴1的具有拉放线机构的可转向机构进行。
90.当输送导管进入患者的脉管系统内时,输送导管100的软尖端13作用为引导输送导管100前进。在进入患者的脉管系统后,输送导管100通过患者的动脉的多个弯曲部。为了平滑地通过所述弯曲部,沿主动脉弓的方向牵拉与牵拉器(未示出)连接的牵拉线1c。牵拉器与手柄11的螺纹主轴结合,以便使得输送导管100的次级端b发生弯曲。螺纹主轴旋转(例
如,顺时针),进而使得牵拉器移向手柄11的端部。所述运动拉伸牵拉线的拉环,从而使得外轴1的柔性部分相应地弯曲。执行上述步骤直到输送导管100到达患者的自体瓣膜(即目标位置)处。
91.在步骤203,塌缩的球囊5(其设置在输送导管100上)被膨胀以使塌缩的人工心脏瓣膜10贴附至自体瓣膜环。在进入目标位置后,膨胀流体通过支撑管7和一个或多个止动件9进入球囊5。
92.首先,膨胀流体使球囊5的近端5a和远端5b膨胀。球囊5的近端5a和远端5b的膨胀有助于保持塌缩的人工心脏瓣膜10的位置。上述膨胀还有助于保持塌缩的人工心脏瓣膜10的膨胀高度。
93.然后膨胀流体进入球囊5的中间部分5c。由于膨胀流体在球囊5内部逐渐积聚,球囊5在其周边区域逐渐膨胀而不妨碍人工心脏瓣膜10的塌缩轮廓。这使得人工心脏瓣膜10在目标位置均匀膨胀。
94.在人工心脏瓣膜10膨胀之后,膨胀流体经由外轴1的毂1d被抽出,使球囊5收缩。
95.在步骤205,输送导管100从患者的脉管系统中被撤回。撤回步骤在外轴1的具有拉放线机构的可转向机构的帮助下进行(如步骤201中所述),而不妨碍患者脉管系统内的血管。
96.本发明的范围仅受所附的专利申请的权利要求书所限制。更一般来说,本领域技术人员应容易理解,本文描述的所有参数、尺寸、材料和配置均为示例性的,并且实际的参数、尺寸、材料和/或配置将取决于使用本发明的技术教导的特定的应用场景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1