一种具有荧光分子开关特性的无载体纳米粒及其制备方法与应用与流程
本发明涉及一种纳米粒及其制备方法与应用,尤其涉及一种具有荧光分子开关特性的无载体纳米粒及其制备方法。
背景技术:
恶性肿瘤是威胁人类健康的一大杀手。据统计,在世界范围内,每年有将近100万人被诊断出癌症。光动力治疗作为一种新型的抗肿瘤方式,它具有治疗创伤小,毒副作用小等优势,自从1996年被美国fda批准用于治疗梗阻性食道肿瘤以来,受到越来越多的关注。但是光敏剂作为光动力治疗不可或缺的要素,常存在水溶性差、无法靶向递送到肿瘤部位等缺陷,这些极大的限制了它在临床上的应用。近年来,纳米递药系统的飞速发展为克服光敏剂在临床上的这些缺陷提供了契机。针对脂质体、胶束等纳米技术的研究已有很多报道,但是,光动力治疗作为一种光触发激活的治疗方式,实时追踪光敏剂的分布与释放,将对光动力治疗实现时空性激活、肿瘤的精准治疗提供很大的帮助。利用光敏剂自身发出的荧光成像实时追踪光敏剂的分布是一种无创无毒的方式,但是如何实现光敏剂的智能释放以及实时监测释放过程依旧是很大的挑战。目前,大部分监测释药过程的策略是将荧光分子与药物通过物理包埋的方式共包被在纳米载体中,荧光分子由于聚集引起猝灭不具有荧光,当从纳米载体中释放出时荧光恢复。但是这种方式制备工艺复杂,并且常存在载药量低、稳定性差、无法实现肿瘤部位响应释药等问题。因此,需要开发出更高效智能的药物递送系统用于递送光敏剂,同时实现光敏剂体内分布的实时追踪,以及释药过程的实时监测。将具有荧光猝灭作用的荧光分子制备成小分子前药,利用荧光小分子前药自组装形成纳米粒的能力运载光敏剂,这就减少甚至避免了载体材料的大量使用引起的相关不良反应,同时也极大地提高了载药量。
具有聚集引起荧光猝灭(aggregation-causedquench,acq)效应的荧光小分子前药,在形成纳米粒后发生荧光猝灭,而在释放出游离的荧光小分子后荧光恢复,这为监测释药过程提供了可能。
但是,不论是常规的纳米递送策略还是基于小分子前药策略设计的纳米粒,实现靶部位的特异性释放对于提高抗肿瘤效果,降低对正常组织的毒副作用都具有非常重要的意义。相对于正常细胞,肿瘤细胞内存在高浓度的ros水平,这可以用于设计ros响应型的药物递送系统。例如在荧光小分子前药结构中引入单硫醚键、二硫键、单硒键、二硒键或间隔二硫醚键、硫缩酮键、草酸酯键等对ros比较敏感的化学键。但是肿瘤细胞内ros的表达水平依然不足以快速打断这些ros敏感键,因此依然无法实现肿瘤细胞内的快速响应释药。而光动力治疗是一种消耗氧气产生ros的过程,所产生的ros既可以引起肿瘤细胞的凋亡又可以作为ros补充剂,加速荧光小分子前药的释放,而荧光小分子发出的荧光又可以反映光敏剂实时释放的情况,为调整给药时间与给药剂量提供指导意义,进一步地为实现抗肿瘤的精准治疗提供可能。本发明所提供的一种具有荧光分子开关特性的无载体纳米粒能够通过epr效应在肿瘤部位蓄积,制备方法简单、快速,具有很好的临床转化应用前景。
技术实现要素:
发明目的:本发明的第一目的是提供一种具有荧光分子开关特性的无载体纳米粒;
本发明的第二目的是提供该纳米粒的制备方法。
本发明的第三目的是提供该纳米粒的应用。
本发明通过以下技术方案实现上述目的:一种具有荧光分子开关特性的无载体纳米粒,所述纳米粒由前药分子通过自组装包裹光敏剂而成,其中,所述前药分子由具有聚集荧光猝灭特性的荧光分子通过ros敏感键与疏水基团连接而成。
优选地,所述的具有聚集荧光猝灭特性的荧光分子为具有活性羟基或活性羧基的香豆素类、醌类、黄酮类、生物碱类、二苯基庚烷类分子。
进一步地,所述的具有聚集荧光猝灭特性的荧光分子为姜黄素、喜树碱、藤黄酸、槲皮素。
进一步地,,所述的具有聚集荧光猝灭特性的荧光分子为姜黄素。
优选地,所述的ros敏感键为单硫醚键、二硫键、单硒键、二硒键、间隔二硫醚键或草酸酯键。
进一步地,所述的ros敏感键为单硫醚键。
优选地,所述的疏水基团为含有不饱和基团的化合物。
进一步地,所述疏水基团为维生素e、油醇、油酸、亚麻醇、亚油醇或全反式维甲酸。
进一步地,所述疏水基团为油醇。
优选地,所述的光敏剂为卟啉类或酞菁类。
进一步地,所述的光敏剂为焦脱镁叶绿酸a、二氢卟吩、酞菁锌、5-氨基酮戊酸、血卟啉单甲醚或叶绿素衍生物。
其中,二氢卟吩即ce6、酞菁锌即znpc。
优选地,所述自组装包裹为将的前药分子与光敏剂通过非共价作用结合,所述非共价作用为π-π堆积、疏水作用或分子间氢键,前药分子与光敏剂的摩尔比为3:1~1:3。
本发明还提供上述的具有荧光分子开关特性的无载体纳米粒的制备方法:将摩尔比为3:1~1:3的荧光小分子前药与光敏剂的混合物溶解到有机溶剂中,随后滴加到水中即形成纳米粒,利用透析法除去制剂中的有机溶剂,即得到所述无载体纳米粒;或在摩尔比为3:1~1:3的荧光小分子前药与光敏剂的混合物中添加以荧光小分子前药重量比15~50%的peg修饰剂,溶解到有机溶剂中后,滴加到水中形成纳米粒,利用透析法除去制剂中的有机溶剂,即得到所述无载体纳米粒。
其中,所述荧光小分子前药为具有acq特性的荧光分子通过ros敏感键与疏水基团连接而成的前药分子。
优选地,所述的具有acq特性的荧光分子为香豆素类、醌类、黄酮类、生物碱类、二苯基庚烷类、蒽环类化合物,如姜黄素等,ros敏感键如单硫醚键等,疏水基团为含有不饱和基团的化合物,如油醇等,光敏剂为卟啉类、酞菁类,如znpc等。
优选地,所述的有机溶剂为乙醇、四氢呋喃、二甲基亚砜。
进一步地,所述的有机溶剂为二甲基亚砜。
优选地,所述的peg修饰剂为tpgs、dspe-peg、plga-peg或pe-peg,所述分子量为1000、2000或5000。
进一步地,所述的peg修饰剂中peg分子量优选为2000。
具体地,本发明选择znpc作为光敏剂模拟分子,姜黄素作为具有聚集荧光猝灭特性的荧光分子模拟分子,油醇作为疏水基团,将二者通过硫代二乙酸(单硫键)作为连接臂连接,构建具有ros响应特性的荧光小分子前药(cur-s-oa)。同时,将姜黄素和油醇以戊二酸桥连合成对照前药分子(cur-oa);
其中,cur-s-oa结构式为:
cur-oa结构式为:
本发明提供所述具有聚集荧光猝灭特性的荧光分子前药和对照前药的合成方法,包括如下步骤:
首先油醇与二元酸反应得到中间产物。中间产物继续与姜黄素反应成酯,得到最终产物。
所述的二元酸选自:硫代二乙酸、硒代二乙酸、3,3’-二硫代二丙酸、3,3’-二硒代二丙酸、(亚乙基二硫代)二乙酸、草酸、戊二酸。
具体地,本发明提供了系列姜黄素-油醇小分子前药的合成方法:
将硫代二乙酸、硒代二乙酸、3,3’-二硫代二丙酸、3,3’-二硒代二丙酸、(亚乙基二硫代)二乙酸、草酸、戊二酸溶于二氯甲烷中,随后加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edci)、对二甲氨基吡啶(dmap)室温搅拌反应0.5h后,加入一定量的油醇,继续搅拌反应2~5h,tlc监测反应进行的程度,柱色谱分离得到单侧羧基取代的油醇羧基化产物。随后将所得醇羧基化产物、edci、dmap、1-羟基苯并三唑(hobt)、和n,n-二异丙基乙胺(dipea)室温搅拌反应0.5h后,加入姜黄素,n2保护下在室温中继续搅拌反应24h,最后通过柱色谱分离纯化得到产物。
本发明中所述的姜黄素可以用其他含有活性羟基的荧光分子,如香豆素类、醌类、黄酮类、生物碱类、其他二苯基庚烷类、蒽环类化合物化合物所代替。
油醇可以用其他含有不饱和键的基团代替,如维生素e、油醇、油酸、亚麻醇、亚油醇。
所述的光敏剂可以用其他卟啉类或酞菁类光敏剂替代,如二氢卟吩e6。
本发明还提供了所述的姜黄素-油醇小分子前药包裹znpc自组装纳米粒。
本发明所提供的姜黄素-油醇小分子前药包裹znpc自组装纳米粒的制备方法如下:
将一定量的peg修饰剂(tpgs、dspe-peg、plga-peg或pe-peg)和荧光小分子前药、光敏剂溶解到适量的有机溶剂中,剧烈搅拌下,将该有机溶剂溶液缓慢加入到水中,自发形成均匀的纳米粒。利用透析法除去纳米粒中的有机溶剂,即可得到具有纳米粒溶液。
所述的有机溶剂为乙醇、四氢呋喃或二甲基亚砜;
进一步地,本发明提供的一种具有荧光分子开关特性的无载体纳米粒,以姜黄素-油醇和znpc共组装纳米粒为模型。
其中姜黄素-油醇和znpc的摩尔比为3:1~1:3。
所述的姜黄素-油醇和znpc共组装纳米粒制备方法如下:
将一定量的姜黄素-油醇、peg修饰剂和znpc溶于适量的有机溶剂中,有机溶剂优选为乙醇、二甲基亚砜。姜黄素-油醇浓度范围为0.5~5mg/ml,znpc浓度范围为0.5~5mg/ml,搅拌下,将该溶液缓慢滴加到水中,自发形成均匀的纳米粒。其中peg与姜黄素-油醇的比例为0~30%,优选比例为30%;所用的peg修饰剂为tpgs、dspe-peg、plga-peg或pe-peg等,优选为tpgs。所述的peg分子量为1000、2000、5000,优选peg分子量为2000。
本发明还提供上述的具有荧光分子开关特性的无载体纳米粒在检测药物释放过程中的应用,通过所述纳米粒在解聚过程中伴随着荧光分子荧光强度由弱到强的变化,实现对药物释放过程的监测。
有益效果:(1)一种具有荧光分子开关特性的无载体纳米粒利用ros敏感释药的小分子荧光分子通过非共价方式包裹光敏剂,实现荧光分子与光敏剂的同步递送。光动力治疗产生ros杀伤肿瘤细胞的同时引起小分子荧光前药中ros敏感键的断裂,实现光触发下的荧光小分子和光敏剂的智能释放,而荧光小分子荧光实现由“关”到“开”的转变,可以用于实时监测释药过程,为调整给药时间与给药剂量提供指导;
(2)采用纳米沉淀法制备,简单快速,工艺简单,适合产业化生产;
(3)粒径小于200nm,多分散系数小,粒径均一,结构稳定;3)载药量高,可避免辅料引起的毒性;
(4)具有光触发产生ros响应释药的特性,可实现肿瘤部位的时空响应释药;
(5)伴随释药过程荧光分子所表现出的荧光“关-开”特性,可用于实时监控释药情况,为调整给药时间与给药剂量提供指导意义;将为可视化的诊疗纳米粒提供一种新型、安全、有效的设计思路与制备方法。
附图说明
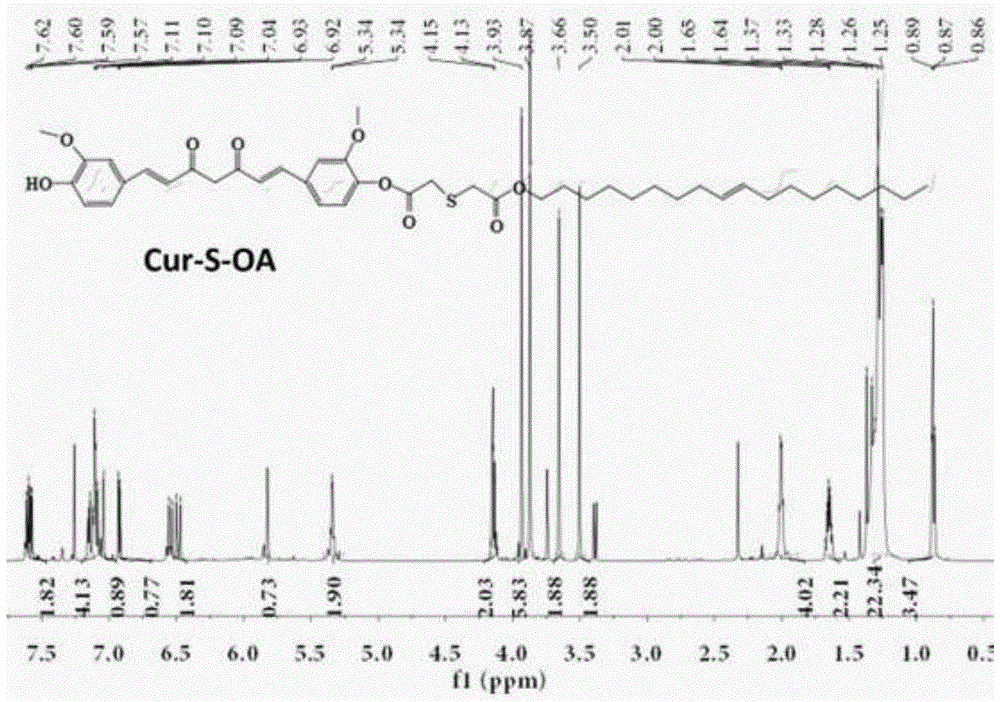
图1为本发明实施例1的单硫醚键相连的姜黄素-油醇前药(cur-s-oa)的1h-nmr谱图;
图2为本发明实施例1的单硫醚键相连的姜黄素-油醇前药(cur-s-oa)的esi-ms谱图;
图3为本发明实施例2的酯键相连的姜黄素-油醇前药(cur-oa)的1h-nmr谱图;
图4为本发明实施例2的单硫醚键相连的姜黄素-油醇前药(cur-s-oa)的esi-ms谱图;
图5为本发明实施例3中的cur-s-oa或姜黄素分散在水中或thf中的荧光发射光谱图;
图6为本发明实施例4的姜黄素-油醇前药包裹znpc形成的自组装纳米粒的透射电子显微镜图及动态光散射粒径分布图;
图7为本发明实施例4的含单硫醚键的姜黄素-油醇前药包裹znpc形成的自组装纳米粒(znpc@cur-s-oa)的粒径-存储时间变化图;
图8为本发明实施例6的姜黄素-油醇前药包裹znpc形成的自组装纳米粒的体外释放实验图;
图9为本发明实施例6的含单硫醚键的姜黄素-油醇前药包裹znpc形成的自组装纳米粒(znpc@cur-s-oa)激光照射前后粒径变化图;
图10为本发明实施例7的细胞摄取图;
图11为本发明实施例8的细胞内释药图;
图12为本发明实施例9的细胞毒性图;
图13为本发明实施例10的姜黄素-油醇前药包裹znpc形成的自组装纳米粒的离体器官分布图;
图14为本发明实施例11的抗肿瘤实验肿瘤体积变化图;
图15为本发明实施例11的抗肿瘤实验肿瘤小鼠体重变化图;
具体实施方式
下面结合具体实施案例对本发明所述的技术方案做进一步的说明,但并不能将发明限制在所述的实施例范围之中。
实施例1
单硫醚键相连的姜黄素-油醇前药(cur-s-oa)的合成
称取一定量的硫代二乙酸溶于二氯甲烷中,随后加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edci)、对二甲氨基吡啶(dmap)室温搅拌反应0.5h后,加入一定量的油醇继续搅拌反应2~5h,tlc监测反应进行的程度,柱色谱分离得到单侧羧基取代的油醇羧基化产物。随后将所得油醇羧基化产物、edci、dmap、1-羟基苯并三唑(hobt)、和n,n-二异丙基乙胺(dipea)室温搅拌反应0.5h后,加入姜黄素,n2保护下在室温中继续搅拌反应24h,最后通过柱色谱分离纯化得到产物。通过核磁共振氢谱(1h-nmr)确定实施例1中前药的结构,选用溶剂为cdcl3,结果如图1,解析结果如下:
1h-nmr(400mhz,cdcl3,δ):0.89(t,j=8.0hz,3h,h-25),1.12~1.44(m,22h,h-10,11,12,13,14,19,20,21,22,23,24),1.52~1.67(m,2h,h-9),1.92~2.20(m,4h,h-15,18),3.46~3.53(s,2h,h-4),3.61~3.67(s,2h,h-2),3.83~3.89(s,3h,h-53),3.90~3.97(s,3h,h-52),4.11~4.17(t,j=8.2hz,2h,h-8),5.25~5.40(m,2h,h-16,17),6.45~6.59(m,2h,h-34,38),6.89~6.94(d,j=8.3hz,1h,h-29),7.02~7.17(m,5h,h-30,32,43,44,47),7.55~7.63(m,2h,h-33,39)。
通过esi-ms确定实施例1中前药结构的分子量,结果如图2,理论分子量750.38,谱图中找到[m+h]+:751.3893。
实施例2
酯键相连的姜黄素-油醇前药(cur-oa)的合成
称取一定量的戊二酸溶于二氯甲烷中,随后加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edci)、对二甲氨基吡啶(dmap)室温搅拌反应0.5h后,加入一定量的油醇继续搅拌反应2~5h,tlc监测反应进行的程度,柱色谱分离得到单侧羧基取代的油醇羧基化产物。随后将所得油醇羧基化产物、edci、dmap、1-羟基苯并三唑(hobt)、和n,n-二异丙基乙胺(dipea)室温搅拌反应0.5h后,加入姜黄素,n2保护下在室温中继续搅拌反应24h,最后通过柱色谱分离纯化得到产物。通过核磁共振氢谱(1h-nmr)确定实施例2中前药的结构,选用溶剂为cdcl3,结果如图3,解析结果如下:
1h-nmr(400mhz,cdcl3,δ):0.89(t,j=8.0hz,3h,h-25),1.12~1.44(m,22h,h-10,11,12,13,14,19,20,21,22,23,24),1.52~1.67(m,4h,h-3,9),1.92~2.20(m,4h,h-15,18),2.44~2.54(t,j=8.0hz,2h,h-2),2.63~2.70(t,j=8hz,2h,h-4),3.82~3.89(s,3h,h-53),3.91~3.98(s,3h,h-51),4.05~4.13(t,j=8.2hz,2h,h-8),5.29~5.40(m,2h,h-16,17),6.44~6.62(m,2h,h-34,38),6.91~6.96(d,j=8.3hz,1h,h-29),7.03~7.19(m,5h,h-30,32,43,44,47),7.56~7.65(m,2h,h-33,39)。
通过esi-ms确定实施例1中前药结构的分子量,结果如图4,理论分子量732.42,谱图中找到[m+h]+:733.4305。
实施例3
含单硫醚键的姜黄素-油酸前药(cur-s-oa)聚集诱导猝灭现象
取等摩尔量的cur-s-oa和姜黄素分别溶于thf中,配制成等摩尔浓度的cur-s-oa和姜黄素溶液,利用471nm激发光激发,记录450~800nm处的荧光发射光谱。取等摩尔量的cur-s-oa,超声分散到等体积水中形成纳米粒,利用471nm激发光激发,记录450~800nm处的荧光发射光谱。结果如图5,cur-s-oa在水中存在荧光猝灭现象,520nm左右的荧光强度很低,当溶解在thf时荧光强度得到增强,而等摩尔浓度的姜黄素溶解在thf中则表现出最强的荧光强度,由此可以看到利用cur-s-oa制备的纳米粒,在纳米粒解聚水解的过程中伴随着荧光的增强,因此可以用于实时监测药物情况。
实施例4
姜黄素-油醇前药包裹znpc形成的自组装纳米粒的制备
精密称取实施例1、2中所制备的前药10mg,znpc2mg,tpgs3mg,将其溶解于1ml二甲基亚砜中,剧烈搅拌下,将该二甲基亚砜溶液缓慢滴加到4ml超纯水中,即可得均匀的纳米粒(含单硫醚键的姜黄素-油醇前药包裹znpc形成的自组装纳米粒znpc@cur-s-oa纳米粒和含酯键的姜黄素-油醇前药包裹znpc形成的自组装纳米粒znpc@cur-oa纳米粒)。通过透射显微镜和马尔文粒度仪对实施例4所制备的纳米粒外观形貌与粒径分布进行表征。结果如图6,所制备的纳米粒粒径均在100nm左右,外观呈球形,粒径分布均匀。
实施例5
znpc@cur-s-oa纳米粒的稳定性考察
将实施例4中所制备的znpc@cur-s-oa纳米粒分别分散于pbs(ph7.4)和fbs中,配制成1mg/ml的胶体溶液,37℃下静置24h,在预定的时间点通过马尔文粒度仪测定其粒径变化。结果如图7所示。姜黄素-油醇前药包裹znpc形成的自组装纳米粒在24h内粒径无明显变化,显示出良好的稳定性。
实施例6
姜黄素-油醇前药包裹znpc形成的自组装纳米粒的体外释放实验及激光照射前后粒径变化
以含有0.1%吐温80的磷酸盐缓冲液为释放介质,考察姜黄素-油醇前药包裹znpc形成的自组装纳米粒的体外释放情况。将实施例4中所制备的姜黄素-油醇前药包裹znpc形成的自组装纳米粒(姜黄素-油醇前药浓度为5mg/ml,znpc浓度为1mg/ml),加入到10ml释放介质中,37℃下,使用638nm激光(0.5w/cm2)照射不同时间后,于设定的时间点取样,通过高效液相色谱测定游离姜黄素浓度,使用紫外分光光光度计测定释放出的znpc的浓度。
结果如图8所示,随着光照时长的增加,含单硫键的姜黄素-油醇前药包裹znpc形成的自组装纳米粒,姜黄素和znpc的释放速度加快,表现出明显的光触发加速释药的性质,而与单硫键相比,碳键没有ros响应释药特性,因此姜黄素与znpc24h内的释放量很低。
使用超纯水配制1mg/ml的含单硫醚键姜黄素-油醇前药包裹znpc形成的自组装纳米粒,利用638nm(0.5w/cm2)激光照射5min后,利用马尔文粒度仪测定照射前后粒径的变化,结果如图9所示,经激光照射之后,纳米粒的粒径变得不均一,出现超过1000nm的大的团聚物,这意味着,经激光照射后,纳米粒结构被破坏,成功实现了光触发下的药物释放。
实施例7
znpc@cur-s-oa纳米粒的细胞摄取
将b16f10细胞按照1×105个细胞/孔的密度接种到共聚焦皿中,在细胞培养箱中培养24h后,将实施例4中所制备的含单硫醚键的姜黄素-油醇前药包裹znpc形成的自组装纳米粒znpc@cur-s-oa纳米粒以及游离znpc与b16f10细胞共孵育4h后,使用pbs清洗细胞后,利用4%多聚甲醛固定10min,加入dapi对细胞核进行染色,10min后使用pbs清洗细胞三次,置于共聚焦显微镜下观察,znpc使用638nm进行激发,姜黄素通道使用472nm激发,dapi使用405nm激发。
实验结果如图10所示,相同时间内,使用含单硫醚键的姜黄素-油醇前药包裹znpc形成的自组装纳米粒znpc@cur-s-oa纳米粒孵育的细胞显示出比游离znpc孵育的细胞更高的细胞内荧光。因此本发明所制备的单硫醚键的姜黄素-油醇前药包裹znpc形成的自组装纳米粒比游离znpc具有更高的细胞摄取效率。
实施例8
姜黄素-油醇前药包裹znpc形成的自组装纳米粒的细胞内释药
将实施例4中所制备的纳米粒与b16f10细胞共孵育4h后,利用638nm激光照射30s或者不照射,随后在细胞培养箱中继续孵育2h,使用pbs清洗细胞后,利用4%多聚甲醛固定10min,加入dapi对细胞核进行染色,10min后使用pbs清洗细胞三次,置于共聚焦显微镜下观察,znpc使用638nm进行激发,姜黄素通道使用472nm激发,dapi使用405nm激发。
结果如图11所示,含单硫醚键的姜黄素-油醇前药包裹znpc形成的自组装纳米粒znpc@cur-s-oa在经过激光照射以后,在姜黄素荧光通道可以看到明显的荧光增强,这也进一步证实了在实施例3中观测的现象;而在含酯键的姜黄素-油醇前药包裹znpc形成的自组装纳米粒znpc@cur-oa在激光照射前后则没有看到这样的现象,这说明单硫醚键在实现光触发下的加速药物释放起着关键作用,而释药过程中伴随着的荧光增强可以用于实时反映释药情况。
实施例9
znpc@cur-s-oa纳米粒的细胞毒性
采用mtt法考察znpc@cur-s-oa纳米粒对b16f10黑色素瘤细胞的细胞毒性。将状态良好的b16f10细胞以每孔接种5000个细胞的密度接种于96孔板中,置于培养箱中孵育过夜,待细胞密度长至60%时,加入实施例4中所制备的纳米粒或者游离的光敏剂znpc。每个测试孔添加100μl的测试溶液,每个浓度5个平行测试孔,置于细胞培养箱中培养24后,将96孔板取出,每孔加入5mlmtt溶液10μl,细胞培养箱中培养2h后,吸弃96孔板中液体,每孔加入100μldmso,使用酶标仪测定490nm处的吸光度值。
细胞毒结果如图12所示。与游离znpc组相比,znpc@cur-s-oa纳米粒具有更强的细胞毒作用,这可能是由于znpc被制备成纳米粒后能够促进细胞摄取,从而增强了细胞毒作用。
实施例10
znpc@cur-s-oa纳米粒在小鼠器官中的分布
b16f10细胞接种于babl/c小鼠,当瘤体积达到150mm3时,尾静脉注射实施例4中所制备的znpc@cur-s-oa纳米粒以及游离的znpc,znpc的给药剂量为2mg/kg。由于znpc可以发出强烈的近红外荧光,具有较强的穿透能力,因此可以用于实时观察药物的分布,给药4、12或24h后,将小鼠处死,分离出心、肝、脾、肺、肾和肿瘤,用小动物活体成像系统进行分析。结果如图13所示,与游离的znpc相比,在相同的时间点,含单硫醚键的姜黄素-油醇前药包裹znpc形成的自组装纳米粒znpc@cur-s-oa纳米粒在肿瘤中的荧光强度更强,表明本发明所制备的纳米粒具有更好地肿瘤蓄积能力,同时证明znpc可以用于实时监测药物的分布。
实施例11
znpc@cur-s-oa纳米粒的在体抗肿瘤实验
将b16f10黑色素瘤细胞接种于小鼠右侧腋下,当肿瘤体积达到150mm3时,将小鼠随机分组,每组8只,分别给予生理盐水、游离znpc、游离姜黄素、实施例4中所制备的znpc@cur-s-oa纳米粒,每隔一天给药一次,共给药3次(znpc=5mg/kg,cur=6.5mg/kg),给药24h后激光照射组激光照射(638nm,0.5mw/,5min),非激光照射组不给予光照,每天记录小鼠体重,隔天测量并记录肿瘤体积。结果如图14所示,在治疗周期内各治疗组小鼠体重未发生明显变化,说明本发明所提供的纳米粒具有良好的安全性与生物相容性。此外,如图15所示,小鼠在治疗周期结束后,可以看到与单独的znpc治疗组或姜黄素治疗组相比,znpc@cur-s-oa纳米粒对小鼠肿瘤的抑制作用最为明显,说明本发明所制备的纳米粒能够显著提高光敏剂的光动力治疗效果。由此可以证明本发明所提供的纳米粒是一种安全有效的抗肿瘤制剂。
- 还没有人留言评论。精彩留言会获得点赞!