一种微异型载细胞海藻酸凝胶及其制备方法和应用与流程
本发明涉及水凝胶技术领域,更具体地,涉及一种微异型载细胞海藻酸酸凝胶及其制备方法和应用。
背景技术:
凝胶是指溶胶或溶液中的胶体粒子或高分子在一定条件下相互链接,形成具有三维网状结构的凝胶,在其结构空隙中充满了作为分散介质的液体。凝胶种类繁多,例如葡甘露胶、凝胶糖果、芦荟凝胶、气凝胶等等,其中由于海藻酸钠具有较好的生物相容性、无毒性和生物可降解行,使用海藻酸钠制备的海藻酸水凝胶已广泛应用于食品工业和医药领域。凝胶的制备分为物理交联和化学交联。物理交联如加热、扩散等;化学交联如紫外交联等。现有的制备凝胶以海藻酸凝胶为例,将一定量的海藻酸钠粉末或颗粒加入到去离子水中,加热搅拌至完全溶解,制成海藻酸钠溶液。将一定量的钙盐加入到去离子水中,搅拌至完全溶解,制成钙盐溶液,然后通过滴制法将海藻酸钠溶液滴入到钙盐溶液中,钙离子和钠离子进行粒子交换形成海藻酸钙凝胶。海藻酸钠溶液除了可以与ca2+进行离子交换完成凝胶化,也可以与ba2+、zn2+等二价金属离子形成凝胶。化学交联如甲基丙烯酸酐化明胶(gelma),gelma由甲基丙烯酸酐(ma)与明胶(gelatin)制备获得,加入一定浓度的va-086光引发剂通过紫外光或可见光激发固化反应,形成适于细胞生长与分化且有一定强度的三维结构。还有聚丙烯酰胺凝胶,它以次甲基双丙烯酰胺为交联剂,经过四甲基乙二胺催化、通过游离基引发(光引发、化学引发等)聚合而成交联聚丙烯酰胺。通过加入光引发剂和光照交联的凝胶的制备已有利用微流控技术来实现,其先通过两相流形成球状凝胶液滴,液滴聚集并暴露在光照下,光照激发光引发剂的作用完成凝胶化。
滴制法制备海藻酸钙凝胶简单易操作,实验室中配置好相关试剂后通过滴管滴加液滴即可形成凝胶,无需复杂昂贵的设备即可完成操作。但是在凝胶液滴上无法保证均匀性,由于表面张力的原因液滴只能保持球形,并且由于交联反应迅速,液滴下落时并非完整球形,而是带有尖端的水滴,所以最终形成的凝胶也是拟球形。而且凝胶的制备速度跟滴入液滴的速度和离子浓度有关,若无相关滴加的仪器设备支持,制备速度较低。光引发剂和光诱导的化学交联制备凝胶可以通过控制引发剂的浓度、种类以及光照强度等各参数来控制凝胶的质量以及凝胶胶体的凝胶化程度。但是由于化学交联的原因,需要引入交联剂和激发条件,比如紫外光照则需要引入紫外光设备,这增加了制造成本。而且引入交联剂不知道其交联反应后是否产生副产物并对内部细胞造成损伤,以及使用的外部激发条件是否损伤细胞,如紫外激发的紫外光对细胞的突变型诱导,温度激发对细胞活性的影响等。
cn108636380a公开了一种吸附重金属砷的水凝胶微球及制备方法,其制备方法为:(a)将海藻酸钠加入去离子水或茶碱水溶液中,在室温下机械搅拌,形成海藻酸钠溶液;(b)将凹凸棒土单体加入去离子水或茶碱水溶液中,超声分散,然后通过离心去除分散体中的固体沉淀,制得凹凸棒土单体悬浮溶液;(c)将海藻酸钠溶液与凹凸棒土单体悬浮溶液按照1:9—10:1的比例混合后搅拌均匀,制成凹凸棒土石海藻酸钠混合液;(d)将凹凸棒土石海藻酸钠混合液滴入二价金属离子交联剂中,制得离子交联凝胶粒,将离子交联凝胶粒蒸馏水润洗,真空干燥后得到凹凸棒土石海藻酸钠改性聚合物,即水凝胶微球。其制备过程中需要加入化学交联剂,会引发一定的副反应,且对载细胞有一定的损伤。对于如何得到具有良好均一性的载细胞凝胶问题的解决并未提供相关的技术启示。
技术实现要素:
本发明要解决的技术问题是克服现有无法获得形状均一且无损内部载细胞的微异型载细胞海凝胶的缺陷和不足,提供一种微异型载细胞海藻酸凝胶。
本发明的另一目的在于提供一种微异型载细胞海藻酸凝胶的制备方法。
本发明的又一方法在于提供一种微异型载细胞海藻酸凝胶在程器官移植、损伤器官和组织修复中的应用。
本发明的再一目的在于提供一种用于工程器官移植、损伤器官和组织修复的材料。
本发明上述目的通过以下技术方案实现:
一种微异型载细胞海藻酸凝胶,所述微异型载细胞海藻酸凝胶为依次包裹的四层结构,由内至外依次为:细胞和营养液—内层异型凝胶—药物溶液—外层凝胶。
其中内层异型凝胶为细胞定向繁殖提供生物支架;药物溶液使细胞产生功能性分化,形成特定组织/器官的细胞群;外层凝胶保证内部物质的相对独立性。由于凝胶可降解,在内部细胞完成培养分化后由于凝胶的降解释放细胞群,细胞群依靠凝胶的降解,逐步与其他同类型细胞群发生联系、相互作用,形成更大的细胞群,最终形成所需的组织/器官。
优选地,所述微异型载细胞海藻酸凝胶的内层异型凝胶为不同长宽比的棒形,外层凝胶为球形。一般微流控制备出的凝胶由于表面张力的原因,凝胶为球形形态,而本发明为棒状。细胞分化主要由两种因素决定:药物处理和微结构,在此处棒状结构主要是以微结构来控制细胞的分化。
在整个微流控制备凝胶的过程中,通过改变内部异形凝胶制备时注入的凝胶原料溶液中所含的细胞类型,以及两相流的流速,可以制备不同长宽比和的棒形液滴。
本发明包保护一种上述微异型载细胞海藻酸凝胶的制备方法,包括如下步骤:
s1.制备内层异性凝胶:将含有种子细胞和凝胶材料的溶液作为内相,将具有一定生物相容性的油相作为外相,利用两相流进行液滴生成形成凝胶液滴,再通过流道对凝胶液滴进行塑形,同时凝胶液滴本身发生凝胶化,进行定型,制备得到异型载细胞凝胶层;
s2.内层异性凝胶去油:使得s1制备的异型载细胞凝胶从油相进入药物溶液,完成去油过程;
s3.制备外层凝胶层:将内层凝胶和含药物的溶液包裹进凝胶中,利用两相流进行液滴生成形成外层凝胶层,制备得到所述微异型载细胞海藻酸凝胶。
优选地,所述微异型载细胞海藻酸凝胶由微异型载细胞海藻酸凝胶制备系统控制完成,所述微异型载细胞海藻酸凝胶制备系统包括控制系统、驱动模块、集成微流控芯片以及收集系统,
所述控制系统用于控制驱动模块的驱动力,即注射泵参数,以调节流体进入微流控芯片的流速,从而达到液滴生成的生成速率和液滴大小控制;
驱动模块给液体流动提供流动动力;
集成微流控芯片用于注射原料流体一步生成最终所需要溶液,避免了中间移液加液操作;
收集系统用于收集最终生成的凝胶原料,以及在制备过程中产生的废液。
在本发明的微异型载细胞海藻酸凝胶制备系统中:控制系统用于控制驱动模块的驱动力,即注射泵参数,以调节流体进入微流控芯片的流速,从而达到液滴生成的生成速率、液滴大小等控制。
驱动模块主要给液体流动提供流动动力,一般常用注射泵作为动力源,注射泵的精度决定了流体在微流控芯片中的最小流动速率,而注射泵的稳定性决定了微流控芯片中流体流动的稳定性。
集成微流控芯片是把内层异型载细胞凝胶的制备、凝胶去油、外层凝胶制备三大模块集成到芯片中,注射原料流体一步生成最终所需要的凝胶原料,避免了中间移液加液等实验室的操作。
收集系统用于收集最终生成的凝胶原料,以及在制备过程中,产生的废液(如去油模块中,凝胶从油相进入到水相,该油相已完成其作用作为废液流出)。
利用该微异型载细胞海藻酸凝胶制备系制备本发明的微异型载细胞海藻酸凝胶的具体操作说明如下:
内层异型凝胶的制备主要是通过液滴微流控的两相流生成液滴的原理,内相流体为凝胶原料溶液,其中包含制备所需的种子细胞,外相为具有一定生物相容性的油相,用于剪切内相流体使其在油相中形成液滴,对两相流的流速进行控制,制备出不同体积的凝胶液滴,然后进入到微流道中进行塑形,同时凝胶化。当液滴在塑形流道中外层凝胶化后,完成定型,接着是在微流道中保持一段时间增强其凝胶效果,制备出异型载细胞凝胶。
对两相流速的控制可以形成不同体积大小的液滴,在经过塑形和定型后,所制备的凝胶的尺寸有所差,控制两相流速比和塑性微流道结构,生成大小、形状不同的载细胞凝胶。
凝胶通过微结构,迫使凝胶从油相进入到带有药物的水相中,完成去油过程。
同时,使凝胶处于药物溶液环境中,便于后于的药物通过凝胶层进入到内部处理细胞,再次利用两相流进行液滴生成。这个过程把内层凝胶和含药物的溶液包裹进凝胶中,形成外层凝胶包裹,最终形成异型载细胞凝胶。
优选地,所述集成微流控芯片包括内层异性凝胶制备模块、凝胶去油模块和外层凝胶层制备模块。利用微流控芯片快速、大通量制备微异形载细胞凝胶。
现在的载细胞凝胶是通过滴制法、浸渍法、紫外交联等方法制备,这些方法需在实验台上预先配置好所需试剂溶液,完成从试剂管移液加液等操作,若需要外部紫外照射或加热等,再暴露于紫外光下或放置于水浴仪器等外部诱导设备,完成交联形成凝胶。
本发明利用微流控技术将一系列操作集成在微流控芯片上,实现微量、高通量、自动化制备微异形载细胞凝胶。首先根据液滴微流控原理,在内相流体中混入一定浓度的细胞,通过外相剪切和界面的表面张力作用,形成载细胞凝胶液滴,该液滴生成速度与两相流速和两相类型等有关系,在高流速下可实现每秒几百个液滴的生成速度。凝胶液滴形成之后进入到带塑性作用的微流道中完成凝胶液滴塑性,然后保持较长时间的塑性使液滴完全凝胶化,形成微异形载细胞凝胶;改变两相流速和流道的塑性结构,生成不同体积、形状的凝胶。然后形成的凝胶再次利用液滴微流控两相流包裹技术,完成载细胞凝胶/药物溶液/凝胶的包裹,形成双层载细胞凝胶。本发明提供的异形载细胞凝胶的制备放置,可改变混至内相的细胞种类和浓度的不用,以及包裹的药物种类不同,可实现不同功能的凝胶。
上述微异型载细胞海藻酸凝胶在工程器官移植、损伤器官和组织修复中的应用也在本发明的保护范围之内。
本发明通过改变细胞种类、细胞密度、凝胶之间溶液种类等可以制备出不同功能的凝胶,可以广泛应用于各类工程器官移植、损伤器官和组织修复中,满足其不同的功能需求。
在去油模块中,改变凝胶进入的水相所包含的药物,匹配凝胶内所含细胞,即可使最终制备出的载细胞凝胶具有不同的功能。
本发明还保护一种用于工程器官移植、损伤器官和组织修复的材料,所述微异型载细胞海藻酸凝胶制备得到。
与现有技术相比,本发明的有益效果是:
本发明提供了一种微异型载细胞海藻酸凝胶,由内至外依次为:细胞和营养液—内层异型凝胶—药物溶液—外层凝胶,内层异型凝胶为细胞定向繁殖提供生物支架;药物溶液使细胞产生功能性分化,形成特定组织/器官的细胞群;外层凝胶保证内部物质的相对独立性。
本发明的制备方法通过利用微流控芯片控制两相流的表面张力和剪切力作用形成均一性较好的凝胶液滴,再以微流道的微结构特性作塑性,快速、大通量形成微异形载细胞凝胶。
本发明的制备方法还可以通过改变细胞种类、细胞密度制备出不同功能的凝胶,去油模块中通过改变凝胶进入的水相所包含的药物,匹配凝胶内所含细胞,最终制备出的载细胞凝胶具有不同的功能,可以广泛应用于各类工程器官移植、损伤器官和组织修复中,满足其不同的功能需求。
附图说明
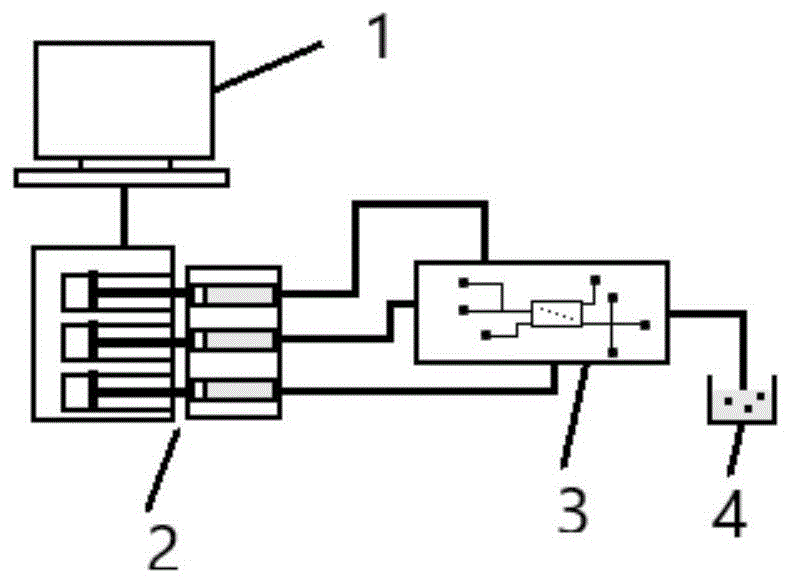
图1为微流控制备微异型载细胞凝胶系统,1:控制系统2:驱动模块3:集成微流控芯片4:收集系统。
图2为集成微流控芯片,1:内层液滴生成;2:凝胶去油;3:外层凝胶液滴生成;4:聚集增强凝胶化;5:内层凝胶液滴塑性;6:去油微结构。
图3为制备过程流程图:a:内层异型凝胶制备;b:凝胶去油;c:外层凝胶制备。
图4为实施例1制备的内层异型凝胶的形貌图。
图5为实施例2制备的内层异型凝胶的形貌图。
图6为实施例2的球形凝胶生成规律。
图7为实施例2制备的微异型载细胞海藻酸凝胶的形貌图(200μm)。
具体实施方式
附图仅用于示例性说明,不能理解为对本专利的限制;为了更好说明本实施例,附图某些部件会有省略、放大或缩小,并不代表实际产品的尺寸;对于本领域技术人员来说,附图中某些公知结构及其说明可能省略是可以理解的。附图中描述位置关系仅用于示例性说明,不能理解为对本专利的限制。
实施例1
一种微异型载细胞海藻酸凝胶,微异型载细胞海藻酸凝胶为四层结构,由内至外依次为:细胞和营养液(种子细胞如:胚胎干细胞、多能干细胞等,营养液:氨基酸、维生素、葡萄糖以及无机盐等细胞生成增殖所需的正常成分)—内层异型凝胶—药物溶液,如表皮生长因素、成纤细胞生长因素等,针对所需而选择不同药物—外层凝胶,内层异型凝胶为棒形,外层凝胶为球形。
其中内层异型凝胶为细胞定向繁殖提供生物支架;药物溶液使细胞产生功能性分化,形成特定组织/器官的细胞群;外层凝胶保证内部物质的相对独立性。由于凝胶可降解,在内部细胞完成培养分化后由于凝胶的降解释放细胞群,细胞群依靠凝胶的降解,逐步与其他同类型细胞群发生联系、相互作用,形成更大的细胞群,最终形成所需的组织/器官。
具体制备方法如下:
s1.制备内层异性凝胶:将含有种子细胞和凝胶材料的溶液作为内相,将具有一定生物相容性的油相作为外相,利用两相流进行液滴生成形成凝胶液滴,再通过流道对凝胶液滴进行塑形,同时凝胶液滴本身发生凝胶化,进行定型,制备得到异型载细胞凝胶层;
s2.内层异性凝胶去油:使得s1制备的异型载细胞凝胶从油相进入药物溶液,完成去油过程;
s3.制备外层凝胶层:将内层凝胶和含药物的溶液包裹进凝胶中,利用两相流进行液滴生成形成外层凝胶层,制备得到所述微异型载细胞海藻酸凝胶。
其中,s1中内相和油相的流速分别为:内相(氯化钙流速为50μl/h,海藻酸钠流速为100μl/h),外相油相流速150μl/h。
s3中外层凝胶和药物溶液的流速分别为:外层凝胶和含内层凝胶的药物溶液流速均为150μl/h。该部分主要形成聚焦效果,使药物溶液被两端凝胶溶液夹持包裹,然后油相对聚焦流进行剪切形成液滴。可根据外层凝胶层厚度需要进行流速调整,现有文献资料可查知聚焦效果一般规律为中间流速不变形况下,两端流速越高,聚焦出的内相流体越细,即药物溶液在药物溶液和凝胶溶液中的占比越小。
具体的制备系统主要由四部分组成,如图1所示:控制系统、驱动模块、集成微流控芯片以及收集系统:
其中控制系统用于控制驱动模块的驱动力,即注射泵参数,以调节流体进入微流控芯片的流速,从而达到液滴生成的生成速率、液滴大小等控制。
驱动模块主要给液体流动提供流动动力,一般常用注射泵作为动力源,注射泵的精度决定了流体在微流控芯片中的最小流动速率,而注射泵的稳定性决定了微流控芯片中流体流动的稳定性。
集成微流控芯片是把内层异型载细胞凝胶的制备、凝胶去油、外层凝胶制备三大模块集成到芯片中,注射原料流体一步生成最终所需要的凝胶原料,避免了中间移液加液等实验室的操作。
收集系统用于收集最终生成的凝胶原料,以及在制备过程中,产生的废液(如去油模块中,凝胶从油相进入到水相,该油相已完成其作用作为废液流出)。
整个系统最关键的部分为集成微流控芯片,如图2所示,芯片主要分为三大模块,一是内层异型凝胶的制备,二是凝胶去油处理,三是外层凝胶的制备。
在图2和和图3(a),利用液滴微流控液滴生成的两相流原理,内相为含有种子细胞和凝胶材料的溶液,外相为具有一定生物相容性的油相。对两相流的流速进行控制,制备出不同体积的凝胶液滴,再通过流道对凝胶液滴进行塑形,同时凝胶液滴本身发生凝胶化,进行定型,对两相流速的控制可以形成不同体积大小的液滴,在经过塑形和定型后,所制备的凝胶的尺寸有所差;
在图2和和图3(b),为内层凝胶的去油:
凝胶通过微结构,迫使凝胶从油相进入到带有药物的水相中,完成去油过程。同时,使凝胶处于药物溶液环境中,便于后于的药物通过凝胶层进入到内部处理细胞;
在图2和和图3(c),再次利用两相流进行液滴生成,这个过程把内层凝胶和含药物的溶液包裹进凝胶中,形成外层凝胶包裹,最终形成异型载细胞凝胶。
实验结果如图4所示,可以看出所制备出的凝胶由于流道的现状,形成扁条状。同时可以看出其生成间隔和形状基本一直。
实施例2
一种微异型载细胞海藻酸凝胶,微异型载细胞海藻酸凝胶为四层结构,由内至外依次为:细胞和营养液—内层异型凝胶—药物溶液—外层凝胶,内层异型凝胶为棒形,外层凝胶为球形。
种子细胞如:胚胎干细胞、多能干细胞等;
营养液:氨基酸、维生素、葡萄糖以及无机盐等细胞生成增殖所需的正常成分。
具体制备方法如下:
s1.制备内层异性凝胶:将含有种子细胞和凝胶材料的溶液作为内相,将具有一定生物相容性的油相作为外相,利用两相流进行液滴生成形成凝胶液滴,再通过流道对凝胶液滴进行塑形,同时凝胶液滴本身发生凝胶化,进行定型,制备得到异型载细胞凝胶层;
s2.内层异性凝胶去油:使得s1制备的异型载细胞凝胶从油相进入药物溶液,完成去油过程;
s3.制备外层凝胶层:将内层凝胶和含药物的溶液包裹进凝胶中,利用两相流进行液滴生成形成外层凝胶层,制备得到所述微异型载细胞海藻酸凝胶。
其中,s1中内相和油相的流速分别为:内相(氯化钙流速为50μl/h,海藻酸钠流速为100μl/h),油相流速100μl/h;
s3中外层凝胶和药物溶液的流速分别为:均为100μl/h,其作用如实例1所述。
s1的实验结果如图5所示,相比于实例1,保持内相流速不变,降低了油相流速,使生成的液滴体积增加。该液滴在相同流道尺寸下,由于体积增大,是其形成长宽轴比不同的扁条状凝胶。
s3部分生成球形凝胶与球形液滴生成原理一致,其液滴大小尺寸,生成规律如图6所示:在内相流速固定不变情况下,生成液滴直径随油相流速增加而降低,生成速度则升高。
以50μl/h和220μl/h分别为内外相流速,生成水液滴为例,结果如图7所示,可以看出液滴呈球形,且大小形成基本一致。
微异型载细胞海藻酸凝胶生成的均一性主要从尺寸形态上可以看出,从上述图片结果可以看出,本发明利用微流控芯片控制两相流的表面张力和剪切力作用形成均一性较好的凝胶液滴,再以微流道的微结构特性作塑性,快速、大通量形成均一的微异形载细胞凝胶。
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!