苯达莫司汀组合物及其用途的制作方法
本发明涉及包含苯达莫司汀及其盐、环糊精以及任选的稳定剂的组合物及其用途。
背景技术:
苯达莫司汀用于治疗多种癌症,包括白血病、霍奇金病和多发性骨髓瘤。当前商品名为treandatm的产品说明书要求将重建产品(30分钟内)稀释到500毫升的稀释剂(生理盐水、2.5%葡萄糖/0.45%盐水)中以供输液,以100mg/m2输液30分钟或以120mg/m2输液60分钟。商品名balrapzo与treanda稀释的混合物在2~8℃下可存储24小时,在室温(15~30℃)下可存储3小时,由于苯达莫司汀在水中的高度不稳定性,与生理盐水和2.5%葡萄糖/0.45%盐水配伍后必须要在3小时内输液完成。
当前批准的苯达莫司汀冻干粉(如treanda)需要占用15-30分钟的重构时间,重构过程伴随着分解,重构后需要及时稀释后在3小时内给病人输液完毕。
即用型苯达莫司汀(如bendeka)虽然无需重构,但是使用的丙二醇降低peg酯的形成。杂质种类远多于treanda,并且丙二醇具有一定的潜在风险,会导致肾衰竭和心律失常。
另外,对于需要使用苯达莫司汀进行治疗的患者来说,如果患者患有严重心脏疾病、急性左心衰竭、充血性心力衰竭、肾衰竭、肝硬化、腹水、脑水肿、特发性水肿、高血压、低钾血症等疾病时,应尽量避免使用生理盐水。然而已有的市售产品用5%葡萄糖稀释1小时后含量就低于95%,无法在临床上使用。0.9%生理盐水配置后,从配制到输液完毕也不能超过3小时。同时,2.5%葡萄糖/0.45%盐水并非常用输液,当医院没有库存时往往将一瓶250ml的5%葡萄糖和一瓶250ml0.9%生理盐水混合注入一个500ml的输液袋中,增加了染菌风险和配制时间。并且,2.5%葡萄糖/0.45%盐水也仅仅将患者的氯化钠负担下降了一半。
而对于一些需要控制糖类摄入如糖尿病病人,或者需要同时控制盐分和糖类摄入的病患如三高综合征病人来说,0.45%盐水、2.5%葡萄糖/0.45%盐水、2.5%葡萄糖甚至注射用水配制的苯达莫司汀注射液可以更好的消除患者的风险与担忧。鉴于上述问题,本发明旨在提供一种可以稀释到0.2~100mg/ml的苯达莫司汀制剂,同时满足低盐、低糖、无盐、无糖病人的需求,并能在稀释后长时间稳定,降低了快速增长的杂质带来的风险,提高了临床用药的便利性,降低遗弃药品的量这将有重大的意义,这也正是本发明提供的制剂开发的目标。
技术实现要素:
一直以来,公知的是苯达莫司汀或其盐(api)不能与5%葡萄糖配伍,如果病人需要减少氯化钠摄入,只可使用2.5%葡萄糖/0.45%氯化钠溶液进行输液。我们通过研究,出乎意料的发现一种包含苯达莫司汀或其盐的组合物,它经5%葡萄糖稀释后可以稳定3小时以上,为不能摄入过多氯化钠的患者提供了使用苯达莫司汀或其盐进行治疗的希望。
本发明主要在于提供了一种包含苯达莫司汀或其盐的组合物,其经5%葡萄糖溶液稀释至api的浓度为0.2mg/ml时,在室温(15~30℃)和自然光照下可提供至少3小时的稳定性(不高于5wt%的api降解)。本文中所述的“稳定性”是指包含苯达莫司汀或其盐的组合物在重构或稀释后,苯达莫司汀或其盐降解5wt%所需的时间。可以理解地是,苯达莫司汀或其盐降解5wt%所需的时间越长或苯达莫司汀或其盐在规定的时间降解的越少,则苯达莫司汀或其盐的重构溶液或稀释溶液越稳定。本文中的稳定性包括冷藏稳定性和室温稳定性,其中冷藏稳定性是指在2-8℃下的稳定性,室温稳定性是指在15-30℃下的稳定性。
本发明提供了一种包含苯达莫司汀或其盐的组合物,其经0.9%氯化钠溶液稀释至api的浓度为0.2mg/ml时,在室温(15~30℃)和自然光照下可提供至少6小时的稳定性(不高于5wt%的api降解)。
本发明提供了一种包含苯达莫司汀或其盐的组合物,该组合物可用注射用水,0.9%氯化钠,0.45%氯化钠2.5%葡萄糖/0.45%氯化钠,2.5%葡萄糖,5%葡糖糖进行重构和稀释。
本发明提供了一种包含苯达莫司汀或其盐的组合物,该组合物经注射用水,0.9%氯化钠,0.45%氯化钠2.5%葡萄糖/0.45%氯化钠,2.5%葡萄糖,5%葡糖糖进行重构和稀释至api的浓度为大于0.2mg/ml,例如0.6、1.0、2.5、5、10、16、25、100mg/ml时,在室温(15~30℃)和自然光照下可提供至少3小时的稳定性(不高于5wt%的api降解),且随着稀释浓度的升高,稳定性也更好。0.2mg/ml等数值并非固定,本组合物可稀释至api的浓度在0.2~100mg/ml范围内的任意浓度,均可不因溶解度受限而析出,也均能在室温(15~30℃)和自然光照下可提供至少3小时的稳定性(不高于5wt%的api降解)。
研究中,我们还发现,氯化钠的存在会降低苯达莫司汀的溶解度,使得不能获得更小的输液体积,本发明中的组合物使得苯达莫司汀浓度在0.2~100mg/ml可以不因溶解度不够而析出,因此在患者需要更小体积的输液时可以得到满足,本发明中的组合物可以稀释成1~500ml以供患者使用。例如:按100mg/m2剂量,一个bsa为1的病人需要100mg的苯达莫司汀,本发明的组合物可以用稀释剂稀释至1ml获得100mg/ml的药液,可稀释至4ml获得25mg/ml的药液,可稀释至10ml获得10mg/ml的药液,可稀释至20ml获得5mg/ml的药液可稀释至50ml获得2mg/ml的药液,可稀释至100ml获得1mg/ml的药液,可稀释至250ml获得0.4mg/ml的药液,可稀释至500ml获得0.2mg/ml的药液。这些稀释剂可以是注射用水、生理盐水、5%葡萄糖、2.5%葡萄糖、0.45%氯化钠、0.45%氯化钠/2.5%葡萄糖等。稀释后药液没有晶体析出,并提供不少于3小时以上的输液时间。
本发明提供了一种包含苯达莫司汀或其盐的组合物,所述组合物用注射用水,生理盐水进行重构后,于2~8℃避光环境下,至少可贮存28天(不高于5wt%的api降解),治疗周期第一天重构的药液将可以保存到治疗周期的第28天,以减少患者经济损失。市售冻干粉重构后无法在2~8℃稳定28天(api降解小于5wt%)。
本发明的一些实施例包含的苯达莫司汀为苯达莫司汀,或苯达莫司汀盐酸盐,或其他苯达莫司汀盐。
在本发明的一些实施例中,所述组合物包含环糊精。虽然环糊精可以通过亲酯性的内腔提高难溶性药物的溶解度和稳定性,但对水溶性的药物稳定性和溶解性改善的研究并不多。
环糊精是一类种类繁多的环多糖,它可以是6~7个多元环构成的筒状超分子结构,根据衍生化基团的不同,可以分为甲基化环糊精,羟丙基环糊精,磺丁基环糊精等,根据多元环的个数可以分为α-环糊精、β-环糊精、γ-环糊精等;根据ph可以分为碱性环糊精、酸性环糊精、中性环糊精等。
我们在研究过程中意外的发现,同一种类相同质量比的环糊精和苯达莫司汀组合物溶解后在室温下会出现稳定性不一致的情况。这严重影响苯达莫司汀环糊精包合制剂临床使用的安全性。经反复对比不同厂家与批次的不同种类环糊精,我们发现环糊精衍生物制备过程需使用氢氧化钠产生碱性环境,再使用盐酸或强酸型离子交换树脂等手段去除氢氧化钠和氯化钠。
对苯达莫司汀稳定性影响最大的是含有氢氧化钠残留的一类环糊精,氢氧化钠的存在使环糊精产品ph偏碱性,苯达莫司汀及其盐会加速降解,导致杂质异常增多。
残存的氢氧化钠可以被阳离子交换除去,获得不存在氢氧化钠和/或氯化钠的环糊精。这一类的环糊精在与苯达莫司汀的组合物稳定性在同重量比的情况下较差,尤其与葡萄糖配伍的时候更加显著。
含氯环糊精由残留氢氧化钠中和形成氯化钠,经过或不经过脱盐,最终氯离子含量在0.001~5wt%范围。虽然苯达莫司汀会比同质量脱盐的环糊精组合后更稳定,并且苯达莫司汀稳定性伴随氯离子含量的升高而升高。但不同厂家、不同工艺、不同批次、不同种类的环糊精存在较大的氯离子残留差异,不同的脱除氯化钠的工艺可使环糊精中氯离子含量在0~5%(w/w%)内浮动,1克环糊精附带的氯化钠约为0~50mg。环糊精与苯达莫司汀质量比越大,氯离子与苯达莫司汀的质量比也越大。苯达莫司汀的制剂中,氯离子担负着稳定剂的作用,过高的氯离子含量不仅威胁低钠饮食患者的生命健康,也不利于产品质量复杂引起的潜在质量隐患。稳定剂的加入可以降低环糊精的用量,减轻肾功能受损患者的使用风险。若合理控制环糊精中氯含量,同时调整稳定剂的用量,则可获得更好的稳定性和质量均一的苯达莫司汀制剂。
本专利采用氯离子含量为0~5%(w/w)的环糊精进行苯达莫司汀及其盐的稳定性改良,优选氯离子含量为0~3%(w/w),进一步优选氯离子含量为0~1%(w/w),例如0.01~1%(w/w)的环糊精进行苯达莫司汀及其盐的稳定性改良。如本文中所使用的,含氯环糊精是指含有氯化钠的环糊精,环糊精中氯含量是指氯化钠相对于环糊精的质量百分数。
本发明的一些实施例中的环糊精是磺丁基-β-环糊精。磺丁基-β-环糊精的取代度可以是1~11,以取代度6~7应用最为广泛。
本发明的一些实施例中的环糊精是羟丙基-β-环糊精。羟丙基-β-环糊精的取代度可以是1~11,以取代度4~9应用最为广泛。
在一些更优选的实施例中,环糊精是磺丁基-β-环糊精。
本发明的一些实施例中的稳定剂包括氯化钠,氯化胆碱等含有氯元素的无机物或有机物,稳定剂有助于协同环糊精提供不差于仅含环糊精的组合物。
本发明的一些实施例中的稳定剂包括聚乙烯吡咯烷酮(如,pvpk12,pvpk17,pvpk30),硫辛酸,硫代甘油等,稳定剂有助于协同环糊精提供不差于仅含环糊精的组合物。
本发明通过调节环糊精中氯含量和稳定剂的含量可以抑制苯达莫司汀及其盐的降解作用和缩短苯达莫司汀及其盐的溶解时间,实现苯达莫司汀在低钠环境中使用的巨大优势。
本发明还可根据公知的方案增加抑菌剂,渗透压调节剂等。
本发明还可根据公知的方案增加冻干保护剂或支撑剂,如甘露醇等。冻干保护剂或支撑剂用于改变冻干粉形态和复溶时间。
本发明中的苯达莫司汀及其盐与环糊精的质量比是1:5~100,更高的环糊精比例虽然能提供更好的稳定性,但存在现实条件下的成本,辅料安全性等问题。质量比1:5~100的所有个别值和子范围包含在本文中且公开在本文中。例如,苯达莫司汀及其盐与环糊精的质量比可以为1:5-24,也可以为1:24-100。
本发明中的苯达莫司汀及其盐与稳定剂的质量比是1:0~5。质量比1:0~5的所有个别值和子范围包含在本文中且公开在本文中。
本发明中的组合物可以通过冷冻干燥,喷雾干燥制备制成干粉制剂。冻干前的溶液中苯达莫司汀的浓度可以是0.2~100mg/ml。0.2~100mg/ml的所有个别值和子范围包含在本文中且公开在本文中。
另外,本发明提供包含上述稀释剂的组合物或注射液,其包含苯达莫司汀或其盐,环糊精,任选的稳定剂和稀释剂,其中苯达莫司汀或其盐与环糊精的质量比为1:5~1:100,并且所述稀释剂选自由注射用水、0.9%氯化钠、0.45%氯化钠、0.45%氯化钠/2.5%葡萄糖、2.5%葡萄糖和5%葡萄糖所组成的组。在一些实施例中,所述稀释剂为5%葡萄糖。
本发明还提供了一种预防或治疗癌症的方法,包括向受试者提供苯达莫司汀或其盐的浓度为0.2~100mg/ml的注射液,其中所述注射液包括苯达莫司汀或其盐、环糊精、任选的稳定剂和稀释剂,所述苯达莫司汀或其盐与所述环糊精的质量比为1:5~100。
本发明还提供了根据本发明所述的组合物在制备用于治疗癌症的药物中的用途。所述癌症选自有慢性淋巴细胞白血病、霍奇金淋巴瘤、非霍奇金淋巴瘤、多发性骨髓瘤和乳腺癌构成的组。
除非另外定义,否则本文使用的所有技术和科学术语都具有与本领域的普通技术人员通常所理解的意义相同的意义。
附图说明
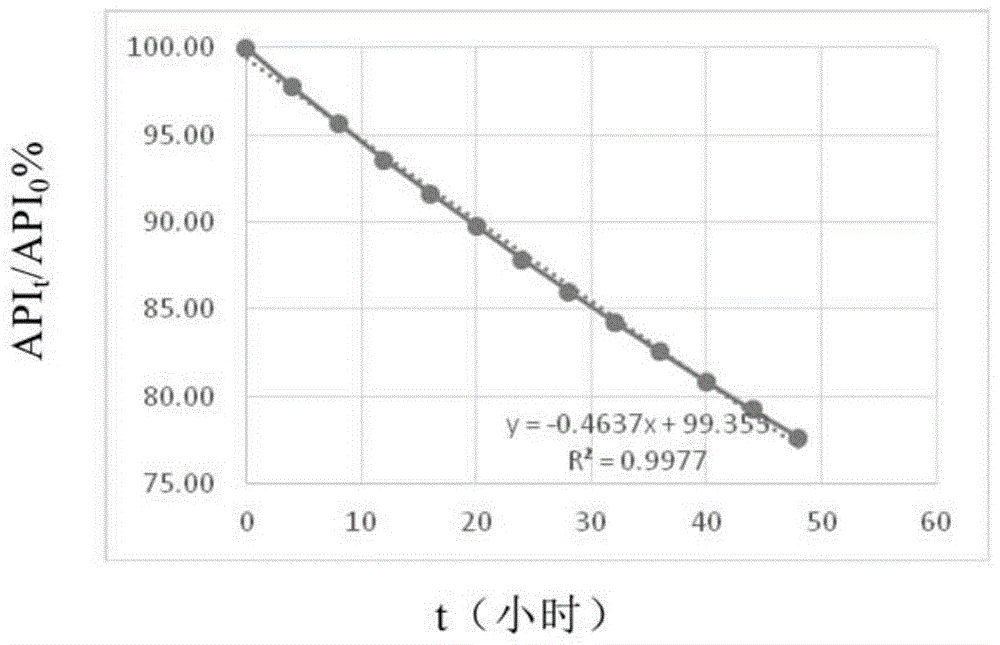
图1示出了实施例1中的api的含量百分比随时间t(小时)的变化曲线。
图2示出了实施例16中的冻干粉的x射线粉末衍射图。
实施例
以下实施例用于进一步阐述本发明,但不以任何方式限制本发明的有效范围。
实施例中hplc法测定含量与有关物质参照美国药典关于苯达莫司汀原料和制剂制定的usp43草案。hplc方法如下所示:
实施例中室温如无特殊说明,指的是15~30℃。
实施例中冷藏如无特殊说明,指的是2~8℃。
实施例中的冷冻干燥也可替换为喷雾干燥等其他干燥手段。
实施例中0.9%氯化钠注射液也可以是生理盐水,0.45%氯化钠/2.5%葡萄糖注射液也表述为2.5%葡萄糖/0.45%氯化钠注射液或半盐半糖注射液等等同的描述。
实施例中使用的术语“干粉”或“干粉制剂”是指通过连续干燥如喷雾干燥或流化床干燥非水性溶液或水性溶液或水性溶液和非水性溶液的组合获得的任何固体材料。以下实施例中未注明具体条件的,均按本领域常规条件或制造商建议的条件进行。
实施例中所示出的api为苯达莫司汀盐酸盐。
实施例1
组合物中的api经0.9%氯化钠稀释至0.2mg/ml后室温放置48小时稳定性
用注射用水溶解800mg磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)定容至2ml后,降温到4℃,加入api,搅拌至全溶约5分钟,用0.22μm滤器过滤,用0.9%氯化钠稀释至0.2mg/ml,室温下放置,hplc测定48小时稳定性。数据如下表所示:
根据上述数据,以时间为横坐标,api百分比为纵坐标作图(见附图1),可见api含量的下降呈线性,降解速率没有明显的受到环糊精的影响,api与环糊精的结合作用不至于影响药物的释放。
实施例2
搅拌温度对冻干前溶液的杂质影响
用注射用水溶解2400mg磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)定容至4ml后,分别控温到4、10、20℃,加入api,搅拌至全溶约5分钟,继续搅拌30分钟,用0.22μm滤器过滤,用0.9%氯化钠稀释至0.2mg/ml,hplc测量0小时含量与杂质。数据如下表所示:
注:hp1杂质是苯达莫司汀最主要的降解杂质,苯达莫司汀在水性溶液中稳定时间短主要是由于水解产生hp1。hp1的结构式如下:
由上表数据可知,磺丁基-β-环糊精使得苯达莫司汀在较高温度下制备成为可能,并不一定要依照现有制剂工艺在4~15℃下方能制备。
实施例3
组合物经不同稀释溶剂稀释后的稳定性
用注射用水溶解2400mg磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)定容至4ml后,加入api,搅拌至全溶约5分钟,继续搅拌30分钟,用0.22μm滤器过滤,用相应稀释溶剂稀释至0.2mg/ml,hplc测24小时冷藏稳定性和6小时室温稳定性。数据如下表所示:
24小时冷藏稳定性
由上表可见,用0.9%氯化钠或5%葡萄糖稀释至0.2mg/ml,冷藏放置24小时后,api含量几乎没有改变,组合物稳定性得到了较大的改善。
6小时室温稳定性
由上表可见,用注射用水,5%葡萄糖,2.5%葡萄糖,2.5%葡萄糖/0.45%氯化钠,0.45%氯化钠,0.9%氯化钠稀释到0.2mg/ml后,至少可以提供不低于三小时的稳定时间(api降解小于5%)。
实施例4
组合物中的api经不同稀释溶剂稀释至不同浓度后在4℃下的析晶考察
用注射用水溶解2400mg磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)定容至4ml后,加入api,搅拌至全溶约5分钟,继续搅拌30分钟,用0.22μm滤器过滤,用相应稀释溶剂稀释至100mg/ml,2~8℃冷藏,观察24h和28天的析晶情况:
由上表可见,组合物中苯达莫司汀或其盐可以在各种稀释溶剂中获得0.2~100mg/ml的溶解度,在临床使用时不会应溶解度小而析出。
实施例5
含羟丙基-β-环糊精的组合物用5%葡萄糖稀释后的稳定性
用注射用水溶解相应处方量的环糊精定容至相应体积后,降温到4℃,加入api,搅拌至全溶约5分钟,用0.22μm滤器过滤,用5%葡萄糖稀释至0.2mg/ml,室温下放置,hplc测定6小时稳定性。数据如下表所示:
由上表可知,羟丙基-β-环糊精(羟丙基-β-环糊精中的氯含量为0.08重量%)可用于提供不低于三小时的稳定时间(api降解小于5%)的组合物。
实施例6
包含不同质量比的api与磺丁基-β-环糊精的组合物经5%葡萄糖稀释后的稳定性
用注射用水溶解相应处方量的磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)定容至相应体积后,降温到4℃,加入api,搅拌至全溶约5分钟,用0.22μm滤器过滤,用5%葡萄糖注射液稀释至0.2mg/ml,室温下放置,hplc测定6小时稳定性。数据如下表所示:
由上表可知,随着环糊精比例的变大,组合物中的api用5%葡萄糖稀释至0.2mg/ml后,api降解速度越来越小。
实施例7
含氯化钠的组合物经5%葡萄糖稀释后的稳定性
用注射用水溶解相应处方量的磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)和氯化钠定容至相应体积后,降温到4℃,加入api,搅拌至全溶约30~120分钟,用0.22μm滤器过滤,用5%葡萄糖注射液稀释至0.2mg/ml,室温下放置,hplc测定6小时稳定性。数据如下表所示:
加入氯化钠的处方溶解时间比不加氯化钠的组合物要长,不加氯化钠的处方溶解时间约为5分钟,加氯化钠的处方溶解时间在5~120分钟不等。
实施例8
含有具有不同氯含量的环糊精的组合物用5%葡萄糖稀释后的稳定性
磺丁基-β-环糊精a的氯含量低于检测线,视为0;
磺丁基-β-环糊精b的氯含量为0.01%,
磺丁基-β-环糊精c的氯含量为1%,
磺丁基-β-环糊精d的氯含量为3%。
用注射用水溶解相应处方量的环糊精定容至相应体积后,降温到4℃,加入api,搅拌至全溶约5分钟,用0.22μm滤器过滤,用5%葡萄糖稀释至0.2mg/ml,室温下放置,hplc测定6小时稳定性。数据如下表所示:
由上表可知,同样质量比的环糊精和苯达莫司汀因氯含量的升高而显示出更好的稳定性。
实施例9
含有不同质量比的pvpk12的组合物经5%葡萄糖稀释后的稳定性
用注射用水溶解相应处方量的磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)和pvpk12定容至相应体积后,降温到4℃,加入api,搅拌至全溶约5分钟,用0.22μm滤器过滤,用5%葡萄糖注射液稀释至0.2mg/ml,室温下放置,hplc测定6小时稳定性。数据如下表所示:
实施例10
含pvpk12与氯化钠的组合物用5%葡萄糖稀释后的稳定性
用注射用水溶解相应处方量的磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)和pvpk12和氯化钠定容至相应体积后,降温到4℃,加入api,搅拌至全溶约30分钟,用0.22μm滤器过滤,用5%葡萄糖注射液稀释至0.2mg/ml,室温下放置,hplc测定6小时稳定性。数据如下表所示:
实施例11
不同稀释终浓度(0.6、1.0、2.5、5、10、16mg/ml)的稳定性
用注射用水溶解相应处方量的磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)定容至相应体积后,降温到4℃,加入api,搅拌至全溶约5分钟,用0.22μm滤器过滤,制备成冻干粉。用5%葡萄糖注射液稀释至0.6、1、2.5、5、10、16mg/ml,室温下放置,hplc测定6小时稳定性。数据如下表所示:
由上表可见,随着稀释终浓度的升高,3小时和6小时api降解率也逐渐减小。当以100~120mg/m2体表面积(bsa)计算给药时,1~3m2需要100~360mg的苯达莫司汀,稀释到500ml时,苯达莫司汀浓度为0.2~0.72mg/ml,稀释到250ml时,苯达莫司汀的浓度为0.4~1.44mg/ml稀释到100ml时,苯达莫司汀的浓度为1~3.6mg/ml,稀释到50ml时,苯达莫司汀的浓度为2~7.2mg/ml,稀释到25ml时,苯达莫司汀的浓度为4~14.4mg/ml。对于需要减少输液体积的患者,都可以获得足够不析出的溶解度和不低于3小时的稳定时间(api降解不大于5%)。
实施例12
不同重构浓度的重构时间及5%葡萄糖稀释稳定性
用注射用水溶解相应处方量的磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)定容至相应体积后,降温到4℃,加入api,搅拌至全溶约5分钟,用0.22μm滤器过滤,用冻干机制备成冻干粉。
冻干曲线为:隔板预冷温度为5℃,在-50℃冻结6小时,-20℃一次干燥48小时,30℃二次干燥6小时。预冻,一次干燥,二次干燥的温度和时间可根据需要调节。
用5%葡萄糖注射液重构至2.5、10、25mg/ml,记录重构时间,重构后继续用5%葡萄糖注射液稀释至0.2mg/ml,室温下放置,hplc测定6小时稳定性。下表为重构时间:
下表为稳定性数据:
由重构时间和稀释稳定性数据可见,重构体积越大,重构时间越短,重构时间也远小于15分钟,不同重构体积样品用5%葡萄糖稀释至0.2mg/ml后,都可以提供大于3小时的稳定性。
实施例13
不同冻干体积组合物经5%葡萄糖注射液稀释后的稳定性
用注射用水溶解相应处方量的磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)定容至相应体积后,降温到4℃,加入api,搅拌至全溶约5分钟,用0.22μm滤器过滤,用冻干机制备成冻干粉。用5%葡萄糖注射液重构至25mg/ml,重构后继续用5%葡萄糖注射液稀释至0.2mg/ml,室温下放置,hplc测定6小时稳定性。下表为稳定性数据:
由稀释稳定性数据可见,不同的冻干体积样品用5%葡萄糖稀释至0.2mg/ml后,都可以提供大于3小时的稳定性。
实施例14
不同体积的冻干粉40℃加速15天的稳定性
用注射用水溶解相应处方量的磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)定容至相应体积后,降温到4℃,加入api,搅拌至全溶约5分钟,用0.22μm滤器过滤,用冻干机制备成冻干粉。用5%葡萄糖注射液重构至25mg/ml,重构后继续用5%葡萄糖注射液稀释至0.2mg/ml,室温下放置,hplc测定含量变化。下表为稳定性数据:
综合稳定性数据,组合物预计可以在2~15℃的环境下提供不少于两年的货架期。
实施例15
不同处方中的api重构至25mg/ml后28天稳定性
用注射用水溶解相应处方量的磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)、氯化钠、pvpk12定容至相应体积后,降温到4℃,加入api,搅拌至全溶,用0.22μm滤器过滤,用冻干机制备成冻干粉。用注射用水重构至25mg/ml,重构后继续用5%葡萄糖注射液稀释至0.2mg/ml,室温下放置,hplc测定6小时稳定性。下表为0天稳定性数据:
下表为28天稳定性数据:
由数据可知,组合物冻干粉经重构后可以在冷藏环境下放置28天保持良好的稳定性,可以提供0.2mg/ml的5%葡萄糖稀释液具有3小时的稳定时间,以保证临床的使用。
实施例16
冻干粉的x射线粉末衍射
用注射用水溶解相应处方量的磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)定容至相应体积后,降温到4℃,加入api,搅拌至全溶约5分钟,用0.22μm滤器过滤,用冻干机制备成冻干粉用于粉末x射线衍射测定2θ角。结果显示没有尖锐晶型特征峰(见图2)。
实施例17
0.9%氯化钠稀释组合物稳定性
用注射用水溶解相应处方量的磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)定容至相应体积后,降温到4℃,加入api,搅拌至全溶约5分钟,用0.22μm滤器过滤,用冻干机制备成冻干粉。用生理盐水重构至25mg/ml,重构后继续用0.9%氯化钠稀释至0.2、0.6mg/ml,室温下放置,hplc测定稳定性。下表为稳定性数据:
由上表可知,苯达莫司汀组合物在0.9%氯化钠中的稳定性显著提高。稀释终浓度越高,稳定性也越好。
实施例18
仿市售产品稳定性
按照bendeka与treanda的说明书配制仿市售制剂,分别用2.5%葡萄糖/0.45%盐水、5%葡萄糖、0.9%氯化钠稀释至0.2mg/ml,室温放置,考察稳定性。数据如下表所示:
由上表可知,现有的产品在0.2mg/ml浓度下无法与5%葡萄糖稳定配伍(3小时api降解小于5%)
实施例19
只有氯化钠或/和pvpk12的处方
用注射用水溶解相应处方量的稳定剂定容至相应体积后,降温到4℃,加入api,搅拌至全溶,用0.22μm滤器过滤。用5%葡萄糖注射液稀释至0.2mg/ml,室温下放置,hplc测定6小时稳定性。下表为稳定性数据:
由上表可知,氯化钠和pvpk12作为稳定剂,无法在缺失环糊精的情况下提供满足本专利要求的稳定性。
实施例20
包含硫代甘油的组合物经5%葡萄糖注射液稀释后的稳定性
用注射用水溶解相应处方量的磺丁基-β-环糊精(磺丁基-β-环糊精中的氯含量为0.08重量%)和硫代甘油定容至相应体积后,降温到4℃,加入api,搅拌至全溶约5分钟,用0.22μm滤器过滤,用5%葡萄糖注射液稀释至0.2mg/ml,室温下放置,hplc测定6小时稳定性。下表为稳定性数据:
实施例21
不同稀释剂和输注体积引起的氯化钠和/或葡萄糖摄入量
按bsa为3,120mg/m2计算不同稀释剂和输注体积引起的氯化钠和/或葡萄糖摄入量,结果如下表所示。
由上表可见,对于需要降低或免除氯化钠和/或葡萄糖的患者,不同的稀释剂和输液体积的调整可以很好的满足这部分患者的需求。以一次剂量为360mg计算,氯化钠作为稳定剂与苯达莫司汀质量比5:1,最高为1800mg氯化钠,此时使用注射用水稀释组合物后,依然比0.9%氯化钠,0.45%氯化钠,半盐半糖稀释剂所引起的氯化钠负担要少20~60%。
- 还没有人留言评论。精彩留言会获得点赞!