半乳寡糖及其衍生物在作为防治非酒精性脂肪肝药物中的应用的制作方法
本发明属于海洋药物领域,具体涉及一种含有d-半乳糖和l-半乳糖的寡糖及其衍生物在作为防治非酒精性脂肪肝药物中的应用。
背景技术:
非酒精性脂肪肝(nafld)是代谢综合征的肝脏表现,是全球最常见的慢性肝病。nafld是指排除过量饮酒、病毒感染或其他肝脏疾病,以肝脏脂肪异常累积为特点的临床病理综合征。nafld由一系列肝脏疾病组成,包括单纯肝脂肪变性、非酒精性脂肪性肝炎(nash)及nash相关性肝硬化和肝细胞癌。随着全球肥胖的流行,nafld的发病率不断上升,现已成为世界范围内最常见的慢性肝病。nafld是一种与胰岛素抵抗和遗传易感性相关的肝脏疾病,其确切机制目前尚不十分清楚。day等人提出“二次打击”学说,第一次打击是肝脏中甘油三酯(tg)累积增加,而第二次打击是脂质氧化应激诱发肝实质炎症,最终导致nash。研究人员还提出“多因素共同打击”学说,即在单纯脂肪变性之前或之后,炎症可能与多种因素如脂毒性、氧化应激和线粒体功能障碍共同促进nash的发生。迄今为止,没有任何药物制剂已被许可用于特定的nafld治疗。推荐的nafld治疗仍然局限于改变生活方式,包括调整饮食和适当的体力活动。因此,探索nafld发病的确切机制,鉴定nafld治疗的新靶点具有重要的临床意义。
肠道菌群是一组与宿主协同作用的共生微生物群。肠道菌群包含超过1x1014个细胞,超过1000种不同的细菌种类,基因组数量多达30万个基因,是人类基因组数量的150倍,被称为“人体第二基因组”。人体内的肠道菌群并非固定不变,它很容易受到遗传、饮食、药物及卫生环境等多种因素的影响。liu等人通过给予sd大鼠不同类型的饮食发现,高脂高糖饮食对nafld的诱导作用与热量摄入无关,而与肠道菌群的变化有关,提示肠道菌群可能在nafld的发病中起重要作用。由于肝脏和肠道通过门静脉相连,使肝脏更容易暴露于易位的细菌,细菌产物,脂多糖和炎症介质中。在某些病理条件下,肠道屏障的破坏可导致细菌及其代谢产物的易位和免疫系统的异常活化,引发肝脏炎症和损伤。肠-肝轴是指肠道与肝脏之间的相互作用,其作为连接肠道与肝脏的重要结构,在nafld的发病机制中起关键作用。
益生菌是指对宿主健康有益的活性微生物。在小鼠和啮齿动物的模型中,用鼠李糖乳杆菌和干酪乳杆菌菌株干预后,肝脏脂肪变性在生物化学和组织学水平均改善,揭示了肠道益生菌在饮食诱导nafld中的保护作用。肠道菌群可通过影响能量代谢、诱导内毒素血症、调节胆汁酸代谢等多种机制促进nafld的发病,由此可见肠道菌群在nafld发病机制中发挥重要作用。研究发现,nafld患者会出现小肠细菌过度生长以及肠道生态失调的现象。越来越多的研究证实,nafld与肠道微生物群之间的紧密关联,这也使得肠道微生物可能成为nafld早期诊断的潜在标志物。例如,loomba等人通过宏基因组学分析合并纤维化的nafld患者肠道微生物的改变,结果显示合并纤维化的nafld患者的大肠杆菌(escherichiacoli)和普通拟杆菌(bacteroidesvulgatus)丰度明显增加。益生元是指一组非消化性食物成分,可选择性地改变结肠中某些细菌的生长或活性,对人体健康产生益处。动物研究显示,在蛋氨酸-胆碱缺乏小鼠模型中,补充膳食果寡糖可使胃肠微生物群和肠上皮屏障功能恢复正常,并减少脂肪性肝炎。这表明益生元可通过调节肠道菌群来缓解nafld,为nafld的临床治疗治疗提供了新的方向和途径。
本团队研究表明,酸性多糖和寡糖(比如硫酸软骨素及其寡糖、硫酸角质素、岩藻聚糖硫酸酯和浒苔多糖(公开号cn108440681a)等)可作为益生元改善肠道菌群紊乱,进而发挥降血糖、降血脂、抗炎和改善代谢综合征作用。本团队研究还发现琼胶寡糖(公开号cn105168232a)具有降血脂等活性,岩藻聚糖硫酸酯具有抑制α-糖苷酶活性(公开号cn103288978a),褐藻胶寡糖及其衍生物具有改善胰岛素抵抗及降血糖活性(公开号cn101649004a,公开号cn101691410a)等,但迄今还没有发现含有红藻来源半乳寡糖及其衍生物可改善非酒精性脂肪肝小鼠肠道菌群紊乱的报道。红藻来源的半乳聚糖主要有三个结构系列,即卡拉胶系列、琼胶系列和紫菜胶系列,其中,卡拉胶系列的多糖与寡糖均由d-半乳糖及其硫酸酯衍生物组成(公开号cn1513880a,公开号cn101012249a,公开号cn101279991a),而琼胶和紫菜胶系列的多糖与寡糖则是由d-半乳糖和l-半乳糖二种糖残基及硫酸酯衍生物组成。琼胶与紫菜胶的不同在于前者含有较多的l-ang,而后者含有较多6-硫酸-l-gal(gal6s),单糖种类不同则理化性质和生物学功能也不同。例如,虽然卡拉胶及其寡糖作为喷剂具有抗病毒活性(公开号cn102516323a,公开号cn104546895a),但口服却有一定的安全隐患(shangq.,toxicollet.,2017,279:87-95),琼胶和紫菜胶及其寡糖口服则安全性很高,是海洋药物及功能食品开发的优质原料。由于半乳聚糖溶解性较差,结构序列不明确,致使其质量难控制,所以寡糖的制备与应用是近年来研究开发的重点。在琼胶寡糖制备技术方面,主要有酸法、酶法与化学法降解,不同方法能获得结构与活性不同的寡糖,例如酸法降解可以得到奇数琼胶寡糖(公开号cn1513860a),酶法降解得到偶数新琼胶寡糖(公开号cn102827899a;公开号cn109576328a),还原酸降解得到偶数糖醇(公开号cn100999537a),自由基降解则得到混合的琼胶寡糖(公开号cn109400756a);紫菜胶采用酸法降解(liuy.,etal,mardrugs.2018,16(3).pii:e82)或者酶法降解(zhangy.,etal,j.agr.foodchem.2019,67,9307-9313)均能获得紫菜胶寡糖等。本发明在已有的降解技术基础上,进一步对所制备的各种寡糖进行定向还原和氧化反应,得到了结构与序列不同且还原端含有糖醇或糖酸结构的新寡糖衍生物,并通过实验证明了这些半乳寡糖及衍生物能作为益生元,具有治疗非酒精性脂肪肝活性,可用做制备防治nafld、胰岛素抵抗和抗高脂血症和抗代谢综合征等相关疾病的药物及其功能制品。
技术实现要素:
本发明的目的是提供一种半乳寡糖及衍生物在作为防治非酒精性脂肪肝药物中的应用,从海洋红藻多糖中获得系列半乳寡糖及其衍生物,并证明其具有改善肠道微生物紊乱,在防治非酒精性脂肪肝等相关疾病中具有广阔应用前景。
为实现上述发明目的,本发明采用下述技术方案:
一种半乳寡糖及其衍生物在作为防治非酒精性脂肪肝药物中的应用,半乳寡糖及其衍生物的结构通式如下:
式中,r=-h或-so3na,n=0~30;
所述的半乳寡糖及其衍生物在作为防治非酒精性脂肪肝药物中的应用,以富含d-半乳糖/l-半乳糖及其衍生物的红藻多糖为原料,经物理降解、化学降解、酶法降解之一种或两种以上降解方法的组合,制备不同聚合度的寡糖及其衍生物,所制备的化合物结构中同时含有β-1,3-d-半乳糖(d-gal)残基和α-1,4-l-半乳糖(l-gal)残基,或同时含有d-gal与α-1,4-l-3,6-内醚半乳糖(l-ang)残基;在d-gal与l-gal糖残基的c6位羟基含有不同程度的硫酸酯基(gal6s);所制备寡糖的非还原端是gal,gal6s或ang,还原端是gal或糖醇(gal-oh)与糖酸(gal-ooh),或ang糖醇(ang-oh),或gal6s及其糖醇(gal6s-oh)与糖酸(gal6s-ooh)。
所述的半乳寡糖及其衍生物在作为防治非酒精性脂肪肝药物中的应用,该半乳寡糖及其衍生物采用下述制备工艺:
将红藻来源的琼脂糖(agarose)溶于60℃热水,用缓冲液配成10mg/ml溶液,放置于30℃水浴锅内添加β-琼胶酶(cas#37288-57-6)并搅拌降解4小时,冷却后离心,收集上清液,加3倍体积95%医用乙醇于4℃过夜,离心,收集沉淀并用水将其溶解,用200da透析袋透析脱盐,将内液旋蒸浓缩并冷冻干燥,得到新琼寡糖混合物,并进一步采用硼氢化钠还原得到新琼胶寡糖醇,或者用本尼迪克试剂氧化得到新琼胶寡糖酸;或者,将琼脂糖用60℃热水溶解,采用摩尔浓度0.1m稀盐酸配成10mg/ml溶液,于80℃搅拌降解0.5小时,冷却后用摩尔浓度2m的naoh水溶液中和,离心收集上清液,然后加2倍体积95%医用乙醇于4℃过夜,离心收集沉淀,将沉淀用水溶解后,用200da透析袋透析脱盐,旋蒸浓缩并冷冻干燥得到寡糖混合物,进一步采用硼氢化钠还原得到琼胶寡糖醇,或者采用本尼迪克试剂氧化得到琼胶寡糖酸;或者,将硫琼胶(agaropectin)用摩尔浓度0.1m稀硫酸配成10mg/ml水溶液,加热到60℃后搅拌降解1.5小时,冷却后用摩尔浓度2m的naoh水溶液中和,离心收集上清液,然后加入3倍体积95%医用乙醇于4℃过夜,离心收集沉淀,将沉淀溶水溶解后,用200da透析袋透析脱盐,之后旋蒸浓缩并冷冻干燥得到硫琼胶寡糖混合物,然后进一步经硼氢化钠还原得到硫琼胶寡糖醇,或者采用本尼迪克试剂氧化得到硫琼胶寡糖酸;或者,将紫菜胶(porphyran)用摩尔浓度0.1m稀硫酸配成10mg/ml水溶液,加热到80℃后搅拌降解2小时,冷却后用摩尔浓度2m的naoh水溶液中和,离心收集上清液,然后加入3倍体积95%医用乙醇于4℃过夜,离心收集沉淀,将沉淀用水溶解后,用200da透析袋透析脱盐,之后旋蒸浓缩并冷冻干燥得到寡糖混合物,进一步采用硼氢化钠还原得到紫菜胶寡糖醇,或者采用本尼迪克试剂氧化得到紫菜胶寡糖酸。
所述的半乳寡糖及其衍生物在作为防治非酒精性脂肪肝药物中的应用,半乳寡糖及衍生物作为益生元和功能因子发挥防治非酒精性脂肪肝作用,具有这些结构特征的半乳寡糖及其衍生物有效改善非酒精性脂肪肝患者肠道的紊乱,通过调节肠道菌群增加有益菌比例减少有害菌比例起到减少肝脏脂肪积累、抗氧化、抗炎、缓解肝纤维化、减少肝细胞损伤,作为防治非酒精性脂肪肝及相关疾病的药物或保健品。
所述的半乳寡糖及其衍生物在作为防治非酒精性脂肪肝药物中的应用,在门水平上该半乳寡糖及其衍生物显著增加非酒精性脂肪肝小鼠盲肠bacteroidete和verrucomicrobia的相对丰度,同时降低firmicutes,deferribacteres和candidatussaccharibacteria的相对丰度;在属水平上,该半乳寡糖及其衍生物显著增加nafld小鼠盲肠akkermansia,parabacteroides,alloprevotella和clostridiumxiva,并降低helicobacter,mucispirillum和barnesiella的相对丰度,使肠道菌群恢复正常水平。
所述的半乳寡糖及其衍生物在作为防治非酒精性脂肪肝药物中的应用,该半乳寡糖及其衍生物能显著降低氧化应激、炎症、肝脏脂质的积累和纤维化,用做制备抗非酒精性脂肪肝、保肝、胰岛素抵抗、抗代谢综合征、抗高脂血症或降血脂的药物。
所述的半乳寡糖及其衍生物在作为防治非酒精性脂肪肝药物中的应用,该半乳寡糖及其衍生物用于抗脂肪肝、保护肝脏或降脂的保健品;或者用于饮料、啤酒、饮食补充剂,或者与其它保肝的药物联用,或者与降血脂的药物联用;或者包含该半乳寡糖及其衍生物的复配制剂;或以该半乳寡糖及其衍生物为母核制备的衍生物用于抗脂肪肝、抗胰岛素抵抗、抗代谢综合征、抗高脂血症的药物、功能食品或者生物制品中。
所述的半乳寡糖及其衍生物在作为防治非酒精性脂肪肝药物中的应用,该半乳寡糖及其衍生物与熊去氧胆酸、维生素e、吡格列酮、二甲双胍或相关临床药物形成复配制剂。
本发明的优点及有益效果是:
1、本发明含d-和l-半乳糖残基的寡糖及其衍生物能改善非酒精性脂肪肝小鼠肠道菌群的紊乱。
2、本发明含d-和l-半乳糖残基的寡糖及其衍生物具有显著的降肝脂积累、降低肝脏氧化应激和炎症以及肝脏纤维化效果,对肝脏有很好的保护效果,可用于脂肪肝、高血脂症的防治。
3、本发明产品的原料来源于海洋红藻多糖,具有资源丰富、制备工艺简单、产品稳定性好,易于产业化,安全性高、效果独特等优点,用于改善非酒精性脂肪肝所致肠道菌群的紊乱,在防治非酒精性脂肪肝及在保肝、降脂和代谢综合征等新药和特医食品的开发领域,具有广阔的开发应用前景。
4、本发明采用高脂饮食诱导构建的非酒精性脂肪肝动物模型对所制备的系列半乳寡糖进行缓解nafld等相关功能评价。研究结果表明,含d-和l-半乳糖残基及其衍生物的寡糖能显著改善高脂饮食诱导的非酒精性脂肪肝小鼠肠道菌群紊乱,进而显著降低肝脏氧化应激、炎症、纤维化和脂质积累,进而对肝脏起到很好的保护作用,具有治疗非酒精性脂肪肝、高血脂症的作用。
附图说明
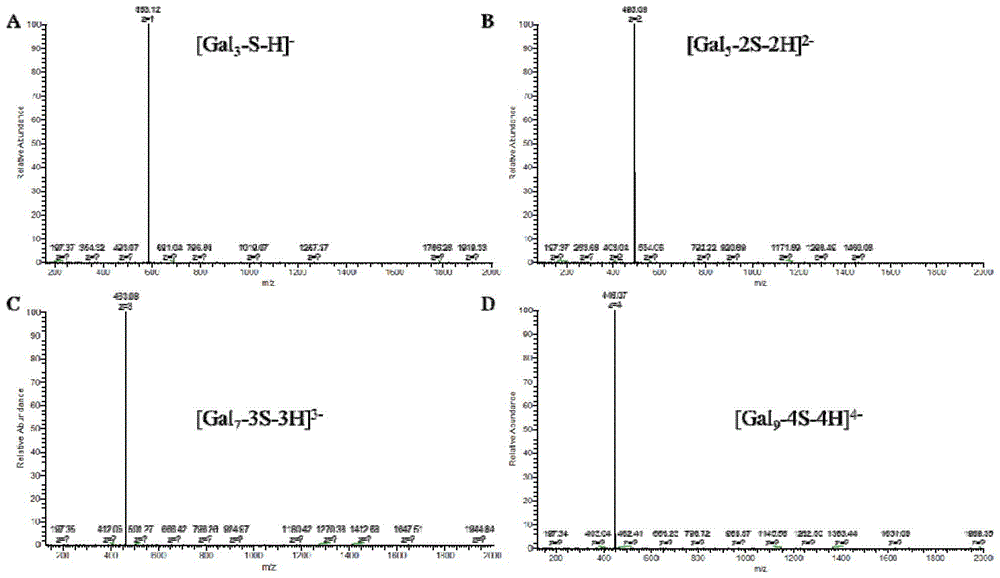
图1a图、b图、c图和d图分别为紫菜胶寡糖(pyos)三糖、五糖、七糖和九糖的高分辨质谱图及结构式。图中,横坐标m/z代表质荷比,纵坐标relativeabundance代表相对丰度。
图2a图、b图、c图分别为新琼四糖及其糖醇、糖酸的高分辨质谱图及结构式。图中,横坐标m/z代表质荷比,纵坐标relativeabundance代表相对丰度。
图3为门水平pyos对nafld小鼠盲肠菌群结构的调节作用图。pyos代表紫菜胶寡糖。control代表低脂饲料组,model代表高脂饲料组,metf代表高脂饲料加二甲双胍处理组,pyos-l代表高脂饲料加100mg/kg/dpyos处理组,pyos-h代表高脂饲料加300mg/kg/dpyos处理组。*p<0.05,与control组相比;#p<0.05,与model组相比;&p<0.05,pyos-h组与pyos-l组相比。a图为不同组别小鼠盲肠菌群的pcoa图;b图为不同处理组小鼠肠道菌群门水平的总体变化图;c图、d图、e图、f图分别代表小鼠肠道菌群在门水平firmicutes、bacteroidetes、verrucomicrobia、deferribacteres、candidatussaccharibacteria相对丰度变化。
图4为属水平pyos对nafld小鼠盲肠菌群结构的调节作用图。control代表低脂饲料组,model代表高脂饲料组,metf代表高脂饲料加二甲双胍处理组,pyos-l代表高脂饲料加100mg/kg/dpyos处理组,pyos-h代表高脂饲料加300mg/kg/dpyos处理组。*p<0.05,与control组相比;#p<0.05,与model组相比;&p<0.05,pyos-h组与pyos-l组相比。其中,a图为不同处理组小鼠肠道菌群属水平的总体变化图;b图、c图、d图、e图、f图分别为helicobacter、akkermansia、alloprevotella、mucispirillum、barnesiella的相对分度图,其中横坐标代表不同组别,纵坐标代表relativeabundance(%)代表相对分度。
图5为pyos对高脂饮食诱导的nafld小鼠减重效果图。control代表低脂饲料组,model代表高脂饲料组,metf代表高脂饲料加二甲双胍处理组,pyos-l代表高脂饲料加100mg/kg/dpyos处理组,pyos-h代表高脂饲料加300mg/kg/dpyos处理组。*p<0.05,与control组相比;#p<0.05,与model组相比。其中,a图为试验结束时小鼠体态图;b图为小鼠体重变化图,横坐标代表不同处理组,纵坐标bodyweight(g)代表小鼠体重,无斜杠组代表造模前体重,斜杠组代表实验结束时体重;c图为实验期间小鼠体重增加结果图,横坐标代表不同处理组,纵坐标weightgain(g)代表小鼠体重增加量;d图为小鼠身体质量指数,横坐标代表不同处理组,纵坐标bmi(kg/m2)代表身体质量指数;e图为各组肝脏指数图,横坐标代表不同处理组,纵坐标liverindex(mg/kg)代表肝脏指数。
图6为pyos抑制nafld小鼠肝脏脂质积累效果图。control代表低脂饲料组,model代表高脂饲料组,metf代表高脂饲料加二甲双胍处理组,pyos-l代表高脂饲料加100mg/kg/dpyos处理组,pyos-h代表高脂饲料加300mg/kg/dpyos处理组。*p<0.05,与control组相比;#p<0.05,与model组相比;&p<0.05,pyos-h组与pyos-l组相比。其中,a图为不同处理组小鼠肝脏的外观;b图为不同处理组小鼠肝脏h&e染色结果图;c图为不同处理组小鼠肝脏oilredo染色结果图;d图、e图、f图分别为不同处理组小鼠肝脏甘油三酯、游离脂肪酸、胆固醇含量结果图,横坐标代表不同处理组,纵坐标tg(mg/gliver)代表甘油三酯含量,ffa(μmol/gliver)代表游离脂肪酸含量,cholesterol(mg/gliver)代表胆固醇含量。
图7为pyos缓解nafld小鼠肝脏氧化应激结果图。control代表低脂饲料组,model代表高脂饲料组,metf代表高脂饲料加二甲双胍处理组,pyos-l代表高脂饲料加100mg/kg/dpyos处理组,pyos-h代表高脂饲料加300mg/kg/dpyos处理组。*p<0.05,与control组相比;#p<0.05,与model组相比;&p<0.05,pyos-h组与pyos-l组相比。其中,a图为不同处理组肝脏活性氧(ros)水平;b图、c图、d图、e图分别为肝脏中谷胱甘肽、丙二醛、过氧化氢酶和超氧化物歧化酶的含量图,横坐标代表不同处理组,纵坐标gsh(nmol/mg)代表谷胱甘肽含量,mda(nmol/mg)代表丙二醛含量,cat(u/mg)代表过氧化氢酶含量,sod(u/mg)代表超氧化物歧化酶含量。
图8为pyos缓解nafld小鼠肝脏炎症结果图。control代表低脂饲料组,model代表高脂饲料组,metf代表高脂饲料加二甲双胍处理组,pyos-l代表高脂饲料加100mg/kg/dpyos处理组,pyos-h代表高脂饲料加300mg/kg/dpyos处理组。*p<0.05,与control组相比;#p<0.05,与model组相比;&p<0.05,pyos-h组与pyos-l组相比。其中,a图、b图、c图分别为不同处理组肝脏白介素-6、肿瘤坏死因子水平α和单核细胞趋化蛋白-1的含量图,横坐标代表不同处理组,纵坐标il-6(nmol/mg)代表白介素-6含量,tnfα(pg/ml)代表肿瘤坏死因子水平α含量,mcp-1(pg/ml)代表单核细胞趋化蛋白-1含量。
图9为pyos对nafld小鼠肝纤维化的改善作用结果图。control代表低脂饲料组,model代表高脂饲料组,metf代表高脂饲料加二甲双胍处理组,pyos-l代表高脂饲料加100mg/kg/dpyos处理组,pyos-h代表高脂饲料加300mg/kg/dpyos处理组。其中,a图为肝脏masson三色染色结果图,图中黄色箭头处代表肝脏纤维;b图为肝脏α-sma的免疫组化结果图,图中黄色箭头处代表α-sma阳性;c图、d图、e图、f图分别为不同处理组tgf-β、fn、coliii、coliv的westernblot结果。其中,tgf-β代表转化生长因子-β,fn代表纤连蛋白,coliii代表iii型胶原蛋白,coliv代表iv型胶原蛋白。
图10为pyos对nafld小鼠肝脏细胞保护作用结果图。control代表低脂饲料组,model代表高脂饲料组,metf代表高脂饲料加二甲双胍处理组,pyos-l代表高脂饲料加100mg/kg/dpyos处理组,pyos-h代表高脂饲料加300mg/kg/dpyos处理组。*p<0.05,与control组相比;#p<0.05,与model组相比;&p<0.05,pyos-h组与pyos-l组相比。其中,a图、b图、c图分别为不同处理组血清谷丙转氨酶、谷草转氨酶和碱性磷酸酶活性图,横坐标代表不同处理组,纵坐标alt(u/l)代血清谷丙转氨酶含量,ast(u/l)代表血清谷草转氨酶含量,alp(u/l)代表血清碱性磷酸酶含量。
图11为肠道菌群在属水平与代谢相关参数之间的spearman’s相关性分析热图。+:p<0.05,*:p<0.01。其中,a图、b图、c图、d图分别为与肝损伤(alt、ast和alp指标)、脂质水平(tc、ldl-c、tg和hdl-c含量)、氧化应激水平(ros、mda、sod和cat水平)以及炎症因子(il-1β、tnf-α、mcp-1和lbp水平)与肠道菌群之间的相关性分析。
具体实施方式
在具体实施过程中,本发明以含有d-/l-半乳糖的红藻多糖为原料,经物理法、化学法、生物酶法或上述方法的任意组合进行可控降解,制备获得不同聚合度的半乳寡糖及其衍生物,其分子骨架中含有d-半乳糖和l-半乳糖及其衍生物。本发明产品的原料来源于红藻多糖,具有资源丰富、制备工艺简单、安全性高,易于产业化等优点,作为益生元和功能因子,在改善非酒精性脂肪肝患者肠道菌紊乱,防治高脂饮食引起的非酒精性脂肪肝,及在护肝、降脂、减肥及特医食品的开发领域,具有广阔的应用前景。
下面,结合具体实施例对本发明的技术方案作进一步的说明。
实施例1:含有6-o-硫酸-β-1,3-d-半乳糖(gal6s)和α-1,4-l-3,6-内醚半乳糖(ang)硫琼胶寡糖(saos)、寡糖醇(saos-oh)及寡糖酸(saos-ooh)的制备。
将1g硫琼胶多糖用摩尔浓度0.1m的稀硫酸配成10mg/ml水溶液,加热到60℃,搅拌降解1.5小时,冷却后用摩尔浓度2m的naoh水溶液中和,离心收集上清液,然后加入3倍体积95%医用乙醇(体积浓度)于4℃过夜,离心收集沉淀,用少量水溶解后,用200da透析袋透析脱盐,内液经旋蒸浓缩后冷冻干燥,得到saos。取100mgsaos,将其溶于10ml摩尔浓度100mm的nabh4水溶液(含摩尔浓度100mm的naoh)于4℃过夜反应,加入醋酸调ph至7.0,经透析脱盐,冷冻干燥得寡糖醇saos-oh。再取200mgsaos,将其溶于5ml新配制的本尼迪克试剂中,55℃加热反应至无砖红色沉淀产生,离心取上清液,经阳离子交换树脂去除残余铜离子,调ph至中性,经透析脱盐,冷冻干燥,得到寡糖酸saos-ooh。
所制得的saos系列硫琼胶寡糖醇、寡糖酸和寡糖的结构式如下:
式中,r=-so3na;n=0-30;
实施例2:含有β-1,3-d-半乳糖(gal)和6-o-硫酸-α-1,4-半乳糖(gal6s)的紫菜胶寡糖(pyos)、寡糖醇(pyos-oh)和寡糖酸(pyos-ooh)的制备。
将紫菜胶用摩尔浓度0.1m的稀硫酸配成10mg/ml水溶液,加热到80℃,搅拌降解2小时,冷却后用摩尔浓度2m的naoh水溶液中和,离心收集上清液,加入4倍体积95%医用乙醇于4℃过夜,离心收集沉淀并用少量水溶解后用200da透析袋脱盐,经旋蒸浓缩、冷冻干燥得到紫菜胶寡糖pyos(如图1a-d所示)。取pyos寡糖150mg,将其溶于15ml摩尔浓度为150mm的nabh4水溶液(含摩尔浓度150mm的naoh)于4℃过夜反应,加入醋酸调ph至7.0,经透析脱盐,冷冻干燥,得紫菜胶寡糖醇pyos-oh。再取100mg的pyos,将其溶于3ml新配制的本尼迪克试剂中,55℃加热搅拌反应,至无转红色沉淀产生后,离心取上清液,经阳离子交换树脂去除残余铜离子,调ph至中性,经透析脱盐,冷冻干燥,得到紫菜胶寡糖酸pyos-ooh。
所制备的紫菜胶pyos寡糖醇、寡糖酸及其寡糖的结构式如下:
式中,r=-h,或-so3na;n=0-30;
实施例3:含有β-1,3-d-半乳糖(gal)和α-1,4-l-3,6-内醚半乳糖(ang)的琼胶寡糖及其寡糖醇和寡糖酸的制备。
将琼脂糖用热水溶解,采用摩尔浓度0.1m的稀盐酸配成10mg/ml溶液,于80℃搅拌降解0.5小时,冷却后用摩尔浓度2m的naoh水溶液中和,离心收集上清液,然后加3.5倍体积95%医用乙醇于4℃过夜,离心收集沉淀,水溶解后用200da透析袋透析脱盐,旋蒸浓缩并冷冻干燥得到琼寡糖aos,进一步采用硼氢化钠还原得到琼胶寡糖醇aos-oh,或者采用本尼迪克试剂氧化得到琼胶寡糖酸aos-ooh。琼胶寡糖醇、寡糖酸及其寡糖的化学结构式如下:
式中,n=0-30;
实施例4:含有α-1,4-l-3,6-内醚半乳糖(ang)和β-1,3-d-半乳糖(gal)新琼胶寡糖及其糖醇和寡糖酸的制备。
将琼脂糖用60℃热水溶解,配成10mg/ml水溶液,放置35℃水浴锅内搅拌降温后,加入β-琼胶酶,恒温搅拌酶解3小时,立即置于95℃水浴锅使酶变性10分钟后冷却到室温,离心收集上清液,然后加3倍体积95%医用乙醇于4℃过夜,离心收集沉淀,少量水溶解后,用200da透析袋透析脱盐,旋蒸浓缩并冷冻干燥得到新琼寡糖naos,进一步采用硼氢化钠还原得到新琼胶寡糖醇naos-oh,或者采用本尼迪克试剂氧化得到新琼胶寡糖酸naos-ooh。所制备的新琼胶寡糖醇、寡糖酸及寡糖的化学结构式如下:
式中,n=0-30;
为了验证所得寡糖醇的序列结构,可以将酶解得到的新琼胶寡糖用superdex30柱分离纯化,得到新琼四糖纯品(图2a),采用碱性硼氢化钠还原方法制得新琼四糖糖醇,所得产品的高分辨质谱(esi-ms)分析结果如图2b所示。同样,将所得新琼四糖采用本尼迪克定向氧化方法获得新琼四糖酸产品,其高分辨质谱(esi-ms)分析结果如图2c所示。
实施例5:pyos对高脂饲料引起的nafld小鼠结肠微生物紊乱的影响。
为了研究在pyos的益生元作用,选取20~22g雄性c57bl/6j小鼠适应一周后进行不同饲料喂养。其中,control组用低脂饲料进行喂养,其他组用高脂饲料进行喂养。喂养6个月后造nafld模型成功,之后metf组、pyos-l和pyos-h组分别灌胃225mg/kg/dmetformin、100mg/kg/dpyos以及300mg/kg/dpyos一个月,其余组灌胃相同体积地无菌生理盐水。实验结束时,取不同处理组小鼠结肠内容物用于16srdna测序和分析。通过pcoa分析可知(如图3a所示),与control组相比,nafld小鼠结肠菌群的组成结构发生显著改变,但是补充pyos显著改变了nafld小鼠结肠菌群的结构且更趋向于control组。pyos-l组和pyos-h组的结肠菌群结构完全分离,表明pyos对结肠菌群的调控呈剂量依赖性(如图3a所示)。
在门水平评价了pyos对nafld小鼠结肠菌群的调节作用(如图3b-f所示),与control组相比,nafld小鼠结肠的bacteroidetes相对丰度较低,firmicutes相对丰度较高,firmicutes/bacteroidetes比值显著增大(p<0.05),而补充剂pyos能够显著逆转这种情况(p<0.05)(图3b和c)。pyos组均显著增加了nafld小鼠体内verrucomicrobia的丰度,同时降低deferribacteres和candidatussaccharibacteria的相对丰度(p<0.05)(图3d-f),这些变化对能改善小鼠nafld有积极作用。
研究了pyos在属水平对nafld小鼠结肠菌群的调节作用(如图4a-f所示),pyos显著增加了nafld小鼠结肠中akkermansiaspp.和alloprevotellaspp.的相对丰度(p<0.05),同时降低了helicobacterspp.、mucispirillumspp.和barnesiellaspp.的相对丰度(p<0.05),使它们恢复到相对正常的水平。
上述结果表明,pyos能够从门水平和属水平显著改善nafld小鼠结肠菌群紊乱,能有效地重塑nafld小鼠结肠菌群,对pyos发挥抗nafld起到积极的作用。
实施例6:pyos对hfd诱导的小鼠肥胖和肝脏指数的影响。
肥胖(尤其是腹部肥胖)与nafld的发生和发展有关。经观察可知,model组腰围显著大于control组;pyos喂养六周后显著降低小鼠腰围(图5a),因此pyos可显著降低小鼠的肥胖程度。此外,nafld小鼠比control组小鼠体重和体重指数(bmi)显著增加(p<0.05)(图5b-d),pyos可显著改善hfd诱导的nafld小鼠肥胖(p<0.05)。此外,如图5e所示,与control组相比,nafld小鼠的肝脏指数显著增加(p<0.05),而pyos治疗显著逆转了这种情况(p<0.05)。以上结果表明,pyos以剂量依赖的方式显著抑制了nafld小鼠的肥胖和肝脏指数增加。
实施例7:pyos对nafld小鼠肝脏脂质积累的影响。
研究证明,nafld的一个显著组织学特征是肝组织中存在大量的囊泡脂肪并伴有细胞核向细胞边缘迁移。通过肝脏组织学分析,探究pyos对肝脂肪变性和细胞结构的影响。如图6a和b所示,control组小鼠肝脏呈光亮的红棕色,肝小叶结构完整清晰;model组小鼠肝脏是苍白的,呈现出肉眼可见的脂肪颗粒,并且被白斑浸润。肝小叶中央有大面积坏死,其特征是溶解、细胞核消失和细胞破裂,证明肝细胞受到损伤;经pyos或metf治疗后,上述症状与model组相比明显逆转,并趋于更接近正常状态。油红o染色结果表明(如图6c所示),与control组相比,model组肝脏出现异常脂质堆积,而pyos或metf治疗明显减轻hfd诱导的肝内脂质堆积。如图6d-f所示,与control组相比,nafld小鼠的tg、ffa和cholesterol含量均显著增加(p<0.05),而pyos或metf治疗显著逆转了这种情况(p<0.05)。以上结果表明,hfd小鼠成功诱导了小鼠的nafld,pyos能够显著抑制nafld小鼠肝脏脂肪的积累。
实施例8:pyos对nafld小鼠肝脏氧化应激和炎症状态的影响。
研究表明,肝脏氧化应激和炎症状态对nafld的发生起重要作用。氧化的dhe荧光强度与组织ros含量呈正相关,如图7a所示,与control组相比,model组ros含量显著增加,pyos或metf处理可显著降低nafld小鼠肝脏ros水平。与control组相比,nafld小鼠肝脏中sod、cat和gsh的活性显著降低,同时显著增加肝脏中mda的含量(p<0.05)(图7b-e),补充pyos后这些情况被显著地改善(p<0.05),并呈现一定的剂量依赖性,表明pyos可以减轻nafld肝脏氧化应激。
研究表明,氧化应激介导的信号转导机制参与nafld炎症的发生和发展。如图8a-c所示,与control组相比,nafld小鼠肝脏il-6、tnfα和mcp-1水平显著升高(p<0.05),而pyos以剂量依赖性方式显著抑制肝脏促炎症细胞因子的升高(p<0.05)。
实施例9:pyos对nafld小鼠肝脏纤维化的改善作用。
研究表明,肝细胞氧化应激可导致胶原合成增加,从而导致肝脏纤维化的发生和发展。肝纤维化是nafld进展的重要生物标记物,门静脉纤维化被认为是严重nafld的重要临床表征。通过masson三色和α-sma免疫组化表征nafld小鼠肝细胞纤维化的发展,如图9a和b所示,pyos有效地改善nafld小鼠肝脏纤维化状态。此外,与control组小鼠相比,model组小鼠的tgf-β及其相关的细胞外基质蛋白(如fn、coliii和coliv)水平显著升高(p<0.05),而pyos治疗显著降低了肝纤维化相关蛋白的水平(p<0.05)(图9c-f)。这些结果表明pyos可显著缓解hfd诱导的nafld小鼠肝脏纤维化的发生和发展。
实施例10:pyos对nafld小鼠肝脏损伤的保护作用。
肝功能酶(alt、ast和alp)主要存在于肝脏,但在肝细胞膜受损的情况下可大量入血,血清中这些相关酶的活性可以反映肝损伤的程度。如图10a-c所示,model组小鼠血清中alt、ast和alp酶活性明显高于control组(p<0.05),而pyos或metf治疗显著逆转了这种情况(p<0.05)。上述结果表明,100mg/kg/d和300mg/kg/d的pyos对nafld小鼠肝脏具有显著保护作用,且优于225mg/kg/d的metf的肝脏保护作用。
实施例11:pyos调控结肠菌群与nafld小鼠生理指标的相关性。
利用spearman相关性分析阐明了结肠菌群与nafld小鼠生理指标之间的关系(如图11a-d所示),veillonellaspp.和olsenellaspp.与血清alt和alp水平呈正相关;clostridiumxviiispp.、roseburiaspp.、enterorhabdusspp.、brachyspiraspp.、anaeroplasmaspp.、bifidobacteriumspp.、parabacteroidesspp.、desulfovibriospp.、clostridiumxivaspp.和clostridiumxivbspp.的相对丰度与肝损伤程度负相关;增加pararevotellaspp.的相对丰度能显著增加ldl-c含量,而alloprevotellaspp.、parabacteroidesspp.、enterorhabdusspp.、roseburiaspp.、brachyspiraspp.、bifidobacteriumspp.、anaeroplasmaspp.、clostridumxivbspp.和clostridumxivaspp.的相对丰度与tc、ldl-c和tg积累呈负相关;paraprevotellaspp.、clostridiumxispp.和barnesiellaspp.的相对丰度与hdl-c含量呈负相关,而eubacteriumspp.、akkermansiaspp.、alloprevotellaspp.和parabacteroidesspp.的相对丰度与hdl-c含量呈正相关;anaeroplasmspp.、parabacteroidesspp.、desulfovibriospp.、brachyspiraspp.、clostridumxivaspp.和clostridumxivbspp.的相对丰度与cat、sod呈正相关,而与ros、mda、il-1β、tnfα、mcp-1和lbp含量呈负相关。综上所述,pyos在降低nafld小鼠体内有害微生物含量的同时,增加了益生菌的相对丰度,上述菌群相对丰度的变化与降低nafld小鼠脂质积累、氧化应激水平、炎症反应以及保护肝损伤密切相关。pyos可通过调控上述菌属的相对丰度发挥改善hfd诱导的nafld的作用。
利用高脂饲料诱导的nafld小鼠动物模型评价pyos的抗nafld效果。结果表明,pyos通过调节nafld小鼠结肠菌群门水平(pyos显著提高nafld小鼠结肠bacteroidetes和verrucomicrobia的相对丰度,降低firmicutes、deferribacteres和candidatussaccharibacteria的相对丰度)和属水平(pyos显著增加nafld小鼠结肠akkermansiaspp.的相对丰度,同时降低helicobacterspp.的相对丰度)的组成和丰度变化,缓解nafld小鼠的结肠微生物群紊乱,进而起到缓解hfd诱导的nafld的作用。通过spearman相关性分析可知,pyos在降低nafld小鼠体内有害微生物丰度的同时,增加了益生菌的相对丰度,上述菌群相对丰度的变化与降低nafld小鼠脂质积累、氧化应激水平、炎症反应以及保护肝损伤密切相关。进一步证明了pyos可通过调控上述菌属的相对丰度发挥改善hfd诱导的nafld的作用。从改善结肠菌群角度初步阐释了pyos的益生元效果,使得pyos能够显著降低hfd诱导的nafld小鼠肥胖和肝脏指数增加,改善nafld小鼠肝脏氧化应激和炎症状态,显著减少肝脏脂质积累。此外,pyos明显缓解氧化应激所致肝脏纤维化,进而改善肝脏损伤。总之,通过上述保护机制,pyos可显著改善hfd诱导的小鼠nafld。
综上,本发明的寡糖通过改善肠道菌群稳态进而起到抗非酒精性脂肪肝的效果,宜于作为抗脂肪肝、保护肝脏、降血脂或者抗代谢综合征药物候选药物或保健品或复配制剂应用。实施例结果表明,本发明的紫菜胶寡糖(pyos)可作为益生元,调节非酒精性脂肪肝相关肠道菌群紊乱,从而发挥抗非酒精性脂肪肝作用,可作为防治非酒精性脂肪肝相关疾病的药物或保健品。pyos能够显著减少脂质积累、缓解肝脏氧化应激、炎症、纤维化和组织细胞凋亡,从而实现保护肝脏和缓解非酒精性脂肪肝的作用。本发明产品来源于海洋红藻寡糖,具有资源丰富、易于产业化,安全有效等诸多优点,在防治非酒精性脂肪肝、肝脏保护、高血脂症以及抗代谢综合征等方面具有广阔的开发应用前景。
以上实施例仅用以说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实施例中所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本发明所要求保护的技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!