槲皮素-3′-O-β-D-葡萄糖苷作为钙离子通道的抑制剂的应用的制作方法
本发明技术属于医药领域,具体涉及槲皮素-3′-o-β-d-葡萄糖苷的应用。
背景技术:
:心血管疾病是对现代社会人类生命健康最具危害的疾病,根据世界卫生组织报道,2016年全球约1790万人死于心血管疾病,占全球死亡总数的31%。由此可见,预防和治疗心血管疾病的新药物的医疗需求非常迫切。相关研究证明,trpc通道是心肌病、心力衰竭、高血压和脑血管疾病等一些心血管病变的新药开发的重要的药理学靶点。专利申请wo2006/074802a1公开了trpc通道用于心脑血管疾病中的治疗,其研究表明利用基因技术,在兔动脉粥样硬化模型中,通过抑制血管内皮细胞trpc3\trpc6和trpc7活性,可明显改善血管功能和动脉粥样硬化的血管病理改变。trpc通道是一种ca2+透过的非选择性离子通道,广泛存在于哺乳动物组织中。根据结构同源性和功能倾向性,可将trpc家族划分为四个亚群:trpc1和trpc2各构成一个亚群;trpc4和trpc5之间有大约65%的氨基酸同源性,因此把它们划为同一亚群;trpc3、trpc6和trpc7有70-80%的氨基酸同源性,三者归为同一亚群。trpc3、trpc6和trpc7通道有着共同的活化机制,目前已知其内源性配体有二酰甘油(dag)和4-乙基-(3-(4-氟苯基)-7-羟基-2-甲基吡唑[1,5-a]-嘧啶-5-基)哌啶-1-羧酸盐(m085)。目前已知的trpc有机抑制剂有2-氨基乙氧基二苯基硼酸(2-apb)、skf96365、ym-58483(btp2)以及无机阻断剂(如gd3+和la3+)等,但是都缺乏足够有效性和特异性。现在关于trpc的天然组成、活化机制、生理功能及其在病理生理和疾病中的作用等依然是悬而未决的问题。因为它们广泛而且部分重叠的分布、潜在的杂多聚化、相似的电生理特性以及缺乏明确追踪这些通道的化合物工具,实现原位鉴定天然trpc通道存在一定困难。dietrich等人的研究证明,通过研究转基因小鼠模型可能解开某些trpc可能的生理学功能,总结了trpc3、6、7亚家族在体内外的异终极化潜力,并提供它们在通道活性下调的孤立组织和基因缺陷小鼠模型中生理功能分析的初步数据。但是,由于缺乏特异性的通道阻滞剂,容易受到与trpc通道密切相关通道的补偿效应,因此无法确定trpc同型或异型异构体在整个机体复杂器官功能中的生理相关性,要克服这一缺陷,需要在胚胎干细胞中靶向基因失活以及随后为每个通道和通道亚科生产基因缺陷小鼠模型,这些模型系统的生成和分析非常消耗时间和成本,存在一定局限性。黄蜀葵花为锦葵科秋葵属植物黄蜀葵abelmoschusmanihot(l.)medic的干燥花,黄蜀葵花最早记载于《嘉佑本草》,分布广泛、资源丰富,《本草纲目》记载:其花气味甘、寒、滑、无毒,主治小便淋及催生,治诸恶疮脓水久不瘥者,作末敷之即愈,为疮家要药,消疽肿,浸油涂汤火伤等。黄蜀葵花中含有多种化学成分,包括:没食子酸、5-羟甲基-2-呋喃甲酸、原儿茶酸-3-o-β-d-葡萄糖苷、原儿茶酸、acortatarina、棉皮素-3-o-β-d-葡萄糖-8-o-β-d-葡萄糖醛酸苷、槲皮素-3-o-[β-d-木糖基(1→2)-α-l-鼠李糖基1→6)]-β-d-半乳糖苷、杨梅素-3-o-β-d-半乳糖苷、杨梅素-3-o-β-d-葡萄糖苷、槲皮素-3-o-β-d-木糖基-(1→2)-β-d-半乳糖苷、槲皮素-3-o-洋槐糖苷、芦丁、金丝桃苷、异槲皮苷、杨梅素-3′-o-β-d-葡萄糖苷、棉皮素-3′-o-β-d-葡萄糖苷、棉皮素-8-o-β-d-葡萄糖醛酸苷、杨梅素、槲皮素-3′-o-β-d-葡萄糖苷、槲皮素等。目前,尚没有研究表明槲皮素-3′-o-β-d-葡萄糖苷对trpc通道的抑制作用,以及在制备治疗trpc通道相关的心血管疾病、冠心病、动脉粥样硬化、晚期肾衰竭、神经疾病、慢性疼痛、急性疼痛或炎性疾病的药物中的用途。有鉴于此,本发明提供了黄蜀葵花提取物作为trpc离子通道的抑制剂和制备治疗心血管疾病、冠心病、动脉粥样硬化、晚期肾衰竭、神经疾病、慢性疼痛、急性疼痛或炎性疾病的药物的用途,证明其提取物中槲皮素-3′-o-β-d-葡萄糖苷作为一种新的药理学工具,能够选择性抑制trpc离子通道,能够在trpc亚家族之间和内部有所区分,从而能够阐明在生理和病理生理条件下不同通道的作用,为心脑血管疾病等开拓了思路,同时拓展了黄蜀葵花提取物的用途。技术实现要素:本发明的技术方案如下:术语:1、本
发明内容中的术语“trpc通道”、“trpc离子通道″或″trpc″是指可通透ca2+的非选择性阳离子通道。它是指下面瞬时受体电位典型离子通道列表中的任何一个:trpc1,trpc2,trpc3,trpc4,trpc5,trpc6和trpc7。特别优选是trpc3,trpc6和trpc7。这种trpc离子通道可以来源于任何脊椎动物,并且特别是哺乳动物类(例如狗、马、牛、小鼠、大鼠、犬、兔、鸡、类人猿、人或其他)。trpc能够从这种脊椎动物生物体的组织探测剂中分离,或是通过能够表达trpc蛋白质的重组生物材料的方法制造。这个术语可以指天然多肽、多态变异体、突变体,以及种间同系物。2、本
发明内容中的术语“药理学工具”是指其功能特性能够研究药物如何与活生物体相互作用、以产生目的功能的变化的化合物和化合物组合,从而能够研究新药物组合物,以及性质、相互作用、毒理学、治疗、医疗医用和抗病能力。而且,该术语指可用于新药开发时表征潜在靶标的化合物,例如表征它们的天然组分、活化机制、生理功能以及在病理生理和疾病中的作用。3、本
发明内容中的术语“trpc离子通道调节剂”是指trpc通道的调节分子,特别是一种抑制或活化分子(“抑制剂”或“活化剂”),特别是一种根据本发明方法可鉴定的trpc通道的抑制剂。抑制剂通常为一种化合物,像上文详细优选描述的那样,例如结合、部分或全部阻断活性、降低、防止、延迟活化、灭活、减敏或下调至少一种trpc通道的活性或表达。活化剂通常为一种化合物,像上文详细优选描述的那样,例如增加、打开、活化、促进、增强活化、敏化、激动或上调至少一种trpc通道的活性或表达。这种调节剂包括trpc通道的基因改造版本,优选trpc通道的失活突变体,以及自然存在或合成的配体、拮抗剂、激动剂、肽类、环肽、核酸、抗体、反义分子、核酶、有机小分子等。trpc活化剂的例子为二酰甘油,特别是1-油酰基-2乙酰基-sn-甘油(oag);gq偶联的受体激动剂,例如苯肾上腺素,特别是胰蛋白酶;刺激受体酪氨酸激酶的激动剂例如表皮生长因子(egf);或二酰甘油生成酶例如磷脂酶或其活化剂。存在测试化合物时对trpc离子通道活性调节的测量的实例如下:一般情况下,提供表达trpc通道的细胞。这种细胞能够使用本领域技术人员所知的基因方法产生。在进行trpc通道的诱导表达之后,通常将细胞放入例如微孔板之中并生长。通常细胞在多孔板底部生长并固定。然后,常规清洗这些细胞并加入适合的加样缓冲液中的染料,优选荧光染料例如fluo4am。在移除加样缓冲液之后,将细胞与测试化合物或调节剂(特别是上述生物化学的或化学的测试化合物,例如以化学化合物库的形式一同孵育ca2+测量能够通过使用例如荧光成像读板仪(flipr)进行。为了刺激通过trpc通道的ca2+内流,通常应用通道活化剂例如oag和4-乙基-(3-(4-氟苯基)-7-羟基-2-甲基吡唑[1,5-a]-嘧啶-5-基)哌啶-1-羧酸盐(m085)。抑制剂的预期影响是例如荧光增加的减少。活化剂是会导致例如活化剂诱发荧光的进一步增加,或诱导例如不依赖活化剂的荧光增强。此后,适合的调节剂,特别是抑制剂能够被分析和/或分离。优选使用技术人员所知或可商用的高通量分析进行化学化合物库的筛选。4、本
发明内容中的术语“表达trpc的细胞”是指内源表达目的离子通道的细胞或重组细胞。该细胞通常为哺乳动物细胞,例如人细胞、小鼠细胞、大鼠细胞、中国仓鼠细胞等。已发现方便使用的细胞包括mdck,hek293,hek293t,bhk,cos,nih3t3,swiss3t3和cho细胞,优选hek293细胞。5、本
发明内容中的术语“组织”,是指组织制品的任何类型,或组织或器官的一部分(例如脑、肝、脾、肾、心脏、血管、肌肉、皮肤等,也指任何类型的体液例如血液、唾液、淋巴液、滑液等),优选如果来源于脊椎动物,更优选来源于哺乳动物例如人。组织样品能够通过公知的技术获得,例如取血、组织穿刺或外科技术。6、本
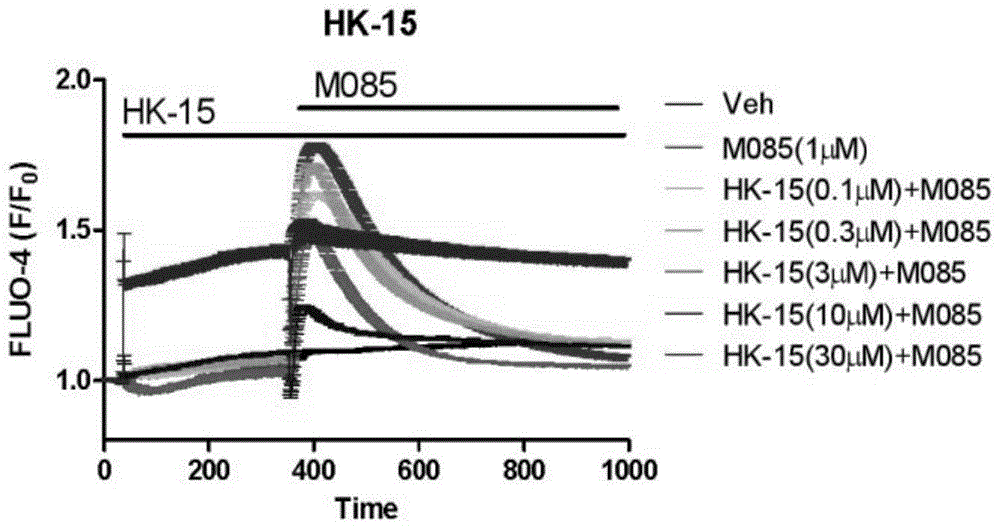
发明内容中的术语“药物”是指包含治疗有效量的槲皮素-3′-o-β-d-葡萄糖苷中的治疗剂,或者是包含了该化合物的植物提取物。该药物能以任何传统方式全身或局部给药。这可以例如通过口服剂型例如片剂、颗粒剂或胶囊的方法,通过粘膜例如鼻腔或口腔的方法,皮肤下植入的储库式制剂,通过包含根据本发明药物的注射、输注或凝胶的方法。如果适当,为了治疗上述某种特殊疾病,还可以脂质体复合物的形式局部(topicallyandlocally)给药。该药物也可以注射剂或输液的形式给药,如果只是相对少量的溶液或悬浮液,例如大约1至20ml,一般使用注射液对身体给药。一方面,本发明提供了槲皮素-3′-o-β-d-葡萄糖苷在制备抑制钙离子通道的药物中的应用。作为实例,本发明提供了槲皮素-3′-o-β-d-葡萄糖苷在制备抑制钙离子通道的药物中的应用。作为示例性或优选性的实例,上述钙离子通道为trpc通道(或称为trpc离子通道)。作为示例性或优选性的实例,上述trpc通道trpc3、trpc6或trpc7通道。作为示例性或优选性的实例,上述钙离子通道指槲皮素-3′-o-β-d-葡萄糖苷用于在体外和体内抑制的钙离子通道。另一方面,本发明提供了槲皮素-3′-o-β-d-葡萄糖苷在制备诊断、治疗或辅助治疗心血管疾病、冠心病、动脉粥样硬化、晚期肾衰竭、神经疾病、慢性疼痛、急性疼痛或炎性疾病的药物中的用途。作为实例,本发明提供了槲皮素-3′-o-β-d-葡萄糖苷在制备诊断、治疗或辅助治疗心血管疾病、冠心病、动脉粥样硬化、晚期肾衰竭、神经疾病、慢性疼痛、急性疼痛或炎性疾病的药物中的用途。作为示例性或优选性的实例,所述的药物还包含一种或多种可药用载体或助剂配制。可药用载体或助剂为例如生理缓冲溶液如氯化钠溶液,脱矿水,稳定剂如蛋白酶或核酸酶抑制剂,或螯合剂如edta。另一方面,本发明提供了一种植物提取物,所述的植物提取物含有以重量计为0.5%以上的槲皮素-3′-o-β-d-葡萄糖苷;进一步地所述的植物提取物含有以重量计为0.5-2.0%的槲皮素-3′-o-β-d-葡萄糖苷;更进一步地,所述的植物提取物含有以重量计为0.8-1.6%的槲皮素-3′-o-β-d-葡萄糖苷;优选所述植物为木槿属植物、锦葵科植物,进一步优选为黄葵、黄蜀葵、金花葵、葡萄叶木槿、羊角豆、磨盘草中的一种或多种。另一方面,本发明提供了上述植物提取物在制备治疗钙离子通道介导的疾病的药物中的应用。作为示例性或优选性的实例,所述的植物提取物为黄蜀葵花提取物。所述黄蜀葵花提取物为乙醇提取物,优选为50-95%乙醇回流的提取物,进一步优选为80-95%乙醇回流提取的提取物。本发明所述黄蜀葵花提取物可以由如下方法制备:取黄蜀葵花药材,乙醇加热回流提取,滤过,滤液浓缩,干燥。进一步的,优选为由如下方法制备:黄蜀葵花用85%~95%的乙醇,回流提取1~3次,每次1~2小时,过滤,合并滤液回收乙醇,浓缩滤液至比重1.20~1.35,浓缩液在0℃~4℃静置24~48小时,去除冷藏液的油层,调ph值6.0~7.0,浓缩,薄层快速干燥或真空干燥,即得黄蜀葵花提取物。本发明所述的黄蜀葵花提取物的制备方法可以为:黄蜀葵花用95%的乙醇,回流提取2次,每次1小时,过滤,合并滤液回收乙醇,浓缩滤液至比重1.20,浓缩液在0℃~4℃静置24~48小时,去除冷藏液的油层,调ph值6.0,将冷藏液缓慢加入薄层快速干燥滚筒槽内,使滚筒槽内冷藏液液面与滚筒体表面刚接触为止,预热滚筒体表面温度至140℃~150℃,气压为0.4~0.5mpa,打开滚筒滚动启动按钮,筒体转速为3~3.5分钟/转,将滚下的浸膏液体涂布在聚四氟乙烯板上降温,待烘干物料冷却变脆,敲碎,装入洁净双层塑料袋中,即得黄蜀葵花提取物。上述薄层快速干燥操作的条件为:预热薄层快速干燥滚筒体表面温度至135℃~160℃,气压为0.3~0.6mpa,滚筒转速为2~4.5分钟/转,涂布板为塑料板或不锈钢板,塑料板选自聚乙烯版、pvc塑料板、pp塑料板、pe塑料板、聚四氟乙烯板,优选聚四氟乙烯板。本发明所述的黄蜀葵花提取物的优选制备方法为:黄蜀葵花用95%的乙醇,回流提取2次,每次1小时,过滤,合并滤液回收乙醇,浓缩滤液至比重1.20,浓缩液在0℃~4℃静置24~48小时,去除冷藏液的油层,调ph值6.0,浓缩后缓慢加入真空带式干燥机内进行真空带式干燥。作为一个实例,上述黄蜀葵花提取物的制备方法为:取药材黄蜀葵花4000g,用15倍(质量/体积比)95%的乙醇,回流提取2次,每次1小时,过滤,合并滤液回收乙醇,浓缩滤液至比重1.20,浓缩液在0℃~4℃静置24小时,去除冷藏液的油层,调ph值6.0,浓缩后缓慢加入干燥机内,干燥,粉碎,装入洁净双层塑料袋中,即得黄蜀葵花提取物。另一方面,本发明提供了一种黄蜀葵花提取物,所述的黄蜀葵花提取物含有以重量计为以重量计为0.5%以上的槲皮素-3′-o-β-d-葡萄糖苷;进一步地所述的黄蜀葵花提取物含有以重量计为0.5-2.0%的槲皮素-3′-o-β-d-葡萄糖苷;更进一步地,所述的黄蜀葵花提取物含有以重量计为0.8-1.6%的槲皮素-3′-o-β-d-葡萄糖苷。另一方面,本发明提供了上述黄蜀葵花提取物在制备治疗钙离子通道介导的疾病的药物中的应用。另一方面,本发明提供了上述黄蜀葵花提取物在制备诊断、治疗或辅助治疗心血管疾病、冠心病、动脉粥样硬化、晚期肾衰竭、神经疾病、慢性疼痛、急性疼痛或炎性疾病的药物中的用途。另一方面,本发明提供了一种治疗或辅助治疗心血管疾病、冠心病、动脉粥样硬化、晚期肾衰竭、神经疾病、慢性疼痛、急性疼痛或炎性疾病的药物,所述的药物包含槲皮素-3′-o-β-d-葡萄糖苷。作为实例,本发明提供了一种治疗或辅助治疗心血管疾病、冠心病、动脉粥样硬化、晚期肾衰竭、神经疾病、慢性疼痛、急性疼痛或炎性疾病的药物,所述药物包含槲皮素-3′-o-β-d-葡萄糖苷。另一方面,本发明提供了一种新的药理学工具,能够在trpc亚家族之间和内部有所区分。从而能够阐明在生理和病理生理条件下不同通道的作用。即,本发明提供了一种表征属于不同trpc亚家族通道的药理学工具,所述的药理学工具包含槲皮素-3′-o-β-d-葡萄糖苷。根据本发明,这是通过用槲皮素-3′-o-β-d-葡萄糖苷抑制trpc3、trpc6和trpc7实现的。因而,槲皮素-3′-o-β-d-葡萄糖苷能够药理学区分属于不同trpc亚家族的通道。此外,槲皮素-3′-o-β-d-葡萄糖苷不会干扰在许多细胞中介导trpc通道活化的普通g蛋白偶联受体、gq、磷脂酶cβ通路。这些特性使得槲皮素-3′-o-β-d-葡萄糖苷成为鉴定和调节trpc3、trpc6和trpc7的优选工具。作为一种trpc3,trpc6和trpc7的抑制剂,槲皮素-3′-o-β-d-葡萄糖苷可用作一种药理学工具,能够表征属于不同trpc亚家族的通道,区分trpc3/6/7亚家族成员和其他离子通道家族成员(图1-6)。作为这样一种抑制剂,槲皮素-3′-o-β-d-葡萄糖苷可进一步用作一种开发和验证测定法的工具化合物,以测量有关离子通道的活性。这种测定法的一个实例如图1-3所示。另一方面,本发明提供了:针对在生理和病生理条件下,槲皮素-3′-o-β-d-葡萄糖苷对trpc3/6/7亚家族成员进行通道功能的示差分析的用途。这个可以像实施例中描述的那样做到。该分析可以在细胞、组织或动物中进行。动物可为啮齿动物,优选为小鼠或大鼠。根据优选的实施方案,槲皮素-3′-o-β-d-葡萄糖苷对天然trpc的调节能够使用hek293细胞系进行研究,其中hek293细胞系是用于研究内源性表达的trpc离子通道的验证模型系统。实施例和图1-6中给出了这种优选测定系统的进一步详情。另一方面,本发明提供了:测定槲皮素-3′-o-β-d-葡萄糖苷对trpc通道活性影响的方法,优选trpc离子通道为trpc3,trpc6和trpc7。一般来说,表达trpc离子通道的细胞与槲皮素-3′-o-β-d-葡萄糖苷相接触,并且测量或检测槲皮素-3′-o-β-d-葡萄糖苷对trpc离子通道活性的影响。另一方面,本发明提供了:针对鉴定trpc离子通道调节剂的方法,优选trpc离子通道为trpc3、trpc6和trpc7。一般来说,表达trpc离子通道的细胞与测试化合物相接触,并且测量或检测测试化合物对trpc离子通道活性的影响。在实施方案中,上述方法中使用的细胞为荧光细胞。根据本发明优选的细胞为mdck,hek293,hek293t,bhk,cos,nih3t3,swiss3t3或cho细胞,特别是hek293细胞。trpc通道的活性能够通过例如膜片钳技术、全细胞电流、放射性标记离子流,或特别是荧光(例如使用电压敏感染料或离子敏感染料)测量或检测离子流特别是ca2+离子流的变化来进行测量或检测。trpc通道活性测定的一个实例为包含以下步骤的测定法:(1)使槲皮素-3′-o-β-d-葡萄糖苷中与表达trpc离子通道的荧光细胞接触,并在接触之前、同时或之后,使用通道活化剂刺激ca2+内流;(2)检测trpc离子通道活性的变化。另一方面,本发明提供了:针对描述槲皮素-3′-o-β-d-葡萄糖苷对trpc通道的选择性的方法,包含评估槲皮素-3′-o-β-d-葡萄糖苷抑制trpc通道活性的能力。本发明具有如下有益效果:(1)本发明开拓性地提供了槲皮素-3′-o-β-d-葡萄糖苷中的一种或多种的组合物的新用途,在制备抑制钙离子通道的药物中的应用及其相关用途。(2)为制备治疗尤其是trpc通道相关的心血管疾病、冠心病、动脉粥样硬化、晚期肾衰竭、神经疾病、慢性疼痛、急性疼痛和炎性疾病的药物、研发trpc离子通道的选择性抑制剂提供了新的思路;(3)拓展了黄蜀葵花提取物的用途。附图说明图1为不同剂量的槲皮素-3′-o-β-d-葡萄糖苷引起trpc3hek293细胞内ca2+荧光强度随时间的变化图;图2为不同剂量的槲皮素-3′-o-β-d-葡萄糖苷引起trpc6hek293细胞内ca2+荧光强度随时间的变化图;图3为不同剂量的槲皮素-3′-o-β-d-葡萄糖苷引起trpc7hek293细胞内ca2+荧光强度随时间的变化图。图4为黄蜀葵花提取物引起trpc3hek293细胞内ca2+荧光强度随时间的变化图;图5为黄蜀葵花提取物引起trpc6hek293细胞内ca2+荧光强度随时间的变化图;图6为黄蜀葵花提取物引起trpc7hek293细胞内ca2+荧光强度随时间的变化图。具体实施方式为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施例,进一步阐明本发明,但下述实施例仅仅为本发明的优选实施例,并非全部。基于实施方式中的实施例,本领域技术人员在没有做出创造性劳动的前提下所获得其它实施例,都属于本发明的保护范围。下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。本发明实施例中涉及的槲皮素-3′-o-β-d-葡萄糖苷化合物的结构为:制备例:黄蜀葵花提取物的制备取药材黄蜀葵花3000g,黄蜀葵花用19倍95%的乙醇,回流提取2次,每次1小时,过滤,合并滤液回收乙醇,浓缩滤液至比重1.20,浓缩液在0℃~4℃静置48小时,去除冷藏液的油层,调ph值6.0,浓缩后缓慢加入真空带式干燥机内,100℃下干燥,粉碎,装入洁净双层塑料袋中,即得黄蜀葵花提取物。其中,含有槲皮素-3-o-刺槐糖苷5.6(mg/g),异槲皮苷12.2(mg/g),槲皮素-3′-o-β-d-葡萄糖苷11.2(mg/g)。实施例1-6(1)将含有trpc3、trpc6或trpc7离子通道的cdna质粒载体转染到herk293细胞系中,然后根据质粒的抗性选择相应的抗生素孵育细胞,以选择性地筛选转染成功的细胞。对存活下来的细胞进行功能测试,确认通道蛋白的表达和功能,然后通过“有限稀释”过程克隆纯化,从而获得稳定表达特定通道的稳定细胞系。(2)将步骤(1)获得的稳定细胞以10-13×104个/ml,每孔加入150μl细胞悬液加入黑壁底透96孔板。培养箱中培养24h后可用于进行后续实验。(3)观察细胞,确认细胞状态良好后,装载染料(fluo-4)60min。(4)配制通道活化剂和抑制剂溶液,如下:1.trpc6激动剂(m085)配制:称量适量m085溶于二甲基亚砜(dmso),获得浓度为10mm的m085母液。flipr实验中,按照实验步骤加入locke’s缓冲液及其他实验试剂使m085的终浓度为1μm。2.药物配制:黄蜀葵花提取物溶液:称量适量的制备例中的黄蜀葵花提取物,溶于dmso,得到浓度为300mg/ml的黄蜀葵花提取物母液。flipr实验中,按照实验步骤加入locke’s缓冲液及其他实验试剂使黄蜀葵花提取物的终浓度为50μg/ml。槲皮素-3′-o-β-d-葡萄糖苷单体化合物溶液:称量适量的单体化合物,溶于dmso,得到浓度为10mm的单体化合物母液。flipr实验中,按照实验步骤加入locke’s缓冲液及其他实验试剂使单体化合物的终浓度分别为0.1、0.3、3、10和30μm。(5)加药:所用活化剂为m085,用量为1μm;所用抑制剂为槲皮素-3′-o-β-d-葡萄糖苷、制备例的黄蜀葵花提取物(具体见表1),每个实施例的抑制剂分别设置0.1μm、0.3μm、3μm、10μm、30μm五个梯度用量,同时设置不加药对照组(veh)。(6)加药完成后,使用flipr(moleculardevices,sunnyvale,ca,usa)进行细胞内钙离子浓度测定。实施例1-6使用的抑制剂和离子通道类型如表1所示:表1.实施例组名抑制剂离子通道类型实施例1hk-15-trpc3槲皮素-3′-o-β-d-葡萄糖苷trpc3实施例2hk-15-trpc6槲皮素-3′-o-β-d-葡萄糖苷trpc6实施例3hk-15-trpc7槲皮素-3′-o-β-d-葡萄糖苷trpc7实施例4hk-d-total-extract制备例的黄蜀葵花提取物trpc3实施例5hk-d-total-extract制备例的黄蜀葵花提取物trpc6实施例6hk-d-total-extract制备例的黄蜀葵花提取物trpc7以上实施例的检测结果如图1-6所示。图中的横坐标为时间,单位为(s)。除实施例4的图外,其他所有实施例图在400s左右的峰形最高的组为m085组,图1-3中,在400s左右的峰形里由高到低依次是m085组、0.1μm用量、0.3μm用量、3μm用量、10μm用量、30μm用量、不加药对照组(veh)。在图5-6中,在400s左右的峰形里由高到低依次是m085组、hk-d-total-extract组、不加药对照组(veh)。在图4中,在400s左右的峰形里由高到低依次是hk-d-total-extract组、m085组、不加药对照组(veh)。实施例1-3的检测结果分别如图1-3所示,不同剂量组的槲皮素-3′-o-β-d-葡萄糖苷引起细胞内ca2+荧光强度随时间的变化不同。不同剂量的槲皮素-3′-o-β-d-葡萄糖苷能降低m085引起的细胞内ca2+荧光强度的提高成程度,并呈现剂量依赖性。图1和图3中各组在400s时左右细胞内ca2+荧光强度达到高峰,且达峰时间基本差不多,在600s之后细胞内ca2+荧光强度趋于稳定。图2各组在400s之后细胞内ca2+荧光强度达到高峰,在600s之后细胞内钙离子荧光强度趋于稳定。表明槲皮素-3′-o-β-d-葡萄糖苷对trpc3/6/7开放引起的钙离子内流均表现出抑制作用。总的来说,槲皮素-3′-o-β-d-葡萄糖苷对trpc6的ic50=7.518μm。实施例4-6的检测结果分别如图4-6所示,50μg/ml的黄蜀葵花提取物可抑制m085引起的trpc6-hek293细胞和trpc7-hek293细胞中的钙离子内流。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1