一种可控的氧载体微针及其应用的制作方法
本发明涉及生物医用材料及创面修复领域,具体涉及一种可控的氧载体微针及其应用。
背景技术:
微针是指尺寸为微米级的、尖端锋利的针尖及其构成的阵列。由于其合适的长度、锋利的尖端,微针可以刺破皮肤表皮到达真皮层并接触组织液、增强皮肤渗透性和吸收性、实现药物等的递送,同时不接触内部的毛细血管和神经末梢。因此,微针被视为一种微创、几乎无痛的新型生物医学器件,被越来越多地用于医疗美容、疫苗注射和包括糖尿病、皮肤病等在内的常见疾病的治疗中。近来,微针在创面修复领域的应用也受到了广泛关注。
二维材料是指电子仅可在两个维度的纳米尺度上自由运动的材料,常见的二维材料有黑磷、过渡金属碳/氮化物溶液(mxene)、二硫化钼、石墨烯等。所述二维材料在近红外光的照射下,可以将光能转化为热能,具有近红外消光系数大、光热转换效率高、制作工艺简单、细胞毒性小、生物相容性好等优点,被广泛应用于光热转换器件。
氧气是生命不可缺少的基本物质,可以促进细胞增殖、组织生成和组织重塑,并且充足的氧气是创面成功愈合的前提之一。使用载氧材料对创面输送氧气的疗法在创面治疗中十分有效,这点尤其体现在治疗糖尿病伤口等深部乏氧的难愈合伤口方面。
技术实现要素:
本发明的目的是提供一种可控的氧载体微针及其在创面修复上的应用,所述氧载体微针具有良好的光热响应性,可以在近红外刺激下升温,控制氧气的释放。该氧载体微针可以作为优良的氧气控释载体,应用于多种创面修复,如治疗糖尿病创面等难愈合创面。
为实现上述目的,本发明提供的技术方案是:
一种可控的氧载体微针,在微针针尖同时装载具有光热效应的二维材料和载氧的血红蛋白,在近红外作用下能够可控地释放氧气;微针采用如下的方法制备:首先配置含有具有光热效应的二维材料和血红蛋白的针尖原材料溶液,通过离心的方法将针尖原材料溶液填充到具有微米级孔洞的反模板表面,吸走孔洞外周的针尖原材料溶液后,固化得到针尖;然后将基底原材料溶液加到固化后的针尖上,并将基底原材料溶液固化,得到微针基底;最后,进行模板脱离,即可得到可控的氧载体微针。
离心的参数为4000rpm,5分钟;基底原材料溶液滴加0.3-1.5毫升;微针基底由快速溶解的材料构成。
所述的具有光热效应的二维材料选自黑磷量子点、黑磷纳米片、过渡金属碳/氮化物溶液(mxene)、二硫化钼量子点、石墨烯量子点、石墨烯纳米片中的一种。
所述的针尖原材料溶液含有甲基透明质酸、甲基丙烯酸酯明胶、聚乙二醇双丙烯酸酯、聚乙二醇甲基丙烯酸甲酯和丝素蛋白中的一种或多种。采用甲基透明质酸、甲基丙烯酸酯明胶、丝素蛋白,质量分数为10%-30%;采用聚乙二醇双丙烯酸酯、聚乙二醇甲基丙烯酸甲酯,质量分数为20%-80%。
所述的针尖原材料溶液中,具有光热效应的二维材料的浓度范围为0.1-2mg/ml,血红蛋白的浓度范围为1-5mg/ml。
所述的基底原材料溶液选自海藻酸钠、透明质酸、壳聚糖、聚乙烯吡咯烷酮、聚乙二醇和聚乙烯醇中的一种或多种。
微针针尖的半径为100-400μm,长度为300-1000μm,相邻微针的间距为100-800μm。
固化得到针尖的方法为:若针尖原材料溶液含有甲基透明质酸、甲基丙烯酸酯明胶、聚乙二醇双丙烯酸酯或聚乙二醇甲基丙烯酸甲酯,则通过添加体积分数为1%的2-羟基-2-甲基苯丙酮在紫外照射下固化;否则,通过在37度温度下烘干12小时固化;基底原材料溶液固化的方法为:基底原材料溶液通过在37度温度下烘干12小时固化。
所述的可控的氧载体微针作为创面修复药物的应用。所述的创面修复包括糖尿病引发的难愈合创面。
与现有技术相比,本发明的有益效果是:
(1)本发明的氧载体微针可在近红外光的作用下升高局部温度,促进氧气从血红蛋白的分离,从而实现氧气的可控释放。
(2)本发明的氧载体微针在刺入创口皮肤后,微针基底可快速溶解从而和微针针尖分离,将微针针尖留在皮肤内,实现组织较深部分的供氧。
(3)本发明的氧载体微针通过在创口提供富氧环境加速创面愈合。
(4)本发明的氧载体微针还具有制备简单、易批量化、使用方便等优点。
附图说明
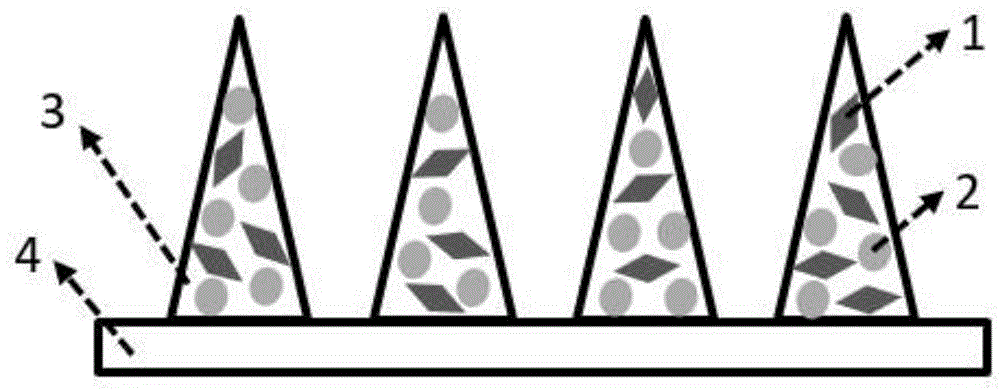
图1是本发明一种可控的氧载体微针的组成及结构示意图:其中1为具有光热效应的二维材料,2为载氧的血红蛋白,3为微针针尖,4为微针基底。
图2是本发明一种可控的氧载体微针的实物图。
图3是实施例4的氧载体微针氧气释放情况的柱状统计图。
图4是接受氧载体微针治疗的大鼠和不接受治疗的大鼠的背部创面随时间的变化图。
具体实施方式
以下结合具体实施例对上述方案做进一步说明。应理解,这些实施例是用于说明本发明而不限于限制本发明的范围。凡根据本发明精神实质所做的等效变换或修饰,都应涵盖在本发明的保护范围之内。实施例中采用的实施条件可以根据具体检测的条件做进一步调整,未注明的实施条件通常为常规实验中的条件。
实施例1
一种含有黑磷量子点且以聚乙烯醇为基底的氧载体微针的制备:
均匀混合黑磷量子点、血红蛋白、甲基丙烯酸酯明胶和2-羟基-2-甲基苯丙酮以配置针尖原材料溶液,各成分最终浓度为黑磷量子点0.1mg/ml,血红蛋白2mg/ml,甲基丙烯酸酯明胶0.3g/ml,2-羟基-2-甲基苯丙酮1%(体积分数)。通过离心(4000rpm,5分钟)将其填充到具有微米级孔洞的反模板表面,并用移液枪吸走孔洞外的针尖原材料溶液,紫外光固化25秒得到针尖。选择聚乙烯醇溶液作为基底原材料溶液,将其滴加到固化后的针尖上,在37度温度下烘干12小时以固化基底。将制得的微针从反模板中小心剥离,即可得到光可控的氧载体微针,如图1和图2所示。
实施例2
一种含有二硫化钼量子点且以聚乙烯醇为基底的氧载体微针的制备:
均匀混合二硫化钼量子点、血红蛋白、甲基丙烯酸酯明胶和2-羟基-2-甲基苯丙酮以配置针尖原材料溶液,各成分最终浓度为二硫化钼量子点0.15mg/ml,血红蛋白2mg/ml,甲基丙烯酸酯明胶0.3g/ml,2-羟基-2-甲基苯丙酮1%(体积分数)。通过离心(4000rpm,5分钟)将其填充到具有微米级孔洞的反模板表面,并用移液枪吸走孔洞外的针尖原材料溶液,紫外光固化25秒得到针尖。选择聚乙烯醇溶液作为基底原材料溶液,将其滴加到固化后的针尖上,在37度温度下烘干12小时以固化基底。将制得的微针从反模板中小心剥离,即可得到可控的氧载体微针。
实施例3
一种含有黑磷量子点且以聚乙烯吡咯烷酮为基底的氧载体微针的制备:
均匀混合黑磷量子点、血红蛋白、甲基丙烯酸酯明胶和2-羟基-2-甲基苯丙酮以配置针尖原材料溶液,各成分最终浓度为黑磷量子点0.1mg/ml,血红蛋白2mg/ml,甲基丙烯酸酯明胶0.3g/ml,2-羟基-2-甲基苯丙酮1%(体积分数)。通过离心(4000rpm,5分钟)将其填充到具有微米级孔洞的反模板表面,并用移液枪吸走孔洞外的针尖原材料溶液,紫外光固化25秒得到针尖。选择聚乙烯吡咯烷酮溶液作为基底原材料溶液,将其滴加到固化后的针尖上,在37度温度下烘干12小时以固化基底。将制得的微针从反模板中小心剥离,即可得到可控的氧载体微针。
实施例4
近红外控制氧载体微针的氧气释放:
先将磷酸盐缓冲液通氮气处理24小时,以尽可能地除去氧气。随后,把氧载体微针浸泡在氮气处理过的磷酸盐缓冲液中,并用功率约为1.5瓦的近红外照射。在0时、4时、10时、16时和24时分别用氧分压测试仪(hemoxanalyzer)测量磷酸盐缓冲液中的氧分压变化,测量结果如图3所示。
实施例5
氧载体微针用于大鼠创面修复:
在大鼠背部制造直径为1厘米的圆形创面,并随机等分为两组。其中一组不做任何处理,另一组接受氧载体微针的治疗。接受治疗组的具体操作为:首先,氧载体微针被按压在伤口表面10分钟,使得微针基底完全溶解,而微针针尖被保留在模拟皮肤内;随后,用功率约为1.5w的近红外灯照射施加微针处,近红外灯和伤口的距离为5厘米;每天进行十次近红外照射,每次照射时间为3分钟。记录第0、3、5、7、9天创面的恢复情况,如图4所示,可见接受氧载体微针治疗的大鼠恢复情况远远好于不做处理的大鼠。
以上所述,仅是本发明的较佳实施例,并非对本发明作任何形式上的限制,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,依据本发明的技术实质,对以上实施例所作的任何简单的修改、等同替换与改进等,均仍属于本发明技术方案的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!