一种光响应型工程菌肠道靶向光遗传载体系统及构建方法和应用与流程
本发明属于生物技术和医药技术领域,尤其是一种光响应型工程菌肠道靶向光遗传载体系统及构建方法和应用。
背景技术:
临床应用表明,重组工程菌移植在艰难梭菌感染、炎症性肠病、糖尿病、癌症、肝硬化及相关脑病的预防、缓解和治疗中发挥着不可或缺的作用。已有研究报道,通过重组工程菌定植可缓解临床上90%的艰难梭菌感染症状;在帕金森病动物模型中,重组工程菌移植在调节运动功能缺损和神经炎症方面也发挥重要作用。此外,与口服或注射用药相比,细菌作为肠道的内生“药物工厂”,更适合小分子蛋白质和多肽药物的递送,避免了药物递送过程中的降解和免疫排斥。传统的重组工程菌定植方法依赖于细菌本身的随机沉降,从而使工程菌的定植周期和定植位置无法控制,导致重组工程菌临床推广应用处于停滞状态。
一般来说,重组工程菌成功定植的必要条件是重组菌锚定于肠上皮细胞或黏膜层。这种锚定现象取决于细菌表面黏附蛋白与其相互作用。有报道称,乳酸菌表面形成菌毛的spacba蛋白复合物是使其黏附于宿主肠道肠上皮细胞和黏液层的原因。其中微生物具有不同的黏附相关大分子(蛋白质、血凝素和多聚糖等)分泌系统,通过调控的方式来控制微生物分泌预期数量的大分子,使外源工程菌时空精准地定植于宿主特定肠断(十二指肠、空肠、回肠、结肠等),有望解决重组工程菌移植面临的临床难题。本申请人设想通过调控使工程菌在“开”和“关”状态下相互转化。在“开”状态下,工程菌分泌黏连蛋白协助定植,在“关”状态下,工程菌处于静息状态。目前,小分子物质调控系统,如tetracycline-inducedtetr系统和bht-inducedpr-α系统,已用来影响工程菌的生物学功能。然而,由于在复杂的肠道环境中难以追踪化学诱导物质,因此增加了精准调控的难度。“光遗传技术”的时空精度在神经调节领域中表现突出。其中,光遗传调控方法通过遗传编码光依赖受体或光敏感转录元件已在细胞分辨率水平上实现了对神经元的精确操作。与化学诱导剂相比,光以其毒性小、快速激活和失活等优点在控制细胞行为方面表现出巨大潜力。利用光作为媒介,如蓝光敏感的pdawn系统和红光敏感的cph8系统,已经能够准确地调控细菌的基因表达。
通过检索,尚未发现与本专利申请相关的公开专利文献。
技术实现要素:
本发明目的在于克服现有技术中的不足之处,提供一种光响应型工程菌肠道靶向光遗传载体系统及构建方法和应用。
本发明解决其技术问题所采用的技术方案是:
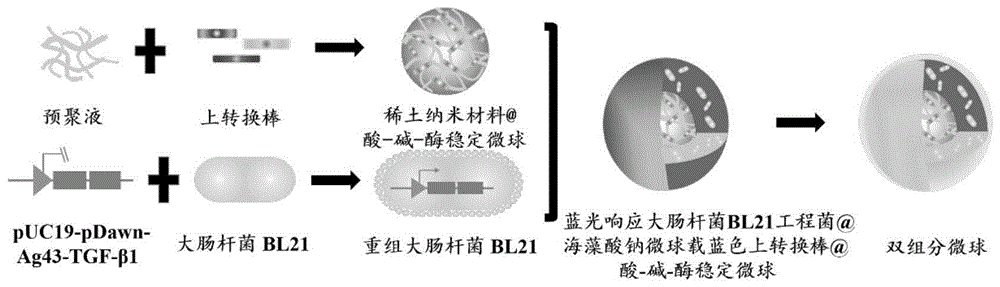
一种光响应型工程菌肠道靶向光遗传载体系统,所述系统为蓝光响应工程菌bl21@ph敏感微球载稀土纳米材料@酸-碱-酶稳定的双组分微球,该双组分微球为均匀包裹壳聚糖的工程菌bl21@海藻酸钠微球载稀土纳米材料@酸-碱-酶稳定微球;
所述工程菌bl21@海藻酸钠微球载稀土纳米材料@酸-碱-酶稳定微球包括工程菌bl21puc19-pdawn-ag43-tgf-β1、稀土纳米材料@酸-碱-酶稳定微球和海藻酸钠;所述工程菌bl21@海藻酸钠微球载稀土纳米材料@酸-碱-酶稳定微球具有高效递送工程菌bl21和稀土纳米材料的双组分递送功能;
所述工程菌bl21puc19-pdawn-ag43-tgf-β1包含光响应启动子pdawn、黏附基因ag43、工程菌表面展示因子tgf-β1;所述光响应启动子pdawn、黏附基因ag43具有光控定位功能,工程菌表面展示因子tgf-β1能够与肠道黏膜系统共同承担免疫协同功能;
所述混合稀土纳米材料@酸-碱-酶稳定微球具有将近红外光转换成可视光源的功能。
而且,所述近红外光为980nm.。
而且,所述双组分微球粒径为400-1000μm,所述稀土纳米材料@酸-碱-酶稳定微球粒径为80-1000μm。
而且,所述双组分微球的粒径通过调节微流控平台中内外两相流体的流速控制。
而且,所述系统为一种智能化、精准化、可视化和无创化的外源工程菌高效递送,该系统利用光遗传技术激活光响应外源工程菌,实现外源工程菌在宿主肠道病灶部位的靶向有效定植,进一步实现外源光响应工程菌发挥免疫调控的时空精准性。
如上所述的载体系统的制备方法,具体方法如下:
⑴制备稀土纳米材料@酸-碱-酶稳定微球:称取稀土纳米材料溶于预聚液中,稀土纳米材料:预聚液的比例g:ml为0.1-0.5:1-5,预聚液的组成比例为:聚乙二醇二丙烯酸酯:聚乙二醇:2-羟基-2-甲基-1-苯基-1-丙酮的体积比为5:4-3:1-2,预聚液在制备时,直接将聚乙二醇二丙烯酸酯:聚乙二醇:2-羟基-2-甲基-1-苯基-1-丙酮按比例混匀即可;超声分散,避光保存,作为内液;二甲基硅油作为外液;然后制备粒径均一的稀土纳米材料@酸-碱-酶稳定微球,其中内液的流速为10-160ul/min,内液与外液的流速比为1:30-40;
⑵构建蓝光响应型大肠杆菌bl21工程菌株:利用pcr技术从模板addgene#107742扩增pdawn-ag43片段;利用pcr技术将载体puc19线性化,并避开原有启动子区域;利用同源重组,将pdawn-ag43片段与puc19载体连接,构建的质粒puc19-pdawn-ag43首先转化dh5a感受态菌株,测序获得重组阳性质粒;在此基础上构建含有绿色荧光蛋白gfp报告基因的大肠杆菌bl21表达质粒puc19-pdawn-ag43-gfp及含有转换生长因子tgf-β1免疫因子的大肠杆菌bl21表达质粒puc19-pdawn-ag43-tgf-β1;
⑶构建光响应型工程菌肠道靶向光遗传载体系统:将培养至od=0.3-0.6的工程菌bl21puc19-pdawn-ag43-tgf-β1离心重悬后,混合稀土纳米材料@酸-碱-酶稳定微球,加入到质量分数为0.1-0.5%的海藻酸钠溶液中,其中工程菌bl21p8uc19-pdawn-ag43-tgf-β1:稀土纳米材料@酸-碱-酶稳定微球:海藻酸钠溶液的体积比为1-2:1:7-8;搅拌均匀后作为内液;二甲基硅油与cacl2超细粉末共混后作为外液,二甲基硅油与cacl2的比例ml:g为1-5:1;然后制备粒径均一的蓝光响应工程菌bl21@海藻酸钠微球载稀土纳米材料@酸-碱-酶稳定微球的双组分微球;其中内液的流速为40-100ul/min,内液与外液的流速比为1:20-40;以上操作均为无菌操作;
将制备的双组分微球与质量浓度1%-5%的壳聚糖溶液共混后封装于注射器内,其中双组分微球:壳聚糖溶液的体积比为1:5-10,注射器针头呈45°弯曲,借助注射器的推力,均匀包裹壳聚糖的工程菌bl21@海藻酸钠微球载稀土纳米材料@酸-碱-酶稳定微球从注射器针头挤出,冷冻干燥后即得到蓝光响应工程菌bl21@ph敏感微球载稀土纳米材料@酸-碱-酶稳定的双组分微球,包裹壳聚糖的双组分微球能够避免胃酸的腐蚀,使稀土纳米材料@酸-碱-酶稳定微球和光响应工程菌精准到达肠道。
而且,所述步骤⑴中使用微流控平台制备粒径均一的稀土纳米材料@酸-碱-酶稳定微球。
而且,所述步骤⑶中使用简易微流控平台制备粒径均一的蓝光响应工程菌bl21@海藻酸钠微球载稀土纳米材料@酸-碱-酶稳定微球的双组分微球。
如上所述的光响应型工程菌肠道靶向光遗传载体系统在制备炎症性肠病治疗药物方面中的应用。
如上所述的光响应型工程菌肠道靶向光遗传载体系统在制备预防炎症性肠病治疗药物方面中的应用。
本发明取得的优点和积极效果为:
1、本发明光响应型工程菌肠道光遗传载体系统为一种蓝光响应工程菌bl21@ph敏感微球载稀土纳米材料@酸-碱-酶稳定的双组分微球,形貌均一,分散性好,可靶向炎症性肠病病灶部位,同时释放蓝光响应的工程菌bl21和稀土纳米材料@酸-碱-酶稳定微球,利用“光遗传技术”实现外源工程菌的精准有效定植,进一步实现对炎症性肠病的缓解与治疗。
2、本发明系统有望通过双组分微球ph敏感缓释定位、光响应精准启动、肠道黏膜免疫系统协同应答实现外源工程菌在宿主肠道病灶部位的靶向有效定植,进一步实现外源光响应工程菌发挥免疫调控的时空精准性,从而最大程度实现炎对症性肠病的病程抑制、原位治疗和预防复发。
3、本发明光响应型工程菌肠道靶向光遗传载体系统通过ph敏感缓释定位、光响应精准启动、肠道黏膜免疫系统协同应答实现外源工程菌对炎对症性肠病的病程抑制、原位治疗和预防复发。本发明创新性的将“光遗传学-合成生物学-纳米技术”有机融合,开发了一套可实现外源工程菌在宿主肠道内靶向有效定植的新策略。在此基础上精准调控工程菌分泌单一治疗因子,激活肠道黏膜免疫。
4、本发明创新性地将“光遗传学-合成生物学-纳米技术”有机融合,开发了一套可实现外源工程菌在宿主肠道内靶向有效定植的新策略。在此基础上精准调控工程菌分泌单一治疗因子,激活肠道黏膜免疫。
5、本发明双组分载体系统可实现智能化、精准化、可视化和无创化的外源工程菌高效递送;利用“光遗传技术”激活外源工程菌,实现外源工程菌在宿主肠道病灶部位的靶向有效定植,进一步实现外源光响应工程菌发挥免疫调控的时空精准性。
附图说明
图1为本发明中双组分载体系统的一种制备流程工艺图;
图2为本发明中稀土纳米材料@酸-碱-酶稳定微球的稳定性验证图;
图3为本发明中稀土纳米材料和稀土纳米材料@酸-碱-酶稳定微球的光转换效率验证图;
图4为本发明中稀土纳米材料和稀土纳米材料@酸-碱-酶稳定微球的细胞安全性验证图;
图5为本发明中启动子pdawn的蓝光响应效率和响应时间验证图;
图6为本发明中大肠杆菌bl21分泌黏附蛋白ag43的黏附效果验证图;
图7为本发明中工程菌bl21分泌tgf-β1的验证图;
图8为本发明中双组分微球的稳定性验证图;
图9为本发明中双组分微球的细胞安全性验证图;
图10为本发明中il-6,tnf-α及ifn-β的血清含量检测图;
图11为本发明中微流控平台的一种结构连接照片图;
图12为本发明中简易微流控平台的一种结构连接示意图。
具体实施方式
下面详细叙述本发明的实施例,需要说明的是,本实施例是叙述性的,不是限定性的,不能以此限定本发明的保护范围。
本发明中所使用的原料,如无特殊说明,均为常规的市售产品;本发明中所使用的方法,如无特殊说明,均为本领域的常规方法。
一种光响应型工程菌肠道靶向光遗传载体系统,所述系统为蓝光响应工程菌bl21@ph敏感微球载稀土纳米材料@酸-碱-酶稳定的双组分微球,该双组分微球为均匀包裹壳聚糖的工程菌bl21@海藻酸钠微球载稀土纳米材料@酸-碱-酶稳定微球;
所述工程菌bl21@海藻酸钠微球载稀土纳米材料@酸-碱-酶稳定微球包括工程菌bl21puc19-pdawn-ag43-tgf-β1、稀土纳米材料@酸-碱-酶稳定微球和海藻酸钠;所述工程菌bl21@海藻酸钠微球载稀土纳米材料@酸-碱-酶稳定微球具有高效递送工程菌bl21和稀土纳米材料的双组分递送功能;
所述工程菌bl21puc19-pdawn-ag43-tgf-β1包含光响应启动子pdawn、黏附基因ag43、工程菌表面展示因子tgf-β1;所述光响应启动子pdawn、黏附基因ag43具有光控定位功能,工程菌表面展示因子tgf-β1能够与肠道黏膜系统共同承担免疫协同功能;
所述混合稀土纳米材料@酸-碱-酶稳定微球具有将近红外光转换成可视光源的功能。
较优地,所述近红外光为980nm.。
较优地,所述双组分微球粒径为400-1000μm,所述稀土纳米材料@酸-碱-酶稳定微球粒径为80-1000μm。
较优地,所述双组分微球的粒径通过调节微流控平台中内外两相流体的流速控制。
较优地,所述系统为一种智能化、精准化、可视化和无创化的外源工程菌高效递送,该系统利用光遗传技术激活光响应外源工程菌,实现外源工程菌在宿主肠道病灶部位的靶向有效定植,进一步实现外源光响应工程菌发挥免疫调控的时空精准性。
如上所述的载体系统的制备方法,具体方法如下:
⑴制备稀土纳米材料@酸-碱-酶稳定微球:称取稀土纳米材料(如蓝色上转换棒,可简称为上转换棒)溶于预聚液中,稀土纳米材料:预聚液的比例g:ml为0.1-0.5:1-5,预聚液的组成比例为:聚乙二醇二丙烯酸酯-200:聚乙二醇-700(其中,200,700是这两种物质的分子量):2-羟基-2-甲基-1-苯基-1-丙酮的体积比为5:4-3:1-2,预聚液在制备时,直接将聚乙二醇二丙烯酸酯-200:聚乙二醇-700:2-羟基-2-甲基-1-苯基-1-丙酮按比例混匀即可;超声分散,避光保存,作为内液;二甲基硅油作为外液;然后制备粒径均一的稀土纳米材料@酸-碱-酶稳定微球,其中内液的流速为10-160ul/min,内液与外液的流速比为1:30-40;此部分中稀土纳米材料@酸-碱-酶稳定微球承担双组分微球中将近红外光(980nm)转换为可视光源的功能;
⑵构建蓝光响应型大肠杆菌bl21工程菌株:利用pcr技术从模板addgene#107742扩增pdawn-ag43片段;利用pcr技术将载体puc19线性化,并避开原有启动子区域;利用同源重组,将pdawn-ag43片段与puc19载体连接,构建的质粒puc19-pdawn-ag43首先转化dh5a感受态菌株,测序获得重组阳性质粒;在此基础上构建含有绿色荧光蛋白gfp报告基因的大肠杆菌bl21表达质粒puc19-pdawn-ag43-gfp(这个质粒是用来确认启动子pdawn的蓝光响应效率的)及含有转换生长因子tgf-β1免疫因子的大肠杆菌bl21表达质粒puc19-pdawn-ag43-tgf-β1;此部分中光响应启动子pdawn及黏附基因ag43承担的光控定位功能,工程菌表面展示因子tgf-β1和肠道黏膜系统共同承担免疫协同功能;
⑶构建光响应型工程菌肠道靶向光遗传载体系统:将培养至od=0.3-0.6的工程菌bl21puc19-pdawn-ag43-tgf-β1离心重悬后,混合稀土纳米材料@酸-碱-酶稳定微球,加入到质量分数为0.1-0.5%的海藻酸钠溶液中,其中工程菌bl21p8uc19-pdawn-ag43-tgf-β1:稀土纳米材料@酸-碱-酶稳定微球:海藻酸钠溶液的体积比为1-2:1:7-8;搅拌均匀后作为内液;二甲基硅油与cacl2超细粉末共混后作为外液,二甲基硅油与cacl2的比例ml:g为1-5:1;然后制备粒径均一的蓝光响应工程菌bl21@海藻酸钠微球载稀土纳米材料@酸-碱-酶稳定微球的双组分微球;其中内液的流速为40-100ul/min,内液与外液的流速比为1:20-40;此部分中工程菌bl21@海藻酸钠微球载稀土纳米材料@酸-碱-酶稳定微球的双组分微球承担智能递送功能,将稀土纳米材料和工程菌精准递送到宿主肠道;以上操作均为无菌操作;
将制备的双组分微球与质量浓度1%-5%的壳聚糖溶液共混后封装于注射器内,其中双组分微球:壳聚糖溶液的体积比为1:5-10,注射器针头呈45°弯曲,借助注射器的推力,均匀包裹壳聚糖的工程菌bl21@海藻酸钠微球载稀土纳米材料@酸-碱-酶稳定微球从注射器针头挤出,冷冻干燥后即得到蓝光响应工程菌bl21@ph敏感微球载稀土纳米材料@酸-碱-酶稳定的双组分微球,包裹壳聚糖的双组分微球能够避免胃酸的腐蚀,使稀土纳米材料@酸-碱-酶稳定微球和光响应工程菌精准到达肠道。
较优地,所述步骤⑴中使用微流控平台(可以使用现有技术中的其它类似平台,也可以使用如图11所示的平台)制备粒径均一的稀土纳米材料@酸-碱-酶稳定微球。
较优地,所述步骤⑶中使用简易微流控平台(可以使用现有技术中的其它类似平台,也可以使用如图12所示的平台)制备粒径均一的蓝光响应工程菌bl21@海藻酸钠微球载稀土纳米材料@酸-碱-酶稳定微球的双组分微球。
如上所述的光响应型工程菌肠道靶向光遗传载体系统在制备炎症性肠病治疗药物方面中的应用。
如上所述的光响应型工程菌肠道靶向光遗传载体系统在制备预防炎症性肠病治疗药物方面中的应用。
具体地,相关制备及检测步骤如下:
(1)制备稀土纳米材料@酸-碱-酶稳定微球:称取0.1-0.5g稀土纳米材料棒溶于1-5ml预聚液中,预聚液的组成比例为pegda-200:peg-700:hmpp=5:3:2。超声分散,避光保存,作为内液。二甲基硅油作为外液。依托天津大学生命科学学院纳米技术实验室搭建的微流控平台制备粒径均一的稀土纳米材料@酸-碱-酶稳定微球。
(2)构建蓝光响应型大肠杆菌bl21工程菌株:利用pcr技术从模板(addgene#107742)扩增pdawn-ag43片段。利用pcr技术将载体puc19线性化,并避开原有启动子区域。利用同源重组,将pdawn-ag43片段与puc19载体连接,构建的质粒puc19-pdawn-ag43首先转化dh5a感受态菌株,测序获得重组阳性质粒。在此基础上构建含有绿色荧光蛋白(gfp)报告基因的大肠杆菌bl21表达质粒puc19-pdawn-ag43-gfp及含有转换生长因子(tgf-β1)免疫因子的大肠杆菌bl21表达质粒puc19-pdawn-ag43-tgf-β1。
(3)构建光响应型工程菌肠道靶向光遗传载体系统:将培养至od=0.3-0.6的大肠杆菌bl21(puc19-pdawn-ag43-tgf-β1)离心重悬后,混合稀土纳米材料@酸-碱-酶稳定微球,加入到质量分数0.1-0.5%的海藻酸钠溶液中。搅拌均匀后作为内液。二甲基硅油与cacl2超细粉末共混后作为外液。依托天津大学生命科学学院纳米技术实验室搭建的简易微流控平台制备粒径均一的蓝光响应大肠杆菌bl21工程菌@海藻酸钠微球载稀土纳米材料@酸-碱-酶稳定微球的双组分微球。将制备的双组分微球与1%-5%的壳聚糖溶液共混后封装于50ml注射器内,注射器针头呈45°弯曲,以“天女散花”式将封装于注射器内的混合液挤出,即得到蓝光响应大肠杆菌bl21工程菌@ph敏感微球载稀土纳米材料@酸-碱-酶稳定的双组分微球。
更为具体地,相关制备如下:
实施例1
制备稀土纳米材料@酸-碱-酶稳定微球:称取0.4g稀土纳米材料棒溶于2ml预聚液中,预聚液的组成比例为pegda-200:peg-700:hmpp=5:3:2。超声分散,避光保存,作为内液。二甲基硅油作为外液。依托天津大学生命科学学院纳米技术实验室搭建的微流控平台制备粒径均一的稀土纳米材料@酸-碱-酶稳定微球。
实施例2
构建蓝光响应型大肠杆菌bl21工程菌株:利用pcr技术从模板(addgene#107742)扩增pdawn-ag43片段。利用pcr技术将载体puc19线性化,并避开原有启动子区域。利用同源重组,将pdawn-ag43片段与puc19载体连接,构建的质粒puc19-pdawn-ag43首先转化dh5a感受态菌株,测序获得重组阳性质粒。在此基础上构建含有转换生长因子(tgf-β1)免疫因子的大肠杆菌bl21表达质粒puc19-pdawn-ag43-tgf-β1。
实施例3
构建光响应型工程菌肠道光遗传载体系统:将培养至od=0.6的大肠杆菌bl21(puc19-pdawn-ag43-tgf-β1)离心重悬后,混合稀土纳米材料@酸-碱-酶稳定微球,加入到质量分数0.1-0.5%的海藻酸钠溶液中。搅拌均匀后作为内液。二甲基硅油与cacl2超细粉末共混后作为外液。依托天津大学生命科学学院纳米技术实验室搭建的简易微流控平台制备粒径均一的蓝光响应大肠杆菌bl21工程菌@海藻酸钠微球载稀土纳米材料@酸-碱-酶稳定微球的双组分微球。以上实验均为无菌操作。将制备的双组分微球与2%的壳聚糖溶液共混后封装于50ml注射器内,注射器针头呈45°弯曲,以“天女散花”式将封装于注射器内的混合液挤出,即得到蓝光响应大肠杆菌bl21工程菌@ph敏感微球载稀土纳米材料@酸-碱-酶稳定的双组分微球。
本发明中评估本发明制备的稀土纳米材料@酸-碱-酶稳定微球体外稳定性及安全性实验技术如下:
体外模拟消化道环境,将优化制备的稀土纳米材料@酸-碱-酶稳定微球分别置于ph=2、ph=7、ph=8以及胃蛋白酶胰蛋白酶缓冲液中。通过荧光显微镜观察微球前后的形貌,见图2,稀土纳米材料@酸-碱-酶稳定微球分别置于ph=2胃蛋白酶缓冲液、ph=7胃蛋白酶缓冲液、ph=8酶胰蛋白酶缓冲液中前后静置4小时后,从明场来看微球仍保持原有的稳定形态,从荧光场来看,稀土纳米材料仍稳定存在于微球内部。通过光功率计对比稀土纳米材料和稀土纳米材料@酸-碱-酶稳定微球转换近红外光(980nm)的效率,见图3,在ph=2的胃蛋白酶缓冲液中和ph=8酶胰蛋白酶缓冲液中,稀土纳米材料@酸-碱-酶稳定微球的转换效率±98%等于稀土纳米材料转换近红外光(980nm)的效率。通过mtt验证稀土纳米材料@酸-碱-酶稳定微球的生物安全性,见图4,在探究的浓度条件下,小肠内分泌细胞stc-1的存活率均在80%以上。由此评估活体实验最佳用量为1ng/ml。
评估本发明制备的puc19-pdawn-ag43-gfp及puc19-pdawn-ag43-tgf-β1质粒的功能实验技术如下:
(1)将重组阳性质粒puc19-pdawn-ag43-gfp化学转换大肠杆菌bl21,将含puc19-pdawn-ag43-gfp质粒的蓝光响应大肠杆菌工程菌株按照1:100的比例接入lb培养基,培养至对数期时(od600=0.5),给予脉冲式蓝光诱导。分别在诱导0分钟,10分钟,20分钟,60分钟及120分钟时取样500μl,利用4%多聚甲醛室温固定3min,用pbs在8000rpm/min条件下离心1min,重复一次后用500μlpbs重悬,利用流式细胞检测技术评估启动子pdawn的蓝光响应效率,见图5,通过流式细胞仪筛选得到启动子pdawn的蓝光响应时间为20分钟,在120分钟内响应效率可达到50%。另外在诱导120分钟时取样100μl,接种于24孔板,通过结晶紫染色验证ag43的黏附效果,见图6,大肠杆菌bl21分泌的ag43可以将细菌牢固的黏附于孔板底部。
(2)将重组阳性质粒puc19-pdawn-ag43-tgf-β1化学转换大肠杆菌bl21,将含puc19-pdawn-ag43-tgf-β1质粒的蓝光响应的大肠杆菌工程菌株按照1:100的比例接入lb培养基,培养至对数期时(od600=0.5),给予脉冲式蓝光诱导。利用elisa试剂盒检测工程菌bl21分泌的tgf-β1的含量,见图7,tgf-β1的分泌量相对稳定在蓝光诱导30分钟后达到50ng/l。
评估本发明制备的蓝光响应工程菌bl21@ph敏感微球载稀土纳米材料@酸-碱-酶稳定的双组分微球体外缓释性及安全性实验技术如下:
体外模拟消化道环境,将优化制备的光响应工程菌bl21@ph敏感微球载稀土纳米材料@酸-碱-酶稳定的双组分微球分别置于ph=2、ph=7、ph=8以及胃蛋白酶胰蛋白酶缓冲液中。通过荧光显微镜观察双组分微球前后的形貌,见图8,从明场来看置于ph=7胃蛋白酶缓冲液中的双组分微球吸水胀大,形貌变得不规则。从明场来看置于ph=8胰蛋白酶缓冲液中的双组分微球外层的ph敏感材料完全被降解,内部的稀土纳米材料@酸-碱-酶稳定微球释放出来。通过mtt验证光响应大肠杆菌bl21工程菌@ph敏感微球载稀土纳米材料@酸-碱-酶稳定的双组分微球生物安全性,见图9,在探究的浓度条件下,小肠内分泌细胞stc-1的存活率均在60%以上,由此评估活体实验最佳用量为1ng/ml。
评估本发明制备的双组分载体系统宿主肠道内的定植效率及炎症性肠病治疗功能实验技术如下:
构建c57bl/6小鼠急性肠炎模型,口服双组分微球后,近红外照射小鼠腹腔启动光响应工程菌。通过组织切片和免疫组化,验证外源工程菌有效递送到急性肠炎病灶部位;通过微生物多样性分析,验证肠道菌群稳态;通过动物行为学(步态、旷场),统计分析小鼠治疗的恢复程度。在此基础上,通过elisa试剂盒检测血液中il-6,tnf-α及ifn-β等分子指标的表达含量,结果见图10,炎性指标恢复到正常水平。进一步绘制生存曲线,验证光响应型工程菌肠道光遗传载体系统治疗的效果。
尽管为说明目的公开了本发明的实施例,但是本领域的技术人员可以理解:在不脱离本发明及所附权利要求的精神和范围内,各种替换、变化和修改都是可能的,因此,本发明的范围不局限于实施例所公开的内容。
- 还没有人留言评论。精彩留言会获得点赞!