miR-302b-3p在作为口腔鳞状细胞癌抗肿瘤标志物中的用途
mir-302b-3p在作为口腔鳞状细胞癌抗肿瘤标志物中的用途
技术领域
1.本发明属于肿瘤诊断和治疗领域。
背景技术:
2.口腔鳞状细胞癌(oscc),简称口腔鳞癌,约占口腔颌面部恶性上皮源性肿瘤的90%,其对头颈及颌面局部美观及功能的破坏性极大,具有较高的转移率和较差的预后。oscc细胞具有较高的侵袭迁移能力,易在疾病的早期阶段侵犯周围组织并转移至局部淋巴结,此后可通过淋巴管、血管等转移至远隔器官,发生转移性肿瘤。基于上述特点,oscc患者的治疗常不及时,现有治疗方式的远期效果仍不理想,死亡率较高,五年生存率只有50%左右。因此,寻找阻遏口腔黏膜癌变并抑制oscc转移的关键分子迫在眉睫。在临床中尽早关注这些警示因子,对于随时监测疾病进展及防治口腔黏膜癌变,具有重要意义。
3.mirna是长度约为20个核苷酸序列的单链小rna,是非编码rna的一种,在调控基因表达方面具有较高的效能,在组织发育和各种疾病中有各自协调有序的表达模式,参与细胞生物学行为的方方面面,亦参与了多种肿瘤性疾病的发生与发展。它可通过控制细胞周期在基因水平上直接调控细胞功能;也可通过抑制靶基因的翻译或清除靶基因转录体等途径,在转录后水平对基因表达进行调控。mirna通常是通过rna诱导沉默复合体(rnainduced silencing complex,risc)发挥作用的。目前已有学者研究了差异表达的mirna在多种肿瘤性疾病中的作用及机制,其调控的肿瘤细胞生物学行为包括细胞干性、增殖、凋亡、血管形成、侵袭与迁移、肿瘤免疫等。
4.has-mir-302b-3p(人mir-302b-3p,简称“mir-302b-3p”)是mirnas家族中的重要组成部分,根据mirna领域权威数据库mirbase(http://www.mirbase.org/),其曾用名为hsa-mir-302b(简称“mir-302b”)。研究发现,在oscc肿瘤处分离得到的hsc-3细胞内抑制mir-302a或mir-302b表达,可导致cd44v3和aldh1同时高表达的细胞(cd44是肿瘤干细胞标志物,aldh1是头颈鳞状细胞癌肿瘤干细胞标志物)受到功能性抑制,包括自我更新、肿瘤生长受到抑制(hyaluronan-cd44v3interaction with oct4-sox2-nanog promotes mir-302expression leading to self-renewal,clonal formation,and cisplatin resistance in cancer stem cells from head and neck squamous cell carcinoma.journal of biological chemistry,2012,287(39):32800-32824),表明mir-302b有可能促进oscc细胞增殖。另有研究表明,oscc患者唾液外泌体中含有mir-302b-3p,但是健康人唾液外泌体中不含mir-302b-3p(salivary extracellular vesicle-associated mirnas as potential biomarkers in oral squamous cell carcinoma.bmc cancer.2018apr18;18(1):439.),由此可以推论:mir-302b-3p有可能是oscc促癌因子,口腔细胞mir-302b-3p的表达量越高,患有oscc的可能性越高,但这一观点尚未被完全证实。
5.另外,目前尚未见mir-302b-3p与oscc侵袭性或迁移性的报道。
技术实现要素:
6.本发明的目的在于:提供mir-302b-3p在作为口腔鳞状细胞癌抗肿瘤标志物中的用途,具体的,分为两个方面:第一个方面是将mir-302b-3p检测试剂用于制备口腔鳞状细胞癌侵袭性和/或迁移性的诊断试剂盒,第二个方面是将mir-302b-3p或mir-302b-3p前体作为活性成分用于制备延缓口腔鳞状细胞癌侵袭和/或迁移的药物。
7.术语“前体”指:携带mirna的核苷酸序列,并能在细胞内产生mirna的物质。优选的,前体为mirna mimics或mirna agomir。所述mirnamimics是针对mirna的成熟体设计并合成的小片段双链mirna;所述mirna agomir指在mirna mimics的基础上进行化学修饰,经过特殊的化学修饰升级的产品,表达更稳定,表达时间更长,可以实现细胞实验,不需要转染试剂,另外,可以直接溶解后用于动物实验。
8.本发明的技术方案如下:
9.本发明首先提供了人类mir-302b-3p或其前体在制备延缓口腔鳞状细胞癌侵袭和/或迁移的药物中的用途。
10.进一步的,所述前体是人类mir-302b-3p的mirna mimics或人类mir-302b-3p的mirna agomir。
11.进一步的,所述药物还包括mir-302b-3p或其前体的载体;优选的,所述载体为慢病毒或脂质体。
12.本发明还提供了一种延缓口腔鳞状细胞癌侵袭和/或迁移的口腔鳞状细胞癌的药物,该药物的活性成分是人类mir-302b-3p或其前体。
13.如前述的药物,所述前体是人类mir-302b-3p的mirna mimics或人类mir-302b-3p的mirna agomir。
14.如前述的药物,所述药物还包括mir-302b-3p或其前体的载体;优选的,所述载体为慢病毒或脂质体。
15.本发明还提供了检测人类mir-302b-3p的试剂在制备口腔鳞状细胞癌侵袭性和/或迁移性的诊断试剂盒中的用途。
16.如前述的用途,所述检测人类mir-302b-3p的试剂是qrt-pcr试剂。
17.本发明还提供了一种口腔鳞状细胞癌侵袭性和/或迁移性的诊断试剂盒。
18.如前述的试剂盒,所述检测人类mir-302b-3p的试剂是qrt-pcr试剂。
19.本发明用直接证据证明,mir-302b-3p可抑制oscc的侵袭和/或迁移,口腔细胞内mir-302b-3p水平越高,oscc侵袭和迁移的可能性越低。而mir-302b-3p与oscc的侵袭和/或迁移性的关系未被现有技术报道。本发明的药物可以通过提高mir-302b-3p的水平,延缓oscc的侵袭和/或迁移,是一种构思与现有oscc药物不同的新药物,丰富了治疗oscc的药物选择。
20.本发明的试剂盒可以通过检测mir-302b-3p水平高低,评估oscc患者出现肿瘤细胞侵袭或迁移的风险,为oscc治疗决策提供有价值的参考信息。
21.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
22.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容
所实现的技术均属于本发明的范围。
附图说明
23.图1:oscc细胞系的侵袭迁移能力与mir-302b-3p表达相关性。
24.图2:oscc淋巴转移率与mir-302b-3p的相关性。
25.图3:mir-302b-3p与fzd6基因之间的靶向关系。
26.图4:mir-302b-3p的靶基因fzd6表达与oscc预后的关系。
27.图5:过表达fzd6对oscc细胞的侵袭与迁移能力的增强作用,以及mir-302b-3p对该增强作用的逆转作用。
具体实施方式
28.实施例1oscc细胞系的侵袭迁移能力与mir-302b-3p表达水平的关系
29.使用真核细胞转染技术,将mir-302b-3p-mimic【正义链:uaagugcuuccauguuuuaguag(seq id no.1);反义链cuacuaaaacauggaagcacuua(seq id no.2)】、mir-302b-3p-off【cuacuaaaacauggaagcacuua(seq id no.3)】或随机mirna mimic【即nc-mimic;micron mimic nc序列正义链:uuuguacuacacaaaaguacug(seq id no.4),反义链:caguacuuuuguguaguacaaa(seq id no.5);microff inhibitor nc序列:caguacuuuuguguaguacaa(seq id no.6)】分别转染oscc细胞系hsc-3、hsc-4、um1、um2。使用transwell侵袭实验与迁移实验,检测转染前、后的的迁移和侵袭情况。另外抽提细胞rna,使用qrt-pcr检测mir-302b-3p的表达。
30.具体操作方法如下:
31.1.细胞rna抽提和qrt-pcr。oscc细胞系hsc-3、hsc-4、um1、um2培养至对数生长期,每5~10
×
106个细胞加入1ml trizol,用一次性或已消毒的细胞刮刮下,转入新的洁净ep管中,用注射器反复抽吸5~6次,或反复用移液枪捶打或剧烈震荡,以充分裂解细胞。室温下静置5min(除离心外,所有操作尽量在通风橱内进行)。ep管中按照每1ml trizol加入0.2ml氯仿,观察液体由淡红色清亮转为桃红色浑浊样,盖上ep管,用力震荡15秒,或涡旋。室温下静置2~3min。再离心,参数为12000g,4℃,15min。取上层水相置于新的ep管中,注意避免吸取到中间的白色蛋白。加入0.5ml异丙醇,室温下静置10min,离心,参数为12000g,4℃,10min。弃上清,ep管中加入1ml 75%乙醇进行洗涤,涡旋混合。离心,参数为≤7500g,4℃,5min。弃上清。在通风橱内室温下自然干燥,用约30μl的rnase-free水溶解rna,将液体转至pcr管中,55℃或60℃温育10min。用分光光度仪测定rna浓度。按照taqman microrna反转录试剂盒产品说明书将rna反转录为cdna,并进行荧光定量pcr检测(qrt-pcr)。u6作为内参基因,结果采用相对定量法,公式为2
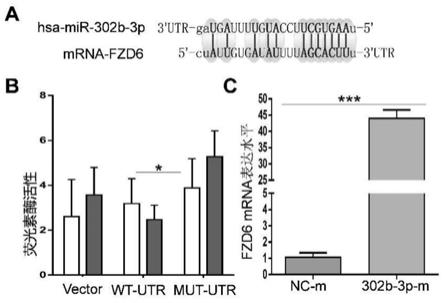
-△△
ct
。
32.2.真核细胞转染技术。
①
铺六孔板,用有血清培养基培养上述oscc细胞系至细胞量为70~80%。吸去每孔原培养基,加入新的无血清培养基(即不加胎牛血清的dmem液)1.5~2ml,置于细胞培养箱备用。
②
取ep管1个,用opti-mem培养基稀释mir-302b-3p-mimic(即mir-302b-3p的mirna mimics),比例:opti:mir-302b-3p-mimic=250ul:10ul。其中模拟物及对照试剂的10ul用量为锐博生物试剂公司说明书推荐值。同法稀释空白nc-mimic,比例同上。
③
取ep管1个,用opti-mem培养基稀释转染试剂invitrogen lipofectamine 2000,
(常规比例为目的待转物:lipo2000=1:2~3),因lipo2000预实验中六孔板每孔>10μl时细胞状态较差,所以本次用opti:lipo2000=250ul:10μl,保温5min。
④
混合稀释的mir-302b-3p-mimic与lipo2000,单个样本量为500ul opti-mem+5ul mir+10ul lipo2000,保温20min。同法操作nc组。
⑤
将混合液加入6孔板中,摇动培养板,轻轻混匀。
⑥
将六孔板置于细胞培养箱中,37℃,5%的co2条件下培养6小时后,更换为有血清培养基。
33.3.transwell侵袭实验与迁移实验。
①
取出成品matri-gel胶,用无血清培养基稀释为1:3浓度备用。使用前置于0℃冰箱中融化为液态,取出时置于冰上备用。避免高温。
②
在上述无菌操作台中,取出transwell小室,置于六孔板中备用。a.预计进行侵袭试验的小室上层加入35μlmatri-gel胶,避免气泡,加完后,盖好24孔板板盖,做好组别标记,放入37℃细胞培养箱中,静置45min,待matri-gel胶凝固呈果冻状时,在transwell小室下方的24孔板力,按每孔500μl的量加入有血清培养基。b.进行迁移试验的小室内不必加matri-gel胶,在下层的六孔板中置入500μl有血清培养基即可。
③
铺细胞:收取上述转染成功并培养24小时后的细胞,用无血清培养基重悬至浓度为5
×
105个/ml,备用。取上述细胞悬液,在加了matri-gel胶的侵袭实验组transwell小室上层加入200μl/孔。将剩余的上述混悬液对稀释为2.5
×
105个/ml后,在未加matri-gel胶的迁移实验组transwell小室上层加入200μl/孔。24小时后取出transwell小室。
④
固定、染色及统计:a.用干棉签擦去小室上层的细胞后,将上室置于70%甲醇溶液中固定半小时,用pbs漂洗。b.在24孔板中倒入500μl的4%结晶紫溶液,将transwell小室置于其中染色20min。c.取出小室,pbs洗净后,自然晾干。取下小室并置于载玻片上,中性树胶封片。静置24小时后显微镜下拍照保存后统计。
34.结果如图1所示:无论是初始状态(图1a、b),还是转染mir-302b-3p-mimic(图1d)或mir-302b-3p-off(图1c)前后,mir-302b-3p的表达量高的细胞内,侵袭和/或迁移能力越低。
35.结论:在各oscc细胞系中,mir-302b-3p的表达量越高,侵袭和/或迁移能力越低。
36.实施例2裸鼠oscc颊部移植瘤动物模型转移实验
37.方法如下:
①
细胞悬液的制备:a.荧光素酶基因(luciferase)标记细胞:采用具有体外成瘤能力的高侵袭性hsc-3细胞系,用荧光素酶(luciferase)基因标记细胞。其中空白组为正常无处理的荧光素酶基因标记hsc-3细胞系,对照组为过表达nc mimic的荧光素酶基因标记hsc-3细胞系,实验组为过表达mir-302b-3p的荧光素酶基因标记hsc-3细胞系。培养至生长状态良好的指数生长期。收取细胞并制备不含血清及抗生素的培养基(即dmem)重悬细胞液,计数并调整细胞浓度为1
×
107/ml。
②
提前将matri-gel胶置于4度冰箱融化。将上述细胞悬液与matri-gel胶1:1比例混合,冰上进行。
③
裸鼠接种:空白组、对照组及实验组各3只,每组按照各自组别,取相应单细胞均匀混悬液100μl,缓慢注射于裸鼠颊黏膜下。注射后用消毒棉签轻压片刻,止血及避免细胞顺针口流出,可见接种处黏膜稍隆起,随后将裸鼠放回饲养笼。待裸鼠颊部接种部位肉眼可见明显的肿瘤结节(本实验为第12天),结节质地较硬后,空白组、对照组和实验组分别行pbs、nc agomir试剂、mir-302b-3p agomir瘤内注射,每隔2日一次,每次10nmol。肉眼观察并记录裸鼠颊部肿瘤生长情况,并用活体荧光成像检测颊部及内脏情况。
38.结果如图2所示:注射mir-302b-3p agomir的小鼠oscc颈部、腋窝淋巴结转移率显著低于对照组。
39.结论:mir-302b-3p可以抑制oscc的转移。
40.实施例3验证靶基因
41.经软件预测发现,fzd6是mir-302b-3p的靶基因,其靶向识别模式如图3a所示。本实施例的目的是验证该基因是否为靶基因。
42.1.双荧光素酶报告基因系统验证
43.方法:将hek-293t细胞接种于96孔板,使转染细胞密度达1
×
107/ml。将mir-302b-3p过表达载体和psicheck-2-report-fzd6-3’utr载体共转染至293t细胞中,共转染mir-302b-3p过表达载体和psicheck-2-report-fzd6-3’utr mut载体或psicheck-2-report空载体做对照。每组共转染海蜇荧光素酶(prl-tk)作为内参,转染试剂为invitrogen lipofectamine 2000。转染48小时后,荧光倒置显微镜下观察绿色荧光发光情况,并裂解细胞,按照promega双荧光素酶试剂盒说明书进行操作,所用仪器为微孔板发光分析仪。
44.结果:因为mir-302b-3p对psicheck-2-report-fzd6-3’utr载体的utr区进行识别,该载体的荧光素酶表达受到抑制,因此wt-utr组(即psicheck-2-report-fzd6-3’utr载体)荧光受到抑制,比内参荧光要弱;而mut-utr组(psicheck-2-report-fzd6-3’utr mut载体)的mirna识别位点被突变,表达不受mir-302b-3p的抑制,因此其荧光比内参荧光要强,与vector组(psicheck-2-report空载体)荧光相对强弱趋势一致(图4)。可见mir-302b-3p可识别fzd6的3’utr区,并下调具备该3’utr区的基因。
45.2.rna pull-down验证
46.方法:使用lipofectamine 2000转染试剂(美国invitrogen,美国),用生物素化的mir-302b-3p探针(序列为:5
′-
cuacuaaaacauggaagcacuua-3
′
(seq id no.7))及生物素化的nc-mimic探针(序列为:5
′-
caguacuuuuguguaguacaaa-3
′
(seq id no.8))(ribobio,中国广州)将hsc-3细胞转染24小时,然后在冷的全细胞裂解缓冲液中裂解。通过将细胞裂解液与抗生蛋白链菌素包被的磁珠(thermo fisher scientific,美国)在室温下孵育1小时,来完成目标mrna-mirna复合物的下拉。用下拉洗涤缓冲液洗涤珠子3次。使用rneasy mini kit(qiagen,德国)提取总rna。行rt-qpcr以检测相对的fzd6mrna含量。
47.结果:如图3c所示,mir-302b-3p探针可大量结合fzd6的mrna,结合能力远高于对照组(nc-mimic探针)。
48.结论:fzd6是mir-302b-3p的靶基因。
49.实施例4临床样本验证fzd6与oscc侵袭性和/或迁移性的关系
50.收集四川大学华西口腔医院就诊、经手术切除后病理确诊为oscc的组织样本,制备oscc石蜡切片。观察切片并使用免疫组织化学染色检测fzd6的表达情况;随后考察病人生存率与fzd6表达量高低的关系。
51.免疫组织化学方法如下:
52.石蜡切片置于65℃烤箱,2h。过二甲苯后梯度酒精水化。1
×
tbs洗5min,2次(3min,3次)。edta修复液行抗原修复;3%过氧化氢封闭。按稀释比滴加羊抗的fzd6抗体,室温/37℃条件下孵育10-30min,后在4℃下放过夜。次日取出,置于37℃,40min;tbs洗5min,2次。滴加dako公司产通用型二抗,37℃下静置40min;dab显色,苏木素复染;清水冲洗片子后过一遍盐酸酒精液;细水流轻轻冲洗2-5min,去除盐酸酒精。玻片置于氨水中反蓝约10min。洁净水细流冲洗20min。脱水、透明、封片。胶封﹥24h,扫片。光盘刻录图像数据。
53.结果如图4所示:正常口腔黏膜的fzd6表达量低,而oscc口腔黏膜以及淋巴结转移组织中fzd6表达量高(图5a、b);fzd6低表达患者的生存率显著高于fzd6高表达患者生存率。
54.这进一步证实了fzd6表达量越高,oscc越严重(发生转移、死亡率高)。
55.实施例5验证mir-302b-3p、fzd6与口腔鳞癌的侵袭性的关系
56.本实施例使用慢病毒包装fzd6过表达载体(fzd6-oe)、fzd6小干扰rna(fzd6-si,序列为5
′-
ucagcggcuuguaucuugu-3
′
(seq id no.9))、mir-302b-3p-mimic(302b-3p-m)、随机mirna mimic(nc-mimic)、mir-302b-3p agomir(302b-3p-ago,序列同302b-3p-m)或随机agomir(nc-ago,序列同nc-mimic)组合侵染口腔鳞癌细胞系hsc-3。其中,在hsc-3细胞的体外实验中,fzd6-si与mir-302b-3p-mimic和nc-mimic均通过脂质体转染,通过实施例1的方法检测其转移细胞和侵袭细胞,并通过免疫组化、western blot检测相关蛋白的表达。而在动物体内研究部分,首先将hsc-3细胞经脂质体转染mir-302b-3p-mimic,再通过尾静脉注射方式构建裸鼠肺转移瘤模型;再通过尾静脉将mir-302b-3p agomir及nc-agomir直接注射进入各组裸鼠血液循环,被靶细胞摄取。该产品为人工合成的动物专用模拟物,可被活体动物细胞高效吸收并发挥稳定和高效的作用;在没有转染试剂的情况下,也可以高效进入靶细胞中发挥作用,可维持长达数周的效果。
57.实验操作参考:
58.1.慢病毒包装和侵染。转染前24h,用胰蛋白酶消化对数生长期的293t细胞,用含10%血清的培养基调整细胞密度为约5
×
106个/15ml,重新接种于10cm细胞培养皿,37℃、5%co2培养箱内培养。24h待细胞密度达70%~80%时即可用于转染;转染前2h更换为无血清培养基;向一灭菌离心管中加入所制备的各dna溶液(gv载体质粒20μg、phelper1.0载体质粒15μg、phelper 2.0载体质粒10μg),不相应体积的吉凯转染试剂混合均匀,调整总体积为1ml,在室温下温育15min;混合液缓慢滴加至293t细胞的培养液中,混匀,于37℃、5%co2细胞培养箱中培养;培养6h后弃去含有转染混合物的培养基,加入10ml的pbs液清洗一次,轻柔晃动培养皿以洗涤残余的转染混合物后倒弃;缓慢加入含10%血清的细胞培养基20ml,于37℃、含5%co2培养箱内继续培养48-72h。根据细胞状态,收集转染后48h的293t细胞上清液。于4℃,4000g离心10min,除去细胞碎片,以0.45μm滤器过滤上清液于40ml超速离心管中。分别配平样品,将带有病毒上清液的超速离心管逐一放入至beckman超速离心机内,设置离心参数为25000rpm,离心时间为2h,离心温度控制在4℃。离心结束后,弃去上清,尽量去除残留在管壁上的液体,加入病毒保存液(可用pbs或细胞培养基替代),轻轻反复吹打重悬。经充分溶解后,高速离心10000rpm,离心5min后,取上清按要求分装。运用倍比稀释原则对病毒进行滴度测定,感染口腔鳞状细胞癌细胞系hsc-3。感染24~48h后观察荧光标记基因的表达情况,荧光率大于80%,拍完荧光后补加500μl正常培养基,待长满后收集细胞用于fzd6基因的rna提取或fzd6蛋白质检测验证。
59.2.western blot技术。培养生长状态良好的空白组及处理组细胞至对数生长期。按照常规方法提取细胞总蛋白并进行bca定量。通过sds-page分离,半干转至pvdf膜,5%脱脂奶粉封闭1小时,加入相应稀释比例的羊抗的fzd6抗体(1:1000),4℃过夜。tbst洗膜后,加入辣根过氧化酶(hrp)标记的对应二抗(兔抗山羊igg,1:5000)孵育1小时,充分洗膜后用ecl化学发光法进行暗室曝光。
[0060]3·
免疫组织化学染色。方法同实施例4。结果:
[0061]
本领域公知的,小干扰rna可特异性识别靶基因的dna或mrna序列,在转录水平或转录后水平抑制靶基因表达。图5a~c表明,fzd6的过表达可导致oscc侵袭、迁移能力增强;而fzd6的小干扰rna能够通过抑制fzd6的表达,进而减弱oscc侵袭、迁移能力。而使用mir-302b-3p也能明显减弱oscc侵袭、迁移能力,效果与小干扰rna类似。
[0062]
由图5d可知,fzd6的小干扰rna能够显著降低侵袭迁移关键蛋白rhoa、rock2、vimentin的表达水平,过表达fzd6能够显著提高rhoa、rock2、vimentin的表达水平,而过表达mir-302b-3p后,fzd6蛋白表达水平显著下降,且侵袭迁移关键蛋白rhoa、rock2、vimentin的表达水平同样地显著下调。
[0063]
由图5f可知,过表达fzd6可提高oscc裸鼠肺转移模型中的肺转移数,这一结果可被mir-302b-3p逆转。
[0064]
结论:mir-302b-3p通过抑制fzd6的表达,减弱oscc侵袭、迁移能力。
[0065]
综上,mir-302b-3p表达量与oscc侵袭能力、迁移能力负相关;mir-302b-3p通过下调fzd6表达,减弱oscc侵袭能力、迁移能力,延缓oscc病程。因此,检测mir-302b-3p的试剂可以用于筛查oscc的侵袭性和/或迁移性;且mir-302b-3p(及其前体)能够作为延缓oscc侵袭和/或迁移的药物中的活性成分。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1