一种盐酸二甲双胍缓释片及其制备方法与流程
本发明属于药物制剂技术领域,具体涉及一种盐酸二甲双胍缓释片及其制备方法。
背景技术:
盐酸二甲双胍为双胍类口服降糖药,可用于非胰岛素依赖型糖尿病的治疗,是一种首选用于单纯饮食控制及体育锻炼治疗无效的2型糖尿病,特别是肥胖的2型糖尿病;对于1型或2型糖尿病,本品与胰岛素合用,可增加胰岛素的降血糖作用,减少胰岛素用量,防止低血糖发生。本品也可与磺脲类口服降糖药合用,具协同作用。
据文献报道,本品为降血糖药。本品可降低ⅱ型糖尿病患者空腹及餐后高血糖,hbalc可下降1%-2%,本品降血糖的机制可能是:1.增加周围组织对胰岛素的敏感性,增加胰岛素介导的葡萄糖利用。2.增加非胰岛素依赖的组织对葡萄糖的利用,如脑、血细胞、肾髓质、肠道、皮肤等。3.抑制肝糖原异生作用,降低肝糖输出。4.抑制肠壁细胞摄取葡萄糖。5.抑制胆固醇的生物合成和贮存,降低血甘油三酯、总胆固醇水平。与胰岛素作用不同,本品无促进脂肪合成作用、对正常人无明显降血糖作用,对ⅱ型糖尿病单独应用时一般不引起低血糖。
中国发明专利申请cn1543937a(盐酸二甲双胍缓释片及其制备方法)中,缓释片由盐酸二甲双胍46.5-70%,羟丙甲基纤维素13.5-33.0%,微粉乙基纤维素10-14%,填充剂1.3-9.4%,润滑剂1.2-1.5%组成,将其按照常规工艺进行压片即可。使用粒径为100μm以下的微粉乙基纤维素,可减少羟丙甲基纤维素和乙基纤维素的用量,实现控制药物以一定速率平稳释放的目的。中国发明专利申请cn101283993a(盐酸二甲双胍缓释片在治疗2型糖尿病药物中的应用)中,缓释片的原料用量为盐酸二甲双胍42-60%,羟丙基甲基纤维素34-50%,羟甲基纤维素钠2-5%,微晶纤维素1-3%,硬脂酸镁2-4%。利用微晶纤维素做辅料,将干粉直接添加到颗粒中混合后压片,加工简单、方便,减少了羟丙基甲基纤维素和羟甲基纤维素钠的用量,能按一定速度有效控制和释放药物。中国发明专利申请cn102440975a(一种盐酸二甲双胍缓释片及其制备方法)中,每10000片的原料组成为:盐酸二甲双胍5000g,羟丙甲纤维素1750g,羧甲基纤维素钠1750g,硬脂酸180g,硬脂酸镁200g,75%的乙醇适量。首先用75%的乙醇配制质量百分比浓度为0.5%的羟丙甲纤维素和10%的硬脂酸镁溶液;然后将过筛后的盐酸二甲双胍、羟丙甲纤维素、羧甲基纤维素钠加入羟丙甲纤维溶液中一次制粒,再加入硬脂酸镁溶液二次制粒,干燥后过筛、整粒,压片即可。采用两次加浆的方法制粒,可提高颗粒的粘性,增加药片缓释度,明显提高了药物的缓释效果。中国发明专利申请cn103816130a(一种盐酸二甲双胍缓释片)中,缓释片的原料组成为:盐酸二甲双胍400-600份,羧甲基纤维素钠30-60份,羟丙甲纤维素200-250份,丙烯酸乙酯-甲基丙烯酸甲酯共聚物水分散体180-220份,硬脂酸镁5-10份。将原料经过筛分、制粒、干燥、整粒后,进行压片,得到的盐酸二甲双胍缓释片缓释性能良好,常温保存下药品稳定性达24个月。中国发明专利申请cn106176652a(一种盐酸二甲双胍缓释片及其制备方法)中,首先将吸收促进剂、盐酸二甲双胍和粘合剂混合制粒,再与羟丙甲纤维素和药用辅料混合,压片即可。其中吸收促进剂包括壳聚糖和磷酸二氢钙,粘合剂包括聚维酮和羧甲基纤维素钠,药用辅料包括微晶纤维素和硬脂酸镁。得到的盐酸二甲双胍缓释片能够拓宽盐酸二甲双胍的吸收窗口,生物利用度高,并能够使盐酸二甲双胍的血药浓度在较长时间内相对稳定地维持在治疗水平以上,从而有效治疗该疾病。中国发明专利申请cn110354090a(一种盐酸二甲双胍缓释片及其制备方法)中,缓释片由缓释颗粒、缓释微囊和润滑剂组成,其中缓释颗粒和缓释微囊中所含的盐酸二甲双胍的重量比为3:7-6:4,润滑剂选自微粉硅胶或硬脂酸镁。缓释颗粒通过干法制粒制成,缓释颗粒由盐酸二甲双胍、缓释材料和粘合剂组成,其中缓释材料为羟丙甲基纤维素,粘合剂选自微晶纤维素或共聚维酮;缓释微囊通过喷雾干燥法制成,缓释微由盐酸二甲双胍和囊材组成,其中囊材为白芨多糖、阿拉伯胶等。采用上述方法制备得到的盐酸二甲双胍缓释片可能存在释放不稳定,可能存在突释的情况,并且制备方法较为复杂,工业化生产难度大,产品质量不稳定等缺点。
技术实现要素:
本发明欲解决的问题是现有技术中盐酸二甲双胍缓释片释放不稳定,可能存在突释,以及生产工艺复杂等技术问题。
为了解决上述技术问题,本发明公开了一种盐酸二甲双胍缓释片的制备方法,所述盐酸二甲双胍缓释片的原料包括盐酸二甲双胍、缓释剂;所述缓释剂包括羧甲基纤维素钠;在制备过程中,将盐酸二甲双胍、羧甲基纤维素钠经喷水混合制粒,然后对混合制粒后得到的颗粒进行第二次喷水。
进一步地,所述缓释剂中还包括羟丙基甲基纤维素;在制备过程中,将缓释剂中一部分的羟丙基甲基纤维素加入制粒机中,与第二次喷水后的颗粒混合均匀;整粒后,将缓释剂中剩余部分的羟丙基甲基纤维素、以及盐酸二甲双胍缓释片的其他原料加入,与整粒后的颗粒混合均匀后进行压片。
用助流剂进行整粒,本发明中助流剂选择二氧化硅。
其中缓释剂中一部分的羟丙基甲基纤维素的质量为缓释剂中全部羟丙基甲基纤维素总质量的1/3,也即缓释剂中的羟丙基甲基纤维素分两次加入,第一次加入总质量的1/3,第二次加入剩余的2/3。这样分次加入能够使盐酸二甲双胍稀释片的缓释效果达到最优。
进一步地,所述第二次喷水中,喷水速度大于混合制粒时的喷水速度,喷水量小于混合制粒时的喷水量。更进一步地,喷水量占混合制粒时的喷水量的1/4-1/2。第二次喷水主要是为了对颗粒表面进行湿润,使其能够与后续加入的缓释剂中剩余部分的羟丙基甲基纤维素很好地粘合在一起。
缓释剂中,羟丙基甲基纤维素选用羟丙基甲基纤维素k100m,这种型号的羟丙基甲基纤维素k100m取代度适中,作为缓释剂更能提高盐酸二甲双胍缓释片的缓释效果。
本发明同时要求保护一种采用上述制备方法得到的盐酸二甲双胍缓释片。
进一步地,所述盐酸二甲双胍缓释片的其他原料包括粘合剂、填充剂、润滑剂。
进一步地,所述盐酸二甲双胍与缓释剂的质量比为125:80-120。
进一步地,所述盐酸二甲双胍与粘合剂的质量比为125:1.5-3.0。
进一步地,所述粘合剂选自聚维酮k30、羟丙基甲基纤维素中的一种或两种。更进一步地,粘合剂选择羟丙基甲基纤维素,更进一步地羟丙基甲基纤维素选用羟丙基甲基纤维素e5,这种型号的羟丙基甲基纤维素粘度适中,粘合效果更好。
进一步地,所述填充剂选自乳糖、微晶纤维素中的一种或两种。更进一步地,所述填充剂选择微晶纤维素。
进一步地,所述润滑剂为硬脂酸镁。
本发明中,在制备盐酸二甲双胍缓释片之前,需要对各原料进行处理,具体为原料中的盐酸二甲双胍、羧甲基纤维素钠、羟丙基甲基纤维素k100m、微晶纤维素、羟丙基甲基纤维素e5需要进行过筛处理。
各原料中,对盐酸二甲双胍和羧甲基纤维素钠粉碎后过筛网的筛网目数大于羟丙基甲基纤维素k100m、微晶纤维素和羟丙基甲基纤维素e5的粉碎后过筛网目数。这是因为:筛网目数越大,过筛后的原料粒度越细,细粒料溶解性好但流动性差,粗粒料溶解性差但流动性好。盐酸二甲双胍和羧甲基纤维素钠作为盐酸二甲双胍缓释片中的主要药物成分,需要具有更高的溶解性来更好地发挥药效,而羟丙基甲基纤维素k100m、微晶纤维素和羟丙基甲基纤维素e5作为非主要药物成分,需要更好的流动性来提高药物压片制备工艺时的可操作性。所以对不同用途的原料,所需要的原料粒度大小不同。
具体地,本发明中盐酸二甲双胍缓释片的制备方法包括如下步骤:
步骤1:将羟丙甲纤维素k100m、微晶纤维素、羟丙甲纤维素e5过筛,其余物料直接称量备用;
步骤2:将处理后的盐酸二甲双胍、羧甲纤维素钠加入到沸腾干燥制粒机内,进行混合;
步骤3:将纯化水喷入沸腾干燥制粒机内,进行制粒,并进行干燥。
步骤4:对沸腾干燥制粒机内的颗粒,进行第二次喷水,打湿:
步骤5:将处方量1/3的羟丙甲纤维素k100m加入到沸腾干燥制粒机中,混合干燥。
步骤6:将处方量二氧化硅加入物料舱中使用提升翻转整粒机进行整粒。
步骤7:将剩余处方量的羟丙甲纤维素k100m、羟丙甲纤维素e5、微晶纤维素、硬脂酸镁加入物料舱中,投入整粒完成的颗粒,按下混合位按钮开始混合。混合结束,取中间体检测。
步骤8:依据中间体颗粒含量制定应压片重,进行压片。
其中,步骤1物料过筛,优选60-80目;更优选60目筛。
步骤2对沸腾干燥制粒机中的物料进行混合,风机频率设置35hz;混合时间10-15min;更优选10min;
步骤3中制粒,其工艺参数设置为风机频率至35hz、进风温度80.0℃、设置雾化压力内层0.35mpa、外层0.30mpa,设置供液速度300r/min,待物料温度达到45℃±5℃时开始喷水制粒,每隔5min提升25r。当供液频率达到450r/min时,直至喷水结束,物料温度达到42.0℃±2℃时制粒完成。
步骤4中第二次喷水打湿,风机频率为40hz;供液频率400-500r/min;更优选500r/min。
步骤5中混合干燥时间为5-10min;
步骤6中整粒前,先将二氧化硅加入物料中,整粒筛网为1.5mm;
步骤7中混合时间为20-30min;更优选25min;混合转速为10r/min;
步骤8中的压片,模具为19mm×9mm;片剂硬度控制在150n-250n;更优选170n-200n。
相对于现有技术,本发明的有益效果是:
1.本发明盐酸二甲双胍缓释片制备方法,所需设备均为常用设备,工艺简单,而且适合商业化大生产,重现性好,质量稳定。
2.本发明得到的盐酸二甲双胍缓释片释放曲线更加平稳,与参比制剂相似性高,长时间后释放曲线仍较为稳定。
3.本发明得到的盐酸二甲双胍缓释片释放均匀,不易存在突释。
附图说明
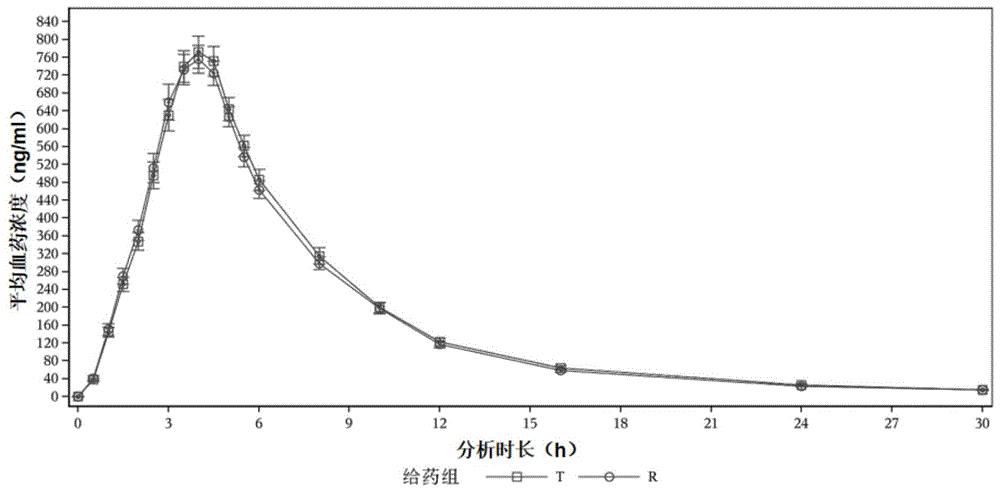
图1:t组与r组受试者的平均血药浓度(+/-sd)-时间曲线(线性坐标)-pk浓度集曲线。
图2:t组与r组受试者的平均血药浓度(+/-sd)-时间曲线(半对数坐标)-pk浓度集曲线。
具体实施方式
下面通过具体实施例进行详细阐述,说明本发明的技术方案。
本发明中所用到的水,均指纯化水。
采用下述方法制备盐酸二甲双胍缓释片,包括如下步骤:
步骤1:将盐酸二甲双胍、羧甲基纤维素钠、羟丙基甲基纤维素k100m、微晶纤维素、羟丙基甲基纤维素e5过筛,随后称量备用,其余物料直接称量备用;
步骤2:将过筛后的盐酸二甲双胍、羧甲基纤维素钠加入到沸腾干燥制粒机内,进行混合;
步骤3:将纯化水喷入沸腾干燥制粒机内,进行制粒,并进行干燥。
步骤4:对沸腾干燥制粒机内的颗粒,进行第二次喷水,打湿。
步骤5:将处方量1/3的羟丙基甲基纤维素k100m加入到沸腾干燥制粒机中,混合干燥。
步骤6:将处方量二氧化硅加入物料舱中使用提升翻转整粒机进行整粒。
步骤7:将剩余处方量的羟丙基甲基纤维素k100m,以及处方量的羟丙基甲基纤维素e5、微晶纤维素、硬脂酸镁加入物料舱中,投入整粒完成的颗粒,按下混合位按钮开始混合。混合结束,取中间体检测。
步骤8:依据中间体颗粒含量制定应压片重,进行压片。
实施例1
1)粉碎过筛
在投料生产前对盐酸二甲双胍、羧甲基纤维素钠分别粉碎过80目筛;羟丙基甲基纤维素k100m、微晶纤维素、羟丙基甲基纤维素e5过60目筛,其余物料直接称量备用。
2)制粒
混合:将过筛后的盐酸二甲双胍、羧甲纤维素钠加入到沸腾干燥制粒机内,风机设置35hz,不开加热,混合10min。
制粒:设置风机频率至35hz、进风温度80.0℃、设置雾化压力内层0.35mpa、外层0.30mpa(或内层较外层大0.05mpa,但是外层不小于0.2mpa),设置供液速度300r/min,待物料温度达到45℃±5℃时开始喷水制粒,每隔5min提升25r。当供液频率达到450r/min时,直至喷水结束,物料温度达到42.0±2℃时落锅观察物料成粒情况。此处制粒时的喷水总量为85kg。
第二次喷水:不开热风,设置风机频率40hz,供液频率500r/min喷水打湿物料。风机频率决定干燥速度,供液频率决定喷水速度。第二次喷水时的喷水总量为混合制粒时喷水量的1/4-1/2。
混合:将处方量1/3的羟丙基甲基纤维素k100m抽加入到沸腾干燥制粒机中,混合干燥5-10min。
整粒:将处方量二氧化硅加入物料舱中使用提升翻转整粒机进行整粒,整粒机安装1.5mm的筛网,将沸腾干燥机的料仓推入干法整粒机下,将联接料桶盖的6个联接螺钉拧紧后密封;将料仓小车推走后,操作提升机将料桶翻转180°并上升至适当高度。推进1000l混合罐,使混合桶出料口对准干法整粒机的入料口,干法整粒机的出料口对准混合罐口并用软管固定,启动整粒机,整粒转速设置10hz,打开料桶盖出料旋钮,进行整粒,整粒出料结束后,关闭料桶盖出料旋钮,停止整粒机。
3)总混
打开混合机料斗盖,将剩余处方量的羟丙基甲基纤维素k100m、羟丙基甲基纤维素e5、微晶纤维素、硬脂酸镁加入物料舱中,投入整粒完成的颗粒,盖上并箍紧料斗盖,设定混合时间为25min,混合转速为10r/min,按下混合位按钮开始混合。混合完毕后,在放料口取样量送检中间体颗粒。
4)压片
依据中间体颗粒含量制定应压片重,安装19mm*9mm盐酸二甲双胍缓释片专用异形冲进行压片,片剂硬度控制在170n-200n,脆碎度不得超过0.8%。
5)泡罩包装
选择8片/板或10片/板模具进行包装。领取中间产品、pvc与铝箔,安装好成形模具,热封模具,印字模具,冲栽模具,设置全自动高速泡罩包装机空气压力0.6mpa-0.8mpa,上、下成形模温度120-140℃、热封温度200℃-240℃、20-45hz冲栽速度,进行包装。
6)外包装
对片剂进行铝塑泡罩包装的铝塑进行纸盒包装,并最终进行纸箱包装。
实施例1中盐酸二甲双胍缓释片中各原料种类及用量如表1所示,制成盐酸二甲双胍缓释片25万片,记为s1。
实施例2-4
采用与实施例1相同的方法,制备了盐酸二甲双胍缓释片,其各原料种类及用量如表1所示,制成盐酸二甲双胍缓释片25万片,记为s2-s4。
实施例5
原料种类及用量同s1,不同之处在于:制备方法中不分次加入羟丙基甲基纤维素k100m,而是在步骤3)总混阶段,将全部的羟丙基甲基纤维素k100m加入。其各原料种类及用量如表1所示,制成盐酸二甲双胍缓释片25万片,记为s5。
对比例1
原料种类及用量同s1,不同之处在于:制备方法中不进行第二次喷水。其各原料种类及用量如表1所示,制成盐酸二甲双胍缓释片25万片,记为b1。
对比例2
原料种类同实施例1,不同之处在于:制备方法中不进行步骤第二次喷水,同时也不分次加入缓释剂羟丙基甲基纤维素k100m,即一次性在步骤3)总混阶段,将全部的羟丙基甲基纤维素k100m加入。其各原料种类及用量如表1所示,制成盐酸二甲双胍缓释片25万片,记为b2。
表1各实施例和对比例中盐酸二甲双胍缓释片的各原料种类及用量
对上述方法制备得到的盐酸二甲双胍缓释片进行性能测试:
(1)体外溶出曲线
测试方法:取本品,按照溶出度与释放度测定法(中国药典2015年版通则0931第一法),以磷酸盐缓冲液(ph6.8)1000ml为溶出介质,转速为每分钟100转,依法操作,在1小时、3小时与10小时,分别取溶液5ml,滤过,并即时补充相同温度、相同体积的溶出介质,分别精密量取续滤液适量,加溶出介质定量稀释制成每1ml中约含盐酸二甲双胍5μg的溶液,摇匀,按照紫外-可见分光光度法(中国药典2015年版通则0401),在233nm的波长处分别测定吸光度;另取盐酸二甲双胍对照品适量,精密称定,加溶出介质溶解并定量稀释制成每1ml中含5μg的溶液,同法测定,分别计算每片在不同时间的溶出量。本品每片在1小时、3小时与10小时的溶出量应分别为标示量的20%-45%、45%-75%与80%以上,均应符合规定。同时按照上述方法分别测试ph1.2盐酸溶液、ph4.0醋酸盐缓冲液、水介质中的释放曲线。
样品来源:实施例1-5、对比例1-2;规格:0.5g。
参比制剂:批号hn0072,商品名:
检测结果如表2-5所示。
表2:水介质-被评价制剂与参比制剂溶出曲线相似性比较结果
表3:ph1.2盐酸溶液介质-被评价制剂与参比制剂溶出曲线相似性比较结果
表4:ph4.0醋酸盐缓冲液介质-被评价制剂与参比制剂溶出曲线相似性比较结果
表5:ph6.8磷酸盐缓冲液介质-被评价制剂与参比制剂溶出曲线相似性比较结果
标准转速条件下(100转/分钟)参比制剂与实施例制剂溶出度试验结果,以参比制剂hn0072溶出曲线结果为参比,计算实施例制剂在ph1.2盐酸溶液、ph4.0醋酸盐缓冲液、ph6.8磷酸盐缓冲液、水四个介质中溶出曲线的相似因子(f2),结果均大于50,说明其体外溶出情况具有相似性。
(2)剂量倾泻试验
参考cfda发布的《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》为考察盐酸二甲双胍缓释片在体内酒精环境中出现药物突释的可能性,可能导致剂量倾泻,故选用1批参比制剂(批号:hn0072)和实施例1-5、对比例1-2进行溶出曲线测定。检测结果如表6-8所示。
表6:5%乙醇浓度的盐酸溶液-被评价制剂与参比制剂溶出曲线相似性比较结果
表7:20%乙醇浓度的盐酸溶液-被评价制剂与参比制剂溶出曲线相似性比较结果
表8:40%乙醇浓度的盐酸溶液-被评价制剂与参比制剂溶出曲线相似性比较结果
结果表明,参比制剂和实施例1制剂在剧烈条件下均未发生剂量倾泻,能保证安全性;以各条件下的参比制剂溶出曲线结果为参比,计算相应条件下被评价制剂的溶出曲线相似因子(f2),结果均大于50,说明其体外溶出情况具有相似性。但是对比例1、对比例2样品在不同浓度的乙醇溶液中,各取样点溶出均高于实施例1-5。说明在不进行二次喷水,或不进行二次喷水和羟丙甲基纤维素k100m不分次加入,得到的样品可能存在突释的风险。
(3)药代动力学曲线
pk浓度集30例受试者进行药代动力学浓度分析。
采用实施例1样品与参比制剂(批号:hn0072)进行药代动力学试验。
餐后所有受试者均须在每个周期服药前0h(-1h内)及服药后0.5h、1.0h、2.0h、3.0h、4.0h、4.5h、5.0h、5.5h、6.0h、6.5h、7.0h、7.5h、8.0h、10.0h、12.0h、16.0h、24.0h、30.0h共19个采血点分别抽外周静脉血约3ml用于检测二甲双胍的血药浓度。
采用液相色谱质谱(lc-ms/ms)检测法测定血浆中二甲双胍的药物浓度。定量下限是2.00ng/ml。
对血药浓度数据采用phoenixwinnonlin8.1软件进行非房室模型药代动力学参数的估算分析,计算主要药代动力学参数。
药代动力学参数计算时,按照实际的采样时间进行计算,调整的时间保留小数点后两位。
低于定量下限的所有血药浓度值,在tmax之前的按照“0”处理,在tmax之后,不参与计算。
低于定量下限的所有血药浓度值,在tmax之前的按照“0”处理,在tmax之后,不参与计算。
pk参数集30例受试者进行药代动力学参数分析。
t组受试者服用实施例1样品;r组受试者服用参比制剂。
图1和图2分别给出了t组与r组受试者的平均血药浓度(+/-sd)-时间曲线(线性坐标)-pk浓度集曲线,以及平均血药浓度(+/-sd)-时间曲线(半对数坐标)-pk浓度集曲线。可以看出,由本发明制备得到的盐酸二甲双胍缓释片可在短时间内达到峰值,并在30小时的较长时间内浓度保持平稳。
t组受试者中,平均cmax为644.9±115.53ng/ml,个体间变异系数为17.91%。
r组受试者中,平均cmax为633.4±90.12ng/ml,个体间变异系数为14.23%。
t组受试者中,平均auc0-t为7031.092±1357.5925h*ng/ml,个体间变异系数为19.31%。
r组受试者中,平均auc0-t为6960.412±1219.3524h*ng/ml,个体间变异系数为17.52%。
t组受试者中,平均auc0-∞为7118.783±1368.9918h*ng/ml,个体间变异系数为19.23%。
r组受试者中,平均auc0-∞为7052.991±1237.4619h*ng/ml,个体间变异系数为17.55%。
t组受试者中tmax的中位数为6.500h,范围4.01-10.00h。
r组受试者中tmax的中位数为6.000h,范围4.00-8.00h。
本发明制备的盐酸二甲双胍缓释片,体外溶出曲线稳定,在有效期内无明显变化。本发明制备的盐酸二甲双胍缓释片,在人体内的药代动力曲线与原研相似,而且无明显个体差异。
以上所述仅为本发明的较佳实施例,但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!