一种水溶性阳离子卟啉在制备PDT纳米光敏剂中的应用的制作方法
本发明属于光动力治疗(pdt)、化学分析和生物化学领域,特别涉及一种水溶性阳离子卟啉在制备pdt纳米光敏剂中的应用。
背景技术:
癌症是一系列相关恶性肿瘤的总称几乎可以发生于人体的任何部位,可能与遗传因素、长期接触致癌物质有关,常表现体重明显下降、疼痛、乏力等。癌症的具体病因尚未明确,但截至目前,已经有很多治疗癌症的方法。常见的有:手术治疗,化学疗法,放射疗法,光动力学治疗和光热力学治疗。其中,光动力学治疗(pdt)是对有病变的患者进行全身或者局部给药的无毒药物或染料治疗,当过了一段潜伏期以后,在氧气存在的情况下,用近红外波长的红色可见光照射特定的病灶,导致某些毒性物质的产生,从而导致细胞死亡和组织的破坏。由此可知,实现pdt的三个主要成分为:合适的光敏剂(pss),光和氧气,缺一不可。由于pdt的特异性和选择性,其作为癌症疗法的用途特别有吸引力,因为可以直接在病灶上产生一种活性氧(单线态氧)从而导致细胞破坏。又因具有创伤小、毒性小、能重复作用、不干扰传统治疗等优点已成为广泛研究的对象。水溶性良好为其在生物领域的应用提供了保障。但目前临床应用的光敏剂还存在着细胞摄取量低、暗毒性较强、靶向性差、吸收光波长短(导致低组织穿透能力和减少潜在治疗深部肿瘤)等缺陷。只有克服了上述缺点,水溶性阳离子卟啉类光敏剂才能真正的进一步广泛应用于癌症的治疗中。
dna是编码,存储和转移生物学信息的遗传材料,也是生物细胞内的四种生物大分子之一。近年来,随着dna纳米技术的高速发展,多种设计精妙、结构精确表征的dna纳米结构(包括dna四面体、dna八面体、dna纳米管、dna折纸等)相继涌现,这种dna纳米技术由于在其纳米尺度的精准可控已成为自组装领域的一项重要的技术手段,在纳米材料组装制备、纳米反应器、生物传感、药物控释等领域都展示了重要的应用前景。研究表明,许多dna纳米结构很容易地进入细胞,并具有很高的细胞摄取效率。参考文献可见lij.,fanc.h.,peih.,etal,adv.mater.,2013,25,4386-4396。基于这些dna纳米结构为开发具有多功能性的智能药物输送纳米载体提供了广阔前景。
目前已报道有ce6、tmpyp4等多种卟啉类化合物已被广泛用作光敏剂,因为卟啉类化合物具有很高的吸光能力并在高能量的激发下反应释放能量实现电子的转移。参考文献可见如hual.,nagaok.,chem.rev.2016,116,6184-6261。由于卟啉类化合物的卟吩环和g-四分体平面尺寸相互匹配存在π-π堆积作用,卟啉能促进g-四链体的形成并能对其产生稳定作用。曾报道的一种水溶性阳离子卟啉tmpipeopp,已报道它能在单链dna、双链dna存在下特异性识别g-四链体。参考文献可见zhul.-n.,zhaos.-j.,wub.,etal,plosone,2012,7,e35586。这就为水溶性阳离子卟啉tmpipeopp作为以g-四链体为靶点的pdt光敏剂奠定了重要基础。
技术实现要素:
本发明的目的是克服目前光敏剂存在的被动靶向、生物相容性差等缺点,提供利用水溶性阳离子卟啉化合物——四碘化5,10,15,20-四{4-[2-(1-甲基-1-哌啶)乙氧基]苯基}卟啉(以下简称tmpipeopp)与“dna纳米灯笼”(dna纳米结构)相结合,并应用于制备具有生物兼容性好的可识别肿瘤细胞的纳米pdt光敏剂,该纳米pdt光敏剂具有能够自组装形成、对细胞低暗毒性、高光毒性、无需强制性释放光敏剂的要求以及有良好的epr效应等特点。本发明借助g-四链体kras(序列为agggcggtgtgggaagagggaagagggggagg,摩尔消光系数为341000l·mol-1·cm-1)的特异性结合形成tmpipeopp/kras复合光敏剂,并使其具有一定的靶向性。在复合光敏剂中引入dna纳米结构,通过将kras序列一段延伸出25个碱基(序列为:tttttgtttttgttttttttttttt)变成p3-kras后,通过碱基互补配对原则,p3-kras中延伸出来的序列可以与dna纳米结构中伸展出来的序列互补配对自组装形成一种新型的具有epr效应的纳米复合光敏剂,使这种超分子纳米复合光敏剂能够在肿瘤细胞内稳定地存在并富集,从而进一步探究其在肿瘤细胞的光动力效果。
本发明的目的是通过以下技术方案实现的:
一种通过水溶性阳离子卟啉制备pdt纳米光敏剂中的方法,包括以下步骤:
(1)将浓度均为1μm的a1、a2、p1、p2四条寡核苷酸序列在含有25mmmgcl2和10mmtris-hcl的缓冲溶液(ph7.0)中混合,形成一种混合物a;将混合物a放入基因扩增仪(pcr)中加热至95℃维持5min,随即放置在冰上温育10min;即制备好dna纳米灯笼;
(2)将2μmp3-kras稀释在10mmtris-hcl缓冲溶液(ph7.0)和10mmkcl溶液中,形成一种混合物b;将混合物b放入基因扩增仪中加热至95℃维持5min,之后迅速将温度降至25℃孵育0.5h;而后,向混合物b中再加入2μmtmpipeopp,并充分混匀,得到复合光敏剂tmpipeopp/p3-kras;
(3)将上述制备好的1μm的dna纳米灯笼和2μm的复合光敏剂tmpipeopp/p3-kras混合,形成混合物c;将混合物c放入基因扩增仪中保持37℃温育1h;温育后,加入2mmna2edta形成混合物d,将混合物d并放入基因扩增仪中继续保持37℃温育1h;然后,将得到的混合物d在温度为4℃、转速为14000rpm环境下离心15min;用超纯水洗涤三次获得纳米复合光敏剂tmpipeopp/p3-kras-dna纳米灯笼,简称dna-nps,并将dna-nps重悬于10mmtris-hcl缓冲溶液(ph7.0)中以备使用。
(4)利用紫外-可见光谱、动态光散射(dls)和zetapotential、透射电镜验证上述纳米复合光敏剂的形成。
还提供一种水溶性阳离子卟啉化合物在制备pdt纳米光敏剂中的应用,所述水溶性阳离子卟啉化合物的结构式为:
化学名为:四碘化5,10,15,20-四{4-[2-(1-甲基-1-哌啶)乙氧基]苯基}卟啉,简称tmpipeopp。
一种水溶性阳离子卟啉化合物在制备pdt纳米光敏剂中的应用实验方法,包括以下步骤:
(301)通过细胞对纳米复合光敏剂dna-nps进行摄取和共聚焦荧光成像;
(302)对活细胞内产生的单线态氧进行检测;
(303)进行细胞毒性实验。
进一步的,步骤(301)具体如下:将dna-nps(其中tmpipeopp浓度为0.5μm)与hela细胞共同孵育1h,4h,8h后,用pbs洗3次以除去未摄取的药物,然后用4%多聚甲醛固定细胞15min;激光共聚焦成像使用olympusix-81显微镜进行成像,选择458nm作为二极管泵浦激光器激发波长。
进一步的,步骤(302)具体如下:2',7'-二氯荧光黄双乙酸盐(dcfh-da)作为活细胞内单线态氧的指示剂;将dna-nps(其中tmpipeopp浓度为0.5μm)与hela细胞共同孵育4h后,用pbs洗3次以除去未摄取的药物,然后将含有1μldcfh-da的无血清培基与hela细胞共同孵育30min后,用pbs洗3次以除去未摄取的dcfh-da;用波长为690nm的激光器照射5min;最后用4%多聚甲醛固定以用作clsm分析,激发波长为488nm。
进一步的,步骤(303)具体如下:在96孔板中每孔接种5×103个hela细胞,孵育24h;除去原来的培基,换上新培基,新培养基中含有dna-nps(其中tmpipeopp浓度为0.5μm);在新培基中孵育4h后用pbs洗3次,换不含药物的新培基并用650nm和690nm的激光器照射3.5min,再继续培养24h;接着向每个孔中加入10μlmtt(5mg/ml)与细胞共孵育4h,去掉含有mtt的培基,并向每个孔中加入100μldmso以溶解甲瓒晶体并且用酶标仪测定其490nm处的吸光值。
与现有技术相比,本发明通过把4条寡核苷酸制备成的dna纳米灯笼和卟啉/g-四链体复合物通过特定部分序列的碱基互补配对进行组装形成纳米复合光敏剂dna-nps,本发明的技术方案所带来的有益效果是:
1.本发明是通过基于5条寡核苷酸链和卟啉分子的组合与协作构建了一种纳米pdt光敏剂dna-nps。其对细胞具有低暗毒性和高光毒性;制备这种纳米复合光敏剂的原料和产物均为水溶性良好的物质,生物相容性好,容易代谢分解,毒副作用低,制备方法简单,容易合成,合成效率高,成本较低。
2.本发明中制备的dna-nps由5条寡核苷酸和卟啉构成,在水溶剂中即可制备,通过静电作用和超分子作用构建,方法简单,容易合成。
3.本发明中制备的dna-nps尺寸约为100nm,具有显著的epr(渗透与保留)效应,容易通过内吞作用促进肿瘤细胞中纳米颗粒的内化。
4.本发明中制备的dna-nps的近红外光的窗口的吸收大幅增强,卟啉/g-四链体复合物可以良好的组装在dna纳米结构上,将激发光波长从透明窗口边界红移到内部(约700nm),由此,显示出了很好的pdt效率。
5.本发明中制备的dna-nps无需在体内释放就可以显示出良好的光敏活性,即整个纳米颗粒可以直接在肿瘤细胞中发挥pdt功效。在光照条件下,显示出相当高的光致细胞毒性,这也证明了它的良好的光动力治疗的潜力。
附图说明
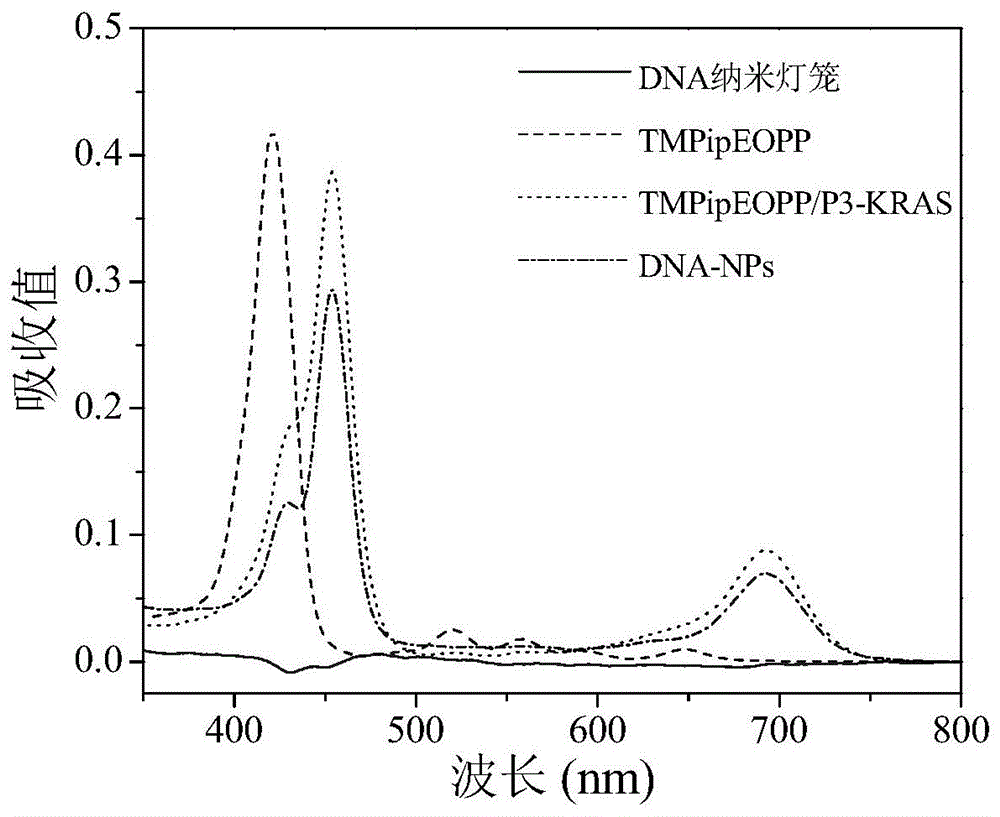
图1是本发明中dna纳米灯笼、tmpipeopp、tmpipeopp/p3-kras和dna-nps的紫外-可见分光光谱图。
图2是本发明中dna-nps的动态光散射(dls)图。
图3a、图3b和图3c分别是本发明中dna-nps被hela细胞摄取1h、4h、8h的共聚焦荧光图像。
图4是本发明中hela细胞中dna-nps产生单线态氧的共聚焦荧光图像。其中,激发波长为690nm。
图5是本发明中的dna-nps细胞暗毒性图。
图6是本发明中的dna-nps在两种激发波长下的细胞光毒性图。
图7是本发明中阳离子水溶性阳离子卟啉tmpipeopp的的分子结构图。
具体实施方式
以下结合附图和具体实施例对本发明作进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
本发明中所使用的寡核苷酸序列见表1,均订购于生工生物工程(上海)有限公司;
实施例1
一种pdt纳米光敏剂的制备,具体包括以下步骤:
(1)将浓度均为1μm的a1、a2、p1、p2四条寡核苷酸序列在含有25mmmgcl2和10mmtris-hcl的缓冲溶液(ph7.0)中混合,形成一种混合物a;将混合物a放入基因扩增仪(pcr)中加热至95℃维持5min,随即放置在冰上温育10min;即制备好dna纳米灯笼;
(2)将2μmp3-kras稀释在10mmtris-hcl缓冲溶液(ph7.0)和10mmkcl溶液中,形成一种混合物b;将混合物b放入基因扩增仪中加热至95℃维持5min,之后迅速将温度降至25℃孵育0.5h;而后,向混合物b中再加入2μmtmpipeopp,并充分混匀,得到复合光敏剂tmpipeopp/p3-kras;
(3)将上述制备好的1μm的dna纳米灯笼和2μm的复合光敏剂tmpipeopp/p3-kras混合,形成混合物c;将混合物c放入基因扩增仪中保持37℃温育1h;温育后,加入2mmna2edta形成混合物d,将混合物d并放入基因扩增仪中继续保持37℃温育1h;然后,将得到的混合物d在温度为4℃、转速为14000rpm环境下离心15min;用超纯水洗涤三次获得纳米复合光敏剂tmpipeopp/p3-kras-dna纳米灯笼,简称dna-nps,并将dna-nps重悬于10mmtris-hcl缓冲溶液(ph7.0)中以备使用。
(4)利用紫外-可见光谱、动态光散射(dls)和zetapotential、透射电镜验证上述纳米复合光敏剂的形成。
实施例2
一种pdt纳米光敏剂的表征,主要采用以下两种方式:
(1)紫外-可见光谱表征:将dna纳米灯笼、tmpipeopp、tmpipeopp/p3-kras和dna-nps(其中保持tmpipeopp浓度一致)扫描紫外-可见分光光谱,得到的谱图见图1。由图可知,游离tmpipeopp在417nm处显示出强烈的soret吸收峰,而4个弱q吸收带的中心分别519、559、580和650nm。当tmpipeopp与g-四链体p3-kras结合后,形成了一个新的吸收带,在700nm处左右,而且其摩尔吸收系数比游离tmpipeopp在650nm处的吸收系数高得多,这表明tmpipeopp/p3-kras复合物作为一种复合光敏剂非常有前途,与游离tmpipeopp的吸收率相比,它不仅将激发光波长从生物透明窗口的边界红移到内部,而且还大大增强了光的强度。当tmpipeopp/p3-kras复合物结合了dna纳米灯笼形成dna-nps后,在700nm处依旧有较强的吸收峰,这表明,组装在dna纳米灯笼上的tmpipeopp分子仍可与g-四链体p3-kras结合。同时,dna纳米灯笼本身在700nm处没有特征吸收峰。
(2)动态光散射(dls)的表征:通过使用zetasizernanozs(malverninstruments,uk)测量流体力学尺寸,测的结果为108±6nm,见图2。
实施例3
(1)细胞摄取和共聚焦显微成像。
(a)细胞培养。培养箱保持37℃,5%co2,hela细胞在含有10%胎牛血清和1%双抗的培养基dmem中培养。
(b)加入纳米复合光敏剂。将dna-nps(其中tmpipeopp浓度为0.5μm)与hela细胞共同孵育1h,4h,8h后,分别记作1、2、3号样,用pbs洗3次以除去未摄取的药物,然后用4%多聚甲醛固定细胞15min。
(c)利用激光共聚焦成像获得实验结果。使用olympusix-81显微镜进行激光共聚焦成像,选择458nm作为二极管泵浦激光器激发波长。得到纳米复合光敏剂dna-nps在与hela细胞共同孵育1h,4h,8h后的共聚焦荧光显微成像图,见图3a至图3c。
(2)对活细胞内产生的的单线态氧进行检测。
(a)细胞培养。培养箱保持37℃,5%co2,hela细胞在含有10%胎牛血清和1%双抗的培养基dmem中培养。
(b)加入纳米复合光敏剂和单线态氧指示探针。将dna-nps(其中tmpipeopp
浓度为0.5μm)与hela细胞共同孵育4h后,用pbs洗3次以除去未摄取的药物,然后将含有1μldcfh-da的无血清培基与细胞共同孵育30min后,用pbs洗3次以除去未摄取的dcfh-da;用波长为690nm的激光器照射5min;最后用4%多聚甲醛固定细胞15min。
(c)利用激光共聚焦成像获得实验结果。使用olympusix-81显微镜进行激光共聚焦成像,激发波长为488nm。得到纳米复合光敏剂dna-nps在hela细胞中产生单线态氧的共聚焦荧光显微成像图,见图4。
(3)细胞毒性实验。
(a)细胞培养。培养箱保持37℃,5%co2,hela细胞在含有10%胎牛血清和1%双抗的培养基dmem中培养。而后在96孔板中每孔接种5×103个hela细胞,孵育24h。
(b)暗条件下细胞培养。孵育24h后,除去原来的培基,换上新培基,新培养基中含有dna-nps(其中tmpipeopp浓度为0.05、0.25、0.5、1、2.5、5μm);在新培基中孵育4h后用pbs洗3次,再继续培养24h。
(c)光条件下细胞培养。孵育24h后,除去原来的培基,换上新培基,新培养基中含有dna-nps(其中tmpipeopp浓度为0.5μm);在新培基中孵育4h后用pbs洗3次,换不含药物的新培基并用650nm和690nm的激光器照射3.5min,再继续培养24h。
(d)利用酶标仪获得光、暗条件下的细胞毒性。去掉原来的培养基,向每个孔中加入10μl噻唑蓝(mtt)(5mg/ml)与细胞共孵育4h,去掉含有mtt的培基,并向每个孔中加入100μldmso来溶解甲瓒晶体,15min后,使用酶标仪测定490nm处的吸光值,并计算出细胞存活率。见图5和图6,图5中tmpipeopp的浓度分别为0.05、0.25、0.5、1、2.5、5μm。图6中,tmpipeopp的浓度为0.5μm。
实施例4
一种水溶性阳离子卟啉的制备:
水溶性阳离子卟啉化学名为:四碘化5,10,15,20-四{4-[2-(1-甲基-1-哌啶)乙氧基]苯基}卟啉,简称omhepzeopp,见图7。
(1)四(对羟基卟啉)的合成
在四口烧瓶中加入100mm对羟基苯甲醛、120ml丙酸,搅拌,回流(127℃-132℃)下滴加吡咯100mm,15min内滴毕,回流反应120min。趁热倒入烧杯中,搅拌冷却至室温,抽滤,滤饼用丙酸洗涤,真空干燥得蓝紫色粗品,用无水乙醇重结晶,得紫色晶体。
(2)四(1-哌啶乙氧基-苯基卟啉)的合成
0.1mm的四(对羟基卟啉)、0.4mm的n-(2-氯乙基)哌啶盐酸盐和2mm的k2co3在30ml干燥dmf中,氮气保护下室温搅拌72小时,然后有紫红色沉淀产生,过滤,蒸干,得紫色固体。
(3)四碘化5,10,15,20-四{4-[2-(1-甲基-1-哌啶)乙氧基]苯基}卟啉的合成
将0.05mm的四(1-哌啶乙氧基-苯基卟啉)溶解在30ml干燥的二氯甲烷中,然后滴加碘甲烷0.2mm,氮气保护下油浴加热40℃反应24小时。停止反应后,将反应液蒸干,粗产品用二氯甲烷和乙醚轮流洗涤,得紫红色固体。
表1本实施例中所使用的寡核苷酸序列
本发明并不限于上文描述的实施方式。以上对具体实施方式的描述旨在描述和说明本发明的技术方案,上述的具体实施方式仅仅是示意性的,并不是限制性的。在不脱离本发明宗旨和权利要求所保护的范围情况下,本领域的普通技术人员在本发明的启示下还可做出很多形式的具体变换,这些均属于本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!