紫檀芪在制备TOP1酶抑制剂中的应用的制作方法
本发明属于医药用途领域,具体涉及紫檀芪的一种新的用途,进一步涉及紫檀芪在制备top1酶抑制剂中的应用。
背景技术:
癌症是威胁人类健康的一大疾病,所造成的死亡人数仅次于心脏病,并有超过心脏病死亡率的趋势,给社会和家庭带来了沉重的经济和精神负担。国际癌症研究机构(iarc)称,2018年全球预计有1810万例新增癌症病理,并且大约有960万人死于癌症。在中国,大约有280.4万新发癌症病例,229.6万癌症死亡病例,与前一年的评估报告相比,癌症的发病率和死亡率呈明显上升趋势。现有常规的肿瘤治疗方法为手术加药物治疗,但是多数抗肿瘤药物具有毒副作用大、靶向性不强、易产生耐药性等缺点。
dna拓扑异构酶i(topoisomerasei,top1)是一个普遍存在于哺乳动物细胞内的酶,参与许多重要的细胞过程,如dna复制、转录及染色质重塑等,能够调节dna的拓扑结构,解开dna的正负超螺旋,是迄今发现的唯一可以形成dna3’-酪胺酰磷酸二酯键的酶。top1已被证明是治疗肿瘤的一个有效靶点,喜树碱及其衍生物为top1酶抑制剂,在抗肿瘤临床治疗中有着广泛应用。但是喜树碱及其衍生物水溶性差,且大多数具有较高的细胞毒性,从而导致其在临床应用中受到了限制。因此,研发新的低毒性、高靶向性的抗肿瘤药物有着十分重要的意义。
在寻找抗肿瘤药物的过程中,天然来源的化合物引起了科学家们的重视。紫檀芪最早来源于檀香,并因此而命名,后又在蓝莓、葡萄等浆果中发现并大量提取。紫檀芪是白藜芦醇的二甲基化衍生物,相比于白藜芦醇,紫檀芪具有更加优秀的口服吸收利用率。紫檀芪有抗癌、抗炎、抗氧化和镇痛剂的作用。目前大量研究表明紫檀芪在皮肤疾病的治疗和防护中有较好的作用,特别是在抗氧化等领域。目前,国内已有专利“紫檀芪在制备抗宫颈癌药物中的应用”(cn201010249037.x),该专利公开表明紫檀芪急性毒性较低,可用于制备抗宫颈癌药物。但截至目前国内外未见紫檀芪在制备top1酶抑制剂中的相关报道。
技术实现要素:
为解决上述技术问题,本发明提供了一种紫檀芪在制备top1酶抑制剂中的用途,公开紫檀芪能够抑制top1酶的活性,能够抑制具有top1介导的dna复制损伤特征的肿瘤疾病。
本发明所述的紫檀芪,其分子式为:c16h16o3,分子量:256.30,结构式如下:
在一个实施例中,本发明提供了紫檀芪在制备top1酶抑制剂中的应用。
在一个实施例中,本发明还提供了紫檀芪在制备用于具有top1介导的dna复制损伤特征的肿瘤疾病的药物中的应用。
在一个实施例中,所述肿瘤包括但不限于非小细胞肺癌、乳腺癌、肝癌、卵巢癌、回盲肠癌、结肠癌或大肠癌。进一步的,紫檀芪能够抑制a549、mcf-7、hepg2、a2780、hct-116、hct-8、sw480、lovo、colo205和/或cl187肿瘤细胞的增殖。
在一个实施例中,所述抑制剂中紫檀芪的浓度为0.25~500μm。进一步的,所述紫檀芪的浓度为0.25、0.5、2.5、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、110、120、130、140、150、200、300、400、500μm。
在一个实施例中,所述抑制剂采用本领域常规方法配制,包括:采用适量的溶剂将紫檀芪充分溶解制成母液;再用所述溶剂将母液按梯度稀释成所述浓度。进一步的,所述溶剂包括但不限于:纯化水、生理盐水、葡萄糖水等水溶剂;醇与多元醇类,如乙醇、丙二醇、甘油、聚乙二醇200(400、600)、丁醇和苯甲醇等;酰胺类,如二甲基甲酰胺、二甲基乙酰胺等;酯类,如三醋酸甘油酯、醋酸乙酯、油酸乙酯、苯甲酸苄酯和肉豆蔻酸异丙酯等;植物油类,如花生油、玉米油、芝麻油等;亚砜类,如二甲基亚砜等;环糊精,如羟丙基-β-环糊精和磺丁基-β-环糊精等。
在一个实施例中,所述应用中紫檀芪以药物组合物形式存在,所述药物组合物包括紫檀芪和药学上可接受的任何载体。所述载体指给药时基本上没有长期或永久有害效果的任何载体,并包括“可药用的介质、稳定剂、稀释剂、添加剂、辅助剂或赋形剂”等含义。所述载体通常与活性化合物混合或可用于稀释或封装活性化合物并且可以为固态、半固态或液态制剂。应当理解,活性组分在理想载体或稀释剂中应可溶或作为悬浮物释放。任何品种的可药用载体都可使用,包括但不限于水、盐水、甘氨酸、透明质酸等水介质;甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、糖钠、纤维素、葡萄糖、蔗糖、碳酸镁等固体载体;溶剂;分散试剂;包衣;抗细菌剂以及抗真菌剂;等渗剂以及吸收延迟剂;或任何其他非活性组分。可药用载体的选择可以取决于给药模式。除了目前一些可药用的载体与活性组分不相容之外,可以设想将其应用于可药用的组合物中。所述药物载体的特定用法的非限定实施例可以参考《药物剂型和药物传递系统》(howardc.anseletal.,eds.,lippincottwilliams&wilkinspublishers,7thed.1999);《雷姆森:药物的科学与实践》((alfonsor.gennaroed.,lippincott,williams&wilkins,20thed.2000);古德曼与吉尔曼的《治疗的药理学基础》(joelg.hardmanetal.,eds.,mcgraw-hillprofessional,10thed.2001));《药学赋性剂手册》(raymondc.roweetal.,aphapublications,4thedition2003)。这些协议是常规程序,任何修改应涵盖在本领域技术人员的范围之内且来自本文的教导。
进一步的,所述药物组合物可以可选择地包括但不限于其他可药用的组分(或药用组分),包括但不限于缓冲剂、防腐剂、张力调节剂、盐、抗氧化剂、渗透压调节剂、生理物质、药理物质、填充剂、乳化剂、润湿剂、甜味剂或调味剂等等。各种缓冲剂和调节ph的方法可以用于制备本文所公开的药物组合物,前提是由此引起的制备是可药用的。这样的缓冲剂包括但不限于乙酸盐缓冲剂、柠檬酸盐缓冲剂、磷酸盐缓冲剂、中性缓冲盐水、磷酸盐缓冲盐水和硼酸盐缓冲剂。应当理解,酸或碱可以按照需要用于调节组合物的ph。可药用的抗氧化剂包括但不限于焦亚硫酸钠、硫代硫酸钠、乙酰半胱氨酸、丁基羟基茴香醚和二叔丁基对甲酚。有用的防腐剂包括但不限于苯扎氯铵、氯丁醇、硫柳汞、醋酸苯汞、硝酸苯汞、稳定的氧氯组成物和螯合剂,例如dtpa或dtpa-双酰胺、钙dtpa以及canadtpa-双酰胺。在药物组合物中有用的张力调节剂包括但不限于盐(例如,氯化钠、氯化钾)、甘露醇或甘油和其他可药用的张力调节剂。所述药物组合物可以作为盐被提供,并且可用多种酸形成,包括但不限于盐酸、硫酸、醋酸、乳酸、酒石酸、苹果酸、琥珀酸等等。相比于成为相应的游离碱基形式,所述盐更倾向溶于水溶液或其他质子溶剂。应当理解,药物组合物可以包括所述药剂和在药学领域已知的其他物质。
进一步的,所述药物组合物可制成固态制剂。适用于肠内或肠胃外给药的固态制剂包括但不限于,胶囊、片剂、丸剂、锭剂、含片以及适于吸入或重建成无菌可注射溶液或分散液的粉剂及粒剂。用于此施用的本文所公开的治疗性化合物或组合物可根据该领域已知的用于制造医药组合物的任何方法制备。在此固态剂型中,治疗性化合物可与以下混合:(a)至少一种惰性常见赋形剂(或载体),例如,柠檬酸钠或磷酸二钙或(b)填充物或增量剂,例如,淀粉、乳糖、蔗糖、葡萄糖、甘露醇、异麦芽糖醇,以及硅酸,(c)粘合剂,例如,羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、蔗糖和阿拉伯胶,(d)湿润剂,例如,甘油,(e)崩解剂,例如,琼脂-琼脂、碳酸钙、玉米淀粉、马铃薯淀粉、木薯淀粉、藻酸、某些复合硅酸盐和碳酸钠,(f)溶液阻滞剂,例如,石蜡,(g)吸收加速剂,例如,季铵化合物,(h)加湿剂,例如,鲸蜡醇和单硬脂酸甘油酯,(i)吸附剂,例如,高岭土及膨润土,(j)润滑剂,例如,滑石、硬脂酸、硬脂酸钙、硬脂酸镁、固体聚乙二醇、硫酸月桂酸钠或其混合物,以及(k)缓冲剂。片剂可不用包衣或可利用已知技术包覆以延缓在胃肠道中的崩解和吸收,进而在较长一段时间内提供持续作用。例如,可使用延时材料例如单硬脂酸甘油酯或二硬脂酸甘油酯。在固态制剂中,所述紫檀芪的治疗有效量通常可介于约0.0001%(w/w)与约60%(w/w)之间,约0.001%(w/w)与约40.0%(w/w)之间,或约0.01%(w/w)与约20.0%(w/w)之间。
进一步的,所述药物组合物可制成半固态制剂。适用于局部施用的半固态制剂包括,不限于、软膏、霜剂、油膏、及凝胶。用于此施用的本文所公开的治疗性化合物或组合物可根据该领域已知的用于制造药物组合物的任何方法制备。在半固态制剂中,所述紫檀芪的治疗有效量通常可介于约0.0001%(w/v)与约60%(w/v)之间,约0.001%(w/v)与约40.0%(w/v)之间,或约0.01%(w/v)与约20.0%(w/v)之间。
进一步的,所述药物组合物可制成液态制剂。适于肠内或肠胃外施用的液态制剂包括不限于,溶液、糖浆、酏剂、分散液、乳液及包括但不限于用于静脉内施用的那些悬浮液。本文所公开的用于这种施用方式的治疗性化合物或组合物可根据该领域已知的用于制造药物组合物的任何方法制备。在此液体剂型中,所述紫檀芪可与以下混合:(a)适宜的水性及非水性载体,(b)稀释剂,(c)溶剂,例如,水、乙醇、丙二醇、聚乙二醇、甘油、植物油(比如,菜籽油和橄榄油),以及可注射的有机酯(例如油酸乙酯);和/或流动剂(比如,表面活化剂或如卵磷脂的涂层剂)。在分散液和悬浮液的情况下,流动性也可通过保持特定的粒径来控制。在液态制剂中,所述紫檀芪的治疗有效量通常可介于约0.0001%(w/v)与约60%(w/v)之间,约0.001%(w/v)与约40.0%(w/v)之间,或约0.01%(w/v)与约20.0%(w/v)之间。
本发明的有益效果:
本发明提供了紫檀芪在制备top1酶抑制剂中的应用。实验表明紫檀芪能够有效抑制top1酶的酶活,抑制其对超螺旋dna的解旋能力,且对top1酶的抑制效果与喜树碱持平。此外,紫檀芪能够有效抑制多种肿瘤细胞的增殖,具有广谱抗肿瘤效果;还能在细胞内下调top1酶蛋白的浓度,对体外非增值型细胞无细胞毒性,安全性较高。
附图说明
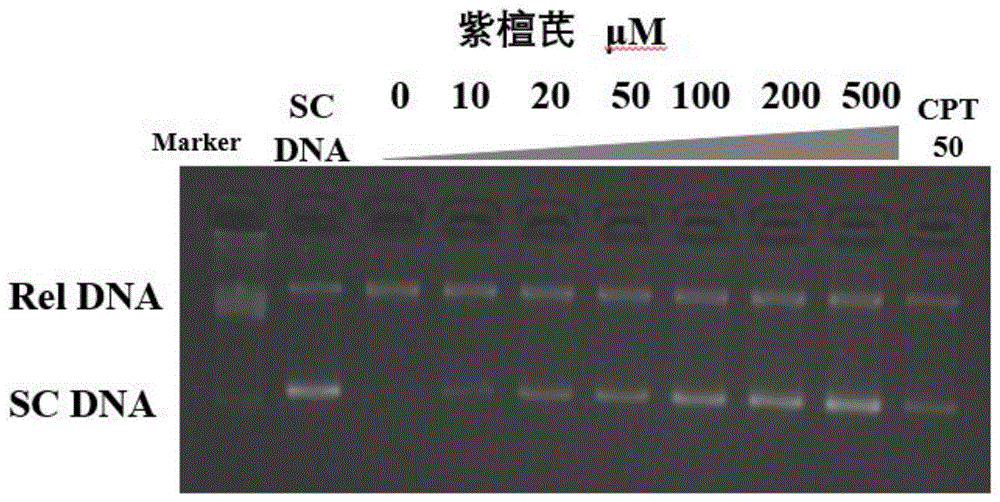
图1为紫檀芪体外抑制top1酶活性。
图2为紫檀芪对多种肿瘤细胞增殖的抑制。
图3为紫檀芪在cl187细胞中对top1酶蛋白含量的抑制。
图4为紫檀芪对胞内top1酶基因表达的抑制。
图5为紫檀芪对体外增值型正常细胞的影响。
图6为紫檀芪对体外非增值型正常细胞的影响。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案,但本领域的技术人员容易理解,实施例所描述的具体的物料配比、工艺条件及其结果仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
实施例1top1酶活抑制试验
在37℃温孵30min条件下,一个酶活单位(unit)的top1酶可解旋1ng的超螺旋dna。本试验使用的超螺旋dna为phot1dna质粒,浓度为0.25μg/ml,使用的拓扑异构酶i为杆状病毒中过表达并纯化的高纯度、高催化活性酶,酶活力为330units/μl。配制实验体系如表1。
表1:top1酶活试验样品准备
以上体系配置完成后,37℃水浴30min,取出后向每管中加入2μl的10%sds溶液,加入2.5μl蛋白酶k(0.5mg/ml),终止反应并降解top1酶,继续在37℃水浴15min,取出后向每管中加入4μl6xloadingbuffer终止反应。
配置2%的琼脂糖凝胶,取上述样品6μl点样,在tae缓冲液中,恒压80v,电泳80min。电泳结束后,使用非eb核酸染料染色30min,在化学发光成像系统中完成照胶工作,结果如图1。
结果显示:紫檀芪能够有效抑制top1酶的酶活,抑制其对超螺旋dna的解旋能力,该能力随着紫檀芪浓度的增加而增大,呈剂量依赖性;且在同浓度(50μm)时,紫檀芪对top1酶的抑制效果与喜树碱持平。
实施例2体外肿瘤细胞增殖抑制试验
本实验使用cck-8试剂盒检测细胞增殖情况。cellcountingkit-8,简称cck-8试剂盒或cck8,是一种基于wst-8而广泛应用于细胞增殖和细胞毒性的快速、高灵敏度检测的试剂盒。wst-8是一种类似于mtt的化合物,在电子耦合试剂存在的情况下,可以被线粒体内的一些脱氢酶还原生成橙黄色formazan。细胞增殖越多越快,则颜色越深;细胞毒性越大,则颜色越浅。对于同样的细胞,颜色的深浅和细胞数目呈线性关系。
实验设置空白对照组、阳性对照组和试验组,每组设置6个复孔。取对数生长期的肿瘤细胞,调整细胞密度为5×104个/ml,接种于96孔板内,每孔100μl,在细胞培养箱中孵育12h。配置含不同浓度紫檀芪的培养基,每孔添加100μl,使紫檀芪最终作用于细胞的浓度为0.25、0.5、2.5、5、25、50、100μm。阳性对照组是最终浓度为0.5μm的喜树碱。继续在培养箱中孵育24h/48h/72h。
孵育结束后,向每孔添加20μl的cck-8溶液,继续在细胞培养箱内孵育1h。拿出96孔板,使用酶标仪在450nm波长下进行检测。
细胞抑制率(%)=(1-试验组od/空白组od)×100
细胞存活率(%)=1-细胞抑制率(%)
绘制紫檀芪浓度和肿瘤细胞存活率曲线,结果见图2;计算紫檀芪对各种细胞的半数抑制浓度ic50值,结果见表2。
表2:紫檀芪对多种肿瘤细胞的ic50值
结果显示:紫檀芪能够有效抑制多种肿瘤细胞的增殖,浓度越大,抑制效果越明显,呈剂量依赖性。紫檀芪在一定程度上具有广谱抗肿瘤效果。
实施例3胞内top1蛋白含量检测试验
实验设置空白对照组、阳性对照组和试验组。取对数生长期的肿瘤细胞,调整细胞密度为调整细胞密度为5×105个/ml,接种于12孔板内,每孔1ml,在细胞培养箱中孵育24h。配置含不同浓度紫檀芪的培养基,每孔添加1ml,使紫檀芪最终作用于细胞的浓度为1、10、20、50、80、100μm。阳性对照组是最终浓度为1μm的喜树碱。继续在培养箱中孵育12h/24h/36h/48h。
孵育结束后,弃上清,用无菌pbs清洗细胞两遍,用含1%pmsf的ripa裂解液在冰上裂解5-15min,待细胞完全裂解后,吹打混匀细胞,收入到离心管内。
用bca法测定蛋白含量,调整各个样品总蛋白浓度一致,然后使用人拓扑异构酶i的elisa试剂盒进行检测,测定各个样品中的蛋白含量。结果如图3。
结果显示:紫檀芪能够在细胞内下调top1酶蛋白的浓度。
实施例4胞内top1蛋白的基因表达水平检测试验
实验设置空白对照组、阳性对照组和试验组。取对数生长期的肿瘤细胞,调整细胞密度为调整细胞密度为2×105个/ml,接种于24孔板内,每孔0.5ml,在细胞培养箱中孵育24h。配置含不同浓度紫檀芪的培养基,每孔添加0.5ml,使紫檀芪最终作用于细胞的浓度为1、5、10、20、50μm。阳性对照组是最终浓度为1μm的喜树碱。继续在培养箱中孵育24h。
孵育结束后,弃上清,用无菌pbs清洗细胞两遍,用trizol裂解5-15min,待细胞完全裂解后,吹打混匀细胞,收入到离心管内。
抽提样品中的总rna,然后反转录成cdna,以gapdh蛋白的基因为内参,设计top1酶的基因上下游引物如表3,进行实时荧光定量pcr,结果见图4。
表3:top1和gapdh基因的引物序列
结果显示:紫檀芪能够在细胞内下调top1酶基因水平的表达。
实施例5体外增殖型正常细胞毒性试验
使用raw264.7(小鼠巨噬细胞)和hcoepic-(人正常结肠上皮细胞)细胞,使用cck-8试剂盒检测其24h/48h细胞毒性,方法同实施例1。结果如图5。
结果显示:紫檀芪在较高浓度时,对增殖型正常细胞有一定的细胞毒性,但相对喜树碱来说,毒性较小,安全性较高。
实施例6体外非增值型正常细胞毒性试验
取icr小鼠,脱臼处死后,在超净台内无菌取出小鼠的脾脏和肝脏,经过胰蛋白酶消化和200目细胞筛网研磨,过滤收集得到单个细胞。进行细胞计数、铺板后,使用cck-8试剂盒检测其24h/48h细胞毒性,方法同实施例1。结果如图6。
结果显示:紫檀芪对体外非增值型细胞无细胞毒性,安全性较高。
- 还没有人留言评论。精彩留言会获得点赞!