REGEND001细胞自体回输制剂的新用途的制作方法
regend001细胞自体回输制剂的新用途
技术领域
1.本发明涉及临床医学领域,具体涉及一种regend001细胞自体回输制剂的新用途。
背景技术:
2.特发性肺纤维化(ipf)是一种病因不明,慢性进行性纤维化性间质性肺炎。ipf已被列入2018年国家罕见病名录,目前在我国的发病人数呈逐年增加的趋势。ipf好发于中老年男性人群,主要表现为进行性加重的呼吸困难,伴限制性通气功能障碍和气体交换障碍,最终导致低氧血症、甚至呼吸衰竭。ipf预后差,其肺组织学和胸部高分辨率ct(hrct)表现为普通型间质性肺炎(uip),主要病理特征包括弥漫性肺泡炎和肺间质纤维化,其肺部损伤持续进展,不可逆转。肺泡数量的缺乏导致肺部换气功能低下乃至丧失,从而导致患者机体缺氧、活动能力下降乃至死亡。因此ipf诊断后的平均生存期仅2.8年,死亡率高于大多数肿瘤,被称为一种“类肿瘤疾病”。
3.治疗ipf的传统方法主要是服用抗炎症药物和抗纤维化药物。糖皮质激素能抑制炎症反应和免疫过程。免疫抑制剂(环磷酰胺、硫唑嘌呤、甲氨蝶呤等)也有抑制炎症反应的作用,故糖皮质激素和免疫抑制剂/细胞毒药物曾作为治疗ipf的基本药物,但对于中晚期纤维化患者疗效不理想。目前在中国批准上市的ipf治疗药物有吡非尼酮和尼达尼布等。它们对于患者的肺功能下降有一定的延缓作用,但难以改善肺功能或逆转病程,无法真正阻止纤维化的发生。目前针对ipf,除了开展全肺移植手术之外,全世界范围内都缺乏有效的常规治疗手段,根本的原因在于缺乏有效方法能够再生修复损伤的肺泡结构。
4.哈佛大学frank mckeon研究组于2011年率先从小鼠远端支气管中鉴定到支气管基底层细胞这一细胞类群。2018年,在成年人体内成功鉴定并在体外分离扩增到该群支气管基底层细胞。该群细胞属于基底层细胞大类,具有分化形成支气管和肺泡上皮的潜能。
技术实现要素:
5.本发明提供一种regend001细胞自体回输制剂在制备产品中的应用,所述产品的功能为改善特发性肺纤维化患者肺功能。
6.所述regend001细胞自体回输制剂为采集、体外分离和培养扩增的患者自身支气管基底层细胞制备而得到的细胞制剂成品。本发明提供一种regend001细胞自体回输制剂在制备产品中的应用,所述产品的功能为改善特发性肺纤维化患者肺换气功能。
7.本发明提供一种regend001细胞自体回输制剂在制备改善和/或治疗人肺换气功能产品中的应用。
8.本发明提供一种regend001细胞自体回输制剂在制备改善人肺弥散功能产品中的应用。
9.本发明提供一种regend001细胞自体回输制剂在制备改善人运动功能产品中的应用。
10.上述regend001细胞自体回输制剂的给药部位为左肺舌叶、左肺下叶与右肺中叶、
右肺下叶任一肺亚段。
11.上述regend001细胞自体回输制剂的给药剂量为1-10
×
106个细胞/kg。
12.本发明提供一种regend001细胞自体回输制剂在治疗特发性肺纤维化中应用。
13.本发明技术方案,具有如下优点:本发明开发了支气管基底层细胞产品即regend001细胞自体回输制剂。在早期探索性临床研究中,通过气道局部给药,将其自体回输至特发性肺纤维化患者体内,具有修复肺损伤,提高肺脏换气功能的效果。
附图说明
14.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
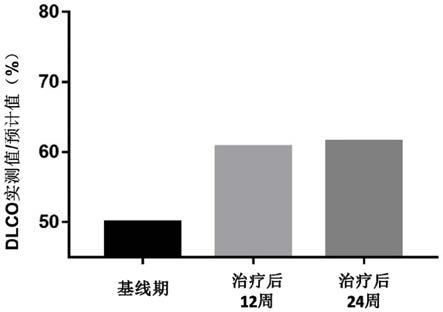
15.图1是本发明实施例3中病例1治疗前后弥散功能(dlco实测值/预计值)变化;
16.图2是本发明实施例3中病例1治疗前后弥散功能(dlco实测值)变化;
17.图3是本发明实施例3中病例2治疗前后弥散功能(dlco实测值/预计值)变化;
18.图4是本发明实施例3中病例2治疗前后弥散功能(dlco实测值)变化;
19.图5是本发明实施例3中病例3治疗前后弥散功能(dlco实测值/预计值)变化;
20.图6是本发明实施例3中病例3治疗前后弥散功能(dlco实测值)变化;
21.图7是本发明实施例3中病例4治疗前后弥散功能(dlco实测值/预计值)变化;
22.图8是本发明实施例3中病例4治疗前后弥散功能(dlco实测值)变化。
具体实施方式
23.下列实施例中的dlco预计值由欧洲胸科协会推荐的预计值(ecsc)方程计算而得,对我国而言,在ecsc方程的基础上加用校正系数进行校正获得预计值。通常预计值与患者的身高、体重和年龄均具有相关性。我国华东地区成人肺功能预计值计算公式为dlco=0.3894*h-0.1244*a-0.0790*w-25.3405。
24.下列实施例中的6分钟步行试验参考标准说明:
25.据美国胸科协会(ats)于2002年发布的6分钟步行实验详细指南,六分钟步行试验是一种对中、重度心肺疾病患者功能状态的运动试验,主要适用于测量中到重度心脏或肺疾病患者对于医疗干预的反应,主要评估患者的运动能力。对于获得结果6分钟步行距离的变化用哪种方式(绝对值或百分比或变化占预计值的百分比)表达对临床的意义最大,目前尚无定论,指南给出的建议为使用绝对值。
26.圣乔治呼吸问卷(sgrq)参考标准说明:
27.圣乔治呼吸问卷(sgrq)是目前用于测量呼吸性疾病成年患者健康受损情况和生活质量的应用最广泛的特殊量表之一,是一种标准化的患者自填问卷,根据症状(症状发生频率和严重程度)、活动(能导致气促或气促引起的活动受限)、对日常活动的影响(气道疾病引起的社会能力损害和心理障碍)三个方面的问题进行权重计分。得分越高,说明生活质量越差(参考文献:jones pw,quirk fh,baveystock cm.the st george's respiratory questionnaire.respir med.1991sep;85suppl b:25-31;discussion33-7)。当前被越来越
多的呼吸性疾病采用,用来评估患者的生活质量。2017年获批的治疗ipf的化学药物尼达尼布的临床试验也采用该评估项目。当前并无固定的标准,主要用于患者自身前后的对比。
28.实施例1 regend001细胞自体回输制剂的制备
29.本实施例提供了一种临床级自体支气管基底层细胞的制备工艺,具体包括如下步骤:
30.取离体活性支气管刷检组织备用,在本实施例中选择取位于支气管两个不同部位的组织。之所以选择两个或者多个部位,是为了保证分离的成功率。
31.取组织消化液和终止液备用;其中组织消化液中,99v%为dmem/f12,其余为1-20ng/ml的dna酶,0.1-4mg/ml蛋白酶xiv和10-200ng/ml胰酶;终止液中90v%为dmem,10v%为fbs。
32.利用组织消化液对上述刷检组织进行消化处理,利用终止液对经消化处理后的组织进行终止消化后收集细胞。经酶解后的细胞进行菌检和支原体检测后部分冻存。
33.取培养基备用,其中培养基中225ml dmem,225ml f12,20-70ml fbs,0.2-2mm l-glutamine,1-14ng/ml胰岛素,0.1-1ng/ml表皮生长因子,5-30ug/ml腺嘌呤,2-20ug/ml氢化可的松。
34.将已经辐照辐照灭活的滋养层细胞铺于t25细胞培养瓶中,放在细胞培养箱中培养(37℃,5%co2),1-2天后可使用,细胞的密度以1-2天后细胞铺展到培养瓶底表面的50-70%为宜。
35.取部分经消化处理后的细胞,每部位来源细胞重悬并铺于1个铺被滋养层细胞的t25培养瓶中,加入200ng/ml庆大霉素,在37℃,co2浓度为4%-8%条件下培养,隔天更换培养基,待细胞呈克隆状生长至细胞聚集成团,细胞克隆长大至超过80%的克隆中有40-100个细胞,且随机观察的5个视野中有3个视野均有a级和b级克隆时,收集细胞进行传代培养。
36.对细胞的第一次传代培养,去细胞培养上清,1
×
dpbs洗涤一次,加入2ml重组胰酶37℃消化5-10min,待大部分细胞变圆变亮后,将贴壁细胞吹打下来并吹打成单细胞悬液,用等体积dmem培养基终止消化,收集细胞悬液,1200rpm离心5min去上清,并用培养基重悬细胞,最后按照5-10
×
103个细胞/cm2的密度铺于1个铺被滋养层细胞的t75细胞培养瓶进行培养,隔天换液。
37.待第一次传代细胞长满至培养瓶底表面积的50%-90%时,进行第二次传代培养。去培养上清,加入1
×
dpbs洗涤一次,加入5ml重组胰酶37℃消化5-10min,待大部分细胞变圆变亮后,将贴壁细胞吹打下来并吹打成单细胞悬液,用等体积dmem培养基终止消化,收集细胞悬液,1200rpm离心5min去上清,并用培养基重悬细胞。按5-10
×
103个细胞/cm2的密度铺于铺被滋养层细胞的3个t75细胞培养瓶上进行培养,隔天换液。
38.待第二次传代细胞长满至培养瓶底表面积的50%-90%时,进行第三次传代培养。每瓶细胞去培养上清,加入1
×
dpbs洗涤一次,加入5ml重组胰酶37℃消化5-10min,待大部分细胞变圆变亮后,将贴壁细胞吹打下来并吹打成单细胞悬液,用等体积dmem培养基终止消化,收集细胞悬液,1200rpm离心5min去上清,并用培养基重悬细胞。取2ml细胞培养上清和3-16
×
105个细胞进行菌检和支原体检测为阴性,庆大霉素残留检测结果低于5.4ppb,生物学效应检测hopx阳性率≥30%、细胞鉴别为krt5阳性和细胞纯度分析结果为krt5细胞比例≥90%。同时重悬细胞按5-10
×
103个细胞/cm2的密度铺于铺被滋养层细胞的10个t75细
胞培养瓶上进行培养,隔天换液。
39.待第三次传代细胞长满至培养瓶底表面积的50%-90%时,进行第四次传代培养。每瓶细胞分别去培养上清,加入1
×
dpbs洗涤一次,加入5ml重组胰酶37℃消化5-10min,待大部分细胞变圆变亮后,将贴壁细胞吹打下来并吹打成单细胞悬液,用等体积dmem培养基终止消化,收集细胞悬液,1200rpm离心5min去上清,并用培养基重悬细胞。取1-10
×
105个细胞进行生物学效应检测hopx阳性率≥30%。同时重悬细胞按5-10
×
103个细胞/cm2的密度铺于铺被滋养层细胞的30个t75细胞培养瓶上进行培养,隔天换液。
40.待第四次传代培养细胞长满至培养瓶底表面积的50%-90%时,进行滋养层细胞去除。操作为每个培养瓶中去培养上清,加入1
×
dpbs洗涤一次,加入5ml重组胰酶,在37℃中放置1-2min,将滋养层细胞吹打下来,再用1
×
dpbs洗涤一次,加入5ml重组胰酶消化,待大部分细胞变圆变亮后,将贴壁细胞吹打下来并吹打成单细胞悬液,用等体积dmem培养基终止消化,收集细胞悬液,1200rpm离心5min去上清,并用培养基重悬细胞。取5-10
×
105个细胞进行细胞纯度分析结果为krt5细胞比例≥90%。最后将所有细胞铺于30个t75细胞培养瓶中进行培养。
41.待细胞培养瓶中细胞长满至培养皿表面积的85%-95%时,每个培养瓶中加入1
×
dpbs洗涤一次,加入5ml重组胰酶,在37℃中放置5-15min,待大部分细胞变圆变亮后,用1ml枪头轻轻将贴壁细胞吹打下来并吹打成单细胞悬液,用等体积dmem培养基终止消化,收集细胞悬液,再用5ml dmem培养基冲洗培养瓶底表面,收集所有的细胞悬液。细胞悬液收集后,1200rpm离心5min,去上清,用注射用生理盐水洗涤3次,每次洗涤步骤为用40ml 1
×
dpbs重悬细胞沉淀,1200rpm离心5min,去上清。再加入16ml注射用生理盐水重悬细胞,制备成制剂成品,regend001细胞自体回输制剂
42.实施例2 regend001细胞自体回输制剂的制备
43.本实施例提供了一种临床级自体支气管基底层细胞的制备工艺,具体包括如下步骤:
44.取离体活性支气管刷检组织备用,在本实施例中选择取位于支气管两个不同部位的组织。之所以选择两个或者多个部位,是为了保证分离的成功率。
45.取组织消化液和终止液备用;其中组织消化液中,99v%为dmem/f12,其余为1-20ng/ml的dna酶,0.1-4mg/ml蛋白酶xiv和10-200ng/ml胰酶;终止液中90v%为dmem,10v%为fbs。
46.利用组织消化液对上述刷检组织进行消化处理,利用终止液对经消化处理后的组织进行终止消化后收集细胞。经酶解后的细胞进行菌检和支原体检测后部分冻存。
47.取培养基备用,其中培养基中225ml dmem,225ml f12,20-70ml fbs,0.2-2mm l-glutamine,1-14ng/ml胰岛素,0.1-1ng/ml表皮生长因子,5-30ug/ml腺嘌呤,2-20ug/ml氢化可的松。
48.将已经辐照辐照灭活的滋养层细胞铺于t25细胞培养瓶中,放在细胞培养箱中培养(37℃,5%co2),1-2天后可使用,细胞的密度以1-2天后细胞铺展到培养瓶底表面的50-70%为宜。
49.取部分经消化处理后的细胞,每部位来源细胞重悬并铺于1个铺被滋养层细胞的t25培养瓶中,加入200ng/ml庆大霉素,在37℃,co2浓度为4%-8%条件下培养,隔天更换培
养基,待细胞呈克隆状生长至细胞聚集成团,细胞克隆长大至超过80%的克隆中有40-100个细胞,且随机观察的5个视野中有3个视野均有a级和b级克隆时,收集细胞进行冻存。
50.在产品制备安排确定后,取出冻存细胞,每个部位一管,在37℃水浴中快速溶解后,收集所有液体在15ml管中,并逐滴加入2ml已经在37℃温育过的复苏液,1200rpm离心5min,去上清后用培养基重悬细胞后,利用铺被滋养层细胞的t25细胞培养瓶对细胞进行培养。
51.待解冻细胞长满至细胞培养板表面积的50%-90%时,进行第一次传代培养。去细胞培养上清,1
×
dpbs洗涤一次,加入2ml重组胰酶37℃消化5-10min,待大部分细胞变圆变亮后,将贴壁细胞吹打下来并吹打成单细胞悬液,用等体积dmem培养基终止消化,收集细胞悬液,1200rpm离心5min去上清,并用培养基重悬细胞,最后按照5-10
×
103个细胞/cm2的密度铺于1个铺被滋养层细胞的t75细胞培养瓶进行培养,隔天换液。
52.待第一次传代细胞长满至培养瓶底表面积的50%-90%时,进行第二次传代培养。去培养上清,加入1
×
dpbs洗涤一次,加入5ml重组胰酶37℃消化5-10min,待大部分细胞变圆变亮后,将贴壁细胞吹打下来并吹打成单细胞悬液,用等体积dmem培养基终止消化,收集细胞悬液,1200rpm离心5min去上清,并用培养基重悬细胞。取2ml细胞培养上清和3-16
×
105个细胞进行菌检和支原体检测为阴性,生物学效应检测hopx阳性率≥30%、细胞鉴别为krt5阳性和细胞纯度分析结果为krt5细胞比例≥90%。同时重悬细胞按5-10
×
103个细胞/cm2的密度铺于铺被滋养层细胞的3个t75细胞培养瓶上进行培养,隔天换液。
53.待第二次传代细胞长满至培养瓶底表面积的50%-90%时,进行第三次传代培养。每瓶细胞去培养上清,加入1
×
dpbs洗涤一次,加入5ml重组胰酶37℃消化5-10min,待大部分细胞变圆变亮后,将贴壁细胞吹打下来并吹打成单细胞悬液,用等体积dmem培养基终止消化,收集细胞悬液,1200rpm离心5min去上清,并用培养基重悬细胞按5-10
×
103个细胞/cm2的密度铺于铺被滋养层细胞的10个t75细胞培养瓶上进行培养,隔天换液。
54.待第三次传代细胞长满至培养瓶底表面积的50%-90%时,进行第四次传代培养。每瓶细胞分别去培养上清,加入1
×
dpbs洗涤一次,加入5ml重组胰酶37℃消化5-10min,待大部分细胞变圆变亮后,将贴壁细胞吹打下来并吹打成单细胞悬液,用等体积dmem培养基终止消化,收集细胞悬液,1200rpm离心5min去上清,并用培养基重悬细胞。取1-10
×
105个细胞进行生物学效应检测hopx阳性率≥30%。同时重悬细胞按5-10
×
103个细胞/cm2的密度铺于铺被滋养层细胞的30个t75细胞培养瓶上进行培养,隔天换液。
55.待第四次传代培养细胞长满至培养瓶底表面积的50%-90%时,进行滋养层细胞去除。操作为每个培养瓶中去培养上清,加入1
×
dpbs洗涤一次,加入5ml重组胰酶,在37℃中放置1-2min,将滋养层细胞吹打下来,再用1
×
dpbs洗涤一次,加入5ml重组胰酶消化,待大部分细胞变圆变亮后,将贴壁细胞吹打下来并吹打成单细胞悬液,用等体积dmem培养基终止消化,收集细胞悬液,1200rpm离心5min去上清,并用培养基重悬细胞。取5-10
×
105个细胞进行细胞纯度分析结果为krt5细胞比例≥90%。最后将所有细胞铺于30个t75细胞培养瓶中进行培养。
56.待细胞培养瓶中细胞长满至培养皿表面积的85%-95%时,每个培养瓶中加入1
×
dpbs洗涤一次,加入5ml重组胰酶,在37℃中放置5-15min,待大部分细胞变圆变亮后,用1ml枪头轻轻将贴壁细胞吹打下来并吹打成单细胞悬液,用等体积dmem培养基终止消化,收集
guidelines for diagnosis and management.am j respir crit care med published online:mar 2011):ipf是一种原因不明的,局限于肺部的慢性进行性纤维化性间质性肺炎的一种特殊形式。其诊断标准为:1、排除其他间质性肺疾病(ild)(例如家庭或职业环境暴露相关ild,结缔组织疾病相关ild,药物毒性相关ild);2、hrct表现为uip;3、有肺组织标本的患者可以结合hrct和组织学特点进行诊断。(其中以上第2条和第3条满足其中一条即可)。特发性肺纤维化患者的肺换气功能(肺弥散功能)受损,一氧化碳弥散量dlco实测值占预计值的百分比低于80%。(临床肺弥散功能分级:正常:80%≤dlco占预计值%;轻度:60%≤dlco占预计值%《80%;中度:40%≤dlco占预计值%《60%;重度:dlco占预计值%《40%)
69.病例1:
70.男,66岁,身高172cm,体重83kg,反复咳嗽、咳痰伴气促,病程2年,临床诊断为特发性肺纤维化,中度弥散功能障碍,同时患有高血压病7年,2型糖尿病7年。
71.肺换气功能(dlco),前%预(即实测值占预计值百分比),基线期为50.0%,移植治疗后12周为60.7%,较基线改善21.4%;治疗后24周61.5%,较基线改善23.0%;治疗后弥散功能明显改善(见表1、图1)。
72.肺换气功能dlco实测值(ml
·
kpa-1
/s),基线期4.40,治疗后12周5.29,治疗后24周5.37,治疗后弥散功能明显改善(见图2)。
73.6分钟步行试验,基线330米,治疗后12周523米(较基线增加193米,增加58.48%),运动功能状态改善明显。
74.圣乔治呼吸问卷(sgrq),基线17.39,治疗后12周9.57(较基线下降7.82,44.97%),治疗对生活质量的影响改善明显。
75.病例2:
76.男,64岁,身高172cm,体重86kg,反复咳嗽、咳痰,临床诊断为特发性肺纤维化,重度弥散功能障碍,病程4年,同时患冠心病4年,高血压4年。
77.肺换气功能dlco,前%预(即实测值占预计值百分比),基线期23.1%,治疗后4周26%,治疗后12周28%,弥散功能较基线有明显改善(见表1和图3)。
78.肺换气功能dlco实测值(ml
·
kpa-1
/s),基线期2.04,治疗后4周2.25,治疗后12周2.34,弥散功能较基线有明显改善(见图4)。
79.尿常规、血生化治疗前后无异常或异常加剧变化。
80.病例3:
81.女,60岁,身高156cm,体重55kg,反复咳嗽、咳痰,病程8年余,临床诊断为特发性肺纤维化,病情较重,弥散功能未测出,同时合并桥本氏甲状腺炎。
82.dlco前%预(即实测值占预计值百分比),基线期未测出,治疗后4周该值为23.2%,治疗后12周该值为31%,弥散功能有明显改善(见表1和图5)。
83.dlco实测值(ml
·
kpa-1
/s),基线期未测出,治疗后4周1.64,治疗后12周2.19,弥散功能有明显改善(见图6)。
84.病例4:
85.男,56岁,身高162cm,体重68kg,胸闷气促伴咳嗽,病程2年,临床诊断为特发性肺纤维化,轻度弥散功能障碍,同时患肺气肿,高血压病史5年,肾功能。
86.dlco前%预(即实测值占预计值百分比),基线期该值为61.1%,治疗后4周该值为57.7%,治疗后12周该值为57.5%,治疗后24周该值为57.0%,治疗前后弥散功能稳定(见表1和图7)。
87.dlco实测值(ml
·
kpa-1
/s),基线期5.06,治疗后4周4.78,治疗后12周4.76,治疗后24周4.68,弥散功能稳定(见图8)。
88.6分钟步行试验,基线期(即给药前)510米,治疗后4周520米,治疗后12周490米,治疗后24周492米,治疗前后运动功能状态稳定。
89.圣乔治呼吸问卷(sgrq),筛选期60.13,基线65.13,治疗后4周60.77,治疗后12周66.11,疾病对生活质量的影响尚可。
90.表1上述所有4名ipf患者一氧化碳弥散量(dlco)实测值占预计值的百分比(%)
[0091][0092]
*受试者肺功能极差以至于无法测出数值
[0093]
**与基线期相比+/-10%以内的数值变化在临床上一般无意义,可能为仪器测量误差等造成,视为稳定;超过10%的提升在临床上有意义,视为改善。
[0094]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1