奥替溴铵在抗肿瘤中的应用
1.本发明涉及医药技术领域,具体地,涉及奥替溴铵在抗肿瘤中的应用。
背景技术:
2.二十世纪以来,人类的生活环境不断恶化,生活环境污染日趋加剧,人们与致癌因素的接触越来越紧密,恶性肿瘤的发病率也逐年递增,恶性肿瘤已经超过心脑血管疾病成为人类健康的最大敌人。根据世界卫生组织的实况报道,肿瘤即癌症是世界的第二大死因,2012年有1400万人被诊断为癌症。据估计,到2023年,全球每年新增患癌病例将增至2200万,到2035年将增至2400万,即未来20年,癌症病例将增加五成。报告数据显示,我国癌症新增病例和死亡病例位居全球之冠。因此,本领域迫切需要开发有效的抗肿瘤药物。
3.而去泛素化水解酶usp28具有重要的生物学功能,参与多种肿瘤相关信号通路的调控。通过靶向抑制usp28,将会是一种有效的抑制肿瘤细胞增殖的思路。
4.奥替溴铵在临床上通常被应用为解痉药,可以缓解腹部疼痛、胀气与肠易激综合征的复发。该药物是乙酰胆碱受体抑制剂,可以抑制细胞内乙酰胆碱诱导的ca
2+
信号。然而,目前尚未有文献报道奥替溴铵对去泛素化酶usp28的酶活抑制作用和对肿瘤细胞的增殖抑制作用。
技术实现要素:
5.本发明的目的是提供奥替溴铵在抗肿瘤方面的新应用。具体地,本发明揭示了奥替溴铵通过抑制usp28的活性,下调肿瘤细胞内usp28底物蛋白c-myc的水平,从而抑制肿瘤细胞增殖生长,具有有效的抗肿瘤作用。
6.在本发明的第一方面,提供了一种式(ⅰ)所示化合物或其药学上可接受的盐,或含所述化合物的制剂的用途,用于制备
7.a)抑制usp28酶活性的药物;
8.b)抑制肿瘤细胞增殖的药物;
9.c)治疗、缓解、预防由肿瘤引起的相关疾病的药物。
[0010][0011]
在另一优选例中,所述肿瘤为在usp28高表达相关的肿瘤。
[0012]
在另一优选例中,所述肿瘤选自:直肠癌、乳腺癌、非小细胞肺癌和神经胶质瘤、或其组合。
[0013]
在另一优选例中,所述制剂为口服的或者非口服的。
[0014]
在另一优选例中,所述的制剂包括:粉剂、颗粒剂、胶囊剂、注射剂、酊剂、口服液、片剂、含片、或滴丸。
[0015]
在另一优选例中,所述制剂进一步包含:
[0016]
选自下组的抗肿瘤药物:卡培他滨、伊立替康、奥沙利铂、曲氟尿苷复方片、康奈非尼、瑞戈非尼、哌柏西利或替莫唑胺。
[0017]
在本发明的第二方面,提供了一种药物组合物,所述药物组合物含有:
[0018]
i)式i所示的化合物或其药学上可接受的盐、或其前药;
[0019]
ii)其他抗肿瘤药物,可以包括(但不限于)卡培他滨、伊立替康、奥沙利铂、曲氟尿苷复方片、贝伐株单抗、西妥昔单抗、帕尼单抗、康奈非
[0020]
尼、瑞戈非尼、哌柏西利、替莫唑胺和阿特珠单抗;
[0021]
iii)药学上可接受的载体。
[0022]
在另一优选例中,所述药物组合物为注射剂、片剂、胶囊剂、丸剂、悬浮剂或乳剂。
[0023]
在另一优选例中,所述药物组合物为口服剂型、经皮剂型、静脉或肌肉注射剂型。
[0024]
在本发明的第三方面,提供了一种第二方面所述的药物组合物的用途,所述药物用于制备:
[0025]
a)抑制usp28酶活性的药物;
[0026]
b)抑制肿瘤细胞增殖的药物;
[0027]
c)治疗、缓解、预防由肿瘤引起的相关疾病的药物。
[0028]
在本发明的第四方面,提供了一种抑制usp28酶活性的方法,包括步骤将足够量的式i化合物或其药学上可接受的盐或第二方面所述的药物组合物和细胞充分接触,从而抑制usp28酶的活性。
[0029]
在另一优选例中,所述细胞为usp28高表达的细胞。
[0030]
在本发明的第五方面,提供了一种抑制肿瘤细胞增殖的方法,包括步骤:
[0031]
1)给有需要的对象施用医学有效量的式i化合物或其药学上可接受的盐或如权里要求5所述的药物组合物;
[0032]
2)抑制肿瘤细胞的usp28酶的活性,从而抑制肿瘤细胞的增殖。
[0033]
在另一优选例中,所述方法为非诊断性的非治疗性的。
[0034]
在另一优选例中,所述方法为体外的。
[0035]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0036]
图1.奥替溴铵抑制usp28的去泛素水解活性。
[0037]
图2.奥替溴铵抑制a549、mcf7、u87、ls174t与hct116细胞的增殖生长。
[0038]
图3.奥替溴铵降低hct116和ls174t细胞中c-myc蛋白的稳定性。
具体实施方式
[0039]
本发明人经过广泛而深入的研究,首次意外发现奥替溴铵具有抑制肿瘤增殖的作
用,在此基础上完成了本发明。
[0040]
具体地,本发明研究表明奥替溴铵通过抑制去泛素化水解酶usp28的活性,从而下调usp28底物蛋白c-myc水平,达到抑制肿瘤增殖的效果。
[0041]
术语
[0042]
活性成分
[0043]
如本文所用,术语“本发明化合物”指式(ⅰ)所示的化合物。该术语还包括及式(ⅰ)化合物的及其各种药学上可接受的盐。
[0044]
如本文所用,术语“药学上可接受的盐”指本发明化合物与酸或碱所形成的适合用作药物的盐。药学上可接受的盐包括无机盐和有机盐。一类优选的盐是本发明化合物与酸形成的盐。适合形成盐的酸包括但并不限于:盐酸、氢溴酸、氢氟酸、硫酸、硝酸、磷酸等无机酸,甲酸、乙酸、丙酸、草酸、丙二酸、琥珀酸、富马酸、马来酸、乳酸、苹果酸、酒石酸、柠檬酸、苦味酸、甲磺酸、苯甲磺酸,苯磺酸等有机酸;以及天冬氨酸、谷氨酸等酸性氨基酸。一类优选的盐是本发明化合物与碱形成的盐。适合形成盐的碱包括但并不限于:氢氧化钠、氢氧化钾、碳酸钠、碳酸氢钠、磷酸钠等无机碱,氨水、三乙胺、二乙胺等有机碱。这些盐可通过已知的成盐方法由式(ⅰ)的化合物制备。
[0045]
药物组合物和施用方法
[0046]
由于本发明化合物具有显著的usp28酶活抑制作用并且抑制肿瘤细胞的增殖生长,因此,本发明化合物及其药学上可接受的无机或有机盐,以及含有本发明化合物为主要活性成分的药物组合物可用于治疗usp28高表达相关的肿瘤。本发明的药物组合物包含安全有效量范围内的本发明化合物或其药学上可接受的盐及药学上可以接受的赋形剂或载体。其中“安全有效量”指的是:化合物的量足以明显改善病情,而不至于产生严重的副作用。通常,药物组合物含有1-2000mg本发明化合物/剂,更佳地,含有5-100mg本发明化合物/剂。较佳地,所述的“一剂”为一个胶囊或药片。
[0047]“药学上可以接受的载体”指的是:一种或多种相容性固体或液体填料或凝胶物质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。“相容性”在此指的是组合物中各组份能和本发明的化合物以及它们之间相互掺和,而不明显降低化合物的药效。药学上可以接受的载体部分例子有纤维素及其衍生物(如羧甲基纤维素钠、乙基纤维素钠、纤维素乙酸酯等)、明胶、滑石、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂(如吐温)、润湿剂(如十二烷基硫酸钠)、着色剂、调味剂、稳定剂、抗氧化剂、防腐剂、无热原水等。
[0048]
本发明化合物或药物组合物的施用方式没有特别限制,代表性的施用方式包括(但并不限于):口服、肠胃外(静脉内、肌肉内或皮下)。
[0049]
用于口服给药的固体剂型包括胶囊剂、片剂、丸剂、散剂和颗粒剂。在这些固体剂型中,活性化合物与至少一种常规惰性赋形剂(或载体)混合,如柠檬酸钠或磷酸二钙,或与下述成分混合:(a)填料或增容剂,例如,淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;(b)粘合剂,例如,羟甲基纤维素、藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和阿拉伯胶;(c)保湿剂,例如,甘油;(d)崩解剂,例如,琼脂、碳酸钙、马铃薯淀粉或木薯淀粉、藻酸、某些复合硅酸盐、和碳酸钠;(e)缓溶剂,例如石蜡;(f)吸收加速剂,例如,季胺化合物;(g)润湿剂,例如鲸蜡醇和单硬脂酸甘油酯;(h)吸附剂,例如,高岭土;和(i)润滑剂,例如,滑石、硬脂酸钙、硬脂
酸镁、固体聚乙二醇、十二烷基硫酸钠,或其混合物。胶囊剂、片剂和丸剂中,剂型也可包含缓冲剂。
[0050]
固体剂型如片剂、糖丸、胶囊剂、丸剂和颗粒剂可采用包衣和壳材制备,如肠衣和其它本领域公知的材料。它们可包含不透明剂,并且,这种组合物中活性化合物或化合物的释放可以延迟的方式在消化道内的某一部分中释放。可采用的包埋组分的实例是聚合物质和蜡类物质。必要时,活性化合物也可与上述赋形剂中的一种或多种形成微胶囊形式。
[0051]
用于口服给药的液体剂型包括药学上可接受的乳液、溶液、悬浮液、糖浆或酊剂。除了活性化合物外,液体剂型可包含本领域中常规采用的惰性稀释剂,如水或其它溶剂,增溶剂和乳化剂,例知,乙醇、异丙醇、碳酸乙酯、乙酸乙酯、丙二醇、1,3-丁二醇、二甲基甲酰胺以及油,特别是棉籽油、花生油、玉米胚油、橄榄油、蓖麻油和芝麻油或这些物质的混合物等。
[0052]
除了这些惰性稀释剂外,组合物也可包含助剂,如润湿剂、乳化剂和悬浮剂、甜味剂、矫味剂和香料。
[0053]
除了活性化合物外,悬浮液可包含悬浮剂,例如,乙氧基化异十八烷醇、聚氧乙烯山梨醇和脱水山梨醇酯、微晶纤维素、甲醇铝和琼脂或这些物质的混合物等。
[0054]
用于肠胃外注射的组合物可包含生理上可接受的无菌含水或无水溶液、分散液、悬浮液或乳液,和用于重新溶解成无菌的可注射溶液或分散液的无菌粉末。适宜的含水和非水载体、稀释剂、溶剂或赋形剂包括水、乙醇、多元醇及其适宜的混合物。
[0055]
本发明化合物可以单独给药,或者与其他药学上可接受的化合物联合给药。
[0056]
使用药物组合物时,是将安全有效量的本发明化合物适用于需要治疗的哺乳动物(如人),其中施用时剂量为药学上认为的有效给药剂量,对于60kg体重的人而言,日给药剂量通常为1~2000mg,优选5~100mg。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
[0057]
去泛素化水解酶usp28
[0058]
去泛素化水解酶usp28具有重要的生物学功能,参与多种肿瘤相关信号通路的调控。usp28是第一个被发现可以拮抗泛素连接酶fbw7功能的去泛素化酶
[4]
。细胞中usp28过量表达将拮抗fbw7对c-myc与cyclin e1的泛素化修饰,敲除肿瘤细胞中的usp28,c-myc蛋白水平随之下降,因此,usp28促进c-myc介导的肿瘤细胞增殖。除此之外,其他一些非fbw7相关的蛋白的稳定性也受到usp28的调控。usp28可提高lsd1的细胞内稳定性,lsd1通过参与h3k4me1/2的去甲基化过程而调控细胞的多能性与分化,lsd1过表达与多种肿瘤的形成有关。usp28通过去除lsd1的泛素化修饰而使其逃离被蛋白酶体降解的命运,并因此提高lsd1的细胞内稳定性,并使得乳腺癌细胞具有干细胞的多能性
[5]
。除了调控上述原癌蛋白的稳定性,usp28同时也参与对其他肿瘤形成相关信号通路蛋白的调控。一项新的研究结果表明,usp28通过拮抗gsk-3β和fbw7对hif-1α的泛素化修饰而使hif-1α逃离被降解的命运。gsk-3β/fbw7/usp28对hif-1α的调控影响细胞的增殖、分化以及凋亡
[6]
。usp28和多种肿瘤特别是结直肠癌的发生、发展密切相关:研究发现usp28具有维持肠道稳态、促进结直肠癌形成的作用。对结直肠癌病人的癌细胞样本进行分析后发现,细胞内usp28、c-myc、nicd1与c-jun的水平与正常个体结肠细胞相比有显著升高
[7]
。此外,对膀胱癌、非小细胞肺癌、神经胶质瘤的研究同样显示在这些癌细胞中均有usp28表达上调的现象
[8-10]
。因此,usp28已成
为癌症治疗的潜在新靶标。
[0059]
本发明的主要优点包括:
[0060]
(1)本发明首次揭示了奥替溴铵具有去泛素化水解酶usp28抑制作用,并且可以显著抑制a549、mcf7、u87、ls174t与hct116细胞的增殖生长。奥替溴铵为靶向去泛素化酶usp28的药物研发提供了化合物结构骨架参考。
[0061]
(2)奥替溴铵是已上市的药物,具有较好的抗肿瘤药物成药前景。
[0062]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
[0063]
实施例1奥替溴铵抑制usp28的酶活性的测试方法及结果
[0064]
本实施例采用ub-amc水解抑制实验检测奥替溴铵对usp28的酶活性抑制效果,具体实验方法与步骤如下:
[0065]
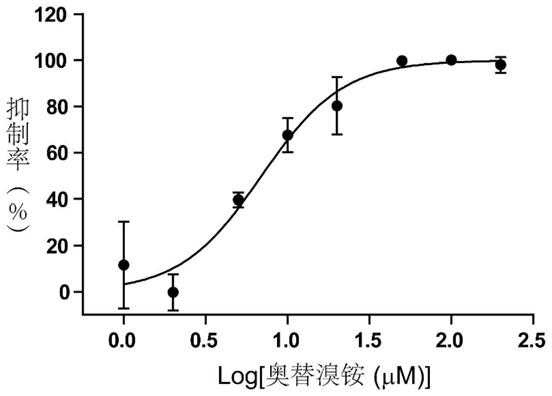
该实验主要分为2个体系,即对照组与实验组。对照组:实验反应总体系共200μl,usp28的终浓度为20nm,ub-amc的终浓度为250nm,dmso的含量为2%。实验组:实验反应总体系为200μl,usp28的终浓度为20nm,ub-amc的终浓度为250nm,奥替溴铵的终浓度设置为1,2,5,10,20,50,100和200μm,dmso的含量为2%。将每组实验样品依次加入黑色微孔板(96孔板),实验过程中spectramax m5酶标仪的激发光设置为380nm,发射光设置为460nm,反应温度设置为37℃,反应时间为10min。根据酶催化反应速率值计算出不同浓度的奥替溴铵对去泛素化酶usp28的酶活性抑制百分比。利用graphpad prism 5软件将奥替溴铵浓度与酶活性抑制百分比进行非线性拟合,计算奥替溴铵对usp28的酶活性抑制ic
50
值。
[0066]
测试结果如图1所示:奥替溴铵显著抑制usp28催化水解ub-amc的酶活性,其ic
50
值为6.90
±
0.90μm,n=3。
[0067]
实施例2奥替溴铵对肿瘤细胞增殖生长的抑制效果测试方法及结果
[0068]
本实施例采用srb法测定奥替溴铵对肿瘤细胞的增殖生长抑制效果,具体实验方法与步骤如下:
[0069]
(1)将状态良好且处于生长对数期的a549、mcf7、u87、ls174t与hct116细胞分别用胰酶消化,计数。用培养基稀释到一定浓度,混匀,用排枪分别将细胞接种到96孔板中心的60个孔中,每孔加入细胞悬液180μl,每孔细胞数5000-6000个。细胞铺板结束后,在96孔板外围的一圈孔内加入200μl已灭菌pbs溶液,将细胞置于37℃,5%co2培养箱中过夜培养;
[0070]
(2)96孔板中的细胞经过夜贴壁生长后,每孔加入相应浓度的奥替溴铵,以0.5%dmso作为对照。在a549与hct116细胞实验中,奥替溴铵的终浓度设置为1,5,10,15,20,25,30,50和80μm,dmso含量为0.5%。在mcf7细胞实验中,奥替溴铵的终浓度设置为1,3,6,10,15,20,25,30和60μm,dmso含量为0.5%。在u87细胞实验中,奥替溴铵的终浓度设置为0.5,1,3,6,10,15,30,60和100μm,dmso含量为0.5%。在ls174t细胞实验中,奥替溴铵的终浓度设置为2,5,10,15,20,25,30,60和100μm,dmso含量为0.5%。每个浓度条件设置3个复孔。将细胞置于37℃,5%co2培养箱中培养72h;
[0071]
(3)细胞培养72h后,每孔分别加入50μl 50%三氯乙酸(wt/vol)。在4℃条件下固
定细胞约1h。细胞固定完成后,倒去96孔板中液体,并用自来水缓慢冲洗孔内,将96孔板置于烘箱中烘干;
[0072]
(4)每孔加入100μl srb染料(4mg/ml),染色15min,用1%冰乙酸冲洗未结合的染料,将96孔板置于烘箱中烘干;
[0073]
(5)每孔加入150μl 10mm tris溶液,将96孔板置于摇床上缓慢晃动,使srb染料充分溶解并混匀。随后将96孔板置于spectramax m5酶标仪中读取od
510
吸光值。根据吸光值分别计算出不同浓度的奥替溴铵对以上5种肿瘤细胞的增殖抑制百分比。利用graphpad prism 5软件将奥替溴铵浓度与增殖抑制百分比进行非线性拟合,计算奥替溴铵对以上5种肿瘤细胞的增殖抑制ic
50
值。
[0074]
测试结果如图2所示:奥替溴铵显著抑制a549、mcf7、u87、ls174t与hct116细胞的增殖生长,奥替溴铵对以上5种肿瘤细胞的增殖抑制ic
50
值分别为17.60
±
0.26μm,9.19
±
0.84μm,26.30
±
1.33μm,18.60
±
0.42μm与13.20
±
0.49μm,n=3。
[0075]
实施例3奥替溴铵降低hct116和ls174t细胞中usp28底物蛋白c-myc稳定性的检测方法及结果
[0076]
本实施例采用免疫印迹法检测奥替溴铵对hct116和ls174t细胞中c-myc蛋白稳定性的影响。
[0077]
本实施例中所使用的抗体信息如下所示:
[0078]
anti-usp28(abcam,ab126604,1:1000),anti-c-myc(abcam,ab32072,1:1000),anti-gapdh(cell signaling technology,#2118,1:1000)。
[0079]
以上三种一抗均是兔源抗体,本实施例中所使用的二抗anti-rabbit购于absin公司,按1:4000的稀释比例配置使用。
[0080]
具体实验方法与步骤如下:
[0081]
3.1奥替溴铵对肿瘤细胞中c-myc蛋白水平的影响:
[0082]
(1)将状态良好且处于生长对数期的ls174t与hct116细胞分别用胰酶消化,计数。将细胞悬液混匀,接种到6孔板中,每孔细胞数80-90万个。将细胞置于37℃,5%co2培养箱中培养;
[0083]
(2)待细胞密度生长至约90%,吸去培养基,使用pbs缓冲液清洗细胞,随后加入含奥替溴铵的培养基,奥替溴铵终浓度设置为10,30,50,80和100μm,并同时设置0.5%dmso为对照组,加药处理2h;
[0084]
(3)经药物处理后,从培养箱中取出细胞,用pbs缓冲液清洗两次,将细胞置于冰上并加入适量ripa(radio immunoprecipitation assay)裂解液,将细胞裂解产物收集至1.5ml ep管中,12000rpm,4℃,离心10min,吸取细胞裂解液上清,用bradford试剂盒测定细胞裂解液总蛋白浓度,并用ripa裂解液将所有样品的总蛋白浓度调为一致,加入相应体积5
×
loading上样缓冲液,随后将样品在100℃条件下煮沸10min。制备好的样品用于开展后续的蛋白质免疫印迹实验。
[0085]
3.2奥替溴铵对肿瘤细胞中c-myc蛋白的泛素蛋白酶体降解途径的影响:
[0086]
为了证明奥替溴铵对肿瘤细胞中c-myc蛋白水平的下调作用是通过促进c-myc的泛素蛋白酶体降解过程而实现的,我们使用了蛋白酶体抑制剂mg132处理肿瘤细胞。
[0087]
(1)将状态良好且处于生长对数期的ls174t与hct116细胞分别用胰酶消化,计数。
将细胞悬液混匀,接种到6孔板中,每孔细胞数80-90万个。将细胞置于37℃,5%co2培养箱中培养。
[0088]
(2)待细胞密度生长至约90%,吸去培养基,使用pbs缓冲液清洗细胞,随后分别加入含有不同实验体系组分的培养基。在不含mg132的实验体系中,对照组仅含0.5%dmso,实验组仅含奥替溴铵,在hct116细胞实验中,奥替溴铵终浓度设置为25μm,在ls174t细胞实验中,奥替溴铵终浓度设置为40μm;在含mg132的实验体系中,对照组仅含10μm mg132(0.5%dmso),实验组含奥替溴铵和10μm mg132(0.5%dmso),在hct116细胞实验中,奥替溴铵终浓度设置为25μm,在ls174t细胞实验中,奥替溴铵终浓度设置为40μm。
[0089]
(3)经药物处理3h后,从培养箱中取出细胞,用pbs缓冲液清洗两次,将细胞置于冰上并加入适量ripa裂解液,将细胞裂解产物收集至1.5ml ep管中,12000rpm,4℃,离心10min,吸取细胞裂解液上清,用bradford试剂盒测定细胞裂解液总蛋白浓度,并用ripa裂解液将所有样品的总蛋白浓度调为一致,加入相应体积5
×
loading上样缓冲液,随后将样品在100℃条件下煮沸10min。制备好的样品用于开展后续的蛋白质免疫印迹实验。
[0090]
3.3蛋白质免疫印迹实验:
[0091]
(1)sds-page
[0092]
将制备好的样品离心后,用移液枪将样品加入各孔道,每块胶设2个marker孔道,每孔道加入2μl蛋白marker,剩余体积用上样缓冲液补齐。加样完成后,加盖电极盖,先以60v积层低电压使样品在层积胶中浓缩成线,再以120v分离电压较快分离样品,待溴酚蓝移动至分离胶底部时,结束电泳;
[0093]
(2)转膜
[0094]
在进行sds-page时可将pvdf膜浸入甲醇中活化,活化完成后将pvdf膜放入转膜液中稳定10min,以便后续实验使用。装配转膜三明治:将黑白夹的黑面置于底部,从负极到正极按照海绵片-滤纸-胶-pvdf膜-滤纸-海绵片的顺序制备三明治夹。为了避免影响实验结果,整个三明治夹制备过程在转膜液中进行,并需避免气泡产生。将装配置于转膜槽中,加入低温保存的转膜液和冰盒,防止转膜过程温度过高,恒流0.25a转膜3h。转膜完成后,关闭电源,取出pvdf膜,以marker条带位置作为蛋白分子量参考,剪裁目的蛋白条带,并写好标记,将pvdf膜放入孵育盒中;
[0095]
(3)抗体孵育与显影
[0096]
将含有目的蛋白条带的pvdf膜用tbst缓冲液清洗后,放入含5%脱脂牛奶的tbst缓冲液中封闭1h。倒去牛奶,加入适量tbst缓冲液清洗3次,每次在侧摆摇床上晃动洗涤10min。用一抗稀释液将一抗按照说明书中的稀释比例进行稀释。将清洗干净的pvdf膜加入相应的一抗,4℃摇晃孵育过夜。吸去一抗,加入适量的tbst缓冲液清洗3次,每次洗涤10min,去除非特异性结合的抗体。用含5%脱脂牛奶的tbst缓冲液配制二抗。根据一抗的种属来源选择相应的二抗并与pvdf膜室温孵育1.5h。吸去二抗,加入适量的tbst缓冲液清洗3次,每次洗涤10min,去除非特异性结合的抗体。将显影液a与显影液b等比例混合混匀后,缓慢匀速滴在pvdf膜上,匀速缓慢晃动载物板,使条带上的显影液分布均匀,利用凝胶成像拍照系统拍照获得免疫印迹结果照片。
[0097]
3.4实验结果
[0098]
实验结果如图3所示:奥替溴铵降低hct116和ls174t细胞中c-myc蛋白的稳定性。
图3a显示奥替溴铵下调细胞内usp28底物蛋白c-myc的水平:随着加入奥替溴铵的浓度逐渐升高,细胞内的c-myc蛋白水平逐渐降低,且降低程度呈现出对奥替溴铵浓度的依赖性。图3b显示奥替溴铵对hct116和ls174t细胞中c-myc蛋白水平的下调作用依赖于泛素蛋白酶体降解途径,由此表明:c-myc蛋白水平的下调是usp28活性受到奥替溴铵抑制所导致的。在细胞培养过程中加入mg132后,未使用和使用奥替溴铵处理的细胞中c-myc蛋白水平相当。
[0099]
实验结果显示奥替溴铵显著下调hct116和ls174t细胞中的c-myc蛋白水平,并且奥替溴铵对c-myc蛋白含量的下调作用是通过促进其经由泛素蛋白酶体途径的降解过程而实现的。因此,本发明化合物有望开发成为靶向去泛素化酶usp28的抗肿瘤先导化合物或药物。
[0100]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1