一种含有氨苯砜类化合物的经皮给药组合物及其制备方法与流程
1.本发明属于经皮给药药物技术领域,特别涉及一种含有氨苯砜类化合物的经皮给药组合物及其制备方法。
背景技术:
2.痤疮是一种常见的皮肤病,多发生于青春期。所述痤疮可被细菌污染,如痤疮丙酸杆菌(propionibacterium acnes),并且还可以炎症为特征。痤疮倾向于发生在皮脂腺(sebaceous gland)最活跃的皮肤区域,如面部。痤疮与心理创伤相关,并且如果不经治疗,会导致疤痕形成和毁容,并可以引起相关的皮肤疾病,例如:毛囊炎、口周皮炎、光损伤、皮肤老化、牛皮癣、特应性皮炎、角化病、疤痕(包括手术疤痕和痤疮疤痕)、皮脂囊肿、炎性皮肤病、炎症后色素沉着过度,等。痤疮发生的因素多种多样,但最直接的因素是毛孔堵塞。由于毛囊口被堵塞,毛囊管腔狭窄,形成缺氧状态,使毛囊内的厌氧菌大量增生,导致微生物失衡,人体启动炎症介质,粉刺变红,形成痤疮。
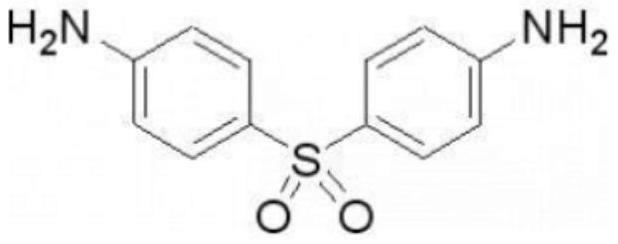
3.氨苯砜(4,4'-二氨基二苯砜,dapsone)曾是治疗麻风病和疤疹皮炎的经典药物,近年发现氨苯砜对于痤疮棒状杆菌具有抑菌作用,还具有免疫抑制作用。氨苯砜及其衍生物还有效用于治疗细菌感染,原生动物感染如疟疾、卡氏肺囊虫(pneumocystis carinii),以及胞质基因(plasmonic)感染如弓形体病。
[0004][0005]
氨苯砜还适用作抗炎剂。它已用于治疗以中性粒细胞的异常浸润为特征的皮肤疾病,如疱疹样皮炎、线状iga皮肤病、脓疱性牛皮癣、坏疽性脓皮病、寻常痤疮和斯威特氏综合征(sweet's syndrome)。但容易引起全身毒副作用。患者可产生不良反应包括:轻度不适,如恶心、上腹不适、纳差、头痛、头晕、失眠、无力等。贫血,可由于溶血、缺铁或营养不良所致,一般见于治疗初期。亦可有粒细胞缺乏、白细胞减少等血液系统反应。药疹,严重者表现为剥脱性皮炎,如有发热、淋巴结肿大、肝、肾功能损害和单核细胞增多,称为“氨苯砜综合征”。急性中毒,一次服用大剂量本品可使血红蛋白转为高铁血红蛋白,造成组织缺氧、紫绀、中毒性肝炎、肾炎和神经精神等损害,如未及时治疗可致死亡。
[0006]
经皮给药系统(transdermal delivery system,tds)是指通过皮肤表面给药,以达到局部或全身治疗作用的一种给药途径。用于局部治疗的经皮给药制剂,可控制药物经皮渗透的速度和程度,使其给药后能迅速、特定的递送至浅表感染部位发挥疗效,具有一定的靶向意义;同时由于药物靶向富集于皮层,从而避免药物透过皮层后进一步通过毛细血管迅速吸收进入全身循环,降低了由全身吸收所引起的毒副作用与不良反应,提高了用药的安全、有效和临床顺应性。因此,此类经皮给药制剂对浅部皮肤疾病的治疗具有极大的临床应用优势与前景。
[0007]
目前有多项研究或产品涉及氨苯砜的皮肤外用制剂,用于局部治疗痤疮。例如,发
明专利1(申请号2016108453526)公开了一种含氨苯砜的凝胶制剂及其制备方法,发明专利2(申请号2008101388413)公开了一种氨苯砜的脂质体,由氨苯砜、磷脂、亲脂性添加剂组成。发明专利3(申请号2011103242193)提供了一种质量稳定的氨苯砜凝胶及其制备方法,其特征是该氨苯砜凝胶含有2%~8%(w/w)的增溶剂。该发明的氨苯砜凝胶使用时无沙粒感,患者顺应性良好。发明专利4(申请号028287479)发明专利提供了一种通过局部应用含有氨苯砜的皮肤病学组合物治疗痤疮的方法。除了炎性病变外,该组合物也可以治疗非炎性痤疮。论文《氨苯砜包合物凝胶剂的研究》提出采用倍他环糊精为主要辅料制备成具有缓释作用的氨苯砜包合物凝胶剂。
[0008]
但现有技术或上市药物在使用中存在下列问题与不足:一、氨苯砜药物递送靶向性不佳。现有技术在临床使用过程中,患病皮肤表面涂敷药物制剂后,部分氨苯砜分布于皮层,但仍有较多的药物渗入皮下组织,不利于药物集中靶向于皮肤病变部位发挥药效,同时,透过皮层的药物可进一步通过毛细血管吸收迅速进入全身循环,由于氨苯砜有较严重的血液系统、胃肠系统及神经毒性等全身不良反应,从而产生由全身吸收所引起的不良反应和毒副作用,不仅影响了氨苯砜外用制剂治疗效果,而且存在较大安全性风险;二、制剂质量不稳定。经长期贮存后,凝胶中氨苯砜发生集聚,导致产品粒径不断变大,而凝胶的粒径又直接影响到产品的质量,其粒径不符合《中国药典》的规定(≤180μm),同时凝胶涂抹于患处会产生明显沙粒感,产生不适感觉;三、局部不良反应多。患者临床应用凝胶剂后出现与药物相关的副作用较多,表现为瘙痒、烧灼感、刺激和过敏性皮炎、毛囊炎、红斑、丘疹、皴裂、软化、潮红、刺痛和节结等不良反应。以上问题不仅影响了药品质量,而且影响了患者用药顺应性,不利于药品持续应用。从保证药品质量、改善患者顺应性、降低药物毒副作用的角度,需要提供一种患者药物传递更加高效、质量更为稳定、顺应性更好的氨苯砜局部外用制剂技术。
技术实现要素:
[0009]
发明目的:针对上述技术问题,本发明的目的是提供一种氨苯砜类化合物的组合物,该组合物适于外用局部给药,具有皮肤靶向递送效率高,稳定性好,皮肤刺激性小的优点,最为突出的是其在皮肤结构中有较好的靶向性滞留的特点,透过皮层的药物量显著减少,使得药物通过毛细血管吸收迅速进入全身循环的比率降低,从而减弱了由全身吸收药物所引起的不良反应,提高氨苯砜类化合物的治疗效果,改善药物制剂的质量和稳定性。
[0010]
技术方案:为达到上述发明目的,本发明采用以下技术方案:
[0011]
一种含有氨苯砜类化合物的经皮给药组合物,所述组合物的原料包括氨苯砜类化合物和环糊精。
[0012]
优选,所述的经皮给药组合物中,所述氨苯砜类化合物和环糊精的用量按重量份数计如下:
[0013]
氨苯砜类化合物1~10份;
[0014]
环糊精5~30份,优选5~25份,更优选8~15份。
[0015]
优选,所述组合物的原料包括氨苯砜类化合物、环糊精和二乙二醇单乙基醚(又称卡必醇,c6h
14
o3,cas:111-90-0)。
[0016]
进一步优选:所述的经皮给药组合物中,所述氨苯砜类化合物、环糊精和二乙二醇
单乙基醚的用量按重量份数计如下:
[0017]
氨苯砜类化合物1~10份;
[0018]
环糊精5~28份,优选5~20份,更优选8~15份;
[0019]
二乙二醇单乙基醚3~20份,优选3~15份,更优选5~12份。
[0020]
优选,所述氨苯砜类化合物选自氨苯砜(dapsone,c
12
h
12
n2o2s,cas no:80-08-0)或氨苯砜的类似物(相似化学结构和类似治疗作用的化合物),如阿达帕林(adapalene,c
28
h
28
o3,cas no:106685-40-9)、过氧苯甲酰(benzoyl peroxide,c
14
h
10
o4,cas no:94-36-0)等。
[0021]
优选,所述环糊精选自羟丙基-β-环糊精(hp-β-cd)、磺丁基-β-环糊精(sbe-β-cd)、甲基-β-环糊精(me-β-cd)、γ-环糊精(γ-cd)中的一种或多种,优选羟丙基-β-环糊精、磺丁基-β-环糊精、甲基-β-环糊精中的一种或几种的混合物。
[0022]
优选,所述组合物的原料还包括药学上可接受的辅料和/或基质。
[0023]
进一步优选,所述药学上可接受的辅料选自促渗剂、稳定剂、保湿剂、防腐剂、乳化剂、增稠剂、赋形剂、抑菌剂、ph调节剂中的一种或几种;例如:peg-400、甘油、甘油聚甲基丙烯酸酯、丁二醇、尼泊金乙酯、三乙酸甘油酯、三乙醇胺、氢氧化钠、乙二胺四乙酸、乙二胺四乙酸二钠、焦亚硫酸钠、抗坏血酸、pvp
k30
、十二烷基硫酸钠、丁基羟基茴香醚(bha)、泊洛沙姆、卡波姆、羟丙基甲基纤维素、海藻酸钠、壳聚糖,甲基纤维素、羟丙基纤维素、羟乙基纤维素等。
[0024]
所述的保湿剂或增稠剂选自peg-400、甘油、丁二醇、丙二醇、甘油聚甲基丙烯酸酯、三乙酸甘油酯,优选其中的一种或它们的混合物。
[0025]
所述的防腐剂或抑菌剂选自尼泊金乙酯、尼泊金甲酯、丁二醇的一种或它们的混合物;优选其中的一种或它们的混合物。
[0026]
所述的稳定剂选自乙二胺四乙酸、乙二胺四乙酸二钠、焦亚硫酸钠、抗坏血酸、丁基羟基茴香醚(bha)、pvp-k30、十二烷基硫酸钠、泊洛沙姆、卡波姆、羟丙基甲基纤维素、海藻酸钠、壳聚糖,甲基纤维素、羟丙基纤维素、羟乙基纤维素的一种或它们的混合物。
[0027]
所述的ph调节剂选自氢氧化钠、三乙醇胺中的一种或它们的混合物。
[0028]
进一步优选,所述基质选自乳剂基质、凝胶基质、油相基质、膜剂基质、喷雾剂基质、膏剂基质、喷雾剂基质、卡波姆、hpmc、泊洛沙姆中的一种或几种的混合物。
[0029]
优选,所述组合物的剂型包括凝胶剂、乳剂、洗剂、霜剂、溶液剂、喷雾剂、膜剂或膏剂。例如,所述组合物的剂型选自药物溶液凝胶剂、药物微米混悬凝胶剂或药物纳米混悬凝胶剂。
[0030]
进一步优选,所述药物微米混悬凝胶剂中,氨苯砜类化合物的平均粒径为2.6μm~55.8μm;所述药物纳米混悬凝胶剂中,氨苯砜类化合物的平均粒径为90.8nm~412.5nm。
[0031]
作为优选方案,所述组合物是由含有氨苯砜类化合物和环糊精的溶液、微米混悬液或者纳米混悬液,与药学上可接受的辅料和/或基质混合所制成。
[0032]
作为优选方案,所述组合物是由含有氨苯砜类化合物、环糊精和二乙二醇单乙基醚的溶液、微米混悬液或者纳米混悬液,与药学上可接受的辅料和/或基质混合所制成。
[0033]
本发明还提供了所述的经皮给药组合物的制备方法,包括以下步骤:
[0034]
(1)将氨苯砜类化合物微粉化处理;
[0035]
(2)将氨苯砜类化合物、环糊精在水溶性介质中充分混合分散,制备溶液、微米混悬液或者纳米混悬液;
[0036]
(3)与药学上可接受的辅料和/或基质混合,即得。
[0037]
或者,所述的经皮给药组合物的制备方法,包括以下步骤:
[0038]
(1)将氨苯砜类化合物微粉化处理;
[0039]
(2)将氨苯砜类化合物、环糊精和二乙二醇单乙基醚在水溶性介质中充分混合分散,制备溶液、微米混悬液或者纳米混悬液;
[0040]
(3)与药学上可接受的辅料和/或基质混合,即得。
[0041]
例如,所述组合物制成凝胶剂时,其制备方法包括以下步骤:
[0042]
(1)将氨苯砜类化合物微粉化处理;
[0043]
(2)将氨苯砜类化合物、环糊精在水溶性介质中充分混合分散,制备溶液、微米混悬液或者纳米混悬液;
[0044]
(3)将凝胶剂基质分散于适量纯水使其充分溶胀,调节ph得到半固体状凝胶基质;
[0045]
(4)将所述溶液、微米混悬液或者纳米混悬液,与药学上可接受的辅料和凝胶基质充分混合,即得。
[0046]
或者,所述组合物制成凝胶剂时,其制备方法包括以下步骤:
[0047]
(1)将氨苯砜类化合物微粉化处理;
[0048]
(2)将氨苯砜类化合物、环糊精和二乙二醇单乙基醚在水溶性介质中充分混合分散,制备溶液、微米混悬液或者纳米混悬液;
[0049]
(3)将凝胶剂基质分散于适量纯水使其充分溶胀,调节ph得到半固体状凝胶基质;
[0050]
(4)将所述溶液、微米混悬液或者纳米混悬液,与药学上可接受的辅料和凝胶基质充分混合,即得。
[0051]
上述制备方法中,优选:
[0052]
氨苯砜类化合物粉碎过筛得到微粉(小于或等于100目);
[0053]
所述分散方法包括:快速搅拌分散、湿法研磨法、反溶剂法、高压均质法或微射流法;
[0054]
所述凝胶基质制备:将凝胶剂基质在30~40倍纯水中均匀分散,静置使其充分溶胀,三乙醇胺调节ph至中性,得到凝胶基质;
[0055]
所述药学上可接受的辅料包括防腐剂、稳定剂和保湿剂等。
[0056]
本发明最后提供了所述的经皮给药组合物在制备治疗痤疮的经皮给药药物中的应用。
[0057]
本发明组合物的研究实验结果表明,本发明的组合物技术通过对多个影响因素的优化(包括组合物组成、组分比例、药物粒径等),不仅改善了药物的溶解性,而且调控药物的溶解速率和渗透速率,产生一系列意想不到的应用优势。例如,氨苯砜与环糊精联合应用制备组合物体系,可以实现皮肤靶向作用;通过氨苯砜与环糊精及二乙二醇单乙基醚联合应用,该组合物体系可以更好地改善氨苯砜的皮肤靶向滞留效果;本发明组合物应用于混悬体系或纳米混悬体系,可以进一步优化透皮速率,明显改善皮肤内药物滞留量和滞留比。
[0058]
现有知识表明,影响药物皮肤传递或生物吸收的因素包括:药物的水溶解性和生物膜渗透性。二乙二醇单乙基醚可以作为溶剂、增溶剂、促渗剂,对于某些药物具有改善皮
肤滞留的作用,现有的一些技术在氨苯砜外用制剂处方中采用二乙二醇单乙基醚、吐温80或丙二醇等辅料。申请人研究发现:与这些辅料相比,环糊精在外用制剂中更有助于氨苯砜溶解,有利于在皮肤表面释放充足的溶解态药物分子。例如,25℃时在5%hp-β-cd溶液中氨苯砜的溶解度大于5mg/ml;相比之下,在5%二乙二醇单乙基醚溶液中氨苯砜的溶解度小于0.5mg/ml。在改善药物渗透机制方面,环糊精和二乙二醇单乙基醚各有特点。例如,环糊精载药有助于改善氨苯砜与皮肤表层的亲和性,使药物更容易进入皮层;二乙二醇单乙基醚通过影响皮层结构有助于氨苯砜在皮层滞留蓄积。在本发明技术方案中,申请人发现,氨苯砜皮肤渗透量q随透皮速率js上升而显著增大,但需要对氨苯砜透皮速率js的数值进行优化后才能获得最佳的皮肤滞留量。环糊精与氨苯砜形成的超分子体系在皮肤亲水层释放药物分子,使脂溶性的药物分子容易通过皮肤水性皮层进入皮肤脂性皮层(附图2)。药物透皮速率js受到超分子结合/解离平衡(k1/k2)的影响,影响因素包括:药物/环糊精的结合能力、药物/环糊精的比例等。在本发明技术方案中,申请人发现,当采用特定环糊精且药物/环糊精的比例在特定范围内可以达到优化的药物透皮速率js,实现皮肤滞留靶向效果。应用氨苯砜/环糊精/二乙二醇单乙基醚组合时,二乙二醇单乙基醚可以通过干扰皮层结构而进一步影响透皮速率js。申请人发现,当采用特定环糊精且药物/环糊精/二乙二醇单乙基醚在特定比例范围内可以达到更优化的药物透皮速率js,实现更好的皮肤滞留靶向效果。因此,本发明组合物在改善氨苯砜的溶解性和渗透性方面可以相互协同作用,显著改善氨苯砜的皮肤靶向传递。
[0059]
申请人发现,当氨苯砜和环糊精按特定重量比例进行组合时将产生皮肤靶向效果:氨苯砜类化合物1~10份,环糊精5~30份;或者氨苯砜类化合物1~10份,环糊精5~25份;或者氨苯砜类化合物1~10份,环糊精8~15份。当氨苯砜、环糊精和二乙二醇单乙基醚三者按特定重量比例进行组合时将产生更好的皮肤靶向效果:氨苯砜类化合物1~10份;环糊精5~28份,二乙二醇单乙基醚3~20份。申请人进一步发现,当三者按以下重量比例进行组合时将产生更优化的皮肤靶向效果:氨苯砜类化合物1~10份,环糊精5~20份,二乙二醇单乙基醚3~15份;或者氨苯砜类化合物1~10份;环糊精8~15份,二乙二醇单乙基醚5~12份。
[0060]
本发明技术通过环糊精与二乙二醇单乙基醚的组合还可以有效降低二乙二醇单乙基醚在处方中用量。现有的一些技术采用二乙二醇单乙基醚作为氨苯砜的溶剂/或增溶剂,在处方中含量达到20%~35%。处方中高含量二乙二醇单乙基醚易与氨苯砜相互作用引起制剂外观变色。本发明实施例中二乙二醇单乙基醚处方用量可以低于20%,有利于改善制剂稳定性。
[0061]
有益效果:本发明组合物应用于氨苯砜外用制剂用于治疗痤疮等皮肤疾病,可以产生多种有益效果:
[0062]
1)靶向递送效果显著,有利于提高疗效,降低毒性和不良反应。本发明组合物改善了药物的经皮转运效果,改善了在皮层中的滞留量和滞留比,应用于混悬体系后进一步优化了药物靶向于皮层的特性,提高了到达患病部位的药物量从而有利于皮肤疾病的治疗。由于减少药物进入全身循环的量,进一步可降低由全身吸收所引起的不良反应和毒性反应。
[0063]
2)改善制剂质量和稳定性。本发明混悬凝胶制剂中药物颗粒分散均匀、粒径稳定,
药物含量和性状外观稳定;对照凝胶剂的颗粒明显聚集,长期放置后粒径明显增大、性状颜色显著改变、药物含量波动明显(附图1和凝胶剂质量评价表),本发明技术显著改善了制剂的质量和稳定性。
[0064]
3)减小皮肤刺激性。本发明组合物氨苯砜/环糊精超分子体的形成使药物对皮肤的暴露剂量降低,减小了药物对皮肤的刺激性,临床顺应性好,综合治疗指数高。
[0065]
4)本发明组合物技术更有利于大规模生产实施,提高了产业化可行性。现有技术制备环糊精包合物制剂需要先进行固体包合物的制备,需要进行药物溶解、搅拌或研磨、干燥、包合物质量检验等工序过程,不仅延长制备时间和工艺过程、增加成本能耗,增加了药物损失或分解的风险、降低制剂中药物回收率。本发明技术无需提前制备包合物,简化了制备工艺,明显缩短了制剂生产过程,降低了经济成本,更便于质量控制管理,为制剂生产的产业化提供创新有益技术。
[0066]
下面对本发明中的部分术语做进一步说明:
[0067]
粒径:平均粒径(z-ave)或中值粒径(d50)。
[0068]
pdi(particle distribution index):粒径分布指数,反映所有颗粒粒径分布的均匀程度。
[0069]
皮肤累积渗透量:在本发明中特指氨苯砜凝胶制剂经皮给药后,某一特定时间内氨苯砜透过单位面积皮肤的累积透过量qn。
[0070]
皮肤滞留量:在本发明中特指氨苯砜凝胶制剂经皮给药后,某一特定时间内单位面积皮肤皮层中氨苯砜的含量。
[0071]
皮肤滞留比:在本发明中特指氨苯砜凝胶制剂经皮给药后,某一特定时间内氨苯砜在单位面积皮肤的滞留量与累积渗透量的比值,例如:给药2h后,药物在单位面积皮层中滞留量为2.0μg.cm-2
,在透过单位面积皮肤的累积渗透量为1.0μg.cm-2
,那么此时药物的皮肤滞留比则为2.0(2.0μg.cm-2
/1.0μg.cm-2
)。
附图说明
[0072]
图1:本发明实施例m11,m21,rm11,rm12的显微照片。
[0073]
图2:环糊精载药示意图。
具体实施方式
[0074]
下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实例用于说明本发明,但不用来限制本发明的范围。
[0075]
一、组合物实施例的制剂制备研究
[0076]
(1)凝胶剂的制备实施例
[0077]
药物溶液凝胶剂处方表
[0078][0079]
g11、g21和对照rg11制备方法:
[0080]
将氨苯砜粉碎过100目筛,备用;采用搅拌分散方法制备药物溶液。称取处方量的氨苯砜、hp-β-cd和/或二乙二醇单乙基醚,加入1/3处方量的纯水,搅拌使完全溶解;将卡波姆均匀分散于适量纯水后静置使其充分溶胀,滴加20%三乙醇胺溶液调节ph至7.0,使形成半固体状的凝胶基质,加入药物溶液和其它辅料,补足纯水至100%,100~200r/min充分搅拌使成凝胶状,脱气,分装,即得。
[0081]
实施例g12与实施例g11相似,但环糊精为磺丁基-β-环糊精(sbe-β-cd),含量为25%;
[0082]
实施例g13与实施例g11相似,但环糊精为甲基-β-环糊精(me-β-cd),含量为18%;
[0083]
实施例g14与实施例g11相似,但含有5%氨苯砜,环糊精含量为30%,组成为sbe-β-cd与me-β-cd的混合物(w/w,1:1);
[0084]
实施例g15与实施例g11相似,但环糊精含量为22%,组成为hp-β-cd与γ-cd的混合物(w/w,2:1);
[0085]
实施例g23与实施例g21相似,但hp-β-cd含量为18%,二乙二醇单乙基醚含量为8%;
[0086]
实施例g24与实施例g21相似,但hp-β-cd含量为22%,二乙二醇单乙基醚含量为12%;
[0087]
实施例g25与实施例g21相似,但含有5%氨苯砜,28%hp-β-cd,二乙二醇单乙基醚含量为15%;
[0088]
实施例g26与实施例g21相似,但环糊精为20%me-β-cd,二乙二醇单乙基醚含量3%。
[0089]
实施例g27与实施例g21相似,但含有5%过氧苯甲酰,环糊精为25%hp-β-cd,二乙二醇单乙基醚含量20%。
[0090]
实施例g28与实施例g21相似,但含有0.1%阿达帕林,环糊精为3%hp-β-cd,二乙二醇单乙基醚含量2%。
[0091]
(2)药物微米混悬凝胶的制备的实施例
[0092]
药物微米混悬凝胶的处方表
[0093][0094]
m11、m12、m21、m22及对照凝胶rm0、rm11、rm12、rm13制备方法:
[0095]
将氨苯砜粉碎过300目筛,采用搅拌分散方法制备药物微米混悬液。将氨苯砜加入1/2处方量纯水中充分搅拌分散,加入hp-β-cd或/和二乙二醇单乙基醚,300rpm搅拌混合2小时;将卡波姆均匀分散于适量纯水后静置使其充分溶胀,滴加20%三乙醇胺溶液调节ph至7.0,使形成半固体状的凝胶基质,加入药物微米混悬液和其它辅料,补足纯水至100%,充分搅拌使成凝胶状,脱气,分装,即得。所得的凝胶中药物粒径为11.4~18.7μm。
[0096]
实施例m13与实施例m11相似,但m13中hp-β-cd含量为5%,将环糊精溶于水相,氨苯砜粉碎过200目筛后加入水相充分搅拌分散。所得的混悬凝胶中氨苯砜的粒径为25.1μm。
[0097]
实施例m14与实施例m11相似,但m14中氨苯砜粉碎化后过200目筛,hp-β-cd含量为25%,所得的混悬凝胶中氨苯砜的粒径为31.7μm。
[0098]
实施例m15与实施例m11相似,但m15中氨苯砜粉碎后采用震动筛进行筛分,收集200目~300目的微粉,环糊精含量为20%,组成为hp-β-cd与me-β-cd的混合物(w/w,1:1),所得的混悬凝胶中氨苯砜的粒径为42.6μm。
[0099]
实施例m16与实施例m12相似,但采用湿法循环研磨机制备药物混悬液:氨苯砜粉碎过100目筛,加入适量纯水和环糊精,采用氧化锆磨珠(ф1.0mm)1500rpm研磨25分钟,制备药物微米混悬液,所得的混悬凝胶中氨苯砜的平均粒径为55.8μm。
[0100]
实施例m17与实施例m12相似,但含有15%hp-β-cd。采用湿法循环研磨机制备药物混悬液:氨苯砜粉碎过100目筛,加入适量纯水及0.3%泊洛沙姆188,采用氧化锆磨珠(ф1.0mm)2500rpm研磨60分钟,加入环糊精,300rpm均匀搅拌2小时制备药物微米混悬液,所得的混悬凝胶中氨苯砜的平均粒径为3.8μm。
[0101]
实施例m23与实施例m21相似,但m23中氨苯砜微粉化后过300目筛,hp-β-cd含量为20%,二乙二醇单乙基醚含量为15%,所得的混悬凝胶中氨苯砜的粒径为8.2μm。
[0102]
实施例m24与实施例m21相似,但m24含有8%氨苯砜,氨苯砜微粉化后过200目筛,环糊精含量为25%,组成为hp-β-cd与sbe-β-cd的混合物(w/w,3:2),20%二乙二醇单乙基醚。所得的混悬凝胶中氨苯砜的粒径为21.8μm。
[0103]
实施例m25与实施例m22相似,但m25含12%me-β-cd,5%γ-cd,12%二乙二醇单乙基醚。氨苯砜粉碎过200目筛,将环糊精溶于水相,在快速搅拌状态下使氨苯砜在水相中充分分散,加入二乙二醇单乙基醚,300rpm搅拌2小时制备药物微米混悬液。所得的混悬凝胶中氨苯砜的平均粒径为27.9μm。
[0104]
实施例m26与实施例m22相似,但采用湿法循环研磨机制备药物混悬液。氨苯砜粉碎过100目筛,加入1/2处方量纯水及0.5%羟乙基纤维素,采用氧化锆磨珠(ф1.0mm),1500rpm研磨40分钟,加入环糊精和二乙二醇单乙基醚,混合均匀制备药物微米混悬液。所得的凝胶中药物粒径为26.8μm。
[0105]
实施例m27与实施例m26相似,但含有8%hp-β-cd,3%二乙二醇单乙基醚。氨苯砜采用湿法循环研磨机2500rpm研磨30分钟,加入环糊精和二乙二醇单乙基醚混合均匀制备药物微晶混悬液。所得的混悬凝胶中氨苯砜的平均粒径为2.6μm。
[0106]
实施例m28与实施例m22相似,但含有5%hp-β-cd,15%二乙二醇单乙基醚,采用反溶剂法制备药物混悬液。氨苯砜粉碎过100目筛后溶于二乙二醇单乙基醚作为有机相,环糊精溶于水相,有机相在搅拌状态下快速加入等体积水相进行分散,800rmp持续搅拌90分钟制备药物微米混悬液。所得的混悬凝胶中氨苯砜的平均粒径为14.6μm。
[0107]
实施例m29与实施例m22相似,但含有12%hp-β-cd,12%二乙二醇单乙基醚,采用反溶剂法制备药物混悬液。氨苯砜溶于二乙二醇单乙基醚,在快速搅拌下分散于2倍体积含0.5%甲基纤维素的水溶液,加入环糊精,500rmp持续搅拌60分钟。所得的混悬凝胶中氨苯砜的平均粒径为25.7μm。
[0108]
实施例m30与实施例m21相似,但含有5%过氧苯甲酰,环糊精为20%hp-β-cd,二乙二醇单乙基醚含量12%。所得的混悬凝胶中过氧苯甲酰的平均粒径为9.3μm。
[0109]
(3)药物纳米混悬凝胶剂的制备实施例
[0110]
纳米混悬凝胶剂处方表
[0111][0112]
实施例n11、n12、n21,n22及对照凝胶rn0、rn1、rn2、rn22制备方法:
[0113]
采用湿法循环研磨机制备药物纳米混悬液。氨苯砜粉碎过150目筛,加入1/2处方量纯水和0.8%羟乙基纤维素,采用等体积氧化锆磨珠(ф0.5mm),3000rpm研磨120分钟,加入hp-β-cd或/和二乙二醇单乙基醚混合均匀,得到药物纳米混悬液;将卡波姆均匀分散于适量纯水后静置使其充分溶胀,滴加20%三乙醇胺溶液调节ph至7.0,使形成半固体状的凝胶基质,加入药物纳米混悬液和其它辅料,补足纯水至100%,100~200r/min充分搅拌使成凝胶状,脱气,分装,即得。所得的混悬凝胶中氨苯砜的平均粒径为316.2~335.4nm。
[0114]
实施例n13与实施例n11相似,但n13含有20%me-β-cd,湿法研磨170分钟。所得的混悬凝胶中氨苯砜的平均粒径为158.3nm。
[0115]
实施例n14与实施例n12相似,但n13含有15%hp-β-cd,湿法研磨190分钟。所得的混悬凝胶中氨苯砜的平均粒径为125.2nm。
[0116]
实施例n15与实施例n12相似,但n13含有25%hp-β-cd,湿法研磨210分钟。所得的混悬凝胶中氨苯砜的平均粒径为90.8nm。
[0117]
实施例n16与实施例n12相似,但n16含有8%sbe-β-cd,5%γ-cd。氨苯砜粉碎过100目筛,加入纯水、环糊精及0.8%羟丙基纤维素,采用氧化锆磨珠(ф0.5mm)3000rpm研磨180分钟,得到药物纳米混悬液。所得的混悬凝胶中氨苯砜的平均粒径为205.7nm。
[0118]
实施例n23与实施例n21相似,但n23含有15%hp-β-cd,15%二乙二醇单乙基醚,湿法研磨200分钟,所得的混悬凝胶中氨苯砜的平均粒径为122.7nm。
[0119]
实施例n24与实施例n21相似,但n24含有5%sbe-β-cd,12%二乙二醇单乙基醚,湿法研磨180分钟,所得的混悬凝胶中氨苯砜的平均粒径为173.6nm。
[0120]
实施例n25与实施例n21相似,但n25含有12%hp-β-cd,8%二乙二醇单乙基醚,湿法研磨180分钟,所得的混悬凝胶中氨苯砜的平均粒径为230.1nm。
[0121]
实施例n26与实施例n21相似,但n26含有18%hp-β-cd,3%二乙二醇单乙基醚,湿法研磨150分钟,所得的混悬凝胶中氨苯砜的平均粒径为306.1nm。
[0122]
实施例n27与实施例n21相似,但n27含有8%氨苯砜、20%hp-β-cd、20%二乙二醇单乙基醚。氨苯砜粉碎过100目筛,加入1/2处方量纯水、0.6%甲基纤维素和环糊精,采用氧化锆磨珠(ф0.8mm)3000rpm湿法研磨120分钟,加入二乙二醇单乙基醚混合均匀,得到药物纳米混悬液。所得的混悬凝胶中氨苯砜的平均粒径为412.5nm。
[0123]
实施例n28与实施例n21相似,但n28含有18%hp-β-cd,12%二乙二醇单乙基醚,采用反溶剂法制备药物纳米混悬液。氨苯砜溶于二乙二醇单乙基醚作为有机相,环糊精溶于水相,有机相在快速搅拌状态下分散于2倍体积含0.5%泊洛沙姆188的水相溶液中,800rmp持续搅拌1小时得到药物纳米混悬液。所得的混悬凝胶中氨苯砜的平均粒径为303.7nm。
[0124]
实施例n29与实施例n22相似,但含有15%hp-β-cd,8%二乙二醇单乙基醚,采用反溶剂法制备药物纳米混悬液。氨苯砜溶于丙二醇和二乙二醇单乙基醚作为有机相,有机相在快速搅拌状态下分散于等体积含0.8%羟丙基纤维素的水相溶液中,1000rmp持续搅拌1小时,加入环糊精混合均匀,得到药物纳米混悬液。所得的混悬凝胶中氨苯砜的平均粒径为121.5nm。
[0125]
实施例n30与实施例n29相似,但含有5%过氧苯甲酰,环糊精为8%hp-β-cd,二乙二醇单乙基醚含量15%。所得的混悬凝胶中过氧苯甲酰的平均粒径为172.4nm。
[0126]
二、实施例的质量评价研究
[0127]
实验方法
[0128]
外观性状
[0129]
采用目测法、涂抹法评价凝胶剂的外观、涂展性、皮肤感受性。
[0130]
均匀性
[0131]
采用bm2100pol偏光显微镜观察混悬凝胶剂中药物颗粒分散的均匀性(
×
100,
×
200,
×
400)。
[0132]
ph测定
[0133]
照ph值测定法(中国药典2015版通则)进行测定,取凝胶1g置于烧杯中,加10ml蒸
馏水搅拌溶解,采用phb-3型ph计测定ph值,测定三次计算平均值。
[0134]
粘度测定
[0135]
按照旋转粘度计测定法(中国药典通则)室温下采用ndj-79型旋转粘度计进行粘度测定,测定三次计算平均值。
[0136]
粒径分析
[0137]
取凝胶样品,加适量蒸馏水稀释,采用bt-9300s激光粒度测定仪、nano zs-90激光粒度仪,mastersizer 3000型激光粒度测定仪测定混悬凝胶粒径,测定三次计算平均值。
[0138]
含量测定
[0139]
色谱条件:kromasil 100a c18(4.6mm
×
250cm,5μm)色谱柱,乙腈-甲醇-0.01mol/l磷酸二氢钠溶液(2:1:7),1ml/min,296nm,柱温30℃,岛津lc-20ad高效液相色谱仪。
[0140]
标准曲线的制备:精密称取氨苯砜对照品30mg,加流动相溶解,转移至100ml容量瓶,定容,摇匀,制成每1ml溶液中含氨苯砜0.3mg的对照品溶液。精密量取氨苯砜对照品溶液1、2、3、4、5、6ml分别置于50ml量瓶中,加流动相稀释至刻度,摇匀。0.45μm微孔滤膜过滤后进样10μl测定峰面积(a),以峰面积(a)对进样浓度(c)进行线性回归。
[0141]
对照品溶液的制备:精密称取氨苯砜对照品50mg,置于100ml容量瓶中,加流动相溶解并定容至刻度,摇匀后精密量取1.0ml置于25ml容量瓶中,加流动相定容至刻度,用0.45μm微孔滤膜过滤,作为对照品溶液。
[0142]
供试品溶液的制备:精密称取凝胶1g,置于烧杯中,加流动相搅拌溶解,转入100ml容量瓶中定容,摇匀后精密量取1.0ml置于25ml容量瓶中,加流动相定容至刻度,摇匀后用0.45μm微孔滤膜过滤,作为供试品溶液。
[0143]
测定法:分别精密量取对照品溶液和供试品溶液10μl注入液相色谱仪,记录色谱图,按外标法以峰面积计算含量,测定三次计算平均值。
[0144]
初步稳定性考察
[0145]
凝胶样品包装于铝塑复合软管放置于药品稳定性试验箱中(25℃,rh60%
±
5%),在第0、1、3、6月取样对外观性状、均匀性、粒径、粘度、ph值及含量进行考察分析。
[0146]
试验结果
[0147]
氨苯砜溶液凝胶剂质量评价
[0148]
[0149]
研究结果显示,氨苯砜环糊精组合物可以改善凝胶剂中氨苯砜的稳定性。对照凝胶rg11放置6个月后性状发生显著改变,药物含量明显下降,粘度减小。与对照凝胶rg11相比,本发明组合物凝胶剂(g11、g21)的各项指标符合外用凝胶剂通则要求,长期放置后制剂各项质量指标稳定。实施例g12~g15、g23~g28也有相似效果,各项指标符合外用凝胶剂通则要求,长期放置后制剂各项质量指标稳定。
[0150]
微米混悬凝胶剂质量评价表
[0151][0152]
研究结果显示,氨苯砜环糊精组合物可以改善氨苯砜微米混悬凝胶剂中颗粒的均匀度和聚集性。与对照混悬凝胶相比,本发明组合物微米混悬凝胶剂(m11、m12、m21、m22)的质量指标符合中国药典外用凝胶剂通则要求,微粒分散均匀性好(见附图1),长期放置后药物粒径未见显著增大,性状和药物含量稳定。实施例m13~m17、m23~m30具有相似效果,相关质量指标符合中国药典外用凝胶剂通则要求,具有较好的微粒分散均匀性,长期放置后药物粒径、性状和药物含量稳定,本发明组合物技术有利于改善制剂的质量和用药顺应性。
[0153]
纳米混悬凝胶剂质量评价表
[0154][0155]
实验研究结果显示,与对照纳米凝胶相比,本发明组合物纳米混悬凝胶剂(n11、n12、n21,n22)的外观细腻光滑,性状良好。本发明组合物混悬凝胶剂长期放置后药物粒径稳定,制剂性状和药物含量未见明显变化,药物稳定性明显改善。n13~n16、n23~n30具有相似效果,具有较好的粒径稳定性和药物稳定性,制剂质量稳定。
[0156]
三、实施例的体外透皮释放试验
[0157]
取体重为150~180g sd大鼠,麻醉处死后除净腹部毛,分离无损伤的皮肤,清除皮下粘连的脂肪组织和血管,用生理盐水洗净,滤纸吸干表面水分,-25℃冷冻保存备用。将制备好的皮肤固定于franz扩散池的供给室底部,精密称取0.2g样品置供给室内,接受池中加入30%peg400-ph 7.4磷酸盐缓冲液作为接受介质,保持内皮层与接受溶液密切接触。将franz扩散池置透皮扩散试验仪水浴中(水浴温度为32℃,搅拌速度为100r/min),分别于1、2、4、6、8、12、24小时定时取样,每次取样后补充同体积同温度的接受介质。取出的接受液经0.45μm微孔过滤后用高效液相色谱仪进行测定,采用下述公式计算药物累积渗透量qn。
[0158][0159]
其中a为有效扩散面积(cm2),cn为第n个取样点测得的接受液中的药物浓度(μg/ml),v为接受液体积(16ml),ci为第i(i≤n-1)个取样点测得的接受液中药物浓度(μg/ml),vi为取样体积(1ml)。以q(μg.cm-2
)为纵坐标,时间t(h)为横坐标,求得线性回归方程,所得斜率js即为药物透皮速率,js=dq/dt。
[0160]
12小时或24小时后将鼠皮从扩散池取下,棉球擦拭除去残留药物,供试鼠皮用生理盐水冲洗后剪碎,加入适量甲醇,组织匀浆机匀浆打碎处理,超声提取30min后,溶液转移至容量瓶中,剩余物用甲醇重复提取5次,提取液合并后8000r/min离心5min,吸取上清液测定药物含量,计算皮肤药物滞留量(μg.cm-2
)。
[0161]
实验结果
[0162]
溶液凝胶透皮实验结果(n=6)
[0163][0164]
微米混悬凝胶透皮实验结果(n=6)
[0165][0166]
纳米混悬凝胶透皮实验结果(n=6)
[0167][0168]
研究结果表明:
[0169]
(1)氨苯砜/环糊精组合物溶液凝胶剂(g11、g21)药物皮肤滞留量或滞留比明显高于rg11,实施例g12~g15、g23~g28也有相似效果,说明氨苯砜环糊精组合物具有靶向皮肤的作用。实验结果进一步表明,g21皮肤内药物滞留量和滞留比明显高于g11,实施例g23~g28与g12~g15之间存在相似规律,说明环糊精/二乙二醇单乙基醚组合可以更好地调节氨苯砜的透皮速率,在氨苯砜皮肤靶向传递方面具有更好效果。
[0170]
(2)将本发明组合物技术应用于混悬凝胶体系具有更好的皮肤靶向效果。在微米混悬凝胶体系中,氨苯砜/环糊精组合物混悬凝胶(m11、m12)药物皮肤滞留量和滞留比明显高于组合物溶液凝胶(g11)。实施例m13~m17具有与m11、m12相似的皮肤靶向效果。在纳米混悬凝胶体系中,氨苯砜/环糊精组合物混悬凝胶(n11、n12)药物皮肤滞留量和滞留比明显高于组合物溶液凝胶(g11)。实施例n13~n16具有与n11、n12相似的皮肤靶向效果。
[0171]
本研究进一步发现,环糊精与二乙二醇单乙基醚可以相互协同,进一步提高氨苯砜的皮肤滞留量和滞留比。在微米混悬凝胶体系中,m21或m22的皮肤内药物滞留量和滞留比明显高于m11或m12,也明显高于对照凝胶rm0、rm11、rm12、rm13。实施例m23~m30与m13~m18之间存在相似规律。
[0172]
在纳米混悬凝胶体系中,n21或n22皮肤内药物滞留量和滞留比明显高于n11或n12,也明显高于对照凝胶rn0、rn11、rn12、rn13。实施例n23~n30与n13~n16之间存在相似规律。
[0173]
微米混悬凝胶m21或m22、纳米混悬凝胶n21或n22的皮肤内药物滞留量和滞留比明
显高于药物溶液凝胶(g11,g21),实施例m23~m30或n23~n30也有相似效果。
[0174]
以上结论说明氨苯砜/环糊精组合物具有皮肤靶向效果,氨苯砜/环糊精/二乙二醇单乙基醚组合物进一步改善药物皮肤递送效果,本发明组合物技术与药物混悬体系联合应用可以产生意想不到的皮肤靶向改善效果,可以更好地发挥药物疗效。
[0175]
四、实施例的皮肤刺激性试验
[0176]
选取清洁级sd大鼠为受试动物,随机分为空白基质组、组合物凝胶组、对照凝胶组,每组6只。将受试动物进行脱毛处理,脱毛范围为3cm
×
3cm,并确保脱毛处理未造成皮肤损伤,给药方法为单次和多次给药。采用同体左右自身对照法进行皮肤刺激性试验,试验左侧作为空白对照,右侧分别给予1g样品,将受试样品分别均匀涂布于已去毛的大鼠皮肤上,用纱布(2.5cm
×
2.5cm)和薄膜覆盖,用胶布和绷带加以固定,贴敷结束后,除去受试样品并用温水清洁给药部位,以皮肤出现红斑、水肿的程度为评价指标,按下表对实验结果进行评分和刺激强度评价。组合物凝胶制剂为本研究制备的实施例。
[0177]
皮肤刺激反应评分标准
[0178][0179]
皮肤刺激性强度分级
[0180]
[0181]
单次给药
[0182]
大鼠涂抹给药12小时后,温水洗净药物,观察去除药物后的1h,24h,48h,72h对大鼠皮肤进行观察,按以下要求对大鼠皮肤进行皮肤刺激性评分,按照受试动物积分的平均值进行综合评价。
[0183][0184]
多次给药
[0185]
每天涂抹一次,连续7天,每次涂药1g,每日拭去残留的凝胶,观察受试部位皮肤反应情况,进行皮肤刺激性评分评价,随后涂抹凝胶继续试验。
[0186]
实验结果
[0187]
单次给药
[0188]
由下表可知,单次刺激试验中,凝胶基质组、本发明组合物凝胶组、对照凝胶组未出现肉眼可见的红斑或水肿。根据评分标准,本发明组合物凝胶组反应总分值为0,根据皮肤刺激性强度分级,对皮肤无刺激性。
[0189]
大鼠皮肤单次给药刺激性反应评分(n=6)
[0190][0191]
多次给药
[0192]
由下表结果显示,空白凝胶基质组未出现红斑、水肿等刺激症状,溶液凝胶剂对照组(rg11)第4~5天出现轻度或中度红斑。本发明组合物凝胶组的个别样品(g11、g21)在第5~6天个体出现轻度红斑。混悬对照凝胶剂第4~5天出现轻度红斑。本发明组合物混悬凝胶组个别样品第5天或第6天出现勉强可见的轻度红斑,但很快消退。根据评分标准,对照凝胶剂反应分值为0.17~0.67,本发明组合物凝胶组反应分值为0.17,根据皮肤刺激性强度分级,可判断本发明组合物凝胶对皮肤无明显刺激性。
[0193]
根据皮肤刺激性反应分值评估,本发明组合物凝胶优于对照凝胶,提示本发明组合物有利于降低氨苯砜皮肤刺激性。
[0194]
大鼠皮肤多次给药刺激性反应评分(n=6)
[0195][0196]
其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1