一种促进毛发再生的外用药物及其制备方法与流程
[0001]
本发明涉及基因工程技术及生物药物领域,尤其涉及一种促进毛发毛发再生的外用药物及其制备方法。
背景技术:
[0002]
脱发是皮肤科的一种常见疾病,分为非瘢痕性脱发和瘢痕性脱发。雄激素性脱发、斑秃、拔毛癖等属于前者,毛发扁平苔藓、毛囊炎性脱发、盘状红斑狼疮性脱发等属于后者。雄激素性脱发最为常见,表现为头发密度进行性减少,为雄激素依赖的常染色体显性遗传性多变性疾病。
[0003]
目前针对脱发患者有几种治疗选择,如使用口服或者外用药物,或者进行手术治疗。然而,这些治疗方式具有局限性,药物治疗只能短暂的缓解症状,当病人停止用药后头发又会开始脱落。比如口服非那雄胺有性副作用并且会至畸,停止用药后,头发会加速脱落。采用自体的单个毛囊和毛囊单位移植是一种可靠的手术治疗方法,但是毛囊供体的数量是有限的。因此,脱发急需一些新的治疗手段。
[0004]
毛囊干细胞(hair follicle stem cells,hfscs)是存在于毛囊外根鞘隆突部中的一群能自我更新和增殖的多潜能干细胞,能分化成毛囊、皮脂腺、表皮,对毛发的再生起着重要的作用。研究表明,人毛囊干细胞表达多种细胞表面分子标记物如cd200、角蛋白15(keratin 15,k15)、角蛋白19(keratin 19,k19)、整合素α6、整合素β1、nestin等,而不表达内皮细胞标志分子cd31;此外,也不表达小鼠毛囊干细胞的标记分子cd34。利用这些阳性和阴性标记分子,研究者们可以更好的分离纯化毛囊干细胞,这加快了毛囊干细胞的研究进程。与胚胎干细胞及其它成体干细胞相比,毛囊干细胞具有来源丰富、取材方便、对机体无损害、无伦理问题等优点。文献报道过,通过移植毛囊干细胞使裸鼠长出毛发,证明移植健康毛囊干细胞具有修复受损毛囊的潜力。倘若能够应用异体来源的毛囊干细胞作为供体,这必将大大扩大毛囊干细胞的应用范围。鉴于此,本发明研究毛囊干细胞促进毛发再生的相关机制,探索利用异体毛囊干细胞作为治疗病理性脱发的药物。
技术实现要素:
[0005]
本发明的目的是研究毛囊干细胞促进毛发再生的相关机制,探索利用异体毛囊干细胞作为治疗病理性脱发的药物。
[0006]
一种促进毛发再生的外用药物,包含毛囊干细胞培养基上清液和胸腺肽联用。
[0007]
进一步,所述胸腺肽的质量分数为0.01-0.1%。
[0008]
进一步,将毛囊干细胞培养基上清液分装后置于4℃保存,与质量分数0.01-0.1%胸腺肽混合后得到药物组合物。
[0009]
一种促进毛发毛发再生的外用药物的制备方法,:将毛囊干细胞培养基上清液分装后置于4℃保存,胸腺肽为静脉注射或腹腔给药,
[0010]
所述毛囊干细胞培养基上清液的培养方法包括以下步骤:
[0011]
(1)取健康毛囊以青-链霉素的pbs液反复冲洗;
[0012]
(2)在解剖显微镜下采用显微手术剪剪下毛囊外根鞘隆突部,放到培养皿中;加入毛囊干细胞培养基,37℃、5%co2孵箱培养;
[0013]
(3)次日补加等量培养基1.5ml,在倒置显微镜下观察毛囊外根鞘隆突部有无梭形生长的细胞爬出,待细胞融合达80%后传代培养;
[0014]
(4)将上述毛囊干细胞消化,用毛囊干细胞培养液制成1.0
×
105个/ml的毛囊干细胞悬液,计数。
[0015]
(5)按1:1混合1.2%的琼脂糖和dmem/f12培养基后,取2ml混合液注入35cm2培养皿中,待冷却凝固后,置入培养箱中备用。
[0016]
(6)按1:1比例将0.7%琼脂糖和毛囊干细胞培养基在无菌试管中混合后,在向管中加入1/10体积的毛囊干细胞悬液,充分混匀,注入培养基i的培养皿中,加入量等于培养基i。
[0017]
(7)2天一次更换培养基,总共培养10天,得到毛囊干细胞培养基上清液。
[0018]
进一步,所述毛囊干细胞培养液含10%fbs、100u/ml青链霉素双抗、2ng/ml bfgf的dmem/f12。
[0019]
进一步,所述培养基i,按1:1混合1.2%的琼脂糖和dmem/f12培养基后,取2ml混合液注入35cm2培养皿中,待冷却凝固后,置入培养箱中备用。
[0020]
进一步,所述毛囊干细胞消化的消化液包含质量百分含量为0.1%的胰酶和0.008%的edta的磷酸缓冲液。
[0021]
进一步,所述健康毛囊取自脑后枕部。
[0022]
进一步,所述消化条件为37℃消化3-5分钟。
[0023]
有益效果:本发明所述的外用药物组合物主要适用于雄激素性等脱发症状,通过毛囊干细胞培养基上清液和胸腺肽联用,能够有效激发毛囊,促进脱发者的毛发再生。具有方便、安全、低成本、效果显著、治疗过程简单、病人接受度高的优势。
附图说明
[0024]
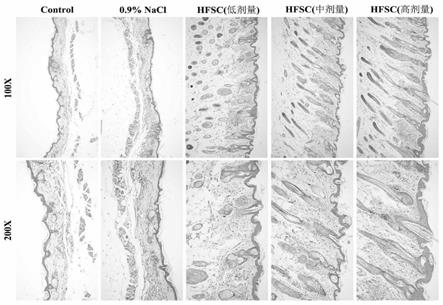
图1注射5w后各组裸鼠皮肤he;
[0025]
图2皮下注射hfsc后毛发生长状态。
具体实施方式
[0026]
为了阐述本发明的技术方案和技术目的,下面具体实施方式对本发明做进一步介绍。
[0027]
一、药物筛选
[0028]
1.样本收集与分组:招募健康志愿者和病理性脱发志愿者各20名,从每名志愿者优势供区(脑后枕部)及前额区分别提取30个完整毛囊。将所采集的毛囊样本按来源分为:健康优势供区组、健康前额组、脱发优势供区组、脱发区组,用于后续的实验研究。
[0029]
2.免疫荧光双染鉴定毛囊样本内毛囊干细胞数量:每组每人分别取5个毛囊样本,制成5μm厚的冰冻切片,以4%多聚甲醛固定10min。pbs清洗3次,用含0.25%triton-100的10%山羊血清封闭液处理20min,分别加入适当稀释的一抗(k19、整合素β1)4℃孵育过夜;
次日,pbs清洗3次后,加入与一抗对应种属的荧光二抗37℃反应30min;pbs清洗并经dapi复染后封片,于荧光显微镜下观察并拍照。统计并比较各组毛囊中毛囊干细胞的数量有无差异。
[0030]
3.基因芯片分析各组毛囊样本的基因表达谱:每组每人分别取15个毛囊样本,利用affymetrix human gene 2.0starray基因芯片分析获取毛囊样本的基因表达谱数据。
[0031]
4.生物信息学方法分析基因表达谱数据:将步骤4中获得的基因表达谱数据导入ngf模型,获得基因表达谱数据中基因重要性分值(important score,is)及排名;将ngf打分排名前3000的基因及各自的is得分(作为初始热度)数据输入hotnet2模型,利用hotnet2方法鉴定关键调控子网络。每组每人分别取10个毛囊样本,提取mrna,采用实时荧光定量pcr法验证这些关键基因在各组毛囊样本中的表达水平;
[0032]
5.系统药理学方法筛选候选药物:将hotnet2鉴定出的子网络基因及这些基因的表达水平作为标签信息输入连通图谱(connectivity map,cmap)数据库进行查询(网站:http://www.broadinstitute.org/cmap/),将返回的结果按p值进行排序,选择排列前三的小分子进行后续的实验验证。
[0033]
二、进一步筛选药物分子
[0034]
1)用三蒸水分别制备1.2%和0.7%两个浓度的低溶点琼脂糖液体,高压灭菌后,40℃维持,使之保持溶解状态。
[0035]
2)配制2
×
dmem/f12完全培养基(含20%fbs、200u/ml青链霉素双抗的2
×
dmem/f12培养基),0.1μm一次性无菌滤器过滤后,保存在37℃中。
[0036]
3)按1:1混合1.2%的琼脂糖和2
×
dmem/f12培养基后,取2ml混合液注入35cm2培养皿中,待冷却凝固后,置入培养箱中备用。
[0037]
4)按1:1比例将0.7%琼脂糖和2
×
dmem/f12培养基在无菌试管中混合后,注入已铺有1.2%琼脂糖的培养皿中,加入量2ml。
[0038]
5)从前述20名病理性脱发志愿者脱发区每人再次分别采集40个完整毛囊,随机分为对照组、1号药物组、3号药物组、3号药物组,每人每组10个;以含高浓度青、链霉素的pbs液反复冲洗3次。待上层琼脂糖处于半凝固状态时,插入上层琼脂糖,置入培养箱中进行3d共培养。
[0039]
6)培养期间,对各实验组每根毛囊根部滴加10ul pbs或对应药物,2天一次,总共培养10天,观察受损毛囊有无毛发生长。
[0040]
7)每组每人分别取5个毛囊样本用于荧光染色双标鉴定毛囊样本内毛囊干细胞数量;另外5个毛囊样本用于实时荧光定量pcr法检测药物处理后受损毛囊中前述毛发再生关键基因的表达水平。
[0041]
8)根据实验结果筛选出治疗效果最佳的药物分子为胸腺肽。
[0042]
三、毛囊干细胞培养基上清液的培养方法包括以下步骤:
[0043]
(1)取健康毛囊以青-链霉素的pbs液反复冲洗;
[0044]
(2)在解剖显微镜下采用显微手术剪剪下毛囊外根鞘隆突部,放到培养皿中;加入毛囊干细胞培养基,37℃、5%co2孵箱培养;
[0045]
(3)次日补加等量培养基1.5ml,在倒置显微镜下观察毛囊外根鞘隆突部有无梭形生长的细胞爬出,待细胞融合达80%后传代培养;
[0046]
(4)将上述毛囊干细胞消化,用毛囊干细胞培养液制成1.0
×
105个/ml的毛囊干细胞悬液,计数。
[0047]
(5)按1:1混合1.2%的琼脂糖和dmem/f12培养基后,取2ml混合液注入35cm2培养皿中,待冷却凝固后,置入培养箱中备用。
[0048]
(6)按1:1比例将0.7%琼脂糖和毛囊干细胞培养基在无菌试管中混合后,在向管中加入1/10体积的毛囊干细胞悬液,充分混匀,注入培养基i的培养皿中,加入量等于培养基i。
[0049]
(7)2天一次更换培养基,总共培养10天,得到毛囊干细胞培养基上清液。
[0050]
四、动物试验
[0051]
1.1建立雄激素性脱发大鼠模型:6周龄雄性sd大鼠,先以脱毛膏脱去背部毛发,再1ml(1.5mg)甲睾酮(取甲睾酮片60片,每片0.5mg,碾成细粉,配蒸馏水20m l,搅匀)及0.2ml猪油灌胃,每天1次,连续灌胃60天,制作雄激素性脱发大鼠模型。
[0052]
1.2动物分组及毛囊干细胞移植:将造模成功的sd大鼠随机分为对照组、毛囊干细胞组、毛囊干细胞+药物组,每组6只。消化收集毛囊干细胞后,以无菌生理盐水洗涤两次,再以无菌生理盐水重悬制成1.0
×
105个/ml的细胞悬液。毛囊干细胞组取细胞悬液于大鼠背部脱毛部位皮下多点注射,每个点100μl,共注射500μl;毛囊干细胞每2天注射1次,共进行3次注射。对照组则以同样方式注射同等体积的生理盐水。毛囊干细胞+药物组除进行毛囊干细胞移植外,另外给予腹腔注射适量药物,每周2次。细胞移植外,另外给予腹腔注射适量药物,每周2次。
[0053]
1.3每周观察大鼠脱毛部位毛发生长情况并作好记录,8周后处死大鼠,取背部脱毛部位皮肤组织制成石蜡组织标本。 对照组实验组1实验组2实验组3实验组4实验组5实验组60w00000001w00000002w00220123w02323234w02332335w0233333
[0054]
1.4毛囊he染色:将皮肤组织蜡块切成厚度为5μm的石蜡切片后,二甲苯脱蜡和梯度酒精水化;自来水清洗3次后,用harris苏木素染色液浸泡染色3-5min,自来水清洗;1%盐酸酒精分化3-5s,自来水清洗;0.2%氨水溶液浸泡1min返蓝,自来水清洗;以伊红染色液浸泡染色30s;95%酒精、无水乙醇脱水,二甲苯透明、中性树胶封片;显微镜下观察并拍照,如图1。比较实验组与对照组毛囊有无病理学差异。
[0055]
1.5毛囊免疫荧光染色:皮肤组织石蜡切片经二甲苯脱蜡和梯度酒精水化后,蒸馏水清洗3-5次,用含0.25%triton-100的10%山羊血清封闭液处理20min,分别加入适当稀释的一抗(k19、cd200、整合素β1)4℃孵育过夜;次日,pbs清洗3次后,加入与一抗对应种属的荧光二抗37℃反应30min;pbs清洗并经dapi复染后封片,于荧光显微镜下观察并拍照。比较实验组与对照组的毛囊干细胞有无差异。
[0056]
2.毛囊干细胞的分离培养
[0057]
1)分离培养人毛囊干细胞:招募10名健康志愿者,从每名志愿者脑后枕部提取8~10个完整毛囊,以含高浓度青、链霉素的pbs液反复冲洗3次。在解剖显微镜下采用显微手术剪剪下毛囊外根鞘隆突部,放到35cm2培养皿中;加入1.5ml毛囊干细胞培养基(含10%fbs、100u/ml青链霉素双抗、2ng/ml bfgf的dmem/f12培养基),37℃、5%co2孵箱培养。次日补加培养基1.5ml,在倒置显微镜下观察毛囊外根鞘隆突部有无梭形生长的细胞爬出,待细胞融合达80%后传代。传代培养至第3代的细胞用于后续实验。
[0058]
2)流式细胞术鉴定毛囊干细胞表面标记分子和阴性标记分子的表达:0.25%的胰蛋白酶消化收集第3代的毛囊干细胞,pbs洗1遍,离心收集细胞,用含1%bsa的pbs溶液重悬。分别加入k15、k19、cd200、整合素β1、cd31和cd34荧光抗体,室温避光孵育30min标记细胞,pbs洗涤后流式细胞仪检测上述标记分子表达情况。
[0059]
2.毛囊干细胞的免疫原性鉴定
[0060]
1)wb检测毛囊干细胞mhc-ii类分子的表达:收集毛囊干细胞,加入细胞总蛋白提取试剂提取总蛋白并定量。取15μg蛋白样本加入2
×
sds凝胶加样缓冲液,煮沸5min,6000rpm离心3min,取上清液上样,电泳后将凝胶上的蛋白转移至pvdf膜,转膜后室温下封闭2h,将pvdf膜放入杂交袋,分别加入适当稀释的一抗(hla-dpa1、hla-dqa1、hla-dra1及内参gapdh)4℃过夜,加与一抗种属对应的hrp标记的二抗,室温下振荡孵育1h,滤膜漂洗后加入显影液显色,放入凝胶成像仪中曝光成像。利用quantity one软件处理系统分析目标带的光密度值。
[0061]
2)实时荧光定量pcr检测毛囊干细胞mhc-ii类分子的表达:收集毛囊干细胞以trizol法提取细胞总mrna,紫外分光光度计鉴定并定量。利用逆转录反应试剂盒(rt reagent kit with gdna eraser,takara)将总rna逆转录为cdna。根据genebank序列,利用primer 5.0软件设计hla-dpa1、hla-dqa1、hla-dra1及内参gapdh引物并委托公司合成。qrt-pcr反应按试剂盒(sybr premix extaqtm ii,takara)说明书进行。hla-dpa1、hla-dqa1、hla-dra1及内参gapdh引物如下表所示:
[0062]
表1.hla-dpa1、hla-dqa1、hla-dra1及内参gapdh引物序列
[0063]
以上显示和描述了本发明的基本原理和主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1