金挖耳内酯化合物在制备治疗炎症引起疾病药物中的应用的制作方法
[0001]
本发明涉及一种金挖耳内酯化合物在制备治疗炎症引起疾病药物中的应用,属于医药领域。
背景技术:
[0002]
目前金挖耳提取物是一种公认具有药用效果的植物提取物,目前存在一系列的内酯类化合物,但该类化合物目前仅有结构信息报道,其生理功能尚未可知,特别是未有报道对其炎症的相关作用进行过报道。
[0003]
金挖耳目前相关研究少,内酯化合物报道分散,申请人通过提取,获取一类的内酯化合物,具有相似的结构,但取代基不同,均具有炎症抵抗的相关效果,并在动物模型中得到进一步的炎症,认为所提取的金挖耳内酯化合物不仅具有抗炎症的功能,同时在动物模型中,对于哮喘模型也具有相关的改善作用,具有更加广泛的药物开发和准确的药物开发潜力。
技术实现要素:
[0004]
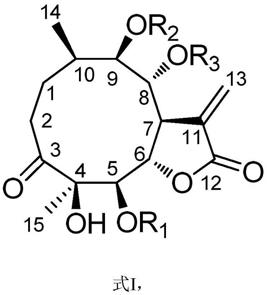
本发明目的在于提供一类金挖耳内酯化合物在制备治疗炎症引起疾病药物中的应用,所述金挖耳内酯化合物为通式i所示化合物或其生理上可接受的盐,
[0005][0006]
其中,r1选自氢基、甲基或含有1~8个碳原子的酰基中的一种;
[0007]
r2选自氢、甲基或含有1~8个碳原子的酰基中的一种;
[0008]
r3选自氢、甲基或含有1~8个碳原子的酰基中的一种;
[0009]
进一步优选,所述的r3为氢基,所述r1为3~5个碳原子的酰基中的一种,r2为3~5个碳原子的酰基中的一种。
[0010]
进一步优选,在上述应用中,所述金挖耳内酯化合物的r1选自3-甲基丁酰基、2-甲基丁酰基、2-甲基丙烯酰基、当归酰基或异丁酰基;
[0011]
r2选自氢、3-甲基丁酰基、2-甲基丁酰基、2-甲基丙烯酰基、异丁酰基或当归酰基;
[0012]
r3选自氢、3-甲基丁酰基或当归酰基。
[0013]
进一步优选,在上述应用中,所述金挖耳内酯化合物的r1选自3-甲基丁酰基、2-甲基丁酰基、当归酰基或异丁酰基;
[0014]
r2选自氢、3-甲基丁酰基、2-甲基丁酰基、2-甲基丙烯酰基、异丁酰基或当归酰基;
[0015]
r3选自氢、3-甲基丁酰基或当归酰基。
[0016]
进一步优选,在上述应用中,所述金挖耳内酯化合物的r1为异丁酰基,r2选自氢、异丁酰基、2-甲基丙烯酰基、3-甲基丁酰基或当归酰基,r3选自氢、3-甲基丁酰基或当归酰基。
[0017]
进一步优选,所述r1选自异丁酰基,r2选自异丁酰基。
[0018]
进一步优选,在上述应用中,所述r3为氢。
[0019]
进一步优选,所述化合物包括其异构体、包括立体异构、光学异构等。
[0020]
所述炎症引起疾病包括哮喘、过敏性肠炎、鼻炎、过敏性哮喘、过敏性结膜炎、咽炎、过敏性支气管炎、湿疹、荨麻疹和过敏性咳嗽。
[0021]
进一步优选,所述炎症引起疾病包括哮喘和过敏性肠炎。进一步地,所述炎症引起疾病为哮喘。
[0022]
发明人在对天名精属植物成分的研究过程中,惊喜地发现了通式为i的化合物,该化合物在抗炎方面表现出了良好的活性,实验表明,该化合物能显著抑制lps诱导的no的产生,与公认效果最强的地塞米松相近。该化合物的结构及其在抗炎方面的活性未见任何报道。
[0023]
临床数据显示,地塞米松作为一种长效糖皮质激素类药物,具有神经性休克股骨头坏死等严重副作用,但目前缺乏同样具有良好抗炎活性的药物可替代它,而本发明所述化合物的抗炎活性虽不及地塞米松强,但已与其相近,在没有更好的替代产品的情况下,是对其不足的良好补充,是深受地塞米松副作用毒害人群的福音。
[0024]
所述的生理上可接受的盐,主要是指金挖耳内酯化合物的无机酸盐或有机酸盐,其中的无机酸为盐酸、硫酸、磷酸、氢溴酸或氢碘酸;有机酸为酒石酸、柠檬酸、甲酸、乙酸、乙二酸、丁酸、草酸、马来酸、琥珀酸、己二酸、藻酸、柠檬酸、天冬氨酸、苯苯磺酸、樟脑酸、樟脑磺酸、二葡糖酸、环戊烷丙酸、十二烷基硫酸、乙磺酸、葡庚糖酸、甘油磷酸、半硫酸、庚酸、己酸、延胡索酸、2-羟基乙磺酸、乳酸、马来酸、甲磺酸、烟酸、2-萘磺酸、扑酸、果胶酯酸、3-苯基丙酸、苦味酸、新戊酸、丙酸、琥珀酸、酒石酸、硫代氰酸、对-甲苯磺酸盐和十一烷酸盐等,优选酒石酸、柠檬酸、乙二酸、马来酸、琥珀酸、柠檬酸、苯磺酸。成盐后既不影响药效,又可进一步提高其溶解性;进一步优选为盐酸盐或马来酸盐。
[0025]
申请人从金挖耳中分离出以下的已知化合物,
[0026]
[0027][0028]
金挖耳内酯x1:(4r,5r,6s,7r,8r,9r,10r)-4,8-双羟基-5-异丁酰氧基-9-3-甲基丁酰氧基-3-酮-吉玛烷-6,12-内酯;
[0029]
金挖耳内酯x2:(4r,5r,6s,7r,8r,9r,10r)-4,8-双羟基-5-2-甲基丁酰氧基-9-3-甲基丁酰氧基-3-酮-吉玛烷-6,12-内酯;
[0030]
金挖耳内酯x3:(4r,5r,6s,7r,8r,9r,10r)-4,8-双羟基-5-当归酰氧基-9-2-甲基丁酰氧基-3-酮-吉玛烷-6,12-内酯;
[0031]
金挖耳内酯x4:(4r,5r,6s,7r,8r,9r,10r)-4,8-双羟基-5-当归酰氧基-9-丁酰氧基-3-酮-吉玛烷-6,12-内酯;
[0032]
上述化合物取代基列表1如下:
[0033]
表1上述化合物的取代基比对
[0034]
序号化合物编号r1r2r31incaspitolide d异丁酰基异丁酰基氢基2cardivarolide f当归酰基当归酰基氢基3cardivarolide g当归酰基3-甲基丁酰基-氢基4cardivarolide h异丁酰基当归酰基氢基5cardivarolide i异丁酰基氢基3-甲基丁酰基6cardivarolide j当归酰基氢基当归酰基7cardivarolide k异丁酰基氢基当归酰基8divarolide e3-甲基丁酰基3-甲基丁酰基氢基9divarolide f异丁酰基2-甲基丙烯酰基氢基10divarolide g2-甲基丁酰基2-甲基丁酰基氢基11金挖耳内酯x1异丁酰基3-甲基丁酰基氢基12金挖耳内酯x22-甲基丁酰基3-甲基丁酰基氢基13金挖耳内酯x3当归酰基2-甲基丁酰基氢基14金挖耳内酯x4当归酰基异丁酰基氢基
[0035]
目前已知金挖耳具有清热解毒、消肿止痛的功效,但尚未发现相关具有炎症抵抗作用的有效成分。
[0036]
但申请人通过相应植物的提取,发现所提取上述金挖耳提取物具有炎症引起疾病的治疗相关功能。
[0037]
本发明的目的还在于提供通式ⅰ化合物的制备方法,该方法为:用有机溶剂提取天名精属属植物的花、根、茎叶或全草,提取物用水分散后用乙酸乙酯萃取,取乙酸乙酯部分,回收溶剂,得到的萃取物经过柱层析后得到通式ⅰ化合物。
[0038]
所述的天名精属植物包括金挖耳、大花金挖耳、暗花金挖耳、小花金挖耳、毛暗花金挖耳、烟管头草、天名精、贵州天名精、高原天名精等。本发明优选以金挖耳(学名:carpesium divaricatum sieb.et zucc)为提取原料,药用部位优选为全草。
[0039]
上述的有机溶剂选自甲醇、乙醇、丙酮、乙醚及乙酸乙酯中的一种,优选甲醇、乙醇或丙酮。考虑到安全性和成本问题等因素,进一步优选为浓度50-95%乙醇,最优选为浓度90-95%乙醇。提取方法为冷浸或热回流提取法。
[0040]
上述制备方法进一步为:用浓度为50-95%的低级醇提取天名精属植物的花、根、茎叶或全草,提取物用水分散后依次用乙酸乙酯萃取,取乙酸乙酯部分,回收乙酸乙酯,得到的萃取物过层析柱分离得到通式ⅰ化合物,该通式ⅰ化合物再经过制备液相色谱及半制备液相色谱可得到高纯度单体化合物,所述的高纯度是指纯度不低于98%。
[0041]
所述的低级醇包括甲醇和乙醇。所述的制备液相色谱(prephplc),如,色谱柱daisogel-c
18-100a(10μm;250
×
30mm;20ml/min),流动相为55~65%的ch3oh,优选流动相为60%的ch3oh;半制备液相色谱(semi-prephplc),如ymc-pack ods-a column(5μm;250
×
10mm;2ml/min),以60%-90%(0-35min)的ch3oh-h2o为流动相进行梯度洗脱。
[0042]
所述萃取的步骤中,提取物加4-6倍量的水进行分散,水相与有机相的体积比为(1:3)~(3:1),优选为1:1;萃取以两层均澄清为终点,萃取次数为1~5次。溶剂回收方法为本领域常规方法。
[0043]
所述得到的通式(i)化合物为有效部位,该有效部位中约含有通式(i)化合物40~50%。
[0044]
上述的柱层析包括:所述萃取物首先采用硅胶柱层析分离,用二氯甲烷-甲醇(200:1,60:1,30:1)进行梯度洗脱,收集30:1部分,回收溶剂至干,再采用凝胶柱层析进行纯化,以甲醇、二氯甲烷-甲醇(1:1)或丙酮为洗脱剂洗脱,收集洗脱液,回收溶剂至干,得到通式(i)化合物,优选以丙酮为洗脱剂。
[0045]
上述以二氯甲烷-甲醇(200:1,60:1,30:1)梯度洗脱的环节,还可以采用石油醚-丙酮(20:1,6:1,3:1)进行梯度洗脱,收集3:1的部分,凝胶柱纯化的方法不变。上述比例均为体积比。
[0046]
所述的硅胶柱层析,选用为粒径200~300目的柱层析硅胶,上样量为6.7%~10%,即上样量与硅胶重量比为(1:10)~(1:15),梯度洗脱时,每个浓度洗脱液优选洗脱3~5柱体积。
[0047]
所述的凝胶柱层析,上样量为2%~2.5%,即上样量与凝胶重量比为(1:40)~(1:50),洗脱7~8柱体积,根据具体情况,选择收集第3~5个柱体积洗脱液。
[0048]
因柱层析过程中影响流份的因素较多,所以,该过程中优选通过薄层检测法(tlc)来确定所需流份。即,通过薄层检测吉玛烷型倍半萜,254nm下有暗斑,5%浓硫酸显色(95℃烘5分钟)后显淡黄点。
[0049]
本发明尤其提供了所述通式ⅰ化合物在制备治疗哮喘疾病的药物中的应用,实验发现抗炎作用与治疗哮喘作用并不存在相应的必然关系,因此当申请人发现所述化合物具有抗炎作用后,分别进行哮喘防治的动物模型研究,因此本发明提供了其他化合物在制备治疗哮喘疾病的药物中的应用。
[0050]
本发明的另一个目的在于,提供一种抗炎的药物组合物,该组合物由有效剂量的本发明所述化合物及药学上可接受的辅料制成。所述的有效量是指5~50mg/天,所述的药学上可接受的辅料,是指为制成适用于人类或动物使用的任何药物剂型所需的辅料,如制成口服固体制剂时,药学上可接受的辅料指稀释剂、粘合剂、润湿剂、崩解剂、润滑剂、助流剂;制成注射液时,药学上可接受的辅料指ph调节剂、助溶剂、抗氧剂、等渗剂等。
[0051]
再次重申:以下实验只是本发明研发过程中众多实验中的举例性实验,并未涵盖和穷尽了发明人为本发明所做的所有实验,目的仅仅在于用那些数据来阐述本发明化合物的抗抑郁活性。
[0052]
实验部分
[0053]
化合物对脂多糖诱导的抗炎活性
[0054]
1、实验材料
[0055]
药品及试剂:二甲基亚砜(dmso),购于fisher公司(hplc级);25%胰蛋白酶,购于sigma公司;dmem培养基(内含青链霉素),购于美国invitrogen公司;胎牛血清,购于gibco公司;马血清,购于hyclone公司;pbs购于hyclone公司
[0056]
细胞及器械:raw264.7细胞株由中国医学科学院药用植物研究所齐云课题组惠赠,细胞培养瓶(coring公司),无菌96孔板,细胞计数板,载玻片,盖玻片,玻璃移液管,尼龙过滤器,不锈钢滤器,各种规格玻璃瓶、移液枪、枪头、枪头盒和离心管。
[0057]
仪器:dhg-9070a电热恒温鼓风干燥箱(北京陆希科技有限公司),mco-15ac型co2恒温细胞培养箱(日本sanyo公司),zhjh-c 1115b型超净工作台(上海智成分析仪器制造有限公司),ckx41型倒置相差显微镜(日本olympus公司),mqx200型酶标光度计(美国biotek仪器有限公司),legend micro 17r型高速低温离心机(美国thermo公司),ql-901微型涡旋混合器(海门市其林贝尔仪器制造有限公司),-80℃超低温冰箱(美国thermo公司),kq-250b型超声波清洗器(昆山市超声波仪器厂),ssw-420-2s型恒温水浴锅(上海博迅有限公司),cy50945型locator液氮罐(美国thermo公司)。
[0058]
供试样品:本发明化合物incaspitolide d、cardivarolide f、cardivarolide g、cardivarolideh、cardivarolide i、cardivarolide j、cardivarolide k、divarolide e、divarolide f、divarolide g、金挖耳内酯x1、金挖耳内酯x2、金挖耳内酯x3及金挖耳内酯x4,均为自制,纯度为98%以上;
[0059]
阳性药:地塞米松。
[0060]
2、实验方法
[0061]
使用griess试剂来检测细胞中的no分泌水平。该方法是green等在1982年提出。原理是no在体内或水中易氧化生成no
2-,在酸性条件下可以和重氮盐磺胺发生griess反应生成重氮化合物。该类化合物可以进一步发生显色反应,在540nm处有最大吸收峰。od值和no的浓度成线形关系。
[0062]
在体外实验中,使用raw264.7细胞来进行实验。细胞培养在塑料培养皿中,使用dmem培养基加10%体积的fbs(胎牛血清),在37℃,5%co2的条件下进行培养。细胞在培养皿中,不使用e酶,枪头吹打下来,因raw细胞较小,数量较多,因此稀释以后,使用计数板计数。然后按照2
×
104每孔在96孔板上种板。在37℃,5%co2的培养箱中培养24h,使细胞贴壁完全。
[0063]
先加入不同浓度的药物,然后加入1μg/ml的lps诱导炎症的发生。共培养24h后。取上清液50μl至新的96孔板中加入同体积的griess试剂,孵育10min,在酶标仪上进行no含量的检测。波长使用540nm。no的含量使用预先用亚硝酸钠测定的标准曲线进行浓度计算。每种药物测3次。
[0064]
抑制率通过以下公式计算:
[0065]
抑制率%=(od对照-od样品)/od对照
×
100。
[0066]
3、实验结果
[0067]
表2已知化合物的抗炎活性结果
[0068][0069]
实验结果如表格2所示,本发明所述通式i中的化合物:incaspitolide d、cardivarolide f、cardivarolide g、cardivarolide h、cardivarolide i、cardivarolide j、cardivarolide k、divarolide e、divarolide f、divarolide g、金挖耳内酯x1、金挖耳内酯x2、金挖耳内酯x3及金挖耳内酯x4能显著抑制lps诱导的no的产生,虽未达到公认活性最强的地塞米松的效果,但已与之接近。
[0070]
进一步动物模型证明:(细胞模型的抗炎模型与动物疾病模型功能不同,因此需要进一步证明)
[0071]
实验动物和材料:
[0072]
(1)实验动物
[0073]
遵照中国医学科学院药用植物研究所动物保护和使用委员会指南及协议,将选好的6-8周龄雄性balb/c小鼠置于本单位实验动物中心,予以spf级管理和饲养。在实验开始前先饲养2天以适应环境,随后在整个实验期间所有小鼠正常进食。
[0074]
(2)实验试剂
[0075]
吐温20(国药试剂公司,上海)、多聚甲醛溶液(生工生物公司,上海)、脱脂奶粉(蒙牛公司,安徽)、苏木素-伊红染液(江苏大学附属医院,镇江)、卵清蛋白(ova,sigma公司,日本)、二甲苯(国药试剂公司,上海)、无水乙醇(国药试剂公司,上海)、nf-κbp65一抗(默克公司,达姆施塔特,德国)、maker(fermentas公司,立陶宛)、pmsf溶液(百奥莱博公司,北京)、pvdf膜(millipore公司,麻省,美国)、蛋白酶抑制剂(thermo scientific公司,麻省,美国)、tweak一抗(默克公司,达姆施塔特,德国)、山羊血清封闭液(赛泓瑞公司,南京)、羊抗
鼠二抗(默克公司,达姆施塔特,德国)、兔抗羊二抗(默克公司,达姆施塔特,德国)、羊抗兔二抗(默克公司,达姆施塔特,德国)、trizol(分离液invitrogen公司,卡尔斯巴德,美国)、转膜液(自配)、dab(显色剂dako公司,丹麦)、ripa裂解液(碧云天公司,上海)、bca蛋白定量试剂盒(碧云天公司,上海)、page凝胶配胶试剂盒(索莱宝公司,北京)、loading buffer(百奥森泰公司,北京)。
[0076]
(3)实验仪器
[0077]
雾化吸入泵(omron公司,日本)、低温离心机(白洋公司,北京)、超净工作台(苏净净化公司,浙江)、电子天平(sartorius公司,日本)、组织切片机(leica公司,德国)、细胞离心涂片器(thermo shandon公司,麻省,美国)、超纯水分离仪(millipore公司,麻省,美国)、制冰机(scotsman公司,意大利)、-20℃、-80℃冰箱(海尔公司,青岛)、水浴箱(跃进医用光学仪器厂,上海)、大、中、小枪头(axygen公司,加州,美国)、离心管(axygen公司,加州,美国)、微量可调移液枪(eppendorf公司,汉堡,德国)、ep管(eppendorf公司,汉堡,德国)、八联管离心机(kylin-bell制造厂,南通)、漩涡混合器(康健医疗有限公司,泰州)、电泳仪(bio-rad公司,加州,美国)、摇床(新康医疗公司,泰州)、光学显微镜(olympus公司,日本)、镊子、剪刀、止血钳等(手术器械厂,上海)、防脱载玻片和盖玻片(世泰器材公司,南通)。
[0078]
1、实验方法
[0079]
(1)实验动物分组及模型制作
[0080]
将70只雄性balb/c小鼠随机平均分为正常对照组、哮喘模型组、地塞米松干预组。
[0081]
哮喘模型组:将抗原混合溶液(含ovalbumin,ova和10%氢氧化铝各50μg)于第1天、第8天、第15天,注入小鼠腹腔内;从第22天至第28天,每天给小鼠进行哮喘激发(予2%ova混悬液雾化吸入,1次/日,30分钟/每次)。
[0082]
地塞米松干预组:同哮喘组进行致敏和激发,但于激发前先在小鼠腹腔内注射0.2mg地塞米松进行干预。
[0083]
样品组:同哮喘组进行致敏和激发,但于激发前先在小鼠腹腔内注射5mg样品进行干预。
[0084]
对照组:分别于第1天、第8天、第15天,将0.2m lpbs注射入小鼠腹腔内,从第22天至第28天,每天给小鼠雾化吸入pbs液(1次/日,30分钟/每次)。
[0085]
2、数据分析
[0086]
检测数据采用spss17.0统计软件包处理,数据以表示,数据具有方差齐性,以f检验作组内统计学分析,多组间采用lsd-t检验进行两两比较,当p值<0.05时表示该差异具有统计学意义。
[0087]
3、结论
[0088]
表3免疫组化监测各组tweak和nf-κb蛋白表达量n=10,
k、divarolide e、divarolide f、divarolide g、金挖耳内酯x1、金挖耳内酯x2、金挖耳内酯x3及金挖耳内酯x4十四种化合物,均具有抗炎的功能,而且在动物模型中,12种化合物均发挥改善哮喘的作用,而以incaspitolide d的功能最佳,12种化合物在治疗制备哮喘药物中的应用。
具体实施方式
[0094]
实施例1:
[0095]
通式(i)化合物(总内酯)的制备:
[0096]
取干燥的金挖耳(carpesium divaricatum)全草9.0kg用8倍量的95%乙醇回流提取3次,每次3小时,合并提取液,回收乙醇,得干浸膏720g,提取物(干浸膏)用加约3l水分散,依次用等体积的石油醚及乙酸乙酯萃取,各萃取3次,收集乙酸乙酯部分,回收溶剂,得到的乙酸乙酯萃取物270g。将乙酸乙酯萃取物用硅胶柱(200-300目的柱层析硅胶,样品与硅胶质量比为1:10)层析纯化,用ch2cl
2-meoh(200:1,60:1,30:1)进行梯度洗脱,每个梯度洗脱3个柱体积,收集ch2cl
2-meoh(30:1)洗脱液,回收溶剂,得到通式(i)化合物的粗提物。该粗提取再采用sephadex lh-20柱色谱(样品与凝胶质量比为1:40)进行分离,以甲醇洗脱,洗脱8个柱体积,收集第5-6个柱体积的洗脱液,回收溶剂,得到通式(i)总内酯65g。
[0097]
实施例2:
[0098]
通式(i)化合物(总内酯)的制备:
[0099]
取干燥的金挖耳(c.divaricatum)全草9.0kg用8倍量的95%乙醇冷浸提取3次,每次2天,合并提取液,回收乙醇,得干浸膏270g,提取物(干浸膏)用加约2.5l水分散,加两倍体积的乙酸乙酯萃取,萃取5次,取乙酸乙酯部分,回收溶剂,得到的乙酸乙酯萃取物35g。将乙酸乙酯萃取物用硅胶柱(200-300目的柱层析硅胶,样品与硅胶质量比为1:15)层析纯化,用ch2cl
2-meoh(200:1,60:1,30:1)进行梯度洗脱,每个梯度洗脱3个柱体积,收集ch2cl
2-meoh(30:1)洗脱液,回收溶剂,得到通式(i)化合物的粗提物。该粗提取再采用sephadex lh-20柱色谱(样品与凝胶质量比为1:40)进行分离,以甲醇洗脱,洗脱8个柱体积,收集第5-6个柱体积的洗脱液,回收溶剂,得到通式(i)总内酯6.8g。
[0100]
实施例3
[0101]
与实施例1不同之处在于,被提取物为大花金挖耳(c.macrocephalum),药用部位为全草,所用溶剂为甲醇。得到通式(i)总内酯30g。
[0102]
实施例4
[0103]
与实施例2不同之处在于,被提取物为暗花金挖耳(c.triste),药用部位为茎叶,所用溶剂为丙酮。得到通式(i)总内酯7.5g。
[0104]
实施例5
[0105]
与实施例1不同之处在于,被提取物为暗花金挖耳(c.triste),药用部位为根,所用溶剂为50%乙醇。得到通式(i)总内酯7.5g。
[0106]
实施例6
[0107]
化合物incaspitolide d的制备:
[0108]
实施例1所得总内酯再分别采用prephplc(60%ch3oh)制备,得到incaspitolide d。
[0109]
incaspitolide d的理化数据如下:白色针晶(甲醇),[α]2d0
–
83.8(c 0.167,meoh),易溶于甲醇,可溶于氯仿、二氯甲烷、乙醇。正离子hr-esi-ms显示:m/z 477.2111[m+na]
+
(calcd for c
23
h
34
o9na,477.2101),1h nmr(cd3od,600mhz)和
13
c nmr(cd3od,150mhz)数据见表1。
[0110]
以核磁共振法确认该化合物结构:1h nmr(cd3od,600mhz)δ1.87(1h,m,h-1a),1.75(1h,m,h-1b),3.85(1h,br d,j=10.2hz,h-2a),2.20(1h,o,h-2b),5.43(1h,dd,j=9.6,2.4hz,h-5),4.70(1h,dd,j=9.6,6.6hz,h-6),3.05(1h,m,h-7),4.44(1h,d,j=10.2hz,h-8),5.17(1h,d,j=10.2hz,h-9),2.22(1h,o,h-10),6.35(1h,d,j=3.0hz,h-13a),5.70(1h,d,j=2.4hz,h-13b),0.99(3h,d,j=6.6hz,h-14),1.26(3h,s,h-15),2.71(1h,o,h-2
′
),1.28(3h,d,j=6.6hz,h-3
′
),1.27(3h,d,j=6.6hz,h-4
′
),2.71(1h,o,h-2
″
),1.26(3h,d,j=7.2hz,h-3
″
),1.26(3h,d,j=7.2hz,h-4
″
)。
13
c nmr(cd3od,150mhz)δ25.3(c-1),32.9(c-2),217.6(c-3),80.4(c-4),78.1(c-5),80.0(c-6),41.5(c-7),70.3(c-8),78.5(c-9),30.0(c-10),132.7(c-11),169.6(c-12),123.8(c-13),19.9(c-14),23.3(c-15),176.4(c-1
′
),34.0(c-2
′
),18.0(c-3
′
),18.0(c-4
′
),177.2(c-1
″
),34.1(c-2
″
),18.5(c-3
″
),17.9(c-4
″
)。
[0111]
实施例7
[0112]
cardivarolide f的制备:
[0113]
实施例2所得总内酯再分别采用prephplc(60%ch3oh)制备,得到cardivarolide f。
[0114]
cardivarolide f理化数据如下:白色针晶(甲醇),[α]2d0
–
84.7(c 0.085,meoh),易溶于甲醇,可溶于氯仿、二氯甲烷、乙醇。uv(meoh)λ
max
(logε):199(4.88)nm,ir(neat)n
max
:3443,1757,1718,1690cm-1
。正离子hr-esi-ms显示:m/z 501.2101[m+na]
+
(calcd for c
25
h
34
o9na,501.2101)。
[0115]
以核磁共振法确认该化合物结构:1h nmr(cd3od,500mhz)δ1.87(1h,m,h-1a),1.74(1h,m,h-1b),3.87(1h,m,h-2a),2.24(1h,o,h-2b),5.51(1h,dd,j=10.0,2.0hz,h-5),4.73(1h,dd,j=9.0,6.5hz,h-6),3.08(1h,m,h-7),4.48(1h,d,j=10.5hz,h-8),5.27(1h,d,j=10.5hz,h-9),2.24(1h,o,h-10),6.34(1h,d,j=3.0hz,h-13a),5.71(1h,d,j=1.0hz,h-13b),0.99(3h,d,j=6.5hz,h-14),1.25(3h,s,h-15),6.18(1h,o,h-3
′
),2.00(3h,s,h-4
′
),1.96(3h,br d,j=10.5hz,h-5
′
),6.18(1h,o,h-3
″
),2.00(3h,s,h-4
″
),1.96(3h,d,j=10.5hz,h-5
″
)。
13
c nmr(cd3od,125mhz)δ25.7(c-1),33.0(c-2),217.9(c-3),80.4(c-4),78.1(c-5),80.0(c-6),41.7(c-7),70.5(c-8),78.5(c-9),30.1(c-10),132.8(c-11),169.7(c-12),124.0(c-13),20.0(c-14),23.4(c-15),167.1(c-1
′
),127.9(c-2
′
),137.7(c-3
′
),19.3(c-4
′
),14.6(c-5
′
),167.7(c-1
″
),127.5(c-2
″
),138.4(c-3
″
),19.5(c-4
″
),14.7(c-5
″
)。
[0116]
实施例8
[0117]
cardivarolide g的制备:
[0118]
实施例2所得总内酯再分别采用prephplc(60%ch3oh)制备,得到cardivarolide g。
[0119]
cardivarolide g的理化数据如下:白色针晶(甲醇),易溶于甲醇,可溶于氯仿、二
氯甲烷、乙醇。正离子hr-esi-ms显示:m/z 503.2257[m+na]
+
(calcd for c
23
h
32
o9na,503.2263)。
[0120]
以核磁共振法确认该化合物结构:1h nmr(cd3od,500mhz)δ1.87(1h,m,h-1a),1.65(1h,m,h-1b),3.88(1h,m,h-2a),2.23(1h,o,h-2b),5.52(1h,dd,j=9.5,2.0hz,h-5),4.73(1h,dd,j=9.5,1.5hz,h-6),3.06(1h,m,h-7),4.44(1h,d,j=10.5hz,h-8),5.18(1h,d,j=10.0hz,h-9),2.23(1h,m,h-10),6.34(1h,d,j=3.0hz,h-13a),5.69(1h,d,j=3.0hz,h-13b),0.99(3h,d,j=6.5hz,h-14),1.26(3h,s,h-15),6.20(1h,qq,j=7.0,1.5hz,h-3
′
),1.99(3h,q,j=1.5hz,h-4
′
),2.02(3h,dq,j=7.0,1.5hz,h-5
′
),2.32(2h,o,h-2
″
),2.13(3h,o,h-3
″
),1.01(3h,d,j=6.6hz,h-4
″
),1.01(3h,d,j=6.6hz,h-5
″
)。
13
c nmr(cd3od,125mhz)δ25.4(c-1),33.2(c-2),217.8(c-3),80.4(c-4),78.1(c-5),80.0(c-6),41.6(c-7),70.3(c-8),78.7(c-9),29.9(c-10),132.8(c-11),169.7(c-12),123.9(c-13),20.0(c-14),23.4(c-15),167.1(c-1
′
),127.5(c-2
′
),138.4(c-3
′
),19.3(c-4
′
),14.8(c-5
′
),173.2(c-1
″
),43.2(c-2
″
),25.4(c-3
″
),21.4(c-4
″
),21.5(c-5
″
)。
[0121]
实施例9
[0122]
cardivarolide h的制备:
[0123]
实施例3所得总内酯再分别采用prephplc(60%ch3oh)制备,得到cardivarolide h。
[0124]
cardivarolide h的理化数据如下:白色针晶(甲醇),易溶于甲醇,可溶于氯仿、二氯甲烷、乙醇。正离子hr-esi-ms显示:m/z 489.2101[m+na]
+
(calcd for c
24
h
34
o9na,489.2101)。
[0125]
以核磁共振法确认该化合物结构:1h nmr(cd3od,600mhz)δ1.88(1h,m,h-1a),1.73(1h,m,h-1b),3.84(1h,br d,j=11.4hz,h-2a),2.24(1h,o,h-2b),5.41(1h,dd,j=9.6,1.8hz,h-5),4.70(1h,dd,j=9.6,6.6hz,h-6),3.07(1h,m,h-7),4.47(1h,d,j=10.2hz,h-8),5.28(1h,d,j=10.2hz,h-9),2.24(1h,m,h-10),6.35(1h,d,j=3.0hz,h-13a),5.72(1h,d,j=3.0hz,h-13b),1.00(3h,d,j=6.6hz,h-14),1.25(3h,s,h-15),2.72(1h,m,h-2
′
),1.26(3h,d,j=6.6hz,h-3
′
),1.25(3h,d,j=6.6hz,h-4
′
),6.17(2h,qq,j=7.2,1.8hz,h-3
″
),1.97(3h,dq,j=1.8,1.2hz,h-4
″
),2.01(3h,dq,j=7.2,1.8hz,h-5
″
)。
13
c nmr(cd3od,150mhz)δ25.5(c-1),32.8(c-2),217.6(c-3),80.4(c-4),78.1(c-5),80.0(c-6),41.6(c-7),70.5(c-8),78.5(c-9),30.0(c-10),132.7(c-11),169.6(c-12),123.9(c-13),20.0(c-14),23.3(c-15),176.4(c-1
′
),34.0(c-2
′
),18.0(c-3
′
),17.9(c-4
′
),167.7(c-1
″
),127.8(c-2
″
),137.7(c-3
″
),19.4(c-4
″
),14.6(c-5
″
)。
[0126]
实施例10
[0127]
cardivarolide i的制备:
[0128]
实施例4所得总内酯再分别采用prephplc(60%ch3oh)制备,得到cardivarolide i。
[0129]
cardivarolide i的理化数据如下:白色针晶(甲醇),易溶于甲醇,可溶于氯仿、二氯甲烷、乙醇。正离子hr-esi-ms显示:m/z 491.2249[m+na]
+
(calcd for c
24
h
36
o9na,491.2257)。
[0130]
以核磁共振法确认该化合物结构:1h nmr(cd3od,500mhz)δ1.89(1h,m,h-1a),1.71
(1h,m,h-1b),3.76(1h,m,h-2a),2.30(1h,m,h-2b),5.20(1h,dd,j=8.0,2.0hz,h-5),4.88(1h,m,h-6),3.11(1h,m,h-7),5.56(1h,d,j=8.5hz,h-8),3.70(1h,d,j=8.5hz,h-9),2.06(1h,m,h-10),6.33(1h,d,j=3.0hz,h-13a),5.66(1h,d,j=3.0hz,h-13b),1.11(3h,d,j=6.0hz,h-14),1.22(3h,s,h-15),2.69(1h,m,h-2
′
),1.26(3h,d,j=6.0hz,h-3
′
),1.23(3h,d,j=6.0hz,h-4
′
),2.16(2h,m,h-2
″
),1.98(1h,m,h-3
″
),0.89(3h,d,j=5.0hz,h-4
″
),0.90(3h,d,j=5.0hz,h-5
″
)。
13
c nmr(cd3od,125mhz)δ24.5(c-1),35.2(c-2),217.9(c-3),80.6(c-4),78.5(c-5),80.2(c-6),40.5(c-7),76.4(c-8),75.5(c-9),31.1(c-10),133.0(c-11),169.6(c-12),125.0(c-13),20.2(c-14),23.5(c-15),176.8(c-1
′
),34.3(c-2
′
),18.3(c-3
′
),18.4(c-4
′
),173.3(c-1
″
),43.3(c-2
″
),25.8(c-3
″
),21.6(c-4
″
),21.7(c-5
″
)。
[0131]
实施例11
[0132]
cardivarolide j的制备:
[0133]
实施例5所得总内酯再分别采用prephplc(60%ch3oh)制备,得到cardivarolide j。
[0134]
cardivarolide j的理化数据如下:白色针晶(甲醇),易溶于甲醇,可溶于氯仿、二氯甲烷、乙醇。正离子hr-esi-ms显示:m/z 501.2101[m+na]
+
(calcd for c
25
h
34
o9na,501.2103)。
[0135]
以核磁共振法确认该化合物结构:1h nmr(cd3od,500mhz)δ1.94(1h,m,h-1a),1.76(1h,m,h-1b),3.83(1h,m,h-2a),2.35(1h,m,h-2b),5.30(1h,d,j=10.0hz,h-5),4.95(1h,m,h-6),3.17(1h,m,h-7),5.68(1h,d,j=10.0hz,h-8),3.77(1h,d,j=10.0hz,h-9),2.11(1h,m,h-10),6.34(1h,d,j=3.0hz,h-13a),5.70(1h,d,j=3.0hz,h-13b),1.12(3h,d,j=6.5hz,h-14),1.25(3h,s,h-15),6.08(1h,m,h-3
′
),1.97(3h,s,h-4
′
),1.96(3h,d,j=10.0hz,h-5
′
),6.17(1h,m,h-3
″
),1.80(1h,s,h-4
″
),1.97(3h,d,j=10.0hz,h-5
″
)。
13
c nmr(cd3od,125mhz)δ24.1(c-1),34.9(c-2),217.8(c-3),80.3(c-4),78.0(c-5),79.9(c-6),40.2(c-7),76.2(c-8),75.3(c-9),30.9(c-10),133.1(c-11),169.3(c-12),124.6(c-13),20.2(c-14),23.5(c-15),167.1(c-1
′
),127.4(c-2
′
),138.2(c-3
′
),19.2(c-4
′
),14.6(c-5
′
),167.5(c-1
″
),127.4(c-2
″
),138.4(c-3
″
),19.3(c-4
″
),14.6(c-5
″
)。
[0136]
实施例12
[0137]
cardivarolide k的制备:
[0138]
实施例5所得总内酯再分别采用prephplc(60%ch3oh)制备,得到cardivarolide k。
[0139]
cardivarolide k的理化数据如下:白色针晶(甲醇),易溶于甲醇,可溶于氯仿、二氯甲烷、乙醇。正离子hr-esi-ms显示:m/z 489.2101[m+na]
+
(calcd for c
24
h
34
o9na,489.2101)。
[0140]
以核磁共振法确认该化合物结构:1h nmr(cd3od,500mhz)δ1.90(1h,m,h-1a),1.72(1h,m,h-1b),3.77(1h,m,h-2a),2.31(1h,m,h-2b),5.18(1h,d,j=10.0hz,h-5),4.90(1h,m,h-6),3.14(1h,m,h-7),5.65(1h,d,j=10.0hz,h-8),3.76(1h,d,j=10.5hz,h-9),2.09(1h,m,h-10),6.32(1h,d,j=3.0hz,h-13a),5.70(1h,d,j=3.0hz,h-13b),1.11(3h,d,j=6.5hz,h-14),1.23(3h,s,h-15),2.68(1h,m,h-2
′
),1.22(3h,d,j=6.0hz,h-3
′
),1.23(3h,
14),23.3(c-15),176.3(c-1
′
),33.9(c-2
′
),18.0(c-3
′
),17.9(c-4
′
),167.2(c-1
″
),136.4(c-2
″
),124.7(c-3
″
),17.1(c-4
″
)。
[0151]
实施例15
[0152]
divarolide g的制备:
[0153]
实施例1所得总内酯再分别采用prephplc(60%ch3oh)制备,得到divarolide g。
[0154]
divarolide g的理化数据如下:白色针晶(甲醇),易溶于甲醇,可溶于氯仿、二氯甲烷、乙醇。正离子hr-esi-ms显示:m/z 505.2414[m+na]
+
(calcd for c
25
h
38
o9na,505.2414)。
[0155]
以核磁共振法确认该化合物结构:1h nmr(cd3od,500mhz)δ1.88(1h,m,h-1a),1.75(1h,m,h-1b),3.87(1h,m,h-2a),2.29(1h,m,h-2b),5.39(1h,d,j=10.0hz,h-5),4.69(1h,d,j=10.0hz,h-6),3.02(1h,m,h-7),4.40(1h,d,j=10.0hz,h-8),5.15(1h,d,j=10.0hz,h-9),2.23(1h,m,h-10),6.32(1h,d,j=3.0hz,h-13a),5.67(1h,d,j=3.0hz,h-13b),0.98(3h,d,j=6.5hz,h-14),1.24(3h,s,h-15),2.52(1h,m,h-2
′
),1.76(1h,m,h-3
′
a),1.52(1h,m,h-3
′
b),1.24(3h,d,j=7.0hz,h-4
′
),0.98(3h,d,j=7.0hz,h-5
′
),2.52(1h,m,h-2
″
),1.76(1h,m,h-3
″
a),1.52(1h,m,h-3
″
b),1.26(3h,d,j=7.0hz,h-4
″
),0.96(3h,d,j=7.0hz,h-5
″
)。
13
c nmr(cd3od,125mhz)δ25.3(c-1),33.2(c-2),217.6(c-3),80.3(c-4),78.1(c-5),79.9(c-6),41.7(c-7),70.5(c-8),78.4(c-9),30.0(c-10),132.7(c-11),169.5(c-12),123.8(c-13),20.0(c-14),23.5(c-15),175.9(c-1
′
),41.3(c-2
′
),26.3(c-3
′
),16.1(c-4
′
),10.7(c-5
′
),176.7(c-1
″
),41.5(c-2
″
),26.2(c-3
″
),16.2(c-4
″
),10.6(c-5
″
)。
[0156]
实施例16
[0157]
金挖耳内酯x1的制备:
[0158]
实施例1所得总内酯再分别采用prephplc(60%ch3oh)制备,得到金挖耳内酯x1。
[0159]
金挖耳内酯x1的理化数据如下:白色针晶(甲醇),白色粉末,易溶于甲醇,可溶于氯仿、二氯甲烷、乙醇。正离子hr-esi-ms显示:m/z 491.2269[m+na]
+
(calcd for c
24
h
36
o9na,491.2257)。
[0160]
以核磁共振法确认该化合物结构:1h nmr(cd3od,600mhz)δ1.85(1h,m,h-1a),1.73(1h,m,h-1b),3.83(1h,br d,j=9.0hz,h-2a),2.20(1h,o,h-2b),5.42(1h,dd,j=9.6,2.4hz,h-5),4.69(1h,dd,j=9.6,2.4hz,h-6),3.04(1h,m,h-7),4.42(1h,d,j=10.0hz,h-8),5.18(1h,d,j=10.2hz,h-9),2.20(1h,o,h-10),6.34(1h,d,j=3.0hz,h-13a),5.69(1h,d,j=3.0hz,h-13b),1.02(3h,d,j=7.2hz,h-14),1.25(3h,s,h-15),2.65(1h,m,h-2
′
),1.26(1h,d,j=6.6hz,h-3
′
),1.25(3h,d,j=6.6hz,h-4
′
),2.33(1h,d,j=7.8hz,h-2
″
a),2.20(1h,o,h-2
″
b),2.12(1h,m,h-3
″
),1.02(3h,d,j=7.2hz,h-4
″
),1.00(3h,d,j=6.6hz,h-5
″
)。
13
c nmr(cd3od,150mhz)δ25.3(c-1),32.8(c-2),217.7(c-3),80.3(c-4),78.1(c-5),79.9(c-6),41.3(c-7),70.2(c-8),78.6(c-9),29.9(c-10),132.7(c-11),169.7(c-12),123.8(c-13),19.9(c-14),23.3(c-15),176.3(c-1
′
),33.9(c-2
′
),17.39(c-3
′
),17.9(c-4
′
),173.2(c-1
″
),43.0(c-2
″
),25.3(c-3
″
),21.4(c-4
″
),21.4(c-5
″
)。
[0161]
实施例17
[0162]
金挖耳内酯x2的制备:
[0163]
实施例1所得总内酯再分别采用prephplc(60%ch3oh)制备,得到金挖耳内酯x2。
[0164]
金挖耳内酯x2的理化数据如下:白色针晶(甲醇),[α]2d0
–
70.6(c 0.085,meoh),易溶于甲醇,可溶于氯仿、二氯甲烷、乙醇。正离子hr-esi-ms显示:m/z 505.2473[m+na]
+
(calcd for c
25
h
38
o9na,505.2414)。
[0165]
以核磁共振法确认该化合物结构:1h nmr(cd3od,500mhz)δ1.83(1h,m,h-1a),1.71(1h,m,h-1b),3.81(1h,br d,j=9.0hz,h-2a),2.20(1h,o,h-2b),5.40(1h,d,j=8.0hz,h-5),4.66(1h,dd,j=8.0,5.5hz,h-6),3.01(1h,m,h-7),4.40(1h,d,j=8.5hz,h-8),5.15(1h,d,j=8.5hz,h-9),2.20(1h,o,h-10),6.31(1h,d,j=3.0hz,h-13a),5.66(1h,d,j=3.0hz,h-13b),0.97(3h,d,j=5.5hz,h-14),1.22(3h,s,h-15),2.52(1h,m,h-2
′
),1.70(1h,m,h-3
′
a),1.54(1h,m,h-3
′
b),1.21(3h,d,j=5.5hz,h-4
′
),0.99(3h,t,j=7.0hz,h-5
′
),2.20(2h,d,j=5.5hz,h-2
″
),2.15(1h,m,h-3
″
),1.00(3h,d,j=5.5hz,h-4
″
),1.00(3h,d,j=5.5hz,h-5
″
)。
13
c nmr(cd3od,150mhz)δ25.4(c-1),32.9(c-2),217.6(c-3),80.4(c-4),78.1(c-5),79.8(c-6),41.5(c-7),70.4(c-8),78.7(c-9),29.9(c-10),132.7(c-11),169.7(c-12),123.7(c-13),20.0(c-14),23.3(c-15),176.0(c-1
′
),41.1(c-2
′
),26.5(c-3
′
),15.7(c-4
′
),10.5(c-4
′
),173.2(c-1
″
),43.0(c-2
″
),25.3(c-3
″
),21.4(c-4
″
),21.4(c-5
″
)。
[0166]
实施例18
[0167]
金挖耳内酯x3的制备:
[0168]
实施例1所得总内酯再分别采用prephplc(60%ch3oh)制备,得到金挖耳内酯x3。
[0169]
金挖耳内酯x3的理化数据如下:白色针晶(甲醇),易溶于甲醇,可溶于氯仿、二氯甲烷、乙醇。正离子hr-esi-ms显示:m/z 481.2449[m+h]
+
(calcd for c
25
h
37
o9,481.2438)。
[0170]
以核磁共振法确认该化合物结构:1h nmr(cd3od,500mhz)δ1.88(1h,m,h-1a),1.73(1h,o,h-1b),3.85(1h,m,h-2a),2.24(1h,o,h-2b),5.51(1h,dd,j=9.5,2.0hz,h-5),4.73(1h,dd,j=9.0,6.5hz,h-6),3.06(1h,m,h-7),4.44(1h,d,j=10.5hz,h-8),5.17(1h,d,j=10.5hz,h-9),2.24(1h,o,h-10),6.33(1h,d,j=3.0hz,h-13a),5.68(1h,d,j=3.0hz,h-13b),0.98(3h,d,j=7.5hz,h-14),1.25(3h,s,h-15),6.18(1h,qq,j=7.0,1.5hz,h-3
′
),1.98(3h,dq,j=1.5,1.5hz,h-4
′
),1.96(3h,dq,j=7.0,1.5hz,h-5
′
),2.48(1h,m,h-2
″
),1.73(1h,o,h-3
″
a),1.50(1h,m,h-3
″
b),1.21(3h,d,j=7.0hz,h-4
″
),0.97(3h,t,j=7.0hz,h-5
″
)。
13
c nmr(cd3od,150mhz)δ25.4(c-1),33.1(c-2),217.9(c-3),80.4(c-4),78.1(c-5),80.0(c-6),41.5(c-7),70.4(c-8),78.4(c-9),30.0(c-10),132.8(c-11),169.7(c-12),124.0(c-13),20.0(c-14),23.4(c-15),167.1(c-1
′
),127.8(c-2
′
),138.4(c-3
′
),19.3(c-4
′
),14.6(c-5
′
),176.8(c-1
″
),41.3(c-2
″
),26.3(c-3
″
),16.2(c-4
″
),10.7(c-5
″
)。
[0171]
实施例19
[0172]
金挖耳内酯x4的制备:
[0173]
实施例1所得总内酯再分别采用prephplc(60%ch3oh)制备,得到金挖耳内酯x4。
[0174]
金挖耳内酯x4的理化数据如下:白色针晶(甲醇),易溶于甲醇,可溶于氯仿、二氯甲烷、乙醇。正离子hr-esi-ms显示:m/z 489.2108[m+na]
+
(calcd for c
24
h
34
o9na,489.2101)。
[0175]
以核磁共振法确认该化合物结构:1h nmr(cd3od,600mhz)δ1.87(1h,m,h-1a),1.76(1h,o,h-1b),3.89(1h,m,h-2a),2.24(1h,o,h-2b),5.52(1h,d,j=9.6hz,h-5),4.74(1h,dd,j=9.6,6.6hz,h-6),3.07(1h,m,h-7),4.45(1h,d,j=10.2hz,h-8),5.16(1h,d,j=10.8hz,h-9),2.24(1h,o,h-10),6.34(1h,d,j=3.6hz,h-13a),5.69(1h,d,j=3.0hz,h-13b),0.98(3h,d,j=7.2hz,h-14),1.26(3h,s,h-15),6.20(1h,qq,j=7.2,1.8hz,h-3
′
),1.99(3h,dq,j=1.8,1.8hz,h-4
′
),2.01(3h,dq,j=7.2,1.8hz,h-5
′
),2.68(1h,m,h-2
″
),1.20(3h,d,j=7.2hz,h-3
″
),1.25(3h,d,j=7.2hz,h-4
″
)。
13
c nmr(cd3od,150mhz)δ25.3(c-1),33.1(c-2),217.9(c-3),80.4(c-4),78.1(c-5),80.0(c-6),41.6(c-7),70.3(c-8),78.5(c-9),30.0(c-10),132.7(c-11),169.7(c-12),124.0(c-13),19.9(c-14),23.4(c-15),167.1(c-1
′
),127.4(c-2
′
),138.4(c-3
′
),19.2(c-4
′
),14.6(c-5
′
),177.2(c-1
″
),34.0(c-2
″
),18.5(c-3
″
),17.8(c-4
″
)。
[0176]
上述化合物均可提取得到98%的样品,即本发明实验中所用样品。
[0177]
本发明不局限于上述实施方式,任何人在本发明的启示下得出的其他任何与本发明相同或相近似的产品,均不排除在本发明的保护范围之外。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1