β-葡聚糖联合抗肿瘤药物在抗肿瘤治疗中的应用的制作方法
[0001]
本发明涉及抗肿瘤治疗药物技术领域,具体涉及β-葡聚糖联合抗肿瘤药物在抗肿瘤治疗中的应用。
背景技术:
[0002]
对于癌症(恶性肿瘤)的治疗,由于传统的放疗和化疗往往会具有常见的骨髓抑制、免疫抑制、白细胞减少等血液系统毒性。而近几年来出现的包括细胞治疗,疫苗治疗,抗体药物治疗等在内的免疫治疗(immunotherapy)作为继手术、化疗和放疗之后的第四种癌症治疗方式将逐步成为癌症治疗的主要手段。而其中利用真菌提取的多糖(尤其是β-葡聚糖)作为典型的生物反应调节剂(biological response modifiers,brm)或者免疫调节剂(immunomodulator)通过动员机体免疫系统间接达到抗肿瘤的作用越来越受到重视,并且在合并放、化疗来联合治疗肿瘤将更有其临床应用价值。
[0003]
现有的研究虽然表明,多糖尤其是β-葡聚糖,β-葡聚糖是一种源于酵母的β-葡聚糖多糖(β-(1,3)(1,6)-glucan),它作为一种免疫调节剂,但对被开发用于与抗肿瘤药物在抗肿瘤治疗中联合施用的应用还为进行相关报道和研究。
技术实现要素:
[0004]
针对现有技术的不足,本发明提供了β-葡聚糖联合抗肿瘤药物在抗肿瘤治疗中的应用,β-葡聚糖可以促使天然免疫效应细胞通过补体cr3依赖机制杀伤补体调理的肿瘤细胞。多个动物肿瘤模型表明,与任何单疗法相比,β-葡聚糖与补体激活剂或抗肿瘤抗体联合治疗可以显著延缓肿瘤生长,延长总生存期。
[0005]
本发明通过以下技术方案予以实现:
[0006]
β-葡聚糖联合抗肿瘤药物在抗肿瘤治疗中的应用,其特征在于,所述β-葡聚糖是一种源于酵母的β-葡聚糖多糖,包括β-1,3/1,6葡聚糖,在其结构上,酵母β-葡聚糖主链由葡萄糖单体通过β-(1,3)键连接而成,侧链由葡萄糖通过β-(1,6)糖苷键连接至主链;
[0007]
所述β-葡聚糖与抗体或小分子药物联合施用,通过改善肿瘤免疫微环境起到抗肿瘤效应;
[0008]
所述联合施用指两种及以上成分联合施用,因此其治疗性或预防性效果大于任何一种单独施用,两种成分可能同时施用,或序贯施用;同时,联合施用的成分可能由一多种药物组合物提供,两种及以上成分的序贯施用包括所有药物施用完成后同时呈现生物可利用性,无论成分同时施用或序贯施用,成分可能在同一位点或不同位点施用。
[0009]
优选的,所述β-葡聚糖和药剂由单一制剂提供。
[0010]
优选的,所述β-葡聚糖和药剂由单独制剂提供。
[0011]
优选的,所述β-葡聚糖,药剂,和/或两种成分的联合可由任何合适的形式提供,包括但不限于水溶液,悬浮液,乳浊液,喷雾剂,气雾剂,或任何形式的混合物。
[0012]
优选的,所述β-葡聚糖可以与非补体激活途径的单克隆抗体药物联合使用;
[0013]
进一步的,所述β-葡聚糖可以与抗pd-l1免疫卡控点抑制剂联合治疗多种肿瘤,包括但不限于黑色素瘤、肾细胞癌或肺癌。
[0014]
优选的,所述β-葡聚糖可以与非补体激活途径或非靶向肿瘤的但可以增强免疫共刺激信号的mab联合使用;
[0015]
进一步的,所述β-葡聚糖可以与包括但不限于抗cd40 mab(igg2 mab),靶向dc,抗ox40或抗41bb,增强t细胞共刺激信号,它们可用于治疗多种肿瘤。
[0016]
优选的,所述β-葡聚糖可以与非补体激活途径,靶向或非靶向肿瘤的降低免疫抑制的小分子药物联合使用。
[0017]
优选的,包括施用足够的所述β-葡聚糖或足够的可以特异结合所述β-葡聚糖的抗体,其施用剂量在200ng/kg至100mg/kg。
[0018]
优选的,疗程开始前,其施用剂量按照实际体重计算剂量,采用的体表面积计算公式为m2=(体重kg0.425
×
身高cm0.725)
×
0.007184。
[0019]
本发明的有益效果为:
[0020]
β-葡聚糖可以促使天然免疫效应细胞通过补体cr3依赖机制杀伤补体调理的肿瘤细胞。多个动物肿瘤模型表明,与任何单疗法相比,β-葡聚糖与补体激活剂或抗肿瘤抗体联合治疗可以显著延缓肿瘤生长,延长总生存期。
附图说明
[0021]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0022]
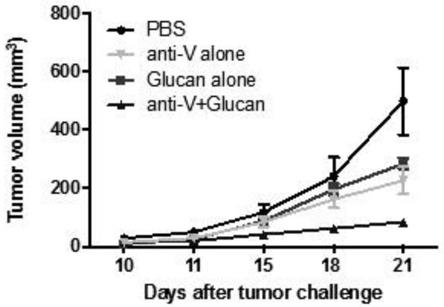
图1为本发明中实施例一的β-葡聚糖与抗血管生成药物联合施用治疗结果图。
具体实施方式
[0023]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0024]
β-葡聚糖联合抗肿瘤药物在抗肿瘤治疗中的应用,β-葡聚糖是一种源于酵母的β-葡聚糖多糖,包括β-1,3/1,6葡聚糖,在其结构上,酵母β-葡聚糖主链由葡萄糖单体通过β-(1,3)键连接而成,侧链由葡萄糖通过β-(1,6)糖苷键连接至主链;
[0025]
β-葡聚糖与抗体或小分子药物联合施用,通过改善肿瘤免疫微环境起到抗肿瘤效应;
[0026]
联合施用指两种及以上成分联合施用,因此其治疗性或预防性效果大于任何一种单独施用,两种成分可能同时施用,或序贯施用;同时,联合施用的成分可能由一多种药物组合物提供,两种及以上成分的序贯施用包括所有药物施用完成后同时呈现生物可利用性,无论成分同时施用或序贯施用,成分可能在同一位点或不同位点施用。
[0027]
具体的,β-葡聚糖,药剂,和/或两种成分的联用可能形成一种药物组合物。在一些
实施例中,β-葡聚糖和药剂由单一制剂提供。在其他的实施例中,β-葡聚糖和药剂由单独制剂提供。可以形成多种形式的药物组合物,以适合一种或多种优先的施用途径。因此,药物组合物可以通过一种以上已知的途径进行治疗,包括,比如,口服,注射(比如,皮内,经皮,皮下,肌内,静脉,腹腔等),或局部使用(比如鼻内,肺内,乳房内,阴道内,子宫内,皮内,经皮,直肠等)。一种药物组合物,或其中一部分,可以使用于粘膜表面,比如鼻腔或呼吸道黏膜(比如,通过喷雾或气雾)。一种药物组合物,或其中一部分,可以通过持续释放或延迟释放。
[0028]
制剂可能在单位剂型中直接方便的呈现(presented),或通过药学领域熟知的方法进行制备。与药理上可接受的载体配制组合物的方法包括将β-葡聚糖和/或药剂交联至含有助剂的载体的步骤。通常,制剂配制可通过活性化合物均匀而/或紧密的交联至液体载体或细固体载体,或两种都有,然后,如果必要的情况下,制备成需要的制剂。
[0029]
具体的,β-葡聚糖,药剂,和/或两种成分的联合可由任何合适的形式提供,包括但不限于水溶液,悬浮液,乳浊液,喷雾剂,气雾剂,或任何形式的混合物。组合物可以是含有任何药学可接受赋形剂,溶媒或载体的制剂进行递送。例如,制剂可以经由传统的局部剂量形式进行递送,比如,乳膏,油膏,气雾,喷雾,凝胶,乳液,等等。制剂可以含有一种或以上添加剂,包括,比如,佐剂,透皮吸收促进剂,色素,香分,调味,润肤膏,增稠剂,等等。
[0030]
具体的,β-葡聚糖可以与非补体激活途径的单克隆抗体药物联合使用;
[0031]
进一步的,β-葡聚糖可以与抗pd-l1免疫卡控点抑制剂(经fc段重组的igg1 mab)联合治疗多种肿瘤,但不限于黑色素瘤、肾细胞癌、肺癌等。其中抗pd1/pd-l1抗体的疗效依赖于肿瘤细胞表面的pd-l1表达。肿瘤表达pd-l1的机制之一称为获得性免疫抑制,由肿瘤微环境中免疫应答(比如激活t细胞分泌的ifn-γ)诱导产生。卡控点抑制剂有nivolumab和pembrolizumab等。
[0032]
具体的,β-葡聚糖可以与非补体激活途径或非靶向肿瘤的但可以增强免疫共刺激信号的mab联合使用;
[0033]
进一步的,β-葡聚糖可以与包括但不限于抗cd40 mab(igg2 mab),靶向dc,抗ox40或抗41bb,增强t细胞共刺激信号,它们可用于治疗多种肿瘤。
[0034]
具体的,β-葡聚糖可以与非补体激活途径,靶向或非靶向肿瘤的降低免疫抑制的小分子药物联合使用。可以作为肿瘤疫苗的佐剂激发th1极化。可以用于慢性疾病(如tb)的治疗,通过降低抑制的机制加速消除感染。它还可以应用于自体免疫疾病(过敏,哮喘,特应性疾病),将th2为主的th1-th2平衡转变成th1极化的微环境。
[0035]
具体的,在一些实施例中,β-葡聚糖来源于酿酒酵母,β-葡聚糖包括β-1,3/1,6葡聚糖,在一些实施例中,方法包括施用足够的β-葡聚糖,比如,单剂量约200ng/kg至100mg/kg,尽管在一些实施例中,给药剂量超出该范围。
[0036]
另一种选择为,疗程开始前,按照实际体重计算剂量。采用这种方式计算剂量,疗程开始前,体表面积计算公式为m2=(体重kg0.425
×
身高cm0.725)
×
0.007184。在一些实施例中,方法包括给药足够的β-葡聚糖,比如,剂量约0.02mg/m2至25mg/m2。
[0037]
在一些实施例中,方法包括施用足够的可以特异结合β-葡聚糖的抗体,比如,剂量约200ng/kg至100mg/kg,尽管在一些实施例中,给药剂量超出该范围。
[0038]
另一种选择为,疗程开始前,按照实际体重计算剂量。采用这种方式计算剂量,疗
程开始前,体表面积计算公式为m2=(体重kg0.425
×
身高cm0.725)
×
0.007184。在一些实施例中,方法包括给药足够的抗体,比如,剂量约0.02mg/m2至25mg/m2。
[0039]
在一些实施例中,β-葡聚糖与药剂可以同时施用,比如,每周一次或多次,尽管在一些实施例中,同时施用的频率超出该范围。在某些实施例中,β-葡聚糖和药剂施用约一月一次至一周一次。
[0040]
实施例一:
[0041]
β-葡聚糖与抗血管生成药物联合使用对肿瘤生长的影响:
[0042]
肿瘤血管生成会改变肿瘤免疫微环境中的免疫功能,进而形成免疫抑制性微环境。抗血管生成药物,比如抗vegfr2抗体anti-v已证实可有效用于肿瘤治疗。由于β-葡聚糖可以将免疫抑制环境转变为有利于抗肿瘤的环境,因此将其与anti-v联合施用治疗llc非小细胞肺癌(nsclc)小鼠皮下移植瘤模型,增强anti-v抗体的疗效。
[0043]
6-8周雌性裸鼠腹股沟皮下注射0.1ml(2
×
106)llc肿瘤细胞。当小鼠肿瘤体积为150mm3时,每周两次按照以下方案治疗:0.1ml/只溶剂;1mg/只β-葡聚糖;10mg/kg或20mg/kg anti-v。第10天和最后一次治疗后2小时采集血样。治疗组包括溶剂组(pbs对照),β-葡聚糖单独组,anti-v单独组,anti-v+β-葡聚糖组。当小鼠肿瘤体积达到150mm3时,随机分组。如图1所示的是10mg/kg治疗方案的结果,结果表明,β-葡聚糖+anti-v产生了协同效应,延缓肿瘤生长。因此,β-葡聚糖与抗血管生成药物联合施用是一种有效的肿瘤治疗方案。
[0044]
实施例二:
[0045]
β-葡聚糖与抗pd-1抗体联合施用改善无肿瘤生存期:
[0046]
在另一项动物研究中,小鼠注射肿瘤细胞eo771后随机分组。8-10周雌性小鼠腹股沟皮下注射3
×
106细胞(重悬于0.1ml)。eo771为乳腺癌细胞,低表达pd-1。从第3天开始,开始每周两次治疗:0.1ml/只溶剂;1mg/只β-葡聚糖;100μg/只抗pd-1单抗。
[0047]
治疗组包括溶剂组(pbs对照),β-葡聚糖单独组,抗pd-1抗体单独组,抗pd-1抗体+β-葡聚糖组。当小鼠肿瘤体积达到150mm3时,随机分组。结果见表1。
[0048]
treatment groupstumor-free survivors(day 30)pbs1/16glucan3/15anti-pd-14/15anti-pd-1+glucan14/16
[0049]
同样的,抗pd-1抗体联合β-葡聚糖可以产生协同作用,有效延长无瘤生存期。
[0050]
以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1