甲硫氨酸酶在制备抗肿瘤的铁死亡诱导剂药物中的应用的制作方法
1.本发明涉及医药技术领域,具体涉及甲硫氨酸酶在制备抗肿瘤的铁死亡诱导剂药物中的应用。
背景技术:
2.恶性肿瘤是一种严重威胁人类生命健康的常见病,根据2015年最新的统计数据显示,恶性肿瘤死亡率占居民全部死因的23.91%。而神经胶质瘤是最常见的原发性中枢神经系统肿瘤,具有侵袭性强、预后差等特点。据2018年最新流行病学统计,我国神经胶质瘤的年发病率为(5~8)/10万,5年死亡率在所有肿瘤中位居第三,仅次于胰腺癌和肺癌。尽管近几年在胶质瘤的诊断和治疗方面取得了很大的进步,但对于高级别胶质母细胞瘤 (glioblastoma multiforme,gbm)的预后仍不理想,患者两年生存率仅为26%-33%。因此,寻找新的靶向治疗药物尤为重要。
3.铁死亡(ferroptosis)是由铁依赖性脂质过氧化作用驱动的调节性细胞死亡的一种形式。最早是2012年由brent r.stockwell提出的,与一般程序性死亡不同,其在形态学、生物学及基因水平均明显区别于凋亡、坏死、自噬等其他形式的调节性细胞死亡。铁死亡的本质是下拨内脂质过氧化物的代谢障碍,进而在铁离子的催化下异常代谢,产生大量脂质,破坏胞内氧化还原反应平衡,共计生物大分子以触发细胞死亡。大量的研究报道表明诱导铁死亡可作为抗肿瘤的重要机制,其在肿瘤发生,发展以及耐药性方面的作用也备受关注。因此,诱导肿瘤细胞发生铁死亡是以中国新型的抗肿瘤治疗策略。
4.甲硫氨酸是人体内必需氨基酸,参与体内dna、蛋白质等多种不同物质的甲基转移催化反应。大部分肿瘤细胞对甲硫氨酸(l-met)的需求较高,具有甲硫氨酸依赖性,即在培养基或饮食中限制或剥夺l-met,肿瘤细胞生长受到抑制,而正常的哺乳细胞可正常增殖。相对于正常细胞,肿瘤细胞则依赖于大量的外源性预形成的l-met维持其生长。尤其是恶性程度高的肿瘤对l-met有更高的依赖性,如gbm、星形细胞瘤、前列腺癌、骨肉瘤和某些淋巴瘤等。肿瘤细胞对l-met的高需求部分与其增殖速率有关,因为l-met是产生l-半胱氨酸(l-cys)的必需物质,用于蛋白质合成以及谷胱甘肽(gsh)和抗氧化反应。同时l-met也被用于多胺合成和s-腺苷甲硫氨酸(sam),sam是dna和蛋白甲基化的主要甲基供体。异常的甲基化和增加的多胺合成是许多肿瘤的标志,也是导致肿瘤发生的已知因素。一些体内体外实验相继证实,直接食用甲硫氨酸缺乏的膳食可以延缓肿瘤细胞的增殖。但是若膳食中甲硫氨酸长期缺乏或不足,将会引起机体营养不良、代谢障碍,还可因dna 长期处于低甲基化状态加剧癌变。利用甲硫氨酸酶megl特异性地将甲硫氨酸分解,从而降低体内甲硫氨酸,则能更加有效地抑制肿瘤细胞生长或使之消退。但是,由于哺乳动物本身不表达甲硫氨酸酶,以外源性给予的方式有一定的副作用,往往引起机体的免疫反应,因此,探寻内源性表达甲硫氨酸酶是一种较好的选择。
5.癌症基因疗法的目的是将治疗性的基因引入肿瘤细胞中。这些被引入靶细胞中的治疗性基因可以纠正被突变的基因、抑制活跃的致癌基因或对细胞产生其它的性能等。适
合的外源治疗性基因包括但不限于免疫治疗性基因、抗血管生成性基因、化学保护性基因和“自杀”基因,并且可利用经修饰的病毒载体或非病毒方法(包括电穿孔、基因枪和脂质或聚合物包被)将它们引入细胞。对最优的病毒载体的要求包括找到特定靶细胞并在靶细胞中表达病毒基因组的有效能力。在过去的几十年中已经开发了病毒载体的所有这些特性并且在生物医学中广泛地研究了例如逆转录病毒、腺病毒、腺相关病毒和溶瘤性病毒载体等。因此,可以利用慢病毒载体过表达甲硫氨酸酶megl基因,以达到制备铁死亡诱导剂药物的目的。
技术实现要素:
6.本发明旨在提供甲硫氨酸酶在制备抗肿瘤的铁死亡诱导剂药物中的应用,为肿瘤患者治疗提供一种新的技术手段。
7.进一步地,所述甲硫氨酸酶为利用慢病毒为载体过表达外源甲硫氨酸酶megl基因。
8.进一步地,所述外源megl基因为甲硫氨酸γ-裂解酶基因(genbank:l43133.1)。
9.进一步地,所述megl基因表达后通过内源性消耗胞内甲硫氨酸而诱导肿瘤细胞铁死亡。
10.进一步地,所述肿瘤为神经胶质瘤,对应地,肿瘤细胞为神经胶质瘤。
11.本发明的有益效果:首次创造性的利用基因疗法过表达甲硫氨酸酶并确定其作为铁死亡诱导剂在神经胶质瘤中的应用,为以铁死亡为靶点的胶质瘤治疗提供了理论依据,也为神经胶质瘤的治疗提供了新思路。
12.上述药物或抑制剂的给药方式可通过多种途径进行给药,包括但不限于:口服给药、局部给药、注射给药(包括但不限于经静脉、腹膜、皮下、肌肉、瘤内、脊柱给药)等。
附图说明
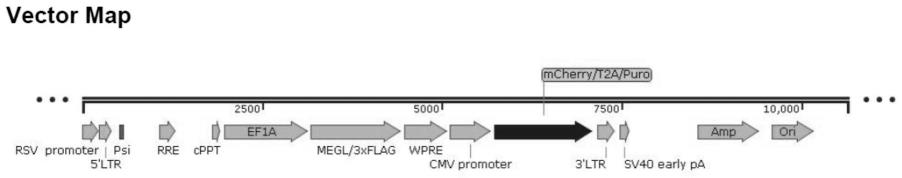
13.图1是过表达megl慢病毒载体构建图。
14.图2是pcr和western blot验证过表达megl慢病毒构建成功。其中,v组:空载对照病毒组;m为过表达megl慢病毒组。
15.图3是western blot检测铁死亡蛋白谷胱甘肽酶4(gpx4)的表达。其中,v组:空载对照病毒组;m为过表达megl慢病毒组。
具体实施方式
16.根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
17.实施例1:过表达megl慢病毒制备
18.1)病毒包装:转染前一天,接种293t细胞到培养皿中,接种细胞数量应以转染当天的细胞生长达到90%~95%融合为佳;转染当天,从293t细胞中去除培养液,加入10ml (10cm培养皿)病毒包装用培养液。按照下述方法制备磷酸钙-dna沉淀:a.钙-dna混合物:在一个5ml灭菌ep管中先加入cacl2,然后分别加入辅助质粒、目的基因质粒混匀。b.将含有
钙-dna混合物的离心管置于涡旋振荡器上,使液体产生涡旋,然后逐滴加入2
×
hbs,滴完后再涡旋几秒,静置5分钟。将磷酸钙-dna悬液倒入上述细胞的细胞培养基中,轻轻混匀培养基,放置37倒、5%co2饱和湿度培养箱中培养;转染4-6h后,吸除原培养液,加入10ml病毒包装用培养液,放置37包、5%co2饱和湿度培养箱中继续培养。
19.2)收集与浓缩病毒:转染后48h,收集含有病毒的培养液至50ml离心管中;低速离心病毒上清,去除细胞碎片,回收上清;用0.45μm的小滤器过滤,收集滤液;根据滤液体积加入对应量的peg6000和nacl溶液。充分均匀混合,静置放置于4℃沉淀过夜;次日4℃、1500
×
g离心30分钟后去除上清;用hbss溶解病毒沉淀,充分吹打沉淀至单个病毒悬液,然后将病毒分装至冻存管。
20.3)real time pcr鉴定病毒滴度:病毒感染1天前,将293t铺板于6孔板,每孔5 板,每5
×
105个/孔;接种细胞24h后,取两个孔的细胞用血球计数板计数,确定感染时细胞的实际数目,记为n。弃去其他培养板中的培养基,更换为含有终浓度 5μg/mlpolybrene的新鲜培养基。将浓缩病毒用培养基稀释200倍,也就是1μl,也病毒加入到199μl到基的培养基中。在3个培养孔中分别加入0.5μl、5μl和5μl的稀释病毒;感染开始后20h,除去培养上清,换为500μl含dnasei的新鲜培养基。在37℃消化15分钟,这一步是要除去残余的质粒dna。然后换为2ml正常的培养基,继续培养48h;用0.5ml 0.25%胰酶-edta溶液消化细胞,离心收集细胞。按照dneasy试剂盒的说明抽提基因组dna并进行实时荧光pcr扩增。滴度(integration units per ml, iu/ml)的计算公式如下:
21.iu/ml=(c
×n×d×
1000)/v
22.其中:c=平均每基因组整合的病毒拷贝数;n=感染时细胞的数目(约为1
×
106) d=病毒载体的稀释倍数;v=加入的稀释病毒的体积数。
23.实施例2:采用pcr和western blot鉴定过表达megl胶质瘤细胞甲硫氨酸酶的表达。
24.取病毒感染后生长良好的细胞,按照trizol法提取细胞总rna,取1μg总rna模板于体外逆转录为cdna。以cdna为模板,经预变性(94变,2min)、变性(94变,30s)、退火(55退、30s)、延伸(72延,1min)循环30次,终延伸(72伸,10min)完成扩增。将扩增产物经琼脂糖凝胶电泳跑胶,凝胶成像系统下曝光拍照。
25.其中,megl引物序列如下:
26.megl-f:cacttctacagccgcatctccaac
27.megl-r:gaccaccacaagcacatcactcc
28.结果如图3所示,pcr结果表明,m组在300-400bp检测到特异性的megl目的基因片段(387bp),该结果表明过表达megl病毒感染胶质瘤成功。取病毒感染后生长良好的细胞,加入200μl ripa裂解液,2μl pmsf,用干净的细胞刮将细胞刮下,转移入新1.5mlep管中。冰上裂解10min,超声破碎,超声3s间歇3s,共30s。4℃,12000rpm,离心 15min,取上清至另一干净的ep管,-20至保存。bca法检测总蛋白浓度。western blot检测megl,选用tubulin作为内参。结果如图3所示,m组在43kd左右检测到特异性条带(*表示甲硫氨酸酶蛋白条带),进一步表明过表达megl病毒感染成功。
29.实施例3:western blot鉴定过表达megl胶质瘤细胞铁死亡蛋白gpx4表达。
30.取第三代megl稳定表达株,加入200μl ripa裂解液,2μl pmsf,用干净的细胞刮将
细胞刮下,转移入新1.5ml ep管中。冰上裂解10min,超声破碎,超声3s间歇3s,共 30s。4℃,12000rpm,离心15min,取上清至另一干净的ep管,-20至保存。bca法检测总蛋白浓度。western blot检测gpx4,选用tubulin作为内参。结果如图3所示,在目的条带17kd处,m组蛋白表达量明显高于v组。
31.上述实验结果进一步说明,本发明所采用甲硫氨酸酶可以作为铁死亡诱导剂,为以铁死亡为靶点的胶质瘤治疗提供了理论依据具有抗肿瘤效果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1