预防或治疗脑和神经系统疾病的组合物的制作方法
1.本发明涉及一种用于预防或治疗脑和神经系统疾病的组合物。
背景技术:
2.在例如中风、痴呆和阿尔茨海默症的退行性脑和神经系统疾病中,由于神经元细胞的死亡和神经分支的萎缩,导致记忆、注意力、认知能力、情绪调节等的退化。神经元细胞中的神经分支伸长导致神经可塑性增加,从而在神经回路的记忆和学习功能中发挥重要作用。因此,可以预测,在神经细胞中促进神经分支伸长和神经再生的活性成分有潜力被开发成为针对退行性脑和神经系统疾病的新治疗剂。
3.随着老龄化人口迅速增加,退行性脑和神经系统疾病的发病率也呈上升趋势。尽管医学取得了创新的进展,但对退行性脑和神经系统疾病的预防和治疗方法尚未明确建立,也没有发现具有决定性作用的药物。目前正在开发治疗退行性脑和神经系统疾病的药物和治疗方法;然而,由于长期使用,它们往往表现出副作用和毒性,并且只起到缓解症状而不是治疗疾病的作用。因此,迫切需要开发一种既能达到治疗目的,又能降低副作用和毒性的材料。
4.技术问题
5.本发明的目的是提供一种能够用于多种用途的组合物,其能够用于预防、改善或治疗脑和神经系统疾病,特别是神经退行性疾病或神经炎症疾病。
6.然而,本发明要实现的技术问题不限于上述问题,本领域普通技术人员将从下面的描述清楚地理解未提及的其他问题。
7.技术问题的解决方案
8.根据本发明的一个实施方案,提供了一种用于预防、改善或治疗脑和神经系统疾病的组合物,其包括作为活性成分的结合分子,该结合分子特异性地结合存在于调节性t细胞(treg细胞)表面的富含亮氨酸和免疫球蛋白样结构域1(lrig
‑
1)蛋白。
9.如本文所用,术语“结合分子”是指包含完整免疫球蛋白的可变结构域,其包括单克隆抗体,例如嵌合、人源化或人单克隆抗体,或者与抗原结合的免疫球蛋白,例如与完整免疫球蛋白竞争结合a型流感病毒的单体ha或三聚体ha的免疫球蛋白片段。无论结构如何,一个抗原结合片段与完整免疫球蛋白识别的同一抗原结合。所述抗原结合片段可以包括肽或多肽,在结合分子的氨基酸序列之外,含有两个或更多连续残基的氨基酸序列,20个或更多连续氨基酸残基,25个或更多连续氨基酸残基,30个或更多连续氨基酸残基、35个或更多连续氨基酸残基、40个或更多个连续氨基酸残基、50个或更多个连续氨基酸残基、60个或更多个连续氨基酸残基、70个或更多个连续氨基酸残基、80个或更多个连续氨基酸残基、90个或更多个连续氨基酸残基、100个或更多个连续氨基酸残基、125个或更多个连续氨基酸残基、150个或更多个连续氨基酸残基、175个或更多个连续氨基酸残基、200个或更多个连续氨基酸残基、或250个或更多个连续氨基酸残基。术语“抗原结合片段”,特别是包括fab、f(ab')、f(ab')2、fv、dab、fd、互补决定区(cdr)片段、单链抗体(scfv)、二价(bivalent)单链
抗体、单链噬菌体抗体、双抗体(diabody)、三抗体、四抗体、含有一个或多个足以使特定抗原结合多肽的免疫球蛋白片段的多肽等。所述片段可以合成或通过酶促或化学消化完整的免疫球蛋白生产,或者可以通过使用重组dna技术通过基因工程方法生产。生产方法在本领域是众所周知的。
10.在本发明中,“lrig
‑
1蛋白”是存在于调节性t细胞表面上由1091个氨基酸组成的跨膜蛋白,并且由细胞外或腔侧的富含亮氨酸的重复序列(leucine
‑
rich repeat,lrr)和三个免疫球蛋白样结构域,细胞跨膜序列和细胞质尾部组成。lrig基因家族包括lrig1、lrig2和lrig3,其间的氨基酸高度保守。lrig1基因在正常皮肤中高度表达,可在基底细胞和毛囊细胞中表达以调节上皮干细胞的增殖。因此,lrig1基因在维持表皮的稳态中起重要作用,并且其缺失可能会产生牛皮癣或皮肤癌。据报道,当lrig1所在的染色体3p14.3部分被切断时,有可能发展成癌细胞。事实上,发现lrig1在肾细胞癌和皮肤鳞状细胞癌中的表达明显降低。最近发现,仅有约20%至30%的癌症表达lrig
‑
1。另一方面,为了本发明的目的,lrig
‑
1蛋白可以是但不限于存在于人或小鼠中的蛋白质。
11.在本发明中,lrig
‑
1蛋白可以是但不限于由seq id no:1所示的人衍生的多肽或由seq id no:3所示的小鼠衍生的多肽。
12.另外,在本发明中,由seq id no:1所示的lrig
‑
1蛋白可以由seq id no:2所示的多核苷酸编码,但不限于此。
13.另外,在本发明中,由seq id no:3所示的lrig
‑
1蛋白可以由seq id no:4所示的多核苷酸编码,但不限于此。
14.在本发明中,所述结合分子可以是包括下述的结合分子:
15.重链可变区,其包含由seq id no:5或13所示氨基酸序列组成的重链cdr1,由seq id no:6或14所示氨基酸序列组成的重链cdr2,以及由seq id no:7或15所示氨基酸序列组成的重链cdr3;和
16.轻链可变区,其包含由seq id no:8或16所示氨基酸序列组成的轻链cdr1,由seq id no:9或17所示氨基酸序列组成的轻链cdr2,和由seq id no:10或18所示氨基酸序列组成的轻链cdr3。
17.在本发明中,所述结合分子可以是包括下述的结合分子:
18.选自以下组的重链可变区:(a)含有由seq id no:5所示的重链cdr1,由seq id no:6所示的重链cdr2,和由seq id no:7所示的重链cdr3的重链可变区;和
19.(b)含有由seq id no:13所示的重链cdr1,由seq id no:14所示的重链cdr2,和由seq id no:15所示的重链cdr3的重链可变区;和
20.选自下组的轻链可变区:(c)包含由seq id no:8所示的轻链cdr1,由seq id no:9所示的轻链cdr2,和由seq id no:10所示的轻链cdr3的轻链可变区;和
21.(d)包含由seq id no:16所示的轻链cdr1,由seq id no:17所示的轻链cdr2,和由seq id no:18所示的轻链cdr3的轻链可变区。
22.在本发明中,结合分子可以是选自下组(1)和(2)的结合分子:
23.(1)包含含有由seq id no:5所示的重链cdr1,由seq id no:6所示的重链cdr2,和由seq id no:7所示的重链cdr3的重链可变区;和含有由seq id no:8所示的轻链cdr1,由seq id no:9所示的轻链cdr2,由seq id no:10所示的轻链cdr3的轻链可变区的结合分子;
和
24.(2)包含含有由seq id no:13所示的重链cdr1,由seq id no:14所示的重链cdr2,和由seq id no:15所示的重链cdr3的重链可变区;以及含有由seq id no:16所示的轻链cdr1,由seq id no:17所示的轻链cdr2,和由seq id no:18所示的轻链cdr3的轻链可变区的结合分子。
25.在本发明中,所述结合分子可以是包括下述的结合分子:
26.重链可变区,其由seq id no:11或19所示的氨基酸序列组成;和
27.轻链可变区,其由seq id no:12或20所示的氨基酸序列组成。
28.在本发明中,所述结合分子可以是选自下组的结合分子:
29.包含由seq id no:11所示的重链可变区,和由seq id no:12所示的轻链可变区的结合分子;和
30.包含由seq id no:19所示的重链可变区,和由seq id no:20所示的轻链可变区的结合分子;
31.在本发明中,所述结合分子可进一步包含片段结晶(fc)区或恒定区。其中,fc区可以是iga、igd、ige、igm、igg1、igg2、igg3或igg4抗体的fc区,或者可以从其衍生。或者,fc区可以是杂化fc(hybrid fc)区。
32.在本发明中,所述fc区可以是哺乳动物衍生的iga、igd、ige、igm、igg1、igg2、igg3或igg4抗体的fc区,并且优选地可以是人衍生的iga、igd、ige、igm、igg1、igg2、igg3或igg4抗体的fc区。然而,fc区域不限于此。
33.作为本发明的一个示例,所述恒定区可以是由seq id no:37所示的小鼠衍生的igg2a恒定区,但不限于此。
34.作为本发明的一个示例,所述恒定区可以是由seq id no:22所示的小鼠衍生的κ恒定区,但不限于此。
35.作为本发明的一个示例,所述恒定区可以是由seq id no:23或24所示的人衍生的igg1恒定区,但不限于此。
36.作为本发明的一个示例,所述恒定区可以是由seq id no:25所示的人衍生的κ恒定区,但不限于此。
37.作为本发明的一个示例,所述恒定区可以是由seq id no:26所示的人衍生的igg2恒定区,但不限于此。
38.作为本发明的一个示例,所述恒定区可以是由seq id no:27所示的人衍生的igg3恒定区,但不限于此。
39.作为本发明的一个示例,所述恒定区域可以是由seq id no:28所示的人衍生的igg4恒定区域,但不限于此。
40.作为本发明的一个例子,所述fc区可以是人衍生的免疫球蛋白λ恒定区,但不限于此。
41.在本发明中,所述“杂化fc”可以源自人igg亚类的组合或人igd和igg的组合。在杂化fc与生物活性分子、多肽等结合的情况下,杂化fc不仅具有增加生物活性分子的血清半衰期的效果,而且当编码fc
‑
多肽融合蛋白的核苷酸序列被表达时,还增加多肽的表达水平。
42.作为本发明的一个示例,杂化fc区可以是由seq id no:29所示的杂化fc,但不限于此。
43.在本发明的结合分子中,fc或恒定区可以通过接头(linker)连接到可变区。这里,所述接头可以与fc或恒定区域的c末端连接,并且本发明的结合分子的n
‑
末端可以与接头连接。然而,本发明不限于此。
44.在本发明中,所述“接头(linker)”可以含有可被在有靶疾病的组织或细胞中过表达的酶切割的序列。在接头可能被如上所述的过表达酶切割的情况下,可能会有效地防止多肽的活性因fc或恒定区而减少。在本发明中,所述接头的实例可以优选地是肽接头,其由血液中存在最丰富的人白蛋白的第282位至第314位部分的33个氨基酸组成,更优选地所述肽接头由位于人白蛋白的第292位至第304位部分的13个氨基酸组成。这一部分大多以三维结构暴露于外部,因此在体内诱导免疫反应的可能性最小。但是,所述接头不限于此。
45.本发明的结合分子可以进一步包含重链恒定区,其包含选自下组的氨基酸序列:seq id no:21、23、24、26、27、28和29。
46.本发明的结合分子可以进一步包含轻链恒定区,其包含选自下组的氨基酸序列:seq id no:22或25。。
47.本发明的结合分子可以进一步包括:
48.由seq id no:21所示的氨基酸序列组成的重链恒定区;和
49.由seq id no:22所示的氨基酸序列组成的轻链恒定区。
50.本发明的结合分子可以进一步包括:
51.由seq id no:23、24、26、27或28所示的氨基酸序列组成的重链恒定区;和
52.由seq id no:25所示的氨基酸序列组成的轻链恒定区。
53.本发明的结合分子可以进一步包括:
54.由seq id no:29所示的氨基酸序列组成的重链恒定区。
55.本发明的结合分子可以是选自下组的结合分子:
56.包含由seq id no:30所示的重链,和由seq id no:31所示的轻链的结合分子;
57.包含由seq id no:32所示的重链,和由seq id no:33所示的轻链的结合分子;和
58.包含由seq id no:34所示的重链,和由seq id no:35所示的轻链的结合分子;
59.本发明的结合分子的特征为抗体,但不限于此。所述抗体包括所有单克隆抗体、全长抗体或作为抗体一部分的抗体片段,具有结合lrig
‑
1蛋白的能力,并且可以与本发明的结合分子竞争结合lrig
‑
1上的表位。
60.如本文所用,术语“抗体”是指用作特异性识别抗原的受体的蛋白质分子,包括与特定抗原具有免疫反应性的免疫球蛋白分子。为了本发明的目的,抗原可以是存在于调节性t细胞表面上的lrig
‑
1蛋白质。优选地,抗体可以特异性识别lrig
‑
1蛋白的富含亮氨酸的区域或免疫球蛋白样结构域,但不限于此。
61.在本发明中,所述“免疫球蛋白”具有重链和轻链,并且每个重链和轻链包括恒定区和可变区。每个轻链和重链的可变区包含三个高变区,称为互补决定区(下文中称为“cdr”)和四个框架区。cdr主要作用是与抗原上的表位结合。每种链的cdr通常从n
‑
末端开始依次称为cdr1、cdr2和cdr3,并且还由特定cdr所在的链来区分。
62.另外,如本文所用,术语“单克隆抗体”是指从基本相同的抗体群体获得的单分子
组分的抗体分子,并且对特定表位具有单一结合特异性和亲和力。
63.在本发明中,所述“全长抗体”的结构中具有两个全长轻链和两个全长重链,其中每个轻链通过二硫键连接到重链,包括iga、igd、ige、igm和igg。igg包括其亚型,igg1、igg2、igg3和igg4。
64.另外,如本文所用,术语“抗原片段”是指保留抗原结合功能的片段,并且包括fab、fab'、f(ab')2、fv等。所述fab的结构中具有轻链和重链的可变区,轻链的恒定区,和重链的第一恒定区(ch1结构域),并具有一个抗原结合位点。此外,fab'与fab不同的点在于fab'在重链ch1结构域的c
‑
末端具有包含至少一个半胱氨酸残基的铰链区域。f(ab')2抗体通过在fab’铰链区的半胱氨酸残基处形成二硫键来生产。fv(可变片段(variable fragment))是指仅具有重链可变区和轻链可变区的最小抗体片段。双链fv(dsfv)被配置为重链可变区和轻链可变区通过二硫键彼此连接,并且单链fv(scfv)被配置为重链可变区域和轻链可变区彼此共价连接,通常通过肽接头连接。抗体片段可通过fab或f(ab')2片段在使用蛋白水解酶(例如木瓜蛋白酶或胃蛋白酶)的情况下获得,并且可以通过基因重组技术生产。
65.此外,在本发明中,抗体可以是但不限于嵌合抗体、人源化抗体、二价抗体、双特异性分子、微抗体、域抗体、双特异性抗体、抗体模拟物、单抗体、双抗体、三抗体、或四抗体,或其片段。
66.在本发明中,“嵌合抗体”是通过重组小鼠抗体的可变区和人抗体的恒定区而获得的抗体,并且与小鼠抗体相比具有大大改善的免疫应答。
67.另外,如本文所用,术语“人源化抗体”是指通过改变衍生自非人类物种的抗体的蛋白质序列,使得蛋白质序列类似于在人体中天然产生的抗体变体而获得的抗体。例如,人源化抗体可以如下制备。可以用人抗体衍生的fr和小鼠衍生的cdr重组以制备人源化的可变区,并且人源化可变区可以与优选的人抗体的恒定区重组以制备人源化抗体。
68.在本发明中,结合分子可以以双特异性抗体或双特异性抗原结合片段的形式提供,其能够与lrig
‑
1蛋白结合并与另一种蛋白质结合。
69.在本发明中,双特异性抗体和双特异性抗原结合片段可包含本发明的结合分子。作为本发明的一个示例,双特异性抗体和双特异性抗原结合片段包含能够结合lrig
‑
1蛋白的抗原结合结构域,其中能够与lrig
‑
1蛋白结合的抗原结合结构域可包含或由本发明的结合分子组成。
70.本发明提供的双特异性抗体和双特异性抗原结合片段包括抗原结合域,该抗原结合域是能够结合本发明所述lrig
‑
1蛋白的结合分子,以及能够结合另一个靶蛋白的抗原结合域。这里,能够结合另一种靶蛋白的抗原结合结构域可以是能够与除lrig
‑
1蛋白之外的蛋白(例如pd
‑
1或细胞表面受体)结合的抗原结合结构域。然而,所述抗原结合域并不局限于此。
71.本发明的双特异性抗体和双特异性抗原结合片段可以以任何合适的形式提供,例如,在kontermann mabs 2012,4(2):182
‑
197中所述,其通过引用整体并入本文。例如,双特异性抗体或双特异性抗原结合片段可以是双特异性抗体缀合物(例如igg2、f(ab’)2或covx
‑
体)、双特异性igg或igg样分子(例如igg、scfv4
‑
ig、igg
‑
scfv、scfv
‑
igg、dvd
‑
ig、igg
‑
svd、svd
‑
igg,或2合1
‑
igg(2in 1
‑
igg)、mab2或tandemab通用lc),不对称双特异性igg或igg样分子(例如,kih igg、kih igg通用lc、crossmab、igg
‑
scfab、mab
‑
fv、电荷对或
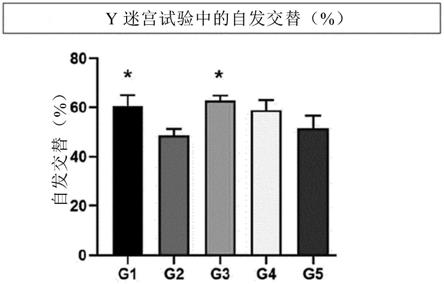
seed
‑
体),小双特异性抗体分子(例如双体抗体(db)、dsdb、dart、scdb、tandab、串联scfv(tafv)、串联dab/vhh、三体、三头、fab
‑
scfv或f(ab')2
‑
scfv2)、双特异性fc和ch3融合蛋白(例如tafv
‑
fc、双
‑
双体抗体、scdb
‑
ch3、scfv
‑
fc
‑
scfv、hcab
‑
vhh、scfv
‑
kih
‑
fc或scfv
‑
kih
‑
ch3),或双特异性融合蛋白(例如scfv2
‑
白蛋白、scdb
‑
白蛋白、tafv毒素、dnl
‑
fab3、dnl
‑
fab4
‑
igg、dnl
‑
fab4
‑
igg
‑
细胞因子2)。特别地,参见kontermann mabs2012,4(2):182
‑
19中的图2。根据本发明的双特异性抗体和双特异性抗原结合片段可以由本领域技术人员设计和制备。
72.在本发明中制备双特异性抗体的方法包括形成还原二硫化物或非还原硫醚键,以及如上所述的抗体或抗体片段的化学交联,例如,在segal和bast,2001,双特异性抗体的生产,《免疫学最新实验方法》,14:iv:2.13:2.13.1
‑
2.13.16中所述,其全部内容通过引用并入本文。例如,n
‑
琥珀酰亚胺基
‑3‑
(
‑2‑
吡啶二硫基)
‑
丙酸酯(spdp)可以被用于例如通过铰链区的sh
‑
基团化学交联fab片段,以产生二硫化物连接的双特异性f(ab)2异二聚体。
73.另外,用于在本发明中制备双特异性抗体的替代方法包括将产生抗体的杂交瘤与例如聚乙二醇融合,以产生能够分泌双特异性抗体的杂交瘤细胞,如d.m.和bast,b.j.2001,双特异性抗体的生产,《免疫学最新实验方法》,14:iv:2.13:2.13.1
–
2.13.16中所述。
74.根据本发明的双特异性抗体和双特异性抗原结合片段也可以通过,例如编码抗原结合分子的多肽的核酸构建体表达来重组生产,如《抗体工程:方法和方案》,第二版(humana出版社,2012),第40章:生产双特异性抗体:二抗体和串联scfv(hornig和farber
‑
schwarz),或french,如何制备双特异性抗体,分子医学方法,2000;40:333
‑
339中所述,两者在此通过引用整体并入本文。
75.例如,可以通过分子克隆技术制备dna构建物,其包含编码两个抗原结合域的轻链和重链可变域序列(即,能够结合pd
‑
1抗原结合域的轻链和重链可变域,和能够结合另一靶蛋白的抗原结合片段的轻链和重链可变域),并包含编码在抗原结合域之间的合适的接头或二聚结构域的序列。随后,重组双特异性抗体可以通过在合适的宿主细胞(例如,哺乳动物宿主细胞)中的构建体(例如,在体外)表达生产,然后表达的重组双特异性抗体可以被任选地纯化。
76.抗体可以通过亲和成熟过程生产,其中生产的修饰抗体与未修饰的亲本抗体相比,具有改善的抗原亲和力。亲和成熟的抗体可以通过本领域已知的方法产生,例如,在marks等,rio/technology,10:779
‑
783(1992);和barbas等,美国科学院学报91:3809
‑
3813(1994);schier等,gene 169:147
‑
155(1995);yelton等人,j.immunol.,155:1994
‑
2004(1995);jackson等,j.immunol.,154(7):3310
‑
159(1995);以及hawkins等,j.mol.biol.,226:889
‑
896(1992)中所述。
77.另外,本发明中提供的结合分子可包括氨基酸序列的变体,只要该变体可以特异性结合lrig
‑
1蛋白。例如,为了改善抗体的结合亲和力和/或其他生物学性质,可以对抗体的氨基酸序列进行修饰。这种修饰包括例如抗体的氨基酸序列残基的缺失、插入和/或替换。
78.这种氨基酸变化是基于氨基酸侧链取代基的相对相似性,例如疏水性、亲水性、电荷和大小。根据对氨基酸侧链取代基的大小、形状和类型的分析,可以看出精氨酸、赖氨酸
和组氨酸是带正电荷的残基;丙氨酸、甘氨酸和丝氨酸具有相似的大小;以及苯丙氨酸、色氨酸和酪氨酸具有相似的形状。因此,基于这些考虑,可以说精氨酸、赖氨酸和组氨酸;丙氨酸、甘氨酸和丝氨酸;以及苯丙氨酸、色氨酸和酪氨酸是生物功能性的等同物。
79.在引入变化时,可以考虑氨基酸的亲水性指数(hydropathic index)。每种氨基酸根据其疏水性和电荷分配了亲水性指数:异亮氨酸(+4.5);缬氨酸(+4.2);亮氨酸(+3.8);苯丙氨酸(+2.8);半胱氨酸/胱氨酸(+2.5);甲硫氨酸(+1.9);丙氨酸(+1.8);甘氨酸(
‑
0.4);苏氨酸(
‑
0.7);丝氨酸(
‑
0.8);色氨酸(
‑
0.9);酪氨酸(
‑
1.3);脯氨酸(
‑
1.6);组氨酸(
‑
3.2);谷氨酸(
‑
3.5);谷氨酰胺(
‑
3.5);天冬氨酸(
‑
3.5);天冬酰胺(
‑
3.5);赖氨酸(
‑
3.9);和精氨酸(
‑
4.5)。亲水性氨基酸指数在赋予蛋白质相互作用的生物学功能方面具有重要意义。已知用具有相似亲水性指数的氨基酸的取代使得蛋白保留类似的生物活性。在参考亲水性指数引入变化的情况下,取代在亲水性指数差异优选在
±
2内,更优选在
±
1内,甚至更优选在
±
0.5内的氨基酸之间进行。
80.同时,众所周知,具有相似亲水性值的氨基酸之间的取代会导致具有等效生物活性的蛋白。如在美国专利no.4,554,101中所公开的,各各自的氨基酸残基已被分配以下亲水性值:精氨酸(+3.0);赖氨酸(+3.0);天冬氨酸(+3.0
±
1);谷氨酸(+3.0
±
1);丝氨酸(+0.3);天冬酰胺(+0.2);谷氨酰胺(+0.2);甘氨酸(0);苏氨酸(
‑
0.4);脯氨酸(
‑
0.5
±
1);丙氨酸(
‑
0.5);组氨酸(
‑
0.5);半胱氨酸(
‑
1.0);甲硫氨酸(
‑
1.3);缬氨酸(
‑
1.5);亮氨酸(
‑
1.8);异亮氨酸(
‑
1.8);酪氨酸(
‑
2.3);苯丙氨酸(
‑
2.5);色氨酸(
‑
3.4)。在参考亲水性指数引入变化的情况下,取代在亲水性指数差异优选在
±
2内,更优选在
±
1内,甚至更优选在
±
0.5内的氨基酸之间进行。
81.本领域已知,蛋白中的氨基酸变换不会完全改变分子的活性(h.neurath,r.l.hill,the proteins,学术出版社,纽约(1979))。最常见的变换是氨基酸残基ala/ser、val/ile、asp/glu、thr/ser、ala/gly、ala/thr、ser/asn、ala/val、ser/gly、tyr/phe、ala/pro、lys/arg、asp/asn、leu/ile、leu/val、gln/glu之间的变换。
82.鉴于上述具有生物等效活性的变化,其可以被解释为本发明的结合分子还包括与序列表中列出的序列具有实质性同一性的序列。
83.如本文所用,术语“实质性同一性”是指当本发明的序列与任何其他序列比对时,序列显示至少61%的同源性,更优选70%的同源性,更优选80%的同源性,最优选90%的同源性,使得它们最大限度地彼此对应,并且通过使用本领域通常使用的算法来分析比对序列。用于比较序列的比对方法是本领域已知的。用于比对的各种方法和算法在smith和waterman,adv.appl.math.2:482(1981);needleman和wunsch,j.mol.bio.48:443(1970);pearson和lipman,methods in mol.biol.24:307
‑
31(1988年);higgins和sharp,gene73:237
‑
44(1988);higgins和sharp,cabios 5:151
‑
3(1989);corpet等人,nuc.acids res.16:10881
‑
90(1988);huang等人,comp.appl.biosci.8:155
‑
65(1992);和pearson等人,meth.mol.biol.24,307
‑
31(1994)中公开。ncbi基本局部比对搜索工具(blast)(altschul等人,j.mol.biol.215:403
‑
10(1990))可从国家生物信息中心(nbci)等访问,并且可以与互联网上的blastp、blasm、blastx、tblastn和tblastx相结合使用。blsat可在http://www.ncbi.nlm.nih.gov/blast/中访问。序列同源性比较方法可以使用此程序在线识别(http://www.ncbi.nlm.nih.gov/blast/blast_help.html)。
84.在本发明中,结合分子优选抗体,可以通过生产抗体的传统方法生产,并且可以通过亲和成熟生产。
85.如本文所用,术语“亲和力成熟”是指在免疫反应过程中活化的b细胞产生对抗原具有增强亲和力的抗体的过程。出于本发明的目的,亲和力成熟允许抗体或抗体片段由于亲和力成熟而产生,这一亲和力成熟基于发生在自然界相同过程的突变和选择原则。
86.本发明提供的结合分子,优选抗体,可以有效地预防、改善或治疗脑和神经系统疾病,特别是神经退行性疾病或神经炎症性疾病。
87.根据本发明的另一个实施方案,提供了一种用于预防、改善或治疗脑和神经系统疾病的组合物,其包括编码本发明提供的结合分子的核酸分子;插入所述核酸分子的表达载体;或转染有表达载体的宿主细胞系作为活性成分。
88.本发明的核酸分子包括通过将本发明提供的结合分子的氨基酸序列翻译成的多核苷酸序列而获得的所有核酸分子,正如本领域技术人员所已知的。因此,可以通过开放阅读框(orf)制备各种多核苷酸序列,并且所有这些多核苷酸序列也包括在本发明的核酸分子中。
89.在本发明中,“载体”是能够运输与其连接的另一核酸的核酸分子。其中一种载体是“质粒”,它是指环状的双链dna,其中可以连接额外的dna片段。另一种载体是噬菌体载体。再一种载体是病毒载体,可以将额外的dna片段可以连接到病毒基因组中。某些载体能够在它们被引入的宿主细胞中自主复制(例如,具有细菌复制起源的细菌载体和游离型哺乳动物载体)。在引入宿主细胞时,可以将其他载体(例如,非游离型哺乳动物载体)整合到宿主细胞的基因组中,从而与宿主基因组一起复制。此外,某些载体能够指导与它们可操作地连接的基因的表达。这样的载体在本文中被称为“重组表达载体”或简称“表达载体”。一般来说,用于重组dna技术的表达载体通常以质粒的形式存在。在本说明书中,“质粒”和“载体”可以互换使用,因为质粒是最常用的载体形式。
90.本发明中表达载体的具体实例可选自但不限于下组:商业上广泛使用的pcdna载体、f、r1、rp1、col、pbr322、tol、ti载体;粘粒;噬菌体,如λ、λ字型(lambdoid)、m13、mu、p1 p22、qμμ、t
‑
even、t2、t3、t7;植物病毒。本领域技术人员已知的任何表达载体作为表达载体都可以用于本发明,并且根据目标宿主细胞的性质选择表达载体。宿主细胞中载体的导入可以通过磷酸钙转染、病毒感染、deae
‑
葡聚糖介导的转染,脂质体转染或电穿孔来进行。然而,本发明不限于此,本领域技术人员可以采用和使用适合于使用的表达载体和宿主细胞的导入方法。该载体可优选地包含至少一个选择标记。然而,本发明不限于此,并且根据是否生产产品,可以使用不包含选择标记的载体进行选择。根据目标宿主细胞来选择选择标记,其使用本领域技术人员已知的方法进行,因此本发明对此没有限制。
91.为了便于纯化本发明的核酸分子,可以将标签序列插入表达载体并融合到表达载体上。所述标签包括但不限于六组氨酸标签、血凝素标签、myc标签或flag标签,本领域技术人员已知的任何有助于纯化的标签均可用于本发明中。
92.在本发明中,所述“宿主细胞”包括单个细胞或细胞培养物,其可以是或已经是多肽插入物掺入载体的受体(recipient)。宿主细胞包括单个宿主细胞的子代,并且由于自然的、偶然的或有意的突变,子代不一定与原始亲本细胞完全相同(在形态或基因组dna补体上)。宿主细胞包括用本文的多核苷酸在体内转染的细胞。
93.在本发明中,宿主细胞可包括哺乳动物、植物、昆虫、真菌或细胞来源的细胞,并且可以是例如细菌细胞,如大肠杆菌、链霉菌、鼠伤寒沙门氏菌;真菌细胞如酵母细胞和毕赤酵母(pichia pastoris);昆虫细胞如果蝇和夜蛾sf9细胞;动物细胞如中国仓鼠卵巢(cho)细胞、sp2/0(小鼠骨髓瘤)、人淋巴细胞、cos、nso(小鼠骨髓瘤)、293t、鲍氏黑色素瘤(bowes selanoma)细胞、ht
‑
1080、幼仓鼠肾(baby hamster kidney,bhk)细胞、人胚胎肾(hek)细胞,或perc.6(人视网膜细胞);或植物细胞。然而,宿主细胞不限于此,本领域技术人员已知的可用作宿主细胞系的任何细胞都是可用的。
94.根据本发明的又一个实施方案,提供了一种用于预防、改善或治疗脑和神经系统疾病的组合物,其包含抗体
‑
药物偶联(adc)作为活性成分,所述抗体
‑
药物偶联物包含本发明中提供的抗体和药物。
95.如本文所用,术语“抗体
‑
药物偶联物(adc)”是指药物和抗体彼此化学连接,而不降低抗体和药物的生物活性的形式。在本发明中,抗体
‑
药物缀合物表示一种药物与抗体的重链和/或轻链的n
‑
末端氨基酸残基结合的形式,具体地,一种药物与抗体的重链和/或轻链的n
‑
末端的α
‑
胺基结合的形式。
96.如本文所用,术语“药物”可指具有对细胞有某种生物活性的任何物质,这一概念包括dna、rna或肽。所述药物可以具有包含能够与α
‑
胺基反应并交联的反应基团的形式,还包括包含能够与α
‑
胺基反应并交联的反应基团并与接头相连的形式。
97.在本发明中,能够与α
‑
胺基团反应和交联的反应基团的例子在类型上没有特别限制,只要反应基团能够与抗体的重链或轻链的n
‑
端的α
‑
胺基团反应和交联即可。反应性基团包括本领域已知的与胺基反应的所有类型。反应性基团可以是例如异硫氰酸酯、异氰酸酯、酰基叠氮化物、nhs酯、磺酰氯、醛、乙二醛、环氧化物、环氧乙烷、碳酸盐、芳基卤化物、亚胺酯、碳二酰亚胺、酸酐和氟苯基酯中的任何一个,但是不限于此。
98.在本发明中,药物可以包括无论何种类型的任何药物,只要所述药物能够治疗脑和神经系统疾病,特别是神经退行性疾病或神经炎症疾病。
99.通过本发明提供的组合物预防、改善或治疗的脑和神经系统疾病可以是神经退行性疾病或神经炎症疾病。
100.在本发明中,所述“神经退行性疾病”可指由神经元功能下降或丧失引起的疾病,而“神经炎症性疾病”可指由神经系统中的过度炎症反应引起的疾病。作为具体实例,本发明中的神经退行性疾病或神经炎症性疾病可选自但不限于下组:中风、痴呆、阿尔茨海默病、帕金森病、亨廷顿病、尼曼
‑
皮克病(niemann
‑
pick disease)、多发性硬化、朊病毒病、克雅氏病(creutzfeldt
‑
jakob disease)、额颞叶痴呆、路易体痴呆、肌萎缩性侧索硬化症、副肿瘤综合征、皮质变性综合征、多系统萎缩、进行性核上性麻痹、神经系统自身免疫性疾病、脊髓小脑共济失调、炎症性和神经病理性疼痛、脑血管病、脊髓损伤和tau蛋白病(tauopathy)。
101.此外,本发明提供的组合物可用作药物组合物或食品组合物。然而,本发明不限于此。
102.在本发明中,所述“预防”可以包括但不限于,使用本发明的药物组合物阻断由神经退行性疾病或神经炎性疾病引起的症状、或抑制或延缓疾病症状的任何行为。
103.在本发明中,所述“治疗”或“改善”可以包括但不限于,使用本发明的药物组合物
能够改善或有利地改变由神经退行性疾病或神经炎性疾病引起的症状的任何行为。
104.在本发明中,所述药物组合物的特征可以为胶囊、片剂、颗粒剂、注射剂、软膏、粉末或饮料的形式,并且所述药物组合物的特征可以是靶向人体的。
105.本发明的药物组合物可以以口服制剂的形式配制,如粉末、颗粒剂、胶囊、片剂和水悬液,按照常规方法分别以外用制剂、栓剂和无菌注射溶液的形式制备并使用。然而,所述药物组合物不限于此。本发明的药物组合物可进一步包含药学上可接受的载体。作为药学上可接受的载体,粘合剂、助溶剂、崩解剂、赋形剂、增溶剂、分散剂、稳定剂、悬浮剂、颜料、香料等可用于口服给药;缓冲液、保存剂、疼痛缓解剂、增溶剂、等渗剂、稳定剂等可用于注射混合物;以及碱、赋形剂、润滑剂、保存剂等可用于局部给药。通过与如上所述的药学上可接受的载体混合,可以以各种方式制备本发明的药物组合物的制剂。例如,对于口服给药,药物组合物可以以片剂、锭剂、胶囊、酏剂、悬浮液、糖浆、晶片等形式配制。对于注射,药物组合物可以以单位剂量安瓿或多种剂型的形式配制。或者,可以将药物组合物配制成溶液、悬浮液、片剂、胶囊、缓释制剂等。
106.同时,作为适于制备制剂的载体、稀释剂或赋形剂的例子,乳糖、葡萄糖、蔗糖、山梨糖醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯树胶(gum acacia)、海藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡啶酮、水、羟苯甲酸甲酯、羟基苯甲酸丙酯、滑石粉、硬脂酸镁、矿物油等可以被使用。另外,还可以包括填料、抗凝剂、润滑剂、润湿剂、香料、乳化剂、防腐剂等。
107.本发明的药物组合物的给药途径包括但不限于口服、静脉、肌肉内、动脉内、髓内、硬膜内、心内、经皮、皮下、腹腔内、鼻腔内、肠道、局部、舌下或直肠途径。口服或肠胃外给药是优选的。
108.在本发明中,所述“肠胃外”包括皮下、皮内、静脉、肌肉内、关节内、囊内、胸骨内、硬膜内、病灶内和颅内注射或输液技术。本发明的药物组合物也可以以栓剂的形式用于直肠给药。
109.本发明的药物组合物可以根据各种因素而变化,包括所使用的某种化合物的活性、患者年龄、体重、一般健康状况、性别、饮食、给药时间、给药途径、排泄速率、药物组合,以及待预防或治疗某种疾病的严重程度。药物组合物的剂量取决于患者的病症、体重、疾病严重程度、药物形式、给药途径和持续时间,并且可以由本领域技术人员适当地选择。药物组合物可以每天以0.0001至50mg/kg或0.001至50mg/kg施用。给药可以每天一次或每天几次。剂量不旨在任何情况下限制本发明的范围。本发明的药物组合物可以以药丸、糖衣片剂、胶囊、液体、凝胶、糖浆、浆料或悬浮液的形式配制。
110.包含本发明组合物的食品组合物可以以各种食品的形式制备,例如饮料、口香糖、茶、维生素复合物、粉末、颗粒、片剂、胶囊、糖膏、年糕、面包等。本发明的食品组合物由毒性和副作用小的植物提取物组成,因此在为了预防目的而长期摄取的情况下可以放心使用。
111.当本发明的组合物包含在食品组合物中时,其添加量可相当于总重量的0.1%至50%。
112.此处,在以饮料形式制备食物组合物的情况下,除了饮料以指定比例包含食物组合物之外,没有特别的限制,并且饮料可以包含各种调味剂、天然碳水化合物等作为附加成分,类似于传统饮料。即,天然碳水化合物的例子可以包括单糖如葡萄糖,双糖如果糖,多糖
如蔗糖,常规糖如糊精和环糊精,以及糖醇如木糖醇、山梨醇和赤藓糖醇。所述调味剂的实例可以包括天然调味剂(索马甜(thaumatin)、甜叶菊提取物(如莱鲍迪苷a)、甘草甜素等)和合成调味剂(糖精、阿斯巴甜等)。
113.此外,本发明的食品组合物可以含有多种营养素、维生素、矿物质(电解质)、香料如合成香料和天然香料、着色剂、果胶酸及其盐、海藻酸及其盐、有机酸、保护性胶体增稠剂、ph调节剂、稳定剂、防腐剂、甘油、醇、碳酸饮料中使用的碳酸剂等。
114.这些成分可以单独使用,也可以组合使用。这样的添加剂的比例不是很重要,并且通常选择在每100重量份本发明组合物0.1至约50重量份的范围内。
115.根据本发明的又一个实施方案,提供了一种用于预防、改善或治疗脑和神经系统疾病的方法,包括向需要的个体施用本发明提供的结合分子;编码所述结合分子的核酸分子;插入所述核酸分子的表达载体;转染所述表达载体的宿主细胞系;或本发明提供的抗体
‑
药物结合物(adc)的施用步骤。
116.在本发明中,所述“个人”是疑似患有脑和神经系统疾病的个体,并且所述怀疑患有脑和神经系统疾病的个体是指已经患有或可能患有所述疾病的哺乳动物,例如小鼠和家畜,包括人。然而,任何可以用本发明提供的活性物质治疗的个体都包括在其中,但不限于此。
117.通过本发明的方法治疗的脑和神经系统疾病可以是神经退行性疾病或神经炎症性疾病。作为具体实例,本发明中的神经退行性疾病或神经炎症性疾病可选自但不限于下组:中风、痴呆、阿尔茨海默病、帕金森病、亨廷顿病、尼曼
‑
皮克病(niemann
‑
pick disease)、多发性硬化、朊病毒病、克雅氏病(creutzfeldt
‑
jakob disease)、额颞叶痴呆、路易体痴呆、肌萎缩性侧索硬化症、副肿瘤综合征、皮质变性综合征、多系统萎缩、进行性核上性麻痹、神经系统自身免疫性疾病、脊髓小脑共济失调、炎症性和神经病理性疼痛、脑血管病、脊髓损伤和tau蛋白病(tauopathy)。
118.本发明的方法可以包括以药学有效量施用本发明提供的结合分子;编码所述结合分子的核酸分子;插入所述核酸分子的表达载体;转染所述表达载体的宿主细胞系;或本发明提供的抗体
‑
药物结合物(adc)的步骤。
119.合适的每日施用总量可以由参与的医师或兽医在适当的医疗判断范围内决定,并且可以分一次或几次进行给药。然而,出于本发明的目的,特定患者的特异性治疗有效量优选地根据各种因素不同地应用,所述因素包括要达到的类型和反应程度,包含上述特异性活性成分的组合物,包括是否视情况与其他药剂一起使用、患者的年龄、体重、一般健康状况、性别和饮食、给药时间、给药途径、包含上述特异性活性成分的组合物的分泌率、治疗持续时间,以及同时使用的药物或与特定组合物联合使用,以及医学领域中众所周知的类似因素。
120.同时,用于预防或治疗脑和神经系统疾病的方法可以是但不限于联合疗法,包括进一步施用对一种或多种疾病具有治疗活性的化合物或物质。
121.在本发明中,“联合”应理解为表示同时、单独或顺序给药。在顺序或单独的方式给药的情况下,应间隔施用第二组分,使其不失去联合的有益效果。
122.在本发明中,所述结合分子或抗体
‑
药物偶联物的剂量可以是但不限于约0.0001μg至500mg每kg患者体重。
123.根据本发明的又一个实施方案,提供了一种用于脑和神经系统疾病的诊断组合物,包括本发明中提供的结合分子。
124.在本发明中,所述“诊断”是指识别病理状态的存在或特征。为了本发明的目的,诊断旨在确定是否已经发生了脑和神经系统疾病,特别是神经退行性疾病或神经炎症疾病。
125.在本发明中,可以通过使用结合分子测量lrig
‑
1蛋白的表达水平来诊断脑和神经系统疾病。
126.根据本发明的又一实施方案,提供了一种用于脑和神经系统疾病的诊断试剂盒,包括本发明的诊断组合物。
127.在本发明中,术语“试剂盒”是指特定目的所需的一组组合物和附件。为了本发明的目的,本发明的试剂盒可以通过检查lrig
‑
1蛋白的表达水平来诊断疾病。本发明的试剂盒不仅可以包括选择性识别免疫相关疾病诊断标记物的引物、探针或抗体,用于测量标记物的表达水平,还可以包括一种或多种适用于测定方法的其它组分组合物、溶液或装置。
128.在本发明中,试剂盒可以是但不限于rt
‑
pcr试剂盒、dna芯片试剂盒、elisa试剂盒、蛋白质芯片试剂盒、快速试剂盒或多重反应监测(mrm)试剂盒。
129.本发明的诊断试剂盒可进一步包括一种或多种适用于分析方法的其它组分组合物、溶液或装置。
130.例如,本发明的诊断试剂盒可进一步包括进行逆转录聚合酶反应所需的必需元件。逆转录聚合酶反应试剂盒包括对编码标记蛋白的基因特异的引物。该引物是具有对该基因的核酸序列特异的序列的核苷酸,并且可以具有约7bp至50bp,更优选约10bp至30bp的长度。该试剂盒还可以包括对对照基因的核酸序列特异的引物。此外,用于逆转录聚合酶反应的试剂盒可以包括试管或其他合适的容器、反应缓冲液(具有不同的ph和镁浓度)、脱氧核苷酸(dntps)、酶如taq
‑
聚合酶和逆转录酶、dnase和rnase抑制剂、depc处理的水、无菌水等。
131.此外,本发明的诊断试剂盒可包括进行dna芯片分析所需的基本元件。所述dna芯片试剂盒可以包括与基因或其片段对应的cdna或寡核苷酸连接的底物;制备荧光标记探针的试剂、药剂和酶;等等。所述底物还可以含有对应于对照基因或其片段的cdna或寡核苷酸。
132.此外,本发明的诊断试剂盒可包括进行elisa所需的基本元件。该elisa试剂盒包括对标记蛋白特异性的抗体。所述抗体是对标记蛋白具有高特异性和亲和力且与其他蛋白交叉反应性小的抗体,包括单克隆抗体、多克隆抗体或重组抗体。该elisa试剂盒还可以包括针对对照蛋白的特异性抗体。除了上述的试剂盒之外,elisa试剂盒可以包括能够检测结合抗体的试剂,例如,标记的二级抗体、发色团、酶(例如,与抗体结合)及其底物,以及能够与抗体结合的其他物质。
133.根据本发明的又一个实施方案,提供了一种用于提供关于脑和神经系统疾病诊断的信息的方法,包括通过使用本发明提供的结合分子来测量目标个体的生物样品中存在的lrig
‑
1蛋白的表达水平的步骤。
134.在本发明中,“目标个体”是指不确定脑和神经系统疾病,特别是神经退行性疾病或神经炎症疾病是否已经发生并且具有发生该疾病的高概率的个体。
135.在本发明中,“生物样本”可指任何材料、组织、细胞、全血、血清、血浆、组织活检样
本(脑、皮肤、淋巴结、脊髓等)、细胞培养上清、破裂的真核细胞、细菌表达系统等,其从个体获得或来源于个体,优选调节性t细胞。
136.在本发明中,用于测量或比较分析lrig
‑
1蛋白表达水平的方法的实例包括但不限于蛋白芯片分析、免疫分析、配体结合分析、基质辅助激光解吸/电离飞行时间质谱(maldi
‑
tof)、磺胺增强激光解吸/电离飞行时间质谱(seldi
‑
tof)、放射免疫分析、径向免疫扩散、免疫双扩散(ouchterlony)、火箭免疫电泳、免疫组织化学染色、补体结合分析、双向电泳、液相色谱
‑
质谱(lc
‑
ms)、液相色谱
‑
质谱/质谱(lc
‑
ms/ms)、蛋白印迹和酶联免疫吸附试验(elisa)。
137.在本发明中,所述方法可以包括以下步骤:在与正常对照相比,当个体的生物样本测量的lrig
‑
1蛋白表达水平增加或减少的情况下,预测目标个体具有发生神经退行性疾病或神经炎症性疾病的高概率。
138.在本发明中,作为要通过诊断组合物、诊断试剂盒或信息提供方法诊断的脑和神经系统疾病可以是神经退行性疾病或神经炎症性疾病。作为具体实例,神经退行性疾病或神经炎症可选自但不限于下组:中风、痴呆、阿尔茨海默病、帕金森病、亨廷顿病、尼曼
‑
皮克病(niemann
‑
pick disease)、多发性硬化、朊病毒病、克雅氏病(creutzfeldt
‑
jakob disease)、额颞叶痴呆、路易体痴呆、肌萎缩性侧索硬化症、副肿瘤综合征、皮质变性综合征、多系统萎缩、进行性核上性麻痹、神经系统自身免疫性疾病、脊髓小脑共济失调、炎症性和神经病理性疼痛、脑血管病、脊髓损伤和tau蛋白病(tauopathy)。
139.发明的有益效果
140.本发明提供的结合分子不仅可以特异性地预防、改善或治疗脑和神经系统疾病,如各种神经退行性疾病或神经炎症性疾病,而且还提供了诊断此类疾病的方法。
附图说明
141.图1示出了根据本发明实施方案的lrig
‑
1蛋白的结构。
142.图2示出了根据本发明实施方案的lrig
‑
1蛋白的结构。
143.图3示出了根据本发明实施方案的lrig
‑
1蛋白表位的预测结果。
144.图4示出了根据本发明实施方案的lrig
‑
1蛋白表位的预测结果。
145.图5示出了根据本发明实施方案的lrig
‑
1mrna的表达水平。
146.图6示出了根据本发明实施方案的lrig
‑
1mrna的表达水平。
147.图7示出了根据本发明实施方案的lrig
‑
1mrna的表达水平。
148.图8示出了根据本发明实施方案的lrig
‑
1、lrig
‑
2和lrig
‑
3mrna的表达水平。
149.图9示出了根据本发明实施方案通过比较调节性t细胞和非调节性t细胞中lrig
‑
1蛋白的表达水平而获得的结果。
150.图10示出了根据本发明的一个实施方案的lrig
‑
1蛋白在调节性t细胞表面的表达。
151.图11示出了根据本发明实施方案通过分析lrig
‑
1蛋白特异性单克隆抗体与lrig
‑
1蛋白的结合能力而获得的结果。
152.图12示出了根据本发明实施方案,用于鉴定lrig
‑
1蛋白特异性单克隆抗体对多发性硬化症的治疗效果的实验设计。
153.图13示出了根据本发明的一个实施方案,通过给药lrig
‑
1蛋白特异性单克隆抗体,然后分析其对多发性硬化的治疗效果而获得的结果。
154.图14示出了根据本发明的一个实施方案,通过给药lrig
‑
1蛋白特异性单克隆抗体,然后分析其对阿尔茨海默病的治疗效果而获得的结果。
155.图15示出了根据本发明的一个实施方案,通过给药lrig
‑
1蛋白特异性单克隆抗体,然后分析其对阿尔茨海默病的治疗效果而获得的结果。
156.图16示出了根据本发明的一个实施方案,通过给药lrig
‑
1蛋白特异性单克隆抗体,然后分析其对阿尔茨海默病的治疗效果而获得的结果。
157.图17示出了根据本发明的一个实施方案,通过给药lrig
‑
1蛋白特异性单克隆抗体,然后分析其对阿尔茨海默病的治疗效果而获得的结果。
具体实施方式
158.在本发明中,提供了一种用于预防、改善或治疗脑和神经系统疾病的组合物,其包括作为活性成分的结合分子,该结合分子特异性地结合存在于调节性t细胞(treg细胞)表面的富含亮氨酸和免疫球蛋白样结构域1(lrig
‑
1)蛋白。
159.此处,结合分子可以是包括以下所述的结合分子:
160.重链可变区,其包含由seq id no:5或13所示氨基酸序列组成的重链cdr1,由seq id no:6或14所示氨基酸序列组成的重链cdr2,以及由seq id no:7或15所示氨基酸序列组成的重链cdr3;和
161.轻链可变区,其包含由seq id no:8或16所示氨基酸序列组成的轻链cdr1,由seq id no:9或17所示氨基酸序列组成的轻链cdr2,和由seq id no:10或18所示氨基酸序列组成的轻链cdr3。
162.在下文中,将通过实施例更详细地描述本发明。这些实施例仅用于更详细地描述本发明,对于本领域技术人员显而易见的是,根据本发明的主旨,本发明的范围不受这些实施例的限制。
163.实施例
164.[制备实施例1]t细胞亚群细胞培养
[0165]
为了鉴定lrig
‑
1蛋白是否仅在调节性t细胞(treg)中表达,制备t细胞亚群th0、th1、th2、th17和itreg。itreg是指在含有下列组合物的培养基中人工诱导分化的细胞,不像ntreg是自然分离出来的。
[0166]
诱导t细胞的亚群分化成各种细胞,首先通过从小鼠脾脏分离初始t细胞,使含有10%胎牛血清(fbs;hyclone,洛根市,犹他州)的rpmi1640(英杰gibco,纽约州格兰德岛)营养培养基进一步含有下表1的相应成分,并在37℃,5%co2的培养箱中孵育72小时。
[0167]
[表1]
[0168]
[0169][0170]
[实施例1]lrig
‑
1的结构分析
[0171]
预测lrig
‑
1蛋白胞外区的三维立体结构以产生针对lrig
‑
1蛋白的特异性抗体,lrig
‑
1蛋白是一种调节性t细胞的表面蛋白。
[0172]
首先,为了预测表位(epitope)的碱基序列,使用uniprot(http://www.uniprot.org)的工具和rcsb蛋白质数据库(http://www.rcsb.org/pdb)来预测lrig
‑
1蛋白胞外区(ecd)的三维立体结构,从而确定了ecd的结构。然后,结果如图1和图2所示。
[0173]
如图1所示,在lrig
‑
1蛋白细胞外结构域中,有lrr1至lrr15的共15个亮氨酸富集区存在于lrig
‑
lrr结构域(41至494位的氨基酸序列)中。每个lrr结构域由23至27个氨基酸组成,存在3至5个亮氨酸。
[0174]
另外,如图2所示,在lrig
‑
1蛋白的细胞外结构域中,三种免疫球蛋白样结构域存在于lrig
‑
1蛋白的氨基酸序列的494
‑
781位处。
[0175]
[实施例2]lrig
‑
1表位氨基酸序列的预测
[0176]
使用ellipro服务器(http://tools.iedb.org/ellipro/)进行上述碱基序列的预测,这是基于lrig
‑
1蛋白的结构的表位预测软件。使用ellipro搜索引擎是因为已知它是现存预测表位的算法中最可靠的搜索引擎。
[0177]
将实施例1中分析的细胞外结构域输入到表位预测软件中,然后在图3和4中示出了预测表位的连续或不连续的氨基酸序列。
[0178]
如图3和图4所示,预测了总共22个连续表位氨基酸序列,以及预测了总共8个不连续的表位氨基酸序列。
[0179]
[生产实施例1至8]生产lrig
‑
1蛋白的特异性单克隆抗体
[0180]
生产根据本发明的lrig
‑
1蛋白特异的抗体。本发明的抗体不是通过特定的表位产生,而是作为能够与lrig
‑
1蛋白质上的任何位点结合的抗体产生。
[0181]
为了生产抗体,制备表达lrig
‑
1蛋白的细胞。更具体地,用裂解酶切割对应于seq id no:2的dna片段和pcdna(hygro),在37℃下孵育,并连接以产生插入lrig
‑
1蛋白的dna序列的pcdna。由此产生的插有seq id no:2的pcdna通过转染导入l细胞,使lrig
‑
1蛋白质在l细胞的表面上表达。
[0182]
从人scfv文库中选择能够结合细胞表面表达的lrig
‑
1的轻链和重链的氨基酸序列,从而总共选择了八个重链和轻链。
[0183]
将所选择的重链和轻链的氨基酸序列与mlgg2a fc区融合,以产生单克隆抗体。单克隆抗体的序列示于下表2中。
[0184]
[表2]
[0185]
[0186]
[0187]
[0188]
[0189]
[0190][0191]
[实施例3]鉴定调节性t细胞中lrig
‑
1mrna的特异性表达
[0192]
验证lrig
‑
1蛋白是否可以作为对调节性t细胞特异的生物标志物。
[0193]
为了验证,采用磁体活化细胞分选(macs)法分离cd4
+
t细胞,通过cd4珠子从小鼠脾脏中分离t细胞。随后,使用cd25抗体与荧光激活的细胞分选仪(facs)分离出调节性t(cd4
+
cd25
+
t)细胞和非调节性t(cd4
+
cd25
‑
t)细胞。对于各细胞和在制备实施例1中分化的细胞,使用trizol提取mrna,并根据制造商提供的方案使用gdna提取试剂盒(qiagen)从基因组rna中除去gdna。通过bdsprint cdna合成试剂盒(clonetech)将去除gdna的mrna合成为cdna。
[0194]
进行实时聚合酶链反应(rt pcr)以定量鉴定cdna中lrig
‑
1mrna的表达水平。
[0195]
使用下表3所示的引物,按照供应商提供的实验方案使用sybr green(分子探针)在40次循环(包括95℃下3分钟,61℃下15秒,72℃下30秒)条件下进行实时聚合酶链反应,通过δδct方法计算相对基因表达水平,并使用hprt标准化。结果如图5到图8所示。
[0196]
[表3]
[0197]
[0198][0199]
如图5中所示,可以看出,调节性t(cd4
+
cd25
+
t)细胞中lrig
‑
1的表达比非调节t(cd4
+
cd25
‑
t)细胞高出18.1倍。这比lag3和ikzf4(先前已知的调节性t细胞的标志物)的表达水平高约10倍。另外,如图6和图7所示,与其他类型的免疫细胞相比,lrig
‑
1mrna的表达在调节性t细胞中非常高,特别是与诱导的调节性t细胞(itreg细胞)相比,在天然分离的调节性t细胞(ntreg)中显著高。
[0200]
另外,如图8所示,lrig
‑
1的表达在对应于lrig家族的lrig
‑
1、lrig
‑
2和lrig
‑
3中最高。
[0201]
根据上述结果,可以看出,根据本发明的lrig
‑
1蛋白在调节性t细胞,特别是天然存在的调节性t细胞中特异性地表达。
[0202]
[实施例4]鉴定调节性t细胞中lrig
‑
1蛋白的特异性表达
[0203]
鉴定了从lrig
‑
1mrna表达的lrig
‑
1蛋白是否在调节性t细胞中特异性表达。
[0204]
使用foxp3
‑
rfp敲入小鼠,foxp3
‑
rfp是通过将红色荧光蛋白(rfp)偶联到foxp3启动子(一种调节性t细胞特异性的转录因子)而获得,使用磁体活化细胞分选(macs)通过cd4珠子在小鼠的脾脏中分离cd4
+
t细胞。随后,使用rfp蛋白,通过荧光激活的细胞分选仪(facs)分离来获得调节性t(cd4
+
rfp
+
t)细胞和非调节性t(cd4
+
rfp
‑
t)细胞。将各细胞用所购买的lrig
‑
1抗体染色,并将同种型匹配的对照抗体染色作为阴性对照,用荧光激活的细胞分选仪来测量lrig
‑
1的表达水平。结果如图9所示。
[0205]
如图9中所示,由虚线表示的非调节性t细胞显示出与阴性对照几乎相同的lrig
‑
1的表达水平,而在调节性t细胞中有大量lrig
‑
1高表达水平的细胞。
[0206]
根据上述结果,可以看出,本发明的lrig
‑
1蛋白在调节性t细胞中特异性地表达。
[0207]
[实施例5]鉴定lrig
‑
1蛋白在调节性t细胞表面上的特异性表达
[0208]
从旨在成为细胞疗法靶标的观点来看,lrig
‑
1蛋白必须在调节性t细胞表面上表达,这反过来又允许更有效的靶向疗法,鉴定了lrig
‑
1蛋白是否在调节性t细胞的表面上表达。
[0209]
制备实施例1的各分化的t细胞亚群用抗cd4
‑
apc和抗lrig
‑1‑
pe抗体染色,使用荧光激活的细胞分选仪(facs)测量lrig
‑
1在各个细胞表面上的表达水平。结果如图10所示。
[0210]
如图10中所示,在激活的t细胞、th1细胞、th2细胞、th17细胞和初始t细胞中,lrig
‑
1的表达量为0.77
‑
15.3,而lrig
‑
1在分化诱导的t细胞中的表达高达83.9(itreg细胞)。
[0211]
根据上述结果,可以看出,本发明的lrig
‑
1蛋白不仅在调节性t(treg)细胞中特异
性表达,而且特别地,在treg细胞表面上也较高水平地表达。
[0212]
[实施例6]评价本发明的抗体与lrig
‑
1蛋白的结合能力
[0213]
为了鉴定在生产实施例1至8中制备的本发明的单克隆抗体是否能很好识别lrig
‑
1,将生产实施例1至8的每种抗体结合到稳定表达lrig
‑
1的l细胞。然后,加入与eflour 670缀合并能识别小鼠抗体的二抗,然后用facs分析单克隆抗体与lrig
‑
1蛋白的结合能力。结果如图11所示。
[0214]
如图11所示,发现根据本发明的所有lrig
‑
1蛋白特异性单克隆抗体(gtc110
‑
04和gtc210
‑
01)都能有效地识别并结合存在于l细胞表面上的lrig
‑
1蛋白。
[0215]
[实施例7]评价本发明的抗体对多发性硬化症的治疗能力
[0216]
1.多发性硬化症小鼠模型的制备
[0217]
为了制备多发性硬化症小鼠模型,按照图12中所示的实验设计进行了实验。在第0天,给7周龄c57bl/6小鼠皮下注射mog肽,腹腔注射结核分枝杆菌毒素。在第2天,再次给小鼠注射结核分枝杆菌毒素以增强免疫系统。在第9天,给小鼠施用在生产实施例1中生产的gtc210
‑
01抗体,并给小鼠施用抗il
‑
17a抗体作为阳性对照。
[0218]
2.多发性硬化症的疗效评价
[0219]
从第7天开始,通过根据以下评价标准计算临床评分来评价小鼠多发性硬化症的治疗效果,结果如图13所示。
[0220]
<评价标准>
[0221]
0分:运动正常,无症状
[0222]
1分:尾尖部分麻痹并垂下
[0223]
2分:整条尾巴都瘫痪,并跛行。
[0224]
3分:其中一只后肢部分瘫痪,但能对刺激做出反应
[0225]
4分:其中一只后肢完全瘫痪,对刺激没有反应,导致在移动时拖曳肢体
[0226]
5分:双后肢瘫痪,前肢拖曳身体
[0227]
6分:前肢拖曳身体困难,但前肢仍然对刺激有反应。
[0228]
7分:小鼠不能移动,但一个前肢对刺激有反应。
[0229]
8分:小鼠不能移动,两个前肢对刺激没有反应。
[0230]
9分:小鼠行动不便,呼吸不规律
[0231]
10分:小鼠死亡
[0232]
结果发现在诱导多发性硬化症的模型中,在给药本发明的抗体的情况下,多发性硬化症得到显著治疗。特别地,发现在第22天和第23天,模型恢复到与正常小鼠相似的水平。
[0233]
[实施例8]评价根据本发明的抗体对阿尔茨海默病的治疗能力
[0234]
为了评价根据本发明的抗体对阿尔茨海默病的治疗能力,如表4所示设计组。具体来说,给7月龄的5xfad诱导阿尔茨海默病小鼠静脉注射gtc110
‑
04抗体或gtc210
‑
01抗体,各10mpk,持续1个月。作为阳性对照,给8月龄的阿尔茨海默病小鼠皮下注射醋酸格拉替拉明(ga、)100微克,持续3周。
[0235]
[表4]
[0236][0237]
1.y迷宫试验
[0238]
在y型迷宫试验中,使用y形迷宫,迷宫中有三个相同的臂,臂长40厘米(墙高15厘米),臂之间成120度角。该实验是一个行为实验,利用啮齿动物的本能探索习惯,并基于探索一个新地区的高可能性的事实。受试动物对它刚刚探索过的臂的记忆程度越高,尝试不进入同一个臂的程度越高,动物的记忆水平就越高。每个个体给予8分钟的探索时间,最终结果以图14中自发交替(%)值表示。自发交替(%)值按表达式1计算。在这里,行为模式分析使用智能视频跟踪软件(panlab,美国)。
[0239]
[表达式1]
[0240]
自发交替(%)=三次重复的次数/(进入臂的总次数
‑
2)
[0241]
结果,在用于测量试验动物感知周围线索并依次进入迷宫的相对频率的实验中,发现在用根据本发明的抗体(gtc210
‑
01和gtc110
‑
04抗体)给药诱导性阿尔茨海默病小鼠的情况下,小鼠具有与正常对照相似水平的自发交替值。
[0242]
2.新物体识别试验
[0243]
新物体识别试验被用于评估记忆力,使用两个不同的物体在一个40厘米
×
40厘米的丙烯酸笼进行。在使实验动物适应丙烯酸笼的内部后,将两个物体放置在特定位置,让动物自由感知物体。然后,测量探索每个物体的时间。每个个体都有24小时的延迟,在同一地点只有一个物体被换为另一个。在这种情况下,如果动物将改变的物体视为新物体,并花费更长的探索时间,就可以确定动物的记忆力更好。如果动物不记得24小时前它探索过的物体,那么它就不能区分新物体和旧物体,因此,动物有可能同时探索两个物体。动物被允许自由探索共10分钟,结果在图15中用偏好指数表示(等于新物体探索时间/总探索时间)。在这里,使用smart视频跟踪软件(panlab,美国)进行分析。
[0244]
结果,关于新对象的偏好指数,正常对照组(g1)对新物体的偏好指数为0.51
±
0.06,g2组(溶媒)为0.42
±
0.04。因此,与正常对照组(g1)相比,诱发性阿尔茨海默病组(g2)具有较低的偏好指数。另一方面,发现接受了根据本发明的抗体(gtc210
‑
01和gtc110
‑
04抗体)的组比正常对照具有更高的偏好指数。
[0245]
3.水迷宫试验
[0246]
水迷宫试验是根据morris设计的方法进行的。不锈钢池(直径90cm,高50cm),充满水(22
±
1℃)并使水面高30cm。水面下1厘米处放置一个直径5厘米的隐蔽平台。在评估的第一天,进行3至4次培训。每个个体的总游泳时间设定为60秒;在60秒内找到平台的个体被允许在平台上停留10秒来诱导记忆。即使在60秒后也找不到平台的个体,将被人工引导到平台上,并被允许在平台上停留10秒,其中逃跑的时间被设置为60秒。在训练后第6天,进行探测测试以测量空间感知值(在sw区的时间百分比,%),即通过计算在平台所在象限所花费的时间占总游泳时间的百分比和到达平台所在位置所花费的时间(到目标的潜伏期,秒)获
得。结果如图16和图17所示。在这里,使用smart视频跟踪软件(panlab,美国)进行分析。在解释结果时,排除标准中包括的个体被设定为在特定区域内移动而没有通过游泳进行探索的个体。
[0247]
结果,发现接受了根据本发明的抗体(gtc210
‑
01和gtc110
‑
04抗体)的组具有显著增加的值(sw区域的时间百分比,%),该值通过计算在平台所在的象限中花费的时间占总游泳时间的百分比而获得,并且具有显著减少的到达平台所在位置的时间(到目标的延迟,秒),这是与正常对照组相似的水平。
[0248]
通过这些实验,发现根据本发明的抗体对脑和神经系统疾病具有预防、改善或治疗作用。
[0249]
尽管上面已经详细描述了本发明,但是本发明的范围不限于此。对于本领域技术人员来说显而易见的是,在不脱离权利要求中描述的本发明的技术精神的情况下可以进行各种修改和改变。
[0250]
工业实用性
[0251]
本发明涉及一种用于预防或治疗脑和神经系统疾病的组合物。
[0252]
序列表自由文本
[0253]
[0254]
[0255]
[0256]
[0257]
[0258]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1