含有靶向肿瘤抗原的Fc区和部分的条件性活化的结合蛋白质的制作方法
含有靶向肿瘤抗原的fc区和部分的条件性活化的结合蛋白质
1.相关申请的交叉引用
2.本技术要求于2019年3月5日提交的美国临时申请第62/814,459 号、于2019年3月6日提交的美国临时申请第62/814,744号、于2019 年3月6日提交的美国临时申请第62/814,744号和于2019年3月29 日提交的美国临时申请第62/826,523号的优先权,将所述美国临时申请的内容据此以全文引用的方式并入。
3.对在压缩光盘上提交的“序列表”、表格或计算机程序列表附件的引用
4.名称为“118459-5008-wo sequence listing_st25.txt”并且大小为 101千字节的文件中包含的序列表已经由efs-web与本文一起以电子方式提交,并且该txt文件的内容据此以全文引用的方式并入。
背景技术:
5.在多种临床环境中通常期望对单个细胞或特定细胞类型进行选择性破坏。例如,癌症疗法的主要目的是特异性地破坏肿瘤细胞,同时使健康细胞和组织尽可能完整和无损伤。一种这样的方法是通过诱导针对肿瘤的免疫应答,使免疫效应细胞(诸如天然杀伤(nk)细胞或细胞毒性t淋巴细胞(ctl))攻击并破坏肿瘤细胞。
6.对肿瘤相关抗原提供优异的结合特异性和亲和力的完整的单克隆抗体(mab)的使用已经成功地应用于癌症治疗和诊断领域。然而,完整mab的大尺寸、它们的较差生物分布以及在血液池中持久存在限制了它们的临床应用。例如,完整抗体可以在肿瘤区域内表现出特异性累积。在生物分布研究中,当精确检查肿瘤时,注意到抗体分布不均匀,主要累积在外周区域中。由于肿瘤坏死,不均匀的抗原分布和增加的间质组织压力,不可能以完整抗体构建体到达肿瘤的中心部分。相比之下,较小的抗体片段显示出快速的肿瘤定位,更深地渗透到肿瘤中,并且也相对快速地从血流中除去。
7.来源于亲本mab的小结合结构域的单链片段(scfv)提供比完整 mab更好的生物分布用于临床应用,并且可以更有效地靶向肿瘤细胞。单链片段可以从细菌中有效地工程化,然而,大多数工程化scfv 具有单价结构,并且由于缺乏二价化合物经历的亲合力而显示出与它们的亲本mab相比减少的肿瘤累积(例如,在肿瘤细胞上的短停留时间)以及特异性。
8.尽管scfv具有有利的特性,但某些特征妨碍了它们在癌症化疗中的完全临床部署。特别值得注意的是它们在患病组织与健康组织之间的交叉反应性,这是由于这些药剂靶向患病组织和健康组织两者共同的细胞表面受体。具有改进的治疗指数的scfv将在这些药剂的临床应用中提供显著的进步。本发明提供了此类改进的scfv及其制备和使用方法。本发明的改进的scfv具有通过形成二聚体化合物克服由单一单元所证实的亲合力缺乏的意想不到的益处。
技术实现要素:
9.在一个方面,本文提供了同源二聚体蛋白质组合物,其包含:
10.(a)两个单体,所述两个单体各自从n末端至c末端包含:
11.i)与第一肿瘤靶抗原(tta)结合的第一单结构域抗原结合结构域(sdabd)(sdabd-tta);
12.ii)任选的结构域接头;
13.iii)受限fv结构域,所述受限fv结构域包含:
14.1)含有vhcdr1、vhcdr2和vhcdr3的可变重结构域;
15.2)受限不可切割接头(cncl);和
16.3)含有vlcdr1、vlcdr2和vlcdr3的可变轻结构域;
17.iv)任选的结构域接头;
18.v)第二sdabd-tta;
19.vi)可切割接头;
20.vii)伪fv结构域,所述伪fv结构域包含:
21.1)伪可变轻结构域;
22.2)不可切割接头;和
23.3)伪可变重结构域;和
24.viii)任选的可切割接头;和
25.ix)fc结构域;
26.其中所述可变重结构域和第一可变轻结构域能够结合人cd3,但所述受限fv结构域不结合cd3;其中所述可变重结构域和所述伪可变轻结构域经分子间缔合而形成无活性的fv;并且其中所述可变轻结构域和所述伪可变重结构域经分子间缔合而形成无活性的fv。
27.在同源二聚体fc蛋白的一些实施方案中,所述第一可变重结构域位于所述第一可变轻结构域的n末端,并且所述伪可变轻结构域位于所述伪可变重链可变结构域的n末端。在一些实施方案中,所述第一可变轻结构域位于所述第一可变重结构域的n末端,并且所述伪可变轻结构域位于所述伪可变重结构域的n末端。在一些实施方案中,所述第一可变轻结构域位于所述第一可变重结构域的n末端,并且所述伪可变重结构域位于所述伪可变轻结构域的n末端。在一些实施方案中,所述第一可变重结构域位于所述第一可变轻结构域的n末端,并且所述伪可变重结构域位于所述伪可变轻结构域的n 末端。
28.在一些实施方案中,cd3可变重链(cd3 vh或αcd3 vh)包含 seq id no:186的氨基酸序列并且cd3可变轻结构域(cd3 vl或αcd3 vl)包含seq id no:170的氨基酸序列。在一些实施方案中,cd3可变重链包含seq id no:186和图2b中所示的cdr1、cdr2 和cdr3。在一些实施方案中,cd3可变重链包含分别如seq id no: 187-189所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 可变轻链包含seq id no:170和图2a中所示的cdr1、cdr2和 cdr3。在一些实施方案中,cd3可变重链包含分别如seq id no: 171-173所示的cdr1、cdr2和cdr3。
29.在一些实施方案中,伪可变重结构域(cd3 vhi或αcd3 vhi)包含seq id no:190的氨基酸序列并且伪可变轻结构域(cd3 vli)包含 seq id no:174的氨基酸序列。在一些实施方案中,cd3 vhi包含 seq id no:190和图2b所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vhi包含分别如seq id no:191-193所述和图2b中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vli包含 seq id no:174和图2a中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vli包含分别如seq id no:175-177所示和图2a 中所示的cdr1、cdr2和cdr3。
30.在一些实施方案中,伪可变重结构域(cd3 vhi2或αcd3 vhi2) 包含seq id no:194的氨基酸序列并且伪可变轻结构域(cd3 vli2 或αcd3 vli2)包含seq id no:178的氨基酸序列。在一些实施方案中,cd3 vhi2包含seq id no:194和图2b所示的cdr1、cdr2 和cdr3。在一些实施方案中,cd3 vhi包含分别如seq id no: 195-197所述和图2b中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vli2包含seq id no:178和图2a中所示的cdr1、 cdr2和cdr3。在一些实施方案中,cd3 vli2包含分别如seq idno:179-181所示和图2a中所示的cdr1、cdr2和cdr3。
31.在一些实施方案中,伪可变重结构域(cd3 vhigl4或αcd3 vhigl4)包含seq id no:198的氨基酸序列并且伪可变轻结构域 (cd3 vligl或αcd3 vligl)包含seq id no:182的氨基酸序列。在一些实施方案中,cd3 vhigl4包含seq id no:198和图2b所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vhigl4包含分别如seq id no:199-201所示和图2b中所示的cdr1、cdr2和 cdr3。
32.在一些实施方案中,cd3 vligl包含seq id no:182和图2a 中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vligl 包含分别如seq id no:183-185所示和图2a中所示的cdr1、cdr2 和cdr3。
33.在一些实施方案中,tta选自egfr、folr1、b7h3、epcam、 trop2和ca9。
34.在某些实施方案中,所述第一sdabd和所述第二sdabd结合至相同的tta。在一些实施方案中,所述第一sdabd和所述第二sdabd 结合至不同的tta。在一些实施方案中,所述第一sdabd-tta和所述第二sdabd-tta是相同的。在一些实施方案中,所述第一 sdabd-tta和所述第二sdabd-tta是不同的。
35.在一些实施方案中,与特异性tta结合的sdabd选自seq idno:50、54、58、62、66、70、74、78、82、86、90、94、98、102、 16、110、114、118、122、126、130、134、138、142、146、151、 154、158、162和166。在一些实施方案中,sdabd包含如seq id no: 50、54、58、62、66、70、74、78、82、86、90、94、98、102、16、 110、114、118、122、126、130、134、138、142、146、151、154、158、162和166所示的cdr1、cdr2和cdr3。在一些实施方案中, sdabd包含如图1中所示的cdr1、cdr2和cdr3。
36.在一些实施方案中,所述第一可切割接头和/或任选的可切割接头被人蛋白酶切割,所述人蛋白酶选自mmp2、mmp9、甲基多巴 (meprin)、组织蛋白酶s、组织蛋白酶k、组织蛋白酶l、颗粒蛋白酶 b、upa、kallekriein7、蛋白裂解酶(matriptase)和凝血酶。在一些实施方案中,可切割接头包含图3a-3d中所描绘的氨基酸序列。在某些实施方案中,可切割接头包含选自seq id no:210-281的氨基酸序列。在一些实施方案中,任选的可切割接头包含图3a-3d中所描绘的氨基酸序列。在某些实施方案中,任选的可切割接头包含选自 seq id no:210-281的氨基酸序列。
37.在一些实施方案中,同源二聚体fc蛋白包含两个单体,所述两个单体各自包含sdabd、cd3可变重结构域、cd3可变轻结构域、 cd3伪可变重结构域、cd3伪可变轻结构域、可切割接头和fc结构域。在一些实施方案中,sdabd结合选自egfr、folr1、b7h3、 epcam、trop2和ca9的tta。在一些实施方案中,sdabd包含序列,所述序列选自seq id no:50、54、58、62、66、70、74、78、 82、86、90、94、98、102、16、110、114、118、122、126、130、 134、138、142、146、151、154、158、162和166。在一些实施方案中,同源二聚体fc蛋白包含两个单体,所述两个单
体各自包含靶向 egfr、folr1、b7h3、epcam、trop2或ca9的sdabd、cd3可变重结构域、cd3可变轻结构域、cd3伪可变重结构域、cd3伪可变轻结构域、可切割接头和fc结构域。
38.在一些实施方案中,同源二聚体fc蛋白的每个单体包含选自 pro556(seq id no:36)、pro587(seq id no:38)、pro588(seq idno:39)和pro589(seq id no:40)的氨基酸序列。在一些实施方案中,同源二聚体fc蛋白包含两个单体,所述两个单体各自包含egfrsdabd、cd3可变重结构域、cd3可变轻结构域、cd3伪可变重结构域、cd3伪可变轻结构域、可切割接头和fc结构域。在一些实施方案中,每个单体从n末端至c末端包含:egfr sdabd、cd3可变重结构域、cd3可变轻结构域、egfr sdabd、可切割接头、cd3 伪可变轻结构域、cd3伪可变重结构域和fc结构域。在一些实施方案中,每个单体从n末端至c末端包含:egfr sdabd、cd3可变轻结构域、cd3可变重结构域、egfr sdabd、可切割接头、cd3 伪可变轻结构域、cd3伪可变重结构域和fc结构域。在一些实施方案中,每个单体从n末端至c末端包含:egfr sdabd、cd3可变重结构域、cd3可变轻结构域、egfr sdabd、可切割接头、cd3 伪可变重结构域、cd3伪可变轻结构域和fc结构域。在一些实施方案中,每个单体从n末端至c末端包含:egfr sdabd、cd3可变轻结构域、cd3可变重结构域、egfr sdabd、可切割接头、cd3 伪可变重结构域、cd3伪可变轻结构域和fc结构域。
39.在一些实施方案中,同源二聚体fc蛋白的每个单体包含选自 pro557(seq id no:37)的氨基酸序列。在一些实施方案中,同源二聚体fc蛋白包含两个单体,所述两个单体各自包含egfr sdabd、 cd3可变重结构域、cd3可变轻结构域、cd3伪可变重结构域、cd3 伪可变轻结构域、不可切割接头和fc结构域。
40.图18a-18c提供了异源二聚体fc蛋白的另一种示例性形式。在另一个方面,本文提供了异源二聚体蛋白质组合物,其包含:
41.(a)包含第一fc结构域的第一fc单体;和
42.(b)第二fc单体,所述第二fc单体从n末端至c末端包含:
43.i)与第一肿瘤靶抗原(tta)结合的第一单结构域抗原结合结构域(sdabd)(sdabd-tta);
44.ii)任选的结构域接头;
45.iii)受限fv结构域,所述受限fv结构域包含:
46.1)含有vhcdr1、vhcdr2和vhcdr3的可变重结构域;
47.2)受限不可切割接头(cncl);和
48.3)含有vlcdr1、vlcdr2和vlcdr3的可变轻结构域;
49.iv)任选的结构域接头;
50.v)第二sdabd-tta;
51.vi)第一可切割接头;
52.vii)伪fv结构域,所述伪fv结构域包含:
53.1)伪可变轻结构域;
54.2)不可切割接头;和
55.3)伪可变重结构域;和
56.viii)任选的第二可切割接头;和
57.ix)第二fc结构域;
58.其中所述第一fc结构域和所述第二fc结构域包含杵臼结构 (knob-in hole)修饰;其中所述可变重结构域和所述可变轻结构域能够结合人cd3,但所述受限fv结构域不结合cd3;其中所述可变重结构域和所述伪可变轻结构域经分子间缔合而形成无活性的fv;并且其中所述可变轻结构域和所述伪可变重结构域经分子间缔合而形成无活性的fv。
59.在一些实施方案中,所述可变重结构域位于所述可变轻结构域的 n末端,并且所述伪可变轻结构域位于所述伪可变重链可变结构域的 n末端。在一些实施方案中,所述可变轻结构域位于所述可变重结构域的n末端,并且所述伪可变轻结构域位于所述伪可变重结构域的n 末端。在一些实施方案中,所述可变轻结构域位于所述可变重结构域的n末端,并且所述伪可变重结构域位于所述伪可变轻结构域的n 末端。在一些实施方案中,所述可变重结构域位于所述可变轻结构域的n末端,并且所述伪可变重结构域位于所述伪可变轻结构域的n 末端。
60.在一些实施方案中,cd3可变重链(cd3 vh或αcd3 vh)包含 seq id no:186的氨基酸序列并且cd3可变轻结构域(cd3 vl或αcd3 vl)包含seq id no:170的氨基酸序列。在一些实施方案中, cd3可变重链包含seq id no:186和图2b中所示的cdr1、cdr2 和cdr3。在一些实施方案中,cd3可变重链包含分别如seq id no: 187-189所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 可变轻链包含seq id no:170和图2a中所示的cdr1、cdr2和 cdr3。在一些实施方案中,cd3可变重链包含分别如seq id no: 171-173所示的cdr1、cdr2和cdr3。
61.在一些实施方案中,伪可变重结构域(cd3 vhi或αcd3 vhi)包含seq id no:190的氨基酸序列并且伪可变轻结构域(cd3 vli)包含 seq id no:174的氨基酸序列。在一些实施方案中,cd3 vhi包含 seq id no:190和图2b所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vhi包含分别如seq id no:191-193所述和图2b中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vli包含 seq id no:174和图2a中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vli包含分别如seq id no:175-177所示和图2a 中所示的cdr1、cdr2和cdr3。
62.在一些实施方案中,伪可变重结构域(cd3 vhi2或αcd3 vhi2) 包含seq id no:194的氨基酸序列并且伪可变轻结构域(cd3 vli2 或αcd3 vli2)包含seq id no:178的氨基酸序列。在一些实施方案中,cd3 vhi2包含seq id no:194和图2b所示的cdr1、cdr2 和cdr3。在一些实施方案中,cd3 vhi包含分别如seq id no: 195-197所述和图2b中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vli2包含seq id no:178和图2a中所示的cdr1、 cdr2和cdr3。在一些实施方案中,cd3 vli2包含分别如seq idno:179-181所示和图2a中所示的cdr1、cdr2和cdr3。
63.在一些实施方案中,伪可变重结构域(cd3 vhigl4或αcd3 vhigl4)包含seq id no:198的氨基酸序列并且伪可变轻结构域 (cd3 vligl或αcd3 vligl)包含seq id no:182的氨基酸序列。在一些实施方案中,cd3 vhigl4包含seq id no:198和图2b所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vhigl4包含分别如seq id no:199-201所示和图2b中所示的cdr1、cdr2和 cdr3。
64.在一些实施方案中,cd3 vligl包含seq id no:182和图2a 中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vligl 包含分别如seq id no:183-185所示和图2a中所示的cdr1、cdr2 和cdr3。
65.在一些实施方案中,tta选自egfr、folr1、b7h3、epcam、 trop2和ca9。
66.在一些实施方案中,所述第一sdabd和所述第二sdabd结合至相同的tta。在一些实施方案中,所述第一sdabd和所述第二sdabd 结合至不同的tta。在一些实施方案中,所述第一sdabd-tta和所述第二sdabd-tta是相同的。在一些实施方案中,所述第一 sdabd-tta和所述第二sdabd-tta是不同的。
67.在一些实施方案中,sdabd(例如,第一sdabd-tta和/或第二 abd-tta)选自seq id no:50、54、58、62、66、70、74、78、82、 86、90、94、98、102、16、110、114、118、122、126、130、134、 138、142、146、151、154、158、162和166。
68.在一些实施方案中,所述第一可切割接头和/或任选的可切割接头被人蛋白酶切割,所述人蛋白酶选自mmp2、mmp9、甲基多巴 (meprin)、组织蛋白酶s、组织蛋白酶k、组织蛋白酶l、颗粒蛋白酶 b、upa、kallekriein7、蛋白裂解酶(matriptase)和凝血酶。在一些实施方案中,可切割接头包含图3a-3d中所描绘的氨基酸序列。在某些实施方案中,可切割接头包含选自seq id no:210-281的氨基酸序列。在一些实施方案中,任选的可切割接头包含图3a-3d中所描绘的氨基酸序列。在某些实施方案中,任选的可切割接头包含选自 seq id no:210-281的氨基酸序列。
69.在一些实施方案中,第一fc单体包含含有ch3臼的空fc结构域。在一些实施方案中,第一fc单体包含含有ch3杵的空fc结构域。在一些实施方案中,第一fc单体包含铰链、ch2结构域和ch3 结构域。在一些实施方案中,第一fc单体包含ch2结构域和ch3 结构域。在一些实施方案中,第一单体的c末端包含标签,诸如但不限于组氨酸标签或链霉抗生物素标签。在一些实施方案中,第二fc 单体包含sdabd、cd3可变重结构域、cd3可变轻结构域、cd3伪可变重结构域、cd3伪可变轻结构域和fc结构域。在一些实施方案中,第二单体从n末端至c末端包含:第一sdabd、cd3可变重结构域、cd3可变轻结构域、第二sdabd、可切割接头、cd3伪可变轻结构域、cd3伪可变重结构域和fc结构域。在一些实施方案中,第二fc单体的fc结构域包含铰链、ch2结构域和ch3结构域。在一些实施方案中,fc结构域包含ch2结构域和ch3结构域。在一些实施方案中,第二单体的c末端包含标签,诸如但不限于组氨酸标签或链霉抗生物素标签。
70.在一些实施方案中,异源二聚体fc蛋白包含第一单体和第二单体,所述第一单体包含空fc结构域,所述第二单体从n末端至c末端包含:第一sdabd、cd3可变重结构域、cd3可变轻结构域、第二sdabd、可切割接头、cd3伪可变轻结构域、cd3伪可变重结构域和fc结构域。在一些实施方案中,异源二聚体fc蛋白包含第一单体和第二单体,所述第一单体包含空fc结构域,所述第二单体从n 末端至c末端包含:第一egfr sdabd、cd3可变重结构域、cd3 可变轻结构域、第二egfr sdabd、可切割接头、cd3伪可变轻结构域、cd3伪可变重结构域和fc结构域。在一些实施方案中,第二单体从n末端至c末端包含:第一egfr sdabd、cd3可变重结构域、cd3可变轻结构域、第二egfr sdabd、可切割接头、cd3伪可变轻结构域、cd3伪可变重结构域和fc结构域。在一些实施方案中,第二单体从n末端至c末端包含:第一egfr sdabd、cd3可变轻结构域、cd3可变重结构域、第二egfr sdabd、可切割接头、 cd3伪可变轻结构域、cd3伪可变重结构域和fc结构域。在一些实施方案中,第二单体从n末端至c末端包含:第一egfr sdabd、 cd3可变轻结构域、cd3可变重结构域、第二egfr sdabd、可切割接头、cd3伪可变重结构域、cd3伪可变轻结构域和fc结构域。
71.在一些实施方案中,第二单体从n末端至c末端包含:第一 sdabd、cd3可变轻结构
域、cd3可变重结构域、第二sdabd、可切割接头、cd3伪可变轻结构域、cd3伪可变重结构域和fc结构域。在一些实施方案中,第二单体从n末端至c末端包含:第一sdabd、 cd3可变重结构域、cd3可变轻结构域、第二sdabd、可切割接头、 cd3伪可变重结构域、cd3伪可变轻结构域和fc结构域。在一些实施方案中,第二单体从n末端至c末端包含:第一sdabd、cd3可变轻结构域、cd3可变重结构域、第二sdabd、可切割接头、cd3 伪可变重结构域、cd3伪可变轻结构域和fc结构域。在一些情况下,靶向egfr的第一和/或第二sdabd包含如seq id no:50、54、58、 62和66所示的序列中的任一个,如图1a中所描绘。在一些实施方案中,靶向folr1的第一和/或第二sdabd包含如seq id no:70、 74和78所示的序列中的任一个,如图1b中所描绘。在一些实施方案中,靶向b7h3的第一和/或第二sdabd包含如seq id no:82、 86、90、94、98、102和106所示的序列中的任一个,如图1b-图1d 中所描绘。在一些实施方案中,靶向epcam的第一和/或第二sdabd 包含如seq id no:110、114、118和122所示的序列中的任一个,如图1d-图1e中所描绘。在一些实施方案中,靶向trop2的第一和/ 或第二sdabd包含seq id no:126,130,134,138,142和146所示的序列中的任一个,如图1e-图1f所描绘。在一些实施方案中,靶向 ca9的第一和/或第二sdabd包含如seq id no:150、154、158和 162所示的序列中的任一个,如图1f-图1g中所描绘。
72.在一些情况下,第二单体的fc结构域包含ch3-杵。在一些情况下,第二单体的fc结构域包含ch3-臼。在一些情况下,不可切割接头位于cd3可变轻链与重结构域之间。在一些情况下,不可切割接头位于cd3伪可变轻链与重结构域之间。
73.在一些实施方案中,第一fc单体包含pro574或seq id no:41 的氨基酸序列。在一些实施方案中,第一fc单体包含pro688或seqid no:47的氨基酸序列。在一些实施方案中,第二fc单体包含pro575 (seq id no:42)或pro576(seq id no:43)或pro577(其与没有可切割接头的pro576相似)的氨基酸序列。在一些实施方案中,第二fc 单体包含pro689或seq id no:48的氨基酸序列。在一些实施方案中,第二fc单体包含pro690或seq id no:49的氨基酸序列。图21 提供了包含空fc臼和sdabd-fc杵的这种异源二聚体fc蛋白的示例性方案。在一些实施方案中,异源二聚体fc包含pro575和pro574。在一些实施方案中,异源二聚体fc包含pro577和pro574。在一些实施方案中,异源二聚体fc包含pro576和pro574。
74.在又另一个方面,本文提供了异源二聚体蛋白质组合物,其包含:
75.(a)第一fc单体,所述第一fc单体从n末端至c末端包含:
76.i)与第一肿瘤靶抗原(tta)结合的第一单结构域抗原结合结构域(sdabd)(sdabd-tta);
77.ii)任选的结构域接头;
78.iii)第一受限fv结构域,所述受限fv结构域包含:
79.1)含有vhcdr1、vhcdr2和vhcdr3的第一可变重结构域;
80.2)第一受限不可切割接头(cncl);和
81.3)含有vlcdr1、vlcdr2和vlcdr3的第一可变轻结构域;
82.iv)任选的结构域接头;
83.v)第二sdabd-tta;
84.vi)第一可切割接头;
85.vii)第一伪fv结构域,所述第一伪fv结构域包含:
86.1)第一伪可变轻结构域;
87.2)不可切割接头;和
88.3)第一伪可变重结构域;
89.viii)第一任选的可切割接头;和
90.ix)第一fc臼结构域;和
91.(b)第二fc单体,所述第二fc单体从n末端至c末端包含:
92.i)第三sdabd-tta;
93.ii)任选的结构域接头;
94.iii)第二受限fv结构域,所述第二受限fv结构域包含:
95.1)含有vhcdr1、vhcdr2和vhcdr3的第二可变重结构域;
96.2)第二cncl;和
97.3)包含vlcdr1、vlcdr2和vlcdr3的第二可变轻结构域;
98.iv)任选的结构域接头;
99.v)第四sdabd-tta;
100.vi)第二可切割接头;
101.vii)第二伪fv结构域,所述第二伪fv结构域包含:
102.1)第二伪可变轻结构域;
103.2)不可切割接头;和
104.3)第二伪可变重结构域;
105.viii)第二任选的可切割接头;和
106.ix)第二fc杵结构域;
107.其中所述第一可变重结构域和所述第一可变轻结构域以及所述第二可变重结构域和所述第二可变轻结构域能够结合人cd3,但所述受限fv结构域不结合cd3;其中所述可变重结构域和所述伪可变轻结构域经分子间缔合而形成无活性的fv;并且其中所述可变轻结构域和所述伪可变重结构域经分子间缔合而形成无活性的fv。
108.在一些实施方案中,所述第一可变重结构域位于所述第一可变轻结构域的n末端,并且所述伪可变轻结构域位于所述伪可变重链可变结构域的n末端。在一些实施方案中,所述第一可变轻结构域位于所述第一可变重结构域的n末端,并且所述伪可变轻结构域位于所述伪可变重结构域的n末端。在一些实施方案中,所述第一可变轻结构域位于所述第一可变重结构域的n末端,并且所述伪可变重结构域位于所述伪可变轻结构域的n末端。在一些实施方案中,所述第一可变重结构域位于所述第一可变轻结构域的n末端,并且所述伪可变重结构域位于所述伪可变轻结构域的n末端。
109.在一些实施方案中,所述第二可变重结构域位于所述第二可变轻结构域的n末端,并且所述第二伪可变轻结构域位于所述第二伪可变重链可变结构域的n末端。在一些实施方案中,所述第二可变轻结构域位于所述第二可变重结构域的n末端,并且所述第二伪可变轻结构域位于所述第二伪可变重结构域的n末端。在一些实施方案中,所述第二可变轻结构域位于所述第二可变重结构域的n末端,并且所述第二伪可变重结构域位于所述第二伪可变轻结构域的n末端。在一些实施方案中,所述第二可变重结构域位于所述第二可变轻结构域的n末端,并且所述第二伪可变重结构域位于所述第二伪可变轻结构域的n末端。
110.在一些实施方案中,cd3可变重链(cd3 vh或αcd3 vh)包含 seq id no:186的氨基酸序列并且cd3可变轻结构域(cd3 vl或αcd3 vl)包含seq id no:170的氨基酸序列。在一些实施方案中, cd3可变重链包含seq id no:186和图2b中所示的cdr1、cdr2 和cdr3。在一些实施方案中,cd3可变重链包含分别如seq id no: 187-189所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 可变轻链包含seq id no:170和图2a中所示的cdr1、cdr2和 cdr3。在一些实施方案中,cd3可变重链包含分别如seq id no: 171-173所示的cdr1、cdr2和cdr3。
111.在一些实施方案中,伪可变重结构域(cd3 vhi或αcd3 vhi)包含seq id no:190的氨基酸序列并且伪可变轻结构域(cd3 vli)包含 seq id no:174的氨基酸序列。在一些实施方案中,cd3 vhi包含 seq id no:190和图2b所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vhi包含分别如seq id no:191-193所述和图2b中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vli包含 seq id no:174和图2a中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vli包含分别如seq id no:175-177所示和图2a 中所示的cdr1、cdr2和cdr3。
112.在一些实施方案中,伪可变重结构域(cd3 vhi2或αcd3 vhi2) 包含seq id no:194的氨基酸序列并且伪可变轻结构域(cd3 vli2 或αcd3 vli2)包含seq id no:178的氨基酸序列。在一些实施方案中,cd3 vhi2包含seq id no:194和图2b所示的cdr1、cdr2 和cdr3。在一些实施方案中,cd3 vhi包含分别如seq id no: 195-197所述和图2b中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vli2包含seq id no:178和图2a中所示的cdr1、 cdr2和cdr3。在一些实施方案中,cd3 vli2包含分别如seq idno:179-181所示和图2a中所示的cdr1、cdr2和cdr3。
113.在一些实施方案中,伪可变重结构域(cd3 vhigl4或αcd3vhigl4)包含seq id no:198的氨基酸序列并且伪可变轻结构域 (cd3 vligl或αcd3 vligl)包含seq id no:182的氨基酸序列。在一些实施方案中,cd3 vhigl4包含seq id no:198和图2b所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vhigl4包含分别如seq id no:199-201所示和图2b中所示的cdr1、cdr2和 cdr3。
114.在一些实施方案中,cd3 vligl包含seq id no:182和图2a 中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vligl 包含分别如seq id no:183-185所示和图2a中所示的cdr1、cdr2 和cdr3。
115.在一些实施方案中,tta选自egfr、folr1、b7h3、epcam、 trop2和ca9。
116.在一些实施方案中,所述第一sdabd和所述第二sdabd结合至相同的tta和/或所述第三和第四sdabd结合至相同的tta。在一些实施方案中,所述第一sdabd、所述第二sdabd、所述第三sdabd 和所述第四sdabd结合至相同的tta。在一些实施方案中,所述第一sdabd-tta和所述第二sdabd-tta是相同的和/或所述第三 sdabd-tta和第四sdabd-tta是相同的。在一些实施方案中,所述第一sdabd-tta和所述第二sdabd-tta是不同的和/或所述第三 sdabd-tta和第四sdabd-tta是不同的。在一些实施方案中,所述第一sdabd、所述第二sdabd、所述第三sdabd和所述第四sdabd 结合至不同的tta。
117.在一些实施方案中,所述sdabd选自seq id no:50、54、58、 62、66、70、74、78、82、86、90、94、98、102、16、110、114、 118、122、126、130、134、138、142、146、151、154、158、162 和166。
118.在一些实施方案中,所述第一可切割接头和/或所述第二可切割接头被人蛋白酶
切割,所述人蛋白酶选自mmp2、mmp9、甲基多巴 (meprin)、组织蛋白酶s、组织蛋白酶k、组织蛋白酶l、颗粒蛋白酶 b、upa、kallekriein7、蛋白裂解酶(matriptase)和凝血酶。在一些实施方案中,所述第一可切割接头包含图3a-3d中所描绘的氨基酸序列。在某些实施方案中,所述第一可切割接头包含选自seq id no: 210-281的氨基酸序列。在一些实施方案中,所述第二可切割接头包含图3a-3d中所描绘的氨基酸序列。在某些实施方案中,任选的可切割接头包含选自seq id no:210-281的氨基酸序列。
119.在一些实施方案中,所述第一任选的可切割接头和/或所述第二任选的可切割接头被人蛋白酶切割,所述人蛋白酶选自mmp2、mmp9、甲基多巴(meprin)、组织蛋白酶s、组织蛋白酶k、组织蛋白酶l、颗粒蛋白酶b、upa、kallekriein7、蛋白裂解酶(matriptase)和凝血酶。在一些实施方案中,所述第一任选的可切割接头包含图 3a-3d中所描绘的氨基酸序列。在某些实施方案中,所述第一任选的可切割接头包含选自seq id no:210-281的氨基酸序列。在一些实施方案中,所述第二任选的可切割接头包含图3a-3d中所描绘的氨基酸序列。在某些实施方案中,所述第二任选的可切割接头包含选自seq id no:210-281的氨基酸序列。
120.在一些实施方案中,异源二聚体蛋白质的第一fc单体包含选自 pro584(seq id no:44)、pro585(seq id no:45)和pro586(seq idno:46)的氨基酸序列。在一些实施方案中,异源二聚体蛋白质的第二fc单体包含pro575(seq id no:42)或pro576(seq id no:43)的氨基酸序列。在一些实施方案中,异源二聚体蛋白质的第二fc单体包含pro689(seq id no:48)的氨基酸序列。
121.在一个方面,本文提供了异源二聚体蛋白质组合物,其包含:
122.(a)第一fc单体,所述第一fc单体从n末端至c末端包含:
123.i)与第一肿瘤靶抗原(tta)结合的第一单结构域抗原结合结构域(sdabd)(sdabd-tta);
124.ii)任选的结构域接头;
125.iii)第一受限fv结构域,所述受限fv结构域包含:
126.1)含有vhcdr1、vhcdr2和vhcdr3的第一可变重结构域;
127.2)第一受限不可切割接头(cncl);和
128.3)含有vlcdr1、vlcdr2和vlcdr3的第一可变轻结构域;
129.iv)第二sdabd-tta;
130.v)第一可切割接头;和
131.vi)第一fc结构域;和
132.(b)第二fc单体,所述第二fc单体从n末端至c末端包含:
133.i)第一伪fv结构域,所述第一伪fv结构域包含:
134.1)第一伪可变轻结构域;
135.2)不可切割接头;和
136.3)第一伪可变重结构域;
137.ii)第二可切割接头;和
138.iii)第二fc结构域;
139.其中所述第一fc结构域和所述第二fc结构域包含杵臼结构 (knob-in hole)修
饰;其中所述可变重结构域和所述可变轻结构域能够结合人cd3,但所述受限fv结构域不结合cd3;其中所述可变重结构域和所述伪可变轻结构域经分子间缔合而形成无活性的fv;并且其中所述可变轻结构域和所述伪可变重结构域经分子间缔合而形成无活性的fv。在一些实施方案中,第一fc结构域包含fc杵修饰,并且第二fc结构域包含fc臼修饰。在一些实施方案中,第一fc结构域包含fc臼修饰,并且第二fc结构域包含fc杵修饰。在一些实施方案中,fc结构域包含铰链、ch2和ch3结构域。在一些实施方案中,fc结构域包含ch2和ch3结构域。
140.在一些实施方案中,cd3可变重链(cd3 vh或αcd3 vh)包含 seq id no:186的氨基酸序列并且cd3可变轻结构域(cd3 vl或αcd3 vl)包含seq id no:170的氨基酸序列。在一些实施方案中, cd3可变重链包含seq id no:186和图2b中所示的cdr1、cdr2 和cdr3。在一些实施方案中,cd3可变重链包含分别如seq id no: 187-189所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 可变轻链包含seq id no:170和图2a中所示的cdr1、cdr2和 cdr3。在一些实施方案中,cd3可变重链包含分别如seq id no: 171-173所示的cdr1、cdr2和cdr3。
141.在一些实施方案中,伪可变重结构域(cd3 vhi或αcd3 vhi)包含seq id no:190的氨基酸序列并且伪可变轻结构域(cd3 vli)包含seq id no:174的氨基酸序列。在一些实施方案中,cd3 vhi包含 seq id no:190和图2b所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vhi包含分别如seq id no:191-193所述和图2b中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vli包含 seq id no:174和图2a中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vli包含分别如seq id no:175-177所示和图2a 中所示的cdr1、cdr2和cdr3。
142.在一些实施方案中,伪可变重结构域(cd3 vhi2或αcd3 vhi2) 包含seq id no:194的氨基酸序列并且伪可变轻结构域(cd3 vli2 或αcd3 vli2)包含seq id no:178的氨基酸序列。在一些实施方案中,cd3 vhi2包含seq id no:194和图2b所示的cdr1、cdr2 和cdr3。在一些实施方案中,cd3 vhi包含分别如seq id no: 195-197所述和图2b中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vli2包含seq id no:178和图2a中所示的cdr1、 cdr2和cdr3。在一些实施方案中,cd3 vli2包含分别如seq idno:179-181所示和图2a中所示的cdr1、cdr2和cdr3。
143.在一些实施方案中,伪可变重结构域(cd3 vhigl4或αcd3 vhigl4)包含seq id no:198的氨基酸序列并且伪可变轻结构域 (cd3 vligl或αcd3 vligl)包含seq id no:182的氨基酸序列。在一些实施方案中,cd3 vhigl4包含seq id no:198和图2b所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vhigl4包含分别如seq id no:199-201所示和图2b中所示的cdr1、cdr2和 cdr3。
144.在一些实施方案中,cd3 vligl包含seq id no:182和图2a 中所示的cdr1、cdr2和cdr3。在一些实施方案中,cd3 vligl 包含分别如seq id no:183-185所示和图2a中所示的cdr1、cdr2 和cdr3。
145.在一些实施方案中,tta选自egfr、folr1、b7h3、epcam、 trop2和ca9。
146.在一些实施方案中,所述第一sdabd和所述第二sdabd结合至相同的tta。在一些实施方案中,所述第一sdabd和所述第二sdabd 结合至不同的tta。在一些实施方案中,所述第一sdabd-tta和所述第二sdabd-tta是相同的。在一些实施方案中,所述第一 sdabd-tta和所述第二sdabd-tta是不同的。
147.在一些实施方案中,所述sdabd选自seq id no:50、54、58、 62、66、70、74、78、82、
86、90、94、98、102、16、110、114、 118、122、126、130、134、138、142、146、151、154、158、162 和166。在一些实施方案中,与特异性tta结合的sdabd选自seqid no:50、54、58、62、66、70、74、78、82、86、90、94、98、 102、16、110、114、118、122、126、130、134、138、142、146、 151、154、158、162和166。在一些实施方案中,sdabd包含如seqid no:50、54、58、62、66、70、74、78、82、86、90、94、98、 102、16、110、114、118、122、126、130、134、138、142、146、 151、154、158、162和166所示的cdr1、cdr2和cdr3。在一些实施方案中,sdabd包含如图1中所示的cdr1、cdr2和cdr3。
148.在一些实施方案中,所述第一可切割接头和/或所述第二可切割接头被人蛋白酶切割,所述人蛋白酶选自mmp2、mmp9、甲基多巴 (meprin)、组织蛋白酶s、组织蛋白酶k、组织蛋白酶l、颗粒蛋白酶 b、upa、kallekriein7、蛋白裂解酶(matriptase)和凝血酶。在一些实施方案中,可切割接头包含图3a-3d中所描绘的氨基酸序列。在某些实施方案中,所述第一可切割接头包含选自seq id no:210-281 的氨基酸序列。在一些实施方案中,所述第二可切割接头包含图 3a-3d中所描绘的氨基酸序列。在某些实施方案中,所述第二可切割接头包含选自seq id no:210-281的氨基酸序列。
149.而且,本文提供了核酸组合物、表达载体、宿主细胞和制备本文所述的同源二聚体蛋白质和异源二聚体蛋白质的方法。
150.而且,提供了用于治疗受试者(例如,人类受试者)中的癌症的方法,所述方法包括施用本文所述的同源二聚体蛋白质或异源二聚体蛋白质中的任一种。
151.本技术参考了于2017年3月8日提交的国际公布的专利申请第 wo2017/156178号、2016年3月8日提交的美国临时申请第 62/305,092号、2017年9月8日提交的美国临时申请第62/555,943号、2017年9月8日提交的美国临时申请第62/555,999号、2017年11月 15日提交的美国临时申请第62/583,327号、2017年11月16日提交的美国临时申请第62/587,318号、2017年9月8日提交的美国临时申请第62/555,999号、2017年9月8日提交的美国临时申请第 62/555,943号和2018年9月6日提交的国际专利申请第 pct/us2018/049798号,它们的公开内容以全文引用的方式并入本文,包括附图、图例和定义以及所有所叙述的实施方案。
附图说明
152.图1a-图1g描绘了本发明的许多sdabd-tta序列。对于抗原结合结构域,cdr为粗体、加有下划线。
153.图2a-图2c描绘了本发明的许多抗cd3 scfv结构域和抗hsa 序列。对于抗原结合结构域,cdr为粗体、加有下划线。
154.图3a-图3f描绘了许多合适的蛋白酶切割位点和不可切割或结构域接头。如本领域技术人员将理解的,这些切割位点可以用作可切割接头。在一些实施方案中,例如当需要更柔性的可切割接头时,在这些切割位点的n和c末端可以存在另外的氨基酸(通常是甘氨酸和丝氨酸)。在一些情况下,“/”标记接头的切割位点。
155.图4显示了包含fc臼/杵区的“构建体1”形式的条件性活化的结合多肽的示例性实施方案。显示了pro37+pro36前药构建体的示意图,以及在肠激酶(ek)切割后所得的双特异性多肽,但是可以使用诸如本文所述的其他切割位点。双特异性多肽包括结合egfr的sdabd
和结合cd3的fv结构域。应当注意,在其他实施方案中可以使用结合其他靶肿瘤抗原(tta)诸如但不限于folr1、b7h3、epcam、egfr、 trop2和ca9的sdabd。此外,图4显示了在fc结构域的c末端使用两种不同的蛋白质“标签”,其用于促进本发明的异源二聚体蛋白质的纯化,但是如本领域技术人员所理解的,这些可以被除去。
156.图5显示了包含fc臼/杵区的“构建体2”形式的条件性活化的结合多肽的示例性实施方案。显示了pro38+pro36前药构建体的示意图,再次使用了ek的flag切割位点,但是许多实施方案利用其他切割位点。应当注意,在其他实施方案中可以使用结合其他靶肿瘤抗原(tta) 诸如但不限于folr1、b7h3、epcam、egfr、trop2和ca9的 sdabd。此外,图5显示了在fc结构域的c末端使用两种不同的蛋白质“标签”,其用于促进本发明的异源二聚体蛋白质的纯化,但是如本领域技术人员所理解的,这些可以被除去。
157.图6a-图6b显示在tdcc测定中用同源蛋白酶切割时本文所述的一些说明性异源二聚体fc前药构建体显示出低条件性或缺乏条件性。在图6a中,pro36+37(圆形)没有用ek蛋白酶进行预处理,而切割过的pro36+37(正方形)进行了预处理。在图6b中,pro36+38(圆形)没有用ek蛋白酶进行预处理,而切割过的pro36+38(正方形)进行了预处理。pro214是全长阴性对照(空心正方形),并且pro 51(三角形)是不需要蛋白酶切割赋予活性的阳性对照。
158.图7显示了包含fc臼/杵区的“构建体3”形式的条件性活化的结合多肽的示例性实施方案。显示了pro68+pro67前药构建体的示意图,以及在肠激酶(ek)切割后所得的双特异性多肽,再次使用了ek的 flag切割位点,但是许多实施方案利用其他切割位点。双特异性多肽包括结合egfr的sdabd和结合cd3的fv结构域。应当注意,在其他实施方案中可以使用结合其他靶肿瘤抗原(tta)诸如但不限于 folr1、b7h3、epcam、egfr、trop2和ca9的sdabd。此外,图7显示了在fc结构域的c末端使用两种不同的蛋白质“标签”,其用于促进本发明的异源二聚体蛋白质的纯化,但是如本领域技术人员所理解的,这些可以被除去。
159.图8显示了包含fc臼/杵区的“构建体4”形式的条件性活化的结合多肽的示例性实施方案。显示了pro69+pro70前药构建体的示意图,再次使用了ek的flag切割位点,但是许多实施方案利用其他切割位点。应当注意,在其他实施方案中可以使用结合其他靶肿瘤抗原(tta) 诸如但不限于folr1、b7h3、epcam、egfr、trop2和ca9的 sdabd。此外,图8显示了在单体蛋白质的c末端使用两种不同的蛋白质“标签”,其用于促进本发明的异源二聚体蛋白质的纯化,但是如本领域技术人员所理解的,这些可以被除去。
160.图9显示了包含fc臼/杵区的“构建体5”形式的条件性活化的结合多肽的示例性实施方案。显示了pro71+pro67前药构建体的示意图,再次使用了ek的flag切割位点,但是许多实施方案利用其他切割位点。应当注意,在其他实施方案中可以使用结合其他靶肿瘤抗原(tta) 诸如但不限于folr1、b7h3、epcam、egfr、trop2和ca9的 sdabd。此外,图9显示了在单体蛋白质的c末端使用两种不同的蛋白质“标签”,其用于促进本发明的异源二聚体蛋白质的纯化,但是如本领域技术人员所理解的,这些可以被除去。
161.图10a-图10c显示了当在tdcc测定中用同源蛋白酶切割时本文所述的一些说明性异源二聚体fc前药构建体显示出条件性但缺乏高活性。在图10a中,pro67+68(圆形)没有用ek蛋白酶进行预处理,而切割过的pro67+68(正方形)进行了预处理。在图10b中,pro69+ 70(圆形)没有用ek蛋白酶进行预处理,而切割过的pro69+70(正方形)进行了预处理。在图10c中,pro67+71(圆形)没有用ek蛋白酶进行预处理,而切割过的pro67+71(正方形)进行了预
处理。pro214 是全长阴性对照(空心正方形),并且pro 51(三角形)是不需要蛋白酶切割赋予活性的阳性对照。
162.图11显示了包含fc臼/杵区的“构建体6”形式的条件性活化的结合多肽的示例性实施方案。显示了pro219+pro218前药构建体的示意图,使用了mmp9蛋白酶切割位点,但是也可以使用如本文所述的其他切割位点。应当注意,在其他实施方案中可以使用结合其他靶肿瘤抗原(tta)诸如但不限于folr1、b7h3、epcam、egfr、trop2 和ca9的sdabd。此外,图11显示了在单体蛋白质的c末端使用两种不同的蛋白质“标签”,其用于促进本发明的异源二聚体蛋白质的纯化,但是如本领域技术人员所理解的,这些可以被除去。
163.图12显示了包含fc臼/杵区的“构建体7”形式的条件性活化的结合多肽的示例性实施方案。显示了pro217+pro218前药构建体的示意图,使用了mmp9蛋白酶切割位点,但是也可以使用如本文所述的其他切割位点。应当注意,在其他实施方案中可以使用结合其他靶肿瘤抗原(tta)诸如但不限于folr1、b7h3、epcam、egfr、trop2 和ca9的sdabd。此外,图12显示了在单体蛋白质的c末端使用两种不同的蛋白质“标签”,其用于促进本发明的异源二聚体蛋白质的纯化,但是如本领域技术人员所理解的,这些可以被除去。
164.图13a-图13b显示了当在tdcc测定中用同源蛋白酶切割时本文所述的一些说明性异源二聚体fc前药构建体显示出条件性和高效力。在图13a中,pro217+218(圆形)没有用ek蛋白酶进行预处理,而切割过的pro217+218(正方形)进行了预处理。在图13b中,pro218 +219(圆形)没有用ek蛋白酶进行预处理,而切割过的pro218+ 219(正方形)进行了预处理。pro214是全长阴性对照(空心正方形),并且pro 51(三角形)是不需要蛋白酶切割赋予活性的阳性对照。
165.图14a-图14g描绘了本发明的示例性序列。接头加有下划线,可切割接头加有单/双下划线并且为斜体。cdr为粗体、加有下划线。斜线(“/”)描绘了结构域分隔符。c末端标记诸如麦芽糖结合蛋白质 (mbp)、(his)10和ii标签为粗体,但如本文所概述,是任选的,这取决于所用的纯化方案。因此,在本文的描述内包括的是图14的排除c末端标签的序列。
166.图15a-图15c描绘了另外的pro219构建体(图15a)和另外的 pro217构建体(图15b和图15c)。
167.图16a-图16g描绘了本发明的另外的序列。对于抗原结合结构域,cdr为粗体、加有下划线。“/”表示结构域的交叉点,结构域接头加有下划线,并且可切割接头加有单/双下划线并且为斜体。许多构建体包括组氨酸标签,其是任选的,这取决于用途。
168.图17a-图17c描绘了本发明的另外的序列,诸如pro556、pro557、pro587、pro588和pro589。对于抗原结合结构域,cdr为粗体、加有下划线。“/”表示结构域的交叉点,结构域接头加有下划线,并且可切割接头加有单/双下划线并且为斜体。许多构建体包括组氨酸标签,其是任选的,这取决于用途。在示例性实施方案中,所提供的序列用于制备同源二聚体fc融合前药蛋白质,使得所述fc结构域形成同源二聚体。
169.图18a-图18c描绘了本发明的另外的序列,诸如pro574、pro575、 pro576、pro584、pro585和pro586。对于抗原结合结构域,cdr为粗体、加有下划线。“/”表示结构域的交叉点,结构域接头加有下划线,并且可切割接头加有单/双下划线并且为斜体。许多构建体包括组氨酸标签,其是任选的,这取决于用途。在示例性实施方案中,所提供的序列用于制备fc融
合异源二聚体。在一些实施方案中,异源二聚体fc融合前药蛋白质包含选自pro575和pro574、pro575和pro584、 pro575和pro585、pro575和pro586、pro576和pro574、pro576和 pro584、pro576和pro585、以及pro576和pro586的对。
170.图19显示了当在tdcc测定中用同源蛋白酶切割时本文所述的一些说明性的同源二聚体fc前药构建体显示出条件性和活性。在图 19中,pro556(圆形)没有用蛋白酶进行预处理,而切割过的pro556(正方形)进行了预处理。pro557在伪fv结构域(黑色三角形)的n末端含有不可切割接头。pro186(菱形)不是同源二聚体fc前药构建体。 pro186从n至c末端包含a)sdabd-egfr,b)受限fv结构域,c) sdabd-egfr,d)可切割接头,e)伪fv结构域,和f)sdabd-hsa。
171.图20a-图20b描绘了本发明的另外的序列,诸如pro688、pro689 和pro690。对于抗原结合结构域,cdr加有下划线。“/”表示结构域的交叉点,结构域接头加有双下划线,并且可切割接头加有双下划线并且为斜体。许多构建体包括组氨酸标签,其是任选的,这取决于用途。在示例性实施方案中,所提供的序列用于制备fc融合异源二聚体。
172.图21描绘了本发明的结合tta的异源二聚体fc蛋白(诸如 pro574、pro575和pro577)的示例性方案。
173.图22描绘了本发明的结合egfr的异源二聚体fc蛋白(诸如 pro574、pro575和pro577)的效力。
174.图23描绘了本发明的结合egfr的异源二聚体fc蛋白(诸如 pro574、pro575和pro577)在过继t细胞转移小鼠模型中的抗肿瘤反应。
具体实施方式
175.i.引言
176.本发明涉及降低与重要的生理靶标诸如cd3和肿瘤抗原结合的双特异性抗体(包括抗体样功能蛋白)的毒性和副作用的方法。许多抗原结合蛋白质(诸如抗体)可能具有显著的“中靶/脱肿瘤”副作用,并且因此需要仅活化治疗分子在疾病组织附近的结合能力,以避免脱靶相互作用。因此,本发明涉及具有许多功能性蛋白质结构域的多价条件有效(“mce”)蛋白质。通常,这些结构域之一是将结合靶肿瘤抗原 (tta)的抗原结合结构域(abd)。另一个结构域是将在某些条件下(诸如当abd的一部分紧紧接近abd的互补部分以形成抗cd3 fv结合结构域时)结合t细胞抗原(诸如cd3)的abd。也就是说,治疗分子以“前药”样形式制备,其中所述cd3结合结构域是无活性的直到暴露于肿瘤环境。为了实现这种条件性,本发明以几种不同的方式利用“伪”或“无活性”或“惰性”可变结构域,这取决于形式,如本文所述和如附图所示。这些在本文中被称为“ivh”和“ivl”结构域。
177.在本发明的一些实施方案中,cd3结合结构域(“cd3 fv”)呈受限形式,其中在传统上形成fv的可变重链和可变轻结构域之间的接头太短而不能使所述两个结构域彼此结合。在一些实施方案中,在前药 (例如,未切割的)形式中,前药多肽还包含“伪fv结构域”。伪fv结构域可以包括具有标准构架区但“惰性”或“假的”cdr的可变重结构域(无活性的可变重结构域)、具有标准构架区但“惰性”或“假的”cdr 的可变轻结构域(无活性的可变轻结构域)、或两者。因此,由于每个结构域的构架区的亲和力,受限fv结构域将与伪fv结构域结合。然而,由于伪结构域的“惰性”cdr,所得的abd将不结合cd3,从而防止脱靶毒性。然而,在
肿瘤之中或附近存在蛋白酶的情况下,前药构建体以允许“真正的”可变重链和可变轻结构域缔合的方式切割,从而触发活性cd3结合和产生的肿瘤功效。
178.在其他实施方案中,在前药形式中,前药多肽包含两个伪fv结构域和与每个伪fv结构域连接的fc结构域。第一伪fv结构域可以包含无活性的可变重结构域和活性可变轻结构域,并且第二伪fv结构域可以包含活性可变重结构域和无活性的可变轻结构域。呈前药形式的abd将不结合在蛋白水解失活的组织中的cd3。然而,在肿瘤之中或附近,蛋白酶可以切割前药构建体,使得活性可变重链和活性可变轻结构域可以缔合并结合cd3,从而诱导靶肿瘤细胞的细胞毒性。
179.因此,本文提供的前药构建体包含形成“杵臼结构 (knobs-into-holes)”(“kih”)构象的异源二聚体igg fc区。杵臼结构概念的详细描述可以在例如以下文献中找到:美国专利第5,731,168号和第7,186,076号;和ridgway等人,protein engineering,design andselection,1996,9(7):617
–
621;atwell等人,j mol biol,1997, 270(1):26-35;merchant等人,nat biotechnol,1998,16:677-681;和 carter,j.immunological methods,2001,24(1-2):7-15。简言之,可以通过用较大的氨基酸侧链替换较小的氨基酸侧链(例如,t366w)在第一 igg fc链的ch3结构域界面处产生杵;并且可以通过用较小的氨基酸侧链替换较大的氨基酸侧链(例如,y407v)在第二igg fc链的ch3 界面的并置位置处产生臼。下文描述了合适的kih变体。因此,在本文中,具有“杵取代”的ch3结构域被称为“ch3杵”,并且具有“臼取代”的ch3结构域在本文中被称为“ch3臼”,其中通用术语“ch3-kih”涵盖两者,因为如本领域技术人员将理解的,fc二聚体的哪“侧”含有“臼变体”和哪“侧”含有“杵变体”不是决定性的并且可以变化。
180.如本文所讨论的,存在可用于本发明的多种构象和形式。前药构建体的构象可以呈现多种构型,使得所述前药活化可以以若干种一般方式发生,如图21中所示的形式和如图17a-17c中提供的序列。另外的有用形式在图1中显示为wo2019/051122的“构建体1”,在图2 中显示为“构建体2”,在图4中显示为“构建体3”,在图5中显示为“构建体4”,在图6中显示为“构建体5”,在图8中显示为“构建体6”,并且在图9中显示为“构建体7”。这些构建体通常依赖于形成异源二聚体fc结构的fc结构域,以允许惰性结合结构域的适当的切割前缔合。
181.在“构建体1”实施方案中,前药构建体包括第一fc多肽和第二 fc多肽,所述第一fc多肽包含ch2-ch3-臼多肽的、第一伪fv结构域、以及能够结合靶肿瘤抗原(tta)的抗原结合结构域(abd);所述第二fc多肽包含ch2-ch3-杵多肽、第二伪fv结构域、以及能够结合靶肿瘤抗原(tta)的抗原结合结构域(abd)。伪fv结构域是指直到暴露于肿瘤环境之前为无活性的cd3结合结构域(fv)。在该实施方案中,伪fv结构域包含活性可变重结构域(活性vh)和无活性的可变轻结构域(无活性vl)。在其他实施方案中,伪fv结构域包含活性可变轻结构域(活性vl)和无活性的可变重结构域(无活性vh)。另外,如本领域技术人员将理解的,“构建体1”的伪fv结构域可以从n末端至c末端以任一方向为vh-接头-vl或vl-接头-vh(例如,在图1 的“构建体1”中,伪fv结构域显示为vh-接头-vl,但这可以切换)。
182.在“构建体1”的一些实施方案中,第一fc多肽(从n末端至c末端)包含:经由结构域接头与活性vl结构域连接的针对第一tta的抗原结合结构域,所述活性vl结构域经由可切割接头附接至无活性的vh结构域,所述无活性的vh结构域连接至第二抗原结合结构域,所
述第二抗原结合结构域连接至ch2-ch3-kih多肽;并且第二fc 多肽(从n末端至c末端)包含:经由结构域接头与活性vh结构域连接的针对第二tta的抗原结合结构域,所述活性vh结构域经由可切割接头附接至无活性的vl结构域,所述无活性的vl结构域连接至ch2-ch3-kih多肽。在一些情况下,第一fc多肽含有ch3臼,并且第二fc多肽含有ch3杵。在在肿瘤位点处或附近的切割第一 fc多肽的可切割接头和切割第二fc多肽的可切割接头后,所述第一 fc多肽的活性vl和所述第二fc多肽的活性vh可以缔合并触发活性cd3结合。除了活性vh和vl结构域的先天自组装以外,每个结构域与针对肿瘤抗原的抗原结合结构域连接。因此,蛋白酶切割产物可以结合肿瘤细胞并将t细胞募集到肿瘤部位。在一些实施方案中,第一tta和第二tta是相同的肿瘤抗原。在其他实施方案中,第一 tta和第二tta是不同的肿瘤抗原。
183.在一些情况下,“构建体1”的前药构建体具有两个切割位点:一个切割位点位于第一fc多肽的活性可变轻链和无活性的可变重链之间,并且第二个切割位点位于第二fc多肽的活性可变重链和无活性的可变轻链之间。在一些实施方案中,两个切割位点被相同的蛋白酶识别和切割。因此,两个切割位点可以具有相同或基本上相同的氨基酸序列。在其他实施方案中,两个切割位点被不同的蛋白酶识别和切割。因此,两个切割位点可以具有不同的氨基酸序列。
184.在“构建体2”的一些实施方案中,前药构建体包括第一fc多肽和第二fc多肽,所述第一fc多肽包含ch2-ch3-kih多肽、含有活性可变轻链(活性vl)和无活性可变重链(无活性vh)的第一伪fv结构域、以及能够结合靶肿瘤抗原(tta)的抗原结合结构域(abd);所述第二fc多肽包含ch2-ch3-kih多肽、含有活性可变重链(活性vh) 和无活性可变轻链(无活性vl)的第二伪fv结构域、以及能够结合靶肿瘤抗原(tta)的抗原结合结构域(abd)。在一些情况下,第一fc多肽含有ch3臼,并且第二fc多肽含有ch3杵。
185.在“构建体2”的一些实施方案中,第一fc多肽(从n末端至c末端)包含:经由结构域接头与活性vl结构域连接的针对第一tta的抗原结合结构域,所述活性vl结构域经由可切割接头附接至无活性的vh结构域,所述无活性的vh结构域经由结构域接头连接至 ch2-ch3-kih多肽;并且第二fc多肽(从n末端至c末端)包含:经由结构域接头与活性vh结构域连接的针对第二tta的抗原结合结构域,所述活性vh结构域经由可切割接头附接至无活性的vl结构域,所述无活性的vl结构域经由结构域接头连接至ch2-ch3-kih 多肽。在一些情况下,第一fc多肽含有ch3臼,并且第二fc多肽含有ch3杵。在在肿瘤位点处或附近的切割第一fc多肽的可切割接头和切割第二fc多肽的可切割接头后,所述第一fc多肽的活性vl 和所述第二fc多肽的活性vh可以缔合并触发活性cd3结合。除了活性vh和vl结构域的先天自组装以外,每个结构域与针对肿瘤抗原的抗原结合结构域连接。因此,蛋白酶切割产物可以结合肿瘤细胞并将t细胞募集到肿瘤部位。在一些实施方案中,第一tta和第二 tta是相同的肿瘤抗原。在其他实施方案中,第一tta和第二tta 是不同的肿瘤抗原。
[0186]“构建体3”的前药类似于“构建体2”,但缺少在第一fc多肽的无活性vh结构域和ch3臼多肽之间的结构域接头、以及在第二fc多肽的无活性vl结构域和ch3杵多肽之间的结构域接头。
[0187]
本文还提供了包含第一fc多肽和第二fc多肽的前药构建体(例如,“构建体4”),所述第一fc多肽包含ch2-ch3-kih多肽和能够结合靶肿瘤抗原(tta)的抗原结合结构域(abd);所述第二fc多肽包含ch2-ch3-kih多肽、第一伪fv结构域、第二伪fv结构域、以及能
够结合靶肿瘤抗原(tta)的第二抗原结合结构域和能够结合靶肿瘤抗原(tta)的第三抗原结合结构域。在一些情况下,第一fc多肽含有 ch3臼,并且第二fc多肽含有ch3杵。在一些实施方案中,第一抗原结合结构域、第二抗原结合结构域和/或第三抗原结合结构域可以结合相同的肿瘤抗原。在其他实施方案中,第一抗原结合结构域、第二抗原结合结构域和/或第三抗原结合结构域是不同的肿瘤抗原。第一抗原结合结构域和第二抗原结合结构域可以结合相同的肿瘤抗原。第一抗原结合结构域和第二抗原结合结构域可以结合不同的肿瘤抗原。第一抗原结合结构域和第三抗原结合结构域可以结合相同的肿瘤抗原。第一抗原结合结构域和第三抗原结合结构域可以结合不同的肿瘤抗原。第二抗原结合结构域和第三抗原结合结构域可以结合相同的肿瘤抗原。第二抗原结合结构域和第三抗原结合结构域可以结合不同的肿瘤抗原。
[0188]
在“构建体4”实施方案中,第一fc多肽(从n末端至c末端)包含:与ch2-ch3-kih多肽连接的针对tta的第一抗原结合结构域;并且第二fc多肽(从n末端至c末端)包含:经由结构域接头与活性 vh结构域连接的针对tta的第二抗原结合结构域,所述活性vh结构域经由可切割接头连接至无活性的vl结构域,所述无活性的vl 结构域连接至ch2-ch3-kih多肽,所述ch2-ch3-kih多肽经由可切割接头与tta的第三抗原结合结构域连接,所述第三抗原结合结构域通过结构域接头连接至活性vl结构域,所述活性vl结构域经由可切割接头连接至无活性的vh结构域。在一些情况下,第一fc 多肽含有ch3臼,并且第二fc多肽含有ch3杵。
[0189]
在“构建体5”实施方案中,第一fc多肽(从n末端至c末端)包含:与ch2-ch3-kih多肽连接的针对tta的第一抗原结合结构域,所述ch2-ch3-kih多肽经由可切割接头连接至第二抗原结合结构域,所述第二抗原结合结构域经由结构域接头连接至活性vl结构域,所述活性vl结构域经由可切割接头连接至无活性的vh结构域;并且第二fc多肽(从n末端至c末端)包含:经由结构域接头与活性vh 结构域连接的针对tta的抗原结合结构域,所述活性vh结构域经由可切割接头附接至无活性的vl结构域,所述无活性的vl结构域连接至ch2-ch3-kih多肽。在一些情况下,第一fc多肽含有ch3 臼,并且第二fc多肽含有ch3杵。在一些实施方案中,第一抗原结合结构域、第二抗原结合结构域和/或第三抗原结合结构域可以结合相同的肿瘤抗原。在其他实施方案中,第一抗原结合结构域、第二抗原结合结构域和/或第三抗原结合结构域是不同的肿瘤抗原。第一抗原结合结构域和第二抗原结合结构域可以结合相同的肿瘤抗原。第一抗原结合结构域和第二抗原结合结构域可以结合不同的肿瘤抗原。第一抗原结合结构域和第三抗原结合结构域可以结合相同的肿瘤抗原。第一抗原结合结构域和第三抗原结合结构域可以结合不同的肿瘤抗原。第二抗原结合结构域和第三抗原结合结构域可以结合相同的肿瘤抗原。第二抗原结合结构域和第三抗原结合结构域可以结合不同的肿瘤抗原。
[0190]
本文提供了包含第一fc多肽和和第二fc多肽的前药构建体(例如,“构建体6”),所述第一fc多肽包含ch2-ch3-kih多肽和第一伪fv结构域,所述第一伪fv结构域包含具有标准框架区和“惰性”或“假的”cdr的可变重结构域和可变轻结构域;所述第二fc多肽包含ch2-ch3-kih多肽、能够结合靶肿瘤抗原(tta)的抗原结合结构域(abd)和呈受限形式的cd3结合结构域(其中在传统上形成fv的可变重链和轻结构域之间的接头太短而不能使所述两个结构域彼此结合)。在一些实施方案中,所述受限活性fv结构域经由可切割接头与ch2-ch3-kih多肽共价附接,并且所述第一伪fv结构域经由可切割接头与ch2-ch3-kih多肽共价
附接。在一些情况下,第一fc多肽含有ch3臼,并且第二fc多肽含有ch3杵。在一些实施方案中,可切割接头可以被相同的蛋白酶识别。在其他实施方案中,可切割接头可以被不同的蛋白酶识别。
[0191]
在“构建体6”实施方案中,第二fc多肽(从n末端至c末端)包含:经由结构域接头与受限活性fv结构域(例如,经由受限不可切割接头与活性可变轻链连接的活性可变重链,或经由受限不可切割接头与活性可变重链连接的活性可变轻链)连接的针对tta的第一抗原结合结构域,所述受限活性fv结构域经由可切割接头与ch2-ch3-kih 多肽连接;并且第一fc多肽(从n末端至c末端)包含:经由可切割接头或不可切割接头与ch2-ch3-kih多肽连接的伪fv结构域(例如,经由不可切割接头与无活性可变重结构域连接的无活性可变轻结构域,或经由不可切割接头与无活性可变轻结构域连接的无活性可变重结构域)。在一些情况下,第一fc多肽含有ch3臼,并且第二fc多肽含有ch3杵。
[0192]
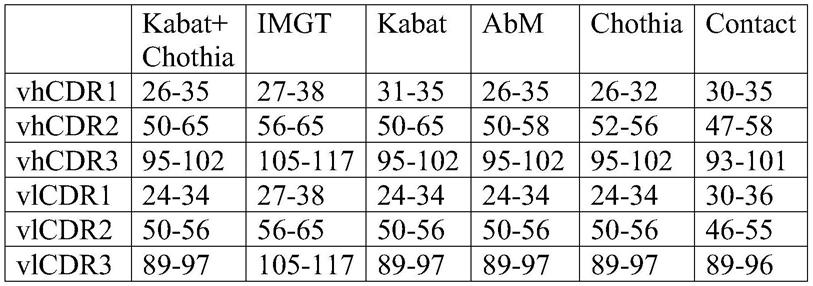
本文提供了与“构建体6”类似的另一种前药构建体(例如,“构建体7”)。构建体7的示例性实施方案包括第二fc多肽和第一fc多肽,所述第二fc多肽包含ch2-ch3-kih多肽、能够结合靶肿瘤抗原(tta) 的第一抗原结合结构域(abd)、能够结合靶肿瘤抗原(tta)的第二抗原结合结构域(abd)和呈受限形式的cd3结合结构域(其中在传统上形成fv的可变重链和轻结构域之间的接头太短而不能使所述两个结构域彼此结合);所述第一fc多肽包含ch2-ch3-kih多肽和第一伪 fv结构域。在一些情况下,第一fc多肽含有ch3臼,并且第二fc 多肽含有ch3杵。在一些情况下,第一抗原结合结构域和第二抗原结合结构域可以结合相同的肿瘤抗原。在其他情况下,第一抗原结合结构域和第二抗原结合结构域可以结合不同的肿瘤抗原。
[0193]
在“构建体7”实施方案中,第二fc多肽(从n末端至c末端)包含:经由结构域接头与受限活性fv结构域(例如,经由受限不可切割接头与活性可变轻链连接的活性可变重链,或经由受限不可切割接头与活性可变重链连接的活性可变轻链)连接的针对tta的第一抗原结合结构域,所述受限活性fv结构域经由结构域接头连接至第二抗原结合结构域,所述第二抗原结合结构域经由可切割接头连接至 ch2-ch3-kih多肽。并且第一fc多肽(从n末端至c末端)包含:经由可切割或不可切割接头与ch2-ch3-kih多肽连接的伪fv结构域 (例如,经由不可切割接头与无活性可变重结构域连接的无活性可变轻结构域,或经由不可切割接头与无活性可变轻结构域连接的无活性可变重结构域)。在一些情况下,第一fc多肽含有ch3臼,并且第二fc多肽含有ch3杵。在一些实施方案中,与ch2-ch3-杵多肽相邻的可切割接头是与ch2-ch3-臼多肽相邻的相同可切割接头。在其他实施方案中,可切割接头是不同的。
[0194]
本文提供了同源二聚体fc前药构建体(例如,“构建体8”)。构建体8的示例性实施方案包括第一fc多肽和第二fc多肽,所述第一 fc多肽包含能够结合靶肿瘤抗原(tta)的第一抗原结合结构域 (abd)、呈受限形式的第一cd3结合结构域(其中在传统上形成fv的可变重链和轻结构域之间的接头太短而不能使所述两个结构域彼此结合)、能够结合靶肿瘤抗原(tta)的第二抗原结合结构域(abd)、第一伪fv结构域和ch2-ch3多肽;所述第二fc多肽包含能够结合靶肿瘤抗原(tta)的第三抗原结合结构域(abd)、呈受限形式的第二 cd3结合结构域(其中在传统上形成fv的可变重链和轻结构域之间的接头太短而不能使所述两个结构域彼此结合)、能够结合靶肿瘤抗原 (tta)的第四抗原结合结构域(abd)、第二伪fv结构域和第二 ch2-ch3多肽。在一些情况下,第一抗原结合结构域和第二抗原结合结构域可以结
合相同的肿瘤抗原。在其他情况下,第一抗原结合结构域和第二抗原结合结构域可以结合不同的肿瘤抗原。在一些情况下,第三抗原结合结构域和第四抗原结合结构域可以结合相同的肿瘤抗原。在其他情况下,第三抗原结合结构域和第四抗原结合结构域可以结合不同的肿瘤抗原。在一些情况下,第一抗原结合结构域、第二抗原结合结构域、第三抗原结合结构域和/或第四抗原结合结构域可以结合相同的肿瘤抗原。
[0195]
在“构建体8”实施方案中,第一fc多肽(从n末端至c末端)包含:经由结构域接头与第一受限活性cd3 fv结构域(例如,经由受限不可切割接头与活性可变轻链连接的活性可变重链,或经由受限不可切割接头与活性可变重链连接的活性可变轻链)连接的针对tta的第一抗原结合结构域,所述第一受限活性cd3 fv结构域连接至第二抗原结合结构域,所述第二抗原结合结构域经由可切割接头与第一伪 cd3 fv结构域(例如,经由不可切割接头与无活性可变重结构域连接的无活性可变轻结构域,或经由不可切割接头与无活性可变轻结构域连接的无活性可变重结构域)连接,所述第一伪cd3 fv结构域连接至 ch2-ch3多肽;并且第二fc多肽(从n末端至c末端)包含:经由结构域接头与第二受限活性cd3 fv结构域(例如,经由受限不可切割接头与活性可变轻链连接的活性可变重链,或经由受限不可切割接头与活性可变重链连接的活性可变轻链)连接的针对tta的第三抗原结合结构域,所述受限活性cd3 fv结构域连接至第四抗原结合结构域,所述第四抗原结合结构域经由可切割接头连接至第二伪cd3 fv结构域(例如,经由不可切割接头与无活性可变重结构域连接的无活性可变轻结构域,或经由不可切割接头与无活性可变轻结构域连接的无活性可变重结构域),所述第二伪cd3 fv结构域连接至ch2-ch3多肽。在一些实施方案中,同源二聚体的第一fc多肽和第二fc多肽是相同的。
[0196]
本文提供了另一种异源二聚体fc前药构建体(例如,“构建体9”)。构建体9的示例性实施方案包括包含ch2-ch3-kih多肽的第一fc 多肽;和第二fc多肽,所述第二fc多肽包含能够结合靶肿瘤抗原 (tta)的第一抗原结合结构域(abd)、呈受限形式的第一cd3结合结构域(其中在传统上形成fv的可变重链和轻结构域之间的接头太短而不能使所述两个结构域彼此结合)、能够结合靶肿瘤抗原(tta)的第二抗原结合结构域(abd)、第一伪fv结构域和ch2-ch3-kih多肽。在一些情况下,第一抗原结合结构域和第二抗原结合结构域可以结合相同的肿瘤抗原。在其他情况下,第一抗原结合结构域和第二抗原结合结构域可以结合不同的肿瘤抗原。在一些实施方案中,第一fc多肽包含fc臼结构域,并且第二fc多肽包含fc杵结构域。在一些实施方案中,第一fc多肽包含fc杵结构域,并且第二fc多肽包含fc臼结构域。
[0197]
在“构建体9”实施方案中,第一fc多肽(从n末端至c末端)包含:结构域接头(铰链接头)-ch2-ch3-kih多肽;并且第二fc多肽(从 n末端至c末端)包含:经由结构域接头与受限活性cd3 fv结构域(例如,经由受限不可切割接头与活性可变轻链连接的活性可变重链,或经由受限不可切割接头与活性可变重链连接的活性可变轻链)连接的针对tta的第一抗原结合结构域,所述受限活性cd3 fv结构域连接至第二抗原结合结构域,所述第二抗原结合结构域经由可切割接头连接至伪cd3 fv结构域(例如,经由不可切割接头与无活性可变重结构域连接的无活性可变轻结构域,或经由不可切割接头与无活性可变轻结构域连接的无活性可变重结构域),所述伪cd3 fv结构域连接至 ch2-ch3-kih多肽。
[0198]
本文提供了二聚体fc前药构建体(例如,“构建体10”或同源二聚体fc构建体)。构建体10的示例性实施方案包括第一fc多肽,所述第一fc多肽包含能够结合靶肿瘤抗原
(tta)的第一抗原结合结构域 (abd)、呈受限形式的第一cd3结合结构域(其中在传统上形成fv的可变重链和轻结构域之间的接头太短而不能使所述两个结构域彼此结合)、能够结合靶肿瘤抗原(tta)的第二抗原结合结构域(abd)、第一伪fv结构域和第一ch2-ch3多肽;和第二fc多肽,所述第二fc 多肽包含能够结合靶肿瘤抗原(tta)的第三抗原结合结构域(abd)、呈受限形式的第二cd3结合结构域(其中在传统上形成fv的可变重链和轻结构域之间的接头太短而不能使所述两个结构域彼此结合)、能够结合靶肿瘤抗原(tta)的第四抗原结合结构域(abd)、第二伪fv 结构域和第二ch2-ch3多肽。在一些情况下,第一抗原结合结构域和第二抗原结合结构域可以结合相同的肿瘤抗原。在其他情况下,第一抗原结合结构域和第二抗原结合结构域可以结合不同的肿瘤抗原。在一些情况下,第三抗原结合结构域和第四抗原结合结构域可以结合相同的肿瘤抗原。在其他情况下,第三抗原结合结构域和第四抗原结合结构域可以结合不同的肿瘤抗原。在一些情况下,第一抗原结合结构域、第二抗原结合结构域、第三抗原结合结构域和/或第四抗原结合结构域可以结合相同的肿瘤抗原。在其他情况下,第一抗原结合结构域、第二抗原结合结构域、第三抗原结合结构域和/或第四抗原结合结构域可以结合不同的肿瘤抗原。
[0199]
在“构建体10”实施方案中,第一fc多肽(从n末端至c末端)包含:经由结构域接头与第一受限活性cd3 fv结构域(例如,经由受限不可切割接头与活性可变轻链连接的活性可变重链,或经由受限不可切割接头与活性可变重链连接的活性可变轻链)连接的针对tta的第一抗原结合结构域,所述第一受限活性cd3 fv结构域连接至第二抗原结合结构域,所述第二抗原结合结构域经由可切割接头连接至第一伪cd3 fv结构域(例如,经由不可切割接头与无活性可变重结构域连接的无活性可变轻结构域,或经由不可切割接头与无活性可变轻结构域连接的无活性可变重结构域),所述第一伪cd3 fv结构域连接至第一ch2-ch3多肽;并且第二fc多肽(从n末端至c末端)包含:经由结构域接头与第二受限活性cd3 fv结构域(例如,经由受限不可切割接头与活性可变轻链连接的活性可变重链,或经由受限不可切割接头与活性可变重链连接的活性可变轻链)连接的针对tta的第三抗原结合结构域,所述第二受限活性cd3 fv结构域连接至第四抗原结合结构域,所述第四抗原结合结构域经由可切割接头连接至第二伪cd3 fv结构域(例如,经由不可切割接头与无活性可变重结构域连接的无活性可变轻结构域,或经由不可切割接头与无活性可变轻结构域连接的无活性可变重结构域),所述第二伪cd3 fv结构域连接至第二 ch2-ch3多肽。在一些实施方案中,与第一ch2-ch3多肽相邻的可切割接头是与第二ch2-ch3多肽相邻的相同的可切割接头。在其他实施方案中,可切割接头是不同的。在一些实施方案中,第一fc多肽包含fc臼结构域,并且第二fc多肽包含fc杵结构域。在一些实施方案中,第一fc多肽包含fc杵结构域,并且第二fc多肽包含fc 臼结构域。
[0200]
ii.定义
[0201]
为了更全面地理解本技术,下文阐述了几个定义。此类定义意在涵盖语法等同物。
[0202]
术语“cobra
tm”和“条件性双特异性受限活化(conditionalbispecific redirected activation)”是指具有许多功能性蛋白质结构域的双特异性条件性有效的蛋白质。在一些实施方案中,功能结构域之一是结合靶肿瘤抗原(tta)的抗原结合结构域(abd)。在某些实施方案中,另一个结构域是在某些条件下结合t细胞抗原的abd。t细胞抗原包括但不限于cd3。术语“半cobra
tm”是指在由于浓缩在靶表达细胞的表面上时固有的自组
装而使半cobra的可变重链可以与另一个半cobra
tm
(互补的半cobra
tm
)的可变轻链缔合时能够结合t细胞抗原的条件性有效的蛋白质。
[0203]
如本文所用的“氨基酸”和“氨基酸同一性”意指20种天然存在的氨基酸中的一种或可能存在于特定的、确定的位置上的任何非天然类似物。在许多实施方案中,“氨基酸”意指20种天然存在的氨基酸中的一种。本文中的“蛋白质”意指至少两个共价附接的氨基酸,其包括蛋白质、多肽、寡肽和肽。
[0204]
本文中的“氨基酸修饰”意指多肽序列中的氨基酸置换、插入和/ 或缺失或者对与蛋白质化学连接的部分的改变。例如,修饰可以是与蛋白质附接的改变的碳水化合物或peg结构。为清楚起见,除非另有说明,氨基酸修饰总是指由dna编码的氨基酸,例如在dna和 rna中具有密码子的20种氨基酸。本文中优选的氨基酸修饰是置换。
[0205]
本文中的“氨基酸置换”或“置换”意指用不同的氨基酸替代在亲本多肽序列中特定位置上的氨基酸。特别地,在一些实施方案中,所述置换是指在特定位置上非天然存在的氨基酸,不是在生物体内或在任何生物体中天然存在的。为清楚起见,已经被工程化以改变核酸编码序列但不改变起始氨基酸(例如,将cgg(编码精氨酸)交换为 cga(仍编码精氨酸)以增加宿主生物体表达水平)的蛋白质不是“氨基酸置换”;即,尽管产生了编码相同蛋白质的新基因,如果该蛋白质在其起始的特定位置上具有相同的氨基酸,则其不是氨基酸置换。
[0206]
如本文所用的“氨基酸插入”或“插入”意指在亲本多肽序列的特定位置上添加氨基酸序列。
[0207]
如本文所用的“氨基酸缺失”或“缺失”意指除去在亲本多肽序列中特定位置上的氨基酸序列。
[0208]
本发明的多肽特异性地结合cd3和靶肿瘤抗原(tta)诸如靶细胞受体,如本文所概述。“特异性结合”或“特异性地结合于”或“特异于”特定抗原或表位意指可测量地不同于非特异性相互作用的结合。特异性结合可例如通过测定与对照分子结合相比的分子结合来测量,对照分子通常是不具有结合活性的类似结构的分子。例如,可通过与类似于靶标的对照分子竞争来测定特异性结合。
[0209]
特定抗原或表位的特异性结合可以例如通过针对抗原或表位的 kd为至少约10-4
m、至少约10-5
m、至少约10-6
m、至少约10-7
m、至少约10-8
m、至少约10-9
m,可替代地,至少约10-10
m、至少约 10-11
m、至少约10-12
m或更大的抗体来展现,其中kd是指特定抗体-抗原相互作用的解离速率。通常,特异性地结合抗原的抗体对于对照分子的kd为相对于所述抗原或表位的20、50、100、500、1000、 5,000、10,000或更高倍数。
[0210]
此外,对特定抗原或抗原表位的特异性结合可例如由对于抗原或抗原表位的ka或ka为对于对照物的至少20、50、100、500、1000、5,000、10,000或更高倍数的抗体展现,其中ka或ka是指特定抗体-抗原相互作用的缔合速率。结合亲和力通常使用本领域已知的 biacore测定或octet来测量。
[0211]
如本文所用的“亲本多肽”或“前体多肽”(包括fc亲本或前体)意指随后被修饰以产生变体的多肽。亲本多肽可以是天然存在的多肽、或天然存在的多肽的变体或工程化版本。亲本多肽可以指多肽本身、包含亲本多肽的组合物或编码所述多肽的氨基酸序列。因此,如本文所用的“亲本fc多肽”意指被修饰以产生变体(通常是如本文所定义的人igg fc结构域)的未经修饰的fc多肽,并且如本文所用的“亲本抗体”意指被修饰以产生变体抗体
的未经修饰的抗体。
[0212]
如本文所用的“位置”意指蛋白质序列中的位置。位置可以按顺序编号,或者根据已建立的格式来编号,例如抗体编号的eu索引。
[0213]
如本文所用的“靶抗原”意指被给定抗体的可变区特异性地结合的分子。靶抗原可以是蛋白质、碳水化合物、脂质或其他化学化合物。本文描述了一系列合适的示例性靶抗原。
[0214]
如本文所用的“靶细胞”意指表达靶抗原的细胞。
[0215]
如本文所用的“fv”或“fv结构域”或“fv区”意指包含通常来自抗体的抗原结合结构域的vl和vh结构域的多肽。如果fv结构域含有活性vh和vl结构域(尽管在一些情况下,fv含有受限接头),则它们通常形成如本文所讨论的“抗原结合结构域”或“abd”。如下文所讨论,fv结构域在本发明中可能以多种方式组织,并且可以是“活性的”或“无活性的”,诸如呈scfv形式、受限fv形式、伪fv形式等。应当理解,在本发明中,在一些情况下,fv结构域由在单一多肽链上的vh和vl结构域组成,诸如图8和9中所示,但是使用受限接头使得不能形成分子内abd。在这些实施方案中,在切割后形成两个活性abd。在一些情况下,fv结构域由vh和vl结构域组成,其中之一是惰性的,使得仅在切割后形成分子间abd。
[0216]
本文中的“可变结构域”意指包含一个或多个ig结构域的免疫球蛋白的区域,所述一个或多个ig结构域基本上由分别构成κ链、λ链和重链免疫球蛋白基因座的vκ、vλ和/或vh基因中的任一个编码。每个vh和vl由三个高变区(“互补决定区”、“cdr”)和四个“框架区”、或“fr”构成,从氨基末端至羧基末端按以下顺序排列: fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。因此,vh结构域具有结构 vhfr1-vhcdr1-vhfr2-vhcdr2-vhfr3-vhcdr3-vhfr4,并且vl结构域具有结构vlfr1-vlcdr1-vlfr2-vlcdr2-vlfr3-vlcdr3-vlfr4。如本文更充分描述的,vhfr区和vlfr区自组装形成fv结构域。通常,在本发明的前药形式中,存在其中vh和vl结构域不能自缔合的“受限fv结构域”和其中cdr在自缔合时不形成功能性(活性)抗原结合结构域的“伪fv结构域”。
[0217]
高变区赋予抗原结合特异性,并且通常涵盖来自轻链可变区中的约氨基酸残基24-34(lcdr1;“l”表示轻链)、50-56(lcdr2)和89-97 (lcdr3)以及重链可变区中的大致约氨基酸残基31-35b(hcdr1;“h”表示重链)、50-65(hcdr2)和95-102(hcdr3)的氨基酸残基 (kabat等人,sequences of proteins of immunologicalinterest,第5版public health service,national institutes of health, bethesda,md.(1991))和/或形成轻链可变区中的高变环的那些残基(例如,残基26-32(lcdr1)、50-52(lcdr2)和91-96(lcdr3))以及形成重链可变区中的高变环的那些残基26-32(hcdr1)、53-55(hcdr2) 和96-101(hcdr3)(chothia和lesk(1987)j.mol.biol.196:901-917。下文描述了本发明的具体cdr。
[0218]
如本领域技术人员将理解的,cdr的确切编号和位置在不同的编号系统中可以不同。然而,应当理解,可变重链和/或可变轻链序列的公开包括相关(固有)cdr的公开。因此,每个可变重链区的公开是vhcdr(例如,vhcdr1、vhcdr2和vhcdr3)的公开,并且每个可变轻链区的公开是vlcdr(例如,vlcdr1、vlcdr2和vlcdr3)的公开。
[0219]
cdr编号的有用比较如下文所述,参见lafranc等人,dev.comp. immunol.27(1):55-77(2003):
[0220]
表1
[0221][0222]
在整个本说明书中,当提及可变结构域中的残基(轻链可变区的大约残基1-107和重链可变区的大约残基1-113)时通常使用kabat编号系统,并且对于fc区通常使用eu编号系统(例如kabat等人,同上(1991))。
[0223]
本发明提供了大量不同的cdr组。在这种情况下,“完整cdr 组”包含三个可变轻链cdr和三个可变重链cdr,例如vlcdr1、 vlcdr2、vlcdr3、vhcdr1、vhcdr2和vhcdr3。正如本领域技术人员将理解的,每组cdr(vh和vl cdr)可以单独地和作为一组结合抗原。例如,在受限fv结构域中,vhcdr可以结合例如cd3,并且vlcdr可以结合cd3,但在受限形式中它们不能结合cd3。
[0224]
这些cdr可以分别是较大可变轻链或可变重结构域的一部分。此外,如本文更全面概述的,可变重链和可变轻结构域可以在分开的多肽链上或在scfv序列的情况下在单一多肽链上。
[0225]
cdr有助于形成抗原结合位点,或更具体地表位结合位点。“表位”是指与可变区中称为互补位的特异性抗原结合位点相互作用的决定簇。表位是分子(诸如氨基酸或糖侧链)的分组,并且通常具有特定的结构特征以及特定的电荷特征。单个抗原可以具有多于一个表位。
[0226]
表位可以包含直接参与结合的氨基酸残基(也称为表位的免疫显性组分)和不直接参与结合的其他氨基酸残基,诸如被特异性抗原结合肽有效地阻断的氨基酸残基;换句话说,所述氨基酸残基在特异性抗原结合肽的足迹内。
[0227]
表位可以是构象的或线性的。构象表位由线性多肽链的不同区段的空间并置氨基酸产生。线性表位是由多肽链中相邻的氨基酸残基产生的一种表位。构象和非构象表位的区别可能在于,在变性溶剂的存在下丧失了与前者而不是后者的结合。
[0228]
表位通常在独特的空间构象中包括至少3个以及更通常至少5个或8-10个氨基酸。可以在显示一种抗体阻断另一种抗体与靶抗原结合的能力的简单免疫测定(例如“框并法(binning)”)中验证识别相同表位的抗体。如下文所概述,本发明不仅包括本文中所列举的抗原结合结构域和抗体,而且包括与由所列举的抗原结合结构域结合的表位竞争结合的那些。
[0229]
本发明的可变重链和可变轻结构域可以是“活性的”或“无活性的”。
[0230]
如本文所用,“无活性的vh”(“ivh”)和“无活性的vl”(“ivl”)是指伪fv结构域的组分,当其分别与其同源的vl或vh配偶体配对时,形成不特异性地结合“活性”vh或“活性”vl将结合的抗原的所得 vh/vl对,其中所述抗原结合“无活性”的类似的vl或vh。示例性的“无活性vh”和“无活性vl”结构域通过突变野生型vh或vl序列而形成。示例性突变在vh或vl的
cdr1、cdr2或cdr3内。示例性突变包括将结构域接头置于cdr2内,从而形成“无活性vh”或“无活性vl”结构域。相比之下,“活性vh”(avh)或“活性vl”(avl) 是在分别与其“活性”同源配偶体即vl或vh配对后能够与其靶抗原特异性地结合的一种序列。
[0231]
相比之下,如本文所用的术语“活性”是指能够与cd3特异性地结合的cd3结合结构域。此术语在两种背景下使用:(a)当提及fv结合对的单个成员(即vh或vl)时,其属于能够与其同源配偶体配对并特异性地结合cd3的序列;和(b)能够特异性地结合cd3的序列的同源对(即vh和vl)。示例性的“活性”vh、vl或vh/vl对是野生型或亲本序列。
[0232]“cd-x”是指分化簇(cd)蛋白。在示例性实施方案中,cd-x选自在已经施用本发明的多肽构建体的受试者中在t细胞的募集或活化方面具有作用的那些cd蛋白。在示例性实施方案中,cd-x是cd3。
[0233]
关于本发明,术语“结合结构域”表征识别靶分子(抗原)上的给定靶表位或给定靶位点(例如:分别为egfr和cd3)/与其(特异性地)结合/相互作用的结构域。靶抗原结合结构域(识别egfr)的结构和功能以及优选地还有cd3结合结构域(识别cd3)的结构和/或功能是基于抗体的结构和/或功能,例如全长或完整免疫球蛋白分子(包括sdabd) 的结构和/或功能。根据本发明,靶抗原结合结构域的特征通常在于存在三个结合靶肿瘤抗原的cdr(在本领域中通常称为可变重结构域,但是不存在相应的轻链cdr)。可替代地,针对tta的abd可以包括三个轻链cdr(即,vl区的cdr1、cdr2和cdr3)和/或三个重链cdr(即,vh区的cdr1、cdr2和cdr3)。cd3结合结构域优选地还至少包含允许靶标结合的抗体的最小结构需求。更优选地,cd3结合结构域包含至少三个轻链cdr(即,vl区的cdr1、 cdr2和cdr3)和/或三个重链cdr(即,vh区的cdr1、cdr2和 cdr3)。设想在示例性实施方案中,靶抗原和/或cd3结合结构域通过噬菌体展示或文库筛选方法产生或可通过其获得。
[0234]
如本文所用的“结构域”意指具有如本文所概述的功能的蛋白质序列。本发明的结构域包括肿瘤靶抗原结合结构域(tta结构域)、可变重结构域、可变轻结构域、接头结构域和半衰期延长结构域。
[0235]
本文中的“结构域接头”意指连接如本文所概述的两个结构域的氨基酸序列。结构域接头可以是可切割接头、受限可切割接头、不可切割接头、受限不可切割接头、scfv接头等。
[0236]
本文中的“铰链接头”意指将结构域与如本文所概述的fc结构域的铰链区连接的氨基酸序列。铰链接头可以是可切割接头、受限可切割接头、不可切割接头、受限不可切割接头、scfv接头等。
[0237]
本文中的“可切割接头”(“cl”)意指可以被蛋白酶(优选地如本文所概述的疾病组织中的人蛋白酶)切割的氨基酸序列。可切割接头的长度通常为至少3个氨基酸,其中4个、5个、6个、7个、8个、9 个、10个、11个、12个、13个、14个、15个或更多个氨基酸可用于本发明,这取决于所需的柔性。
[0238]
本文中的“不可切割接头”(“ncl”)意指在正常生理条件下不能被人蛋白酶切割的氨基酸序列。
[0239]
本文中的“可切割的受限接头”或“受限可切割接头”(“ccl”)意指含有蛋白酶切割位点(如本文所定义)的短多肽,所述蛋白酶切割位点连接如本文所概述的两个结构域,其连接方式使得所述两个结构域不能彼此显著地相互作用,直到它们驻留在不同多肽链上之
后,例如在切割之后。当ccl连接如本文所定义的vh和vl结构域时,由于分子内方式的空间限制,vh和vl在切割之前不能自组装形成功能性fv。在被相关蛋白酶切割后,vh和vl可能以分子间方式装配形成活性抗原结合结构域。通常,ccl的长度小于10个氨基酸,其中 9个、8个、7个、6个、5个和4个氨基酸可用于本发明。一般而言,蛋白酶切割位点的长度通常为至少4+个氨基酸以赋予足够的特异性,如图11a、图11b和图11c中所示。
[0240]
本文中的“不可切割的受限接头”(“nccl”)或“受限不可切割接头”(“cncl”)意指连接如本文所概述的两个结构域的短多肽,其连接方式使得所述两个结构域不能彼此显著地相互作用并且在生理条件下不被人蛋白酶显著地切割。
[0241]
本文中的“受限fv结构域”意指包含活性可变重结构域和活性可变轻结构域的fv结构域,所述活性可变重结构域和活性可变轻结构域用如本文所概述的受限接头共价地连接,其连接方式使得所述活性重链和轻链可变结构域不能在分子内相互作用以形成将结合抗原(诸如cd3)的活性fv。因此,受限fv结构域是与scfv相似但由于受限接头的存在而不能结合抗原的一种结构域。
[0242]
本文中的“伪fv结构域”意指如下结构域,所述结构域包含使用结构域接头(其可以是可切割的、受限、不可切割的、非受限等)连接的(i)伪或无活性可变重结构域和伪或无活性可变轻结构域、(ii)伪或无活性的可变重结构域和活性可变轻结构域、或(iii)活性可变重结构域和伪或无活性可变轻结构域。当彼此缔合(vhi/vli)或与活性vh或 vl缔合时,伪fv结构域的vhi和vli结构域不与人抗原结合;因此,vhi/vli、vhi/vl和vli/vh fv结构域不与人蛋白质明显地结合,使得这些结构域在人体内是惰性的。
[0243]
本文中的“单链fv”或“scfv”意指通常使用如本文所讨论的scfv 接头将可变重链(vh)结构域与可变轻链(vl)结构域共价地附接以形成scfv或scfv结构域。scfv结构域可以是n末端至c末端的任一方向(vh-接头-vl或vl-接头-vh)。
[0244]
本文中的“单结构域fv”、“sdfv”、“单结构域抗体”或“sdabd”意指仅具有三个cdr的抗原结合结构域,通常基于骆驼科(camelid)抗体技术。参见:protein engineering 9(7):1129-35(1994);rev molbiotech 74:277-302(2001);ann rev biochem 82:775-97(2013)。
[0245]“蛋白酶切割位点”是指被蛋白酶识别和切割的氨基酸序列。下文概述了合适的蛋白酶切割位点。
[0246]
如本文所用,“蛋白酶切割结构域”是指掺入“蛋白酶切割位点”以及在单个蛋白酶切割位点之间和在蛋白酶切割位点与本发明构建体的其他功能组分(例如,vh、vl、vhi、vli、靶抗原结合结构域、半衰期延长结构域等)之间的任何接头的肽序列。
[0247]
如本文所用的“fc”或“fc区”或“fc结构域”意指包含除第一恒定区免疫球蛋白结构域之外的抗体恒定区的多肽。对于igg,fc结构域包含免疫球蛋白结构域cγ2和cγ3(ch2和ch3),以及任选地在cγ1 (ch1)与cγ2(ch2)之间的全部或部分铰链区。在人igg1的eu编号中,ch2-ch3结构域包含氨基酸231至447,并且铰链是216至230。因此,“fc结构域”的定义包括氨基酸231-447(ch2-ch3)或 216-447(铰结构域-ch2-ch3)两者。
[0248]
iii.本发明的蛋白质
[0249]
本发明的蛋白质具有许多不同的组分,在本文中通常被称为结构域,它们以各种方式连接在一起。一些结构域是各自结合靶抗原(例如,tta或cd3)的结合结构域。当它们结
合多于一种抗原时,它们在本文中被称为“多特异性的”;例如,本发明的前药构建体可以结合 tta和cd3,并且因此是“双特异性的”,如图1中所示。本发明的蛋白质还可以具有更高的特异性;例如,如果第一抗原结合结构域结合egfr,第二抗原结合结构域结合epcam并且存在抗cd3结合结构域,则这将是“三特异性”分子。
[0250]
本发明的蛋白质可以包括以如本文所概述的多种方式排列的 cd3抗原结合结构域、肿瘤靶抗原结合结构域、半衰期延长结构域、接头等。
[0251]
在一些实施方案中,第一蛋白质包含第一肿瘤靶抗原结合结构域,并且第二蛋白质包含第二肿瘤靶抗原结合结构域,使得所述第一肿瘤靶抗原结合结构域和所述第二肿瘤靶抗原结合结构域结合相同的肿瘤靶抗原。在某些情况下,所述第一肿瘤靶抗原结构域和所述第二肿瘤靶抗原结构域结合相同肿瘤靶抗原的不同表位、区域或部分。在一些情况下,所述第一肿瘤靶抗原结构域和所述第二肿瘤靶抗原结构域结合不同的肿瘤靶抗原。
[0252]
本发明的蛋白质可以通过在细胞中共表达和共纯化以获得能够结合cd3和肿瘤靶抗原的蛋白质互补对而产生。在一些实施方案中,蛋白质互补对中的每一个被单独纯化。在一些实施方案中,蛋白质互补对中的每一个同时或伴随纯化。
[0253]
在一些实施方案中,表达载体包含编码蛋白质互补对中的一种蛋白质的核酸序列和编码蛋白质互补对中的另一种蛋白质的核酸序列。在一些实施方案中,宿主细胞包含这样的表达载体。在一些情况下,这样的宿主细胞可以在合适的条件下在培养基中培养以产生蛋白质。在一些实施方案中,在合适的条件下培养宿主细胞以将本文所述的蛋白质分泌到培养基中。在某些实施方案中,纯化包含本发明分泌性蛋白质的培养基以获得蛋白质互补对中的蛋白质。有用的纯化方法包括但不限于蛋白质a层析、蛋白质g层析、肝素结合、反相色谱、hic 层析、cht层析、亲和层析、阴离子交换色谱、阳离子交换色谱、尺寸排阻色谱等。
[0254]
a.cd3抗原结合结构域
[0255]
t细胞应答的特异性是通过t细胞受体复合物识别抗原(在主要组织相容性复合物mhc的情况下展示的)介导的。作为t细胞受体复合物的一部分,cd3是包括存在于细胞表面上的cd3γ(伽马)链、 cd3δ(德尔塔)链和两条cd3ε(伊普西隆)链的蛋白质复合物。cd3与t 细胞受体(tcr)的α(阿尔法)和β(贝塔)链以及cd-ζ(泽塔)一起缔合以包含t细胞受体复合物。cd3在t细胞上的聚集,诸如通过与cd3 结合的fv结构域,导致类似于t细胞受体的参与但不依赖于其克隆典型特异性的t细胞活化。
[0256]
然而,如本领域已知的,cd3活化可能引起许多毒性副作用,并且因此本发明涉及仅在发现特定蛋白酶的肿瘤细胞的存在下提供本发明多肽的活性cd3结合,所述特定蛋白酶然后切割本发明的前药多肽以提供活性cd3结合结构域。因此,在本发明中,抗cd3 fv 结构域与cd3的结合受蛋白酶切割结构域调节,所述蛋白酶切割结构域仅在具有升高水平的蛋白酶的患病细胞或组织的微环境中(例如在本文所述的肿瘤微环境中)限制cd3 fv结构域与cd3的结合。
[0257]
因此,本发明提供两组vh和vl结构域,即活性组(vh和vl) 和无活性组(vhi和vli),所有四种都存在于前药构建体中。对构建体进行格式化,使得vh和vl组不能自缔合,而是与无活性的配偶体缔合,例如如本文所示的vhi和vl以及vli和vh。
[0258]
存在许多本领域已知的可用于本发明的合适的活性cdr组、和/ 或vh和vl结构域。
例如,cdr和/或vh和vl结构域衍生自已知的抗cd3抗体,例如莫罗单抗(muromonab)-cd3(okt3)、奥昔珠单抗(trx4)、替利珠单抗(mga031)、维西珠单抗(nuvion)、sp34或i2c、 tr-66或x35-3、vit3、bma030(bw264/56)、clb-t3/3、cris7、 yth12.5、f111-409、clb-t3.4.2、tr-66、wt32、spv-t3b、11d8、 xiii-141、xiii-46、xiii-87、12f6、t3/rw2-8c8、t3/rw2-4b6、okt3d、 m-t301、smc2、f101.01、ucht-1和wt-31。
[0259]
在一些实施方案中,形成与人cd3结合的活性fv结构域的vh 和vl序列在图2a-2b中显示为cd3 vh(seq id no:186)和cd3 vl(seq id no:170)。
[0260]
无活性vhi和vli结构域含有允许缔合的“规则”构架区(fr),使得无活性可变结构域将与活性可变结构域缔合,从而使得该对无活性,例如不能结合cd3。在一个实施方案中,当一个或两个无活性结构域存在于互补构建体对中时,vhi和vli形成无活性的fv结构域。在一个实施方案中,当存在一个或两个无活性结构域时形成无活性 fv结构域的vhi和vli在图2a-2b中显示为vhi(seq id no:190) 和vli(seq id no:174)。在一个实施方案中,当存在一个或两个无活性结构域时形成无活性fv结构域的vhi2和vli2在图2a-2b中显示为vhi2(seq id no:194)和vli2(seq id no:178)。在一个实施方案中,当存在一个或两个无活性结构域时形成无活性fv结构域的 vhgl4和vligl在图2a-2b中显示为vhigl4(seq id no:198)和 vligl(seq id no:182)。
[0261]
在一些实施方案中,无活性vhi结构域包含一个或多个(例如,1 个、2个、3个、4个、5个、6个、7个、8个、9个或更多个)氨基酸修饰(例如,氨基酸插入、缺失或置换),当与活性vl结构域配对时所述氨基酸修饰使得配对的vhi-vl结构域不能结合靶抗原。在其他实施方案中,无活性vli结构域包含一个或多个(例如,1个、2个、 3个、4个、5个、6个、7个、8个、9个或更多个)氨基酸修饰(例如,氨基酸插入、缺失或置换),当与活性vh结构域配对时所述氨基酸修饰使得配对的vh-vli结构域不能结合靶抗原。
[0262]
如本领域技术人员将理解的,存在许多可用于本发明的“无活性”可变结构域。基本上,可以使用具有允许与另一个可变结构域自组装的人框架区的任何可变结构域,无论在可变区中的cdr位置上有什么氨基酸。为清楚起见,无活性结构域据说包括cdr,但是在技术上无活性可变结构域不赋予结合能力。
[0263]
在一些情况下,可以将无活性结构域工程化以促进在前药形式中的选择性结合,以促进在切割之前形成分子内vhi-vl和vh-vli结构域(例如,通过分子间配对形成)。参见例如,igawa等人,protein eng. des.selection 23(8):667-677(2010),其据此以引用的方式整体并且尤其是关于界面残基氨基酸置换部分明确地并入。
[0264]
在一个方面,本文所述的多肽构建体包含当被蛋白酶活化时特异性地结合cd3的结构域。在一个方面,本文所述的多肽构建体包含两个或更多个当被蛋白酶活化时特异性地结合人cd3的结构域。在一些实施方案中,本文所述的多肽构建体包含两个或更多个在被蛋白酶活化时特异性地结合cd3ε的结构域。在一些实施方案中,本文所述的多肽构建体包含两个或更多个在被蛋白酶活化时特异性地结合cd3ε的结构域。
[0265]
在一些实施方案中,蛋白酶切割位点位于第一单体上的抗cd3 活性vh和无活性vl结构域之间,并防止它们折叠并结合在t细胞上的cd3。在一些实施方案中,蛋白酶切割位点位于第二单体上的抗 cd3无活性vh和活性vl结构域之间,并防止它们折叠并结合在t 细胞上的cd3。一旦蛋白酶切割位点被在靶细胞上存在的蛋白酶切割,第一单体的抗cd3活性vh
结构域和第二单体的抗cd3活性 vl结构域就能够结合在t细胞上的cd3。
[0266]
在某些实施方案中,本文所述的多肽构建体的cd3结合结构域不仅表现出与人cd3的有效cd3结合亲和力,而且还表现出与相应的食蟹猴cd3蛋白质的优异交叉反应性。在一些情况下,多肽构建体的cd3结合结构域与来自食蟹猴的cd3交叉反应。在某些情况下,针对cd3的人:食蟹猴kd比率在5与0.2之间。
[0267]
在一些实施方案中,抗原结合蛋白质的cd3结合结构域可以是结合cd3的任何结构域,包括但不限于来自单克隆抗体、多克隆抗体、重组抗体、人抗体、人源化抗体的结构域。在一些情况下,cd3 结合结构域衍生自抗原结合蛋白质将最终用于其中的相同物种是有益的。例如,用于人时,抗原结合蛋白质的cd3结合结构域包含来自抗体或抗体片段的抗原结合结构域的人或人源化残基可能是有益的。
[0268]
因此,在一个方面,抗原结合结构域包含人源化或人结合结构域。在一个实施方案中,人源化或人抗cd3结合结构域包含本文所述的人源化或人抗cd3结合结构域的一个或多个(例如,所有三个)轻链互补决定区1(lc cdr1)、轻链互补决定区2(lc cdr2)和轻链互补决定区3(lc cdr3),和/或本文所述的人源化或人抗cd3结合结构域 (例如包含一个或多个(例如,所有三个)lc cdr和一个或多个(例如,所有三个)hc cdr的人源化或人抗cd3结合结构域)的一个或多个(例如,所有三个)重链互补决定区1(hc cdr1)、重链互补决定区2 (hc cdr2)和重链互补决定区3(hc cdr3)。
[0269]
在一些实施方案中,人源化或人抗cd3结合结构域包含对cd3 具有特异性的人源化或人轻链可变区,其中对cd3具有特异性的轻链可变区包含在人轻链框架区中的人或非人轻链cdr。在某些情况下,轻链框架区是λ(兰布达)轻链框架。在其他情况下,轻链框架区是κ(卡帕)轻链框架。
[0270]
在一些实施方案中,一个或多个cd3结合结构域是人源化的或完全人的。在一些实施方案中,一个或多个活化的cd3结合结构域对在cd3表达细胞上的cd3具有1000nm或更小的kd结合。在一些实施方案中,一个或多个活化的cd3结合结构域对在cd3表达细胞上的cd3具有100nm或更小的kd结合。在一些实施方案中,一个或多个活化的cd3结合结构域对在cd3表达细胞上的cd3具有 10nm或更小的kd结合。在一些实施方案中,一个或多个cd3结合结构域与食蟹猴cd3具有交叉反应性。在一些实施方案中,一个或多个cd3结合结构域包含本文所提供的氨基酸序列。
[0271]
在一些实施方案中,人源化或人抗cd3结合结构域包含对cd3 具有特异性的人源化或人重链可变区,其中对cd3具有特异性的重链可变区包含在人重链框架区中的人或非人重链cdr。
[0272]
在一个实施方案中,抗cd3结合结构域是包含本文所提供的氨基酸序列的轻链和重链的fv。在一个实施方案中,抗cd3结合结构域包含:轻链可变区,所述轻链可变区包含具有本文所提供的轻链可变区的氨基酸序列的至少一个、两个或三个修饰(例如,置换、插入和缺失)但不多于30个、20个或10个修饰(例如,置换、插入和缺失) 的氨基酸序列、或者与本文所提供的氨基酸序列具有95-99%同一性的序列;和/或重链可变区,所述重链可变区包含具有本文所提供的重链可变区的氨基酸序列的至少一个、两个或三个修饰(例如,置换、插入和缺失)但不多于30个、20个或10个修饰(例如,置换、插入和缺失)的氨基酸序列、或者与本文所提供的氨基酸序列具有95-99%同一性的序列。在一个实施方案中,人源化或
人抗cd3结合结构域是 scfv,并且包含本文所述的氨基酸序列的轻链可变区经由scfv接头与包含本文所述的氨基酸序列的重链可变区附接。scfv的轻链可变区和重链可变区可以是例如以下方向中的任一种:轻链可变区-scfv接头-重链可变区或重链可变区-scfv接头-轻链可变区。
[0273]
在一些实施方案中,抗原结合蛋白质的cd3结合结构域具有kd 为1000nm或更小100nm或更小50nm或更小20nm或更小10nm 或更小5nm或更小1nm或更小、或0.5nm或更小的对在cd3表达细胞上的cd3的亲和力。在一些实施方案中,抗原结合蛋白质的cd3 结合结构域具有kd为1000nm或更小100nm或更小50nm或更小 20nm或更小10nm或更小5nm或更小1nm或更小、或0.5nm或更小的对cd3ε的亲和力。在另外的实施方案中,抗原结合蛋白质的 cd3结合结构域具有低的对cd3的亲和力,即约100nm或更大。
[0274]
与cd3结合的亲和力可以例如通过抗原结合蛋白质本身或其 cd3结合结构域与在测定板上包被;在微生物细胞表面上展示;在溶液中;等等的cd3结合的能力来确定,如本领域已知的,通常使用 biacore或octet测定。本公开的抗原结合蛋白质本身或其cd3结合结构域对cd3的结合活性可以通过将配体(例如,人cd3)或抗原结合蛋白质本身或其cd3结合结构域固定至珠、底物、细胞等上来测定。可以将药剂添加到适当的缓冲液中并将结合配偶体在给定温度下孵育一段时间。在洗涤除去未结合的物质之后,结合的蛋白质可以用例如sds、高ph缓冲液等释放,并通过例如表面等离子体共振(spr) 进行分析。
[0275]
b.针对肿瘤靶抗原的抗原结合结构域
[0276]
除了所述的cd3和半衰期延长结构域之外,本文所述的多肽构建体还包含至少一个或至少两个或更多个结构域,所述结构域结合一个或多个靶抗原或在单个靶抗原上的一个或多个区域。本文预期本发明的多肽构建体在例如疾病特异性微环境中或在受试者的血液中在蛋白酶切割结构域处被切割,并且每个靶抗原结合结构域将结合靶细胞上的靶抗原,由此活化cd3结合结构域以结合t细胞。通常,tta 结合结构域可以在蛋白酶切割之前结合它们的靶标,因此它们可以在靶细胞上“等待”以被活化为t细胞接合物。至少一种靶抗原参与疾病、障碍或病症和/或与疾病、障碍或病症相关。示例性的靶抗原包括与增生性疾病、肿瘤性疾病、炎症性疾病、免疫性障碍、自身免疫性疾病、感染性疾病、病毒性疾病、过敏反应、寄生虫反应、移植物抗宿主病或宿主抗移植物病相关的那些。在一些实施方案中,靶抗原是在肿瘤细胞上表达的肿瘤抗原。可替代地,在一些实施方案中,靶抗原与病原体诸如病毒或细菌相关。至少一种靶抗原也可能针对健康组织。
[0277]
在一些实施方案中,靶抗原是细胞表面分子诸如蛋白质、脂质或多糖。在一些实施方案中,靶抗原是在肿瘤细胞、病毒感染细胞、细菌感染细胞、受损红细胞、动脉斑块细胞或纤维化组织细胞上。本文预期在结合多于一种靶抗原时,两个无活性cd3结合结构域共定位并在靶细胞表面上形成活性cd3结合结构域。在一些实施方案中,抗原结合蛋白质包含多于一个靶抗原结合结构域以活化在抗原结合蛋白质中的无活性cd3结合结构域。在一些实施方案中,抗原结合蛋白质包含多于一个靶抗原结合结构域以增强与靶细胞结合的强度。在一些实施方案中,抗原结合蛋白质包含多于一个靶抗原结合结构域以增强与靶细胞结合的强度。在一些实施方案中,多于一个抗原结合结构域包含相同的抗原结合结构域。在一些实施方案中,多于一个抗原结合结构域包含不同的抗原结合结构域。例如,已知在患病细胞或组织(例如肿瘤或癌细胞)中双重表达的两个不同的抗原结合结构域可以增强抗原结合蛋
白质对靶标的结合或选择性。
[0278]
本文考虑的多肽构建体包括至少一个抗原结合结构域,其中所述抗原结合结构域结合至少一种靶抗原。在一些情况下,靶抗原在患病细胞或组织(例如肿瘤或癌细胞)的表面上表达。靶抗原包括但不限于上皮细胞粘附分子(epcam)、表皮生长因子受体(egfr)、人表皮生长因子受体2(her-2)、人表皮生长因子受体3(her-3)、c-met、叶酸受体1(folr1)、b7h3(cd276)、含有ly6/plaur结构域的蛋白3 (lypd3)、癌胚抗原(cea)、碳酸酐酶9(ca9或caix)和肿瘤相关钙信号转导蛋白2(trop2)。在一些实施方案中,本文所提供的构建体的一个、两个或更多个抗原结合结构域结合egfr、epcam、b7h3、 folr1、trop2和ca9。
[0279]
本文所公开的多肽构建体还包括包含两个与已知在患病细胞或组织上表达的两种不同的靶抗原结合抗原结合结构域的蛋白质。示例性的抗原结合结构域对包括但不限于egfr/epcam、egfr/folr1、 egfr/b7h3、epcam/folr1、epcam/b7h3、epcam/bcma、 folr1/b7h3、b7h3/epcam、trop2/egfr、trop2/epcam、 trop2/b7h3、trop2/folr1、trop2/ca9、ca9/egfr、ca9/epcam、 ca9/b7h3、ca9/folr1等。
[0280]
本文所述的多肽构建体的设计允许针对一种或多种靶抗原的结合结构域是柔性的,因为针对靶抗原的结合结构域可以是任何类型的结合结构域,包括但不限于来自单克隆抗体、多克隆抗体、重组抗体、人抗体、人源化抗体的结构域。在一些实施方案中,针对靶抗原的结合结构域是单链可变片段(scfv)、单结构域抗体诸如骆驼科来源的纳米抗体的重链可变结构域(vh)、轻链可变结构域(vl)和可变结构域 (vhh)。在其他实施方案中,针对靶抗原的结合结构域是非ig结合结构域,即抗体模拟物,诸如anticalins、affilins、affibody分子、affimers、 affitins、alphabodies、高亲和性多聚体(avimers)、darpins、fynomers、 kunitz结构域肽和单体(monobodies)。在另外的实施方案中,针对一种或多种靶抗原的结合结构域是与一种或多种靶抗原结合或缔合的配体、受体结构域、凝集素或肽。
[0281]
在一些实施方案中,靶细胞抗原结合结构域独立地包含与靶抗原特异性地结合的scfv、vh结构域、vl结构域、非ig结构域或配体。在一些实施方案中,靶抗原结合结构域特异性地结合细胞表面分子。在一些实施方案中,靶抗原结合结构域特异性地结合肿瘤抗原。在一些实施方案中,靶抗原结合结构域特异性地且独立地结合选自egfr、 her-2、her-3、cmet、lypd3、ca9、cea folr1、b7h3、epcam 和trop2中的至少一种的抗原。在一些实施方案中,靶抗原结合结构域特异性地且独立地结合两种不同的抗原,其中所述抗原中的至少一种选自egfr、her-2、her-3、cmet、lypd3、cea folr1、b7h3、 epcam、trop2和ca9中的一种。在一些实施方案中,靶抗原结合结构域特异性地且独立地结合选自egfr、folr1、b7h3、epcam、 trop2和ca9中的至少一种的抗原。在一些实施方案中,靶抗原结合结构域特异性地且独立地结合两种不同的抗原,其中所述抗原中的至少一种选自egfr、folr1、b7h3、epcam、trop2和ca9中的一种。
[0282]
在许多实施方案中,针对靶肿瘤抗原(tta)的抗原结合结构域 (abd)是基于骆驼科动物单结构域抗体(sdabd)的单结构域抗原结合结构域(sdabd-tta)。sdabd-tta具有与传统抗体一样的框架区以及三个cdr,但不具有任何重链恒定结构域。这些sdabd-tta通常优于结合tta的scfv,因为导致不结合cd3的无活性fv形成的分子内折叠较不复杂,具有较少的vh和vl结构域。这些sdabd-tta 可以被它们结合的靶标标记,例如sdabd-egfr是结合人egfr的 sdabd等。
[0283]
在一些实施方案中,抗原结合结构域结合egfr并且具有seqidno:50所示或在图1a中显示为抗egfr1的氨基酸序列。在一些实施方案中,抗原结合结构域结合egfr并且具有seqidno:50所示或在图1a中显示为抗egfr1的氨基酸序列的人源化形式。在其他实施方案中,抗原结合结构域结合egfr并且具有seqidno:50所示或在图1a中显示为抗egfr1的序列的cdr和/或可变结构域。
[0284]
在其他实施方案中,抗原结合结构域结合egfr并且具有seqidno:54所示或在图1a中显示为抗egfr2的氨基酸序列。在其他实施方案中,抗原结合结构域结合egfr并且具有seqidno:54所示或在图1a中显示为抗egfr2的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合egfr并且具有seqidno:54所示或在图1a中显示为抗egfr2的序列的cdr和/或可变结构域。
[0285]
在一些实施方案中,抗原结合结构域结合egfr并且具有seqidno:58所示或在图1a中显示为抗egfr1的氨基酸序列。在其他实施方案中,抗原结合结构域结合egfr并且具有seqidno:58所示或在图1a中显示为人源化抗egfr1的氨基酸序列的人源化形式。在其他实施方案中,抗原结合结构域结合egfr并且具有seqidno:58所示或在图1a中显示为抗egfr1的序列的cdr和/或可变结构域。
[0286]
在某些实施方案中,抗原结合结构域结合egfr并且具有seqidno:62所示或在图1a中显示为抗egfr2asdab的氨基酸序列。在其他实施方案中,抗原结合结构域结合egfr并且具有seqidno:62所示或在图1a中显示为人源化抗egfr2a的氨基酸序列的人源化形式。在各种实施方案中,抗原结合结构域结合egfr并且具有seqidno:62所示或在图1a中显示为抗egfr2a的序列的cdr和/或可变结构域。
[0287]
在某些实施方案中,抗原结合结构域结合egfr并且具有seqidno:66所示或在图1a中显示为抗egfr2d的氨基酸序列。在其他实施方案中,抗原结合结构域结合egfr并且具有seqidno:66所示或在图1a中显示为人源化抗egfr2d的氨基酸序列的人源化形式。在各种实施方案中,抗原结合结构域结合egfr并且具有seqidno:66所示或在图1a中显示为抗egfr2d的序列的cdr和/或可变结构域。
[0288]
在一些实施方案中,抗原结合结构域结合folr1并且具有seqidno:70所示或在图1b中显示为抗folr1h77-2的氨基酸序列。在其他实施方案中,抗原结合结构域结合folr1并且具有seqidno:70所示或在图1b中显示为抗folr1h77-2的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合folr1并且具有seqidno:70所示或在图1b中显示为抗folr1h77-2的序列的cdr和/或可变结构域。
[0289]
在一些实施方案中,抗原结合结构域结合folr1并且具有seqidno:74所示或在图1b中显示为抗folr1h59.3的氨基酸序列。在其他实施方案中,抗原结合结构域结合folr1并且具有seqidno:74所示或在图1b中显示为抗folr1h59.3的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合folr1并且具有seqidno:74所示或在图1b中显示为抗folr1h59.3的序列的cdr和/或可变结构域。
[0290]
在一些实施方案中,抗原结合结构域结合folr1并且具有seqidno:78所示或在图1b中显示为抗folr1h22-4的氨基酸序列。在其他实施方案中,抗原结合结构域结合folr1并且具有seqidno:78所示或在图1b中显示为抗folr1h22-4的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合folr1并且具有seqidno:78所示或在
图1b中显示为抗folr1h22-4的序列的cdr和/或可变结构域。
[0291]
在一些实施方案中,抗原结合结构域结合b7h3并且具有seqidno:82所示或在图1b中显示为抗b7h3hf7的氨基酸序列。在其他实施方案中,抗原结合结构域结合b7h3并且具有seqidno:82所示或在图1b中显示为抗b7h3hf7的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合b7h3并且具有seqidno:82所示或在图1b中显示为抗b7h3hf7的序列的cdr和/或可变结构域。
[0292]
在一些实施方案中,抗原结合结构域结合b7h3并且具有seqidno:86所示或在图1c中显示为抗b7h3hf12的氨基酸序列。在其他实施方案中,抗原结合结构域结合b7h3并且具有seqidno:86所示或在图1c中显示为抗b7h3hf12的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合b7h3并且具有seqidno:86所示或在图1c中显示为抗b7h3hf12的序列的cdr和/或可变结构域。在一些实施方案中,结合b7h3的abd被修饰以除去n连接的糖基化位点。在一些实施方案中,本发明的fc融合蛋白包含亲本抗b7h3hf12sdab(seqidno:86)的抗b7h3sdab变体,所述变体包含选自n57q、n57e、n57d、s59a和s59y的一个或多个氨基酸修饰。
[0293]
在一些实施方案中,抗原结合结构域结合b7h3并且具有seqidno:90所示或在图1c中显示为抗b7h3hf12(n57q)的氨基酸序列。在其他实施方案中,抗原结合结构域结合b7h3并且具有seqidno:90所示或在图1c中显示为抗b7h3hf12(n57q)的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合b7h3并且具有seqidno:90所示或在图1c中显示为抗b7h3hf12(n57q)的序列的cdr和/或可变结构域。
[0294]
在一些实施方案中,抗原结合结构域结合b7h3并且具有seqidno:94所示或在图1c中显示为抗b7h3hf12(n57e)的氨基酸序列。在其他实施方案中,抗原结合结构域结合b7h3并且具有seqidno:94所示或在图1c中显示为抗b7h3hf12(n57e)的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合b7h3并且具有seqidno:94所示或在图1c中显示为抗b7h3hf12(n57e)的序列的cdr和/或可变结构域。
[0295]
在一些实施方案中,抗原结合结构域结合b7h3并且具有seqidno:98所示或在图1c中显示为抗b7h3hf12(n57d)的氨基酸序列。在其他实施方案中,抗原结合结构域结合b7h3并且具有seqidno:98所示或在图1c中显示为抗b7h3hf12(n57d)的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合b7h3并且具有seqidno:98所示或在图1c中显示为抗b7h3hf12(n57d)的序列的cdr和/或可变结构域。
[0296]
在一些实施方案中,抗原结合结构域结合b7h3并且具有seqidno:102所示或在图1d中显示为抗b7h3hf12(s59a)的氨基酸序列。在其他实施方案中,抗原结合结构域结合b7h3并且具有seqidno:102所示或在图1d中显示为抗b7h3hf12(s59a)的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合b7h3并且具有seqidno:102所示或在图1d中显示为抗b7h3hf12(s59a)的序列的cdr和/或可变结构域。
[0297]
在一些实施方案中,抗原结合结构域结合b7h3并且具有seqidno:106所示或在图1d中显示为抗b7h3hf12(s59y)的氨基酸序列。在其他实施方案中,抗原结合结构域结合b7h3并且具有seqidno:106所示或在图1d中显示为抗b7h3hf12(s59y)的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合b7h3并且具有seqidno:106所示或在图1d中显示为抗b7h3hf12(s59y)的序列的cdr和/或可变结构域。
[0298]
在一些实施方案中,抗原结合结构域结合epcam并且具有seqid no:110所示或在图1d中显示为抗epcam h13的氨基酸序列。在其他实施方案中,抗原结合结构域结合epcam并且具有seq idno:110所示或在图1d中显示为抗epcam h13的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合epcam并且具有 seq id no:110所示或在图1d中显示为抗epcam h13的序列的 cdr和/或可变结构域。在一些实施方案中,本发明的fc融合蛋白包含结合未切割的epcam的抗epcam sdab。在一些实施方案中,本发明的fc融合蛋白包含结合切割过的epcam的抗epcam sdab。在一些实施方案中,抗epcam sdab结合未切割的和切割过的epcam。
[0299]
在一些实施方案中,抗原结合结构域结合epcam并且具有seqid no:114所示或在图1d中显示为抗epcam h23的氨基酸序列。在其他实施方案中,抗原结合结构域结合epcam并且具有seq idno:114所示或在图1d中显示为抗epcam h23的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合epcam并且具有 seq id no:114所示或在图1d中显示为抗epcam h23的序列的 cdr和/或可变结构域。在一些实施方案中,本发明的fc融合蛋白包含结合未切割的epcam的抗epcam sdab。在一些实施方案中,本发明的fc融合蛋白包含结合切割过的epcam的抗epcam sdab。在一些实施方案中,抗epcam sdab结合未切割的和切割过的 epcam。
[0300]
在一些实施方案中,抗原结合结构域结合epcam并且具有seqid no:118所示或在图1e中显示为抗epcam hvib665的氨基酸序列。在其他实施方案中,抗原结合结构域结合epcam并且具有seqid no:118所示或在图1e中显示为抗epcam hvib665的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合epcam 并且具有seq id no:118所示或在图1e中显示为抗epcamhvib665的序列的cdr和/或可变结构域。在一些实施方案中,本发明的fc融合蛋白包含结合未切割的epcam的抗epcam sdab。在一些实施方案中,本发明的fc融合蛋白包含结合切割过的epcam 的抗epcam sdab。在一些实施方案中,抗epcam sdab结合未切割的和切割过的epcam。
[0301]
在一些实施方案中,抗原结合结构域结合epcam并且具有seqid no:122所示或在图1e中显示为抗epcam hvib666的氨基酸序列。在其他实施方案中,抗原结合结构域结合epcam并且具有seqid no:122所示或在图1e中显示为抗epcam hvib666的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合epcam 并且具有seq id no:122所示或在图1e中显示为抗epcamhvib666的序列的cdr和/或可变结构域。在一些实施方案中,本发明的fc融合蛋白包含结合未切割的epcam的抗epcam sdab。在一些实施方案中,本发明的fc融合蛋白包含结合切割过的epcam 的抗epcam sdab。在一些实施方案中,抗epcam sdab结合未切割的和切割过的epcam。
[0302]
在一些实施方案中,抗原结合结构域结合trop2并且具有seq idno:126所示或在图1e中显示为抗trop2 hvib557的氨基酸序列。在其他实施方案中,抗原结合结构域结合trop2并且具有seq id no: 126所示或在图1e中显示为抗trop2 hvib557的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合trop2并且具有 seq id no:126所示或在图1e中显示为抗trop2 hvib557的序列的 cdr和/或可变结构域。
[0303]
在一些实施方案中,抗原结合结构域结合trop2并且具有seq idno:130所示或在图1e中显示为抗trop2 hvib565的氨基酸序列。在其他实施方案中,抗原结合结构域结合
trop2并且具有seqidno:130所示或在图1e中显示为抗trop2hvib565的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合trop2并且具有seqidno:130所示或在图1e中显示为抗trop2hvib565的序列的cdr和/或可变结构域。
[0304]
在一些实施方案中,抗原结合结构域结合trop2并且具有seqidno:134所示或在图1f中显示为抗trop2hvib575的氨基酸序列。在其他实施方案中,抗原结合结构域结合trop2并且具有seqidno:134所示或在图1f中显示为抗trop2hvib575的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合trop2并且具有seqidno:134所示或在图1f中显示为抗trop2hvib575的序列的cdr和/或可变结构域。
[0305]
在一些实施方案中,抗原结合结构域结合trop2并且具有seqidno:138所示或在图1f中显示为抗trop2hvib578的氨基酸序列。在其他实施方案中,抗原结合结构域结合trop2并且具有seqidno:138所示或在图1f中显示为抗trop2hvib578的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合trop2并且具有seqidno:138所示或在图1f中显示为抗trop2hvib578的序列的cdr和/或可变结构域。
[0306]
在一些实施方案中,抗原结合结构域结合trop2并且具有seqidno:142所示或在图1f中显示为抗trop2hvib609的氨基酸序列。在其他实施方案中,抗原结合结构域结合trop2并且具有seqidno:142所示或在图1f中显示为抗trop2hvib609的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合trop2并且具有seqidno:142所示或在图1f中显示为抗trop2hvib609的序列的cdr和/或可变结构域。
[0307]
在一些实施方案中,抗原结合结构域结合trop2并且具有seqidno:146所示或在图1f中显示为抗trop2hvib619的氨基酸序列。在其他实施方案中,抗原结合结构域结合trop2并且具有seqidno:146所示或在图1f中显示为抗trop2hvib619的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合trop2并且具有seqidno:146所示或在图1f中显示为抗trop2hvib619的序列的cdr和/或可变结构域。
[0308]
在一些实施方案中,抗原结合结构域结合ca9并且具有seqidno:150所示或在图1f中显示为抗ca9hvib456的氨基酸序列。在其他实施方案中,抗原结合结构域结合ca9并且具有seqidno:150所示或在图1f中显示为抗ca9hvib456的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合ca9并且具有seqidno:150所示或在图1f中显示为抗ca9hvib456的序列的cdr和/或可变结构域。
[0309]
在一些实施方案中,抗原结合结构域结合ca9并且具有seqidno:154所示或在图1g中显示为抗ca9hvib476的氨基酸序列。在其他实施方案中,抗原结合结构域结合ca9并且具有seqidno:154所示或在图1g中显示为抗ca9hvib476的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合ca9并且具有seqidno:154所示或在图1g中显示为抗ca9hvib476的序列的cdr和/或可变结构域。
[0310]
在一些实施方案中,抗原结合结构域结合ca9并且具有seqidno:158所示或在图1g中显示为抗ca9hvib407的氨基酸序列。在其他实施方案中,抗原结合结构域结合ca9并且具有seqidno:158所示或在图1g中显示为抗ca9hvib407的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合ca9并且具有seqidno:158所示或在图1g中显示为抗ca9hvib407的序列的cdr和/或可变结构域。
[0311]
在一些实施方案中,抗原结合结构域结合ca9并且具有seqidno:162所示或在图
1g中显示为抗ca9 hvib445的氨基酸序列。在其他实施方案中,抗原结合结构域结合ca9并且具有seq id no:162 所示或在图1g中显示为抗ca9 hvib445的氨基酸序列的人源化形式。在一些实施方案中,抗原结合结构域结合ca9并且具有seq idno:162所示或在图1g中显示为抗ca9 hvib445的序列的cdr和/ 或可变结构域。
[0312]
在一些实施方案中,在切割蛋白酶切割结构域之前的蛋白质为小于约100kda。在一些实施方案中,在切割蛋白酶切割结构域之后的蛋白质为约25至约75kda。在一些实施方案中,在蛋白酶切割之前的蛋白质具有高于肾的首过清除阈值的大小。在一些实施方案中,在蛋白酶切割之前的蛋白质具有至少约50小时的消除半衰期。在一些实施方案中,在蛋白酶切割之前的蛋白质具有至少约100小时的消除半衰期。在一些实施方案中,与针对相同靶抗原的igg相比,蛋白质具有增加的组织穿透。在一些实施方案中,与针对相同靶抗原的igg 相比,蛋白质具有增加的组织分布。
[0313]
c.半衰期延长
[0314]
本发明的蛋白质任选地包括半衰期延长结构域。预期此类结构域包括但不限于hsa结合结构域、fc区、小分子和本领域已知的其他半衰期延长结构域。
[0315]
1.fc区
[0316]
本发明的蛋白质包括将抗体的fc区与如本文所概述的另外组分组合的fc结构域-融合蛋白,所述另外组分包括针对tta的abd和 fv结构域(通常是如本文所概述的伪结构域)。
[0317]
本文所述的异源二聚体fc蛋白的杵臼结构形式是指产生“空间影响”以有利于异源二聚体形成而不是同源二聚体形成的氨基酸置换。在一些情况下,杵臼结构形式可以与二硫键或带电荷的氨基酸置换对组合以进一步有利于异源二聚体形成。
[0318]
在一些实施方案中,异源二聚体fc蛋白包含fc臂,所述fc臂在fc区中包含杵或臼。换句话说,第一单体fc臂包含杵,并且第二单体fc臂包含臼。在“构建体6”或“构建体7”的实施方案中,含有活性fv结构域(例如,抗cd3可变重链和可变轻链)的单体fc臂包括 ch3杵,并且含有伪fv结构域(例如,无活性可变重链和无活性可变轻链)的单体fc臂包含ch3臼,但是这也可以颠倒。在其他实施方案中,含有活性fv结构域的单体fc臂包含ch3臼,并且含有伪fv 结构域的单体fc臂包含ch3杵。
[0319]
用于形成杵的氨基酸残基通常是天然存在的氨基酸残基并且选自精氨酸(r)、苯丙氨酸(f)、酪氨酸(y)和色氨酸(w)。在一些优选的实施方案中,氨基酸残基是色氨酸和酪氨酸。在一个实施方案中,用于形成杵的原始残基具有小的侧链体积,诸如丙氨酸、天冬酰胺、天冬氨酸、甘氨酸、丝氨酸、苏氨酸或缬氨酸。在ch3结构域中用于形成杵的示例性氨基酸置换包括但不限于t366w、t366y或f405w 置换。
[0320]
用于形成臼的氨基酸残基通常是天然存在的氨基酸残基,并且选自丙氨酸(a)、丝氨酸(s)、苏氨酸(t)和缬氨酸(v)。在一些优选的实施方案中,用于形成臼的原始残基具有大的侧链体积,诸如酪氨酸、精氨酸、苯丙氨酸或色氨酸。在ch3结构域中用于产生臼的示例性氨基酸置换包括但不限于t366s、l368a、f405a、y407a、y407t 和y407v置换。在某些实施方案中,所述杵包含t366w置换,并且所述臼包含t366s/l368a/y407v置换。
[0321]
通常,本文中使用的优选fc结构域是人igg结构域,并且通常是igg1或igg4。在一些情况下,例如当效应子功能不合需要时,使用igg4,并且在一些情况下在铰结构域中含有
s228p变体,因为这防止臂交换。
[0322]
应当理解,本领域已知的促进异二聚化的对fc区的其他修饰也涵盖在本技术中。
[0323]
在一些实施方案中,本文所述形式的fc区在fc的c末端包含标签,诸如但不限于组氨酸标签(例如,(his)6)、链霉抗生物素标签(例如,strep-tag或strep-tagii)或麦芽糖结合蛋白质(mbp)标签。
[0324]
另外,fc结构域可以含有另外的氨基酸修饰以改变效应子功能或半衰期,如本领域已知的。
[0325]
在一些实施方案中,图17a-18c和图20a-20b中描绘了本文所述形式的fc区。在一些实施方案中,seqidno:36(pro556)、seqidno:37(pro557)、seqidno:38(pro587)、seqidno:39(pro588)、seqidno:40(pro589)、seqidno:41(pro574)、seqidno:42(pro575)、seqidno:43(pro576)、seqidno:44(pro584)、seqidno:45(pro585)、seqidno:46(pro586)、seqidno:47(pro688)、seqidno:48(pro689)和seqidno:49(pro690)提供了fc区的氨基酸序列。
[0326]
2.人血清白蛋白结合结构域
[0327]
人血清白蛋白(hsa)(分子量约67kda)是血浆中最丰富的蛋白质,以约50mg/ml(600μm)存在,并且在人中具有约20天的半衰期。hsa用于维持血浆ph,有助于胶质血压,用作许多代谢物和脂肪酸的载体,并且用作血浆中的主要药物转运蛋白。
[0328]
与白蛋白的非共价缔合延长了短寿命蛋白质的消除半衰期。例如,当分别静脉内地施用于小鼠和兔时,与施用单独的fab片段相比,白蛋白结合结构域与fab片段的重组融合导致体内清除率降低25倍和58倍,以及半衰期延长26倍和37倍。在另一个实例中,当将胰岛素用脂肪酸酰化以促进与白蛋白的缔合时,当皮下注射到兔或猪中时观察到延长的效果。总之,这些研究证明了在白蛋白结合与延长作用之间的联系。
[0329]
在一个方面,本文所述的抗原结合蛋白质包含半衰期延长结构域,例如特异性地结合hsa的结构域。在一些实施方案中,抗原结合蛋白质的hsa结合结构域可以是结合hsa的任何结构域,包括但不限于来自单克隆抗体、多克隆抗体、重组抗体、人抗体、人源化抗体的结构域。在一些实施方案中,hsa结合结构域是单链可变片段(scfv)、单结构域抗原结合结构域(sdabd)(诸如骆驼科来源的纳米抗体的重链可变结构域(vh)、轻链可变结构域(vl)和可变结构域(vhh))、肽、配体或对hsa特异的小分子。在某些实施方案中,hsa结合结构域来自单结构域抗体(sdabd)并且包含单结构域抗原结合结构域(sdabd);也就是说,sdabd是含有三个cdr而不是在传统抗体的fv中的标准六个cdr的单一可变结构域(vhh)。在其他实施方案中,hsa结合结构域是肽。在进一步的实施方案中,hsa结合结构域是小分子。预期抗原结合蛋白质的hsa结合结构域相当小并且在一些实施方案中不超过25kd、不超过20kd、不超过15kd或不超过10kd。在某些情况下,如果hsa结合结构域是肽或小分子,则其为5kd或更小。
[0330]
抗原结合蛋白质的半衰期延长结构域提供抗原结合蛋白质本身的改变的药效学和药代动力学。如上所述,半衰期延长结构域延长了消除半衰期。半衰期延长结构域还改变了药效学性质,包括改变抗原结合蛋白质的组织分布、穿透和扩散。在一些实施方案中,与不具有半衰期延长结合结构域的蛋白质相比,半衰期延长结构域提供了改善的组织(包括肿瘤)靶向、组织穿透、组织分布、组织内扩散和增强的功效。在一个实施方案中,治疗方法
有效且高效地利用减少量的抗原结合蛋白质,导致副作用减少,诸如非肿瘤细胞的细胞毒性减少。
[0331]
此外,半衰期延长结构域(例如hsa结合结构域)的特征包括hsa 结合结构域对hsa的结合亲和力。可以选择hsa结合结构域的亲和力,以便靶向特定多肽构建体中的特异性消除半衰期。因此,在一些实施方案中,hsa结合结构域具有高结合亲和力。在其他实施方案中,hsa结合结构域具有中等结合亲和力。在又其他实施方案中, hsa结合结构域具有低的或边际结合亲和力。示例性的结合亲和力包括10nm或更小(高)、在10nm与100nm之间(中等)和大于100nm (低)的kd浓度。如上所述,通过已知方法诸如表面等离子体共振(spr) 确定对hsa的结合亲和力。
[0332]
d.蛋白酶切割位点
[0333]
本发明的多肽(例如蛋白质)组合物以及特别是前药构建体包括一个或多个蛋白酶切割位点,通常存在于可切割接头中,如本文所概述。
[0334]
如本文所述,本发明的前药构建体包括至少一个蛋白酶切割位点,所述至少一个蛋白酶切割位点包含被至少一种蛋白酶切割的氨基酸序列。在一些情况下,本文所述的蛋白质包含被至少一种蛋白酶切割的1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、 11个、12个、13个、14个、15个、16个、17个、18个、19个、 20个或更多个蛋白酶切割位点。如本文更充分讨论的,当在前药构建物中使用多于一个蛋白酶切割位点时,它们可以是相同的(例如,被单一蛋白酶切割的多个位点)或不同的(两个或更多个切割位点被至少两种不同的蛋白酶切割)。如本领域技术人员将理解的,含有三个或更多个蛋白酶切割位点的构建体可以利用一个、两个、三个等;例如,一些构建体可以利用三个位点用于两种不同的蛋白酶等。
[0335]
蛋白酶切割位点的氨基酸序列将取决于所靶向的蛋白酶。如本领域已知的,在体内发现了许多人蛋白酶,并且它们可能与疾病状态相关。
[0336]
已知蛋白酶由一些患病细胞和组织(例如肿瘤或癌细胞)分泌,产生富含蛋白酶的微环境或富蛋白酶微环境。在一些情况下,受试者的血液富含蛋白酶。在一些情况下,肿瘤周围的细胞将蛋白酶分泌到肿瘤微环境中。肿瘤周围的分泌蛋白酶的细胞包括但不限于肿瘤基质细胞、肌成纤维细胞、血细胞、肥大细胞、b细胞、nk细胞、调节性 t细胞、巨噬细胞、细胞毒性t淋巴细胞、树突细胞、间充质干细胞、多形核细胞和其他细胞。在一些情况下,蛋白酶存在于受试者的血液中,例如靶向微生物肽中发现的氨基酸序列的蛋白酶。该特征允许靶向治疗剂诸如抗原结合蛋白质具有另外的特异性,因为除了在靶向细胞或组织的富蛋白酶微环境中,t细胞将不被抗原结合蛋白质结合。
[0337]
蛋白酶是在一些情况下以序列特异性方式切割蛋白质的蛋白质。蛋白酶包括但不限于丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶、苏氨酸蛋白酶、谷氨酸蛋白酶、金属蛋白酶、天冬酰胺肽裂解酶、血清蛋白酶、组织蛋白酶(例如,组织蛋白酶b、组织蛋白酶c、组织蛋白酶d、组织蛋白酶e、组织蛋白酶k、组织蛋白酶l、组织蛋白酶s)、激肽释放酶、hk1、hk10、hk15、klk7、颗粒蛋白酶b、纤溶酶、胶原酶、iv型胶原酶、基质降解酶、因子xa、胰凝乳蛋白酶样蛋白酶、胰蛋白酶样蛋白酶、弹性蛋白酶样蛋白酶、枯草杆菌蛋白酶样蛋白酶、猕猴桃蛋白酶(actinidain)、菠萝蛋白酶、钙蛋白酶 (calpain)、胱天蛋白酶(例如,胱天蛋白酶3)、mir1-cp、木瓜蛋白酶、 hiv-1蛋白酶、hsv蛋白酶、cmv蛋白酶、凝乳酶、肾素、胃蛋白酶、蛋白裂解酶、天冬酰胺内肽酶(legumain)、疟原虫天冬氨酸蛋白酶(plasmepsin)、猪笼
草天冬氨酸蛋白酶(nepenthesin)、金属外肽酶、金属内肽酶、基质金属蛋白酶(mmp)、mmp1,mmp2,mmp3,mmp8, mmp9,mmp13,mmp11,mmp14、甲基多巴、尿激酶血纤蛋白溶酶原活化因子(upa)、肠激酶、前列腺特异性抗原(psa,hk3)、白介素
ꢀ‑
1β转化酶,凝血酶、fap(fap-α)、二肽基肽酶和二肽基肽酶iv (dppiv/cd26)。
[0338]
一些合适的蛋白酶和蛋白酶切割序列如seq id no:210-281所示,并且显示在图3a-3d中。
[0339]
e.接头
[0340]
如本文所讨论,本发明的不同结构域通常使用氨基酸接头连接在一起,所述氨基酸接头也可以赋予功能性(包括柔性或非柔性(例如空间限制))以及使用原位蛋白酶切割的能力。能以多种方式对这些接头进行分类。
[0341]
本发明提供了“结构域接头”,其用于连接两个或更多个结构域 (例如vh和vl),将靶肿瘤抗原结合结构域(ttabd,有时在本文中也称为“αtta”(对于“抗tta”)连接至vh或vl,将半衰期延长结构域连接至另一种组分等。结构域接头可以是例如不可切割接头(ncl)、可切割接头(“cl”)、可切割和受限接头(ccl)以及不可切割和受限接头(nccl)。在一些实施方案中,受限接头是少于10个氨基酸(例如, 9个、8个、7个、6个、5个或4个氨基酸)的短多肽,其以使如本文所概述的两个结构域不能彼此显著相互作用并且在生理条件下不被人蛋白酶显著切割的方式连接所述两个结构域。通常,蛋白酶切割位点的长度通常为至少4+个氨基酸以赋予足够的特异性,如图3a-3d、图14a-14g、图16a-16g、图17a-17c、图18a-18c和图20a-20b 中所示。
[0342]
1.不可切割接头
[0343]
在一个实施方案中,结构域接头是不可切割接头(ncl)。在该实施方案中,接头用于连接结构域以保持结构域的功能性,通常通过在患者中不被原位蛋白酶切割的较长的柔性结构域。适合于连接本发明多肽中的结构域的内部不可切割接头的实例包括但不限于(gs)n、 (ggs)n、(gggs)n(seq id no:167)、(ggsg)n(seq id no:168)、 (ggsgg)n(seq id no:169)或(ggggs)n(seq id no:284),其中n 为1、2、3、4、5、6、7、8、9或10。本领域技术人员公认的任何不可切割结构域接头都可以用于本文所述的同源二聚体和异源二聚体fc蛋白。
[0344]
在一些实施方案中,接头不含有切割位点并且也太短而不能使由接头分开的蛋白质结构域分子内地自组装,并且是“受限不可切割接头”或“cncl”。例如,在pro219和pro217中,活性vh和活性vl 被8个氨基酸(“8聚体”)分开,所述8个氨基酸不允许vh和vl分子内地自组装成活性抗原结合结构域;相反,与pro218发生分子间装配,直到被肿瘤蛋白酶切割。在一些实施方案中,所述接头仍然是柔性的;例如,(gggs)n,其中n=2。在其他实施方案中,尽管通常不太优选,但可以使用更刚性的接头,诸如包括脯氨酸或庞大氨基酸的那些。
[0345]
在一些实施方案中,包括scfv接头在内的接头包含选自seq idno:167、168、169、282、283和284的任一序列。
[0346]
2.可切割接头
[0347]
本文中的所有前药构建体包括至少一个可切割接头。因此,在一个实施方案中,结构域接头是可切割的(cl),在本文中有时被称为“蛋白酶切割结构域”(“pcd”)。在该实施方案中,cl含有蛋白酶切割位点,如本文所概述和如在图3a、3b和3c中以及相应的序列表中所描绘。在一些情况下,cl仅含有蛋白酶切割位点。任选地,取决于切割识别位点的长度,可以
在cl的n或c末端中的任一者或两者处存在额外的少数连接氨基酸;例如,在切割位点的n和c末端中的任一者或两者上可以有1个、2个、3个、4个或5-8个氨基酸。
[0348]
iv.表达方法
[0349]
本发明提供了编码本发明异源二聚体蛋白质的两种单体的核酸、以及表达载体和宿主细胞。如本领域技术人员将理解的,可以制备一种或两种表达载体。即,可以将编码第一单体的第一核酸和编码第二单体的第二核酸置于单个表达载体或两个表达载体中。然后将表达载体置于宿主细胞中,使其生长使得两种单体得以表达。在一些情况下,尽管这通常不是优选的,但是可以在单独的宿主细胞中产生每种单体,然后将表达产物组合以形成本发明的异源二聚体前药蛋白质。
[0350]
然而,大多数实施方案依赖于使用两种单体的共表达。即,本文提供了通过在细胞(例如宿主细胞)中共表达和共纯化以获得第一单体 fc多肽和第二单体fc多肽来生产本发明的蛋白质的方法。在一些实施方案中,蛋白质的互补对(例如第一单体fc多肽和第二单体fc多肽)以约等摩尔比(例如约1:1比率)产生。在其他实施方案中,蛋白质的互补对(例如第一单体fc多肽和第二单体fc多肽)以非等摩尔的比率(例如不是约1:1比率)产生。换句话说,本文所述的方法可以用于获得第一多肽与第二多肽的比率,诸如但不限于100:1、95:1、90:1、 85:1、80:1、75:1、70:1、65:1、60:1、55:1、50:1、45:1、40:1、35:1、 30:1、25:1、20:1、15:1 10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1、 1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:15、1:20、1:25、 1:30、1:35、1:40、1:45、1:50、1:55、1:60、1:65、1:70、1:75、1:80、 1:85、1:90、1:95、1:100等。
[0351]
特定量的编码多肽的多核苷酸(或表达载体)可以在细胞中表达以产生所需量的多肽。在一些实施方案中,引入(例如,转染、电穿孔、转导等)到细胞中的编码第一单体fc多肽的第一多核苷酸(或第一表达载体)的量和编码第二单体fc多肽的多核苷酸(或表达载体)的量是相同的。例如,可以将第一多核苷酸和第二多核苷酸以约1:1的比率引入细胞中。在其他实施方案中,引入细胞中的编码第一单体fc多肽的第一多核苷酸(或第一表达载体)的量和编码第二单体fc多肽的第二多核苷酸(或表达载体)的量是不同的。例如,可以将第一多核苷酸和第二多核苷酸以一定比率引入细胞中,所述比率诸如但不限于 50:1、45:1、40:1、35:1、30:1、25:1、20:1、15:1 10:1、9:1、8:1、7:1、 6:1、5:1、4:1、3:1、2:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、 1:10、1:15、1:20、1:25、1:30、1:35、1:40、1:45、1:50等。
[0352]
多肽的表达载体可以包括一种或多种使得细胞能够以期望的比率生产多肽的组分(例如,启动子、调控元件、增强子等)。在一些情况下,第一单体fc多肽的第一表达载体包含与第二多肽的第二表达载体的表达水平相比增加载体的表达水平的组分。在其他情况下,第二单体fc多肽的第二表达载体包含与第一单体fc多肽的第一表达载体的表达水平相比增加载体的表达水平的组分。在某些情况下,第一单体fc多肽的第一表达载体包含使得载体的表达水平与第二单体fc 多肽的第二表达载体的表达水平相同的组分。
[0353]
在一些情况下,本文所述的核酸提供了例如在哺乳动物细胞中生产本公开的双特异性条件有效的蛋白质。可以将编码本公开的第一和 /或第二多肽的核苷酸序列可操作地连接至转录控制元件,例如启动子和增强子等。
[0354]
合适的启动子和增强子元件是本领域已知的。对于在细菌细胞中的表达,合适的启动子包括但不限于laci、lacz、t3、t7、gpt、λp 和trc。对于在真核细胞中的表达,合适的
启动子包括但不限于轻链和/或重链免疫球蛋白基因启动子和增强子元件;巨细胞病毒立即早期启动子;单纯疱疹病毒胸苷激酶启动子;早期和晚期sv40启动子;来自逆转录病毒的长末端重复序列中存在的启动子;ef-1a,小鼠金属硫蛋白i启动子;和各种本领域已知的组织特异性启动子。
[0355]
编码蛋白质(例如,本文所述的前药构建体)的核酸或核苷酸序列可以存在于表达载体和/或克隆载体中。在蛋白质(例如,前药构建体)包含两种单独的多肽的情况下,可以将编码这两种多肽的核苷酸序列克隆在相同或分开的载体中。表达载体可以包括选择标记、复制起点和提供载体复制和/或维持的其他特征。合适的表达载体包括例如质粒、病毒载体等。
[0356]
表达载体通常具有位于启动子序列附近的方便的限制性位点,以提供编码异源蛋白的核酸序列的插入。可以存在可在表达宿主中操作的选择标记。合适的表达载体包括但不限于病毒载体(例如,基于痘苗病毒的病毒载体;脊髓灰质炎病毒;腺病毒(参见例如li等人,investopthalmolvissci35:25432549,1994;borras等人,genether6:515524,1999;li和davidson,pnas92:77007704,1995;sakamoto等人,hgenether5:10881097,1999;wo94/12649;wo93/03769;wo93/19191;wo94/28938;wo95/11984和wo95/00655);腺相关病毒(参见例如ali等人,humgenether9:8186,1998;flannery等人,pnas94:69166921,1997;bennett等人,investopthalmolvissci38:28572863,1997;jomary等人,genether4:683690,1997;rolling等人,humgenether10:641648,1999;ali等人,hummolgenet5:591594,1996;srivastava,wo93/09239;samulski等人,j.vir.(1989)63:3822-3828;mendelson等人,virol.(1988)166:154-165;和flotte等人,pnas(1993)90:10613-10617);sv40;单纯疱疹病毒;人免疫缺陷病毒(参见例如miyoshi等人,pnas94:1031923,1997;takahashi等人,jvirol73:78127816,1999);逆转录病毒载体(例如,鼠白血病病毒、脾坏死病毒、以及衍生自逆转录病毒(诸如劳斯肉瘤病毒、哈维肉瘤病毒、禽白血病病毒、人免疫缺陷病毒、骨髓增生性肉瘤病毒和乳腺肿瘤病毒)的载体);等等。
[0357]
本公开提供了被修饰以生产蛋白质(例如,本公开的前药构建体)的哺乳动物细胞。可以使用本领域技术人员已知的任何方法将本文所述的多核苷酸引入哺乳动物细胞中,所述方法诸如但不限于转染、电穿孔、病毒感染等。
[0358]
合适的哺乳动物细胞包括原代细胞和永生化细胞系。合适的哺乳动物细胞系包括人细胞系、非人灵长类细胞系、啮齿动物(例如,小鼠、大鼠)细胞系等。合适的哺乳动物细胞系包括但不限于hela细胞(例如,美国典型培养物保藏中心(atcc)编号ccl-2)、cho细胞(例如,atcc编号crl9618、ccl61、crl9096)、293细胞(例如,atcc编号crl-1573)、vero细胞、nih3t3细胞(例如,atcc编号crl-1658)、huh-7细胞、bhk细胞(例如,atcc编号ccl10)、pc12细胞(atcc编号crl1721)、cos细胞、cos-7细胞(atcc编号crl1651)、rat1细胞、小鼠l细胞(atcc编号ccli.3)、人胚肾(hek)细胞(atcc编号crl1573)、hek293细胞、expi293细胞、hlhepg2细胞、hut-78、jurkat、hl-60、nk细胞系(例如,nkl、nk92和yts)等。用于克隆或表达靶蛋白编码载体的合适宿主细胞包括本文所述的原核或真核细胞。
[0359]
关于多肽在细菌中的表达,参见例如美国专利第5,648,237号、第5,789,199号和第5,840,523号。(还参见charlton,methodsinmolecularbiology,第248卷(b.k.c.lo,
编,humana press,totowa, n.j.,2003),第245-254页,其描述抗体片段在大肠杆菌(e.coli)中的表达。)表达后,可以将fc融合蛋白在可溶性级分中从细菌细胞团糊中分离,并可以进一步纯化。
[0360]
除了原核生物外,真核微生物诸如丝状真菌或酵母是合适的克隆或表达宿主,包括其糖基化途径已经“人源化”从而导致产生具有部分或完全人糖基化样式的抗体的真菌和酵母菌株。参见例如gerngross, nat biotech,2004,22:1409-1414;和li等人,nat biotech,2006, 24:210-215。
[0361]
也可以利用植物细胞培养物作为宿主。参见例如美国专利第 5,959,177号、第6,040,498号、第6,420,548号、第7,125,978号和第 6,417,429号。
[0362]
适合于表达糖基化蛋白质的宿主细胞也衍生自多细胞生物体(无脊椎动物和脊椎动物)。无脊椎动物细胞的实例包括植物和昆虫细胞。已经鉴定出许多杆状病毒株,其可以与昆虫细胞一起使用,特别是用于转染草地夜蛾(spodoptera frugiperda)细胞。
[0363]
在一些实施方案中,根据由细胞产生和分泌的多肽的量选择宿主细胞或稳定的宿主细胞系。宿主细胞或稳定的宿主细胞系可以产生和分泌本文所述的前药组合物。在一些情况下,合适的细胞可以产生等摩尔比(例如,约1:1比率)的本文所述的第一多肽中的任一种和第二多肽中的任一种。在其他实施方案中,合适的细胞产生非等摩尔比(例如,不同于1:1的比率)的第一单体fc多肽中的任一种和第二单体fc 多肽中的任一种。
[0364]
v.本发明的示例性形式
[0365]
如本领域技术人员将理解的,包含形成前药组合物的两种单体的异源二聚体蛋白质组合物可以采取各种各样的形式。重要的是活性可变重结构域和活性可变轻结构域各自在切割后终止与sdabd-tta的缔合。也就是说,通常一个sdabd-tta经由不可切割结构域接头与活性可变重结构域连接,并且一个sdabd-tta经由不可切割结构域接头与活性可变轻结构域连接。这确保活性cd3 abd可以形成于肿瘤细胞表面上。一旦发生切割并且无活性vh和vl解离,avh和avl 经分子间缔合而形成一个或多个活性cd3 abd。
[0366]
对于本文所提供的所有构建体和形式,许多不同的组分(例如, sdabd-tta、切割位点、avh和avl结构域、ivh和ivl结构域和 fc结构域,诸如在图13中所描绘的所有)能以每种形式“混合和匹配”。
[0367]
本文提供了异源二聚体fc融合前药蛋白质(参见图4),其包含第一单体fc多肽和第二单体fc多肽,所述第一单体fc多肽包含(从n 末端至c末端)针对tta的abd-结构域接头-抗cd3伪fv结构域(例如,活性vl结构域-可切割接头-无活性vh结构域)-针对gfp的抗原结合结构域-结构域接头(铰链接头)-fc臼;所述第二单体fc多肽包含(从n末端至c末端)针对tta的abd-结构域接头-抗cd3伪fv 结构域(例如,活性vh结构域-可切割接头-无活性vl结构域)-结构域接头(铰链接头)-fc杵。在一些实施方案中,第一单体fc多肽包含 (从n末端至c末端)针对tta的abd-结构域接头-抗cd3伪fv结构域(例如,活性vh结构域-可切割接头-无活性vl结构域)-针对gfp 的抗原结合结构域-结构域接头(铰链接头)-fc臼;并且第二单体fc 多肽包含(从n末端至c末端)针对tta的abd-结构域接头-抗cd3 伪fv结构域(例如,活性vl结构域-可切割接头-无活性vh结构域)
‑ꢀ
结构域接头(铰链接头)-fc杵。在一些实施方案中,第一单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签,但是这通常不用于待施用于患者的实际前药分子。在一些实施方案中,第二单体fc多肽
的c末端包括标签,诸如但不限于(his)10标签或 strep-ii标签。在一些实施方案中,前药构建体包括第一单体fc和第二单体fc,所述第一单体fc包含sdabd(tta)-ncl-活性 vl-cl-vhi-sdabd-ncl-呈臼形式的包含ch2-ch3的fc区,所述第二单体fc包含sdabd(tta)-ncl-活性vh-cl-vli-ncl-呈杵形式的包含ch2-ch3的fc区。在一些实施方案中,此类异源二聚体fc融合前药蛋白质包含pro37(seq id no:2)和pro36(seq id no:1),如在图14a中所描绘。pro37的氨基酸序列如图14a中所示。pro37的氨基酸序列如图14a中所示。
[0368]
而且,本文提供了异源二聚体fc融合前药蛋白质(参见图5),其包含第一单体fc多肽和第二单体fc多肽,所述第一单体fc多肽包含(从n末端至c末端)针对tta的abd-结构域接头-抗cd3伪fv 结构域(例如,活性vl结构域-可切割接头-无活性vh结构域)-结构域接头(铰链接头)-fc臼;所述第二单体fc多肽包含(从n末端至c 末端)针对tta的abd-结构域接头-抗cd3伪fv结构域(例如,活性 vh结构域-可切割接头-无活性vl结构域)-结构域接头(铰链接头)-fc 杵。在一些实施方案中,第一单体fc多肽包含(从n末端至c末端) 针对tta的abd-结构域接头-抗cd3伪fv结构域(例如,活性vh 结构域-可切割接头-无活性vl结构域)-结构域接头(铰链接头)-fc臼;并且第二单体fc多肽包含(从n末端至c末端)针对tta的abd-结构域接头-抗cd3伪fv结构域(例如,活性vl结构域-可切割接头
‑ꢀ
无活性vh结构域)-结构域接头(铰链接头)-fc杵。在一些实施方案中,第一单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或 strep-ii标签。在一些实施方案中,第二单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,此类异源二聚体fc融合前药蛋白质包含pro38和pro36,如在图5中所描绘。pro36的氨基酸序列如图14a中所描绘。pro38的氨基酸序列如图14b中所描绘。
[0369]
本文提供了异源二聚体fc融合前药蛋白质(参见图7),其包含第一单体fc多肽和第二单体fc多肽,所述第一单体fc多肽包含(从n 末端至c末端)针对tta的abd-结构域接头-抗cd3伪fv结构域(例如,活性vl结构域-可切割接头-无活性vh结构域)-fc臼;所述第二单体fc多肽包含(从n末端至c末端)针对tta的abd-结构域接头-抗cd3伪fv结构域(例如,活性vh结构域-可切割接头-无活性 vl结构域)-fc杵。在一些实施方案中,第一单体fc多肽包含(从n 末端至c末端)针对tta的abd-结构域接头-抗cd3伪fv结构域(例如,活性vh结构域-可切割接头-无活性vl结构域)-fc臼;并且第二单体fc多肽包含(从n末端至c末端)针对tta的abd-结构域接头-抗cd3伪fv结构域(例如,活性vl结构域-可切割接头-无活性 vh结构域)-fc杵。在一些实施方案中,第一单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,第二单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,此类异源二聚体fc融合前药蛋白质包含pro68(seq id no:5)和pro67(seq id no:4),如在图 14a-14b中所描绘。pro68类似于pro37,但不包括结合gfp的sdabd 或与ch2结构域附接的结构域接头。pro67类似于pro36,但不包括与ch2结构域附接的结构域接头。pro68的氨基酸序列如图14c中所描绘。pro67的氨基酸序列如图14b中所描绘。
[0370]
本文提供了异源二聚体fc融合前药蛋白质(参见图8),其包含第一单体fc多肽和第二单体fc多肽,所述第一单体fc多肽包含(从n 末端至c末端)针对tta的abd-fc臼;所述第二单体fc多肽包含(从 n末端至c末端)针对tta的abd-结构域接头-抗cd3伪fv结构域 (例如,活性vh结构域-可切割接头-无活性vl结构域)-fc杵-可切割接头-针对tta的abd-结
构域接头-抗cd3伪fv结构域(例如,活性 vl结构域-可切割接头-无活性vh结构域)。在一些实施方案中,第一单体fc多肽包含(从n末端至c末端)针对tta的abd-fc臼;并且第二单体fc多肽包含(从n末端至c末端)针对tta的abd-结构域接头-抗cd3伪fv结构域(例如,活性vl结构域-可切割接头-无活性vh结构域)-fc杵-可切割接头-针对tta的abd-结构域接头-抗 cd3伪fv结构域(例如,活性vh结构域-可切割接头-无活性vl结构域)。在一些实施方案中,第一单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,第二单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii 标签。在一些实施方案中,此类异源二聚体fc融合前药蛋白质包含 pro69(seq id no:6)和pro70(seq id no:7),如在图14c-14d中所描绘。pro70类似于pro67,在c末端附接有pro9构建体。pro69的氨基酸序列如图14c中所描绘。pro70的氨基酸序列如图14d中所描绘。
[0371]
本文提供了异源二聚体fc融合前药蛋白质(参见图9),其包含第一单体fc多肽和第二单体fc多肽,所述第一单体fc多肽包含(从n 末端至c末端)针对tta的abd-fc臼-可切割接头-针对tta的abd
‑ꢀ
结构域接头-抗cd3伪fv结构域(例如,活性vl结构域-可切割接头
ꢀ‑
无活性vh结构域);所述第二单体fc多肽包含(从n末端至c末端) 针对tta的abd-结构域接头-抗cd3伪fv结构域(例如,活性vh 结构域-可切割接头-无活性vl结构域)-fc杵。在一些实施方案中,第一单体fc多肽包含(从n末端至c末端)针对tta的abd-fc臼
‑ꢀ
可切割接头-针对tta的abd-结构域接头-抗cd3伪fv结构域(例如,活性vh结构域-可切割接头-无活性vl结构域);并且第二单体 fc多肽包含(从n末端至c末端)针对tta的abd-结构域接头-抗 cd3伪fv结构域(例如,活性vl结构域-可切割接头-无活性vh结构域)-fc杵。在一些实施方案中,第一单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,第二单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或 strep-ii标签。在一些实施方案中,此类异源二聚体fc融合前药蛋白质包含pro71(seq id no:8)和pro67(seq id no:4),如在图14b和图14d中所描绘。pro71类似于pro69,在c末端附接有pro9构建体。 pro67类似于pro36,没有与ch2结构域附接的结构域接头。pro71 的氨基酸序列如图14d中所描绘。pro67的氨基酸序列如图14b中所描绘。
[0372]
本文提供了异源二聚体fc融合前药蛋白质(参见图11),其包含第一单体fc多肽和第二单体fc多肽,所述第一单体fc多肽包含(从 n末端至c末端)针对tta的abd-结构域接头-受限抗cd3 fv结构域(例如,活性vh结构域-不可切割受限接头(nccl)-活性vl结构域)-可切割接头-fc杵,所述第二单体fc多肽包含(从n末端至c末端)抗cd3伪fv结构域(例如,无活性vl结构域-不可切割接头-无活性vh结构域)-可切割接头-fc臼。在一些实施方案中,第一单体fc 多肽包含(从n末端至c末端)针对tta的abd-结构域接头-受限抗 cd3 fv结构域(例如,活性vl结构域-不可切割受限接头(nccl)-活性vh结构域)-可切割接头-fc杵,并且第二单体fc多肽包含(从n 末端至c末端)抗cd3伪fv结构域(例如,无活性vh结构域-不可切割接头-无活性vl结构域)-可切割接头-fc臼。在一些实施方案中,第一单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或 strep-ii标签。在一些实施方案中,第二单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,此类异源二聚体fc融合前药蛋白质包含pro219(seq id no:9或16) 和pro218(seq id no:10),如在图11中所描绘。pro218的氨基酸序列如图14e中所描绘。pro219的氨基酸序列如图14e中所描绘。在一些实施方案中,第一单体fc组分包含abd,诸如但不限于在 pro219、
或vli-接头-vh。在一些情况下,伪fv结构域具有 vhfr1-vhcdr1-vhfr2-vhcdr2-vhfr3-vhcdr3-vhfr4-cl-vlifr1-vlicdr1-vlifr2-vlicdr2-vlifr3-vlicdr3-vlifr4的结构(n末端至c末端)。在其他情况下,伪fv结构域具有 vlifr1-vlicdr1-vlifr2-vlicdr2-vlifr3-vlicdr3-vlifr4-cl-vhfr1-v hcdr1-vhfr2-vhcdr2-vhfr3-vhcdr3-vhfr4的结构(n末端至c末端)。
[0376]
在一些实施方案中,本发明提供了受限fv结构域,其包含使用受限接头(如本文所概述,其可以是可切割的或不可切割的)共价附接的活性vh和活性vl结构域。在不存在切割的情况下,受限接头防止在vh与vl之间的分子内缔合。因此,受限fv结构域包含在可变结构域内所含的一组六个cdr,其中vh的vhcdr1、vhcdr2和 vhcdr3结合人cd3,并且vl的vlcdr1、vlcdr2和vlcdr3结合人cd3,但呈前药形式(例如,未切割的)存在,所述vh和vl不能空间缔合形成活性结合结构域。
[0377]
受限fv结构域可以包含活性vh和活性vl(vha和vla)或无活性vh和vl(vhi和vli)。如本领域技术人员将理解的,vh和vl 在受限活性fv结构域中的顺序可以是(n末端至c末端)vh-接头-vl 或vl-接头-vh。如本文所概述,在诸如pro219或pro217所示的那些情况下,受限活性fv结构域可以包含使用不可切割接头连接的vh 和vl。在该实施方案中,受限fv结构域具有 vhfr1-vhcdr1-vhfr2-vhcdr2-vhfr3-vhcdr3-vhfr4-ccl-vlfr1-v lcdr1-vlfr2-vlcdr2-vlfr3-vlcdr3-vlfr4的结构(n末端至c末端)。在该实施方案中,cdr和/或可变结构域是分别如seq id no: 186和170提供的活性cd3 vh和活性cd3vl的cdr和/或可变结构域。
[0378]
本文提供了包含第一单体fc多肽和第二单体fc多肽的同源二聚体fc融合前药蛋白质(参见图17a,诸如pro556),所述第一单体fc 多肽包含(从n末端至c末端)针对tta的abd-结构域接头-受限抗 cd3 fv结构域(例如,活性vh结构域-不可切割受限接头(nccl)-活性vl结构域)-针对tta的abd-可切割接头-抗cd3伪fv结构域(例如,无活性vl结构域-不可切割接头-无活性vh结构域)-fc结构域,所述第二单体fc多肽包含(从n末端至c末端)针对tta的abd-结构域接头-受限抗cd3 fv结构域(例如,活性vh结构域-不可切割受限接头(nccl)-活性vl结构域)-针对tta的abd-可切割接头-抗 cd3伪fv结构域(例如,无活性vl结构域-不可切割接头-无活性vh 结构域)-fc结构域。在一些实施方案中,第一单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,第二单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,此类同源二聚体fc融合前药蛋白质包含pro556和pro556。pro556的氨基酸序列如图17a中所描绘。图19中所描绘的数据说明同源二聚体pro556构建体的条件性和活性。在一些实施方案中,任何针对tta的abd都可以用于同源二聚体fc蛋白。在一个实施方案中,所述sdabd选自seq id no:50、 54、58、62、66、70、74、78、82、86、90、94、98、102、106、110、 114、118、122、126、130、134、138、142、146、150、154、158、 162和166。
[0379]
本文提供了包含第一单体fc多肽和第二单体fc多肽的不可切割同源二聚体fc融合前药蛋白质(参见图17a,诸如pro557),所述第一单体fc多肽包含(从n末端至c末端)针对tta的abd-结构域接头-受限抗cd3 fv结构域(例如,活性vh结构域-不可切割受限接头 (nccl)-活性vl结构域)-针对tta的abd-不可切割接头(ncl-15)
‑ꢀ
抗cd3伪fv结构域(例如,无活性vl结构域-不可切割接头-无活性 vh结构域)-fc结构域,所述第二单体fc多肽包含
(从n末端至c末端)针对tta的abd-结构域接头-受限抗cd3 fv结构域(例如,活性 vh结构域-不可切割受限接头(nccl)-活性vl结构域)-针对tta的 abd-不可切割接头(ncl-15)-抗cd3伪fv结构域(例如,无活性vl 结构域-不可切割接头-无活性vh结构域)-fc结构域。此类同源二聚体fc融合蛋白可以作为不可切割对照。在一些实施方案中,第一单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii 标签。在一些实施方案中,第二单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,此类同源二聚体fc融合前药蛋白质包含pro557和pro557。pro557的氨基酸序列如图17a中所描绘。同源二聚体pro557前药构建体不被蛋白酶切割。在一些实施方案中,任何针对tta的abd都可以用于同源二聚体fc蛋白。在一个实施方案中,所述sdabd选自seq id no:50、 54、58、62、66、70、74、78、82、86、90、94、98、102、106、110、 114、118、122、126、130、134、138、142、146、150、154、158、 162和166。
[0380]
本文提供了包含第一单体fc多肽和第二单体fc多肽的同源二聚体fc融合前药蛋白质(参见图17b,诸如pro587),所述第一单体fc 多肽包含(从n末端至c末端)针对tta的abd-结构域接头-受限抗 cd3 fv结构域(例如,活性vl结构域-不可切割受限接头(nccl)-活性vh结构域)-针对tta的abd-可切割接头-抗cd3伪fv结构域(例如,无活性vl结构域-不可切割接头-无活性vh结构域)-fc结构域,所述第二单体fc多肽包含(从n末端至c末端)针对tta的abd-结构域接头-受限抗cd3 fv结构域(例如,活性vl结构域-不可切割受限接头(nccl)-活性vh结构域)-针对tta的abd-可切割接头-抗 cd3伪fv结构域(例如,无活性vl结构域-不可切割接头-无活性vh 结构域)-fc结构域。在一些实施方案中,第一单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,第二单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,此类同源二聚体fc融合前药蛋白质包含pro587和pro587。pro587的氨基酸序列如图17b中所描绘。在一些实施方案中,任何针对tta的abd都可以用于同源二聚体fc蛋白。在一个实施方案中,所述sdabd选自seq id no:50、 54、58、62、66、70、74、78、82、86、90、94、98、102、106、110、 114、118、122、126、130、134、138、142、146、150、154、158、 162和166。
[0381]
本文提供了包含第一单体fc多肽和第二单体fc多肽的同源二聚体fc融合前药蛋白质(参见图17b,诸如pro588),所述第一单体fc 多肽包含(从n末端至c末端)针对tta的abd-结构域接头-受限抗 cd3 fv结构域(例如,活性vh结构域-不可切割受限接头(nccl)-活性vl结构域)-针对tta的abd-可切割接头-抗cd3伪fv结构域(例如,无活性vh结构域-不可切割接头-无活性vl结构域)-fc结构域,所述第二单体fc多肽包含(从n末端至c末端)针对tta的abd-结构域接头-受限抗cd3 fv结构域(例如,活性vh结构域-不可切割受限接头(nccl)-活性vl结构域)-针对tta的abd-可切割接头-抗 cd3伪fv结构域(例如,无活性vh结构域-不可切割接头-无活性vl 结构域)-fc结构域。在一些实施方案中,第一单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,第二单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,此类同源二聚体fc融合前药蛋白质包含pro588和pro588。pro588的氨基酸序列如图17b中所描绘。在一些实施方案中,任何针对tta的abd都可以用于同源二聚体fc蛋白。在一个实施方案中,所述sdabd选自seq id no:50、 54、58、62、66、70、74、78、82、86、90、94、98、102、106、110、 114、118、122、126、130、134、138、142、146、150、154、158、 162和166。
[0382]
本文提供了包含第一单体fc多肽和第二单体fc多肽的同源二聚体fc融合前药蛋白质(参见图17c,诸如pro589),所述第一单体fc 多肽包含(从n末端至c末端)针对tta的abd-结构域接头-受限抗cd3 fv结构域(例如,活性vl结构域-不可切割受限接头(nccl)-活性vh结构域)-针对tta的abd-可切割接头-抗cd3伪fv结构域(例如,无活性vh结构域-不可切割接头-无活性vl结构域)-fc结构域,所述第二单体fc多肽包含(从n末端至c末端)针对tta的abd-结构域接头-受限抗cd3 fv结构域(例如,活性vl结构域-不可切割受限接头(nccl)-活性vh结构域)-针对tta的abd-可切割接头-抗 cd3伪fv结构域(例如,无活性vh结构域-不可切割接头-无活性vl 结构域)-fc结构域。在一些实施方案中,第一单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,第二单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,此类同源二聚体fc融合前药蛋白质包含pro589和pro589。pro589的氨基酸序列如图17c中所描绘。在一些实施方案中,任何针对tta的abd都可以用于同源二聚体fc蛋白。在一个实施方案中,所述sdabd选自seq id no:50、 54、58、62、66、70、74、78、82、86、90、94、98、102、106、110、 114、118、122、126、130、134、138、142、146、150、154、158、 162和166。
[0383]
本文提供了包含第一单体fc臼多肽(参见例如图18a,诸如 pro574)和第二单体fc杵多肽(参见例如图18a,诸如pro575)的异源二聚体fc融合前药蛋白质,所述第一单体fc臼多肽包含(从n末端至c末端)结构域接头(铰链接头)-fc臼结构域,所述第二单体fc杵多肽包含(从n末端至c末端)针对tta的abd-结构域接头-受限抗 cd3 fv结构域(例如,活性vl结构域-不可切割受限接头(nccl)-活性vh结构域或活性vh结构域-不可切割受限接头(nccl)-活性vl 结构域)-针对tta的abd-可切割接头-抗cd3伪fv结构域(例如,无活性vh结构域-不可切割接头-无活性vl结构域或无活性vl结构域-不可切割接头-无活性vh结构域)-fc杵结构域。在一些实施方案中,第一单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,第二单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii标签。在一些实施方案中,异源二聚体fc融合前药蛋白质包含pro574的第一单体fc臼多肽。在一些实施方案中,异源二聚体fc融合前药蛋白质包含pro575 或pro576的第二单体fc杵多肽。pro574的氨基酸序列如图18a中所描绘。pro575的氨基酸序列如图18a中所描绘。pro576的氨基酸序列如图18b中所描绘。pro575和pro576的氨基酸序列是相同的。在一些实施方案中,编码pro575的核酸序列不同于编码pro576的核酸序列。在一些实施方案中,编码pro575的核酸序列与编码pro576 的核酸序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、 88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、 99%或更高的序列同一性。在一些实施方案中,任何针对tta的abd 都可以用于异源二聚体fc蛋白。在一个实施方案中,所述sdabd选自seq id no:50、54、58、62、66、70、74、78、82、86、90、94、 98、102、106、110、114、118、122、126、130、134、138、142、 146、150、154、158、162和166。
[0384]
本文提供了包含第一单体fc杵多肽(参见例如图18a诸如pro575 和图18b诸如pro576)和第二单体fc臼多肽的异源二聚体fc融合前药蛋白质,所述第一单体fc杵多肽包含(从n末端至c末端)针对tta 的abd-结构域接头-受限抗cd3 fv结构域(例如,活性vh结构域
‑ꢀ
不可切割受限接头(nccl)-活性vl结构域)-针对tta的abd-可切割接头-抗cd3伪fv结构域(例如,无活性vl结构域-不可切割接头
ꢀ‑
无活性vh结构域)-fc杵结构域,所述第二单
体fc臼多肽包含(从n 末端至c末端)针对tta的abd-结构域接头-受限抗cd3 fv结构域 (例如,活性vl结构域-不可切割受限接头(nccl)-活性vh结构域或活性vh结构域-不可切割受限接头(nccl)-活性vl结构域)-针对 tta的abd-可切割接头-抗cd3伪fv结构域(例如,无活性vh结构域-不可切割接头-无活性vl结构域或无活性vl结构域-不可切割接头-无活性vh结构域)-fc臼结构域。在一些实施方案中,第二单体fc多肽的c末端包括标签,诸如但不限于(his)10标签或strep-ii 标签。在一些实施方案中,异源二聚体fc融合前药蛋白质包含pro575 或pro576的第一单体fc杵多肽。在一些实施方案中,异源二聚体 fc融合前药蛋白质包含选自pro584、pro585和pro586的第二单体 fc臼多肽。pro575的氨基酸序列如图18a中所描绘。pro576的氨基酸序列如图18b中所描绘。pro584的氨基酸序列如图18b中所描绘。 pro585的氨基酸序列如图18c中所描绘。pro586的氨基酸序列如图18c中所描绘。在一些实施方案中,任何针对tta的abd都可以用于异源二聚体fc蛋白。在一个实施方案中,所述sdabd选自seq idno:50、54、58、62、66、70、74、78、82、86、90、94、98、102、 106、110、114、118、122、126、130、134、138、142、146、150、 154、158、162和166。
[0385]
一些实施方案中,异源二聚体fc融合前药蛋白质包含pro575和 pro574。在一些实施方案中,异源二聚体fc融合前药蛋白质包含pro575和pro584。在一些实施方案中,异源二聚体fc融合前药蛋白质包含pro575和pro585。在一些实施方案中,异源二聚体fc融合前药蛋白质包含pro575和pro586。在一些实施方案中,异源二聚体fc 融合前药蛋白质包含pro576和pro574。在一些实施方案中,异源二聚体fc融合前药蛋白质包含pro576和pro584。在一些实施方案中,异源二聚体fc融合前药蛋白质包含pro576和pro585。在一些实施方案中,异源二聚体fc融合前药蛋白质包含pro576和pro586。
[0386]
vi.本发明的另外实施方案
[0387]
在一个方面,本文提供了异源二聚体蛋白质组合物,其包含:(a) 第一单体,所述第一单体从n末端至c末端包含:(i)与第一肿瘤靶抗原(tta)结合的第一抗原结合结构域;(ii)结构域接头;(iii)受限fv 结构域,所述受限fv结构域包含:(1)包含vhcdr1、vhcdr2和 vhcdr3的可变重结构域;(2)受限不可切割接头;和(3)包含vlcdr1、 vlcdr2和vlcdr3的可变轻结构域;(iv)第一可切割接头;和(v)第一 fc结构域;和(b)第二单体,所述第二单体从n末端至c末端包含:(i)伪fv结构域,所述伪fv结构域包含:(1)伪可变重结构域;(2)不可切割接头;和(3)伪可变轻结构域;(ii)第二可切割接头;和(iii)第二 fc结构域,其中所述第一fc结构域和所述第二fc结构域包含杵臼结构修饰,并且其中所述受限fv结构域在所述可切割接头处不存在切割时不结合人cd3。在一些实施方案中,所述第一单体还包含在所述第一可切割接头的n末端处结合第二肿瘤靶抗原(tta)的第二抗原结合结构域。
[0388]
在某些实施方案中,所述可变重链包含seq id no:186的氨基酸序列。在一些情况下,所述可变重结构域包含 vhfr1-vhcdr1-vhfr2-vhcdr2-vhfr3-vhcdr3-vhfr4。
[0389]
在一些实施方案中,所述可变轻结构域包含seq id no:170的氨基酸序列。在某些情况下,所述可变轻结构域包含 vlfr1-vlcdr1-vlfr2-vlcdr2-vlfr3-vlcdr3-vlfr4。
[0390]
在某些实施方案中,所述伪重结构域包含seq id no:190的氨基酸序列。在一些实施方案中,所述伪轻结构域包含seq id no:174 的氨基酸序列。在某些实施方案中,所述伪重结构域包含seq id no: 194的氨基酸序列。在一些实施方案中,所述伪轻结构域包含seq idno:178的氨基酸序列。在某些实施方案中,所述伪重结构域包含seqid no:198的氨基
酸序列。在一些实施方案中,所述伪轻结构域包含 seq id no:182的氨基酸序列。
[0391]
在一些实施方案中,所述第一tta选自egfr、epcam、folr1、 b7h3、trop2和ca9。在其他实施方案中,所述第二tta选自egfr、 epcam、folr1、b7h3、trop2和ca9。在特定情况下,所述第一 tta和所述第二tta是相同的。在某些情况下,所述第一tta和所述第二tta是不同的。
[0392]
在一些实施方案中,所述第一抗原结合结构域包含seq id no: 50、54、58、62、66、70、74、78、82、86、90、94、98、102、106、110、114、118、122、126、130、134、138、142、146、150、154、 158、162和166中的任一个的氨基酸序列。在其他实施方案中,所述第二抗原结合结构域包含seq id no:50、54、58、62、66、70、 74、78、82、86、90、94、98、102、106、110、114、118、122、126、 130、134、138、142、146、150、154、158、162和166中的任一个的氨基酸序列。
[0393]
在一些实施方案中,所述第一可切割接头和/或所述第二可切割接头含有mmp9的切割位点。在一些实施方案中,所述第一可切割接头和/或所述第二可切割接头含有甲基多巴的切割位点。
[0394]
在各种实施方案中,异源二聚体蛋白质包含pro217和pro218、 pro219和pro218、seq id no:9和10、或seq id no:10和11的氨基酸序列。
[0395]
在另一个方面,本文提供了异源二聚体蛋白质组合物,其包含: (a)第一单体,所述第一单体从n末端至c末端包含:(i)与第一肿瘤靶抗原(tta)结合的第一抗原结合结构域;(ii)第一结构域接头;(iii) 第一伪fv结构域,所述第一伪fv结构域包含:(1)包含vlcdr1、 vlcdr2和vlcdr3的可变轻结构域;(2)第一可切割接头;和(3)伪可变重结构域;和(iv)第一fc结构域;和(b)第二单体,所述第二单体从 n末端至c末端包含:(i)与第二肿瘤靶抗原(tta)结合的第二抗原结合结构域;(ii)第二结构域接头;(iii)第二伪fv结构域,所述第二伪 fv结构域包含:(1)包含vhcdr1、vhcdr2和vhcdr3的可变重结构域;(2)第二可切割接头;和(3)伪可变轻结构域;和(iv)第一fc结构域;并且其中所述第一fc结构域和所述第二fc结构域包含杵臼结构修饰,并且其中所述第一伪fv结构域的可变轻结构域和所述第二伪 fv结构域的可变重结构域在所述可切割接头处不存在切割的情况下不结合人cd3。
[0396]
在某些实施方案中,所述第一单体还在所述第一fc结构域的n 末端处包含第一铰链接头。在一些实施方案中,所述第二单体还在所述第二fc结构域的n末端处包含第二铰链接头。在各种实施方案中,所述第一单体在所述第一fc结构域的n末端处包含第一铰链接头,并且所述第二单体在所述第二fc结构域的n末端处包含第二铰链接头。
[0397]
在某些实施方案中,所述可变重链包含seq id no:186的氨基酸序列。在一些情况下,所述可变重结构域包含 vhfr1-vhcdr1-vhfr2-vhcdr2-vhfr3-vhcdr3-vhfr4。
[0398]
在一些实施方案中,所述可变轻结构域包含seq id no: 170的氨基酸序列。在一些情况下,所述可变轻结构域包含 vlfr1-vlcdr1-vlfr2-vlcdr2-vlfr3-vlcdr3-vlfr4。
[0399]
在某些实施方案中,所述伪重结构域包含seq id no:190的氨基酸序列。在一些实施方案中,所述伪轻结构域包含seq id no:174 的氨基酸序列。在某些实施方案中,所述伪重结构域包含seq id no: 194的氨基酸序列。在一些实施方案中,所述伪轻结构域包含seq idno:178的氨基酸序列。在某些实施方案中,所述伪重结构域包含seqid no:198的氨基酸序列。在一些实施方案中,所述伪轻结构域包含 seq id no:182的氨基酸序列。
[0400]
在一些实施方案中,所述第一tta选自egfr、epcam、folr1、 b7h3、trop2和ca9。在
其他实施方案中,所述第二tta选自egfr、 epcam、folr1、b7h3、trop2和ca9。在特定情况下,所述第一 tta和所述第二tta是相同的。在某些情况下,所述第一tta和所述第二tta是不同的。
[0401]
在一些实施方案中,所述第一抗原结合结构域包含seq id no: 50、54、58、62、66、70、74、78、82、86、90、94、98、102、106、 110、114、118、122、126、130、134、138、142、146、150、154、 158、162和166中的任一个的氨基酸序列。在其他实施方案中,所述第二抗原结合结构域包含seq id no:50、54、58、62、66、70、 74、78、82、86、90、94、98、102、106、110、114、118、122、126、 130、134、138、142、146、150、154、158、162和166中的任一个的氨基酸序列。
[0402]
在一些实施方案中,所述第一可切割接头和/或所述第二可切割接头含有mmp9的切割位点。在一些实施方案中,所述第一可切割接头和/或所述第二可切割接头含有甲基多巴的切割位点。
[0403]
在一些实施方案中,异源二聚体蛋白质包含pro36和 pro37、pro36和pro38、pro67和pro68、seq id no:1和2、seq idno:1和3、或seq id no:4和5的氨基酸序列。
[0404]
在本发明的又另一个方面,本文提供了异源二聚体蛋白质组合物,其包含:(a)第一单体,所述第一单体从n末端至c末端包含: (i)与第一肿瘤靶抗原(tta)结合的第一抗原结合结构域;和(ii)第一fc 结构域;和(b)第二单体,所述第二单体从n末端至c末端包含:(i) 与第二肿瘤靶抗原(tta)结合的第二抗原结合结构域;(ii)结构域接头;(iii)第一伪fv结构域,所述第一伪fv结构域包含:(1)包含 vhcdr1、vhcdr2和vhcdr3的可变重结构域;(2)第一可切割接头;和(3)伪可变轻结构域;(iv)第二fc结构域;(v)第二可切割接头;(vi) 与第三肿瘤靶抗原(tta)结合的第三抗原结合结构域;和(vii)第二伪 fv结构域,所述第二伪fv结构域包含:(1)包含vlcdr1、vlcdr2 和vlcdr3的可变轻结构域;(2)第三可切割接头;和(3)伪可变重结构域;其中所述第一fc结构域和所述第二fc结构域包含杵臼结构修饰,并且所述第一伪fv结构域的可变重结构域和所述第二伪fv结构域的可变轻结构域在所述可切割接头处不存在切割的情况下不结合人 cd3。
[0405]
在某些实施方案中,所述第一单体还在所述第一fc结构域的n 末端处包含第一铰链接头。在一些实施方案中,所述第二单体还在所述第二fc结构域的n末端处包含第二铰链接头。在各种实施方案中,所述第一单体在所述第一fc结构域的n末端处包含第一铰链接头,并且所述第二单体在所述第二fc结构域的n末端处包含第二铰链接头。
[0406]
在某些实施方案中,所述可变重链包含seq id no:186的氨基酸序列。在一些情况下,所述可变重结构域包含 vhfr1-vhcdr1-vhfr2-vhcdr2-vhfr3-vhcdr3-vhfr4。
[0407]
在一些实施方案中,所述可变轻结构域包含seq id no:170的氨基酸序列。在各种情况下,所述可变轻结构域包含 vlfr1-vlcdr1-vlfr2-vlcdr2-vlfr3-vlcdr3-vlfr4。
[0408]
在某些实施方案中,所述伪重结构域包含seq id no:190的氨基酸序列。在一些实施方案中,所述伪轻结构域包含seq id no:174 的氨基酸序列。在某些实施方案中,所述伪重结构域包含seq id no: 194的氨基酸序列。在一些实施方案中,所述伪轻结构域包含seq idno:178的氨基酸序列。在某些实施方案中,所述伪重结构域包含seqid no:198的氨基酸序列。在一些实施方案中,所述伪轻结构域包含 seq id no:182的氨基酸序列。
[0409]
在一些实施方案中,所述第一tta选自egfr、epcam、folr1、 b7h3、trop2和ca9。在其他实施方案中,所述第二tta选自egfr、 epcam、folr1、b7h3、trop2和ca9。在特定情况下,
所述第一 tta和所述第二tta是相同的。在某些情况下,所述第一tta和所述第二tta是不同的。
[0410]
在一些实施方案中,所述第一tta、第二tta和/或第三tta 选自egfr、epcam、folr1、b7h3、trop2和ca9。在一些情况下,所述第一tta选自egfr、epcam、folr1、b7h3、trop2和 ca9。在其他情况下,所述第一tta是epcam。在一些情况下,所述第二tta选自egfr、epcam、folr1、b7h3、trop2和ca9。在其他情况下,所述第二tta是epcam。在某些情况下,所述第三 tta选自egfr、epcam、folr1、b7h3、trop2和ca9。
[0411]
在某些实施方案中,所述第一tta和所述第二tta、或所述第一tta和所述第三tta、或所述第二tta和所述第三tta、或所述第一tta、所述第二tta和所述第三tta是相同的。在特定实施方案中,所述第一tta和所述第二tta、或所述第一tta和所述第三tta、或所述第二tta和所述第三tta、或所述第一tta、所述第二tta和所述第三tta是不同的。
[0412]
在各种实施方案中,所述第一抗原结合结构域包含seq id no: 50、54、58、62、66、70、74、78、82、86、90、94、98、102、106、 110、114、118、122、126、130、134、138、142、146、150、154、 158、162和166中的任一个的氨基酸序列。在一些实施方案中,所述第二抗原结合结构域包含seq id no:50、54、58、62、66、70、 74、78、82、86、90、94、98、102、106、110、114、118、122、126、 130、134、138、142、146、150、154、158、162和166中的任一个的氨基酸序列。在各种实施方案中,所述第三抗原结合结构域包含 seq id no:50、54、58、62、66、70、74、78、82、86、90、94、 98、102、106、110、114、118、122、126、130、134、138、142、 146、150、154、158、162和166中的任一个的氨基酸序列。
[0413]
在一些实施方案中,所述第一可切割接头、第二可切割接头和/ 或第三可切割接头含有mmp9的切割位点。在其他实施方案中,所述第一可切割接头、第二可切割接头和/或第三可切割接头含有甲基多巴的切割位点。
[0414]
在一些实施方案中,异源二聚体蛋白质包含pro69和pro70、或 seq id no:6和7的氨基酸序列。
[0415]
在另一个方面,本文提供了异源二聚体蛋白质组合物,其包含: (a)第一单体,所述第一单体从n末端至c末端包含:(i)与第一肿瘤靶抗原(tta)结合的第一抗原结合结构域;(ii)第一fc结构域;(iii)第一可切割接头;(iv)与第二肿瘤靶抗原(tta)结合的第二抗原结合结构域;(v)第一结构域接头;和(vi)第一伪fv结构域,所述第一伪fv结构域包含:(1)包含vlcdr1、vlcdr2和vlcdr3的可变轻结构域;(2) 第二可切割接头;(3)伪可变重结构域;和(b)第二单体,所述第二单体从n末端至c末端包含:(i)与第二肿瘤靶抗原(tta)结合的第二抗原结合结构域;(ii)第二结构域接头;(iii)第二伪fv结构域,所述第二伪fv结构域包含:(1)包含vhcdr1、vhcdr2和vhcdr3的可变重结构域;(2)第三可切割接头;和(3)伪可变轻结构域;和(iv)第二fc 结构域;其中所述第一fc结构域和所述第二fc结构域包含杵臼结构修饰,并且其中所述第一伪fv结构域的可变轻结构域和所述第二伪 fv结构域的可变重结构域在所述可切割接头处不存在切割的情况下不结合人cd3。
[0416]
在一些实施方案中,所述第一单体还在所述第一fc结构域的n 末端处包含第一铰链接头。在一些实施方案中,所述第二单体还在所述第二fc结构域的n末端处包含第二铰链接头。在各种实施方案中,所述第一单体在所述第一fc结构域的n末端处包含第一铰链接头,并且所述第二单体在所述第二fc结构域的n末端处包含第二铰链接头。
[0417]
在某些实施方案中,所述可变重链包含seq id no:186的氨基酸序列。在一些情况下,所述可变重结构域包含 vhfr1-vhcdr1-vhfr2-vhcdr2-vhfr3-vhcdr3-vhfr4。
[0418]
在一些实施方案中,所述可变轻结构域包含seq id no:170的氨基酸序列。在各种情况下,所述可变轻结构域包含 vlfr1-vlcdr1-vlfr2-vlcdr2-vlfr3-vlcdr3-vlfr4。
[0419]
在一些实施方案中,所述第一抗原结合结构域包含seq id no: 50、54、58、62、66、70、74、78、82、86、90、94、98、102、106、110、114、118、122、126、130、134、138、142、146、150、154、 158、162和166中的任一个的氨基酸序列。在其他实施方案中,所述第二抗原结合结构域包含seq id no:50、54、58、62、66、70、 74、78、82、86、90、94、98、102、106、110、114、118、122、126、 130、134、138、142、146、150、154、158、162和166中的任一个的氨基酸序列。
[0420]
在一些实施方案中,所述第一tta选自egfr、epcam、folr1、 b7h3、trop2和ca9。在其他实施方案中,所述第二tta选自egfr、 epcam、folr1、b7h3、trop2和ca9。在特定情况下,所述第一 tta和所述第二tta是相同的。在某些情况下,所述第一tta和所述第二tta是不同的。
[0421]
在一些实施方案中,所述第一可切割接头和/或所述第二可切割接头含有mmp9的切割位点。在一些实施方案中,所述第一可切割接头和/或所述第二可切割接头含有甲基多巴的切割位点。
[0422]
在一些实施方案中,异源二聚体蛋白质包含pro67和pro71、或 seq id no:4和8的氨基酸序列。
[0423]
本文提供了编码本文所述的异源二聚体蛋白质中任一种的第一单体的核酸。还提供了编码本文所述的异源二聚体蛋白质中任一种的第二单体的核酸。此外,本文提供了包含编码第一单体的核酸的表达载体、包含编码第二单体的核酸的表达载体、或包含编码第一单体的核酸和编码第二单体的核酸的表达载体。在一些实施方案中,本文提供了包含本文所公开的表达载体中任一种的宿主细胞。
[0424]
在本发明的一个方面,提供了制备本文所述的异源二聚体蛋白质中的任一种的方法。所述方法包括在表达异源二聚体蛋白质的条件下培养本文所述的宿主细胞并且回收所述异源二聚体蛋白质。
[0425]
在本发明的一个方面,提供了治疗癌症的方法,所述方法包括向患者施用本发明的异源二聚体蛋白质中的任一种。
[0426]
本文所述的异源二聚体蛋白质组合物可以在不存在同源蛋白酶切割的情况下被称为前药组合物。
[0427]
在另一个方面,本文提供了治疗有需要的人类受试者中的癌症的方法,所述方法包括施用本文所述的任何前药组合物。
[0428]
vii.实施例
[0429]
a.实施例1:前药构建体的构建和纯化
[0430]
转染
[0431]
从单独的表达载体(pcdna3.4衍生物)中表达每对构建体。将等量的编码半cobra对的质粒dna混合并按照制造商的转染方案转染到expi293细胞中。转染后5天通过离心(6000rpm x 25’)和过滤(0.2um 过滤器)收获条件培养基。通过sds-page确认蛋白质表达。纯化构建体,并且最终缓冲液的组成为:25mm柠檬酸盐、75mm精氨酸、 75mm nacl、4%蔗糖,
ph 7。将最终制剂储存在-80℃。
[0432]
蛋白酶切割
[0433]
ek
[0434]
重组人肠激酶(r&d systems目录号1585-se-010)用于切割本文所述的异源二聚体fc前药蛋白质。重组蛋白酶根据制造商的程序活化,并以约100mm的储备液浓度进行制备。
[0435]
将测试样品(pro36+37、pro36+38、pro67+68、pro69+70、pro67+71、 pro217+218、and pro218+219)缓冲交换到含氯化钙的hepes缓冲盐水(25mm hepes、50mm nacl、2mm cacl2)中,并在室温下与10nm 终浓度的适当蛋白酶孵育过夜。通过sds-page确认切割。
[0436]
mmp-9
[0437]
mmp9的活化:根据以下方案活化重组人mmp9。重组人mmp-9 (r&d#911-mp-010)为0.44mg/ml(4.7um)。在dmso中以100mm 的储备液浓度制备对氨基苯基醋酸汞(apma)(sigma)。测定缓冲液为 50mm tris ph 7.5、10mm cacl2、150mm nacl、0.05%brij-35。
[0438]-用测定缓冲液稀释rhmmp9至约100ug/ml(25ul hmmp9+75 ul测定缓冲液)
[0439]-从dmso中的100mm储备液添加对氨基苯基醋酸汞(apma) 至终浓度为1mm(1ul至100ul)。
[0440]-在37℃下孵育24小时
[0441]-将mmp9稀释至10ng/ul(向100ul活化溶液中添加900ul测定缓冲液)
[0442]
活化的rhmmp9的浓度为约100nm。
[0443]
用于tdcc测定的构建体的切割
[0444]
为了切割构建体,向配制缓冲液(25mm柠檬酸、75mm l-精氨酸、75mm nacl、4%蔗糖)中的浓度为1mg/ml(10.5um)的100ul蛋白质样品中补充至多10mm的cacl2。添加活化的rhmmp9至浓度 20-35nm。将样品在室温下孵育过夜(16-20小时)。使用sds page (10-20%tg,tg运行缓冲液,200v,1小时)验证切割的完全性。样品通常98%被切割。
[0445]
b.实施例2:测试活化的异源二聚体fc前药蛋白质的效力的t 细胞依赖性细胞毒性(tdcc)测定。
[0446]
使萤火虫荧光素酶转导的ht-29细胞生长至大约80%融合,并用versene(0.48mm edta于pbs
–
ca-mg中)进行分离。将细胞离心并重悬于tdcc培养基(含hepes、glutamax、丙酮酸钠、非必需氨基酸和β-巯基乙醇的具有5%热灭活fbs的rpmi 1640)中。将纯化的人pan-t细胞解冻,离心并重悬于tdcc培养基中。
[0447]
将ht-29_luc细胞和t细胞的共培养物添加到384孔细胞培养板中。然后将连续稀释的cobra添加到共培养物中并在37℃下孵育48小时。最后,将等体积的steadyglo荧光素酶测定试剂添加到板中并孵育20分钟。以0.1s/孔的暴露时间在perkin elmer envision 上读取板。记录总发光并且在graphpad prism 7上分析数据。
[0448]
使用上述测定我们测试了当活化的(切割的)异源二聚体fc前药蛋白质与t细胞结合并将细胞溶解导向靶阳性肿瘤细胞时诱导的特异性细胞毒性的百分比。
[0449]
图3a和图3b显示在tdcc测定中用同源蛋白酶切割时一些说明性异源二聚体fc前药构建体诸如pro36+37和pro36+38显示出低条件性或缺乏条件性。
[0450]
图7a、图7b和图7c显示了当在tdcc测定中用同源蛋白酶切割时一些说明性异源二
聚体fc前药构建体诸如pro67+68和pro69+70 显示出条件性但缺乏高活性。
[0451]
图10a和图10b显示了当在tdcc测定中用同源蛋白酶切割时一些说明性异源二聚体fc前药构建体诸如pro217+218和pro218+219 显示出条件性和高效力。
[0452]
在蛋白酶切割时以与融合蛋白相当的方式诱导癌细胞杀伤的、含有针对egfr的单结构域抗体的本文所述的前药构建体包含针对 egfr的单结构域抗体和抗cd3 fv结构域。
[0453]
c.实施例3:过继t细胞转移模型
[0454]
向nsg小鼠(jackson)皮下植入肿瘤细胞系。经由阴性选择(stemcell technologies)从leukopak中分离人t细胞,并且将其利用 g-rex技术(wilson wolf)利用t细胞扩增/活化珠(miltenyi)进行扩增。一旦建立肿瘤生长,基于肿瘤体积将小鼠随机化,将扩增的人t细胞静脉内植入,并将供试品按指示进行给药。通过卡尺测量评估肿瘤体积。
[0455]
所使用的供试品为pro574和pro575、以及pro574和pro577(参见例如图21)。如图22所示,cobra杵-臼fc蛋白是有效的。与pro574 与pro577组合(ncl杵对照)相比,pro574(空臼)当与mmp9切割的杵pro575组合时是有效的。
[0456]
与pro574/577(ncl对照)过继t细胞转移模型相比,施用 pro574/pro575的异源二聚体fc蛋白证明了抗肿瘤反应。
[0457]
所有引用的参考文献在本文中以全文引用的方式明确地并入。尽管上面出于说明的目的已经描述了本发明的特定实施方案,但是本领域技术人员应当理解,在不脱离如所附权利要求中所描述的本发明的情况下,可以对细节进行多种改变。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1