用于粒子治疗系统的准直器和射程调节器的制作方法
用于粒子治疗系统的准直器和射程调节器
1.相关应用的交叉引用
2.本技术要求2019年3月8日提交的标题为“delivery of radiation by column”的美国临时专利申请第62/815,721号的优先权和权益。本技术要求2019年5月28日提交的标题为“energy degrader including boron carbide”的美国临时专利申请第62/853,387号的优先权和权益。本技术要求于2019年8月21日提交的标题为“generating a treatment plan”的美国临时专利申请第62/889,825号的优先权和权益。本技术要求2019年8月21日提交的标题为“collimator for a particle therapy system”的美国临时专利申请第62/889,861号的优先权和权益。美国临时专利申请62/815,721、62/853,387、62/889,825和62/889,861的内容通过引用合并于本文。
技术领域
3.本公开总体上涉及用于粒子治疗系统的准直器和射程调节器。
背景技术:
4.粒子治疗系统使用加速器产生粒子束来治疗疾病,例如肿瘤。在操作中,粒子在磁场的存在下在空腔内的轨道中加速,并通过提取通道从空腔中移除。磁场再生器在空腔外部附近产生磁场冲击,以扭曲某些轨道的间距和角度,从而使它们朝着提取通道移动,并最终进入提取通道。由粒子组成的粒子束离开提取通道。
5.扫描系统是在提取通道的粒子束下游(down
‑
beam)。在这个例子中,在粒子束下游表示相对于提取通道更靠近辐射标靶。扫描系统相对于辐射标靶移动粒子束,以将辐射标靶的各个部分暴露于粒子束。例如,为了治疗肿瘤,可以在肿瘤的不同部分上扫描粒子束,以将不同部分暴露于辐射。
6.扫描系统可以包括射程调节器,以改变粒子束的能量,从而改变粒子束影响的肿瘤的不同深度。准直器可用于修整粒子束。例如,准直器可以允许粒子束的一部分到达患者,同时防止粒子束的不同部分到达患者。
技术实现要素:
7.一种示例系统包括产生粒子束以治疗患者的粒子加速器和具有包括第一开口和第二开口的开口的载体。载体包括抑制粒子束输送的材料,并且载体位于粒子加速器和患者之间。控制系统被配置为控制粒子束向第一开口的移动,以使得粒子束的至少一部分能够到达患者,以在粒子束在第一开口处保持静止时改变粒子束的能量,以及控制粒子束从第一开口向第二开口的移动。该示例系统可以单独地或组合地包括一个或多个以下特征。
8.开口可以包括孔阵列,第一开口是第一孔,第二开口是第二孔。开口可以包括槽阵列,第一开口是第一槽,第二开口是第二槽。
9.该系统可以包括在粒子加速器和患者之间的射程调节器。射程调节器可包括构造成移入和移出粒子束路径的结构,以便改变粒子束的能量。控制系统可以被配置成控制所
述结构进入或离开粒子束路径的运动,以改变粒子束的能量。该结构可以包括板,用于在粒子束穿过一个或多个板时改变粒子束的能量。这些板可以是或包括碳化硼。粒子加速器可以包括具有导电线圈的超导磁体。控制系统可以被配置成改变通过导电线圈的电流,以改变粒子束的能量。
10.控制系统可以被配置成改变粒子束的能量,使得粒子束在从第一开口移动到第二开口之前,粒子束通过第一开口治疗患者体内的标靶的柱状部分。当粒子束处于第一开口时,粒子束可以向标靶输送超过每秒1格雷的辐射剂量,持续时间少于5秒。当粒子束处于第一开口时,粒子束可以向标靶输送每秒20格雷到每秒100格雷的辐射剂量,持续时间10毫秒到5秒。当粒子束处于第一开口时,粒子束可以以小于5秒的持续时间向标靶输送每秒40格雷至每秒120格雷的辐射剂量。当粒子束处于第一开口时,粒子束可以以任何超高剂量率向标靶输送辐射剂量。当粒子束处于第一开口时,粒子束可以以小于500ms的持续时间、在10ms和5s之间的持续时间或者小于5s的持续时间向标靶输送大于每秒100格雷、大于每秒200格雷、大于每秒300格雷、大于每秒400格雷或者大于每秒500格雷的辐射剂量。
11.开口可以包括孔,第一开口是第一孔,第二开口是第二孔。控制粒子束向第一孔然后向第二孔的移动可以包括将粒子束居中在第一孔,然后将粒子束居中在第二孔。
12.在粒子束从第一开口移动到第二开口之后,粒子束可以不再移动到第一开口。
13.该系统可以包括具有导电线圈的扫描磁体。扫描磁体可以用于产生磁场以影响粒子束的运动。控制系统可以被配置成通过改变通过扫描磁体的导电线圈的电流来影响磁场,从而控制粒子束的移动。该系统可以包括轨道,载体安装在该轨道上,用于在粒子束的束场内移动。马达可以被配置成沿着轨道移动载体。控制系统可以被配置成基于粒子束的移动来控制马达以沿着轨道移动载体。该系统可以包括脊形滤波器,以扩展粒子束的布拉格峰。
14.该系统可以包括轨道,载体安装在该轨道上以用于移动。马达可以被配置成响应于来自控制系统的一个或多个命令而沿着轨道移动载体。控制系统可以被配置成在粒子束在第二开口处保持静止时改变粒子束的能量,并且控制粒子束从第二开口到多个额外开口的移动,其中粒子束在多个额外开口中的每个开口处保持静止一段时间,同时粒子束的能量在每个开口处改变。
15.一种示例性准直器包括具有一个或多个开口的载体。载体可以是或包括抑制粒子束输送的材料。一个或多个开口中的每一个可以具有不可改变的尺寸和形状。一个或多个开口中的每一个可以具有可变的尺寸和/或形状。一个或多个开口中的一些可以具有可变的尺寸和/或形状,一个或多个开口中的一些可以具有不可变的尺寸和/或形状。准直器可以包括轨道,载体安装在该轨道上,用于在粒子束的束场内移动。马达被配置成基于粒子束的运动沿着轨道移动载体。示例性准直器可以单独或组合地包括一个或多个以下特征。
16.一个或多个开口可以是或包括孔阵列。一个或多个开口可以是或包括单个线性孔阵列。一个或多个开口可以是或包括一个或多个延伸穿过载体纵向维度的槽。一个或多个开口可以是或包括延伸穿过载体纵向维度的单个槽。载体可以由镍、黄铜或钨中的至少一种制成或包括其中的至少一种。马达可以响应来自控制系统的命令,以沿着轨道移动载体。
17.载体可以是第一载体。准直器可以包括具有开口阵列的第二载体。第二载体可以是或包括抑制粒子束输送的材料。第二载体可以被安装用于在粒子束的束场内移动。马达
还可以被配置成基于粒子束的运动而沿着轨道移动第二载体。第一载体和第二载体可以彼此物理连接。第一载体和第二载体可以被配置为相对于彼此独立移动。例如,马达可以是第一马达,准直器也可以包括配置成移动第二载体的第二马达。第二马达可以被配置为基于粒子束的移动来移动第二载体。
18.一种示例性系统包括产生粒子束以治疗患者的粒子加速器和具有开口的载体。载体可以是或包括抑制粒子束输送的材料。载体可以位于粒子加速器和患者之间。该系统可以包括控制系统,以控制粒子束向开口的第一部分的移动,从而使得粒子束的至少一部分能够到达患者,以当粒子束在开口的第一部分保持静止时改变粒子束的能量,并且控制粒子束从开口的第一部分向开口的第二部分的移动。该示例性系统可以单独地或组合地包括一个或多个以下特征。
19.开口可以是或包括沿载体延伸的槽。控制系统可以被配置成当粒子束在开口的第二部分处保持静止时改变粒子束的能量,并且控制粒子束从开口的第二部分到开口的多个额外部分的移动,其中粒子束在开口的多个额外部分的每一个处保持静止一段时间,同时粒子束的能量在开口的每个部分处改变。
20.控制系统可以被配置成改变粒子束的能量,使得在粒子束从开口的第一部分移动到开口的第二部分之前,粒子束通过开口的第一部分治疗患者体内标靶的柱状部分。当粒子束处于开口的第一部分时,粒子束可以以小于5秒的持续时间向标靶输送超过每秒1格雷的辐射剂量。当粒子束处于开口的第一部分时,粒子束可以以10毫秒至5秒的持续时间向标靶输送每秒20格雷至每秒100格雷的辐射剂量。当粒子束处于开口的第一部分时,粒子束可以以小于5秒的持续时间向标靶输送每秒40格雷至每秒120格雷的辐射剂量。当粒子束处于开口的第一部分时,粒子束可以以超高剂量率向标靶输送辐射剂量。
21.该系统可以包括粒子加速器和患者之间的射程调节器。射程调节器可包括构造成移入和移出粒子束路径的结构,以便改变粒子束的能量。控制系统可以被配置成控制所述结构进入或离开粒子束路径的运动,以改变粒子束的能量。该结构可以是或包括板,用于当粒子束穿过一个或多个板时改变粒子束的能量。一个或多个板或结构可以包括碳化硼。
22.粒子加速器可以包括包含导电线圈的超导磁体。控制系统可以被配置成改变通过导电线圈的电流,以改变粒子束的能量。
23.该系统可以包括轨道,载体安装在该轨道上,用于在粒子束的束场内移动。马达可以被配置成沿着轨道而移动载体。
24.一示例系统包括粒子加速器,以提供粒子束来治疗位于治疗室中的患者。该系统包括射程调节器,该射程调节器包括多个结构。多个结构中的每个结构用于当粒子束穿过该结构时改变粒子束的能量。每个结构包括碳化硼。该系统还包括促动器,每个促动器用于控制多个结构中相应一个结构进入或离开粒子束路径的运动。射程调节器位于治疗室。该系统可以单独或组合包括一个或多个以下特征。
25.每个结构可以是一个板。每个结构可以是多面体。每个结构可以是纯碳化硼。多个结构中的一个或多个可以包括由碳化硼和石墨组成的复合材料。
26.射程调节器可以定位为沿着粒子束的束线距离患者不超过3米。射程调节器可以定位为沿着粒子束的束线离患者不超过2米。射程调节器可以定位为沿着粒子束的束线离患者不超过1米。该系统可以包括扫描磁体,以相对于患者移动粒子束。射程调节器可以位
于扫描磁体和患者之间。
27.粒子束可以以超高剂量率应用于患者。粒子束可以以超过每秒1格雷的剂量率应用于患者,持续时间小于5秒。粒子束可以以每秒20格雷至每秒100格雷的剂量率施加到患者,持续时间为10毫秒至5秒。粒子束可以以每秒40格雷至每秒120格雷的剂量率施加到患者,持续时间小于5秒。
28.射程调节器的结构可以是可控的,以在粒子束保持静止的同时移入或移出粒子束,以便使用超高剂量率治疗患者体内的组织柱体。促动器可以是线性马达或任何其他合适类型的马达。
29.一示例性系统包括粒子加速器,以提供粒子束来治疗位于治疗室中的患者。该系统包括射程调节器,该射程调节器包括多个结构。多个结构中的每个结构用于当粒子束穿过该结构时改变粒子束的能量。每个结构包括碳化硼。该系统还包括促动器,每个促动器用于控制多个结构中相应一个结构进入或离开粒子束路径的运动。射程调节器沿着粒子束的束线距离患者不超过4米。该系统可以单独或组合包括一个或多个以下特征。
30.这些结构可以是可控的,以便在粒子束保持静止的同时移入或移出粒子束,从而使用超高剂量率治疗患者体内的组织柱体。射程调节器可以定位为沿着粒子束的束线离患者不超过3米。射程调节器可以定位为沿着粒子束的束线离患者不超过2米。射程调节器可以定位为沿着粒子束的束线离患者不超过1米。
31.粒子束可以以超高剂量率应用于患者。粒子束可以以超过每秒1格雷的剂量率应用于患者,持续时间小于5秒。粒子束可以以每秒20格雷至每秒100格雷的剂量率施加到患者,持续时间为10毫秒至5秒。粒子束可以以每秒40格雷至每秒120格雷的剂量率施加到患者,持续时间小于5秒。
32.射程调节器的结构可以是可控的,以在粒子束保持静止时移入或移出粒子束,以便使用超高剂量率治疗患者体内的组织的柱体。促动器可以是线性马达或其他类型的马达。多个结构中的一个或多个可以包括由碳化硼和石墨组成的复合材料。
33.一示例系统包括:粒子加速器,用于提供粒子束以治疗位于治疗室中的患者;扫描磁体,用于相对于患者移动粒子束;以及射程调节器。射程调节器包括多个结构。多个结构中的每个结构用于当粒子束穿过该结构时改变粒子束的能量。每个结构包括碳化硼。该系统还包括促动器,每个促动器用于控制多个结构中相应一个结构进入或离开粒子束路径的运动。射程调节器位于扫描磁体和患者之间。该系统可以单独或组合包括一个或多个以下特征。
34.射程调节器可以定位为沿着粒子束的束线距离患者不超过1米。粒子束可以以超高剂量率应用于患者。粒子束可以超过每秒1格雷的剂量率应用于患者,持续时间小于5秒。粒子束可以以每秒20格雷至每秒100格雷的剂量率施加到患者,持续时间为10毫秒至5秒。粒子束可以以每秒40格雷至每秒120格雷的剂量率施加到患者,持续时间小于5秒。射程调节器的结构可以是可控的,以便在粒子束保持静止时移入或移出粒子束,从而以超高的辐射剂量率治疗患者体内的组织柱体。
35.该系统可以包括在其上安装粒子加速器的外部台架。外部台架可以是可控的,以至少部分地围绕患者移动粒子加速器。该系统可以包括内部台架,该内部台架可控制成与外部台架一致地移动。内部台架可以包括管口,该管口可以朝向患者延伸,也可以远离患者
缩回。射程调节器可以位于管口中。射程调节器位于治疗室中,在该治疗室中粒子束被施加到患者。管口可以完全缩回到内部台架中。
36.对于能量为70mev或更大的粒子束,粒子束可以具有小于1.2厘米(cm)西格玛的束斑尺寸。粒子束可以具有小于1.2厘米(cm)西格玛的束斑尺寸。粒子束可以具有小于0.5厘米(cm)西格玛的束斑尺寸。
37.射程调节器和患者之间可以没有用于影响粒子束的结构。该系统可以包括射程调节器和患者之间的可配置准直器。可配置的准直器可以是可控的,以与单个束斑一样小的分辨率修整粒子束。促动器可以包括线性马达。促动器可以包括旋转马达,每个旋转马达驱动相应的线性促动器以控制相应结构的运动。
38.射程调节器中的多个结构中的一个或多个可以包括由碳化硼和石墨组成的复合材料。射程调节器中的多个结构中的每一个可以是纯碳化硼。
39.本公开中描述的两个或多个特征,包括本发明内容部分中描述的特征,可以被组合以形成这里没有具体描述的实施方式。
40.本文描述的各种系统或其部分的控制可以通过计算机程序产品来实现,该计算机程序产品包括存储在一个或多个非暂时性机器可读存储介质上并且可在一个或多个处理设备(例如,微处理器(一个或多个)、专用集成电路、诸如现场可编程门阵列(一个或多个)的编程逻辑等)上执行的指令。本文描述的系统或其部分可以实现为装置、方法或电子系统,其可以包括一个或多个处理设备和计算机存储器,以存储可执行指令来实现对所述功能的控制。
41.在附图和下面的描述中阐述了一个或多个实施方式的细节。从说明书和附图以及权利要求中,其他特征、目的和优点将变得显而易见。
附图说明
42.图1是通过在整个层上顺序扫描粒子束来治疗的示例辐射标靶的透视图。
43.图2是通过在标靶上按柱体依次扫描粒子束来治疗的示例辐射标靶的透视图。
44.图3是可用于本文描述的粒子治疗系统的示例性粒子加速器的一部分的剖视图。
45.图4是可用于本文描述的粒子治疗系统的示例性扫描系统的部件的侧视图。
46.图5是可用于本文描述的粒子治疗系统的示例性扫描系统的部件的透视图。
47.图6是用于图4和5所示类型的扫描系统中的示例性磁体的正视图。
48.图7是用于图4和5所示类型的扫描系统中的示例性磁体的透视图。
49.图8是在图4和5所示类型的扫描系统中使用的示例性射程调节器(例如,范围调制器)的透视图。
50.图9是用于将射程调节器的板移入和移出粒子束路径的过程的透视图。
51.图10是示例性线性马达和由其控制的射程调节器的示例性板的框图。
52.图11是示出通过在标靶上按柱体依次扫描粒子束来治疗辐射标靶的示例过程的流程图。
53.图12、13、14和15是示出通过将能量吸收板顺序移动到静止粒子束的路径中来治疗辐射标靶的柱体的透视框图。
54.图16、17、18和19是示出通过将能量吸收板顺序移出静止粒子束的路径来治疗辐
射标靶的柱体的透视框图。
55.图20是包含二维孔阵列的示例性准直器的正视图。
56.图21是包含二维孔阵列和用于准直器的控制部件的示例性准直器的正视图。
57.图22是包含单个线性孔阵列的示例性准直器的透视图。
58.图23是图22的示例性准直器的透视图。
59.图24是包含不可独立控制的两个线性孔阵列的示例性准直器的透视图。
60.图25是包含可独立控制的载体的示例性准直器的正视图。
61.图26和27分别是示例性粒子治疗系统的正视图和透视图。
62.图28是示例性粒子治疗系统的透视图。
63.图29是示出对于射程调节器中用于改变粒子束能量的不同材料,对于不同粒子束能量,束斑尺寸变化的曲线图。
64.图30是包含线性槽阵列的示例性准直器的正视图。
65.图31是包含二维槽阵列的示例性准直器的正视图。
66.图32是示例槽的正视图,示出了通过槽对粒子束执行的准直。
67.图33是包含线性槽阵列的示例性准直器的正视图,示出了粒子束沿着槽的一部分的运动。
68.图34是示出示例性扩展布拉格峰(sobp)和作为示例性辐射标靶的一部分的列的图。
69.图35至44是示出用于通过微体积治疗辐射标靶的柱体的示例过程的透视框图。
70.图45a和45b是示出蒙特卡罗(monte carlo)模拟结果的曲线图,该模拟计算输送到治疗体积的辐射剂量以及该剂量计算中每个体素达到最终剂量所需的时间。
71.图46是可与本文描述的示例性可配置准直器一起使用的示例性可配置准直器叶片的透视图。
72.图47是相对于辐射标靶的治疗区域定位的可配置准直器叶片的俯视图。
73.图48是示例性可配置准直器的透视图。
74.图49是示例性可配置准直器的正视图。
75.图50是示例性可配置准直器的透视图,该准直器具有以透视方式描绘的部件,以示出其内部。
76.图51是在粒子治疗治疗期间相对于患者定位的示例性可配置准直器的透视图。
77.不同附图中相同的参考符号表示相同的元件。
具体实施方式
78.本文描述的是包括准直器的粒子治疗系统的示例性实施方式。粒子治疗系统用于使用粒子束(如质子束或离子束)治疗患者体内的辐射标靶(“标靶”),如肿瘤。一些系统逐层处理标靶横截面。例如,可以控制粒子束的能量以将辐射剂量(“剂量”)传递到一层,然后粒子束可以在该层的全部或部分上移动。此后,粒子束的能量可以被改变以将剂量传递到另一层。粒子束可以移动穿过所有或部分其它层,以此类推,直到整个标靶被处理。例如,图1示出了使用粒子束12处理标靶11的整个层10,粒子束12的能量足以通过沿着箭头15的方向移动粒子束穿过层10来将剂量输送到层10。然后使用具有足以向层16输送剂量的不同能
量的粒子束,以相同的方式处理标靶11的不同层16,以此类推。整个治疗体的平均治疗通常以相对小的剂量率进行,例如每秒0.1格雷(grey)。粒子束通常在到达标靶之前穿透健康组织。在治疗过程中,这个健康组织内的任何一个位置都可被处理几次。在这种位置的剂量是以分钟量级的时间尺度被接收的。
79.相比之下,一些粒子治疗系统可以使用超高(flash)剂量率的辐射来治疗标靶的三维柱体区域。这些系统使用笔状粒子束扫描来调节输送到标靶的超高剂量率。在一些示例中,笔状粒子束扫描包括输送粒子辐射的一系列小粒子束,每个小粒子束可以具有唯一的方向、能量和电荷。通过组合来自这些单独粒子束的剂量,可以用辐射治疗三维标靶治疗体。此外,系统不是以恒定的能量针对多个层来安排治疗,而是将治疗组织到由静止粒子束的方向限定的柱体中。粒子束的方向可以朝向标靶的表面。
80.在一些实施方式中,在粒子束沿着另一条路径穿过辐射标靶之前,治疗全部或部分柱体。在一些实施方式中,穿过标靶的路径穿过标靶的全部或部分。在一示例中,粒子束可以沿着穿过标靶的路径被引导,并且不偏离该路径。当沿着该路径被引导时,粒子束的能量被改变。粒子束不随着其能量的变化而移动,因此,粒子束治疗标靶内部的沿着粒子束的长度和束斑的宽度延伸的全部或一部分。因此,治疗是沿着粒子束的纵向深度进行的。例如,被治疗的标靶的一部分可以从标靶表面处的束斑向下延伸穿过标靶内部的全部或一部分。结果是粒子束使用超高剂量率的辐射来治疗标靶的三维柱状部分。在一些示例中,超高剂量率的辐射包括,例如,在小于500毫秒(ms)的持续时间内超过每秒1格雷,在10ms到5秒之间的持续时间内超过每秒1格雷,或者在小于5s的持续时间内超过每秒1格雷的辐射剂量。本文提供了其他示例。
81.在一些实施方式中,在如上段所述治疗了标靶的柱状部分之后,粒子束沿着穿过标靶的新的不同路径被引导。例如,如图2所示,通过改变沿着箭头28的方向行进的粒子束22的能量来治疗标靶21的柱体20。粒子束然后沿着新的路径24被引导穿过标靶21,在那里它沿着箭头29的方向前进。然后,通过在粒子束静止时改变粒子束的能量,沿着新的路径来治疗柱体25。如前所述,柱体位于粒子束的纵向范围内。在一些实施方式中,当治疗标靶的柱体时,粒子束沿着通过标靶的每个路径仅被引导一次。结果,标靶21之上或之下的健康组织暴露于超高剂量率的辐射一次,而不是如图1中逐层治疗标靶时发生的情况那样暴露于多次低剂量的辐射。
82.换句话说,在一些实施方式中,粒子束沿着新的路径被引导,并且沿着该路径的上游组织不再被访问。以这种方式,可以以一剂量率来治疗标靶内的每个位置,该剂量率与按照层切换时间调制的单个笔状波束的剂量率相当。整个治疗过程中的平均剂量率可能与逐层辐射治疗相当,但任何一个束斑的局部剂量率都处于超高剂量率。在某些情况下,当以超高剂量率进行辐射时,对健康组织的损害可能会减少。例如,当以小于500毫秒的脉冲输送10到20格雷的辐射剂量时——达到每秒20到100格雷的有效剂量率——健康组织可能比在更长的时间尺度上用相同剂量辐射时受损更少,而输送的辐射可以以相同的有效性水平治疗肿瘤。
83.在一些实施方式中,用于产生和调节粒子束的硬件的运行速度可能影响以超高剂量率输送辐射的能力。例如,为了实现超高剂量率,粒子束的能量可以以超过用于逐层扫描的能量变化的剂量率变化。例如,通过在50毫秒的持续时间内切换粒子束能量,可以实现应
用于标靶柱体的超高剂量率。这可以通过例如控制粒子束的运动和包含碳化硼的能量吸收板或包含碳化硼的其他结构进出粒子束路径的运动来实现。举例来说,可能需要5层切换的5厘米(cm)深的柱体可能需要250毫秒的停机时间,在此期间不输送粒子束,允许250毫秒的粒子束输送,在此期间可以输送10到20格雷的剂量。能量吸收板的更快运动和/或粒子束运动的额外协调可以进一步减少层切换时间,允许甚至更多的时间来输送所需的治疗剂量,同时仍然满足局部超高剂量率的要求。
84.本文还描述了用于粒子治疗系统的准直器的示例性实施方式。使用准直来将相邻的束斑(例如,图1)或相邻的柱体(例如,图2)彼此隔离可以使得系统能够在局部区域(例如,束斑或柱体)中实现flasfi剂量率或非flasfi剂量率,而没有辐射泄漏到相邻区域中,或者仅有泄漏到相邻区域中的最小可接受量的辐射。
85.在一些实施方式中,准直器可以包括具有一个或多个开口的载体,例如一个或多个孔或槽,粒子束通过这些开口到达患者体内的标靶。载体可以是由阻止粒子束通过的材料制成的平板、多面体或弯曲三维(3d)结构。例如,载体可以由金属制成,例如镍、黄铜或钨,其厚度足以防止给定能量的辐射通过。在一些实施方式中,一个或多个开口的尺寸和形状是固定的;例如,尺寸和形状是不可改变或不可配置的。例如,准直器的形状和内容物可以是静态的。粒子束可在开口内或开口之间移动。每个开口通过允许粒子束的一部分穿过开口到达患者体内的标靶,同时防止粒子束的不同部分到达患者,从而修整粒子束。修整可以使粒子束准直。例如,作为修整的结果,可以减少沿着粒子束路径的色散量。
86.控制系统,例如计算系统,可以被配置为控制粒子束向准直器的第一孔(开口的例子)的移动,以使得粒子束的至少一部分能够到达患者,在粒子束于第一孔处保持静止的同时改变粒子束的能量,并且控制粒子束从第一孔向第二孔的运动。控制系统还可以被配置成在粒子束在第二孔处保持静止的同时改变粒子束的能量,并且控制粒子束从第二孔到多个额外孔的运动。在多个额外的孔中的每一个处,粒子束被控制成在粒子束的能量改变时保持静止一段时间。结果,在每个孔处,粒子束被修整,并且由于能量变化,粒子束治疗标靶内的三维柱体。
87.粒子治疗系统中使用的准直器的运行速度可能会影响系统以超高剂量率输送辐射的能力。本文描述的示例性准直器可以具有有限的可配置性或没有可配置性,因此可以减少或消除在治疗期间配置准直器所需的时间量。因此,当以超高(flash)剂量率输送辐射时,准直器可以特别有用。然而,当以非超高的剂量率输送辐射时,可以使用准直器。在一些实施方式中,可以使用可配置的准直器。
88.下面描述的是粒子治疗系统的示例性实施方式,该粒子治疗系统被配置为以超高剂量率穿过标靶的三维柱体输送辐射。在示例性实施方式中,粒子治疗系统是质子治疗系统。如本文所述,示例性质子治疗系统在三维方向上穿过辐射标靶扫描质子束,以便破坏恶性组织。图3示出了可用于在质子治疗系统中提供粒子(例如质子)束的示例性超导同步回旋加速器的部件310的横截面。在这个例子中,部件310包括超导磁体311。超导磁体包括超导线圈312和313。超导线圈由多个集成导体形成,每个导体包括缠绕在中心股线周围的超导股线,例如四股或六股,中心股线本身可以是超导或非超导的。每个超导线圈312、313用于传导能产生磁场(b)的电流。磁轭314、315或更小的磁极片在粒子被加速的空腔316中形成磁场。在一个例子中,低温恒温器(未示出)使用液氦(he)将每个线圈传导冷却到超导温
return system”的美国专利第8,791,656号中描述了可使用的有源返回系统的一个例子,该专利的内容通过引用合并于本文。
94.在粒子加速器的提取通道的输出部处或附近,可以有一个或多个包括扫描系统的束成形元件。扫描系统的部件可以安装或以其他方式附接到管口上,用于在治疗期间相对靠近患者定位。
95.参考图4,在示例性实施方式中,在同步回旋加速器421(其可以具有图3的配置)的提取通道420的输出部处是示例性扫描部件422,其可以用于将粒子束三维地移动经过辐射标靶。图5还示出了图4的部件的示例。这些包括但不限于一个或多个扫描磁体424、离子室425、射程调节器(energy degrader)426和准直器428。图4或5中未示出可以在提取通道的粒子束下游的其他部件,并且可以包括例如用于改变束斑尺寸的一个或多个散射设备。示例散射设备包括板或范围调制器,当粒子束通过散射设备时,该板或范围调制器分散粒子束。
96.在示例性操作中,扫描磁体424在两个维度(例如,笛卡尔xy维度)上是可控的,以在该两个维度上定位粒子束,并且移动粒子束穿过辐射标靶的至少一部分。离子室425检测粒子束的剂量,并将该信息反馈给控制系统以调整粒子束移动。射程调节器426是可控的,以将结构移入和移出粒子束的路径,从而改变粒子束的能量,并因此改变粒子束的剂量在辐射标靶中所沉积的深度。这种结构的例子包括但不限于:能量吸收板;多面体,例如楔形体、四面体或曲面多面体;和弯曲的三维形状,例如圆柱体、球体或圆锥体。以这种方式,射程调节器可以使粒子束在辐射标靶的内部沉积一定剂量的辐射,以治疗标靶的柱体。在这方面,当质子穿过组织时,质子电离组织的原子,并沿其路径沉积一剂量。布拉格峰是布拉格曲线上的一个明显的峰,该曲线描绘了电离辐射在穿过组织期间的能量损失。布拉格峰代表大多数质子在组织内沉积的深度。对于质子来说,布拉格峰就在粒子静止之前出现。因此,粒子束的能量可以改变,以改变其布拉格峰的位置,因此,大部分剂量的质子将沉积在组织的深处。
97.图6和7示出了示例扫描磁体424的视图。在该示例中,扫描磁体424包括两个线圈441和两个线圈442,其控制粒子束在x维度上的移动,线圈442控制粒子束在y维度上的移动。在一些实施方式中,通过改变通过一组或两组线圈的电流从而改变由此产生的磁场来实现控制。通过适当改变磁场,粒子束可以在辐射标靶上沿x和/或y方向移动。前面描述的射程调节器可以在z维度上移动粒子束穿过标靶,从而实现三维扫描。
98.返回参考图4,电流传感器427可以连接到扫描磁体424,或者以其他方式与扫描磁体424相关联。例如,电流传感器可以与扫描磁体通信,但不连接到扫描磁体。在一些实施方式中,电流传感器对施加到磁体424的电流进行采样,该电流可以包括去往用于控制x维度上的粒子束扫描的线圈的电流和/或去往用于控制y维度上的粒子束扫描的线圈的电流。电流传感器可以在对应于粒子束中出现脉冲的时间或者以超过粒子束中出现脉冲的剂量率的剂量率来对通过磁体的电流进行采样。识别磁体电流的样本与下述离子室对脉冲的检测相关。例如,使用离子室检测脉冲的时间可以在时间上与来自电流传感器的样本相关联,从而识别脉冲时磁线圈中的电流。因此,使用磁体电流,可以确定辐射标靶内被输送了每个脉冲以及辐射剂量(即粒子剂量)的位置。也可以基于射程调节器的配置,例如基于粒子束路径中的板的数量,来确定在标靶内输送的剂量的位置。
99.在操作过程中,可以针对剂量被输送的每个位置存储磁体电流的幅值以及剂量的量(例如强度)。控制系统(其可以在加速器上或者远离加速器,并且可以包括存储器和一个或多个处理设备)可以将磁体电流与辐射标靶内的坐标相关联,并且这些坐标可以与剂量的量一起存储。例如,可以通过深度方向的层数和笛卡尔xy坐标或笛卡尔xyz坐标来识别位置,其中深度方向的层对应于z坐标。在一些实施方式中,磁体电流的大小和坐标位置可以与每个位置处的剂量一起存储。该信息可以存储在加速器上的存储器中或在远离加速器的存储器中。该信息可用于跟踪标靶的治疗并保留该治疗的记录。
100.离子室425通过检测由入射辐射引起的在气体中产生的离子对的数量来检测由粒子束施加到辐射标靶内的位置的剂量,例如一个或多个单独的剂量。离子对的数量对应于粒子束提供的剂量。该信息被反馈到控制系统,并与提供剂量的时间一起存储在存储器中。如上所述,该信息可以与被提供剂量的位置和/或当时的磁体电流的大小相关联并与之相关联地存储。
101.准直器428可以定位在扫描磁体的粒子束下游和在射程调节器的粒子束下游,如图4和5所示。准直器可以在粒子束从一条路径移动到另一条路径而穿过标靶的过程中逐个束斑地修整粒子束。当粒子束在标靶上静止时,以及当静止粒子束的能量改变以影响标靶内部的不同部分时,准直器也可以修整粒子束。例如,当粒子束进入标靶内部时,粒子束可以沿其直径扩散。准直器可以被配置(例如,被构造)为修整粒子束以解决该扩散。例如,准直器可以被配置成减少到达和穿过标靶的粒子束色散,从而保持更恒定的束斑尺寸。
102.如下所述,在一些示例中,准直器可以包括一个或多个开口,粒子束可以通过这些开口被导向。例如,准直器可以包括以一维阵列或多维阵列排列的多个孔,例如圆孔。在一些示例中,孔的尺寸和形状是不可改变或不可配置的。粒子束可以以特定的顺序移动到孔中,以治疗患者体内的标靶部分。每个孔可以修整和准直粒子束。这些孔可以定位成彼此足够靠近,以限制粒子束的各个束斑重叠的量。这样做是为了限制标靶上方和下方的健康组织受到单剂量的超高剂量率辐射。在一些实施方式中,可以穿过例如抑制或阻挡辐射的衬底这样的载体形成孔。载体本身可以基于例如粒子束的移动而在束场内移动。例如,具有孔的线性阵列的载体可以被配置成跟踪粒子束穿过束场的运动。然而,因为孔本身不需要被配置,所以载体移动所需的时间量不妨碍以超高剂量率输送辐射。
103.在一些实施方式中,准直器可以包括穿过载体的一个或多个槽,而不是孔,或者除了孔之外包括一个或多个槽。例如,准直器可以包括单个线性槽,该槽具有足以修整粒子束的横向尺寸、和延伸跨过辐射标靶的至少一部分并且可以容纳多个束斑的纵向维度。在一些实施方式中,准直器可以包括排列成阵列的多个线性槽。在一些示例中,槽的尺寸和形状是不可改变或不可配置的。粒子束可以移动到每个槽的部分,这在横向维度(以及在槽端束斑的纵向维度)执行准直。在一些实施方式中,可以穿过例如抑制或阻挡辐射的衬底这样的载体形成槽。载体本身可以基于例如粒子束的移动而在束场内移动。例如,具有单个槽的载体可以被配置成跟踪粒子束穿过束场的运动。然而,因为槽本身不需要被配置,所以载体移动所需的时间量不妨碍以超高剂量率输送辐射。
104.图8示出了示例性范围调制器460,其是射程调节器426的示例性实施方式。在一些实施方式中,范围调制器460可以位于准直器和患者之间的扫描磁体的粒子束下游。在一些实施方式中,如图8所示,范围调制器包括一系列板461。这些板可以由一种或多种以下示例
材料制成:聚碳酸酯(如lexan
tm
)、碳、铍、碳化硼、由碳化硼和石墨组成的复合材料或低原子序数材料。然而,可以使用其他材料来代替或补充这些示例材料。在射程调节器的其他实施方式中,包括多面体,例如楔形体、四面体或曲面多面体,或弯曲的三维结构,例如圆柱体形、球形或圆锥形,这些结构可以由一种或多种以下示例材料制成:聚碳酸酯,例如lexan
tm
、碳、铍、碳化硼,由碳化硼和石墨组成的复合材料,或低原子序数的材料。
105.在一些实施方式中,包含碳化硼的范围调制器的结构可以仅包括碳化硼;也就是说,这些结构可以是纯碳化硼。在一些实施方式中,包含碳化硼的结构可以包括与另一种材料结合的碳化硼,例如石墨、聚碳酸酯、碳或铍。在一些实施方式中,射程调节器中的每个结构(例如,板、多面体或弯曲的三维结构)可以包含全部或部分碳化硼。在一些实施方式中,射程调节器中的不同结构(例如,板、多面体或弯曲的三维结构)可以包括不同的材料。例如,射程调节器中的一个或多个板可以由纯碳化硼制成,同一射程调节器的一个或多个其他板可以由聚碳酸酯、碳和/或铍中的一种或多种制成或包括它们。也可以使用其他材料。例如,射程调节器中的一个或多个板或其部分可以由包含碳化硼和石墨的复合材料制成。
106.一个或多个板可移入或移出粒子束路径,从而改变粒子束的能量,从而改变粒子束的大部分剂量在辐射标靶内所沉积的深度。板被物理地移入和移出粒子束的路径。例如,如图9所示,板470沿着箭头472的方向在粒子束473路径中的位置和粒子束路径外部的位置之间移动。这些板是计算机控制的。通常,移动到粒子束路径中的板的数量对应于辐射标靶的扫描所发生的深度。因此,通过适当控制一个或多个板,粒子束的剂量可以被引导到标靶的内部。
107.在一些实施方式中,范围调制器460的各个板每个都连接到相应的马达464并由其驱动。一般来说,马达包括将某种形式的能量转化为运动的装置。马达可以是旋转的或线性的,并且可以是电动的、液压的或气动的。例如,每个马达可以是驱动导螺杆的马达,以将板延伸到束场中或将板从束场中缩回,包括使板的运动跟踪或尾随束场中粒子束的运动。例如,每个马达可以是旋转马达,其驱动相应的线性促动器以控制相应结构的运动。在一些实施方式中,范围调制器460的各个板各自联接到相应的促动器并由其驱动。在一些示例中,促动器包括提供受控运动的机械或机电装置,并且可以通过马达、液压、气动、机械或热来电动操作。在一些示例中,促动器包括由能量源(例如电流、液压流体压力或气动压力)操作并将该能量转换成运动的任何类型的马达。
108.在一些实施方式中,包含碳化硼结构(或由其他材料组成的结构)的射程调节器可以位于将粒子束施加到患者的治疗室中。例如,射程调节器可以位于扫描磁体和患者之间。在一示例中,射程调节器可以位于系统的内部台架(gantry)上的管口中,其示例参照图26、27和28进行描述。
109.射程调节器可以位于靠近患者的位置,以限制粒子束在通过一个或多个板或其他结构后被散射或分散的量。在一些实施方式中,射程调节器可以定位为沿着粒子束的束线距离患者不超过4米。在一些实施方式中,射程调节器可以定位为沿着粒子束的束线距离患者不超过3米。在一些实施方式中,射程调节器可以定位为沿着粒子束的束线距离患者不超过2米。在一些实施方式中,射程调节器可以定位为沿着粒子束的束线距离患者不超过1米。在一些实施方式中,射程调节器可以定位为沿着粒子束的束线距离患者不超过半米。在一些实施方式中,射程调节器可以位于定位为在沿着粒子束的束线距离患者不超过4米的管
口内。在一些实施方式中,射程调节器可以定位为在沿着粒子束的束线距离患者不超过3米的管口内。在一些实施方式中,射程调节器可以定位为在沿着粒子束的束线距离患者不超过2米的管口内。在一些实施方式中,射程调节器可以定位为在沿着粒子束的束线距离患者不超过1米的管口内。在一些实施方式中,射程调节器可以定位为在沿着粒子束的束线距离患者不超过半米的管口内。
110.一般来说,碳化硼可能比其他一些可以用来降低粒子束能量的材料更便宜、更安全,比如铍。一般来说,碳化硼具有相对低的原子量和高的密度,并且在散射特性上可以与一些其他可以用来降低粒子束能量的材料,例如碳(例如石墨)和聚碳酸酯,相比较。减小粒子束散射导致束斑尺寸,即粒子束的横截面尺寸减小。减小的束斑尺寸在笔形粒子束扫描系统中提供了改进的保形性和更高的局部剂量率。换句话说,减小束斑尺寸会减小剂量所沉积的面积。结果,单个束斑内沉积的质子浓度增加,从而增加了单个束斑区域内的剂量率。当使用超高(或“flash”)剂量率执行扫描时,增加单个束斑区域内的剂量率是合乎需要的,因为这有助于在规定的时间内沉积超高剂量的质子。本文描述了施用超高剂量期间的示例。
111.针对射程调节器中使用的能改变粒子束能量的不同材料,图29示出了用于不同粒子束能量的束斑尺寸变化的曲线图。在本例中,显示了lexan
tm
、碳(如石墨)、碳化硼和铍。根据图29的曲线图,例如,碳化硼射程调节器结构在70mev(百万电子伏)的能量下产生束斑尺寸小于1.2厘米(cm)西格玛的粒子束。在本例中,在射程调节器结构的输出端测量束斑尺寸。粒子束在空气中传播得越远,束斑越会散射,这将导致束斑尺寸增大。然而,将射程调节器放置在离患者足够近的地方会限制散射。此外,在一些但不是所有的情况下,准直器可以放置在射程调节器和患者之间,以准直粒子束,从而限制由散射引起的影响。
112.除了上述优点之外,基于碳化硼的射程调节器的尺寸可以相对于例如使用聚碳酸酯的射程调节器被减小。也就是说,基于碳化硼的射程调节器可以实现与基于聚碳酸酯的射程调节器基本相同的效果,但是基于碳化硼的射程调节器可以具有比基于聚碳酸酯的射程调节器更小的形状因子。这是因为碳化硼的密度大于聚碳酸酯的密度。在一些示例中,由纯碳化硼板组成的射程调节器沿着束线可以是30厘米(cm)到40cm厚。这些板可以具有相同或不同的厚度。板的厚度和射程调节器本身的厚度将取决于各种因素,例如所需能量变化的总量和待治疗的层数,这可决定每个板的数量和厚度。
113.由碳化硼组成的射程调节器的尺寸减小使得射程调节器在治疗室中不太显眼。例如,由全部或一些碳化硼结构组成的射程调节器可以容纳在内部台架上的管口内。包括射程调节器的管口可以完全缩回到内部台架内,从而将射程调节器从实施治疗的技术人员的视线中移开。在一些实施方式中,内台架可以与治疗室的墙壁齐平,在这种情况下,将管口和射程调节器完全缩回到内台架内会导致管口和射程调节器完全缩回到墙壁内。
114.图10示出了范围调制器的示例性实施方式,例如基于碳化硼的范围调制器,其使用线性马达来控制能量吸收板101、102和103的操作。否则,图10的范围调制器可以具有图8的范围调制器的配置。尽管在图10的示例中仅示出了三个板,但是可以包括任何适当数量的板,如椭圆106所示。
115.以板102为例,控制板102操作的示例性线性马达包括由两部分组成的可动部件和固定部件——在该示例中是磁体110a和110b。两块磁铁并排排列,磁极对准。也就是说,如
图所示,磁体110a的正极(+)与磁体110b的正极(+)对准,并且磁体110a的负极(
‑
)与磁体110b的负极(
‑
)对准。可动部件包括磁体110a和110b之间的线圈承载板109。线圈承载板109物理连接到能量吸收板102,并控制能量吸收板102沿着箭头111的方向移动,例如进入和离开粒子束的路径。
116.如所解释的,线圈承载板109包括一个或多个导电迹线或其他导电结构,其传递电流以产生磁场。通过控制流经线圈承载板的电流来控制磁场,以便控制线圈承载板的运动,从而控制能量吸收板102的运动。也就是说,通过线圈的电流产生磁场,该磁场与磁体110a和110b产生的磁场相互作用。这种相互作用导致线圈承载板109和能量吸收板102沿着箭头111的方向运动,进入或离开粒子束路径。例如,由线圈承载板109产生的较大磁场可导致能量吸收板移动到粒子束路径中,而由线圈承载板产生的较小或相反的磁场可导致能量吸收板从粒子束路径缩回。
117.在一些实施方式中,线圈承载板上的导电迹线或其他导电结构可以包括嵌入铝中的三个绕组。在一些实施方式中,能量吸收板可以物理地附接到线圈承载板,并与线圈承载板一起移动。在一些实施方式中,绕组的数量和使用的材料可以不同于本文描述的那些。在一些实施方式中,线圈承载板可以是能量吸收板的整体部分。例如,能量吸收板本身可以包括导电结构或迹线。
118.如图10所示,在一些实施方式中,通过线圈承载板的电流可以由从诸如计算系统114的控制系统接收的信号控制。计算系统可能易受中子辐射影响,因此可位于远程室116中。在一些实施方式中,远程室116可以被屏蔽粒子加速器产生的中子辐射。在一些实施方式中,远程室可以位于离治疗室117足够远的地方,以便不受来自粒子加速器的中子辐射的影响。在一些实施方式中,计算系统可以位于治疗室中,但是可以被屏蔽而免受粒子加速器发射的中子辐射。在一些实施方式中,所有计算功能都屏蔽了中子辐射,并且未被屏蔽的电子设备仍然可以在存在中子辐射的情况下工作。编码器就是这种电子设备的例子。
119.在这方面,编码器(未示出)可以包括激光传感器、光学传感器或二极管传感器中的一个或多个。编码器检测线圈承载板的运动,例如通过检测线圈承载板上或与线圈承载板连接并一起运动的结构上的标记或其它标识相对于编码器的位置。关于线圈承载板在哪里的信息被反馈到计算系统,并且被计算系统用来在操作期间确认线圈承载板的位置。编码器可以位于任何合适的位置。在一些实施方式中,编码器位于包括线圈承载板的外壳上。随着板的移动,与线圈承载板一起移动的标记或其他标识移动经过编码器。编码器然后将该信息转发给计算系统114。计算系统114可以使用该信息来控制范围调制器的操作,包括定位其能量吸收板。
120.可以由一个或多个处理设备组成的计算系统114可以被编程以控制质子治疗系统,包括扫描系统的部件,以在辐射标靶中一个柱体接一个柱体地实施超高剂量率辐射治疗。例如,计算系统可以是可控的,以输出一个或多个控制信号来控制一个或多个线性马达在扫描期间伸出或缩回一个或多个能量吸收板。例如,计算系统可以是可控的,以输出一个或多个控制信号来控制一个或多个电动机在扫描期间伸出或缩回一个或多个能量吸收板。计算系统可以包括一个或多个处理设备,例如微处理器、微控制器、现场可编程门阵列(fpga)或专用电路(asic)。
121.参考图11,控制系统可以被配置(例如编程)以实施针对标靶(例如肿瘤)的治疗计
划。治疗计划可以指定参数,包括要使用的粒子束的剂量率,例如超高剂量率、将剂量输送到标靶的位置以及要被治疗的标靶的柱体的顺序。最初,控制系统可以控制粒子加速器——在这个例子中是同步回旋加速器310——以产生(1101)具有特定参数的粒子束,包括粒子束电流和强度。在一些实施方式中,粒子束的粒子束电流是100纳安或更小的电流。在一些实施方式中,粒子束的粒子束电流为50na的电流或更小。毫微安量级的束流水平可以降低对患者的伤害风险,可以降低对加速器或治疗室内其他电子设备的损害风险,或者可以降低这种伤害和损害二者的风险。
122.还可以控制(1102)或调制粒子束的强度,以控制或改变在不同粒子束能量下施加到标靶的剂量。因此,强度调制质子治疗(impt)可以使用本文描述的技术来实施。在一些实施方式中,可以使用来自多个不同角度的具有不同或相同强度的粒子束以flash剂量率或低于flash剂量率的剂量率来治疗相同的辐射标靶。例如,可以通过以不同角度输送辐射通过柱体,以flash或非flash剂量率治疗辐射标靶。在这样的例子中,因为辐射是以不同的角度传递的,所以没有被治疗的健康组织可以只受到一次辐射。
123.粒子束强度至少部分基于粒子束中粒子的数量。例如,束强度可以由粒子束中的粒子数量来定义。粒子束的强度可以在粒子束的不同束斑之间变化。此外,粒子束的一个束斑的强度可以独立于粒子束的一个或多个其他束斑的强度,包括水平紧邻的束斑或垂直紧邻的束斑。因此,在一些示例中,三维空间中的任何束斑可以被处理到任意剂量,而与一个或多个相邻束斑的剂量无关。控制系统可以使用一种或多种技术来控制粒子束强度。
124.在示例技术中,粒子束的强度可以通过改变从等离子体柱获得的粒子脉冲的持续时间来控制。更详细地,rf电压从起始(例如,最大)频率(例如,135兆赫(mhz))扫描直到结束(例如,最小)频率(例如,90mhz)。在rf扫描期间,粒子源被激活一段时间,以产生等离子体柱。例如,在一些实施方式中,粒子源以132mhz激活一段时间。在此期间,粒子被rf电压产生的电场从等离子体柱中提取出来。随着rf电压频率的下降,粒子在膨胀的轨道上向外加速,与不断减小的磁场和不断增加的相对论质量保持同步,直到粒子在一定时间(例如,大约600微秒)后被扫出。改变粒子源被激活的持续时间会改变在频率扫描期间从等离子体柱中提取的粒子脉冲的宽度。增加脉冲宽度会增加提取的粒子数量,从而增加粒子束的强度。相反,减小脉冲宽度会导致提取的粒子数量减少,从而导致粒子束强度降低。
125.在另一示例技术中,粒子束的强度可以通过改变施加到粒子源中阴极的电压来控制。在这点上,通过向粒子源的两个阴极施加电压并在阴极附近输出诸如氢气(h2)的气体来产生等离子体柱。施加到阴极的电压使氢离子化,背景磁场使离子化的氢准直,从而产生等离子体柱。增加阴极电压导致等离子体柱中的离子量增加,而降低阴极电压导致等离子体柱中的离子量减少。当等离子体柱中存在更多离子时,在rf电压扫描期间可以提取更多离子,从而增加粒子束的强度。当等离子体柱中存在更少的离子时,在rf电压扫描期间可以提取更少的离子,从而降低粒子束的强度。
126.在另一示例技术中,粒子束的强度可以通过改变供给粒子源的氢气量来控制。例如,增加供应给粒子源的氢气量导致响应于阴极电压而在等离子体柱中造成更多电离机会。相反,减少供给粒子源的氢气量导致响应于阴极电压而在等离子体柱中造成减少的电离机会。如上所述,当等离子体柱中存在更多粒子时,在rf电压扫描期间提取更多粒子,从而增加粒子束的强度。当等离子体柱中存在更少的粒子时,在rf电压扫描期间提取的粒子
更少,从而降低粒子束的强度。
127.在另一示例技术中,粒子束的强度可以通过改变用于从等离子体柱提取粒子的rf电压的幅值来控制。例如,增加rf电压的幅值会导致从等离子体柱中提取更多的粒子。相反,降低rf电压的幅值会导致从等离子体柱中提取更少的粒子。当提取更多粒子时,粒子束比提取更少粒子时具有更大的强度。
128.在另一示例技术中,粒子束的强度可以通过在粒子源被激活的频率扫描期间以及因此在粒子被提取期间改变开始时间来控制。更具体地说,在频率扫描期间有一个有限的窗口,在此期间可以从等离子体柱中提取粒子。在示例性实施方式中,频率以基本恒定的剂量率从大约135mhz扫描到大约90mhz。在该示例中,可以在开始和结束频率之间的向下斜率的大约开始处提取粒子,例如,分别在132mhz和131mhz之间,并且粒子源可以被激活一段时间,例如,大约0.1微秒(μs)到100μs(例如,1μs到10μs或者1μs到40μs)。改变激活粒子源的频率会影响从粒子束中提取的粒子数量,从而影响粒子束的强度。
129.在另一示例技术中,脉冲消隐(pulse blanking)可以用于控制粒子束的强度。在这点上,rf频率扫描每秒重复多次(例如,500次/秒)。粒子源可以在每次频率扫描时被激活(例如,每2ms)。脉冲消隐通过在每次频率扫描期间不激活粒子源来减少从粒子束中提取的粒子数量。为了获得最大的粒子束强度,粒子源可以在每次频率扫描时被激活。为了降低粒子束强度,粒子源可以不太频繁地被激活,例如每二分之一、三分之一、百分之一扫描等。
130.在另一示例技术中,粒子束的强度可以通过向用于向粒子加速器腔施加rf电压的一个或多个d形板施加dc偏置电压来控制。在这一点上,粒子加速器包括一个主动d形板,它是一个中空的金属结构,具有两个半圆形表面,这两个半圆形表面围成一个空间,质子在围绕由磁轭围成的空腔旋转的过程中在该空间中被加速。有源d形板由施加在rf输送线末端的rf信号驱动,以将电场施加到空间中。随着加速粒子束离几何中心的距离增加,rf场随时间变化。伪d形板可以包括矩形金属壁,该矩形金属壁具有间隔开地靠近有源d形板的暴露边缘的槽。在一些实施方式中,伪d形板连接到真空室和磁轭处的参考电压。
131.在强磁场存在的情况下施加rf电压会导致multi
‑
pactoring现象,这可能会降低rf场的幅值,并且在某些情况下会导致电气短路。为了减少multi
‑
pactoring的量,从而保持rf场,可以将dc(直流)偏置电压施加到有源d形板,并且在一些实施方式中,还可以施加到伪d形板。在一些实施方式中,可以控制有源d形板和伪d形板之间的差分dc偏置电压,以减少multi
‑
pactoring,从而增加粒子束强度。例如,在一些实施方式中,有源d形板和伪d形板上的dc偏置电压之间可能存在50%的差异。在示例性实施方式中,有
‑
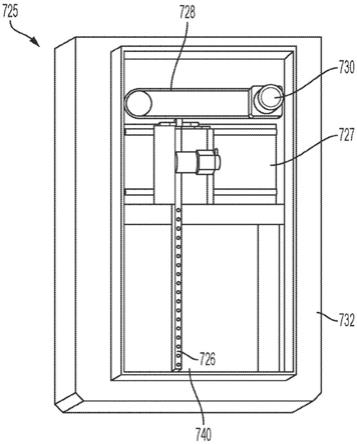
1.9千伏dc偏置电压施加到虚拟d形板,有
‑
1.5千伏dc偏置电压施加到有源d形板。
132.在另一示例技术中,粒子束的强度可以通过控制rf电压扫描的比率来控制,例如,下降的斜率。通过降低斜率,可以增加从等离子体柱中提取粒子的时间。结果,可以提取更多的粒子,从而增加粒子束的强度。反之亦然,例如,通过增加斜率,可以减少从等离子体柱中提取粒子的时间量,这可以导致粒子束强度的降低。
133.前述用于控制粒子束强度的技术的实施方式在美国专利第9,723,705号中描述,该专利的标题“controlling intensity of a particle beam”,其内容通过引用合并于此。
134.控制系统还可以控制(1103)粒子束的束斑尺寸。如上所述,一个或多个散射装置
可以移动到粒子束的路径中,以改变其束斑尺寸。在一些实施方式中,同步回旋加速器的原生束斑尺寸是系统产生的最小束斑尺寸。因为粒子束强度也是束斑尺寸的函数,所以该束斑尺寸也产生最大的粒子束强度。在一些实施方式中,系统可产生的束斑尺寸小于2毫米(mm)西格玛。在一些实施方式中,系统可产生的束斑尺寸至少为2mm。在一些实施方式中,系统可产生的束斑尺寸在2mm西格玛和20mm西格玛之间。在一些实施方式中,系统可产生的束斑尺寸大于20mm西格玛。在一些实施方式中,可以省略操作1103。
135.控制系统控制(1104)扫描磁体,以根据治疗计划将粒子束移动到通过标靶21的路径24,例如如图2所示。控制扫描磁体可以包括:控制通过扫描磁体线圈的电流(图6和7),该扫描磁体线圈控制粒子束在笛卡尔x维度上的运动;控制通过扫描磁体线圈的电流,该扫描磁体线圈控制粒子束在笛卡尔y维度上的运动,或者两者都控制。在该位置,系统将超高剂量率的辐射输送到沿着穿过标靶的粒子束路径延伸的柱体。在这个例子中,该柱体包括沿着粒子束的方向29定位的标靶的内部部分(图2)。柱体25是三维的,因为它从束斑的中心径向延伸到束斑的周边,并且柱体向下延伸穿过标靶。在一些实施方式中,该柱体延伸穿过整个标靶,如图2所示。在某些实施方式中,该柱体只在标靶中延伸了一部分。在一些实施方式中,该柱体完全在标靶的内部。在一些实施方式中,该柱体从标靶的一个表面开始,并延伸到标靶的内部,但是没有到达标靶的另一个表面。在一些实施方式中,相邻柱体的部分重叠。
136.使用超高剂量率的辐射治疗(1105)该柱体。本文描述了超高剂量率辐射的例子,包括但不限于小于5s持续时间的每秒1格雷或更高。当粒子束静止时,控制系统控制粒子束的能量,使得粒子束治疗标靶中的柱体。治疗标靶中的柱体包括改变粒子束的能量,使得对于能量的每次改变,粒子束中的大部分剂量的质子(其布拉格峰)沉积在标靶内的不同深度。如本文所述,可以通过将由碳化硼或其他粒子降能材料制成的结构移入或移出粒子束的路径来改变粒子束的能量,如针对图12至19和35至44的示例所述的。可以重复图11的所有或一些操作来治疗辐射标靶上的不同柱体。例如,操作1102、1103、1104和1105可以重复用于辐射标靶上的待治疗的每一柱体。
137.在下面描述的使用可变能量同步回旋加速器(或其他类型的可变能量粒子加速器)的实施方式中,可以通过改变经过同步回旋加速器主线圈的电流来改变粒子束的能量。在一些实施方式中,通过将诸如范围调制器460的能量吸收板这样的结构移入和移出粒子束的路径来改变粒子束的能量。在这点上,由于治疗计划规定了标靶上的柱体的位置,所以范围调制器的能量吸收板可以被预先定位在这些位置附近,以便减少这些板移动到位置中和离开位置所花费的时间。参考图12,例如,板500可以由例如纯碳化硼或碳化硼
‑
石墨复合材料制成,在开始用辐射来治疗柱体501之前,板500可以靠近标靶503中的柱体501定位。板可以从该位置移动到粒子束中,从而减少板需要行进的距离。也就是说,板500可以被配置成完全缩回到范围调制器中。在治疗之前,板可以部分或完全延伸,因此,不需要从其完全缩回的位置行进以到达粒子束的路径。
138.如上所述,可以控制一个或多个板移入和移出粒子束的路径,以改变粒子束的能量。在一示例中,一个或多个板中的每一个都可以在100ms或更短的持续时间内移入或移出粒子束的路径。在一示例中,一个或多个板中的每一个都可以在50ms或更短的持续时间内移入或移出粒子束的路径。在一示例中,一个或多个板中的每一个都可以在10ms或更短的
持续时间内移入或移出粒子束的路径。在一示例中,一个或多个板中的每一个都可以在20ms或更短的持续时间内或者在10ms或更短的持续时间内移动进入或离开粒子束的路径。如前所述,使用线性马达可以促进板的快速移动,尽管也可以使用电动马达。在这个例子中,快速移动包括几十毫秒量级的移动。
139.一个或多个板可以根据治疗计划中定义的顺序移入和移出粒子束的路径。例如,参考图12、13、14和15,粒子束504由扫描系统定位,以超高剂量率治疗标靶503的柱体501。在这个例子中,为了治疗柱体501的逐渐变浅的部分,最初在粒子束路径中没有板的情况下进行治疗。这显示在图12中。因此,柱体501的最深部分502被治疗。在图13中,板500a沿着箭头505的方向进入粒子束504的路径,以降低粒子束的能量。在这种板配置中,治疗柱体501的第二最深部分506。在图14中,板500b也沿着箭头505的方向进入粒子束504的路径,以进一步降低粒子束的能量。在这种板配置中,治疗柱体501的第三最深部分508。在图15中,板500c也沿着箭头505的方向进入粒子束504的路径,以进一步降低粒子束的能量。在这种板配置中,治疗柱体501的最浅部分510。通过在粒子束504静止时改变粒子束504的能量,整个柱体501可以被输送超高剂量率辐射。本文提供了超高剂量率的例子。
140.粒子束可以由扫描磁体引导到穿过标靶的新路径,以治疗标靶503的不同柱体。不同的柱体可以紧邻柱体501,也可以不紧邻柱体501。在一些实施方式中,粒子束的束斑可以部分重叠或不重叠。例如,参考图16、17、18和19,粒子束604由扫描系统定位,以超高剂量率治疗标靶503的柱体601。在这个例子中,为了治疗柱体601的逐渐变深的部分,首先通过粒子束路径中的所有板500a、500b和500c进行治疗。这显示在图16中。因此,首先治疗柱体601的最浅部分602。在图17中,板500c沿着箭头605的方向移出粒子束604的路径,以增加粒子束的能量。在这种板配置中,治疗柱体601的第二最浅部分602。在图18中,板500b也沿着箭头605的方向移出粒子束604的路径,以进一步增加粒子束的能量。在这种板配置中,治疗柱体601的第三最浅部分608。在图19中,板500c也沿着箭头605的方向移出粒子束604的路径,以进一步增加粒子束的能量。在这种板配置中,治疗柱体601的最深部分610。通过在粒子束604静止时改变粒子束604的能量,整个柱体601可以被输送超高剂量率辐射。
141.在一些实施方式中,为了治疗柱体,板不需要按顺序。例如,板500a可以首先移动到粒子束的路径中,然后是板500c,接着是板500b。
142.在向柱体501或601输送超高剂量率辐射期间,粒子束504或604的强度可以根据需要改变,以便输送治疗计划中规定的超高剂量率辐射。值得注意的是,在将超高剂量率辐射输送到每个柱体期间,粒子束是静止的。例如,当超高剂量率辐射被输送到柱体内的不同深度时,粒子束的路径不会相对于标靶改变,并且粒子束不会移动。在超高剂量率辐射被输送到柱体之后,粒子束被引导到穿过标靶的新路径上。然后,以与参照图11所述相同的方式,在新路径上施加超高剂量率的辐射。重复该过程,直到使用超高剂量率辐射治疗所有标靶,或者直到使用超高剂量率辐射治疗了标靶的指定部分。在一些实施方式中,如图所示,柱体可以是平行的,有一些重叠或者没有重叠。在一些实施方式中,至少一些柱体可以不平行,导致重叠。在一些实施方式中,可以从不同的角度将多组柱体应用于相同的标靶或微体积,从而用辐射治疗标靶多次,同时防止健康组织不止一次地受到辐射的影响。
143.在一些实施方式中,粒子束不再沿着已经使用超高剂量率辐射治疗过的路径被引导。例如,粒子束从一条路径穿过标靶503步进到另一条路径。在这个例子中,沿着路径延伸
到标靶中的每个柱体仅使用超高剂量率辐射治疗一次。不会再次访问和治疗柱体。通过使用超高剂量率辐射仅治疗一次柱体,标靶上方的健康组织以及在某些情况下下方的健康组织更不容易受到辐射的损伤。然而,值得注意的是,本文描述的示例系统不限于仅使用超高剂量率辐射治疗每个柱体一次。例如,在一些实施方式中,每个柱体可以被重新访问任何适当的次数,并且经受一个或多个额外剂量的超高剂量率辐射。此外,本文描述的示例系统不限于仅使用超高剂量率辐射来治疗每个柱体。例如,可以使用小于被认为是超高剂量率的辐射剂量率来如本文所述地治疗标靶的柱体。例如,可以如本文所述,在一分钟或多分钟的持续时间内,使用诸如每秒0.1格雷的辐射剂量率来治疗标靶的柱体。在一些实施方式中,诸如图2所示的按柱体逐一治疗可以与诸如图1所示的逐层治疗相结合。例如,标靶可以按柱体逐一治疗,然后逐层治疗,或者逐层治疗,然后按柱体逐一治疗。在一些实施方式中,标靶的一部分可以被按柱体逐一治疗,并且标靶的一部分可以在每种情况下用超高剂量率辐射或更少的辐射被逐层治疗。
144.在一些实施方式中,为了减少治疗时间,对于标靶上的不同柱体,范围调制器的能量吸收板可以不同地排序。例如,对于柱体501,如参照图12至15所解释的,板可以顺序地移动到粒子束中。然后,可以引导粒子束来治疗标靶的相邻或其他柱体601。如果板已经覆盖了粒子束的路径,它们可以顺序地移出粒子束的路径,如针对图16至19所述的。如果板还没有覆盖粒子束的路径,板可以一起移动以覆盖粒子束的路径,然后顺序地移出粒子束的路径。因此,对于第一柱体,板可以顺序移动以治疗第一柱体的逐渐变浅的部分,例如层。对于与第一柱体相邻的第二柱体,可以顺序移动板,以连续治疗第二柱体的更深部分,例如层。对于粒子束的相邻路径,可以在整个标靶中重复该过程。在一些实施方式中,板的移动在束场中可以是增量的;例如,基于束斑尺寸(例如,毫米量级)而不是从它们完全缩回的位置。例如,板可以从粒子束路径移动到相邻的粒子束路径,而不是对于每个柱体完全缩回和伸出。
145.在一些实施方式中,能量吸收板可以在整个或部分束场中移动。在一些示例中,束场是粒子束能够在平行于患者身上的治疗区域的平面上移动的最大范围。当一个或多个板从粒子束移动到相邻粒子束时,一个或多个板可以跟踪粒子束。例如,一个或多个板可以随着粒子束的移动而移动,使得粒子束在板移动时穿过一个或多个板。
146.在一些实施方式中,小于超高(或flash)辐射剂量率的辐射剂量可以使用射程调节器(其具有诸如由碳化硼制成的板、多面体或弯曲三维形状的结构)逐层施加到标靶。例如,参考图1,通过沿着箭头15的方向移动粒子束穿过层,可以使用粒子束12来治疗标靶11的整个层10,粒子束12具有足以将剂量输送到层10的能量。射程调节器然后可以被重新配置,例如,由碳化硼制成的板可以移出束路径以增加粒子束的能量级。然后,可以使用具有足以向层16输送剂量的不同能量的粒子束,以相同的方式治疗标靶11的不同层16,等等。
147.在一些实施方式中,flash剂量的辐射可以沿着单个柱体传递,其中束方向固定在粒子加速器等的中心的单个束斑上。在一些实施方式中,可以使用略大的局部体积(称为微体积)而不是瞄准单个束斑的柱体来输送flash剂量的辐射。微体积可以是体素、是体素的一部分,或者包括治疗计划中指定的多个体素。图35至44示出了使用flash剂量率通过柱体向辐射标靶的微体积输送辐射的例子。本文描述了flash剂量率的例子。在一些实施方式中,通过柱体向图35至图44的微体积输送辐射可以是非flash剂量率或是flash剂量率和非
flash剂量率的组合。
148.图35示出了辐射标靶(例如患者体内的肿瘤)的部分1400的示例。部分1400被分成四个微体积1401、1402、1403和1404。尽管示出了立方形微体积,但是微体积可以具有任何合适的形状,例如三维棱正交的多胞形(orthotope)、规则弯曲形状或无定形形状。在这个例子中,每个微体积通过以本文描述的方式,例如参照图12至19,通过柱体输送辐射来治疗。例如,可以通过使用射程调节器板来改变粒子束能量或者通过控制可变能量同步回旋加速器来改变粒子束能量而用辐射治疗微体积的柱体深度。在已经治疗了单个微体积之后,治疗下一个微体积,以此类推,直到已经治疗了整个辐射标靶。微体积的治疗可以以任何适当的次序或顺序地进行。
149.在图35至46的示例中,仅示出了八个柱体1405。然而,在每微体积中可以治疗任何适当数量的柱体。在一些例子中,10到20个束斑,以及因此柱体可以用于治疗微体积。此外,尽管每个束斑对应于一个辐射柱体,但为了清楚起见,图中仅示出了前方的柱体。此外,尽管本文描述的例子治疗从柱体的最深部分到柱体的最浅部分的微体积,但情况不必如此。例如,可以控制射程调节器板来治疗从柱体的最深部分到柱体的最浅部分的一个微体积,然后治疗从柱体的最浅部分到柱体的最深部分的相邻微体积,等等,如参考图12至19所述。在其他示例中,不同的柱体深度可以不按顺序治疗。
150.在图35中,治疗柱体1405的最深部分1407。柱体的已治疗部分是阴影的,未治疗部分没有阴影,这是本文的惯例。在图36中,治疗柱体1405的下一个最深部分1408。在图37中,治疗柱体1405的下一个最深部分1409。在图38中,治疗柱体1405的下一个最深部分1410。在图39中,治疗柱体1405的最浅部分1411,从而完成微体积1401的治疗。在这点上,尽管为了清楚起见分离了柱体,但是柱体实际上可以至少部分重叠,如针对图12至19的情况,以确保整个微体积用辐射治疗。
151.在微体积1401被治疗之后,下一个微体积1402以类似的方式被治疗。在图40中,治疗柱体1415的最深部分1417。在图41中,治疗柱体1415的下一个最深部分1418。在图42中,治疗柱体1415的下一个最深部分1419。在图43中,治疗柱体1415的下一个最深部分1420。在图44中,治疗柱体1415的最浅部分1421,从而完成微体积1402的治疗。如上所述,尽管为了清楚起见柱体被分开,但柱体实际上可以至少部分重叠,如针对图12至19的情况,以确保整个微体积被辐射治疗。
152.在微体积1402被治疗之后,剩余的微体积可以以类似的方式被治疗。可以以任何顺序或次序并使用任何适当数量和位置的柱体来治疗微体积。此外,如本文所述,可以使用不同的粒子束强度来治疗各个柱体。这些强度可能因柱体而异,或因微体积而异,或因柱体以及因微体积而异。此外,可以从多个不同的角度进行治疗每个微体积,作为强度调制质子治疗(impt)的一部分。
153.在一示例中,图45a和45b的曲线示出了蒙特卡罗(monte carlo)模拟的结果,该模拟能计算输送到治疗体积的辐射剂量以及在该剂量计算中每个体素达到最终剂量所花费的时间。在一个例子中,对同步回旋加速器的一些参数进行性能修改,例如,10ms层切换时间而不是50ms层切换时间,增加粒子束电流,增强脉冲
‑
脉冲稳定性,在每一边为3cm的立方体上输送的束斑可以在治疗体积的每个部分在不到500毫秒内接收其剂量的情况下输送。这些小立方体并不是严格地以每一个能量层都有一个束斑的柱体的形式输送的,而是以每
一层都有几个(例如10到20个)束斑的微体积的形式输送的。此外,准直可用于将一个微体积与另一个隔离,允许在合理的总治疗时间内输送这些体积。例如,可以使用本文描述的准直器或任何其他合适的准直装置,包括标准多叶准直器。
154.在一些实施方式中,每个微体积可以以参照图12至19描述的方式治疗。例如,在移动到同一微体积中的下一个柱体之前,可以治疗微体积中的整个柱体。一旦治疗了微体积中的所有柱体,则治疗进行到下一个微体积。在那里,重复治疗,直到微体积的所有柱体都被治疗。然后治疗进行到下一个微体积,以此类推,直到整个辐射标靶被治疗。这些实施方式不同于图35至图44的实施方式,在图35至图44的实施方式中,对于微体积中的每一柱体,一次治疗该微体积中每一柱体的整个深度或微层。此后,治疗进行到下一深度,以此类推,直到微体积中的所有柱体都被治疗。
155.如本文所述,以超高剂量(flash)率向全部或部分柱体输送辐射可以实施为以任何随机方式沉积辐射剂量。例如,参考图34,辐射标靶中的示例柱体1299可以包括多个深度。每个深度可以包括标靶的微层,该微层具有大约束斑的直径。使用如本文所述的通过柱体输送或辐射,可以以超高剂量(flash)率将辐射输送到深度1301、1302和1303中的每一个。剂量可以通过治疗计划确定的任何方式提供。例如,可以向深度1303施加比深度1301或1302更高剂量的辐射。在另一个例子中,最高剂量可以施加到深度1303,次高剂量可以施加到深度1302,最低剂量可以施加到深度1302。在另一个例子中,最高剂量可以施加到深度1301,次高剂量可以施加到深度1303,最低剂量可以施加到深度1302。因此,可以在不考虑(例如独立于其)通过对多个剂量求和而产生的布拉格峰的形状的情况下施加剂量。换句话说,在一些情况下,剂量可以不被配置成以超高剂量(flash)率或较低剂量率沿着输送到辐射标靶的辐射柱体获得扩展的布拉格峰。
156.在一些实施方式中,可以将一个或多个脊形滤波器或范围调制器轮添加到粒子束的路径中,以扩展(例如,拉长)粒子束的布拉格峰。通过使用均匀的深度
‑
剂量曲线来产生拉长或扩展的布拉格峰。也就是说,基于剂量将被输送到的组织深度来校准剂量,以便获得平坦或基本平坦的细长布拉格峰。参考图34,例如,为了使用通过柱体的辐射输送来实现扩展的布拉格峰,例如1300,可以将全部(100%)剂量施加到辐射标靶的柱1299中的深度1301一段时间。接下来,可以将80%的剂量施加到深度1302一段时间。深度1302比深度1301更位于光束上游(即更浅)。接下来,可以将66%的剂量施加到深度1303一段时间。深度1303比深度1302更位于光束上游(即更浅)。这可以重复进行,直到获得扩展的布拉格峰1300。
157.马达可以控制一个或多个脊形滤波器或范围调制器轮进入或离开粒子束路径的运动。马达可以对控制系统的命令做出响应。扩展粒子束的布拉格峰可用于如图12至19所示的柱体治疗或如图1所示的逐层治疗。在一些实施方式中,当布拉格峰扩展时,可以使用诸如本文所述的技术来增加粒子束的强度。
158.在一些实施方式中,可以自动控制范围调制器轮在束场内的二维或三维移动,以便跟踪粒子束的移动。例如,范围调制器轮可以被自动控制以在笛卡尔的x、y和/或z维度上移动。范围调制器轮可以具有不同的厚度,并且可以旋转以改变粒子束的布拉格峰,从而改变大部分粒子沉积在标靶内的深度。在一些实施方式中,范围调制器轮可以包括限定其各种厚度的阶梯。在一些实施方式中,可以控制粒子束的强度,以便控制在范围调制器轮上的每个位置输送的剂量。这样做是为了控制深度剂量分布。
159.如上所述,扫描系统包括准直器。准直器可以由控制系统控制,以在粒子束到达患者体内的标靶之前修整粒子束。图20示出了准直器700的示例性实施方式,准直器700可以与诸如本文所述的粒子治疗系统一起使用。准直器700包括载体702。在这个例子中,载体是板;然而,载体可以具有任何合适的结构,例如多面体或三维弯曲结构,例如圆柱体体、圆锥体或球体。如前所述,载体可以由金属或其他材料制成,例如镍、黄铜或钨,其厚度足以防止给定能量的辐射通过。例如,载体可以被构造成例如具有一定厚度和成分,以防止能量为100mev、150mev、200mev、250mev或300mev的质子束通过。在该示例中,载体中的开口704包括二维705孔阵列。在这个例子中,孔是圆形的;然而,可以使用任何适当形状的孔。例如,孔可以是椭圆形、正方形、多边形或任何其他合适的形状。可以基于准直器位置处的粒子束的尺寸以及基于要产生的修整和准直的量来确定孔的尺寸。在这方面,在一些实施方式中,系统可产生的束斑尺寸为2mm西格玛到20mm西格玛。孔可以形成为在该范围内产生准直。如前所述,在一些实施方式中,孔的尺寸和/或形状是不可改变或不可配置的。这可以减少输送超高剂量率辐射时重新配置系统所需的时间。在一些实施方式中,孔的尺寸和/或形状被配置成允许预定义量的粒子束扩展后准直。
160.在一些实施方式中,载体可以在整个束场中移动或跨越整个束场移动。如前所述,在一些示例中,束场是粒子束能够在平行于患者身上的治疗区域的平面上移动的最大程度。在图21的示例性准直器720中,载体708可以安装到轨道709上,并通过物理联接711连接到带710上。旋转马达712可以驱动带710,以沿着轨道移动载体,从而将载体定位在束场内。例如,旋转马达712可以响应于来自控制系统114的命令(如虚线715所示),以在治疗之前定位载体,并在治疗期间将载体留在原位。在替代实施方式中,马达可以是旋转马达,其驱动相应的线性促动器以控制载体在至少部分束场中的移动。在一些实施方式中,载体可以在治疗期间移动。例如,载体可以基于粒子束的移动而移动。例如,如果治疗区域超过准直器的尺寸,则可以通过马达712在柱体的治疗之间移动准直器,以定位准直器来治疗标靶的额外部分。在另一个例子中,当粒子束穿过束场时,准直器可以与粒子束的运动一致地运动,即跟踪粒子束的运动。
161.在一些实施方式中,载体可以在束场内的一维、二维或三维方向上移动。例如,如上所述,载体可以安装在轨道上,以在一个维度上移动通过束场。在一些实施方式中,载体可以被自动控制以在束场内二维或三维地移动。在一些实施方式中,载体所连接的轨道(及其相关组件,例如马达和带)本身可以连接到托架(未示出),该载体可控制成在垂直于轨道的维度上移动。例如,托架(carriage)可以由马达控制,该马达响应于来自控制系统的一个或多个命令。因此,控制系统可以指示载体沿着轨道的运动和通过托架的轨道的运动,从而实现载体在束场内的二维运动。
162.在一些实施方式中,可以使用一个或多个编码器来监控或确定载体的运动。在一些示例中,编码器包括连接到载体或与载体一起移动的组件或结构的电子设备。编码器可以包括一个或多个激光传感器、光学传感器或二极管传感器。编码器检测载体的移动,例如通过检测载体上或与载体连接并随载体移动的结构上的标记或其他标识相对于编码器的位置。关于载体位置的信息被反馈给控制系统,并且被控制系统用来确认载体的位置,并且在一些实施方式中,用来改变其位置。编码器可以是或包括对中子辐射不特别敏感的简单电子传感器,因此可以位于治疗室中。
163.如前所述,在一些实施方式中,准直器用于实施治疗计划,以将超高剂量率辐射输送到患者体内的标靶柱体。为此,控制系统可以被配置为控制粒子束向准直器720的第一孔716的移动,以使得粒子束的至少一部分能够通过第一孔到达患者,在粒子束在第一孔处保持静止的同时改变粒子束的能量,并且控制粒子束从第一孔716向第二孔717的移动。在一些实施方式中,束斑(例如,粒子束的横截面积)的中心位于每个孔的中心。如本文所述,粒子束的能量可以通过将能量吸收结构移入或移出粒子束的路径来改变,或者通过改变通过可变能量粒子加速器中使用的超导磁体的电流来改变。粒子束的运动(或“转向”)可以通过改变或不改变经过参照图4至7描述的扫描磁体的电流来控制。控制系统还可以被配置成在粒子束在第二孔717处保持静止的同时改变粒子束的能量,并且控制粒子束从第二孔717到多个额外孔的运动,该运动的顺序可以由治疗计划来限定。在多个额外孔中的每一个处,例如721、722和723等,粒子束被控制成在粒子束的能量变化时保持静止一段时间。结果,在每个孔处,粒子束被修整,并且由于能量变化,粒子束治疗标靶内的三维柱体,如参考图2、12至19和35至44所述。如前所述,诸如图21的孔的开口可以相对于彼此定位,以在标靶中的相邻柱体之间实现期望的重叠量,或者没有重叠。
164.在一些实施方式中,准直器可以安装在系统内部台架上的管口内,其示例参考图26、27和28进行描述。在这点上,准直器可以相对于粒子加速器位于射程调节器的光束下游。换句话说,准直器可以比射程调节器更靠近患者。这是因为射程调节器可导致粒子束的一些色散,并且该色散可能被准直器减小或校正。管口可以被配置成使准直器朝向或远离患者移动。此外,包括准直器在内的管口可以完全缩回到内部台架内,从而使准直器不妨碍技术人员进行治疗。在一些实施方式中,内部台架可以与治疗室的墙壁齐平,在这种情况下,将管口和准直器完全缩回到内部台架内会导致管口和准直器完全缩回到墙壁内。
165.图22示出了准直器725的示例性实施方式,其包括单个线性孔阵列。除了以单个线性阵列的孔的布置之外,准直器725的组成和孔的结构可以与准直器720的相同。在这个例子中,包括孔的载体726安装在轨道727上并连接到带728上。旋转马达730顺时针或逆时针驱动带728,这使得载体726在框架732内沿箭头731的任一方向移动。当粒子束移动到邻近载体726的区域时,马达730可以响应于来自控制系统的命令,使载体731移动。在一示例中,控制系统可以被配置为控制粒子束向准直器725的第一孔735的移动,以使得粒子束的至少一部分能够到达患者,在粒子束在第一孔处保持静止的同时改变粒子束的能量,并且控制粒子束从第一孔735向第二孔736的移动。控制系统还可以被配置成在粒子束在第二孔736处保持静止的同时改变粒子束的能量,并且控制粒子束从第二孔736向下移动到由载体726限定的线性阵列中的多个额外孔。在诸如737、738和739这样的多个额外孔的每一个处,粒子束被控制成在粒子束的能量改变时保持静止一段时间,从而在所有孔位置处治疗标靶内的柱体。
166.当粒子束要移动到另一个区域时,例如与载体相邻的区域740,载体726可以首先移动以覆盖该区域,使得可以使用超高剂量率辐射治疗在该区域下面的标靶内的柱体,如前所述。例如,如图23所示,载体726可以被移动到区域740,然后粒子束可以被向上引导通过载体中的孔,以治疗标靶内的柱体,如前所述。可以重复该过程,直到使用超高剂量率辐射治疗了所需量的标靶。尽管在图22和23中未示出,但是准直器725可以安装到托架上,该托架可控制成在垂直于轨道727的维度上移动。例如,托架可以由马达控制,该马达响应于
来自控制系统的一个或多个命令。因此,控制系统可以指示载体726沿着轨道727的移动以及轨道727经由托架的移动,从而实现载体在束场内的二维移动。如上所述,准直器也可以连接到管口,从而允许朝向或远离患者的额外尺寸的运动。
167.图24示出了图22和23的准直器725的变型。在该示例性准直器742中,有两个载体744和745,每个载体包括孔的线性阵列。除了将孔布置成两个线性阵列之外,准直器742的组成和孔的结构可以与准直器725相同。在这个例子中,两个载体可以物理连接,以协同地沿着轨道747移动。如上所述,两个载体744和745安装在轨道747上并连接到带749上。旋转马达750顺时针或逆时针驱动带749,这使得两个载体在框架753内沿箭头752的任一方向移动。马达750可以响应来自控制系统的命令,以使载体移动,从而符合治疗计划。在示例中,控制系统可以被配置为控制粒子束向载体744的第一孔755的移动,以使得粒子束的至少一部分能够通过第一孔到达患者,在粒子束在第一孔处保持静止的同时改变粒子束的能量,并且控制粒子束从第一孔755向第二孔756的移动。控制系统还可以被配置成在粒子束在第二孔756处保持静止的同时改变粒子束的能量,并且控制粒子束从第二孔756向下移动到由载体744限定的孔的线性阵列中的多个额外孔。在多个额外孔的每一个处,粒子束被控制成在粒子束的能量改变时保持静止一段时间,从而治疗标靶内的柱体。此后,粒子束可被转向至载体745,并向上穿过载体745中的孔,以治疗载体745下方的标靶内的柱体。可以重复该过程,直到使用超高剂量率辐射治疗了所需量的标靶。尽管图24中未示出,但准直器742可以安装到托架上,该托架可控制成在垂直于轨道747的维度上移动。例如,托架可以由马达控制,该马达响应于来自控制系统的一个或多个命令。因此,控制系统可以指示载体沿着轨道747的移动和轨道747经由托架的移动,从而实现载体在束场内的二维移动。在一些实施方式中,不同的载体744和745可以直接相邻或接触,或者在两者之间可以有间隔758,如图24所示。如上所述,准直器也可以连接到管口,从而允许朝向或远离患者的额外维度的运动。
168.在一些实施方式中,如图25所示,载体761和762(其可以分别具有与载体744和745相同的构造)可以安装到单独的轨道764和765上,连接到单独的带767和768上,并且由单独的旋转马达770和771控制,每个旋转马达都响应于来自控制系统的命令。因此,载体761和762可以被控制成彼此独立地并且相对于彼此移动,以便根据治疗计划实施超高剂量率的辐射输送。准直器760的每个部分及其相关组件可以具有与相应部分准直器725相同或相似的结构和功能。
169.虽然在图25中未示出,但是准直器760可以安装到托架上,该托架可控制以在垂直于轨道764和765的维度上移动。例如,托架可以由马达控制,该马达响应于来自控制系统的一个或多个命令。因此,控制系统可以指示载体沿着轨道764和765的移动以及轨道764和765经由托架的移动,从而实现载体在束场内的二维移动。在一些实施方式中,载体761和762中的每一个可以安装到单独的托架上,从而使得载体761和762中的每一个能够独立地进行第二维运动。如上所述,准直器也可以连接到管口,从而允许朝向或远离患者的额外尺寸的运动。
170.在这方面,图24和25各示出了两个载体,每个载体包含孔的单个线性阵列。在一些实施方式中,准直器742或760可以包括两个或更多个载体,每个载体包含孔的线性阵列或孔的二维阵列。每个载体可以如图24中那样物理连接以一起移动,或者每个载体可以如图
25中那样独立地联接并且响应于来自控制系统的命令独立地移动。此外,如前所述,每个载体可以连接成能够使用一个或多个托架进行二维运动。在一些实施方式中,两个马达可以被配置成沿着彼此独立的单个相同轨道移动载体,例如载体761和762。
171.在一些实施方式中,粒子束穿过的开口可以是槽而不是孔。示例槽的形状是矩形的,并且可以在标靶上方的位置上方并跨过该位置延伸,粒子束的两个或更多个束斑将在该位置被输送。图20至25的实施方式中所示的任何载体可以包括作为开口而不是孔的槽。例如,图20至25中的孔的每个线性阵列可以由单个槽或两个或更多个相邻槽代替。在这点上,图30示出了具有槽阵列781的示例性准直器780。在这个例子中,槽延伸载体的整个长度。然而,槽可以部分地延伸到载体的下方。例如,参考图31,准直器783可以包括二维槽阵列784,每个单独的槽沿着载体783向下延伸大约一半。
172.槽可以被配置为在一维上对粒子束进行修整和准直。例如,如图32所示,示例性槽788通过允许粒子束的部分791穿过患者并阻挡粒子束的部分792和793来准直束斑790。在槽的端部,例如端部794,粒子束可以在二维方向上被准直。如同使用孔的准直器的情况一样,使用槽的准直器也可以用于实施超高剂量率辐射治疗。
173.例如,参考图33的示例性准直器800,控制系统可以控制粒子束向槽798的第一部分801的移动,以使得粒子束的至少一部分能够到达患者,以在粒子束在槽798的第一部分801处保持静止的同时改变粒子束的能量,并且控制粒子束从槽798的第一部分801向槽798的第二部分802的移动。控制系统还被配置成,当粒子束在槽798的第二部分802处保持静止时改变粒子束的能量,并控制粒子束从槽798的第二部分802到槽798的多个额外部分803和804的移动。例如,粒子束可以沿着槽798移动,并且沿着槽在离散的位置输送辐射。粒子束被控制为在槽的多个额外部分中的每一个处保持静止一段时间,同时粒子束的能量在每个部分处变化,从而治疗标靶的柱体。粒子束然后可以移动到槽799的部分805,并沿着槽799向上行进,在柱体中沉积辐射。因此,使用槽作为开口的准直器仍然可以用于通过柱体将超高剂量率辐射输送到患者体内的标靶。通过控制经过扫描磁体的电流以将束斑定位在适当的位置,可以在治疗计划中控制粒子束的相邻束斑之间的重叠。在一些实施方式中,槽的使用可以提高治疗速度并减少当质子束被修整时产生的杂散中子。
174.尽管例如针对图20至25和30至33描述的准直器的各种实施方式被描述为与超高剂量率辐射治疗各个柱体一起使用,但是这种准直器的任何实施方式都可以用于输送并非超高剂量率的辐射剂量和/或不按柱体输送的辐射剂量。例如,本文描述的任何准直器都可以用于实现参考图1描述的逐层扫描方法。此外,所描述的准直器实施方式显示了具有相同形状的开口,这些开口规则地布置在载体上。在一些实施方式中,同一载体上的开口可以具有不同的尺寸和/或形状,这可以由例如治疗计划来决定。此外,开口可以以不规则的模式布置,这可以由例如治疗计划决定。在一些实施方式中,载体可以仅包括孔、仅包括槽或者槽和孔的组合。在一些实施方式中,载体可以具有单个开口,例如孔或槽。载体和粒子束可以一起运动。
175.在一些实施方式中,示例性粒子治疗系统可以包括可配置的准直器,代替或补充针对图20至25和30至33描述的示例性准直器。标题为“adaptive aperture”的美国专利公开第2017/0128746号中描述了可以使用的可配置准直器的一个例子,其内容通过引用结合于此。
176.图46示出了可以在可配置准直器中使用的叶片859的示例,尽管可配置准直器不限于与这种类型的叶片一起使用。叶片的高度850沿着粒子束线(例如,粒子束的方向)。叶片的长度852沿着其促动方向进出治疗区域,并且基于所述系统能够治疗的场(field)的尺寸或其部分。场的尺寸对应于粒子束能够影响的治疗区域。叶片的宽度853是多个叶片被促动时堆叠的方向。通常,使用的叶片越多,可以产生的孔径分辨率越高,包括弯曲边界。
177.在图46中,叶片859包括沿着其侧面的舌
‑
槽特征855,其被配置成当多个这样的叶片堆叠时减少叶片间泄漏。在这个例子中,叶片859的弯曲端856被配置成在治疗区域的所有位置保持与粒子束相切的表面。每片叶片的末端可以是平的,而不是弯曲的。
178.在一些实施方式中,可配置准直器叶片的高度足以阻挡至少最大束能量(例如,加速器输出的粒子束的最大能量)。在一些实施方式中,可配置的准直器叶片具有阻挡小于最大粒子束能量的高度。在一些实施方式中,可配置准直器叶片的长度不由整个治疗区域的面积决定,而是由单个束斑(粒子束的横截面积)或多个束斑的面积决定。
179.图47示出了部分可配置准直器810的示例性实施方式。可配置准直器810包括叶片811,叶片811具有一定高度并由诸如镍、黄铜、钨或其他金属的材料制成,足以抑制或防止给定能量的辐射通过。例如,在一些系统中,粒子加速器被配置成产生最大能量为100mev(百万电子伏)至300mev的粒子束。因此,在这样的系统中,叶片可以被构造成阻止具有100mev、150mev、200mev、250mev、300mev等能量的粒子束通过。例如,在一些系统中,粒子加速器被配置成产生最大能量超过70mev的粒子束。因此,在这样的系统中,叶片可以被构造成阻止具有70mev或更高能量的粒子束通过。
180.叶片811安装在载体上,以控制它们相对于辐射标靶的治疗区域的运动,例如患者体内肿瘤的横截面层。控制该运动以使叶片811覆盖治疗区域814的一些部分,从而防止辐射在治疗期间影响这些部分,同时使治疗区域的其他部分暴露于辐射。在图47的示例性实施方式中,总共有十四片叶片,七片在左边,七片在右边。在一些实施方式中,可以有不同数量的叶片,例如,总共十片,左边五片,右边五片;总共十二片,左边六片,右边六片,等等。
181.在图47中,位置812代表束斑的中心,因此代表辐射将被传递到的标靶中的柱体的位置。圆818代表治疗边界的一部分,超过该部分则不应被输送辐射。靠近该边界(例如,在粒子束轮廓的一个标准偏差内)的束斑与健康组织接壤。通过在可配置的准直器上适当地配置和放置叶片,可以修整(即阻挡)这些束斑。待修整的束斑的一个例子是束斑816,其中心在位置816。如图所示,叶片811被配置成阻挡束斑816的延伸超过圆818并进入健康组织(或至少是未被指定用于治疗的组织)的部分。
182.在一示例性实施方式中,在两个单独的载体的每一个上,有五个大约5mm宽的叶片和两个大约81mm宽的叶片。在一些实施方式中,在两个单独的托架的每一个上,有七个叶片,其中两个叶片的宽度是其他五个叶片的宽度的三倍或更多倍。其他实施方式可以包含不同数量、尺寸和配置的叶片,以及不同数量和配置的载体。例如,一些实施方式可以包括每个托架有五到五十之间的任意数量的叶片,例如每个托架有5、6、7、8、9、10、11、2、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、或50个叶片(或更多)。
183.如本文所述,托架可以水平和垂直移动。叶片也可以相对于每个托架水平地移入和移出治疗区域。以这种方式,叶片可被配置为接近正在治疗的区域附近的区域中的治疗
边界的形状(例如,在该示例中的圆816或其一部分)。
184.叶片可以在待处理的不同柱体之间垂直和/或水平移动,使得当粒子束被输送到特定柱体时,叶片处于适当的位置。如上所述,当粒子束静止时,可以基于粒子束能量重新配置叶片,以为不同的粒子束能量提供不同的配置。如前所述,粒子束可能会在组织中有所分散。可配置的准直器可以随着粒子束能量的变化而重新配置,以保持规则(例如圆柱体形)形状的柱体。
185.图48、49和50示出了可配置准直器的示例性实施方式,包括被配置为保持并相对于治疗标靶垂直和水平移动上述叶片的托架913、914、915。如图所示,垂直移动包括笛卡尔z维度917中的移动,水平移动包括笛卡尔x维度918中的移动(笛卡尔y维度进入或离开图49中的页面)。图49和50示出了透明的托架外壳的部分,以便示出壳体内部的部件;然而,壳体实际上并不透明。
186.托架913在这里被称为主托架,托架914和915在这里被称为副托架。副托架914、915连接到主托架913,如图48至50所示。在该示例中,副托架914、915各自包括经由相应构件918、919固定到主托架915的壳体。在该示例中,主托架913可相对于辐射标靶和相对于粒子加速器沿轨道920垂直地移动(z方向)。主托架913的垂直运动也导致副托架垂直运动。在一些实施方式中,副托架一致地垂直移动。在一些实施方式中,每个副托架的垂直运动独立于另一个副托架的垂直运动。
187.如图48至50所示,每个副托架914、915连接到相应的杆或轨道922、923,副托架沿着该杆或轨道移动。更具体地说,在这个例子中,马达925驱动副托架914沿着杆922朝向或远离副托架915移动。类似地,在该示例中,马达926驱动副托架915沿着杆923朝向或远离副托架914移动。如本文所述,对主托架和副托架的运动进行控制,以相对于辐射标靶定位叶片。此外,叶片本身也构造成移入和移出托架,也如本文所述。
188.如图50所示,马达930驱动主托架913的垂直运动。例如,如图50所示,导螺杆931连接到壳体932,壳体932保持用于驱动相应的副托架914、915的马达925、926,并且安装在轨道920上。丝杠931连接到马达930,并由马达930垂直驱动。也就是说,马达930垂直驱动导螺杆931(笛卡尔z维度)。因为导螺杆931固定在外壳932上,所以这种运动也导致外壳932,从而第二托架914、915沿着轨道920朝向或远离辐射标靶移动。
189.在该示例性实施方式中,如上所述,七个叶片935、936安装在每个副托架914、915上。每个副托架可以被配置成将其叶片水平移入或移出治疗区域。每个副托架上的单个叶片可以使用线性马达相对于同一副托架上的其它叶片在x维度上独立且线性地移动。在一些实施方式中,叶片也可以被配置为在y维度上移动。此外,一个副托架914上的叶片可以独立于另一个副托架915上的叶片移动。副托架上的叶片的这些独立运动,连同由主托架实现的垂直运动,允许叶片被移动成各种构型。结果,叶片可以在水平和垂直方向上符合在水平和垂直维度上随机成形的治疗区域。叶片的尺寸和形状可以变化以产生不同的构型。例如,可以改变尺寸和形状来治疗单个束斑,从而治疗单个柱体。在一些实施方式中,每个副托架上的单个叶片可以使用电动机独立且线性地移动,该电动机相对于同一副托架上的其他叶片在x维度上驱动导螺杆。
190.叶片可以由任何防止或抑制辐射传播的适当材料制成。使用的辐射类型可以决定叶片中使用的材料(一种或多种)。例如,如果辐射是x光,则叶片可由铅制成。在本文描述的
例子中,辐射是质子或离子束。因此,不同类型的金属或其他材料可以用于叶片。例如,叶片可以由镍、钨、铅、黄铜、钢、铁或它们的任何适当组合制成。每片叶片的高度可以决定该片叶片对辐射输送的抑制程度。
191.在一些实施方式中,叶片可以具有相同的高度,而在其他实施方式中,一些叶片的高度可以不同于其他叶片的高度。例如,一组叶片的高度可以各为5mm。然而,可以使用任何合适的高度。例如,叶片935、936可以具有以下任何高度(或其他高度):1mm、2mm、3mm、4mm、5mm、6mm、7mm、8mm、9mm、10mm、11mm、3mm、13mm、14mm、15mm、16mm、17mm、18mm、19mm、20mm、21mm、22mm、23mm、24mm、25mm、26mm、27mm、28mm、29mm,等等。叶片可以具有前述高度的任意组合。此外,每片叶片可以具有不同于一片或多片其它叶片的高度。
192.在一些实施方式中,叶片的高度不仅足以在最大预期质子能量下完全阻挡粒子束(例如,230mev下3.3cm的钨或例如5.2cm的镍),而且具有足够的额外材料来防止叶片之间的质子输送。这种材料可以具有如图46所示的舌
‑
槽结构,或者类似的结构。叶片末端可以被配置成包括弯曲或锥形表面,以增强不同发散度的质子束的输送半影区(penumbra)。
193.在一些实施方式中,可以有一个以上的主托架和相应的马达和轨道。例如,第一主托架可以控制第一副托架的垂直运动,第二主托架可以控制第二副托架的垂直运动。因此,在这种实施方式中,如果需要,两个副托架可以在垂直方向上独立移动。在任何情况下,主托架都可以由计算机控制。例如,可执行指令存储在计算机存储器(例如,一个或多个非暂时性机器可读存储介质)中,并由一个或多个处理设备执行以控制移动。在治疗期间,可以在有或没有用户输入的情况下进行控制。
194.如上所述,每个副托架914、915包括相应的马达来控制水平托架运动。在一些实施方式中,单个托架上的所有叶片都可以使用线性马达独立移动,其中一个线性马达控制每个叶片。每个叶片可以由图10中描述的类型的线性马达控制,以产生边缘来阻挡至少一些辐射到达患者,例如,修整由粒子束产生的一个或多个束斑。如上所述,可配置准直器中使用的线性马达可以具有与范围调制器中使用的线性马达相同的结构和功能。然而,在这种情况下,准直器叶片附接到线性马达,而不是能量吸收板。每个线性马达线性驱动其相应的叶片到达其在经配置边缘中的位置。
195.在上述示例性实施方式中,每个叶片使用独立且可独立控制的线性马达独立促动,使得任何合适的形状都可以用叶片构造来描绘。然而,可能不需要这种柔性来实现可接受的边缘一致性。叶片可能受到机械限制,只能实现有限数量的配置。例如,叶片可以被限制为将它们布置成垂直线、前对角线形状、后对角线形状、凹形形状、凸形形状或任何其他可实现的形状。通过这种方式,灵活性可以换来机械上的简单。
196.在某些情况下,当粒子束与叶片边缘的表面相切时,会产生更好的粒子束性能(半影或边缘锐度)。然而,由于粒子束实际上源自单点源,因此当粒子束远离场中心时,粒子束通过可配置准直器平面的角度会发生变化。由于这个原因,叶片可能有弯曲的边缘,如图46所示,使得边缘总是可以被放置在使它们与粒子束相切的位置。在可配置准直器的示例性实施方式中,主托架和副托架移动的轨道是弯曲的,使得平的叶片边缘可以用来代替弯曲的叶片边缘,并且使得平坦但保持与粒子束相切。
197.概括地说,在一些实施方式中,可配置准直器可以具有相对较小的尺寸,至少部分是由于本文描述的线性马达。因此,与标准多叶准直器相比,示例性可配置准直器因此可以
用于一次修整治疗区域的一部分,例如小于整个治疗区域并且大约等于一个束斑尺寸、两个束斑尺寸、三个束斑尺寸、四个束斑尺寸、五个束斑尺寸等的区域。因此,在一些实施方式中,可配置准直器可以小到足以一次修整单个束斑,并且可以大到足以在一个位置修整几个束斑,而不是整个场(在不移动的情况下)。如上所述,当用于产生治疗柱体的粒子束的能量变化时,修整单个束斑的能力可以用于保持治疗柱体的规则形状。
198.扫描系统可包括本文所述的可配置准直器,其可相对于辐射标靶放置,以限制粒子束的范围,从而限制粒子束的范围。例如,可配置准直器可以被放置在射程调节器的粒子束下游的粒子束中,并且在粒子束撞击辐射标靶的治疗区域之前。可配置的准直器是可控的,以允许粒子束穿过其中,然后撞击治疗区域的特定部分,同时防止粒子束撞击患者的其他部分。图51描绘了可配置准直器970的实施方式相对于患者971的放置。还示出了粒子束971的方向。
199.图26和27示出了包含安装在台架上的粒子加速器的质子治疗系统1082的示例的部分。因为加速器安装在台架上,所以它在治疗室中或邻近治疗室。粒子加速器可以是图3的同步回旋加速器;然而,该系统不限于与同步回旋加速器一起使用。台架和粒子加速器可以与扫描系统一起被控制,以便以本文所述的方式使用超高剂量率辐射来治疗辐射标靶的柱体。在一些实施方式中,台架是钢制的,并且具有安装成在位于患者相反侧的两个相应轴承上旋转的两条腿(未示出)。台架可以包括连接到其每条腿的钢桁架(未示出),该钢桁架足够长以跨越患者所在的治疗区域,并且在两端附接到台架的旋转腿。粒子加速器可以由钢桁架支撑,用于围绕患者运动。
200.在图26和27的例子中,患者位于治疗床1084上。在该示例中,治疗床1084包括支撑患者的平台。该平台还可以包括一个或多个约束装置(未示出),用于将患者保持在适当的位置,并用于在治疗床移动期间和治疗期间保持患者基本不动。平台可以或可以不被填充和/或具有对应于部分患者形状的形状(例如,凹痕)。该床可以通过臂1085移动。
201.图28示出了在美国专利第7,728,311号中描述的台架配置的示例,该专利通过引用合并于此,并且包括质子治疗系统的替代实施方式的部件,该质子治疗系统可用于以本文描述的方式使用超高剂量率辐射来治疗辐射标靶的柱体。图28的示例性质子治疗系统包括内部台架1190,其具有管口1191、治疗床1192和安装在外部台架1194上的粒子加速器1193(例如,本文所述类型的同步回旋加速器),用于至少部分地围绕患者旋转,以向患者体内的标靶(一个或多个)输送辐射。治疗床1192是可控的,并且被配置成以本文描述的方式旋转和平移患者。
202.在图28的例子中,粒子加速器1193也被安装到外部台架1194,也使得粒子加速器能够沿着臂1196在箭头1195的方向上线性移动(例如平移移动)。同样如图28所示,粒子加速器1193可以连接到万向节1199,用于相对于台架枢转运动。这种枢转运动可用于定位加速器,从而定位用于治疗的粒子束。
203.扫描系统的部件(包括扫描磁体、离子室、范围调制器和准直器)可以安装在质子治疗系统的内部台架的管口1081、1191上、之中或联接到其上。这些部件可以由控制系统控制,以使用超高剂量率辐射来处理辐射标靶的柱体。在两个示例中,管口可相对于患者和粒子加速器沿着内部台架(1080或1190)的轨道移动,并且可朝向患者延伸和远离患者缩回,从而也可延伸和缩回安装在其上的部件。
204.在一些实施方式中,本文描述的质子治疗系统中使用的同步回旋加速器可以是可变能量同步回旋加速器。在一些实施方式中,可变能量同步回旋加速器被配置成通过改变粒子束被加速的磁场来改变输出粒子束的能量。例如,电流可以被设置为多个值中的任何一个,以产生相应的磁场。在示例性实施方式中,一组或多组超导线圈接收可变电流以在空腔中产生可变磁场。在一些示例中,一组线圈接收固定电流,而一组或多组其他线圈接收可变电流,使得线圈组接收的总电流变化。在一些实施方式中,所有线圈组都是超导的。在一些实施方式中,一些线圈组(例如用于固定电流的线圈组)是超导的,而其他线圈组(例如用于可变电流的一个或多个线圈组)是非超导的(例如铜)线圈。
205.一般来说,在可变能量同步回旋加速器中,磁场的大小可以随着电流的大小而变化。在预定范围内调节线圈的总电流可以产生在相应的预定范围内变化的磁场。在一些例子中,电流的连续调节可以导致磁场的连续变化和输出束能量的连续变化。或者,当施加到线圈的电流以非连续、步进的方式调节时,磁场和输出束能量也以非连续(步进)的方式相应地变化。磁场相对于电流的比例可以允许相对精确地实现粒子束能量的变化,从而减少对射程调节器的需求。标题为“particle accelerator that produces charged particles having variable energies”的美国专利第9,730,308号中描述了可用于本文所述粒子治疗系统的可变能量同步回旋加速器的一个例子,该专利的内容通过引用合并于本文。
206.在使用可变能量同步回旋加速器的粒子治疗系统的实施中,可以通过改变同步回旋加速器输出的粒子束的能量来控制粒子束的能量以治疗标靶的一个柱体。在这样的实施方式中,可以使用或不使用范围调制器。例如,控制粒子束的能量可以包括将同步回旋加速器主线圈中的电流设置为多个值之一,每个值对应于从同步回旋加速器输出粒子束的不同能量。范围调制器可以与可变能量同步回旋加速器一起使用,以提供额外的能量变化,例如,在同步回旋加速器提供的离散能量级之间。
207.在一些实施方式中,除同步回旋加速器之外的粒子加速器可用于本文所述的粒子治疗系统。例如,回旋加速器、同步加速器、线性加速器等可以代替本文描述的同步回旋加速器。尽管已经描述了旋转台架(例如,外部台架),但是本文描述的示例性粒子治疗系统不限于与旋转台架一起使用。相反,粒子加速器可以适当地安装在任何类型的机器人或其他可控机构上,以实现粒子加速器的运动,在此也将其描述为台架类型。例如,粒子加速器可以安装在一个或多个机械臂上,以实现加速器相对于患者的旋转、枢转和/或平移运动。在一些实施方式中,粒子加速器可以安装在轨道上,并且沿着轨道的运动可以由计算机控制。在这种配置中,加速器相对于患者的旋转和/或平移和/或枢转运动也可以通过适当的计算机控制来实现。在一些实施方式中,粒子加速器可以是静止的,并且位于治疗室的外部,束被输送到治疗室中的管口。
208.在一些例子中,如上所述,超高剂量率的辐射可以包括持续时间小于500ms的超过每秒1格雷的辐射剂量。在一些示例中,超高剂量率的辐射可以包括持续时间在10ms和5s之间的超过每秒1格雷的辐射剂量。在一些示例中,超高剂量率的辐射可以包括持续时间小于5s的超过每秒1格雷的辐射剂量。
209.在一些示例中,超高剂量率的辐射包括持续时间小于500毫秒的超过以下剂量之一的辐射剂量:每秒2格雷、每秒3格雷、每秒4格雷、每秒5格雷、每秒6格雷、每秒7格雷、每秒
8格雷、每秒9格雷、每秒10格雷、每秒11格雷、每秒12格雷、每秒13格雷、每秒14格雷、每秒15格雷、每秒16格雷、每秒17格雷、每秒18格雷、每秒19格雷、每秒20格雷、每秒30格雷、每秒40格雷、每秒50格雷、每秒60格雷、每秒70格雷、每秒80格雷、每秒90格雷或每秒100格雷。在一些示例中,超高剂量率的辐射包括在10ms和5s之间的持续时间内超过以下剂量之一的辐射剂量:每秒2格雷、每秒3格雷、每秒4格雷、每秒5格雷、每秒6格雷、每秒7格雷、每秒8格雷、每秒9格雷、每秒10格雷、每秒11格雷、每秒12格雷、每秒13格雷、每秒14格雷、每秒15格雷、每秒16格雷、每秒17格雷、每秒18格雷、每秒19格雷、每秒20格雷、每秒30格雷、每秒40格雷、每秒50格雷、每秒60格雷、每秒70格雷、每秒80格雷、每秒90格雷或每秒100格雷。在一些示例中,超高剂量率的辐射包括在小于5s的持续时间内超过以下剂量之一的辐射剂量:每秒2格雷、每秒3格雷、每秒4格雷、每秒5格雷、每秒6格雷、每秒7格雷、每秒8格雷、每秒9格雷、每秒10格雷、每秒11格雷、每秒12格雷、每秒13格雷、每秒14格雷、每秒15格雷、每秒16格雷、每秒17格雷、每秒18格雷、每秒19格雷、每秒20格雷、每秒30格雷、每秒40格雷、每秒50格雷、每秒60格雷、每秒70格雷、每秒80格雷、每秒90格雷或每秒100格雷。
210.在一些示例中,超高剂量率的辐射包括持续时间小于500毫秒、持续时间为10毫秒至5秒或持续时间小于5秒的超过以下一个或多个剂量的辐射剂量:1每秒100格雷、每秒200格雷、每秒300格雷、每秒400格雷、每秒500格雷、或每秒600格雷。
211.在一些例子中,超高剂量率的辐射包括持续时间小于500ms的每秒20格雷至每秒100格雷的辐射剂量。在一些示例中,超高剂量率的辐射包括持续时间在10ms和5s之间的每秒20格雷至每秒100格雷的辐射剂量。在一些示例中,超高剂量率辐射包括持续时间小于5s的每秒20格雷至每秒100格雷的辐射剂量。在一些示例中,超高剂量率的辐射包括持续时间例如小于5s的每秒40格雷至每秒120格雷的辐射剂量。时间段的其他示例如上所述。
212.在一些实施方式中,本文描述的准直器中的孔的尺寸、形状或尺寸和形状可以是可变的或可配置的,例如,一个或多个孔或槽的位置可以移动。例如,一个或多个孔或槽可以使用安装在一个或多个载体上的指状物或叶片来形成,例如,在标题为“adaptive aperture”的美国专利申请2017/0128746中所描述的。
213.本文描述的示例性质子治疗系统的操作以及其全部或一些部件的操作可以至少部分地使用一个或多个计算机程序产品来控制(适当时),所述计算机程序产品例如有形地包含在一个或多个非暂时性机器可读介质中的一个或多个计算机程序,用于由一个或多个数据处理设备执行或控制其操作,所述数据处理设备例如可编程处理器、计算机、多台计算机和/或可编程逻辑部件。
214.计算机程序可以用任何形式的编程语言编写,包括编译或解释语言,并且它可以以任何形式部署,包括作为独立程序或作为模块、部件、子例程或其他适合在计算环境中使用的单元。计算机程序可以部署为在一台计算机上或在一个站点的多台计算机上执行,或者分布在多个站点上并通过网络互连。
215.与控制本文描述的示例性质子治疗系统的全部或部分操作相关联的动作可以由一个或多个可编程处理器来执行,该处理器执行一个或多个计算机程序来执行本文描述的功能。所有或部分操作可以使用专用逻辑电路来控制,例如,fpga和/或asic(专用集成电路)。
216.适于执行计算机程序的处理器包括,例如,通用和专用微处理器,以及任何类型的
数字计算机的任何一个或多个处理器。通常,处理器将从只读存储区或随机存取存储区或两者接收指令和数据。计算机(包括服务器)的元件包括用于执行指令的一个或多个处理器以及用于存储指令和数据的一个或多个存储区域设备。通常,计算机还将包括或可操作地联接到一个或多个用于存储数据的机器可读存储介质,例如磁盘、磁光盘或光盘,以从其接收数据,或向其输送数据,或两者兼有。适于存储计算机程序指令和数据的非暂时性机器可读存储介质包括所有形式的非易失性存储区域,包括例如半导体存储区域设备,例如eprom、eeprom和闪存存储区域设备;磁盘,例如内部硬盘或可移动磁盘;磁光盘;以及cd
‑
rom和dvd
‑
rom。
217.前述实施方式中的任意两种以上可以与适当的粒子加速器(例如同步回旋加速器)适当组合使用。同样,前述实施方式中的任意两个或更多个的单独特征可以以适当的组合使用。元件可以被排除在过程、系统、装置等之外。而不会不利地影响它们的操作。各种单独的元件可以组合成一个或多个单独的元件,以执行本文描述的功能。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1