具有微电极的单相驱动导管及其用于局部信号检测的方法与流程
具有微电极的单相驱动导管及其用于局部信号检测的方法
1.相关专利申请的交叉引用
2.本专利申请要求提交于2019年5月2日的美国临时专利申请62/842,439的优先权和权益,该专利申请的全部内容以引用方式并入本文。
技术领域
3.本说明整体涉及电生理导管,并且具体地涉及冲洗消融导管。
背景技术:
4.心脏中某个点处的电活动通常通过推进多电极导管来测量,以在心室中的多个点处同时测量电活动。从由一个或多个电极测量的时变电势导出的记录被称为电描记图。电描记图可通过单极性引线或双极性引线测量,并且被用于例如确定在某个点处的电传播的起始时刻,该起始时刻被称为局部激活时间。用于不同目的的各种电极设计是已知的。具体地,具有篮形电极阵列的导管是已知的并且例如在美国专利5,772,590中有所描述,该专利的公开内容以引用方式并入本文。
5.电描记图是双相的并且是全局信号。因此,心腔中的传感器可检测远场电活动,即,远离传感器发起的周围电活动,该远场电活动可扭曲或模糊局部电活动,即,在传感器位置处或附近发起的信号。因此,在一些情况下,希望获得单相动作电位信号形式的局部信号。单相动作电位(map)为细胞外记录的波形,其可再现具有高保真性的跨膜动作电位(tap)的复极化时间过程。申请人认识到,需要提供可获得map信号形式的局部信号的导管。
技术实现要素:
6.map已用于电生理学中,以允许在组织响应的细胞水平上进行更好地理解。map可利用有源电极和无源电极来再现具有高保真性的跨膜动作电位(tap)的复极化时间过程。本发明的实施方案包括具有微电极和热电偶的导管,使得微电极可用于造成组织上的局部治疗创伤以研究局部组织上的map。
7.本发明的实施方案通过使用具有感测导管的抽吸导管在组织中产生局部创伤来获得map信号,该局部创伤引起来自组织的可测量信号的响应。map信号用于显示药物、患病或健康组织以及其他可诊断指标的影响。本发明的实施方案还通过使用导管在组织上施加压力以在组织上获得可逆性局部损伤来获得map信号。这些技术中的任一种技术允许保健提供者推断因局部创伤引起的细胞水平响应(即,信号),使得治疗响应可被设计。
8.本发明的实施方案包括具有多个微电极和热电偶的导管,以通过使用接触力施加微电极在组织上提供最佳力(用于可逆性局部损伤)同时利用力施加微电极测量来自组织的响应信号来获得map信号。map信号也可利用非力施加微电极来测量。
9.微电极因接触力传感器而允许经由微电极所抵靠的较小表面积来实现一致的力施加,另外粗糙或断裂表面允许从局部组织损伤提取高信噪比电信号。
10.在一些实施方案中,导管包括:
11.伸长导管轴;
12.远侧节段,该远侧节段包括:
13.消融电极,该消融电极具有侧壁和外表面,该侧壁具有至少一个孔;
14.至少一个微电极,该至少一个微电极被配置成感测单相动作电位信号,该至少一个微电极具有从电极的外表面突伸的远侧感测部分和延伸穿过一个孔的近侧部分;
15.力传感器,该力传感器被配置成感测至少一个微电极抵靠组织表面的接触力。
16.在一些实施方案中,远侧感测部分具有球形构型。
17.在一些实施方案中,远侧感测部分从消融电极的远侧端部突伸预定距离。
18.在一些实施方案中,远侧感测部分具有断裂表面。
19.在一些实施方案中,远侧感测部分具有来自由氯化银、氧化铱和氧化钛组成的组的涂层。
20.在一些实施方案中,远侧感测部分具有蚀刻表面。
21.在一些实施方案中,远侧感测部分具有在约0.014mm和0.015mm之间的范围内的宽度。
22.在一些实施方案中,远侧感测部分被配置成对组织造成可逆性局部损伤。
23.在一些实施方案中,远侧节段包括多个微电极,每个微电极具有相应的远侧感测部分和相应的近侧部分,该相应的近侧部分延伸穿过形成于消融电极的侧壁中的相应孔。
24.在一些实施方案中,消融电极的侧壁包括至少一个盲通道和位于该盲通道中的至少一个热电偶线对。
25.在一些实施方案中,热电偶线对具有非线性构型,以便提供与盲通道的内表面的至少一个接触表面。
26.在一些实施方案中,使用具有多个微电极的导管的方法包括:
27.‑
将具有一个或多个微电极的导管定位成在沿期望消融图案的第一位置处接触组织;
28.‑
采集由第一位置处的一个或多个微电极感测的消融前map信号,map信号具有单相特性;
29.‑
在第一位置处利用导管执行消融;
30.‑
采集由第一位置处的微电极感测的消融后map信号;以及
31.‑
仅当消融后map信号缺乏单相特性时,将具有一个或多个微电极的导管重新定位成在沿期望消融图案的第二位置处接触组织。
32.在一些实施方案中,该方法还包括:
33.‑
当单相特性的至少一部分仍呈现在消融后map信号中时,在第一位置处重新执行消融。
附图说明
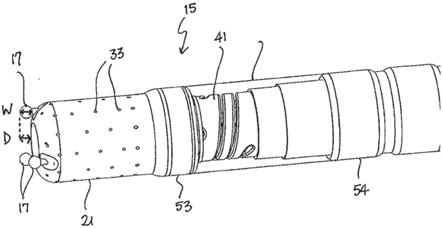
34.通过参考以下结合附图考虑的具体实施方案,将更好地理解本发明的这些和其他特征结构以及优点,其中:
35.图1为根据一个实施方案的导管消融系统的示意性图解;
36.图2为根据一个实施方案的适于与图1的系统一起使用的具有多个微电极的单相
驱动导管的远侧节段的侧透视图。
37.图3为图2的远侧节段的侧剖视图。
38.图4a为由检测map信号的微电极获得的消融前ecg。
39.图4b为在成功消融之后不存在map信号的情况下由微电极获得的3
‑
d电解剖标测图和消融后ecg。
40.图4c为在微电极移动到新的组织目标位置之后由微电极获得的消融后ecg。
41.图5为图2的远侧节段的侧剖视图,其中微电极的感测部分通常以足以产生可逆性局部损伤的力埋入组织中,以用于检测具有map特性的ecg信号。
具体实施方式
42.应结合附图来阅读下面的具体实施方式,其中不同附图中相同元件的编号相同。附图(未必按比例绘制)示出所选择的实施方案,并不旨在限制本发明的范围。详细描述以举例的方式而非限制性方式示出本发明的原理。此描述将明确地使得本领域技术人员能够制备和使用本发明,并且描述了本发明的若干实施方案、适应型式、变型形式、替代形式和用途,包括目前据信是实施本发明的最佳方式。
43.如本文所用,针对任何数值或范围的术语“约”或“大约”指示允许部件或元件的集合实现如本文所述的其预期要达到的目的的合适的尺寸公差。更具体地,“约”或“大约”可指列举值的值
±
20%的范围,例如“约90%”可指71%至99%的值范围。另外,如本文所用,术语“患者”、“宿主”、“用户”和“受检者”是指任何人或动物受检者,并且不旨在将系统或方法局限于人使用,但本主题发明在人类患者中的使用代表优选的实施方案。
44.概述
45.参考图1和图2,可用于微创规程(诸如心脏组织的消融)的导管10包括伸长导管轴12和导管轴12远侧的较短挠曲节段14,该挠曲节段可单向或双向挠曲。导管轴12和挠曲节段14的合适的实施方案在2018年3月19日提交的名称为“catheter with multifunctional microinjection
‑
molded housing”的美国申请序列号申请号15/925,521中有所描述,其全部公开内容以引用方式并入本文。挠曲节段14的远侧为远侧节段15,该远侧节段包括力传感器40和支撑多个微电极17和多个热电偶18的尖端电极21。导管也包括导管轴12近侧的控制手柄16。
46.系统描述
47.如图1所示,其为导管消融系统100的示意性图解。在系统100中,导管10被插入患者11的血管系统中并插入心脏13的腔室中。导管由系统100的操作者19在规程期间使用,该规程通常包括对患者的心脏组织执行消融。
48.系统100的操作、功能和动作由系统控制器130管理,该系统控制器包括处理单元132,该处理单元与其中存储有用于系统100的操作的软件的存储器134连通。在一些实施方案中,控制器130是包括通用计算机处理单元的工业标准个人计算机。然而,在一些实施方案中,控制器的操作、功能或动作中的至少一些是使用定制设计的硬件和软件来执行的,诸如专用集成电路(asic)或现场可编程门阵列(fpga)。在一些实施方案中,控制器130由操作者19使用指点装置136和图形用户界面(gui)138进行管理,使得操作者能够设定系统100的参数。gui 138通常还在显示监视器140上向操作者显示规程结果。
49.存储器134中的软件可通过例如网络以电子形式下载到控制器。另选地或除此之外,软件可通过非临时性有形介质诸如光学、磁性或电子存储介质提供。
50.包括电极、热电偶和方位(位置或取向)传感器的远侧节段15的电子部件通过导体连接到系统控制器130,该导体穿过导管轴12和挠曲节段14。除了用于消融之外,电极还可执行如本领域已知的其他功能。系统控制器130可通过频率复用来区分用于电子部件的不同功能的电流。例如,射频(rf)消融功率可在几百khz左右的频率下提供,而位置感测频率则可处于1khz左右的频率。一种使用针对电极测量的阻抗来评估远侧节段15的方位的方法公开于授予bar
‑
tal等人的名称为“current localization tracker”的美国专利8,456,182中,其全部公开内容以引用方式并入本文。
51.如图1所示,系统控制器130包括力模块148、rf消融模块150、冲洗模块152、跟踪模块154、温度感测模块156和map模块157。系统控制器130使用力模块148生成并测量供应到远侧节段15中的力传感器40和从该力传感器接收的信号,以便测量远侧节段15上的力的大小和方向。系统控制器130使用消融模块150来监测和控制消融参数,诸如经由远侧节段15的一个或多个电极施加的消融功率的水平。消融模块150包括rf发生器(未示出)并且控制所施加的消融的功率/瓦特数和持续时间。
52.通常,在消融期间,在由消融模块150供电的一个或多个电极以及周围区域中生成热量。为了消散热量并改善消融过程的效率,系统控制器130监测远侧节段15的不同部分/表面的温度,并且将冲洗流体供应到远侧节段15。系统控制器130使用冲洗模块152来监测和控制冲洗参数,诸如冲洗流体的流速和温度。在一些实施方案中,系统控制器130响应于温度感测模块156使用冲洗模块152,以通过控制和调节远侧节段15的可移动内部部件来管理远侧节段15的表面上的“热点”或不均匀的加热,如下文进一步详细描述。
53.系统控制器130使用跟踪模块154来监测远侧节段15相对于患者11的位置和取向。可通过本领域已知的任何跟踪方法来实施监测,诸如在由biosense webster(irvine,ca)制造的系统中所提供的一种跟踪方法。此类系统使用患者11外部的射频(rf)磁发射器和远侧节段15内的响应元件(例如,方位传感器50)。另选地或除此之外,可通过测量一个或多个电极(图3)与附接到患者11的皮肤的贴片电极之间的阻抗来实施跟踪,诸如也提供在系统中。为简单起见,在图1中未示出特定用于跟踪且由模块154使用的元件,诸如以上所提及的元件和贴片电极。
54.系统控制器130使用map模块157接收和处理由微电极感测的map信号以利用有源电极和无源电极来再现具有高保真性的跨膜动作电位(tap)的复极化时间过程。如下文进一步详细描述,消融前和消融后的map信号可向系统的操作者提供关于在何处和何时移动导管以产生连续消融灶或阻断线的指示。
55.参见图2和图3,远侧节段15包括外壳顶盖电极21,该外壳顶盖电极被配置成具有近侧颈部22、圆柱形侧壁23和远侧端部24,该远侧端部围绕内部腔室25,该内部腔室在颈部22处具有近侧开口,该近侧开口被配置成容纳占据近侧开口的插入件20。顶盖电极21被配置用于一个或多个功能,包括例如消融。侧壁23包括多个径向冲洗孔33,该多个径向冲洗孔允许腔室25内部的流体流到顶盖电极21的外部。侧壁23还包括定位在围绕远侧节段15的中心纵向轴线27的等角度位置的多个纵向通孔26。在例示的实施方案中,三个孔26定位在围
绕轴线27的约0度、120度和240度处,但应当理解,多个孔可根据需要或期望而有所不同,例如,介于2度和5度之间。每个孔26具有近侧开口和远侧开口,并且每个孔26在颈部22与顶盖电极21的远侧端部24之间延伸侧壁的长度。顶盖电极21可由任何合适的材料构成,包括例如铂钯。
56.相应的微电极17在每个孔26内延伸,该微电极具有伸长杆28和远侧感测部分29,该远侧感测部分被暴露并被配置用于与组织接触。微电极17可由任何材料构成,包括例如铂铱。值得注意的是,每个微电极17的杆28被配置成在顶盖电极21的远侧端部24的远侧延伸预定距离,使得远侧感测部分29可用最佳力接触并压缩组织t以造成可逆性局部创伤,但不造成永久性损伤,以用于感测map信号,如图5所示。微电极17的远侧感测部分29具有突伸超过电极21的表面形貌的接触表面,因此远侧感测部分29通常可被埋入组织中。在孔26的每个远侧端部处,凹陷部30形成于顶盖电极21的远侧端部24处。凹陷部30可填充有材料例如聚氨酯,以将杆28的远侧部分密封并装入凹陷部30中。
57.在一些实施方案中,微电极17的远侧感测部分29被配置成例如具有球形或球状构型,该球形或球状构型通常可被周围组织完全包封,以避免感测细胞外信号或远场信号。微电极的轮廓用于造成可逆性穿孔,以用于研究组织部位处的map。利用多个微电极,可同时研究多个单独的局部组织区域。远侧感测部分的构型可包括卵形或椭圆形构型。在一些实施方案中,远侧部分29具有约0.014mm和0.015mm的宽度或直径w,并且杆28具有约0.100mm的长度。从远侧感测部分29的最远侧表面到远侧端部24的远侧面测得的远侧感测部分29的突伸距离d为约0.023mm。突起距离使得微电极能够深入地获取局部细胞组织的map。
58.在一些实施方案中,远侧感测部分29的表面被机械地制备,以便通过清洁方法和表面涂层来最小化信号噪声。在一些实施方案中,远侧感测部分29的表面例如通过等离子体蚀刻而粗糙化,或者涂覆有断裂物质(例如氯化银、氧化铱或氮化钛)的一个或多个涂层,以提供微米级的裂纹和裂缝,从而增加远侧部分的表面积。氧化铱可提供高达100倍的较大表面积。氮化钛可提供高达1000倍的较大表面积。利用等离子体蚀刻的机械粗糙化可提供高达10倍的较大表面积。此类断裂表面积允许从局部组织创伤中提取高信噪比电信号。
59.每个杆28被具有管腔32的伸长绝缘支撑构件31(例如聚亚胺管)围绕,该伸长绝缘支撑构件通常与相应孔26中的杆共延。构件31将整个微电极17与电极21电隔离。杆28与管腔32之间的配合以及支撑构件31与孔26之间的配合可为紧邻或紧密的配合。绝缘支撑构件31的远侧端部被配置成具有凸缘34以密封孔26和管腔32。在杆28的近侧端部处,电连接件例如通过焊接提供到相应的引线35。每个孔26的近侧开口通向顶盖电极21的颈部22内,使得引线35可延伸到颈部22内并且沿着挠曲节段14和导管轴12朝近侧向控制手柄16延伸。
60.顶盖电极21的侧壁23还具有多个盲通道36,该多个盲通道定位在围绕中心纵向轴线27的等角度位置,与孔26的位置错开,每个盲通道容纳相应的热电偶(tc)线对18,例如康铜线和铜线对。在一些实施方案中,六个盲通道36例如在围绕轴线27的15度、75度、135度、195度、255度和315度处定位在侧壁中以容纳六个tc对18。形成每个热电偶18的远侧接合部的线对的绞合远侧端部容纳在相应的管39(例如海波管)中,该管具有大于盲通道长度的预定长度。海波管和远侧接合部的较大长度以及盲通道36的较大直径使得海波管和远侧接合部能够在盲通道内挤塞成非线性形状,使得确保海波管与盲通道的内壁之间的接触,以用于顶盖电极21的更准确的温度感测。每个盲通道的近侧开口通向顶盖电极21的颈部22内,
使得tc线对18可进入颈部并且沿着导管挠曲节段14、导管轴12朝近侧进入控制手柄16。
61.在一些实施方案中,插入件20被部分地配置成具有一个或多个径向通道37的冲洗流体分流器,该一个或多个径向通道提供腔室25与冲洗管腔52的远侧端部之间的流体连通,该冲洗管腔沿着导管的长度在远侧节段15与控制手柄16之间延伸。系统控制器130(图1)的冲洗模块152控制冲洗流体流过冲洗管腔52并进入腔室25。
62.占据顶盖电极21的颈部22的插入件20可形成有盲孔以接收用于使插入件20和顶盖电极21通电的引线55的远侧端部。还可形成横向通道,安全线38穿过该横向通道以将顶盖电极21拴系到导管10作为安全措施。在一些实施方案中,远侧节段15包括力传感器40,该力传感器的远侧端部连接到插入件的近侧端部。类似的力传感器的各方面在2013年1月22日提交的授予govari等人的美国专利8,357,152和2009年11月30日提交的授予beeckler等人的美国专利申请2011/0130648中有所描述,这两个专利的公开内容均以引用方式并入本文。力传感器40包括弹性联接构件41,该弹性联接构件在联接构件的远侧端部和近侧端部之间形成弹簧接头并具有穿过其的中心管腔42。联接构件41通常具有在构件41切割的一个或多个螺旋43,使得构件41表现为弹簧。
63.联接构件41安装在非导电的生物相容性护套44内并被其覆盖,该护套通常由柔性塑性材料形成。使联接构件具有尽可能大的外径通常会增大力传感器40的灵敏度。此外,如将在下文中说明,管状联接构件41的相对大的直径和其相对薄的壁提供了相对宽敞的中心管腔42,各部件通过该中心管腔进入和离开远侧节段15。在rf消融规程期间,可在远侧节段15中产生大量的热,并且因此护套44可包括耐热性塑性材料诸如聚氨酯,该耐热性塑性材料的形状和弹性基本上不会因暴露于热而受到影响。
64.在一些实施方案中,力传感器40包括容纳在弹簧接头远侧的插入件20中的远侧线圈45(图3)、以及弹簧接头近侧的三个近侧线圈46(未示出)。线圈提供力传感器40的弹簧接头中的任何尺寸变化(包括接头的轴向位移和角度挠曲)的准确读数。这些线圈为可用于本发明实施例中的磁换能器的一种类型。在本专利申请的上下文中和在权利要求中的“磁换能器”意指响应于施加的电流而生成磁场或响应于施加的磁场而输出电信号的装置。虽然本文所述的实施方案使用线圈作为磁换能器,但是在另选的实施方案中可使用其它类型的磁换能器,这对于本领域的技术人员而言将是显而易见的。
65.在一些实施方案中,远侧线圈45由经由缆线(未示出)来自系统控制器130和力模块148的电流驱动,以生成磁场。该场由近侧线圈46接收,该近侧线圈被固定在距线圈45相同的轴向距离处,但位于围绕纵向轴线27的不同角度位置处,例如,围绕轴线27的0度、120度、和240度。近侧线圈46响应于由远侧线圈45发射的磁场而生成电信号。这些信号通过缆线(未示出)传送到系统控制器130,该系统控制器使用力模块148来处理信号以便测量弹簧接头与轴线27平行和同轴的位移,以及测量接头相对于轴线的角度挠曲。根据所测量的位移和挠曲,系统控制器130能够通常使用先前确定的存储在力模块148中的校准表来评估联接构件41的弹簧接头上的力的大小和方向。值得注意的是,力传感器40使得多个微电极17能够对组织施加一致的力,但应当理解,在一些实施方案中,导管10不需要具有力传感器。
66.系统控制器130使用跟踪模块154(图1)来测量并检测远侧端部12的位置和取向。检测的方法可利用本领域已知的任何简便过程。在一些实施方案中,在患者11外部生成的磁场(例如,通过定位在患者床下方的发生器)在容纳在联接构件41的管腔42中的通常位于
弹簧接头近侧的方位传感器50中生成电信号。本领域的普通技术人员应当理解,方位传感器50包括感测线圈x、感测线圈y和感测线圈z(在一些实施方案中为线圈46中的一者)。系统控制器130处理电信号以评估远侧节段15的位置和取向。另选地,可在远侧节段15中生成磁场,并且由场形成的电信号可在患者11的外部测得。
67.在使用中,导管10被引入患者的血管系统中,并且远侧节段15被推进到感兴趣区域,例如心腔。系统控制器130完成诊断规程,包括标测。例如,方位传感器50在确定远侧节段15的位置和取向中生成由跟踪模块154处理的信号。尖端电极21、远侧环形电极53和/或近侧环形电极54感测心脏组织的电活动,这些生成的信号由处理单元132处理。可从这些经处理的信号产生3d电生理学标测图,并对消融组织位点进行识别和靶向。然后,系统控制器130可完成治疗规程。例如,操作者操纵远侧节段15,使得尖端电极21与目标组织位点接触。尖端电极21和组织之间的接触导致施加使远侧节段15相对于力传感器40的联接构件41的近侧端部移位的力。此类移位导致近侧线圈46生成由力模块148处理的信号,例如,用于确认在准备消融时远侧节段15和组织的接触。
68.在消融之前和/或期间,冲洗模块152通过泵(未示出)控制冲洗流体到远侧节段15的递送和递送速率,该泵通过冲洗管腔52从流体源(未示出)递送冲洗流体。消融模块150将rf能量递送到顶盖电极21,该顶盖电极加热目标组织以形成消融灶。热电偶tc 18中的一者或多者生成表示相应周围组织和流体的温度的信号。根据感测到的一个或多个温度,在一些实施方案中,系统控制器130可与消融模块150连通以调节功率递送,并且/或者与冲洗模块152连通以调节流体递送的速率,或者适当地将导流器58的位置调节至其最远侧位置、较远侧位置或不太近侧的位置,以避免热点、炭化、血栓形成。因此,可引导冲洗流体以一个或多个所选择的流速离开冲洗孔33。
69.通过利用足够的力将一个或多个微电极17压靠在组织上以将相应的一个或多个远侧感测部分29埋入组织中以造成可逆性局部创伤或损伤,一个或多个微电极17可检测map信号。如图4a所示,分别由微电极17(被指定为μ1
‑
μ2、μ2
‑
μ3和μ3
‑
μ1)检测到的三个消融前ecg信号表现出与其他电极检测到的双相ecg信号不同的单相特性。相比之下,如图4b所示,由相同微电极检测到的三个消融后ecg信号不表现出单相活动,这些信号通常为扁平线,而其他电极继续感测信号。利用形成有效消融灶的消融规程,微电极检测不到指示目标组织已成功坏死的map信号。在图4c中,导管的远侧节段15已被移动,使得相同微电极嵌入在新的目标位置中;因此,由微电极检测到的ecg信号再次表现出单相特性。因此,在一些实施方案中,使用具有微电极的前述导管进行消融的方法包括:
70.‑
将具有一个或多个微电极的导管定位成在沿期望消融图案的第一位置处接触组织;
71.‑
采集由第一位置处的一个或多个微电极感测的消融前ecg信号,该ecg信号具有单相动作电位特性;
72.‑
在第一位置处利用导管执行消融;
73.‑
采集由第一位置处的微电极感测的消融后ecg信号;以及
74.‑
仅当第一位置处的消融后ecg信号缺乏单相动作电位特性时,将具有一个或多个微电极的导管重新定位成在沿期望消融图案的第二位置处接触组织。
75.该方法还可包括:
76.‑
当单相特性的至少一部分仍呈现在消融后ecg信号中时,在第一位置处重新执行消融。
77.当需要连续的消融灶或阻断线时,诸如对于肺静脉隔离,上述方法可能特别有用。
78.已结合本发明的某些示例性实施方案进行了以上描述。本发明所属技术领域内的技术人员应认识到,在不是有意脱离本发明的原则、实质和范围的情况下,可对所述结构进行改变和变型,并且这些图画不必依比例绘制。此外,应当理解,实施方案的任何一个特征可代替其它实施方案的特征使用或除后者之外附加地使用。因此,以上描述不应该被理解为只涉及附图中所描绘和所示出的具体结构。相反,以上描述应被理解为与以下涵盖其最完整和最清楚范围的权利要求书一致,并且支持该权利要求书。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1