制备基于生物相容性聚合物的负载阿哌沙班的微球的方法与流程
1.本发明涉及制备基于生物相容性聚合物的负载阿哌沙班的微球的方法。更具体地,本发明涉及制备基于生物相容性聚合物的负载阿哌沙班的微球的方法,其包括:i)将脂肪酸或甘油三酯加入分散相;以及ii)使用微流控法制备微球。
背景技术:
2.阿哌沙班是通过在凝血步骤中选择性地抑制凝血因子xa来防止血块和凝血的形成的药物。口服给予阿哌沙班,用于以下目的:防止接受过髋关节或膝关节置换的成年患者的静脉血栓栓塞,降低患有非瓣膜心房颤动的患者中风和全身栓塞的风险,以及治疗深静脉血栓形成和肺栓塞并降低其复发的风险。
3.然而,当口服给予阿哌沙班时,阿哌沙班的低水溶性抑制其体内的吸收,并且因此已知具有大约50%的生物利用度。另外,关于阿哌沙班,其是口服给予的非维生素k拮抗剂口服抗凝药(noac)中的一种,胃肠道出血可能由以下组合的机制引起:1)全身抗凝效应,2)局部抗凝效应,3)局部直接腐蚀作用,和4)非凝固相关的局部生物作用等,或在口服给药后,阿哌沙班在肠道中以活性形式存在,以便发挥抗凝作用,这可能导致肠道中各种损伤出血。因此,亟需新的给药途径来克服阿哌沙班的低生物利用度并减少胃肠道出血。
4.关于寻找现有口服给药药物的新型给药途径,基于生物相容性聚合物的微球具有优势:因为它们通常被制成用于肌内或皮下给药的注射剂,所以能够将药物包封在其中,并且在体内注射之后微球逐渐并完全降解,从而100%释放药物,并且因此能够长时间保持药物的体内有效浓度。
5.因此,在将阿哌沙班包封到基于生物相容性聚合物的微球中的情况下,能够将阿哌沙班的给药途径从常规口服给药改变为用于肌内或皮下给药的注射,并且因此预期改善生物利用度。
6.微球的已知制备方法包括i)溶剂蒸发法、ii)喷雾干燥法、iii)溶剂提取法,iv)微流控法(biomaterials,1989,10(8)557-563;journal of microencapsulation,2004,21(2)203-211;journal of controlled release,1997,47(3)233-245;journal of bioactive and compatible polymers,2014,29(4)318-329)。然而,从未使用上述制备方法将阿哌沙班开发为微球制剂。此外,制备负载阿哌沙班的微球的方法至今也不是已知的。
7.发明的公开
8.技术问题
9.本发明人为开发制备基于生物相容性聚合物的负载阿哌沙班的微球的方法取得了广泛的成果,并且因此已证实,当通过将脂肪酸或甘油三酯加入分散相并使用微流控法来制备微球时,能够制备其中稳定包封高含量的阿哌沙班的微球,从而完成本发明。
10.问题的解决方案
11.本发明的目的是提供制备基于生物相容性聚合物的负载阿哌沙班的微球的方法,其包括:
12.i)将脂肪酸或甘油三酯加入分散相;以及
13.ii)使用微流控方法制备微球。
14.发明的有益效果
15.本发明的制备基于生物相容性聚合物的负载阿哌沙班的微球的方法能够有效地用于制备其中稳定包封高含量的阿哌沙班的微球。
16.附图简要说明
17.图1是在分别向非卤素有机溶剂乙酸乙酯、甲酸乙酯、丙酸甲酯和乙醇中添加阿哌沙班然后搅拌之后用数码相机拍摄的图像。
18.图2示出了在将阿哌沙班溶解于二氯甲烷之后立即和12小时后用数码相机拍摄的图像。
19.图3示出了将阿哌沙班溶解于二氯甲烷之后12小时形成的晶体的光学显微镜图像。
20.图4是实验例3-1中制备的基于聚合物的负载阿哌沙班的微球(比较例1)的光学显微镜图像。
21.图5是实验例3-2中制备的基于聚合物的负载阿哌沙班的微球(比较例2)的光学显微镜图像。
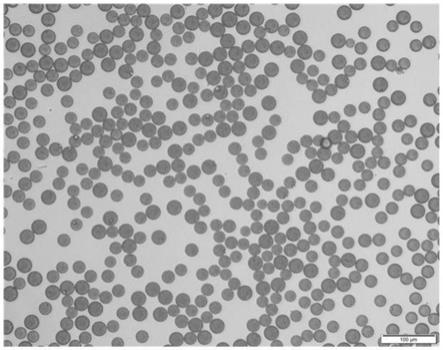
22.图6是实验例4中制备的基于聚合物的负载阿哌沙班的微球(比较例3)的光学显微镜图像。
23.图7是实验例5-1中制备的基于聚合物的负载阿哌沙班的微球(实施例1)的光学显微镜图像。
24.图8是实验例5-2中制备的基于聚合物的负载阿哌沙班的微球(实施例2)的光学显微镜图像。
25.图9是实验例5-3中制备的基于聚合物的负载阿哌沙班的微球(实施例3)的光学显微镜图像。
26.图10是实验例5-4中制备的基于聚合物的负载阿哌沙班的微球(实施例4)的光学显微镜图像。
27.图11是实验例5-5中制备的基于聚合物的负载阿哌沙班的微球(实施例5)的光学显微镜图像。
28.图12是实验例5-6中制备的基于聚合物的负载阿哌沙班的微球(实施例6)的光学显微镜图像。
29.图13是实验例5-7中制备的基于聚合物的负载阿哌沙班的微球(实施例7)的光学显微镜图像。
30.实施发明的最佳方式
31.为了实现所述目的,本发明的一方面提供了制备基于生物相容性聚合物的负载阿哌沙班的微球的方法,其包括:i)将脂肪酸或甘油三酯加入分散相;以及ii)使用微流控法制备微球。
32.具体地,本发明的一个方面可以提供制备用于缓释的注射形式的基于生物相容性聚合物的负载阿哌沙班的微球的方法,其包括以上步骤。
33.如本文所用,术语“阿哌沙班”系指具有化学式1的结构的化合物。阿哌沙班在该结
构中具有三个酰胺,并且具有酰胺的固有偶极结构。因此,阿哌沙班能够形成由n-h
…
o组成的分子间氢键,并且因此能够在质子供体或质子受体存在时在合适的溶剂中形成共沉淀物,或者还能够在阿哌沙班分子之间形成分子间氢键。因此,即使当仅阿哌沙班溶解时,也可以在一定时间段之后形成晶体。
34.[化学式1]
[0035][0036]
由于这种药物结晶的现象显著降低了微球体中药物的含量,并且由于没有办法从其中包封药物的微球中完全去除在制备微球期间产生的药物晶体,所以有必要在制备微球期间防止晶体的形成。
[0037]
诸如阿哌沙班的疏水性药物通常具有在制备微球期间沉淀以形成晶体的倾向。在这种情况下,可以通过使用高浓度/高粘度聚合物溶液、减少添加的药物量、改变有机溶剂的类型或降低溶剂的挥发温度来防止晶体的沉淀。应用这些方法以减少药物与水之间的接触概率并控制聚合物固化的速率,从而允许药物物理地包封在微球中。
[0038]
考虑阿哌沙班的推荐日剂量和从微球释放药物的总持续时间,为开发用于缓释阿哌沙班的微球,应考虑微球中高药物含量的标准。因此,难以应用显著降低微球中的药物含量、减少添加的药物的量或使用高浓度聚合物溶液的方法来制备基于生物相容性聚合物的负载阿哌沙班的微球。
[0039]
另外,改变有机溶剂的类型或降低制造过程中的溶剂蒸发温度的方法可能不适合用于制备负载阿哌沙班的微球,因为在大多数挥发性非卤素有机溶剂中阿哌沙班的溶解度极其有限,并且相对于溶剂的完全去除存在残余溶剂的问题。
[0040]
因此,阿哌沙班至今尚未开发为微球,负载阿哌沙班的微球的制备方法也还未知。就这一点而言,由本发明人首次开发了制备基于生物相容性聚合物的负载阿哌沙班的微球的方法,这具有显著的意义。
[0041]
在本发明中,阿哌沙班可包括其药物可接受的盐。
[0042]
如本文所用,术语“药物可接受的盐”系指能够药物使用形式的盐,其为具有通过静电吸引结合的阳离子和阴离子的物质。通常,其可以包括金属盐、有机碱盐、无机酸盐、有机酸盐、碱性或酸性氨基酸盐等。金属盐的实例可以包括碱金属盐(钠盐、钾盐等)、碱土金属盐(钙盐、镁盐、钡盐等)或铝盐;有机碱盐的实例可以包括三乙胺、吡啶、甲基吡啶、2,6-二甲基吡啶、乙醇胺、二乙醇胺、三乙醇胺、环己胺、二环己胺、n,n
’‑
二苄基乙二胺等的盐;无机酸盐的实例可以包括盐酸、氢溴酸、硝酸、硫酸、磷酸等的盐;有机酸盐的示例可包括甲酸、乙酸、三氟乙酸、邻苯二甲酸、富马酸、草酸、酒石酸、马来酸、柠檬酸、琥珀酸、甲磺酸、苯磺酸、对甲苯磺酸等的盐;碱性氨基酸盐的实例可以包括精氨酸、赖氨酸、鸟氨酸等的盐;酸
性氨基酸盐的实例包括天冬氨酸、谷氨酸等的盐。
[0043]
如本文所用,术语“基于生物相容性聚合物的负载阿哌沙班的微球”系指其中包封阿哌沙班的微球,其使用生物相容性聚合物制备,并且还可以简称为负载阿哌沙班的微球、阿哌沙班微球或微球。微球不受聚合物的类型的限制,并且只要阿哌沙班能够被包封在使用生物相容聚合物制备的微球中,任何微球都落入本发明的范围内。
[0044]
此外,基于生物相容性聚合物的负载阿哌沙班的微球可以用于缓释阿哌沙班,并且可以制成用于皮下或肌内给药的注射剂。如本文所用,术语“缓释”系指通过控制药物的释放机制而在体内长时间释放药物。具体地,在本发明中,其可以指初始药物释放的抑制,但不限于此。
[0045]
就这一点而言,在本发明中制备的基于生物相容性聚合物的负载阿哌沙班的微球可以具体地是用于缓释的注射剂形式的基于生物相容性聚合物的负载阿哌沙班的微球。
[0046]
本发明的制备基于生物相容性聚合物的负载阿哌沙班的微球的方法包括将脂肪酸或甘油三酯加入分散相中。
[0047]
在本发明中,只要脂肪酸或甘油三酯i)是药物可接受的,ii)具有能够与阿哌沙班形成氢键的官能团,iii)在卤素有机溶剂中显示出高溶解度,就能够不受限制地使用脂肪酸或甘油三酯,而对本发明的效果没有影响。
[0048]
另外,脂肪酸或甘油三酯可以在抑制阿哌沙班药物晶体的形成中起作用。
[0049]
如本文所用,术语“脂肪酸”系指具有饱和或不饱和脂肪链的化合物,并且系指具有至少一个羧基的化合物。能够将脂肪酸用在本发明中,因为其i)是药物可接受的,ii)具有能够与阿哌沙班形成氢键的羧基基团,iii)在卤素有机溶剂中显示出高溶解度。具体地,脂肪酸可以是含有一个或多个羧基基团的c
12-18
脂肪酸,其具有35℃或更高的熔点,该熔点是在制备微球时用于蒸发有机溶剂的最低温度,更具体地,其可以是硬脂酸、棕榈酸或月桂酸,甚至更具体地是硬脂酸或月桂酸,但不限于此。
[0050]
如本文所用,术语“甘油三酯”系指经由酯键由三个脂肪酸与甘油形成的化合物。能够将甘油三酯用在本发明中,因为其i)是药物可接受的,ii)具有能够与阿哌沙班形成氢键的酯基,iii)在卤素有机溶剂中显示出高溶解度。具体地,甘油三酯可以是经由酯键由室温下固体形式的具有至少10个碳原子的三个脂肪酸与甘油形成的甘油三酯,更具体地,其可以是甘油三癸酸酯、甘油三十一酸酯、甘油三月桂酸酯、甘油三肉豆蔻酸酯、甘油三棕榈酸酯或甘油三硬脂酸酯。更具体地,其可以是具有35℃或更高的熔点的甘油三月桂酸酯,该熔点为制备微球时用于蒸发有机溶剂的最低温度,但不限于此。
[0051]
在本发明的一具体实施方案中,确认了当使用不添加脂肪酸或甘油三酯的通常的分散相制备负载阿哌沙班的微球时,不能制备微球,因为阿哌沙班快速沉淀到水相中以形成针状晶体(图4和5)。
[0052]
如本文所用,术语“分散相”系指在油包水相中微球的情况下用于构成内部水相的组分、在水包油相中的微球的情况下用于构成内部油相的组分、在水包油相中微球的情况下用于构成内部油相的组分、以及在水包油包水相中微球的情况下用于构成油包水乳液或最初乳液的组分,并且因此系指用于制备微球的组分的不包括外部相的内部相,即药物和聚合物溶解或分散形式的混合物。
[0053]
在本发明中,分散相可以包括生物相容性聚合物和卤素有机溶剂。
[0054]
如本文所用,术语“生物相容性聚合物”系指在将其体内给予时,已确保其体内安全性并且不引起高的细胞毒性和炎症反应的聚合物,并且在本文中也将其简称为聚合物。
[0055]
用于本发明的生物相容性聚合物具体可以是聚酯,并且更具体地,聚酯可以是选自聚乳酸-羟基乙酸共聚物(plga)、聚乳酸(pla)和聚己内酯(pcl)中的任一种或多种,但不限于此。
[0056]
如本文所用,术语“卤素有机溶剂”系指含有卤素基团元素,如f、cl、br或i的有机溶剂。在阿哌沙班的情况下,与其他常见疏水性药物不同,阿哌沙班在非卤素有机溶剂中具有低溶解度,并且因此非卤素有机溶剂不能用于制备阿哌沙班微球。
[0057]
在本发明中,只要卤素有机溶剂对本发明的效果没有影响,其就能够用于制备微球并且不限制其类型。具体地,卤素有机溶剂可以是二氯甲烷(ch2cl2)、氯仿(chcl3)、四氯化碳(ccl4),更具体地可以是二氯甲烷,但不限于此。
[0058]
在本发明的一具体实施方案中,阿哌沙班不溶于非卤素有机溶剂,如乙酸乙酯、甲酸乙酯、丙酸甲酯和乙醇,从而确认了不能将非卤素有机溶剂用于制备负载阿哌沙班的微球(图1)。相反地,阿哌沙班暂时溶于二氯甲烷、卤素有机溶剂,证实了应将卤素有机溶剂用于制备负载阿哌沙班的微球(图2和3)。
[0059]
在本发明中,分散相可以含有相对于生物相容性聚合物的10%至50%重量比的量的阿哌沙班或其药物可接受的盐,但不限于此。
[0060]
如果含有小于相对于生物相容性聚合物的10%重量比的量的阿哌沙班或其药物可接受的盐,则在最终获得的微球中包含少量阿哌沙班,增加体内给予微球的量;因此,其在临床上可能难以使用。相反地,如果含有大于相对于生物相容性聚合物的50%重量比的量的阿哌沙班或其药物可接受的盐,则可能不能抑制阿哌沙班从微球中初始突释。
[0061]
在本发明中,分散相可以含有相对于生物相容性聚合物的50%重量比或更少量的脂肪酸或甘油三酯,但不限于此。
[0062]
如果含有大于相对于生物相容性聚合物的50%重量比的量的脂肪酸或甘油三酯,则可以在制备微球时减少微球的硬度,使得可以制备非球形颗粒。微球的硬度和形状不规则性的降低可能导致质量问题,例如物理化学稳定性降低和药物释放速率的改变。
[0063]
在本发明中,分散相可以含有相对于卤素有机溶剂5w/v%至30w/v%的量的生物相容性聚合物,但不限于此。
[0064]
如果含有小于相对于卤素有机溶剂5w/v%的量的生物相容性聚合物,并且将微流控法用作微球制备方法的示例,则注射时间可能延长,因为为了使用相同量的聚合物,组分的体积增加。此外,由于分散相的粘度降低,可以发生低药物包封率和低效的溶剂去除。相反地,如果含有大于相对于卤素有机溶剂30w/v%的量的生物相容性聚合物,则粘度可能变得非常高,从而对微球的制备施加约束。
[0065]
制备基于生物相容性聚合物的负载阿哌沙班的微球的方法包括使用微流控法制备微球。
[0066]
本发明人已确认是否能够使用溶剂蒸发法、喷雾干燥法、溶剂提取法和微流控法制备负载阿哌沙班的微球,所述方法是微球的已知制备方法。
[0067]
在本发明的一具体实施方案中,确认了阿哌沙班在非卤素有机溶剂乙酸乙酯、甲酸乙酯、丙酸甲酯和乙醇中的溶解度非常低(图1),而阿哌沙班在卤素有机溶剂二氯甲烷中
的溶解度非常高(图2和3)。
[0068]
从这些结果发现,不能通过主要使用非卤素有机溶剂制备微球的喷雾干燥法和溶剂提取来制备负载阿哌沙班的微球,并且应当通过主要使用卤素有机溶剂制备微球的溶剂蒸发法或微流控法来制备含有阿哌沙班的微球。
[0069]
在本发明的一具体实施方案中,当使用未加入脂肪酸或甘油三酯的通常的分散相制备负载阿哌沙班的微球时,观察到在溶剂蒸发法和微流控法中,在由分散相形成的液滴(油相)的水相分散开始的同时,阿哌沙班快速沉淀到水相中以形成针状晶体(图4和5)。
[0070]
从这些结果发现,发现不能使用通常的分散相和溶剂蒸发法以及通常的分散相和微流控法制备基于生物相容性聚合物的负载阿哌沙班的微球。
[0071]
在本发明的一具体实施方案中,当使用加入脂肪酸或甘油三酯的分散相通过溶剂蒸发法制备负载阿哌沙班的微球时,观察到阿哌沙班快速沉淀到水相中以形成针状晶体(图6)。
[0072]
从这些结果发现,即使当添加脂肪酸或甘油三酯时,也不能通过溶剂蒸发法制备基于生物相容性聚合物的负载阿哌沙班的微球。
[0073]
在本发明的一具体实施方案中,当使用加入脂肪酸或甘油三酯的分散相通过微流控法制备负载阿哌沙班的微球时,发现能够获得基于生物相容性聚合物的含有阿哌沙班的微球,并没有观察到药物沉淀。
[0074]
从这些结果发现,只有当脂肪酸或甘油三酯添加到分散相中并且使用微流控法时,能够制备基于生物相容性聚合物的负载阿哌沙班的微球。
[0075]
本发明的基于生物相容性聚合物的负载阿哌沙班的微球可以包含5%至30%重量比的量的阿哌沙班。具体地,其可以含有5%至30%重量比、8%至28%重量比、10%至25%重量比、12%至22%重量比,并且更具体地15%至20%重量比的量的阿哌沙班,但是该量不限于此。
[0076]
在本发明的一具体实施方案中,确认了本发明提供的实施例1至6的微球含有15%至20%重量比的量的高含量的阿哌沙班(表2)。
[0077]
在本发明中,微流控法的具体条件,例如分散相和连续相的注射流速、搅拌速率、用作水相的溶液的类型等能够由本领域技术人员适当地选择,并且只要能够制备负载阿哌沙班的微球,任何具体条件都可以包括在本发明的范围内而没有限制。
[0078]
本发明的制备基于生物相容性聚合物的负载阿哌沙班的微球的方法还可以包括通过微流控法制备微球之后微球的通常的洗涤和干燥过程。具体地,该方法还可以包括过滤所制备的微球并用水洗涤,以及冷冻干燥或真空干燥洗涤的微球,但不限于此。
[0079]
本发明的另一方面提供了通过上述制备方法制备的基于生物相容性聚合物的负载阿哌沙班的微球。
[0080]
实施发明的方式
[0081]
将以实施例的方式更详细地描述本发明。然而,这些实施例仅用于说明性目的给出,并且本发明的范围不限于这些实施例或由这些实施例限制。
[0082]
实验例1.阿哌沙班在非卤素有机溶剂中的溶解
[0083]
将25mg阿哌沙班分别加入到1ml的乙酸乙酯、甲酸乙酯、丙酸甲酯和乙醇中并搅拌。作为结果,确认了阿哌沙班未溶于四种有机溶剂(图1)。
[0084]
从这些结果发现,非卤素有机溶剂中阿哌沙班的溶解度非常低,因此不能通过主要使用非卤素有机溶剂制备微球的喷雾干燥法和溶剂提取法来制备负载阿哌沙班的微球。
[0085]
实验例2.阿哌沙班在卤素有机溶剂中的溶解
[0086]
将25mg阿哌沙班溶于1ml二氯甲烷中,12小时后对混合物拍照。作为结果,发现二氯甲烷中形成了阿哌沙班晶体(图2)。
[0087]
另外,在光学显微镜下观察晶体,作为结果,发现形成针状结构(图3)。
[0088]
从这些结果发现,即使阿哌沙班暂时溶于二氯甲烷,由于阿哌沙班的高结晶度,其随时间推移在溶剂中重结晶。
[0089]
实验例3.使用通常的分散相制备负载阿哌沙班的微球
[0090]
实验例3-1.使用溶剂蒸发法制备负载阿哌沙班的微球(比较例1)
[0091]
通过将25mg的阿哌沙班和100mg的pla r202h同时溶于1ml二氯甲烷来制备分散相,然后使用高剪切混合器(silverson,l5m-a)将所得物分散于1%聚乙烯醇(pva)溶液中,将其以1,500rpm搅拌。具体地,阿哌沙班快速沉淀到水相中,在开始分散的同时形成针状晶体(图4)。
[0092]
从这些结果发现,当使用通常的分散相和溶剂蒸发时,不能制备负载阿哌沙班的微球。
[0093]
实验例3-2.使用微流控法制备负载阿哌沙班的微球(比较例2)
[0094]
通过在1ml二氯甲烷中同时溶解25mg的阿哌沙班和100mg的pla r202h来制备分散相,然后以0.01ml/min的流速将所得物喷射到微流体芯片(白云石、3d聚焦亲水芯片)中。具体地,将1%pva溶液用作连续相,其以0.1ml/min的流速与分散相同时注入,并且在1%pva溶液中获得在微流体芯片内形成的液滴,将其以150rpm搅拌。随后,在光学显微镜下观察由此获得的微球液滴,并且作为结果,确认了形成大量针状晶体(图5)。
[0095]
从这些结果发现,当使用通常的分散相和微流控法时,不能制备负载阿哌沙班的微球。
[0096]
为了尽可能多地将微球与药物晶体分离,使用75μm网筛用纯水将混合物洗涤三次。使用膜滤器再获得分离的微球,然后冷冻干燥2天,以获得干燥的微球。
[0097]
实验例4.使用溶剂蒸发法制备负载阿哌沙班的微球(比较例3)
[0098]
通过将25mg的阿哌沙班、100mg的pla r202h和25mg的硬脂酸同时溶于1ml二氯甲烷来制备分散相,然后使用高剪切混合器(silverson,l5m-a)将所得物分散于1%聚乙烯醇(pva)溶液中,将其以1,500rpm搅拌。具体地,阿哌沙班快速沉淀到水相中,在开始分散的同时形成针状晶体(图6)。
[0099]
从这些结果发现,即使当脂肪酸或甘油三酯添加到分散相时,也不能通过溶剂蒸发法来制备负载阿哌沙班的微球。
[0100]
实验例5.使用本发明的制备方法制备负载阿哌沙班的微球
[0101]
实验例5-1.负载阿哌沙班的微球的制备(实施例1)
[0102]
通过在1ml二氯甲烷中同时溶解25mg的阿哌沙班、100mg的pla r202h以及25mg的硬脂酸来制备分散相,然后以0.01ml/min的流速将所得物喷射到微流体芯片(白云石、3d聚焦亲水芯片)中。具体地,将1%pva溶液用作连续相,其以0.1ml/min的流速与分散相同时注入,并且在1%pva溶液中获得在微流体芯片内形成的液滴,将其以150rpm搅拌。随后,在光
学显微镜下观察由此获得的微球液滴,并且作为结果,没有观察到从微球液滴中沉淀的药物(图7)。
[0103]
将微球液滴在35℃下进一步搅拌2小时以使有机溶剂挥发。在去除有机溶剂之后,使用膜滤器熟化微球,然后通过冷冻干燥干燥2天,以获得干燥的微球。
[0104]
实验例5-2.负载阿哌沙班的微球的制备(实施例2)
[0105]
通过在1ml二氯甲烷中同时溶解25mg的阿哌沙班、100mg的plga rg753h以及25mg的硬脂酸来制备分散相,然后以0.01ml/min的流速将所得物喷射到微流体芯片(白云石、3d聚焦亲水芯片)中。具体地,将1%pva溶液用作连续相,其以0.1ml/min的流速与分散相同时注入,并且在1%pva溶液中获得在微流体芯片内形成的液滴,将其以150rpm搅拌。随后,在光学显微镜下观察由此获得的微球液滴,并且作为结果,没有观察到从微球液滴中沉淀的药物(图8)。
[0106]
将微球液滴在35℃下进一步搅拌2小时以使有机溶剂挥发。在去除有机溶剂之后,使用膜滤器熟化微球,然后通过冷冻干燥干燥2天,以获得干燥的微球。
[0107]
实验例5-3.负载阿哌沙班的微球的制备(实施例3)
[0108]
通过在1ml二氯甲烷中同时溶解25mg的阿哌沙班、100mg的plga rg503h以及25mg的硬脂酸来制备分散相,然后以0.01ml/min的流速将所得物喷射到微流体芯片(白云石、3d聚焦亲水芯片)中。具体地,将1%pva溶液用作连续相,其以0.1ml/min的流速与分散相同时注入,并且在1%pva溶液中获得在微流体芯片内形成的液滴,将其以150rpm搅拌。随后,在光学显微镜下观察由此获得的微球液滴,并且作为结果,没有观察到从微球液滴中沉淀的药物(图9)。
[0109]
将微球液滴在35℃下进一步搅拌2小时以使有机溶剂挥发。在去除有机溶剂之后,使用膜滤器熟化微球,然后通过冷冻干燥干燥2天,以获得干燥的微球。
[0110]
实验例5-4.负载阿哌沙班的微球的制备(实施例4)
[0111]
通过在1ml二氯甲烷中同时溶解25mg的阿哌沙班、100mg的plga rg503h以及25mg的月桂酸来制备分散相,然后以0.01ml/min的流速将所得物喷射到微流体芯片(白云石、3d聚焦亲水芯片)中。特别地,将1%pva溶液用作连续相,其以0.1ml/min的流速与分散相同时注入,并且在1%pva溶液中获得在微流体芯片内形成的液滴,将其以150rpm搅拌。随后,在光学显微镜下观察由此获得的微球液滴,并且作为结果,没有观察到从微球液滴中沉淀的药物(图10)。
[0112]
将微球液滴在35℃下进一步搅拌2小时以使有机溶剂挥发。在去除有机溶剂之后,使用膜滤器熟化微球,然后通过冷冻干燥干燥2天,以获得干燥的微球。
[0113]
实验例5-5.负载阿哌沙班的微球的制备(实施例5)
[0114]
通过在1ml二氯甲烷中同时溶解25mg的阿哌沙班、90mg的plga rg753h、10mg的pcl(平均分子量为45,000g/mol)以及25mg的硬脂酸来制备分散相,然后以0.01ml/min的流速将所得物喷射到微流体芯片(白云石、3d聚焦亲水芯片)中。具体地,将1%pva溶液用作连续相,其以0.1ml/min的流速与分散相同时注入,并且在1%pva溶液中获得在微流体芯片内形成的液滴,将其以150rpm搅拌。随后,在光学显微镜下观察由此获得的微球液滴,并且作为结果,没有观察到从微球液滴中沉淀的药物(图11)。
[0115]
将微球液滴在35℃下进一步搅拌2小时以使有机溶剂挥发。在去除有机溶剂之后,
使用膜滤器熟化微球,然后通过冷冻干燥干燥2天,以获得干燥的微球。
[0116]
实验例5-6.负载阿哌沙班的微球的制备(实施例6)
[0117]
通过在1ml二氯甲烷中同时溶解25mg的阿哌沙班、90mg的plga rg753h、10mg的pla r202h以及25mg的硬脂酸来制备分散相,然后以0.01ml/min的流速将所得物喷射到微流体芯片(白云石、3d聚焦亲水芯片)中。具体地,将1%pva溶液用作连续相,其以0.1ml/min的流速与分散相同时注入,并且在1%pva溶液中获得在微流体芯片内形成的液滴,将其以150rpm搅拌。随后,在光学显微镜下观察由此获得的微球液滴,并且作为结果,没有观察到从微球液滴中沉淀的药物(图12)。
[0118]
将微球液滴在35℃下进一步搅拌2小时以使有机溶剂挥发。在去除有机溶剂之后,使用膜滤器熟化微球,然后通过冷冻干燥干燥2天,以获得干燥的微球。
[0119]
实验例5-7.负载阿哌沙班的微球的制备(实施例7)
[0120]
通过在1ml二氯甲烷中同时溶解25mg的阿哌沙班、100mg的plga rg503h、10mg的pla r202h以及18.7mg的甘油三月桂酸酯来制备分散相,然后以0.01ml/min的流速将所得物喷射到微流体芯片(白云石、3d聚焦亲水芯片)中。具体地,将1%pva溶液用作连续相,其以0.1ml/min的流速与分散相同时注入,并且在1%pva溶液中获得在微流体芯片内形成的液滴,将其以150rpm搅拌。随后,在光学显微镜下观察由此获得的微球液滴,并且作为结果,没有观察到从微球液滴中沉淀的药物(图13)。
[0121]
将微球液滴在35℃下进一步搅拌2小时以使有机溶剂挥发。在去除有机溶剂之后,使用膜滤器熟化微球,然后通过冷冻干燥干燥2天,以获得干燥的微球。
[0122]
从这些结果发现,只能使用加入脂肪酸或甘油三酯的分散相以及微流控法来制备负载阿哌沙班的微球。
[0123]
实验例6.负载阿哌沙班的微球中药物含量的分析
[0124]
为了测量与在实验例3中制备的比较例1和2、实验例4中制备的比较例3以及实验例5中制备的实施例1至7对应的冻干微球的药物含量,将1mg最后冻干的微球溶于乙腈中并使用0.45μm的pvdf注射器式过滤器过滤,然后根据下表1中所示的条件使用hplc-uv设备进行定量分析。
[0125]
[表1]
[0126]
移动相水:acn(60:40)柱ymc-triart c18柱,c18(150x 4.0mm id),s-5μm流速1ml/min柱温度20℃波长281nm注射体积20μl
[0127]
通过下式(1)计算包封在微球中的药物的含量。
[0128]
药物含量=由hplc分析的药物浓度(mg/ml)
÷
1mg/ml
×
100(%)-(1)
[0129]
表2中示出了分析通过式(1)计算出的微球中的阿哌沙班含量的结果。
[0130]
[表2]
[0131][0132]
具体地,在比较例1和3的情况下,由于药物晶体的高含量,难以去除药物晶体,因此,不可能测量微球中阿哌沙班的含量。在比较例2的情况下,通过使用75μm网筛用水洗涤三次,然后冷冻干燥来尽可能多地去除药物晶体而获得的微球被用来测量微球中阿哌沙班的含量。
[0133]
作为结果,确认了通过本发明提供的制备方法制备的实施例1至7的微球能够含有15%至20%的量的高含量的阿哌沙班。
[0134]
从这些结果发现,即使在冷冻干燥之后,也将阿哌沙班良好地包封在通过本发明所提供的制备方法制备的微球中。
[0135]
虽然已经参考特定说明性实施方案描述了本发明,但是本发明所属的本领域的技术人员将理解,本发明可以在不脱离本发明的技术精神或基本特征的情况下以其他具体形式体现。因此,上述实施方案在所有方面都被认为是说明性的而不是限制性的。此外,本发明的范围由所附权利要求书而不是具体实施方式限定,并且应当理解,来源于本发明的含义和范围的所有修改或变型及其等同物均包括在所附权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1