经修饰的间隙子寡核苷酸及其使用方法与流程
经修饰的间隙子寡核苷酸及其使用方法
1.相关申请案的交叉引用
2.本技术案要求以下的优先权:2019年12月4日提交的美国临时申请案第62/943,532号、2019年11月19日提交的美国临时申请案第62/937,760号和2019年5月31日提交的美国临时申请案第62/855,793号,其公开内容以全文引用的方式并入本文中。
背景技术:
3.全世界约3亿人长期受hbv影响。hbsag缺失,一种是许多新颖疗法的目标的“功能性治愈”的关键方面。已证实反义寡核苷酸是在降低动物模型中的hbsag方面的有效模式,且正用这些分子进行临床研究。
4.然而,用反义寡核苷酸治疗hbv仍受到例如核酸酶降解和肝毒性影响。因此,所属领域中需要研发对核酸酶降解具有更高抗性且具有经改进的肝安全概况的反义寡核苷酸。
技术实现要素:
5.本公开涉及含有寡核苷酸的化合物和组合物和其在预防或治疗疾病和病状(例如b型肝炎(hbv))方面的用途。
6.一些实施例包含一种治疗患有b型肝炎病毒(hbv)感染的个体的方法,所述方法包括向所述个体投与第一反义寡核苷酸(aso)和第二aso,其中所述第一aso和所述第二aso各自独立地含有14-22个核苷酸单元,且所述第一aso和所述第二aso各自独立地含有:(a)中心区(b'),其包括6个或更多个连续dna核苷;(b)5'-翼区(a'),其包括2到6个锁核苷或2'取代的核苷;和(c)3'-翼区(c'),其包括2到6个锁核苷或2'取代的核苷,其中所述第一aso与hbv的第一x区或第一s区中的病毒目标rna序列互补或杂交,且所述第二aso与hbv的第二x区或第二s区中的病毒目标rna序列互补或杂交。
7.在一些实施例中,治疗患有b型肝炎病毒(hbv)感染的个体的方法包括向所述个体投与第一反义寡核苷酸(aso),其中所述第一aso含有14-22个核苷酸单元,且所述第一aso含有:(a)中心区(b'),其包括6个或更多个连续dna核苷;(b)5'-翼区(a'),其包括2到6个锁核苷或2'取代的核苷;和(c)3'-翼区(c'),其包括2到6个锁核苷或2'取代的核苷,其中所述第一aso与hbv的第一x区或第一s区中的病毒目标rna序列互补或杂交。在一些实施例中,所述方法进一步包括向所述个体投与第二aso,其中所述第二aso含有14-22个核苷酸单元,且所述第二aso含有:(a)中心区(b'),其包括6个或更多连续dna核苷;(b)5'-翼区(a'),其包括2到6个锁核苷或2'取代的核苷;和(c)3'-翼区(c'),其包括2到6个锁核苷或2'取代的核苷,且所述第二aso与hbv的第二x区或第二s区中的病毒目标rna序列互补或杂交。
8.在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述5'-翼区包括2到6个硫代磷酸酯连接的锁核苷。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述5'-翼区包括2到6个硫代磷酸酯连接的2'取代的核苷。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述5'-翼区包括至少一个锁核苷和至少一个2'取代的核苷,其中所述锁核苷和所述2'取代的核苷通过硫代磷酸酯连接子连接。在一些实施例中,
所述第一aso和所述第二aso中的至少一个的所述5'-翼区进一步包括rna核苷或dna核苷,其中所述rna核苷和dna核苷不是锁核苷或2'取代的核苷。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述5'-翼区的至少两个核苷通过硫代磷酸酯连接子连接。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述5'-翼区的至少2、3、4、5或6个核苷通过硫代磷酸酯连接子连接。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述3'-翼区包括2到6个硫代磷酸酯连接的锁核苷。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述3'-翼区包括2到6个硫代磷酸酯连接的2'取代的核苷。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述3'-翼区包括至少一个锁核苷和至少一个2'取代的核苷,其中所述锁核苷和所述2'取代的核苷通过硫代磷酸酯连接子连接。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述3'-翼区进一步包括rna核苷或dna核苷,其中所述rna核苷和dna核苷不是锁核苷或2'取代的核苷。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述3'-翼区的至少两个核苷通过硫代磷酸酯连接子连接。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述3'-翼区的至少2、3、4、5或6个核苷通过硫代磷酸酯连接子连接。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述中心区包括至少5个连续硫代磷酸酯连接的dna核苷。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述中心区的至少2、3、4、5或6个核苷通过硫代磷酸酯连接子连接。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述中心区的dna核苷通过硫代磷酸酯连接子与所述第一aso和所述第二aso中的至少一个的5'-翼区的核苷连接。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述中心区的dna核苷通过硫代磷酸酯连接子与所述第一aso和所述第二aso中的至少一个的3'-翼区的核苷连接。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述中心区各自独立地包括8到10个连续硫代磷酸酯连接的dna核苷。在一些实施例中,所述锁核苷选自lna、scpbna、amna(n-h)、amna(n-me)、guna、guna(n-r),其中r选自me、et、i-pr、t-bu和其组合。在一些实施例中,所述第二aso与hbv的所述第二x区中的所述病毒目标rna序列互补或杂交。在一些实施例中,所述第二aso与hbv的所述s区中的所述病毒目标rna序列互补或杂交。在一些实施例中,所述第一aso和/或所述第二aso进一步包括靶向基团。在一些实施例中,靶向基团包括galnac部分。在一些实施例中,第一和第二aso各自独立地含有14-18个核苷酸单元。在一些实施例中,第一和第二aso是同时投与。在一些实施例中,第一和第二aso是连续地投与。在一些实施例中,个体是哺乳动物。在一些实施例中,哺乳动物是成人。在一些实施例中,治疗包括减少个体中的hbv病毒负荷。在一些实施例中,治疗包括降低个体中的病毒抗原的含量。在一些实施例中,第一aso包括与选自表1、2a、3、4、7、8、9、10、11、13、14或19中列举的序列的核苷酸序列至少90%一致的核苷酸序列。在一些实施例中,第二aso包括与选自表1、2a、3、4、7、8、9、10、11、13、14或19中的序列的核苷酸序列至少90%一致的核苷酸序列。在一些实施例中,第一aso包括与seq id no:2-428中的任一个的核苷酸序列至少90%一致的核苷酸序列。在一些实施例中,第二aso包括与seq id no:2-428中的任一个的核苷酸序列至少90%一致的核苷酸序列。在一些实施例中,第一aso是aso 120或aso 121。在一些实施例中,第二aso是aso 120或aso 121。
9.一些实施例包含包括第一反义寡核苷酸(aso)和第二aso的药物组合物,其中所述第一aso和所述第二aso各自独立地含有14-22个核苷酸单元,且所述第一aso和所述第二
aso各自独立地含有:(a)中心区(b'),其包括6个或更多个连续dna核苷;(b)5'-翼区(a'),其包括2到6个锁核苷或2'取代的核苷;和(c)3'-翼区(c'),其包括2到6个锁核苷或2'取代的核苷,其中所述第一aso与hbv的第一x区中的病毒目标rna序列互补或杂交,且所述第二aso与hbv的第二x区或s区中的病毒目标rna序列互补或杂交。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述5'-翼区进一步包括rna核苷或dna核苷,其中所述rna核苷和dna核苷不是锁核苷或2'取代的核苷。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述5'-翼区的至少2、3、4、5或6个核苷通过硫代磷酸酯连接子连接。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述3'-翼区进一步包括rna核苷或dna核苷,其中所述rna核苷和dna核苷不是锁核苷或2'取代的核苷。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述3'-翼区的至少2、3、4、5或6个核苷通过硫代磷酸酯连接子连接。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述中心区的至少2、3、4、5、6、7、8、9、10、11或12个核苷通过硫代磷酸酯连接子连接。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述中心区的dna核苷通过硫代磷酸酯连接子与所述第一aso和所述第二aso中的至少一个的5'-翼区的核苷连接。在一些实施例中,所述第一aso和所述第二aso中的至少一个的所述中心区的dna核苷通过硫代磷酸酯连接子与所述第一aso和所述第二aso中的至少一个的3'-翼区的核苷连接。
10.其它实施例包含反义寡核苷酸,其包括与选自表1、2a、3、4、7、8、9、10、11、13、14或19中列举的序列的核苷酸序列至少90%一致的核苷酸序列。在一些实施例中,aso进一步包括靶向部分。在一些实施例中,靶向部分包括galnac部分。在一些实施例中,靶向部分包括通过连接子连接的三个连续galnac部分。
11.其它实施例包含反义寡核苷酸,其包括与seq id no:2-428中的任一个的核苷酸序列至少90%一致的核苷酸序列。在一些实施例中,aso进一步包括靶向部分。在一些实施例中,靶向部分包括galnac部分。在一些实施例中,靶向部分包括通过连接子连接的三个连续galnac部分。
12.额外实施例包含一种治疗患有b型肝炎病毒(hbv)感染的个体的方法,其包括向个体投与治疗有效量的如前述实施例中任一个的一或多种aso。
13.一些实施例包含如前述实施例中任一个的方法,其进一步包括向患者投与额外hbv治疗剂,如核苷酸类似物、衣壳装配调节剂或另一寡核苷酸。在一些实施例中,额外hbv治疗剂选自由以下组成的群:包括stops
tm alg-010133、衣壳装配调节剂alg-000184、重组干扰素α2b、ifn-a、peg-ifn-a-2a、拉米夫定(lamivudine)、替比夫定(telbivudine)、阿德福韦酯(adefovir dipivoxil)、克来夫定(clevudine)、恩替卡韦(entecavir)、替诺福韦艾拉酚胺(tenofovir alafenamide)、替诺福韦二吡呋酯(tenofovir disoproxil)、nvr3-778、bay41-4109、jnj-632、jnj-3989(aro-hbv)、rg6004、gsk3228836、rep-2139、rep-2165、ab-729、vir-2218、dcr-hbvs、jnj-6379、gls4、abi-ho731、jnj-440、nz-4、rg7907、edp-514、ab-423、ab-506、abi-h03733和abi-h2158。在一些实施例中,所述galnac部分包括一个galnac部分或通过连接子连接的三个连续galnac部分,其中所述galnac部分是galnac-4或galnac-6。
14.一些实施例包含如前述实施例中任一个的方法,其中所述患者已用额外hbv治疗剂治疗,如核苷酸类似物、衣壳装配调节剂或另一寡核苷酸。
附图说明
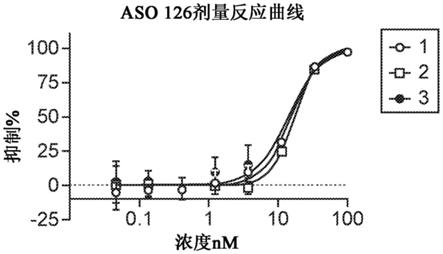
15.图1a显示来自三个实验的hepg2.215细胞中的aso 126的剂量反应曲线。
16.图1b显示来自三个实验的hepg2.215细胞中的aso 120的剂量反应曲线。
17.图1c显示来自三个实验的hepg2.215细胞中的aso 124的剂量反应曲线。
18.图2a显示来自三个实验的hepg2.215细胞中的aso 127的剂量反应曲线。
19.图2b显示来自三个实验的hepg2.215细胞中的aso 121的剂量反应曲线。
20.图2c显示来自三个实验的hepg2.215细胞中的aso 125的剂量反应曲线。
21.图3a显示来自用aso 120处理的hbv小鼠的血清hbsag的变化图。
22.图3b显示来自用aso 121处理的hbv小鼠的血清hbsag的变化图。
23.图3c显示来自用aso 120处理的hbv小鼠的血清alt的图。
24.图3d显示来自用aso 121处理的hbv小鼠的血清alt的图。
25.图4a显示来自用aso 121或aso 120处理的hbv小鼠的血清hbsag的变化图。
26.图4b显示来自用aso 121或aso 120处理的hbv小鼠的血清alt的图。
27.图4c显示来自用(i)aso 121与aso 120的组合;或(ii)呈单一试剂的aso 123处理的hbv小鼠的血清hbsag的变化图。
28.图4d显示来自用(i)aso 121与aso 120的组合;或(ii)呈单一试剂的aso 123处理的hbv小鼠的血清alt的图。
29.图5a显示来自用1
×
5mg/kg的aso 128、aso 129或aso 120处理的小鼠的血清hbsag的变化图。
30.图5b显示来自用5
×
10mg/kg q3d的aso 128、aso 129或aso 120处理的小鼠的血清hbsag的变化图。
31.图5c显示来自用5
×
10mg/kg q3d的aso 128、aso 129或aso 120处理的小鼠的血清alt的图。
32.图6a显示来自用1
×
5mg/kg的aso 130处理的小鼠的血清hbsag的变化图。
33.图6b显示来自用5
×
10mg/kg q3d的aso 130处理的小鼠的血清hbsag的变化图。
34.图6c显示来自用5
×
10mg/kg q3d的aso 130处理的小鼠的血清alt的图。
35.图7a显示来自用3
×
10mg/kg q3d的aso 131处理的小鼠的血清hbsag的变化图。
36.图7b显示来自用3
×
10mg/kg q3d的aso 131处理的小鼠的血清alt的图。
37.图8a显示来自用5
×
10mg/kg q3d的aso 121处理的小鼠的血清hbsag的变化图。
38.图8b显示来自用5
×
10mg/kg q3d的aso 121处理的小鼠的血清alt的图。
39.图9a显示来自用单一剂量aso 120、aso 131,和以1:1、2:1和3:1质量比的aso 120与aso 131的组合处理的小鼠的血清hbeag的变化图。
40.图9b显示来自用单一剂量aso 120、aso 121,和以1:1、2:1和3:1质量比的aso 120与aso 121的组合处理的小鼠的血清hbeag的变化图。
41.图10a显示来自用3
×
10mg/kg qw的aso 133-136和137a处理的小鼠的血清hbsag的变化图。
42.图10b显示来自用3
×
10mg/kg qw的aso 133-136和137a处理的小鼠的血清alt的图。
43.图11a显示来自用3
×
10mg/kg qw的aso 138或153处理的小鼠的血清hbsag的变化
图。
44.图11b显示来自用3
×
10mg/kg qw的aso 138或153处理的小鼠的血清alt的图。
45.图12a显示来自用3
×
10mg/kg qw的aso 132a或137a处理的小鼠的血清hbsag的变化图。
46.图12b显示来自用3
×
10mg/kg qw的aso 132a或137a处理的小鼠的血清alt的图。
47.图13a显示来自用5
×
10mg/kg q3d的aso 140-142处理的小鼠的血清hbsag的变化图。
48.图13b显示来自用5
×
10mg/kg q3d的aso 140-142处理的小鼠的血清alt的图。
49.图14a显示来自用3
×
10mg/kg q3d的aso 143、144、145a或146处理的小鼠的血清hbsag的变化图。
50.图14b显示来自用3
×
10mg/kg q3d的aso 143、144、145a或146治疗的小鼠的血清alt的图。
51.图15a显示来自用5
×
10mg/kg q3d的aso 148-150处理的小鼠的血清hbsag的变化图。
52.图15b显示来自用5
×
10mg/kg q3d的aso 148-150处理的小鼠的血清alt的图。
53.图16a显示来自用3
×
10mg/kg qw的aso 151-154处理的小鼠的血清hbsag的变化图。
54.图16b显示来自用3
×
10mg/kg qw的aso 151-154处理的小鼠的血清alt的图。
55.图17a显示来自用3
×
10mg/kg q3d的aso 147、155或156处理的小鼠的血清hbsag的变化图。
56.图17b显示来自用3
×
10mg/kg q3d的aso 147、155或156处理的小鼠的血清alt的图。
57.图18a显示来自用5
×
10mg/kg q3d的aso 157-159处理的小鼠的血清hbsag的变化图。
58.图18b显示来自用5
×
10mg/kg q3d的aso 157-159处理的小鼠的血清alt的图。
具体实施方式
59.本公开涉及经修饰的反义寡核苷酸和经修饰的反义寡核苷酸的药物组合物。本公开还涉及使用和制备反义寡核苷酸和药物组合物的方法。
60.本公开化合物
61.本公开化合物包含经修饰的反义寡核苷酸(aso)。在一些实施例中,aso包括14-22个核苷酸单元,例如14、15、16、17、18、19、20、21或22个核苷酸单元。在一些实施例中,aso是包括以下三个区的间隙子:5'-翼区(a'),其包括经修饰的核苷酸;中心区(b'),其包括与翼不同类型的核苷酸,例如能够诱导rna酶h裂解的核苷酸;和3'-翼区(c'),其包括经修饰的核苷酸。
62.在一些实施例中,5'-翼区和3'-翼区包括2-6个核苷酸,例如2、3、4、5或6个核苷酸。这些核苷酸中的一或多个是经修饰的(例如所述核苷酸中的1、2、3、4、5或6个是经修饰的)。另一方面,中心区可包括通过磷酸二酯或硫代磷酸酯(“ps”)核苷酸间键联连接的6个或更多个连续dna核苷。在其它实施例中,中心区包含一或多个经修饰的核苷酸。举例来说,
中心区可包含一或多个经修饰的核苷酸,其中中心区能够诱导rna酶h裂解。在一些实施例中,中心区包含具有经修饰的核碱基的一或多个经修饰的核苷酸。在一些实施例中,中心区包括6、7、8、9、10或11个连续dna核苷。在一些实施例中,中心区中的dna核苷的1、2、3、4、5、6、7、8、9、10或11个是经修饰的。
63.因此,在一些方面中,本公开的间隙子aso化合物包含式(i)化合物:
64.a'—b'—c',
65.其中a'和c'各自独立地包括2-6个核苷酸,其中一或多个是经修饰的核苷酸;b'包括通过磷酸二酯或硫代磷酸酯核苷酸间键联连接的6个或更多个连续dna核苷。在一些实施例中,b'包括一或多个经修饰的dna核苷。在一些实施例中,经修饰的核苷酸选自锁核苷或2'-取代的核苷。在一些实施例中,经修饰的dna核苷选自锁核苷或2'-取代的核苷。
66.在某些方面中,a'、b'和c'中的核苷酸和/或核苷的数量选自以下群组(a':b':c'):(2:10:2)、(2:10:3)、(2:10:4)、(2:10:5)、(3:10:2)、(3:10:3)、(3:10:4)、(3:10:5)、(4:10:2)、(4:10:3)、(4:10:4)、(4:10:5)、(5:10:2)、(5:10:3)、(5:10:4)、(5:10:5)、(2:9:2)、(2:9:3)、(2:9:4)、(2:9:5)、(3:9:2)、(3:9:3)、(3:9:4)、(3:9:5)、(4:9:2)、(4:9:3)、(4:9:4)、(4:9:5)、(5:9:2)、(5:9:3)、(5:9:4)、(5:9:5)、(2:8:2)、(2:8:3)、(2:8:4)、(2:8:5)、(3:8:2)、(3:8:3)、(3:8:4)、(3:8:5)、(4:8:2)、(4:8:3)、(4:8:4)、(4:8:5)、(5:8:2)、(5:8:3)、(5:8:4)、(5:8:5)、(2:7:2)、(2:7:3)、(2:7:4)、(2:7:5)、(3:7:2)、(3:7:3)、(3:7:4)、(3:7:5)、(4:7:2)、(4:7:3)、(4:7:4)、(4:7:5)、(5:7:2)、(5:7:3)、(5:7:4)、(5:7:5)、(2:6:2)、(2:6:3)、(2:6:4)、(2:6:5)、(3:6:2)、(3:6:3)、(3:6:4)、(3:6:5)、(4:6:2)、(4:6:3)、(4:6:4)、(4:6:5)、(5:6:2)、(5:6:3)、(5:6:4)、(5:6:5)。
67.在一些实施例中,5'-翼区包括一或多个锁核苷或2'-取代的核苷。在一些实施例中,3'-翼区包括一或多个锁核苷或2'-取代的核苷。在一些实施例中,中心区包括一或多个锁核苷或2'-取代的核苷。锁核苷可在糖的4'与2'位置之间含有桥接子(bridge),其中所述桥接子包括2到4个任选地取代的原子。举例来说,lna核苷是:
68.其它示范性锁核苷包含以下:(scpbna或“cp”);(amna),其中r是h或烷基(或当r是烷基时,amna(n-me));(guna);或在某些实施例中,5'-翼区中的所有核苷
是锁核苷。在一些实施例中,3'-翼区中的所有核苷是锁核苷。在一些实施例中,3'-翼区包括lna和选自scpbna、amna和guna的一个或两个核苷。在一些实施例中,5'-翼区全部均是lna,且3'-翼区含有lna和选自scpbna、amna和guna的一个或两个核苷。pct/jp2010/068409、pct/jp2013/075370、pct/jp2015/054308、pct/jp2018/006061和/或pct/jp2018/006062中包含其它核苷酸,所述文献以全文引用的方式并入。
69.在一些实施例中,aso的5'-翼区包括2到6个硫代磷酸酯连接的锁核苷。在一些实施例中,5'-翼区包括2到6个硫代磷酸酯连接的2'取代的核苷。在一些实施例中,5'-翼区包括至少一个锁核苷和至少一个2'取代的核苷,其中所述锁核苷和所述2'取代的核苷通过硫代磷酸酯连接子连接。在一些实施例中,5'-翼区进一步包括rna核苷或dna核苷,其中rna核苷和dna核苷不是锁核苷或2'-取代的核苷。在一些实施例中,5'-翼区的至少两个核苷通过硫代磷酸酯连接子连接。在一些实施例中,5'-翼区的至少2、3、4、5或6个核苷通过硫代磷酸酯连接子连接。
70.在一些实施例中,aso的3'-翼区包括2到6个硫代磷酸酯连接的锁核苷。在一些实施例中,3'-翼区包括2到6个硫代磷酸酯连接的2'取代的核苷。在一些实施例中,3'-翼区包括至少一个锁核苷和至少一个2'取代的核苷,其中所述锁核苷和所述2'取代的核苷通过硫代磷酸酯连接子连接。在一些实施例中,3'-翼区进一步包括rna核苷或dna核苷,其中rna核苷和dna核苷不是锁核苷或2'-取代的核苷。在一些实施例中,3'-翼区的至少两个核苷通过硫代磷酸酯连接子连接。在一些实施例中,3'-翼区的至少2、3、4、5或6个核苷通过硫代磷酸酯连接子连接。
71.在某些实施例中,5'-翼区和/或3'-翼区中的核苷酸中的一或多个包括硫代磷酸酯核苷酸间键联。在某些实施例中,5'-翼区中的全部核苷酸均包括硫代磷酸酯核苷酸间键联。在一些实施例中,3'-翼区中的全部核苷酸均包括硫代磷酸酯核苷酸间键联。
72.在一些实施例中,中心区包含具有经修饰的核碱基的一或多个经修饰的核苷酸。举例来说,中心区可包含具有以下的保护或无保护型式的一或多个经修饰的核苷酸:
[0073][0074]
和/或其中r是卤
素或r'-c≡c-;且r'是c
6-12
芳基、5到12元杂芳基、羟基-c
1-6
烷基或c
1-7
烷酰基氧基。在一些实施例中,中心区在第1、第2、第3或第4间隙核苷位置(距5'端)处包含一个经修饰的核苷酸(例如(2s)t或(5oh)c)。在一些实施例中,经修饰的核苷酸是在第3间隙核苷位置(距5'端)处。在一些实施例中,经修饰的核苷酸是具有以下结构的核苷酸:
[0075][0076]
其中:
[0077]
w独立地是o、n或s;
[0078]
r1、r2和r5独立地是h或d;
[0079]
r3是h或f;
[0080]
r4是f或och3;和
[0081]
碱基是
[0082][0083][0084]
其中:
[0085]
r是卤素或r'-c≡c-;和
[0086]
r'表示c
6-12
芳基、5到12元杂芳基、羟基-c
1-6
烷基或c
1-7
烷酰基氧基。
[0087]
在一些实施例中,c
1-7
烷酰基包含(但不限于)甲酰基、乙酰基、乙基羰基、正丙基羰基、异丙基羰基、正丁基羰基、异丁基羰基、叔丁基羰基、正戊基羰基和正己基羰基。其它经修饰的核苷酸包含pct/jp2018/006061中的那些,所述文献以全文引用的方式并入。
[0088]
如本文所用,除非另外指示,否则“芳基”是指具有完全非定域π电子系统的碳环(全碳)环。“芳基”可由两个或更多个稠环(共享两个相邻碳原子的环)构成。当芳基是稠环系统时,那么与分子的其余部分连接的环具有完全非定域π电子系统。稠环系统中的其它环
可具有或可不具有完全非定域π电子系统。芳基的实例包含(但不限于)苯、萘和甘菊环的基团。
[0089]
如本文所用,除非另外指示,否则“杂芳基”是指具有完全非定域π电子系统且在环中含有独立地选自由氮、氧和硫组成的群的一或多个杂原子(例如一到三个杂原子、或一到四个杂原子或一到五个杂原子)的环。“杂芳基”可由两个或更多个稠环(共享两个相邻碳原子的环)构成。当杂芳基是稠环系统时,那么与分子的其余部分连接的环具有完全非定域π电子系统。稠环系统中的其它环可具有或可不具有完全非定域π电子系统。杂芳基环的实例包含(但不限于)呋喃、噻吩、吡咯、恶唑、噻唑、咪唑、吡唑、异恶唑、异噻唑、三唑、噻二唑、吡啶、哒嗪、嘧啶、吡嗪和三嗪。
[0090]
在一些实施例中,aso的中心区包括至少5个连续硫代磷酸酯连接的dna核苷。在一些实施例中,中心区的至少2、3、4、5或6个核苷通过硫代磷酸酯连接子连接。在一些实施例中,中心区的dna核苷通过硫代磷酸酯连接子与5'-翼区的核苷连接。在一些实施例中,中心区的dna核苷通过硫代磷酸酯连接子与3'-翼区的核苷连接。在一些实施例中,中心区包括8到10个连续硫代磷酸酯连接的dna核苷。
[0091]
在一些实施例中,aso与开始于hbv的x区中或hbv的s区中的病毒目标rna序列互补或杂交。病毒目标可例如在acc.kc315400.1(基因型b,“gt b”)中或基因型a、c或d中的任一个中的目标位点的5'端处开始。技术人员应了解hbv位置,例如如宋永健(wing-kin sung)等人,《自然遗传学(nature genetics)》44:765(2012)中所描述。在一些实施例中,s区定义为从小s蛋白(在基因型b kc315400.1分离株中,位置155号)开始到在x蛋白(在基因型b kc315400.1分离株中,位置1373号)开始之前。在一些实施例中,x区定义为从x蛋白(在基因型b kc315400.1分离株中,位置1374号)开始到dr2位点(在基因型b kc315400.1分离株中,位置1603号)结束。
[0092]
在一些实施例中,aso与病毒目标rna序列互补或杂交,所述病毒目标rna序列包括以下、由以下组成或基本上由以下组成:seq id no:1的位置100-800或1050-1700内的至少5、6、7、8、9、10、11、12、13、14或15个连续核苷酸。在一些实施例中,aso与病毒目标rna序列互补或杂交,所述病毒目标rna序列包括以下、由以下组成或基本上由以下组成:seq id no:1的位置100-800或1050-1700内的5到15、5到14、5到13、5到12、5到11、5到10、5到9、5到8、6到15、6到14、6到13、6到12、6到11、6到10、7到15、7到14、7到13、7到12或7到11个连续核苷酸。在一些实施例中,aso与病毒目标rna序列互补或杂交,所述病毒目标rna序列包括以下、由以下组成或基本上由以下组成:seq id no:1的位置180-280、300到450、650到775、1125到1300或1400到1650内的至少5、6、7、8、9、10、11、12、13、14或15个连续核苷酸。在一些实施例中,aso与病毒目标rna序列互补或杂交,所述病毒目标rna序列包括以下、由以下组成或基本上由以下组成:seq id no:1的位置180到215、230到270、350到420、675到730、1165到1210、1245到1290、1400到1480或1500到1630内的至少5、6、7、8、9、10、11、12、13、14或15个连续核苷酸。在一些实施例中,aso与病毒目标rna序列互补或杂交,所述病毒目标rna序列包括以下、由以下组成或基本上由以下组成:起始于seq id no:1的191、245、246、276、376、377、381、383、694、700、1182、1261、1262、1408、1410、1426、1431、1432、1433、1435、1438、1441、1443、1513、1516、1517、1518、1519、1520、1521、1522、1527、1559、1575、1576、1577、1580、1581、1582或1589位置处的至少5、6、7、8、9、10、11、12、13、14或15个连续
核苷酸。在一些实施例中,aso极佳地与病毒目标rna序列互补。在一些实施例中,在aso与病毒目标序列之间存在小于或等于5、4、3、2或1个错配。在一些实施例中,在aso与病毒目标序列之间存在小于或等于2个错配。在一些实施例中,在aso与病毒目标序列之间存在小于或等于1个错配。在一些实施例中,错配是在aso的翼区中。在一些实施例中,错配是在aso的5'翼区中。在一些实施例中,错配是在aso的3'翼区中。在一些实施例中,错配是在aso的中心区中。
[0093]
在一些实施例中,中心区与病毒目标rna序列互补或杂交,所述病毒目标rna序列包括以下、由以下组成或基本上由以下组成:seq id no:1的位置100-800或1050-1700内的至少5、6、7、8、9、10、11、12、13、14或15个连续核苷酸。在一些实施例中,中心区与病毒目标rna序列互补或杂交,所述病毒目标rna序列包括以下、由以下组成或基本上由以下组成:seq id no:1的位置100-800或1050-1700内的5到15、5到14、5到13、5到12、5到11、5到10、5到9、5到8、6到15、6到14、6到13、6到12、6到11、6到10、7到15、7到14、7到13、7到12或7到11个连续核苷酸。在一些实施例中,中心区与病毒目标rna序列互补或杂交,所述病毒目标rna序列包括以下、由以下组成或基本上由以下组成:seq id no:1的位置180-280、300到450、650到775、1125到1300或1400到1650内的至少5、6、7、8、9、10、11、12、13、14或15个连续核苷酸。在一些实施例中,中心区与病毒目标rna序列互补或杂交,所述病毒目标rna序列包括以下、由以下组成或基本上由以下组成:seq id no:1的位置180到215、230到270、350到420、675到730、1165到1210、1245到1290、1400到1480或1500到1630内的至少5、6、7、8、9、10、11、12、13、14或15个连续核苷酸。在一些实施例中,中心区与病毒目标rna序列互补或杂交,所述病毒目标rna序列包括以下、由以下组成或基本上由以下组成:起始于seq id no:1的191、245、246、276、376、377、381、383、694、700、1182、1261、1262、1408、1410、1426、1431、1432、1433、1435、1438、1441、1443、1513、1516、1517、1518、1519、1520、1521、1522、1527、1559、1575、1576、1577、1580、1581、1582或1589位置处的至少5、6、7、8、9、10、11、12、13、14或15个连续核苷酸。在一些实施例中,中心区极佳地与病毒目标rna序列互补。在一些实施例中,在中心区与病毒目标序列之间存在小于或等于5、4、3、2或1个错配。在一些实施例中,在中心区与病毒目标序列之间存在小于或等于2个错配。在一些实施例中,在中心区与病毒目标序列之间存在小于或等于1个错配。
[0094]
以下表1中的特定序列在本公开的范围内。如本文所用,ln=锁核酸(lna);lna=锁核酸(lna)a;ln(5m)c=锁核酸(lna)-5甲基c;lng=锁核酸(lna)g;lnt=锁核酸(lna)t;(5m)c=5甲基c;ma=2-o-甲氧基a;mu=2-o-甲氧基u;(8nh)a=8-氨基a;(8nh)g=8-氨基g;(2s)t=2-硫基t;(5-oh)c=5-羟基c;cp=scp=环丙基;cpc=scpc=环丙基c;cpg=scpg=环丙基g;cpt=scpt=环丙基t;ps=硫代磷酸酯键联。“hbv基因组中的位置”描述acc.kc315400.1(基因型b)中的目标位点的5'端。
[0095]
[0096]
[0097]
[0098]
[0099]
[0100]
[0101][0102]
在一些实施例中,aso包括与选自表1、2a、3、4、7、8、9、10、11、13、14或19中列举的序列的核苷酸序列至少90%一致的核苷酸序列。在一些实施例中,aso是aso 120或aso 121。
[0103]
在一些实施例中,本公开的aso具有与表1、2a、3、4、7、8、9、10、11、13、14或19的aso相差一个核苷的序列。在其它实施例中,aso具有与表1、2a、3、4、7、8、9、10、11、13、14或19的aso相差1、2、3或4个核苷的序列。在一些实施例中,核苷酸序列与选自表1、2a、3、4、7、8、9、10、11、13、14或19的核苷酸序列至少90%一致。在一些实施例中,本公开的aso具有表1、2a、3、4、7、8、9、10、11、13、14或19的序列,但中心区中的一个t被(2s)t置换,中心区中的一个c被(5oh)c置换,和/或中心区中的一个a被(8nh)a置换。在一些实施例中,本公开的aso具有表1、2a、3、4、7、8、9、10、11、13、14或19的序列,但在5'翼部分中具有一个或两个scpbna、amna或guna。在一些实施例中,本公开的aso具有表1、2a、3、4、7、8、9、10、11、13、14或19的序列,但在3'翼部分中具有一个或两个scpbna、amna或guna。在一些实施例中,本公开的aso具有表1、2a、3、4、7、8、9、10、11、13、14或19的序列,但具有与序列的5'端连接的ma或mu。在一些实施例中,本公开的aso具有表1、2a、3、4、7、8、9、10、11、13、14或19的序列,但具有与同galnac衍生物(例如galnac4,如galnac4-(ps)2-p-;或galnac6,如galnac6-(ps)2-p-)连接的序列的5'端连接的ma或mu,如本文中详述。
[0104]
在一些实施例中,aso包括与seq id no:2-428中的任一个的核苷酸序列至少90%一致的核苷酸序列。在一些实施例中,aso包括seq id no:400或404的核苷酸序列。
[0105]
在一些实施例中,本公开的aso具有与seq id no:2-428的核苷酸中的任一个相差一个核苷的序列。在其它实施例中,aso具有与seq id no:2-428的核苷酸中的任一个相差1、2、3或4个核苷的序列。在一些实施例中,核苷酸序列与seq id no:2-428中的任一个的核苷酸序列至少90%一致。在一些实施例中,本公开的aso具有seq id no:2-428中的任一个的序列,但中心区中的一个t被(2s)t置换,中心区中的一个c被(5oh)c置换,和/或中心区中的一个a被(8nh)a置换。在一些实施例中,本公开的aso具有seq id no:2-428中的任一个的序列,但在5'翼部分中具有一个或两个scpbna、amna或guna。在一些实施例中,本公开的aso具有seq id no:2-428中的任一个的序列,但在3'翼部分中具有一个或两个scpbna、amna或
guna。在一些实施例中,本公开的aso具有seq id no:2-428中的任一个的序列,但具有与序列的5'端连接的ma或mu。在一些实施例中,本公开的aso具有seq id no:2-428中的任一个的序列,但具有与同galnac衍生物(例如galnac4,如galnac4-(ps)2-p-;或galnac6,如galnac6-(ps)2-p-)连接的序列的5'端连接的ma或mu,如本文中详述。
[0106]
本公开还涉及与aso结合的额外组分,如靶向部分和在一或多个端处经修饰的寡核苷酸。
[0107]
在一些实施例中,靶向部分可包括碳水化合物,如单醣,例如n-乙酰基半乳糖胺(galnac)、双醣、三醣、四醣、寡醣和多醣。在某些实施例中,靶向部分包括一或多个galnac衍生物,如通过一或多个连接子与aso连接的两个或三个galnac衍生物,任选地呈连续结构。在某些实施例中,靶向部分包括通过连接子连接的三个连续galnac部分,如:
[0108][0109]
在一些实施例中,aso在aso的5'端、3'端或两端处含有靶向部分。
[0110]
在某些实施例中,aso在一或多个端处经乙烯基膦酸酯部分(如5'-乙烯基膦酸酯部分)修饰。
[0111]
组合物
[0112]
本公开还涵盖药物组合物,其包括本公开的aso。一个实施例是一种药物组合物,其包括本公开的一或多种aso和药学上可接受的稀释剂或载剂。
[0113]
在一些实施例中,含有本公开的aso的药物组合物被调配用于通过胃肠外递送而全身性投与。胃肠外投与包含静脉内、动脉内、皮下、腹膜内或肌肉内注射或输注;此外皮下投与,例如通过植入装置。在一优选实施例中,含有本公开的aso的药物组合物被调配用于皮下(sc)或静脉内(iv)递送。胃肠外投与用的调配物可包含无菌水溶液,其还可含有缓冲剂、稀释剂和如由熟练技术人员理解的其它药学上可接受的添加剂。对于静脉内使用,可控制溶质的总浓度以使制剂等渗。
[0114]
含有本公开的aso的药物组合物适用于治疗例如与hbv基因的表达或活性相关联的疾病或病症。
[0115]
在一些实施例中,药物组合物包括:本公开的第一aso,其与hbv的第一x区中的病毒目标rna序列互补或杂交;和本公开的第二aso,其与hbv的第二x区或s区中的病毒目标rna序列互补或杂交;和药学上可接受的稀释剂或载剂。当药物组合物包括两种或更多种aso时,aso可以不同量存在。举例来说,在一些实施例中,第一aso与第二aso的重量比是1:4
到4:1,例如1:4、1:3、1:2、1:1、2:1、3:1或4:1。在一些实施例中,第一aso与第二aso的摩尔比是1:4到4:1,例如1:4、1:3、1:2、1:1、2:1、3:1或4:1。
[0116]
使用方法
[0117]
本公开技术的一个方面包含用于治疗诊断是患有、疑似患有hbv感染和/或hbv相关病症或处于患病风险下的个体的方法。在治疗应用中,向疑似或已罹患这种疾病(例如在个体的血清和/或肝中hbv cccdna的存留、hbv抗原(例如hbsag和/或hbeag)的存在,或hbv病毒负荷含量升高)的个体,以足以治愈或至少部分遏制疾病的症状(包含其并发症和发展疾病中的中间病理性表型)的量,投与包括本公开技术的一或多种aso的组合物。
[0118]
可通过所属领域中已知的任何诊断性或预后分析或其组合来鉴别罹患hbv感染和/或hbv相关病症的个体。举例来说,hbv感染和/或hbv相关病症的典型症状包含(但不限于):肝hbv cccdna的存在、血清和/或肝hbv抗原(例如hbsag和/或hbeag)的存在、alt升高、ast升高、不存在抗hbv抗体或低含量的抗hbv抗体、肝损伤、肝硬化、丁型肝炎、急性b型肝炎、急性爆发性b型肝炎、慢性b型肝炎、肝纤维化、晚期肝病、肝细胞癌、血清疾病样症候群、食欲不振、恶心、呕吐、低度发热、肌痛、疲劳、味觉敏锐度和嗅觉障碍(排斥食物和香烟)、右上部和上腹疼痛(间歇性、轻微到中等)、肝脑病、嗜睡、睡眠模式障碍、精神意识模糊、昏迷、腹水、胃肠道出血、凝血病、黄疸、肝肿大(轻度扩大,软肝)、脾肿大、手掌红斑、蜘蛛痣、肌肉萎缩、蜘蛛血管瘤、脉管炎、静脉曲张出血、周边水肿、男性乳房发育症、睪丸萎缩、腹侧支静脉(脐周静脉曲张(caput medusa))、高含量的丙氨酸转氨酶(alt)和天冬氨酸氨基转移酶(ast)(在1000-2000iu/ml的范围内)、alt含量高于ast含量、γ-谷酰基转肽酶(ggt)和/或碱性磷酸酶(alp)含量升高、白蛋白含量降低、血清铁含量升高、白血球减少症(即粒细胞减少症)、淋巴细胞增多、红血球沉降速率(esr)增加、红血球存活缩短、溶血、血小板减少症、国际标准化比值(inr)延长、血清hbv dna的存在、氨基转移酶升高(《5倍uln)、胆红素含量增加、凝血酶原时间(pt)延长、高球蛋白血症、组织非特异性抗体(如抗平滑肌抗体(asma)或抗核抗体(ana))的存在、组织特异性抗体(如针对甲状腺的抗体)的存在、类风湿性因子(rf)的含量升高、高胆红素血症、低血小板和白血球计数、ast含量高于alt含量、小叶发炎伴有退行性和再生性肝细胞变化、和主要小叶中心坏死。
[0119]
在一些实施例中,用本公开技术的aso组合物处理的个体将显示改善或消除以下病状或症状中的一或多个:肝hbv cccdna的存在、血清和/或肝hbv抗原(例如hbsag和/或hbeag)的存在、不存在抗hbv抗体或低含量的抗hbv抗体、肝损伤、肝硬化、丁型肝炎、急性b型肝炎、急性爆发性b型肝炎、慢性b型肝炎、肝纤维化、晚期肝病、肝细胞癌、血清疾病样症候群、食欲不振、恶心、呕吐、低度发热、肌痛、疲劳、味觉敏锐度和嗅觉障碍(排斥食物和香烟)、右上部和上腹疼痛(间歇性、轻微到中等)、肝脑病、嗜睡、睡眠模式障碍、精神意识模糊、昏迷、腹水、胃肠道出血、凝血病、黄疸、肝肿大(轻度扩大,软肝)、脾肿大、手掌红斑、蜘蛛痣、肌肉萎缩、蜘蛛血管瘤、脉管炎、静脉曲张出血、周边水肿、男性乳房发育症、睪丸萎缩、腹侧支静脉(脐周静脉曲张)、alt含量高于ast含量、白血球减少症(即粒细胞减少症)、白蛋白含量降低、血清铁含量升高、淋巴细胞增多、红血球沉降速率(esr)增加、红血球存活缩短、溶血、血小板减少症、国际标准化比值(inr)延长、血清hbv dna的存在、凝血酶原时间(pt)延长、高球蛋白血症、组织非特异性抗体(如抗平滑肌抗体(asma)或抗核抗体(ana))的存在、组织特异性抗体(如针对甲状腺的抗体)的存在、高胆红素血症、低血小板和白血球计
数、ast含量高于alt含量、小叶发炎伴有退行性和再生性肝细胞变化、和主要小叶中心坏死。
[0120]
本公开提供一种用于治疗诊断是患有或疑似患有hbv感染和/或hbv相关病症的个体的方法,其包括向个体投与有效量的本公开技术的aso组合物。在一些实施例中,方法包括向个体投与本公开的第一aso和本公开的第二aso,其中第一aso与hbv的第一x区中的病毒目标rna序列互补或杂交;且第二aso与hbv的第二x区或s区中的病毒目标rna序列互补或杂交。在一些实施例中,所述第二aso与hbv的所述第二x区中的所述病毒目标rna序列互补或杂交。在其它实施例中,第二aso与hbv的所述s区中的病毒目标rna序列互补或杂交。
[0121]
本公开的aso可用于治疗有需要的个体的疾病。在一些实施例中,治疗有需要的个体的疾病的方法包括向个体投与本文公开的aso中的任一个。在一些实施例中,治疗有需要的个体的疾病的方法包括向个体投与本文所公开的组合物中的任一个。
[0122]
可通过所属领域中已知的方法来进行aso的投与。在一些实施例中,通过皮下(sc)或静脉内(iv)递送投与aso。本公开的制剂(例如aso或组合物)可经口、胃肠外、局部或经直肠给与。其当然以适用于各投与途径的形式给与。举例来说,其以以下形式投与:通过注射、输注或吸入投与,锭剂或胶囊形式投与;局部,洗剂或软膏形式;和经直肠,栓剂形式。在一些实施例中,皮下投与是优选的。
[0123]
如本文所使用,短语“胃肠外投与(parenteral administration/administered parenterally)”意味着除经肠和局部投与之外的投与模式,通常是注射,且包含(但不限于)静脉内、肌肉内、动脉内、鞘内、囊内、眶内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛膜下、脊柱内和胸骨内注射和输注。
[0124]
如本文所用,短语“全身性投与(systemic administration/administered systemically)”、“周边投与(peripheral administration/administered peripherally)”意味着将除直接到中枢神经系统中之外投与化合物、药物或其它材料,使得其进入患者的系统且因此经受代谢和其它类似过程,例如皮下投与。
[0125]
这些化合物可通过任何适合投与途径向人类和其它动物投与以用于治疗,投与途径包含经口、经鼻(如通过例如喷雾)、经直肠、阴道内、胃肠外、脑池内和局部(如通过散剂、软膏或滴剂,包含经颊和舌下)。
[0126]
不管所选择投与途径如何,通过熟练技术人员已知的常规方法,将本公开的化合物(例如aso)(其可以适合的水合形式和/或本公开的药物组合物使用)调配成药学上可接受的剂型。
[0127]
可改变本公开的药物组合物中活性成分的实际剂量水准,以便获得针对特定患者、组合物和投与模式有效地实现所需治疗反应而对患者无毒性的活性成分的量。
[0128]
所选剂量水准将视多种因素而定,包含所用本公开的特定化合物(例如aso)或其酯、盐或酰胺的活性,投与途径,投与时间,所用特定化合物的排泄或代谢速率,吸收速率和程度,治疗持续时间,与所用特定化合物组合使用的其它药物、化合物和/或材料,所治疗患者的年龄、性别、体重、病状、一般健康状况和先前病史,以及医学技术中熟知的类似因素。
[0129]
具有本领域的普通技术的医师或兽医可容易地确定和开具所需药物组合物的有效量。举例来说,医师或兽医可以低于为实现所需治疗效果所需的含量的药物组合物中所用的本公开化合物(例如aso)的剂量开始,且逐渐增加剂量直到实现所需效果。
[0130]
一般来说,本公开化合物(例如aso)的适合日剂量是有效产生治疗效果的最低剂量的化合物量。这类有效剂量一般视上文所描述的因素而定。优选地,化合物以约0.01mg/kg到约200mg/kg、更优选约0.1mg/kg到约100mg/kg、甚到更优选约0.5mg/kg到约50mg/kg投与。在一些实施例中,化合物以约1mg/kg到约40mg/kg、约1mg/kg到约30mg/kg、约1mg/kg到约20mg/kg、约1mg/kg到约15mg/kg或1mg/kg到约10mg/kg投与。在一些实施例中,化合物以等于或大于以下的剂量投与:0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.10、0.11、0.12、0.13、0.14、0.15、0.16、0.17、0.18、0.19、0.20、0.21、0.22、0.23、0.24、0.25、0.26、0.27、0.28、0.29、0.30、0.35、0.40、0.45、0.50、0.55、0.60、0.65、0.7、0.75、0.8、0.85、0.9、0.95或1mg/kg。在一些实施例中,化合物以等于或大于以下的剂量投与:1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30mg/kg。在一些实施例中,化合物以等于或小于以下的剂量投与:200、190、180、170、160、150、140、130、120、110、100、95、90、85、80、75、70、65、60、55、50、45、40、35、30、25、20或15mg/kg。在一些实施例中,化合物的每日总剂量等于或大于10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175、180、185、190、195或100mg。
[0131]
必要时,活性化合物(例如aso)的有效日剂量可在当天中以适当时间间隔投与任选地呈单位剂型的分开投与的两个、三个、四个、五个、六个、七个、八个、九个、十个或更多个剂量或子剂量。在一些实施例中,化合物投与至少1、2、3、4、5、6、7、8、9、10、11、12、13、14或15次。优选给药是每天一次投与。在一些实施例中,化合物一周投与至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或21次。在一些实施例中,化合物一月投与至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或21次。在一些实施例中,化合物每1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或21天投与一次。在一些实施例中,化合物每3天投与。在一些实施例中,化合物每1、2、3、4、5、6、7、8、9、10、11、12、13、14或15周投与一次。在一些实施例中,化合物每月投与。在一些实施例中,化合物每1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个月投与一次。在一些实施例中,化合物在至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69或70天的时间段内,投与至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52或53次。在一些实施例中,化合物在至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52或53周的时间段内,投与至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52或53次。在一些实施例中,化合物在至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52或53个月的时间段内,投与至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、
51、52或53次。在一些实施例中,化合物一周至少一次投与持续至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69或70周的时间段。在一些实施例中,化合物一周至少一次投与持续至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69或70个月的时间段。在一些实施例中,化合物一周至少两次投与持续至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69或70周的时间段。在一些实施例中,化合物一周至少两次投与持续至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69或70个月的时间段。在一些实施例中,化合物每两周至少一次投与持续至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69或70周的时间段。在一些实施例中,化合物每两周至少一次投与持续至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69或70个月的时间段。在一些实施例中,化合物每四周至少一次投与持续至少4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69或70周的时间段。在一些实施例中,化合物每四周至少一次投与持续至少4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69或70个月的时间段。
[0132]
所描述方法的个体可以是哺乳动物,且其包含人类和非人类哺乳动物。在一些实施例中,个体是人类,如成人。
[0133]
一些实施例包含一种用于治疗感染病毒的个体中的hbv病毒的方法,其包括向有需要的个体投与治疗有效量的本公开的一或多种aso或本公开组合物,借此降低个体中的病毒的病毒负荷和/或降低个体中的病毒抗原的含量。aso可与病毒中的目标rna的一部分,例如hbv的第二x区和/或s区,互补或杂交。
[0134]
在一些实施例中,如本文所描述的经修饰的寡核苷酸可与一或多种额外药剂组合使用以治疗和/或抑制复制性hbv和/或hdv。当本文中描述的化合物(例如aso)与额外药剂一起共投与时,有效量可小于当单独使用化合物时。额外药剂包含(但不限于)干扰素、核苷/核苷酸类似物、衣壳装配调节剂(cam)、sirna、其它aso、核酸聚合物或s-抗原转运抑制寡核苷酸聚合物(nap或stops)、进入抑制剂和/或小分子免疫调节剂。额外药剂的实例包含
alg-010133、alg-000184、重组干扰素α2b、ifn-a、peg-ifn-a-2a、拉米夫定、替比夫定、阿德福韦酯、克来夫定、恩替卡韦、替诺福韦艾拉酚胺、替诺福韦二吡呋酯、nvr3-778、bay41-4109、jnj-632、jnj-3989(aro-hbv)、rg6004、gsk3228836、rep-2139、rep-2165、ab-729、vir-2218、dcr-hbvs、jnj-6379、gls4、abi-ho731、jnj-440、nz-4、rg7907、edp-514、ab-423、ab-506、abi-h03733和abi-h2158。在一些实施例中,本文公开的aso中的任一个与stops中的一个一起共投与。示范性stops描述于国际公开案第wo2020/097342号和美国公开案第2020/0147124号中,两个以全文引用的方式并入。在一些实施例中,stop是alg-010133。在一些实施例中,本文公开的aso中的任一个与替诺福韦一起共投与。在一些实施例中,本文公开的aso中的任一个与cam一起共投与。示范性cam描述于以下中:伯克(berke)等人,《抗菌物与化学疗法(antimicrob agents chemother)》,2017,61(8):e00560-17;克隆普(klumpp)等人,《胃肠病学(gastroenterology)》,2018,154(3):652-662.e8;国际申请案第pct/us2020/017974号、第pct/us2020/026116号和第pct/us2020/028349号以及美国申请案第16/789,298号、第16/837,515号和第16/849,851号,其中的每一个以全文引用的方式并入。在一些实施例中,cam是alg-000184、alg-001075、alg-001024、jnj-632、bay41-4109或nvr3-778。在一些实施例中,同时投与aso和额外药剂。在一些实施例中,依序投与aso和额外药剂。在一些实施例中,在投与额外药剂之前投与aso。在一些实施例中,在投与额外药剂之后投与aso。
[0135]
定义
[0136]
在数值前存在术语“约”的情况下,本文呈现特定范围。术语“约”在本文中用以提供用于其后的准确数值以及接近或近似所述术语之后的数值的数值的文本载体。在测定数值是否接近或近似特定叙述的数值中,接近或近似未叙述的数值可以是在呈现其的上下文中提供特定叙述的数值的实质性等效物的数值。
[0137]
除非另外定义,否则本文中所用的所有技术和科学术语具有与本发明所属领域的一般技术人员通常所理解相同的含义。尽管在本发明的实践或测试中也可使用与本文中所描述的方法和材料类似或等效的任何方法和材料,但现描述代表性说明性方法和材料。
[0138]
在提供值范围时,应理解本发明涵盖那个范围的上限与下限之间的各中间值(除非上下文另外明确指出,否则到下限单位的十分的一)和那个所陈述范围内的任何其它所陈述或中间值。这些较小范围的上限和下限可独立地包含于较小范围内且也涵盖于本发明内,在所陈述范围内受到任何特定排他性限制。当所陈述的范围包含限度中的一个或两个时,排除那些所包含的限度中的任一个或两个的范围也包含于本发明中。
[0139]
本公开不限于所描述的特定实施例,因此可变化。也应理解,本文中所用的术语是仅出于描述特定实施例的目的而并不打算是限制性的,因为本发明的范围将仅由所附权利要求书限制。
[0140]
如所属领域的技术人员在阅读本公开之后将显而易见,本文中所描述和说明的个别实施例中的每一个具有离散组分和特征,其可在不脱离本发明的范围或精神的情况下容易地与其它若干实施例中的任一个的特征分离或与其组合。任何所叙述方法均可以所叙述事件顺序或以逻辑上可能的任何其它顺序来进行。
[0141]
本说明书中所引用的所有公开案和专利是以引用的方式并入本文中,就如同特定地且单独地指示各个别公开案或专利以引用的方式并入一般,且以引用的方式并入本文中
以结合所引用的公开案公开和描述方法和/或材料。对任何公开案的引用涉及其在申请日期之前的公开内容,且不应解释为承认本发明未经授权借助于先前发明将所述公开案的日期提前。此外,所提供的公开案的日期可能不同于可能需要独立确认的实际公开案的日期。
[0142]
实例
[0143]
以下实例说明本公开的某些实施例以辅助技术人员实践本公开。因此,实例决不被认为打算限制本公开的范围。
[0144]
实例1:aso合成
[0145]
间隙子aso序列
[0146]
dna、2'-o-me、2'-moe和lna氨基磷酸酯单体系获自市售来源(美国鸿基因生物技术有限公司(hongene biotech usa inc.))。全部单体在真空干燥器中用除湿剂(p2o5,rt24h)干燥。所连接的通用固体载体(cpg)是获自化学与基因公司(chemgenes corporation)。用于合成工作流程的化学物质和溶剂是购自vwr/西格玛(sigma)市售来源且在不进行任何纯化或处理的情况下使用。溶剂(乙腈)和溶液(氨基酸酯和活化剂)在合成期间存储在分子筛上。
[0147]
对照和目标寡核苷酸序列在expedite 8909合成器上使用制造商书写的标准循环来合成,其中具有对几个等待步骤的修改和经修改的偶合步骤。固体载体是受控孔玻璃,且单体含有标准保护基团。各嵌合寡核苷酸分别使用以下,根据标准固相氨基磷酸酯合成方案来合成:市售5'-o-(4,4'-二甲氧基三苯甲基)-3'-o-(2-氰基乙基-n,n-二异丙基)dna、2'-ome、2'-moe,和/或6-n-苯甲酰基腺苷(a
bz
)、4-n-乙酰基胞苷(c
ac
)、2-n-异丁酰鸟苷(g
ibu
)和尿苷(u)或胸苷(t)的lna氨基磷酸酯单体。2'-o-me-2,6-二氨基嘌呤氨基磷酸酯是购自格伦研究公司(glen research)。氨基磷酸酯制备为于无水乙腈中的0.1m溶液。5-乙硫基四唑用作寡核糖核苷酸硫代磷酸酯的合成的活化剂,含3%二氯乙酸的二氯甲烷用于去三苯甲基,含乙酸酐的thf和含16%n-甲基咪唑的thf用于封端,且ddtt((二甲氨基-亚甲基)氨基)-3h-1,2,4-碘二噻宁-3-硫酮用作硫转移剂。在固体结合的寡核苷酸的5-(乙硫基)-1h-四唑活化剂存在下,氨基磷酸酯于ch3cn中的0.1m溶液的延长偶合后,进行延长封端,氧化和去保护,得到经修饰的寡核苷酸。全部经修饰的氨基磷酸酯的逐步偶合效率大于98.5%。
[0148]
去保护和从固体载体裂解利用氨甲基胺(1:1,ama)的混合物在65℃下15min实现,当使用通用连接子时,保持在65℃下去保护90min,或在55℃下加热固体载体与氨水(28%)溶液8h以使碱不稳定的保护基团去保护。
[0149]
在过滤以去除固体载体之后,在genevac离心式蒸发器中真空去除去保护溶液。
[0150]
[0151]
[0152][0153]
2'-moe氨基磷酸酯
[0154][0155]
锁核酸(lna)氨基磷酸酯
[0156][0157]
经修饰的间隙子序列
[0158]
amna(n-me)-t、amna(n-me)-4-n-苯甲酰基(5m)胞苷((5m)c
bz
)、amna(n-me)-4-n-苯甲酰基胞苷(a
bz
)和amna(n-me)-2-n-pac(g
pac
)是购自卢克纳生物技术公司(luxna biotech),而scp-bna-t、scp-bna-6-n-苯甲酰基腺苷(a
bz
)、scp-bna-4-n-苯甲酰基-5甲基胞苷((5m)c
bz
)、scp-bna-2-n-鸟苷(g
ibu
)氨基磷酸酯单体通过按照参考文献(山口孝雄(takao yamaguchi)、堀场正彦(masahiko horiba)和花本聪(satoshi obika);《化学通讯(chem.commun.)》,2015,51,9737-9740;堀场正彦、山口孝雄和花本聪;《有机化学杂志(journal of organic chemistry)》,2016,81,11000-11008)中所描述的程序来合成。全部单体在真空干燥器中用除湿剂(koh和p2o5,在室温下,24小时)干燥。在amna(n-me)-ps-dna-ps和scp-bna-ps-dna-ps修饰的情况下,以1μm规模在3'到5'方向上用稀释于无水ch3cn中到0.12m的浓度的氨基磷酸酯单体,在固体结合的寡核苷酸的0.3m 5-(苯甲硫基)-1h-四唑活化剂(偶合时间16min)存在下,之后经修改的封端,氧化和去保护进行合成,得到经修饰的寡核苷酸。全部经修饰的氨基磷酸酯的逐步偶合效率大于97%。ddtt(二甲氨基-亚甲基)氨基)-3h-1,2,4-碘二噻宁-3-硫酮用作合成寡核糖核苷酸硫代磷酸酯的硫转移剂。携带寡核苷酸的固体载体用于乙腈中的20%dea溶液洗涤15min,随后柱用mecn充分洗涤。载体与二异丙胺:水:甲醇(1:1:2)一起在加热块中于65℃下加热8h,以从载体裂解和使碱不稳定的保护基团去保护。
[0159]
amna(n-me)单体
[0160][0161]
scp-bna单体
[0162][0163]
合成具有各种长度galnac部分的5'和3'-galnac结合的寡核苷酸,例如如下文所描述。galnac3、galnac4、galnac5和galnac6在用1、2或3个部分合成期间以与下文所描述的相同的方式与寡核苷酸结合。其它galnac部分,如本文中先前所描述的galnac-1和galnac-2,也用于使用合成后结合形成5'和3'-galnac。
[0164]
galnac氨基磷酸酯
[0165]
[0166][0167]
粗寡聚物的定量或原始分析
[0168]
将样品溶解于去离子水(1.0ml)中且如下定量:在nanodrop uv分光光度计上首先仅用水进行消隐。nano drop仪可通过使用多路径长度测量宽浓度范围的核酸。最准确量化结果可通过用260nm下的吸光度测量已稀释的寡核苷酸来实现。将粗材料存储在-20℃下。
[0169]
粗hplc/lc-ms分析
[0170]
使用0.1od的粗物质样品来进行粗ms分析。在确认粗lc-ms数据之后,那么进行纯化步骤。
[0171]
hplc纯化
[0172]
磷酸二酯(po)、硫代磷酸酯(ps)和嵌合经修饰的寡核苷酸通过阴离子交换hplc来纯化。缓冲液是含20mm磷酸钠的10%ch3cn,ph 8.5(缓冲液a);和含20mm磷酸钠的10%ch3cn,1.8m nabr,ph 8.5(缓冲液b)。将含有全长寡核苷酸的级分合并,去盐和冻干。
[0173]
脂质结合的寡核苷酸通过内部封装的rpc-source15反相柱来纯化。缓冲液是含20mm乙酸钠的10%ch3cn(缓冲液a)和ch3cn(缓冲液b)。将含有全长寡核苷酸的级分合并,去盐和冻干。
[0174]
已纯化寡聚物的去盐
[0175]
随后,使用葡聚糖凝胶(sephadex)g-25m(安玛西亚生物科学(amersham biosciences))来对已纯化的干燥寡聚物进行去盐。料筒用10ml去离子水调节三次。在极减缓逐滴洗脱的情况下,将充分溶解于2.5ml去离子水中的已纯化的寡核苷酸施加到料筒。无盐寡聚物用3.5ml去离子水直接洗脱到螺帽小瓶中。
[0176]
最终hplc和电喷射lc/ms分析
[0177]
将大致0.10od的寡聚物溶解于水中且随后吸取于特定小瓶中以用于iex-hplc和lc/ms分析。分析性hplc和es lc-ms确立嵌合寡核苷酸的完整性。
[0178]
合成后galnac酯与寡核苷酸的结合
[0179]
5'-c6-氨基前体合成
[0180]
以10μmol规模,使用通用载体(负载65μmol/g),合成序列。在引入c6-nh2连接子的5'末端,使用含6-(4-单甲氧基三苯甲基氨基)己基-(2-氰基乙基)-(n,n-二异丙基)-氨基磷酸酯的0.1m乙腈,其中偶合时间10min。将携带寡核苷酸的固体载体与氨水/甲基胺(1:1)溶液一起在振荡器中于室温下加热3h,以从载体裂解且使碱不稳定的保护基团去保护。在iex纯化和去盐之后,使用c6-nh2修饰的aso来进行合成后结合。
[0181][0182]
6-(4-单甲氧基三苯甲基氨基)己基-(2-氰基乙基)-(n,n-二异丙基)-氨基磷酸酯
[0183]
用于结合的galnac酯
[0184][0185]
合成后5'-galnac合成的结合
[0186]
将5'-c6-nh2修饰的序列溶解于0.2m碳酸氢钠缓冲液ph 8.5(0.015mm)中,且添加5-7摩尔等效的溶解于dmso中的galnac酯。在室温下搅拌反应混合物4h。分析样本以确认是否存在任何未反应的氨基修饰的aso。向此中添加氨水(28wt%)(5
×
反应体积),且在室温下搅拌2-3h。减压浓缩反应混合物,且将残余物溶解于水中且通过强力阴离子交换柱上的hplc来纯化。
[0187]
实例2.hbsag释放分析方案(hepg2.2.15)
[0188]
将hepg2.2.15细胞(具有四个整合的hbv基因组的稳定细胞系)维持在具有10%胎牛血清(fbs)和1%青霉素/链霉素、1%谷氨酰胺、1%非必需氨基酸、1%丙酮酸钠和250μg/ml g418的dmem培养基中。将细胞保持在37℃下于5%co2气氛中。对于hbsag释放分析来说,制备如下分析培养基:具有5%fbs、1%青霉素/链霉素、1%谷氨酰胺和1%dmso的dmem。在分析之前一天,胰蛋白酶化的hepg2.2.15细胞用分析培养基洗涤一次,在250g下旋转5min,用分析培养基再悬浮,且以50,000/孔将细胞接种于胶原蛋白涂覆的96孔板中的分析培养基中。在次日,aso用opti-mem,9-pt 3倍稀释液稀释,且根据制造商的手册稀释脂染胺rnaimax(英杰(invitrogen))。将aso稀释液与rnaimax稀释液混合,置于室温下5分钟,且向
96孔板的各孔中添加15μl。将板置于37℃下、5%co2培育箱中5天。在培育之后,收获上清液且用elisa试剂盒(迪亚西诺(diasino))测量hbsag。用celltiter-glo(普洛麦格(promega))测量细胞存活力。使用prism graphpad,计算相对于未处理细胞对照减少hbsag分泌50%所需的药物浓度ec
50
。使用相同软件,计算相对于未处理细胞对照减少细胞存活力50%所需的药物浓度cc
50
。
[0189]
表1中的化合物的所得ec
50
和cc
50
呈现于下表2中。ec
50
值如下:a:《0.1nm,b:0.1nm-1nm,c:1-10nm。
[0190]
[0191]
[0192][0193]
表2a.使用1x5mg/kg的血清hbsag对数下降值(最低点)
[0194][0195][0196]
在表2a中,粗体核苷含有以下修饰:
[0197][0198]
实例3.aav-hbv小鼠模型中的galnac aso测试
[0199]
aav/hbv是携带可复制hbv基因组的重组aav。利用基因型8aav的高度亲肝性特征,hbv基因组可有效地递送到小鼠肝细胞。用aav/hbv感染免疫胜任小鼠可导致长期hbv病毒血症,其模拟患者中的慢性hbv感染。aav/hbv模型用于评价各种类型的抗hbv药剂的活体内活性。在研究的第28天,用aav-hbv感染小鼠。在第0天以5mg/kg的单一剂量形式或在第0天以10mg/kg的单一剂量形式;或3
×
10mg/kg,一周一次(qw);或3
×
10mg/kg,每3天一次(q3d);或5
×
10mg/kg q3d;或在第0、3、7、14、21、28天6个3mg/kg的剂量;或在第0、3、7、14、21、28天6个10mg/kg的剂量,(除非另外规定,否则)皮下给药测试物品或阴性对照(pbs)。在第0、5、10和15天每5天;或视各研究设计而定,较长持续时间,进行连续血液收集。通过以下方法分析血清hbv s抗原(hbsag)、e抗原(hbeag)和alt:
[0200][0201][0202]
在研究期间所得血清hbsag的最低点log
10
下降呈现于下表中,其中a≥hbsag的1log
10
下降,b是hbsag的0.5-1log
10
下降,且c是《hbsag的0.5log
10
下降
[0203]
[0204]
[0205][0206]
实例4.hbsag释放分析方案中的组合aso测试
[0207]
在上文实例2中所描述的hbsag释放分析方案中,测试aso组合。比较个别aso和两个aso的组合,且报告呈现于表4中。ec
50
值如下:a:《0.2nm,b:0.2nm-0.3nm,c:0.3-5nm。
[0208][0209]
实例5.具有点修饰的aav-hbv小鼠模型中的经修饰的aso测试
[0210]
使用标准氨基磷酸酯化学物质,在abi 394和expedite 8909合成器上合成具有lna和bna化学物质的aso。使用hbsag释放分析,在hepg2.2.15细胞中进行lna aso的活体外筛选。选择强效含lna的aso用于n-乙酰基半乳糖胺(galnac)结合,且在腺相关病毒(aav)-hbv小鼠模型中以每3天3
×
10mg/kg进行测试。施加bna翼修饰,且与其全-lna aso进行比较。表5显示相较于aso 108,用3
×
10mg/kg qw的hbsag最低点。在hbx区中的这些含lna的aso中,靶向全部hbv转录物,包含hbx、用5-甲基螺环丙基c单一置换翼中的5-甲基lnac,提高hbsag的最低点0.5log
10 iu/ml同时降低血清丙氨酸转氨酶(alt)3倍。
[0211][0212]
使用标准氨基磷酸酯化学物质,在abi 394和expedite 8909合成器上合成具有lna和间隙修饰的化学物质的aso。使用hbsag释放分析,在hepg2.2.15细胞中进行lna aso的活体外筛选。选择强效含lna的aso用于n-乙酰基半乳糖胺(galnac)结合,且在腺相关病毒(aav)-hbv小鼠模型中以每3天3
×
10mg/kg进行测试。施加核碱基间隙修饰且与aso 107进行比较。表6显示相较于aso 107,用3
×
10mg/kg qw的hbsag最低点。在这些hbx区lna aso中,用2-硫基t单一置换间隙中的去氧-t,降低血清alt 30倍到正常含量同时维持活体内活性。
[0213][0214]
实例6.以1
×
5mg/kg单一剂量,在aav-hbv小鼠模型中的galnac aso测试
[0215]
以1
×
5mg/kg,在腺相关病毒(aav)-hbv小鼠模型中测试aso。这个给药方案主要是用于对aso的活体内性能进行排序。尽管我们可消除以1
×
5mg/kg随着alt升高的肝中的少量极毒性aso,但大部分aso需要更严格的给药方案来区别于肝毒。在研究期间所得血清hbsag的最低点log
10
下降和alt的倍数变化呈现于表7中,其中a≥hbsag的1log
10
下降,b是hbsag的0.5-1log
10
下降,且c是《hbsag的0.5log
10
下降;和x≤媒剂对照的alt的3倍,其视为正常的,y是媒剂对照的alt的3倍-30倍,且z是≥媒剂对照的alt的30倍。y和z两个均被视为肝毒性。
[0216]
以下表7中的特定序列在本公开的范围内。如本文所用,ln=锁核酸(lna);lna=锁核酸(lna)a;ln(5m)c=ln(5m)c=锁核酸(lna)-5甲基c;lng=锁核酸(lna)g;lnt=锁核酸(lna)t;(5m)c=5甲基c;ma=2-o-甲氧基a;mu=2-o-甲氧基u;(8nh)a=8-氨基a;(8nh)g=8-氨基g;(2s)t=2-硫基t;cp=scp=环丙基;cpc=scpc=环丙基c;cpg=scpg=环丙基g;cpt=scpt=环丙基t;ps=硫代磷酸酯键联。
[0217]
[0218]
[0219]
[0220]
[0221]
[0222]
[0223]
[0224]
[0225][0226]
实例7.以3
×
10mg/kg qw,aav-hbv小鼠模型中的经修饰的aso测试
[0227]
以每周3
×
10mg/kg,在腺相关病毒(aav)-hbv小鼠模型中测试aso。这个3
×
10mg/kg qw给药方案比前述章节中显示的1
×
5mg/kg更严格。我们可进一步选择具有最小alt升高的强效aso。在研究期间所得血清hbsag的最低点log
10
下降和alt的倍数变化呈现于表8中,其中a≥hbsag的1log
10
下降,b是hbsag的0.5-1log
10
下降,且c是《hbsag的0.5log
10
下降;和x≤媒剂对照的alt的3倍,其视为正常的。y是媒剂对照的alt的3倍-30倍,且z是≥媒剂对照的alt的30倍。y和z两个均被认为显示肝毒性,其中z更严重。
[0228]
以下表8中的特定序列在本公开的范围内。如本文所用,ln=锁核酸(lna);lna=锁核酸(lna)a;=ln(5m)c=锁核酸(lna)-5甲基c;lng=锁核酸(lna)g;lnt=锁核酸(lna)t;(5m)c=5甲基c;ma=2-o-甲氧基a;mu=2-o-甲氧基u;(8nh)a=8-氨基a;(8nh)g=8-氨基g;(2s)t=2-硫基t;cp=scp=环丙基;cpc=scpc=环丙基c;cpg=scpg=环丙基g;cpt=scpt=环丙基t;ps=硫代磷酸酯键联;p=磷酸二酯键联。
[0229]
[0230]
[0231]
[0232]
[0233][0234]
实例8.用3
×
10mg/kg q3d的aav-hbv小鼠模型中的经修饰的aso测试
[0235]
以每3天3
×
10mg/kg,在腺相关病毒(aav)-hbv小鼠模型中测试aso。3
×
10mg/kg q3d的给药方案比3
×
10mg/kg qw更严格,且可进一步选择具有最优选治疗性指数的aso。在研究期间所得血清hbsag的最低点log
10
下降和alt的倍数变化呈现于表9中,其中a≥hbsag的1log
10
下降,b是hbsag的0.5-1log
10
下降,且c是《hbsag的0.5log
10
下降;和x≤媒剂对照的alt的3倍,其视为正常的。y是媒剂对照的alt的3倍-30倍,且z是≥媒剂对照的alt的30倍。y和z两个均被视为肝毒性,其中z更严重。
[0236]
以下表9中的特定序列在本公开的范围内。如本文所用,ln=锁核酸(lna);lna=锁核酸(lna)a;ln(5m)c=ln(5m)c=锁核酸(lna)-5甲基c;lng=锁核酸(lna)g;lnt=锁核酸(lna)t;(5m)c=5甲基c;ma=2-o-甲氧基a;mu=2-o-甲氧基u;(8nh)a=8-氨基a;(8nh)g=8-氨基g;(2s)t=2-硫基t;cp=scp=环丙基;cpc=scpc=环丙基c;cpg=scpg=环丙基g;cpt=scpt=环丙基t;ps=硫代磷酸酯键联。“hbv基因组中的位置”描述对应于seq id no:1的acc.kc315400.1(基因型b)中的目标位点的5'端。
[0237]
[0238]
[0239]
[0240]
[0241]
[0242]
[0243][0244]
实例9.aav-hbv小鼠模型中的经修饰的aso测试
[0245]
这个实例使用5
×
10mg/kg的给药方案评价aso的治疗指数。以每3天5
×
10mg/kg,在腺相关病毒(aav)-hbv小鼠模型中测试aso。在研究期间所得血清hbsag的最低点log
10
下降和alt的倍数变化呈现于表10中,其中a≥hbsag的1log
10
下降,b是hbsag的0.5-1log
10
下
降,且c是《hbsag的0.5log
10
下降;和x≤媒剂对照的alt的3倍,其视为正常的。y是媒剂对照的alt的3倍-30倍,且z是≥媒剂对照的alt的30倍。y和z两个均显示肝有毒的,其中z更严重。
[0246]
图3a显示aso 120的血清hbsag的变化图。图3b显示aso 121的血清hbsag的变化图。图3c显示aso 120的血清alt的图。图3d显示aso 121的血清alt的图。这些结果证实,luxna化学方法修饰降低或消除alt同时维持活体内性能。
[0247]
以下表10中的特定序列在本公开的范围内。如本文所用,ln=锁核酸(lna);lna=锁核酸(lna)a;ln(5m)c=ln(5m)c=锁核酸(lna)-5甲基c;lng=锁核酸(lna)g;lnt=锁核酸(lna)t;(5m)c=5甲基c;ma=2-o-甲氧基a;mu=2-o-甲氧基u;(8nh)a=8-氨基a;(8nh)g=8-氨基g;(2s)t=2-硫基t;cp=scp=环丙基;cpc=scpc=环丙基c;cpg=scpg=环丙基g;cpt=scpt=环丙基t;ps=硫代磷酸酯键联。
[0248]
[0249]
[0250][0251]
实例10.aav-hbv小鼠模型中的经修饰的aso测试
[0252]
以1
×
10mg/kg,在腺相关病毒(aav)-hbv小鼠模型中,呈单一药剂或组合(s+x触发以及s+s触发)形式测试aso。在研究期间所得血清hbsag的最低点log
10
下降和alt的倍数变化呈现于表11中,其中a≥hbsag的1log
10
下降,b是hbsag的0.5-1log
10
下降,且c是《hbsag的0.5log
10
下降;和x≤媒剂对照的alt的3倍,y是媒剂对照的alt的3倍-30倍,且z是≥媒剂对照的alt的30倍。结果证实,当组合s和x触发aso时,其显示对于轻微协同效应是相加性的。
[0253]
图9a显示来自用aso 120、aso 131和以1:1、2:1和3:1质量比的aso 120与aso 131的组合处理的小鼠的血清b型肝炎e-抗原(hbeag)的变化图。图9b显示来自用aso 120、aso 121和以1:1、2:1和3:1质量比的aso 120与aso 121的组合处理的小鼠的血清hbeag的变化图。这些结果证实,与aso的组合导致全部hbv rna的破坏,包含x基因,以及来自所整合基因组的rna。
[0254]
[0255]
[0256][0257]
实例11.aav-hbv小鼠模型中的经修饰的aso测试
[0258]
以6个3mg/kg或10mg/kg重复剂量,在第0、3、7、14、21和28天,在腺相关病毒(aav)-hbv小鼠模型中测试aso。在研究期间所得血清hbsag的最低点log
10
下降和alt的倍数变化呈现于表12中,其中a≥hbsag的1log
10
下降,b是hbsag的0.5-1log
10
下降,且c是《hbsag的0.5log
10
下降;和x≤媒剂对照的alt的3倍,其视为正常的。y是媒剂对照的alt的3倍-30倍,且z是≥媒剂对照的alt的30倍。y和z两个均显示肝毒性。s和x aso组合地(1:1和2:1)触发,而总给药药物量(以mg为单位)是恒定的,不管其是单一药剂还是组合药剂。结果显示,s和x组合(1:1)轻微协同效应,而2:1(s:x)混合物显示较少益处。图4a显示来自用aso 121或aso 120处理的hbv小鼠的血清hbsag的变化图。图4b显示来自用aso 121或aso 120处理的hbv小鼠的血清alt的图。图4c显示来自用(a)aso 121与aso 120的组合;或(b)仅aso 123处理的hbv小鼠的血清hbsag的变化图。图4d显示来自用(a)aso 121与aso 120的组合;或(b)仅aso 123处理的hbv的血清alt的图。这些结果证实,具有luxna翼和间隙修饰的化学物质的aso可有效地治疗hbv。另外,用两个aso的组合处理的小鼠显示相较于用仅aso 123处理的小鼠改进的性能。aso 123是gsk836,其目前在gsk赞助的2b期临床试验中。
[0259][0260]
实例12.hepg2.2.15hbv细胞模型中的hbsag释放分析中的aso剂量反应测试
[0261]
使用hbsag释放分析,在hepg2.2.15细胞中进行增加剂量的aso的活体外筛选。三个实验的剂量反应曲线和所得ic
50
(nm)值显示于图1a到2c和表13中,其中a:≤5nm,b是5-20nm,c:≥20nm。结果证实,luxna化学物质修饰的aso(在翼和间隙两个中进行修饰)显示良好的活体外性能。对于一些序列,连接有galnac的aso相比于去除galnac的相同aso仍显示良好性能。对于其它序列,仍连接有galnacx的aso相比于相同序列的未结合的aso显示较少性能。
[0262]
[0263][0264]
实例13.aso合成
[0265]
使用标准氨基磷酸酯化学物质,在abi 394和expedite 8909合成器上合成具有lna和/或间隙修饰的化学物质的aso。含lna的aso与n-乙酰基半乳糖胺(galnac)结合。
[0266]
以下表14中的特定序列在本公开的范围内。如本文所用,ln=锁核酸(lna);lna=锁核酸(lna)a;ln(5m)cln(5m)c=锁核酸(lna)-5甲基c;lng=锁核酸(lna)g;lnt=锁核酸(lna)t;(5m)c=5甲基c;ma=2-o-甲氧基a;mu=2-o-甲氧基u;(8nh)a=8-氨基a;(8nh)g=8-氨基g;(2s)t=2-硫基t;cp=scp=环丙基;cpc=scpc=环丙基c;cpg=scpg=环丙基g;cpt=scpt=环丙基t;ps=硫代磷酸酯键联。
[0267][0268]
将hepg2.2.15细胞(具有四个整合的hbv基因组的稳定细胞系)维持于具有10%胎牛血清(fbs)和1%青霉素/链霉素、1%谷氨酰胺、1%非必需氨基酸、1%丙酮酸钠和250μg/ml g418的dmem培养基中。将细胞维持在37℃下5%co2气氛中。对于hbsag释放分析来说,制备如下分析培养基:具有5%fbs、1%青霉素/链霉素、1%谷氨酰胺和1%dmso的dmem。在分析之前一天,胰蛋白酶化的hepg2.2.15细胞用分析培养基洗涤一次,在250g下旋转5min,用分析培养基再悬浮,且以50,000/孔将细胞接种于胶原蛋白涂覆的96孔板中的分析培养基中。在次日,aso用opti-mem,9-pt 3倍稀释液稀释,且根据制造商的手册稀释脂染胺rnaimax(英杰)。将aso稀释液与rnaimax稀释液混合,置于室温下5分钟,且向96孔板的各孔中添加15μl。将板置于37℃下、5%co2培育箱中5天。在培育之后,收获上清液且用elisa试
剂盒(迪亚西诺)测量hbsag。用celltiter-glo(普洛麦格)测量细胞存活力。使用prism graphpad,计算相对于未处理细胞对照减少hbsag分泌50%所需的药物浓度ec
50
。使用相同软件,计算相对于未处理细胞对照减少细胞存活力50%所需的药物浓度cc
50
。
[0269]
表14中的化合物的所得ec
50
和cc
50
呈现于下表15中。ec
50
值如下:a:《0.1nm,b:0.1nm-5nm,c:》5nm。
[0270]
aso编号ec
50
cc
50
380c》500381b》500382c》500
[0271]
实例14.靶向hbv的s和x基因区的aso的生物信息
[0272]
这个实例分析靶向hbv的s和x基因区的aso的基因型覆盖和脱靶(off target)概况。表16显示靶向s基因区的aso 120和靶向x基因区的aso 121的hbv基因型a-j的基因型覆盖。在》8000个临床分离株中的同源性%(定义为完全匹配或具有1个错配)显示于表16中。
[0273][0274][0275]
实例15.aso组合疗法
[0276]
这个实例研究aso 120和aso 121与其它hbv疗法(例如s-抗原转运抑制性寡核苷酸聚合物(stops)、替诺福韦和衣壳装配调节剂(cam))的组合疗法。对于与aso的stops alg-010133组合研究(aso 120:aso121呈2:1、1:1或1:2比率),将每孔35,000个hepg2.2.15细胞反转染于胶原蛋白i涂覆的96孔板(康宁生物涂层(corning,biocoat);目录号356698)中。分别将alg-010133和aso混合物稀释于opti-mem
tm
i低血清培养基(赛默飞世尔科技(thermo fisher scientific);目录号31985088)到40
×
所需最终测试浓度,随后连续稀释(1:3)直到5或9个不同浓度。以棋盘方式组合3.25μl各稀释化合物等分试样,其中aso混合物添加到板顶部处的具有最高浓度的10行,且alg-010133添加到板右侧上的最远孔处的具有最高浓度的7列。将这个化合物组合与0.3μlrnaimax转染试剂(赛默飞世尔科技,目录号13778150)和6.2μl的opti-mem
tm
i低血清培养基混合。在培育20分钟之后,将混合物添加到hepg2.2.15细胞。还为各单独化合物的滴定分派空格(space)作为参考对照。
将细胞与化合物一起在37℃下在5%co2气氛中培育3天。在初始转染三天之后,更新培养基,且按照与初始转染所使用方案相同的方案再转染细胞。在又3天之后,分析上清液的hbsag含量,且分析残留细胞的细胞毒性。对于与小分子(如cam或替诺福韦)的aso混合物组合,将测试物品溶解于二甲亚砜(dmso)储备溶液中,且以0.5%dmso的最终浓度添加到未转染的细胞。分析的全部其它方面与aso+stops组合研究所使用的方案一致。测量与小分子(如cam或替诺福韦)的这些组合的上清液中的hbv dna。
[0277]
使用hbsag elisa试剂盒(迪亚西诺实验室(diasino laboratories),参考ds187701),根据制造商的方案,测定hbsag含量。使用珀金埃尔默(perkin elmer)多标记计数器victor3v记录发光。用实时qpcr测量hbv dna含量。
[0278]
对于hepg2.2.15细胞存活力分析,使用普洛麦格发光细胞活力分析(目录号g7572)。celltiter-glo发光细胞活力分析是基于所存在的三磷酸腺苷(atp)的数测量定培养物中活细胞数量的均相法,其对代谢活性细胞的存在发信号。分析板设定成与抗hbv活性分析中相同的格式。向各孔中添加100μl celltiter-glo试剂等分试样且在室温下培育8分钟。使用珀金埃尔默多标记计数器victor3v记录发光。
[0279]
各实验进行三次重复(3个板)。产生来自三个实验的hbsag的平均百分比抑制,且使用普里查德氏法(prichard’s method)(macsynergy ii)进行分析。
[0280]
如表17中所示,aso与stops的组合疗法在hbsag降低方面具有相加效应且无细胞毒性。如表18中所示,aso与替诺福韦组合疗法在hbsag降低方面具有强力协同效应,且aso与cam组合疗法在hbsag降低方面具有中等协同效应。
[0281][0282][0283]
实例16.aav-hbv小鼠模型中的经修饰的aso测试
[0284]
使用标准氨基磷酸酯化学物质,在abi 394和expedite 8909合成器上合成具有lna和/或luxna翼或间隙修饰的化学物质的aso。以每3天1
×
10mg/kg或5
×
10mg/kg的剂量,在腺相关病毒(aav)-hbv小鼠模型中测试aso。图5a显示来自用1
×
10mg/kg的aso 128、aso 129或aso 120处理的小鼠的血清hbsag的变化图。图5b显示来自用5
×
10mg/kg q3d的aso 128、aso 129或aso 120处理的小鼠的血清hbsag的变化图。不具有间隙修饰、在间隙位置1号处具有luxna化学物质修饰和在间隙位置3号处具有luxna修饰的全部3种aso的功效具有相同性能。图5c显示来自用5
×
10mg/kg q3d的aso 128、aso 129或aso 120处理的小鼠的血清alt的图。结果显示,在间隙位置3号处的luxna修饰具有最优选的肝安全概况。
[0285]
实例17.aav-hbv小鼠模型中的aso 130的评价
[0286]
使用标准氨基磷酸酯化学物质,在abi 394和expedite 8909合成器上合成aso 130。以每3天1
×
10mg/kg或5
×
10mg/kg的剂量,在腺相关病毒(aav)-hbv小鼠模型中测试aso 130。图6a显示来自用1
×
10mg/kg的aso 130处理的小鼠的血清hbsag的变化图。图6b显示来自用5
×
10mg/kg q3d的aso 130处理的小鼠的血清hbsag的变化图。图6c显示来自用5
×
10mg/kg q3d的aso 130处理的小鼠的血清alt的图。这些结果证实,在翼和间隙处的luxna化学物质修饰可产生稳固持久的反应而无alt升高。
[0287]
实例18.aav-hbv小鼠模型中的aso 131的评价
[0288]
使用标准氨基磷酸酯化学物质,在abi 394和expedite 8909合成器上合成aso 131,且使其与galnac4结合。以每3天3
×
10mg/kg的剂量,在腺相关病毒(aav)-hbv小鼠模型中测试aso 131。图7a显示来自用3
×
10mg/kg q3d的aso 131处理的小鼠的血清hbsag的变化图。图7b显示来自用3
×
10mg/kg q3d的aso 131处理的小鼠的血清alt的图。这些结果证实,在翼和间隙处的luxna化学物质修饰可产生稳固持久的反应而无alt升高。
[0289]
实例19.aav-hbv小鼠模型中的aso 121的评价
[0290]
使用标准氨基磷酸酯化学物质,在abi 394和expedite 8909合成器上合成aso 121,且使其与galnac4结合。以每3天5
×
10mg/kg的剂量,在腺相关病毒(aav)-hbv小鼠模型中测试aso 121。图8a显示来自用5
×
10mg/kg q3d的aso 121处理的小鼠的血清hbsag的变化图。图8b显示来自用5
×
10mg/kg q3d的aso 121处理的小鼠的血清alt的图。这些结果证实,在极严格的3
×
10mg/kg q3d给药方案下,在翼和间隙处的luxna修饰可产生稳固持久的alt升高许多的反应。
[0291]
实例20.aso修饰的评价
[0292]
在这个实例中,针对性能和毒性,筛选aso中的不同核苷酸位置的修饰(lna或间隙修饰的化学物质)。
[0293]
以下表19中的特定序列在本公开的范围内。如本文所用,ln=锁核酸(lna);lna=锁核酸(lna)a;ln(5m)c ln(5m)c=锁核酸(lna)-5甲基c;lng=锁核酸(lna)g;lnt=锁核酸(lna)t;(5m)c=5甲基c;ma=2-o-甲氧基a;mu=2-o-甲氧基u;(8nh)a=8-氨基a;(8nh)g=8-氨基g;(2s)t=2-硫基t;am=amna;am(5m)c=amna-nch3-(5m)c氨基磷酸酯;cp=scp=环丙基;cpc=scpc=环丙基c;cpg=scpg=环丙基g;cpt=scpt=环丙基t;ps=硫代磷酸酯键联;p=磷酸二酯键联。
[0294]
[0295]
[0296][0297]
hbv小鼠以3
×
10mg/kg qw的剂量用aso 133-136和137a处理。所得血清hbsag的变化显示于图10a中,且血清alt显示于图10b中。这些结果证实,对于这个特定序列,具有(5m)cpc luxna修饰的aso翼(aso 137a)具有比全部lna(无luxna化学物质,aso 133)、cpt修饰的(aso 136)、amt修饰的(aso 134)和am(5m)c(aso 135)更高的性能和更低的alt。
[0298]
hbv小鼠以3
×
10mg/kg qw的剂量用aso 138或153处理。图11a显示来自用3
×
10mg/kg qw的aso 138或153处理的小鼠的血清hbsag的变化图。图11b显示来自用3
×
10mg/kg qw的aso 138或153处理的小鼠的血清alt的图。这些结果证实,在中心(“间隙”)区中具
有luxna修饰、间隙位置2号具有(2s)t的aso可消除alt同时维持性能。
[0299]
hbv小鼠以3
×
10mg/kg qw的剂量用aso 132a或137a处理。图12a显示来自用3
×
10mg/kg qw的aso 132a或137a处理的小鼠的血清hbsag的变化图。图12b显示来自用3
×
10mg/kg qw的aso 132a或137a处理的小鼠的血清alt的图。这些结果证实,在翼区中具有luxna化学物质(5m)cpc修饰的aso可降低alt同时改进来自全部lna(翼)aso的性能。
[0300]
hbv小鼠以5
×
10mg/kg q3d的剂量用aso 140-142处理。图13a显示来自用5
×
10mg/kg q3d的aso 140-142处理的小鼠的血清hbsag的变化图。图13b显示来自用5
×
10mg/kg q3d的aso 140-142处理的小鼠的血清alt的图。全部3种序列均在翼中具有全部lna,但分别在距间隙(例如中心区)的5'端的位置1号(aso 140)、2号(aso 141)和3号(aso 142)处具有8-氨基a、8-氨基a或(5-oh)c。在间隙的3号位置处具有(5-oh)c的aso 142无alt升高且具有良好性能。这些结果证实,在中心区中具有修饰的aso可降低或消除alt同时维持性能。
[0301]
hbv小鼠以3
×
10mg/kg q3d的剂量,用aso 143、144、145a或146处理。图14a显示来自用3
×
10mg/kg q3d的aso 143、144、145a或146处理的小鼠的血清hbsag的变化图。图14b显示来自用3
×
10mg/kg q3d的aso 143、144、145a或146治疗的小鼠的血清alt的图。通过使用am(5m)c来“步移”序列,一个接一个地置换ln(5m)c,来设计这些序列。这些结果证实,在5'翼的末端中具有am(5m)c修饰的aso相比于在其它位置处的am(5m)c具有最优选治疗指数。
[0302]
hbv小鼠以5
×
10mg/kg q3d的剂量用aso 148-150处理。图15a显示来自用5
×
10mg/kg q3d的aso 148-150处理的小鼠的血清hbsag的变化图。图15b显示来自用5
×
10mg/kg q3d的aso 148-150处理的小鼠的血清alt的图。这些序列具有全部lna翼,但分别在距中心区的5'端的位置1号(aso 148)、2号(aso 149)和3号(asl 150)处具有luxna间隙修饰。这些结果证实,对于这个序列,在间隙2号位置中具有luxna修饰的aso具有最优选治疗指数。
[0303]
hbv小鼠以3
×
10mg/kg sc qw的剂量,用aso 151-154处理。图16a显示来自用qw 3
×
10mg/kg的aso 151-154处理的小鼠的血清hbsag的变化图。图16b显示来自用qw 3
×
10mg/kg的aso 151-154处理的小鼠的血清alt的图。这些序列具有全部lna翼,但分别不具有luxna化学物质修饰(aso 151)、在1号(aso 152)、2号(aso 153)和3号(aso 154)处具有luxna间隙修饰。这些结果证实,在中心区中具有luxna间隙修饰(aso 152、153和154)的aso可降低或消除来自无luxna间隙修饰的aso(aso 151)的alt同时维持性能。在aso 152、153和154中,在间隙位置2号处具有luxna修饰的aso 153无alt升高。
[0304]
hbv小鼠以3
×
10mg/kg sc q3d的剂量,用aso 147、155或156处理。图17a显示来自用3
×
10mg/kg q3d的aso 147、155或156处理的小鼠的血清hbsag的变化图。图17b显示来自用3
×
10mg/kg q3d的aso 147、155或156处理的小鼠的血清alt的图。aso 155和156具有相同的luxna翼修饰但具有不同之间隙修饰。aso 155在2号位置处具有luxna间隙修饰,且aso 156在3号位置处具有luxna间隙修饰。这些结果证实,尽管具有luxna修饰的两种aso均可降低或消除alt,但对于这个特定序列来说,在2号间隙位置处的修饰作用更优选。
[0305]
hbv小鼠以5
×
10mg/kg sc q3d的剂量用aso 157-159处理。图18a显示来自用5
×
10mg/kg q3d的aso 157-159处理的小鼠的血清hbsag的变化图。图18b显示来自用5
×
10mg/kg q3d的aso 157-159处理的小鼠的血清alt的图。这些结果证实,在间隙的3号位置处具有luxna修饰且在翼中具有cpt修饰的aso具有最优选的性能和安全性。
[0306][0307]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1