用于预防单纯性和/或复发性膀胱炎的包含酵母的组合物的制作方法
1.本发明涉及尿路感染领域。本发明更特别地涉及用于预防单纯性膀胱炎和/或复发性膀胱炎的酵母。
背景技术:
2.尿路感染是全世界细菌感染的主要病因。性别和年龄是尿路感染的重要危险因素。通常并且对于所有年龄组,女性更有发生尿路感染的风险。因此,超过50%的女性在其一生中将会有至少一次尿路感染,而高达30%的女性将患有复发性尿路感染。此外,10-15%的男性将患有至少一次感染性发作。
3.在医院环境中,尿路感染代表肺部感染之后的第二常见的医院感染。最常见的病因是施用导尿管。
4.尿路感染也可根据并发症分类。当没有尿道结构或功能异常,没有肾水平的感染(没有肾病)和没有共病(其它疾病,如糖尿病、高血压等)时,尿路感染被认为是不复杂的。当肾脏受到影响时,尿路感染被认为是复杂的,其临床特征与其它疾病(如肿瘤、代谢原因或肾衰竭)有关。此外,男性的尿路感染被归类为具有并发症风险,因为它们几乎总是与解剖学原因相关。
5.一般人群的尿路感染通常由单一微生物引起:80%以上的尿路感染中的病原体大肠杆菌(escherichia coli)。在10-15%的感染中,病原体腐生葡萄球菌(staphylococcus saprophyticus)是原因。
6.特别地,在大肠杆菌尿道致病性菌株(upec)中的抗生素耐药性正在增加并且令人担忧。这促使科学家和医疗保健专业人员鉴定新的治疗策略。因此,使用没有副作用的天然方案被认为是抗生素的替代方案。
7.例如,alkil et al.(pediatr.nephrol,2006)评价了口服施用布拉迪酿酒酵母变种(saccharomyces cerevisiae var.boulardii)对儿童结肠中大肠杆菌菌落总数的作用。证明了施用布拉迪酿酒酵母变种可显著降低结肠中大肠杆菌菌落,同时显著增加布拉迪酿酒酵母变种的菌落。作者得出结论,布拉迪酿酒酵母变种可有效降低粪便中的大肠杆菌菌落的总数。但是,没有说明该酵母是否具有预防尿路感染的作用。
8.因此,真正需要新的天然方案来预防尿路感染。
9.发明概述
10.因此,本技术人已经令人惊讶地证明,使用酵母可以预防膀胱炎的发生。
11.因此,根据本发明的第一方面,本发明涉及用于预防单纯性膀胱炎和/或复发性膀胱炎的包含至少一种酵母的组合物,所述酵母为活酵母或死酵母的形式,为酵母衍生物(如酵母细胞壁和酵母细胞壁的纯化级分)的形式,或其混合物的形式。
12.根据本发明的第二方面,本发明人还开发了用于预防单纯性膀胱炎和/或复发性膀胱炎的包含至少一种酵母的膳食补充剂或食品组合物,所述酵母为活酵母或死酵母的形式,酵母衍生物(如酵母细胞壁和酵母细胞壁的纯化级分)的形式,或其混合物的形式。
13.根据第三方面,本发明涉及用于预防单纯性膀胱炎和/或复发性膀胱炎的包含含有至少一种酵母的组合物的医疗装置,所述酵母为活酵母或死酵母的形式,为酵母衍生物(如酵母细胞壁和酵母细胞壁的纯化级分)的形式,或其混合物的形式。
14.发明详述
15.本发明涉及用于预防单纯性膀胱炎和/或复发性膀胱炎的包含至少一种酵母的组合物。
[0016]“单纯性膀胱炎”是指不存在并发症风险的尿路感染。这仅涉及在仅存在膀胱炎的特征性症状(如急迫或更频繁需要排尿、灼烧感或麻刺感)而无发热的情况下无风险因素的女性。
[0017]“复发性膀胱炎”是指导致单纯性膀胱炎的一系列感染发作。为了将其称为“复发性膀胱炎”,感染发作的次数必须大于或等于每年4次。
[0018]
术语“酵母”表示酵母菌株、通过培养酵母菌株获得的酵母,该酵母是活的或死的形式,并且是酵母衍生物(例如酵母细胞壁和酵母细胞壁的纯化级分)的形式,或其混合物的形式。
[0019]
表述“酵母菌株”表示通过培养(或增殖)起始菌株获得的相对同质的酵母细胞群。
[0020]
从克隆开始获得酵母菌株,克隆是从单个酵母细胞开始获得的酵母细胞群。
[0021]
酵母菌株的培养可以通过任何合适的方法进行。用于培养酵母的方法在现有技术中是已知的,并且本领域技术人员知道如何根据其性质优化每种菌株的培养条件。通过在培养基中增殖酵母菌株获得酵母,例如参考书“yeast technology”,第2版,1991,g.reed and t.w.nagodawithana,由van nostrand reinhold出版,isbn 0-442-31892-8所描述。
[0022]
因此,例如,在工业规模上,可用于本发明上下文的酵母细胞可通过包括以下步骤的方法获得:
[0023]-在培养基中分几个阶段培养酵母菌株,首先在半厌氧生活中,然后在需氧生活中(富氧培养基/气氛),以获得起始酵母细胞的增殖;和
[0024]-通过离心分离由此产生的酵母细胞,以获得含有12%-25%酵母干物质的液体酵母膏。
[0025]
如此获得的酵母是活酵母。活酵母或活性酵母表示代谢是活性的酵母细胞群。
[0026]
在本发明的上下文中,活酵母是干酵母的形式。干酵母的特征在于低水含量,并且通常包含高于90%的酵母干物质水平,优选93%-96%的干物质水平。干酵母的优点之一是保存期长。
[0027]
因此,生产酵母细胞的方法可以进一步包括干燥细胞以获得干燥形式的酵母的后续步骤。干燥可以例如是通过冻干、流化床干燥、转鼓式干燥或喷雾干燥进行的干燥。
[0028]
根据另一个实施方案,所述酵母菌株以死酵母的形式使用。死酵母也可称为“去活性酵母”或“失活酵母”或“灭活酵母”。它是其代谢永久停止的酵母。
[0029]
死酵母可以通过本领域技术人员熟悉的技术获得,例如酵母的热处理、由使酵母经历冷冻和连续解冻的几个循环组成的处理、通过辐射的处理、通过雾化的处理或这些处理的组合。失活酵母通常为干燥形式。
[0030]
在另一个实施方案中,它是用于本发明上下文的酵母细胞的衍生物。该衍生物选自酵母细胞壁和酵母细胞壁的纯化级分。
cultures de microorganismes,cncm),institut pasteur,25rue du docteur roux,75724paris cedex 15的酿酒酵母菌株获得。
[0043]
该酿酒酵母酵母菌株之前已由本技术人描述于文献wo2009/103884中,其中它被描述为可用于预防和/或治疗肠疾病、病症或障碍;并且描述于文献wo2014/009656中,其中它被描述为可用于预防和/或治疗阴道霉菌病,特别是阴道或外阴阴道念珠菌病。
[0044]
根据本发明的优选实施方案,该酵母通过培养根据布达佩斯条约于2007年8月21日以保藏号i-3799保藏于在国家微生物培养物保藏中心(cncm),institutpasteur,25rue du docteur roux,75724paris cedex 15的酿酒酵母菌株获得。
[0045]
该菌株布拉迪酿酒酵母变种之前已由本技术人描述于文献wo2009/103884中,其中其被呈现为可用于预防和/或治疗肠疾病、病症或障碍。
[0046]
微生物群系对应于构成特定环境微生物群系的所有微生物。存在不是一种,而是几种微生物群系,其组成根据机体区域而变化。其组成例如根据需氧或厌氧培养基、根据微生物群系的酸度、根据培养基的干燥度或含水量或是否为脂肪区而变化。因此,皮肤微生物群系、阴道微生物群系、泌尿道微生物群系、呼吸道微生物群系、orl微生物群系和最大的肠道微生物群系之间存在区别。因此,重要的是记住涉及尿道疾病的病原体和阴道粘膜或肠粘膜疾病的病原体是不同的。因此,病原体和益生菌对于阴道粘膜或肠粘膜的行为不能转移到对于尿道采用的行为,因为这些粘膜的环境是不同的。
[0047]
根据本发明的具体实施方案,根据本发明的酵母是干酵母的形式。
[0048]
根据本发明的另一个实施方案,用于预防单纯性和/或复发性膀胱炎的包含至少一种酵母的组合物旨在用于口服或局部施用。
[0049]
本发明特别涉及如上定义的用于预防单纯性和/或复发性膀胱炎的组合物,其特征在于,所述组合物为硬胶囊、锭剂、丸剂、片剂、软胶囊、粉末、悬浮液、液体溶液、颗粒、阴道栓剂、凝胶或乳膏的形式。本领域技术人员能够选择用于制备给定类型的制剂的最适合的载体和赋形剂。
[0050]
根据本发明的组合物还可以包含添加剂,例如防腐剂、甜味剂、调味剂、增稠剂、着色剂、润湿剂、崩解剂、吸收促进剂、润滑剂等。
[0051]
本发明特别涉及如上定义的用于预防单纯性和/或复发性膀胱炎的组合物,其特征在于,所述组合物是食品组合物或膳食补充剂。
[0052]“食品组合物”表示任何食物、饮料或糖果。
[0053]
食品组合物可以是例如饮料、谷物棒、口香糖或乳制品。
[0054]“膳食补充剂”是指目的在于补充正常膳食并且构成单独或组合的营养物或具有营养或生理效应的其它物质的浓缩来源的食品。
[0055]
膳食补充剂以剂型销售,例如剂型,诸如胶囊、锭剂、片剂、丸剂和其它类似形式、粉末的小袋、液体的安瓿、具有滴管的瓶和其它类似形式的液体或粉末制剂,其旨在以少量的测量单位服用。
[0056]
本发明还涉及如上定义的用于预防单纯性和/或复发性膀胱炎的组合物,其特征在于,其还包含另一种活性成分。
[0057]
当组合物旨在用于口服使用时,其它活性成分是基于植物的,选自蔓越莓、越橘、红蔓越莓、杨梅、石南或其混合物的提取物。
[0058]
在本发明的一个具体实施方案中,其它活性成分不是酵母。
[0059]
本发明还涉及用于预防单纯性和/或复发性膀胱炎的医疗装置,其特征在于,其包含如上所述的组合物。
[0060]
根据本发明的有利实施方案,医疗装置是棉塞或卫生巾、乳膏、凝胶、阴道栓剂、片剂、胶囊、锭剂、丸剂和其它类似形式。
[0061]
现在将通过下文提供的实施例和附图来说明本发明,这些实施例和附图出于说明的目的而提供,并且不以任何方式进行限制。
附图说明
[0062]
[图1]显示每个测试组的肠切片中upec菌株的cfu数量。
[0063]
[图2]显示每个测试组的尿中的以cfu/ml(log10)计的细菌载量。
[0064]
[图3]显示每个测试组的膀胱中的以cfu/ml(log10)计的细菌载量。
[0065]
[图4]显示每个测试组的肾中以cfu/ml(log10)计的细菌载量。
具体实施方式
[0066]
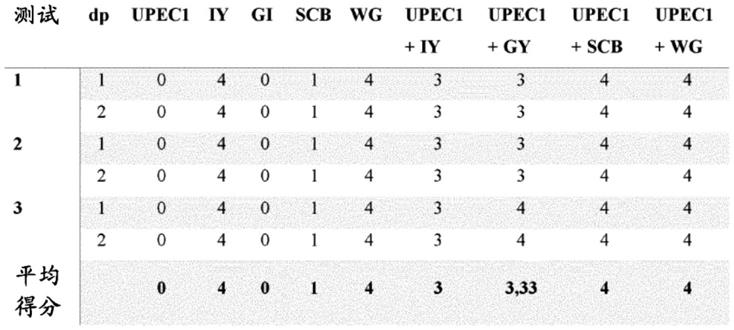
实施例1:酵母与upec菌株的共聚集测试
[0067]
材料和方法
[0068]
upec菌株
[0069]
两个尿道致病性大肠杆菌菌株用于本实施例中,并从中段尿样中分离。
[0070]
所用的第一大肠杆菌菌株称为upec1,对所有抗生素敏感。
[0071]
所用的第二大肠杆菌菌株称为upec2,对抗生素具有多重耐药性。
[0072]
upec菌株的生长条件
[0073]
在测试前将大肠杆菌菌株在37℃下在米勒-海顿琼脂上培养过夜。然后,将菌株通过以11000rpm离心5分钟收集,用磷酸缓冲盐水(pbs)的无菌溶液洗涤两次,将浓度调节至所需浓度,并重悬于相同缓冲液中。
[0074]
测试的酵母
[0075]
对两种upec菌株中的每一种测试的酵母如下:
[0076]-失活酵母酿酒酵母cncmi-3856(iy),其干物质含量为≥94%并且ph为5.5-6.3,
[0077]-活酵母酿酒酵母cncmi-3856(gi),其含量为≥5.109cfu/g,
[0078]-活酵母布拉迪酿酒酵母变种cncmi-3799(scb),含量为≥2.10
10
cfu/g,
[0079]-细胞壁葡聚糖(wg),其β-葡聚糖含量为≥50%。
[0080]
在测试之前,用pbs缓冲液再水合酵母。
[0081]
共聚集方案
[0082]
以等于酵母(10mg/ml)的体积添加pbs缓冲液中的upec菌株(1
×
109个细胞/ml)。
[0083]
将该混合物涡旋至少10秒并在37℃下在搅拌下以每孔1ml的速率在24孔板中沉积4小时。
[0084]
然后,在倒置透射光学显微镜中观察悬浮液以评价聚集程度并根据以下等级给出得分:
[0085]
0=无聚集
[0086]
1=包含小可见簇的小聚集体
[0087]
2=在孔的中心建立的包含大量微生物的聚集体
[0088]
3=包含在孔的中心建立的更大组的肉眼可见的簇
[0089]
4=分配用于描述孔的中心处的大的肉眼可见的簇的最大分数。
[0090]
平行地,也根据上文给出的相同方案(但不向混合物中加入upec菌株)测试不同酵母彼此自聚集的能力。单独测试酵母。
[0091]
结果
[0092]
结果来自3个彼此独立的测试,每个测试用双份样品进行(下文称为dp)。
[0093]
自聚集和共聚集测试的结果在下表1和2中给出。
[0094]
[表1]
[0095][0096]
upec1和酵母之间的自聚集和共聚集测试的结果
[0097]
[表2]
[0098][0099]
upec2和酵母之间的自聚集和共聚集测试的结果
[0100]
酵母和upec菌株的自聚集能力
[0101]
活酵母(gi)、upec1和upec2的分离物不能自聚集,这些分离物中的每一种获得的得分为0。
[0102]
布拉迪酿酒酵母变种(scb)的分离物显示出有限的自聚集能力,这些分离物的得分为1。
[0103]
失活酵母(iy)和细胞壁葡聚糖(wg)的分离物显示出强的自聚集,这些分离物中每一种的得分为4。
[0104]
酵母诱导与upec菌株聚集的能力
[0105]
iy、gi、scb和wg的分离物能够聚集大肠杆菌的2个分离物upec1和upec2。
[0106]
特别地,分离物upec2具有与gi、scb和wg的最大共聚集得分,然后与iy具有略低的得分(参见表2)。upec1的分离物与scb、wg具有最大得分,然后与gi和iy具有略低的得分(参见表1)。
[0107]
结论
[0108]
诱导与大肠杆菌共聚集的能力可能构成建立和维持健康泌尿生殖菌群的重要现象和对抗泌尿生殖感染的重要防御机制。
[0109]
因此,本实施例表明:
[0110]-所测试的所有化合物能够诱导与upec1和upec2菌株的共聚集。
[0111]-酵母scb和wg能够与upec1和upec2共聚集,具有最大得分;
[0112]
酵母gi和iy能够与upec1和upec2共聚集。
[0113]
因此,益生菌可以与对抗生素具有多重耐药性的菌株共聚集。因此,在治疗对抗生素具有多重耐药性的尿路感染期间,使用酵母部分替代或补充抗生素疗法作为辅助手段存在真实益处。
[0114]
实施例2:通过尿道致病性菌株评价酵母对鼠肠定殖的作用
[0115]
材料和方法
[0116]
鼠模型
[0117]
使用的动物模型是7周龄的balb/cyj系雌性小鼠。将小鼠以5只一组圈养在通风支持物上。
[0118]
尿道致病性菌株
[0119]
实施例中使用的尿道致病性菌株是对抗生素多重耐药的大肠杆菌的尿道致病性菌株,下文称为upec3。
[0120]
测试的酵母
[0121]
所测试的酵母如下:
[0122]
失活酵母酿酒酵母cncmi-3856(iy),其干物质含量为≥94%并且ph为5.5-6.3,
[0123]-活酵母酿酒酵母cncmi-3856(gi),含量为≥5.109cfu/g。
[0124]
方案
[0125]
在d(=天)-2天,收集粪便并将硫酸链霉素(5mg/ml)加入饮用水中,持续2天以减少常驻需氧/厌氧细菌。通过将每只动物放置在空笼中持续收集2-4个粪便团粒所花费的时间来收集粪便,然后将其转移至预称重的2ml无菌管中。然后,称重试管,并将粪便样品重悬于1ml pbs中,系列稀释至1:10,并沉积在添加100μg/ml链霉素和卡那霉素的drigalski琼脂培养基的培养皿上。
[0126]
d=0,接种upec3菌株
[0127]
在细菌接种之前,收集小鼠的粪便以证实不存在对链霉素和卡那霉素具有耐药性的肠细菌。
[0128]
upec3菌株的接种通过口服灌胃以1
×
107cfu的剂量进行。从lb(“溶原性肉汤”)液体培养基中的过夜培养物获得接种物,然后在200μl碳酸氢钠溶液中稀释。
[0129]
同时,用1mg/ml硫酸卡那霉素水溶液代替饮用水2天。
[0130]
d=1,通过灌胃按如下每日施用实验处理:
[0131]
第1组(对照):分配在2个笼中的10只小鼠接受200μl pbs;
[0132]
第2组(iy):分配在2个笼中的10只小鼠接受1mg重悬于200μl pbs中的化合物iy;
[0133]
第3组(gi):分配在2个笼中的10只小鼠接受1mg重悬于200μl pbs中的化合物gi。
[0134]
d=14,未施用处理。
[0135]
将动物处死并解剖以去除回肠肠切片和结肠。在去除过程中,将器官的内容物排空,并在无菌条件下用无菌pbs洗涤。
[0136]
将称重的肠切片在温和的macs
tm octo解离器中在pbs中匀化,并在微量滴定板中从10稀释至10。然后,将来自各稀释液的等分试样沉积在添加100μg/ml链霉素和卡那霉素的drigalsky琼脂培养基的培养皿上,用于计数粘附的upec3菌株。一式三份进行沉积。手动进行计数。
[0137]
结果
[0138]
来自第3组(gi)的一只小鼠在第7天死亡,没有确切原因,但可能是由于重复灌胃的压力。
[0139]
来自第2组(iy)的一只小鼠的结肠的肠切片不可用。
[0140]
图1显示了在第14天测试的各组的肠切片中upec3菌株的cfu数量。(*p《0.05;***p《0.0001)
[0141]
在第2组(iy)的肠回肠切片部分中观察到upec3菌株数量的显著降低(mann-whitney检验)。
[0142]
观察到第2组(iy)和第3组(gi)结肠中upec3菌株的数量显著降低。
[0143]
结论
[0144]
对照组的回肠和结肠中的粘附菌群水平显著高于接受酵母的其它两组。更准确地说,在结肠切片中可以看出,两种产物导致粘附的upec3菌株水平的显著降低,而在回肠切片中仅产物iy具有显著的作用。但是,对于产品gi,回肠切片中的作用几乎是显著的,因为对于9只小鼠中的4只,粘附的upec3菌株的水平达到检测阈值。
[0145]
因此,活酵母和失活酵母这两种产物显示出降低粘附于肠上皮的大肠杆菌的尿道致病性菌株水平的能力。
[0146]
因此,这两种酵母能够折中upec3菌株的肠贮库的维持。
[0147]
实施例3:酵母的抗感染功效的评价
[0148]
材料和方法
[0149]
大肠杆菌菌株
[0150]
使用在本实施例中称为upec4的尿道致病性大肠杆菌菌株。
[0151]
测试的化合物
[0152]
缓冲液
[0153]
使用的缓冲溶液是pbs1x缓冲溶液。
[0154]
酵母
[0155]
评价的酵母是干燥形式的活酵母酿酒酵母cncmi-3856,下文称为gi。在再水化之前,酵母为干燥形式并且具有≥5.109cfu/g的含量。在测试之前,用pbs缓冲液再水合酵母。
[0156]
妥布霉素
[0157]
妥布霉素被用作强力抗生素和参考药品。在测试之前,用pbs缓冲液悬浮妥布霉素。
[0158]
动物模型
[0159]
使用的动物模型是8周龄的c57bl/6j系雌性小鼠。将小鼠以5只一组饲养在约22℃的温度下的碎木屑上。将它们用供大鼠和小鼠的标准的完全维持饮食(如)喂养,并且随意饮水。
[0160]
测试组
[0161]
使用8周龄的每组10只雌性小鼠(除了第1组,其仅5只雌性)。
[0162]
测试组如下:
[0163]
g1:小鼠+upec4+缓冲液=对照;
[0164]
g2:小鼠+upec4+妥布霉素(30mg/kg)=阳性对照;
[0165]
g3:小鼠+upec4+gi(13.5mg/kg)。
[0166]
方案
[0167]
测试化合物的施用
[0168]
对于第1组和第3组,在感染前24小时和1小时局部施用(经尿道施用)化合物。在第3组中,在感染前1小时腹膜内施用参考药品妥布霉素。
[0169]
感染upec4小鼠
[0170]
首先用异氟烷(3%)麻醉小鼠。感染前将尿液从膀胱中排出。然后,用50μl的upec4感染小鼠(在2-3秒内施用),即通过经尿道途径施用6x107cfu(菌落形成单位)的upec4。
[0171]
经尿道途径的感染通过将与30g皮下注射针连接的无菌聚乙烯管(内部尺寸0.28mm,外部尺寸0.61mm)插入尿道中来进行。
[0172]
感染后20小时,从每只小鼠收集尿样。取出膀胱和肾并匀浆用于cfu计数。
[0173]
用于测定细菌载量(cfu)的样品制备
[0174]
接种upec菌株20小时后,通过吸入co2处死动物。使用一次性灭菌使用的匀浆体系将右肾和一半膀胱在灭菌等渗盐水中匀浆。用等渗盐水溶液对样品(尿、肾和膀胱匀浆物)进行1/10的连续稀释。然后,将各稀释液的10μl等分试样沉积在bhi(“脑心浸液”)琼脂培养基的培养皿上。一式两份进行沉积。然后,将培养皿在37℃下孵育过夜以测定cfu中活细菌的数目。由两名受试者手动进行计数。
[0175]
结果的统计分析
[0176]
在开始统计分析之前,进行agostino和pearson测试以确定变量是否遵循正常规律。
[0177]
基于正态性检验的结果,使用参数检验(单因子anova,随后是dunnett事后检验,用于正态分布数据)或非参数检验(kruskal wallis,随后是dunn检验的多重比较,用于异常分布)进行实验组之间差异的统计学评价。
[0178]
grubb测试用于确定组中的值之一是否是显著的异常值。
[0179]
数值表示为平均值
±
sem。p≤0.05的值被认为是统计学显著的。
[0180]
结果
[0181]
图2显示了每个测试组的尿液中cfu的细菌载量(n.s:不显著,与g1相比的g2和g3,*p《0.05,***p《0.001)。
[0182]
相对于感染upec4的第1组中的小鼠,在感染upec4并用gi(第3组)和妥布霉素(第2组)处理的小鼠中观察到尿中cfu的显著降低。
[0183]
图3显示了每个测试组的膀胱中cfu的细菌载量(n.s:不显著,与g1相比的g2和g3,*p《0.05,***p《0.001)。
[0184]
相对于感染upec4的第1组中的小鼠,在感染upec4并用gi(第3组)和妥布霉素(第2组)处理的小鼠中观察到膀胱中cfu的显著降低。
[0185]
图4显示了每个测试组的肾中cfu的细菌载量(n.s:不显著,与g1相比的g2和g3,*p《0.05,***p《0.001)。
[0186]
相对于感染upec4的第1组中的小鼠,在感染upec4并用gi(第3组)和妥布霉素(第2组)处理的小鼠中观察到肾中cfu的显著降低。
[0187]
结论
[0188]
在小鼠模型中,upec4菌株诱导细菌载量的显著增加。
[0189]
在感染upec4菌株的小鼠中局部施用活酵母酿酒酵母cncmi-3856诱导尿、膀胱和肾中细菌载量的显著降低。
[0190]
因此,通过局部施用活酵母酿酒酵母cncmi-3856,尿道致病性大肠杆菌菌株对尿道的感染被非常活性地抑制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1