针对iRhom2的蛋白结合物的制作方法
针对irhom2的蛋白结合物
技术领域
1.本技术涉及针对irhom2的蛋白结合物。
背景技术:
2.adam金属肽酶结构域17(adam17)(人adam17的ncbi参考:np_003174)也称为tace(肿瘤坏死因子-α-转化酶),是属于去整合素和金属蛋白酶的adam蛋白家族的70-kda酶。其为824个氨基酸的多肽。
3.adam17被理解为参与肿瘤坏死因子α(tnf-α)在细胞表面的加工,并来自反面高尔基网的胞内膜之内。该过程(也称为“脱落(shedding)”)涉及从膜结合的前蛋白(如pro-tnf-α)切割和释放可溶性胞外域,并且具有已知的生理学重要性。adam17是首个被鉴定的“脱落酶”,并且还理解为在各种各样的膜锚定细胞因子、细胞粘附分子、受体、配体和酶的释放中发挥作用。
4.tnf-α基因的克隆显示出其编码26kda ii型跨膜前多肽,其在内质网中易位期间插入细胞膜中。在细胞表面,pro-tnf-α呈生物活性,并且能够经由近分泌胞间信号传导来诱导免疫应答。然而,pro-tnf-α可在其ala76-val77酰胺键处经历蛋白水解切割,其从pro-tnf-α分子中释放出可溶性17kda胞外结构域(胞外域)。该可溶性胞外域是通常称为tnf-α的细胞因子,其在该分子的旁分泌信号传导中至关重要。可溶性tnf-α的这种蛋白水解释放由adam17催化。
5.adam17还通过调节乳腺中egfr配体双调蛋白的切割来调节map激酶信号传导途径。此外,adam17在细胞粘附分子l-选择素的脱落中起作用。
6.最近,adam17被发现是放疗抗性形成的关键介质。放疗可以诱导弗林蛋白酶介导的adam17前型切割为活性adam17的剂量依赖性增加,这导致体外和体内增强的adam17活性。还显示放疗活化非小细胞肺癌中的adam17,其导致多种存活因子脱落、生长因子途径活化,以及放疗诱导的治疗抗性。
7.由于adam17似乎是包括tnfα在内的不同病原性和非病原性因子释放的关键因素,其作为治疗靶分子已成为关注的焦点。为此,已经作出了不同的尝试来开发adam17的抑制剂。
8.然而,迄今为止,尚未证明此类抑制剂在临床上是成功的。
9.因此,本发明的一个目的在于提供允许控制、调节、降低或抑制adam17活性的新方法。
10.本发明的另一个目的在于提供允许治疗炎性疾病的新方法。
11.这些和其他目的通过独立权利要求的特征得到解决。从属权利要求公开可在特定情况下优选的本发明的实施方案。同样,本说明书公开可在特定情况下优选的本发明的其他实施方案。
技术实现要素:
12.本发明尤其提供了一种蛋白结合物,其与人irhom2结合并且当与人irhom2结合时抑制和/或降低tace/adam17活性。
附图说明
13.图1显示用于免疫和肽结合elisa分析的本文所用的肽的序列。这些肽是整个irhom2或irhom1序列的亚序列。为了增加免疫原性,一些肽经由半胱氨酸的sh基团与klh(钥孔戚血蓝蛋白)缀合。相反,对于肽结合分析,这些肽与生物素缀合。为此目的,使用天然存在于各个肽的n或c末端的半胱氨酸,或者将半胱氨酸添加到n或c末端(图1中标记为
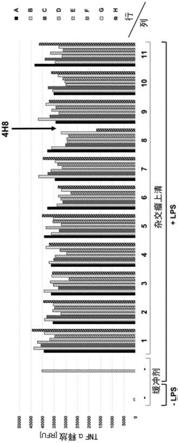
“‑c‑”
)。为了避免klh和/或生物素的非特异性链内二硫键形成或非特异性链内缀合,链内半胱氨酸被氨基丁酸(在图1中标记为“abu”)取代。
14.图2显示用于功能性筛选杂交瘤上清液的tnfα释放测定(脱落测定)的结果,表明杂交瘤克隆4h8的上清液有效地干扰thp-1细胞中lps诱导的tnfα脱落。
15.图3示出抗体同种型确定的elisa分析结果,表明本发明的抗体4h8-e3为小鼠igm同种型。
16.图4显示肽结合elisa分析的结果,显示出本发明的抗体4h8-e3识别人irhom2的大胞外环1部分(“近膜结构域”,jmd)内的表位,该部分邻近第一“跨膜结构域”(tmd1)。
17.本发明的抗体4h8-e3识别肽3,其对应于人irhom2的第431至459位氨基酸,即邻近tmd1的人irhom2的大胞外环1的jmd部分(“近膜结构域”)。
18.图5显示肽结合elisa分析的结果,显示出本发明的抗体4h8-e3识别人irhom2的邻近tmd1的胞外近膜区内的表位,但不识别人irhom1的同源区内的表位。本发明的抗体4h8-e3识别肽3,但不识别肽3b,其对应于人irhom1的相应同源部分。
19.图6显示tnfα释放测定的结果,表明本发明的抗体4h8-e3抑制thp-1细胞中lps诱导的tnfα脱落。
20.图7显示tnfα释放测定的结果,表明在thp-1细胞中本发明的抗体4h8-e3对lps诱导的tnfα脱落的浓度依赖性抑制。
21.图8显示irhom2的示意图,其中说明邻近tmd1的近膜结构域(a)、环1(b)和c末端(c)的位置。
22.图9示出根据seq id no 16的人irhom2的氨基酸序列,所示序列对应于本发明所用的免疫肽。
23.图10显示根据seq id no 16的人irhom2和根据seq id no 17的人irhom1的比对。灰色区域显示对应于本发明所用的免疫肽3的序列。
24.发明详述
25.根据本发明的一个方面,提供了一种蛋白结合物,其与人irhom2结合,并且当与人irhom2结合时抑制和/或降低tace/adam17活性。
26.菱形家族成员2(irhom2)是人体内由rhbdf2基因编码的蛋白质。其为由约850个氨基酸组成的跨膜蛋白,具有七个跨膜结构域。本发明的发明人首次表明irhom2可充当蛋白结合物的靶标以抑制tace/adam17活性。
27.irhom2有不同的同种型(isoform)。本文进行的实验已经用定义为ncbi参考np_
078875.4的同种型建立。然而,教导内容可非限制性地转换到irhom2的其他同种型,如下表所示:
[0028][0029]
如本文所用,术语“抑制和/或降低tace/adam17活性”意在描述由阻断或降低tace/adam17活性的蛋白结合物引起的效应,如例如在相应的脱落测定中所测量(参见例如图2和实施例5)。
[0030]
根据一个或多个实施方案,蛋白结合物是单克隆抗体或其保留靶结合能力的靶结合片段或衍生物、或抗体模拟物。
[0031]
如本文所用,术语“单克隆抗体(mab)”应当指具有同质抗体群体,即由全免疫球蛋白或其保留靶结合能力的片段或衍生物组成的同质群体的抗体组合物。尤其优选的此类抗体选自igg、igd、ige、iga和/或igm、或其保留靶结合能力的片段或衍生物。
[0032]
如本文所用,术语“片段”应当指此类抗体的保留靶结合能力的片段,例如
[0033]
·
cdr(互补决定区)
[0034]
·
高变区,
[0035]
·
可变结构域(fv)
[0036]
·
igg或igm重链(由vh、ch1、铰链、ch2和ch3区组成)
[0037]
·
igg或igm轻链(由vl和cl区组成),和/或
[0038]
·
fab和/或f(ab)2。
[0039]
如本文所用,术语“衍生物”应指在结构上不同于普遍抗体概念,但仍与普遍抗体概念具有一些结构关系的蛋白质构建体,例如scfv、fab和/或f(ab)2,以及双特异性、三特异性或更高特异性的抗体构建体,并且还保留了靶结合能力。以下解释了所有这些项目。
[0040]
技术人员已知的其他抗体衍生物是双抗体(diabodies)、骆驼抗体(camelid antibodies)、纳米抗体(nanobodies)、域抗体(domain antibodies)、具有由scfv、iga组成的两条链的二价同源二聚体(由j链和分泌片连接的两个igg结构)、鲨鱼抗体、由新世界灵长类框架加上非新世界灵长类cdr组成的抗体、包含ch3+vl+vh的二聚化构建体,以及抗体缀合物(例如,与毒素、细胞因子、放射性同位素或标记连接的抗体或片段或衍生物)。这些类型在文献中有充分描述,并且可由技术人员基于本公开使用,而不进一步增加发明活动。
[0041]
&milstein(1975)中公开了用于产生杂交瘤细胞的方法。
[0042]
用于产生和/或选择嵌合或人源化mab的方法是本领域已知的。例如,genentech的us6331415描述了嵌合抗体的产生,而医学研究委员会(medical research council)的us6548640描述了cdr移植技术,并且celltech的us5859205描述了人源化抗体的产生。
[0043]
产生和/或选择完全人mab的方法是本领域已知的。这些可包括使用经相应的蛋白质或肽免疫的转基因动物,或者使用合适的展示技术,如酵母展示、噬菌体展示、b细胞展示或核糖体展示,其中在稳定期针对人irhom2筛选文库中的抗体。
[0044]
体外抗体文库尤其公开于morphosys的us6300064和mrc/scripps/stratagene的us6248516中。噬菌体展示技术例如公开于dyax的us5223409中。转基因哺乳动物平台例如描述于taconicartemis的ep1480515a2中。
[0045]
igg、igm、scfv、fab和/或f(ab)2是技术人员公知的抗体形式。相关的启用技术可从相应的教科书获得。
[0046]
如本文所用,术语“fab”涉及包含抗原结合区的igg/igm片段,所述片段由来自抗体的各重链和轻链的一个恒定区和一个可变区构成。
[0047]
如本文所用,术语“f(ab)
2”涉及由通过二硫键彼此连接的两个fab片段组成的igg/igm片段。
[0048]
如本文所用,术语“scfv”涉及单链可变片段,其是免疫球蛋白的重链和轻链的可变区的融合体,用短接头(通常是丝氨酸(s)或甘氨酸(g))连接在一起。该嵌合分子保留了原始免疫球蛋白的特异性,尽管除去了恒定区并引入了接头肽。
[0049]
经修饰抗体形式为例如双特异性或三特异性抗体构建体、基于抗体的融合蛋白、免疫缀合物等。这些类型在文献中有充分描述,并且可由技术人员基于本公开且进一步增加发明活动来使用。
[0050]
如本文所用,术语“抗体模拟物”涉及有机分子,最常见的是与靶蛋白特异性结合的蛋白质,类似于抗体,但在结构上不与抗体相关。抗体模拟物通常是具有约3至20kda摩尔质量的人工肽或蛋白质。该定义尤其涵盖affibody分子、affilins、affimers、affitins、alphabodies、anticalins、avimers、darpins、fynomers、kunitz结构域肽、monobodies和nanoclamps。
[0051]
在一个或多个实施方案中,蛋白结合物是分离抗体、或其保留靶结合能力的靶结合片段或衍生物、或分离抗体模拟物。
[0052]
在一个或多个实施方案中,抗体是工程化或重组抗体、或其保留靶结合能力的靶结合片段或衍生物、或工程化或重组抗体模拟物。
[0053]
根据本发明的一个或多个实施方案,tace/adam17活性的抑制或降低由干扰irhom2介导的tace/adam17活化引起。
[0054]
根据本发明的一个或多个实施方案,抗体抑制或减少tnfα脱落。
[0055]
如本文所用,tnfα脱落是指膜锚定肿瘤坏死因子α(mtnfα/pro-tnfα)释放到环境中变成可溶性tnfα(stnfα或简称为tnfα)的过程。该过程尤其由tace/adam17触发。
[0056]
根据本发明的一个或多个实施方案,蛋白结合物所结合的人irhom2包含:
[0057]
a)seq id no 16所示的氨基酸序列,或
[0058]
b)与seq id no 16具有至少80%序列相同性的氨基酸序列,条件是所述序列保持irhom2活性。
[0059]
在一些实施方案中,人irhom2包含与seq id no 16具有≥81%,优选地≥82%,更优选地≥83%、≥84%、≥85%、≥86%、≥87%、≥88%、≥89%、≥90%、≥91%、≥92%、≥93%、≥94%、≥95%、≥96%、≥97%、≥98%或最优选地≥99%序列相同性的氨基酸序列。
[0060]
seq id no 16表示非活性菱形蛋白2(irhom2)同种型1[智人]的氨基酸序列,可以ncbi参考np_078875.4获得。通常,存在irhom2的不同变体和同种型。同样,存在或可能存在
包含保守或沉默氨基酸置换的突变体,其保持完全或至少显著的irhom2活性。这些同种型、变体和突变体由以上指定的相同性范围涵盖,然而,这意味着功能异常的非活性变体和突变体被排除在外。
[0061]
在该语境中,“保守氨基酸置换”对抗体功能的影响比非保守置换更小。尽管存在将氨基酸分类的许多方式,但通常基于其结构和其r基团的一般化学特征,将它们分成六个主要类别。
[0062]
在一些实施方案中,“保守氨基酸置换”是其中氨基酸残基被具有类似侧链的氨基酸残基取代的置换。例如,本领域定义了具有类似侧链的氨基酸残基的家族。这些家族包括具有以下的氨基酸:
[0063]
·
碱性侧链(例如赖氨酸、精氨酸、组氨酸),
[0064]
·
酸性侧链(例如天冬氨酸、谷氨酸),
[0065]
·
不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸),
[0066]
·
非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸),
[0067]
·
β支化侧链(例如苏氨酸、缬氨酸、异亮氨酸)和
[0068]
·
芳族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。
[0069]
其他保守氨基酸置换也可跨越氨基酸侧链家族发生,如当用天冬酰胺置换天冬氨酸以改变肽的电荷时。保守性改变还可包括化学上同源的非天然氨基酸的置换(即,合成非天然疏水性氨基酸取代亮氨酸,合成非天然芳族氨基酸取代色氨酸)。
[0070]“序列相同性百分比”通过在比较窗口上比较两个最佳比对序列来确定,其中与不包含添加或缺失的参考序列(例如多肽)相比,比较窗口中的多核苷酸序列的部分可包含添加或缺失(即空位),以使两个序列最佳比对。通过确定两个序列中出现相同核酸碱基或氨基酸残基的位置的数目以产生匹配位置的数目,将匹配位置的数目除以比较窗口中位置的总数目并将结果乘以100以产生序列相同性的百分比来计算百分比。
[0071]
在两个或更多个核酸或多肽序列的语境中,术语“相同”或“相同性百分比”是指两个或更多个序列或亚序列为相同的序列。当在比较窗口或指定区域上比较和比对以获得最大对应性时,如果两个序列具有指定百分比的相同的氨基酸残基或核苷酸(即,在指定区域上或者未指定时在参考序列的整个序列上至少85%、90%、95%、96%、97%、98%或99%的序列相同性),两个序列是“基本上相同的”,如使用以下序列比较算法之一或者通过手动比对和视觉检查所测量。本公开提供了分别与本文例示的多肽或多核苷酸基本上相同的多肽或多核苷酸。任选地,相同性存在于长度为至少约15、25或50个核苷酸的区域上,或更优选地长度为100至500或1000个或更多个核苷酸的区域上,或参考序列的全长上。关于氨基酸序列,相同性或基本相同性可存在于长度为至少5、10、15或20个氨基酸,任选地长度为至少约25、30、35、40、50、75或100个氨基酸,任选地长度为至少约150、200或250个氨基酸的区域上,或参考序列的全长上。关于较短的氨基酸序列,例如20个或更少个氨基酸的氨基酸序列,根据本文所定义的保守置换,当一个或两个氨基酸残基被保守置换时,存在基本相同性。
[0072]
根据本发明的一个或多个实施方案,蛋白结合物与人irhom2的邻近跨膜结构域1
(tmd1)的胞外近膜结构域结合。
[0073]
邻近跨膜结构域1(tmd1)的近膜结构域是涵盖第一跨膜结构域(tmd1)c末端的一段氨基酸的区域。参见图8和9进行说明。
[0074]
在一个实施方案中,邻近跨膜结构域1(tmd1)的近膜结构域包含seq id no 16所示的氨基酸序列的或与seq id no 16具有至少80%序列相同性的氨基酸序列的氨基酸431
–
459。
[0075]
在另一个实施方案中,邻近跨膜结构域1(tmd1)的近膜结构域包含seq id no 16所示的氨基酸序列的或与seq id no 16具有至少80%序列相同性的氨基酸序列的氨基酸431
–
447。
[0076]
根据本发明的一个或多个实施方案,蛋白结合物与人irhom2的氨基酸序列结合,该人irhom2的氨基酸序列包括:
[0077]
a)至少seq id no 3所示的氨基酸序列,或
[0078]
b)与seq id no 3具有至少90%序列相同性的氨基酸序列。
[0079]
在一些实施方案中,氨基酸序列与seq id no 3具有≥91%,优选地≥92%,更优选地≥93%≥94%、≥95%、≥96%、≥97%、≥98,或最优选地≥99%的序列相同性。
[0080]
在一个实施方案中,抗体结合如上所示的整个氨基酸序列。在另一个实施方案中,抗体还结合seq id no3以外、或与seq id no 3具有至少90%序列相同性的氨基酸序列以外的人irhom2的其他氨基酸序列。
[0081]
取决于其他氨基酸的位置,抗体所结合的表位是线性的或构象的。
[0082]
根据本发明的一个或多个实施方案,蛋白结合物与人irhom2的一个或多个氨基酸序列结合,每个氨基酸序列包含seq id no 3所示的氨基酸序列内的一个或多个氨基酸。
[0083]
在一个实施方案中,抗体结合seq id no 3内的一个离散子序列,该子序列包含一个或多个氨基酸。
[0084]
在一个实施方案中,抗体结合seq id no 3内的两个或更多个离散子序列,每个子序列包含一个或多个氨基酸。
[0085]
根据本发明的一个或多个实施方案,蛋白结合物与选自a431、q432、h433、v434、t435、t436、q437、l438、v439、l440、r441、n442、k443、g444、v445、y446、e447、s448、v449、k450、y451、i452、q453、q454、e455、n456、f457、w458、v459的至少一个氨基酸残基结合,其中氨基酸残基的编号是相对于seq id no 16(人irhom2)所示的氨基酸序列的。
[0086]
在一个或多个实施方案中,蛋白结合物与来自以上列表的≥2、≥3、≥4、≥5、≥6、≥7、≥8、≥9、≥10、≥11、≥12、≥13、≥14、≥15、≥16、≥17、≥18、≥19、≥20、≥21、≥22、≥23、≥24、≥25、≥26、≥27、≥28、或≥29个氨基酸残基结合。相应的氨基酸残基可以以离散、连续的序列存在,或者以seq id no 3内的两个或更多个簇存在。
[0087]
在另一个实施方案中,蛋白结合物与人irhom2的氨基酸序列结合,该人irhom2的氨基酸序列包含至少seq id no 4所示的氨基酸序列、或与seq id no 4具有至少90%序列相同性的氨基酸序列。关于序列相同性,应用相同的回退位置。
[0088]
在一个实施方案中,抗体结合如上所示的整个氨基酸序列。在另一个实施方案中,抗体还结合seq id no 4以外、或与seq id no 4具有至少90%序列相同性的氨基酸序列以外的人irhom2的其他氨基酸序列。
[0089]
取决于其他氨基酸的位置,抗体所结合的表位是线性的或构象的。
[0090]
根据本发明的一个或多个实施方案,蛋白结合物与人irhom2的一个或多个氨基酸序列结合,每个氨基酸序列包含seq id no 4所示的氨基酸序列内的一个或多个氨基酸。
[0091]
在一个实施方案中,抗体结合seq id no 4内的一个离散子序列,该子序列包含一个或多个氨基酸。
[0092]
在一个实施方案中,抗体结合seq id no 4内的两个或更多个离散子序列,每个子序列包含一个或多个氨基酸。
[0093]
根据本发明的一个或多个实施方案,蛋白结合物与选自a426、p427、v428、g429、f430、a431、q432、h433、v434、t435、t436、q437、l438、v439、l440、r441、n442、k443、g444、v445、y446、e447、s448、v449、k450、y451、i452、q453、q454、e455、n456、f457、w458、v459的至少一个氨基酸残基结合,其中氨基酸残基的编号是相对于seq id no 16(人irhom2)所示的氨基酸序列的。
[0094]
在一个或多个实施方案中,蛋白结合物与来自以上列表的≥2、≥3、≥4、≥5、≥6、≥7、≥8、≥9、≥10、≥11、≥12、13、≥14、≥15、≥16、≥17、≥18、≥19、≥20、≥21、≥22、≥23、≥24、≥25、≥26、≥27、≥28、≥29、≥30、≥31、≥32、≥33或≥34个氨基酸残基结合。相应的氨基酸残基可以以离散、连续的序列存在,或者以seq id no 3内的两个或更多个簇存在。
[0095]
根据本发明的一个或多个实施方案,蛋白结合物不与人irhom1、或其邻近跨膜结构域1(tmd1)的近膜结构域交叉反应。
[0096]
根据本发明的一个或多个实施方案,蛋白结合物与小鼠irhom2、或其邻近跨膜结构域1(tmd1)的近膜结构域交叉反应。
[0097]
根据本发明的一个或多个实施方案,蛋白结合物是呈选自以下形式中的至少一种的抗体:igg、scfv、fab、(fab)2。
[0098]
根据本发明的一个或多个实施方案,蛋白结合物是具有选自igg、igm的同种型的抗体。
[0099]
根据本发明的一个或多个实施方案,蛋白结合物是小鼠、嵌合、人源化或人抗体。
[0100]
根据本发明的一个实施方案,蛋白结合物是抗体4h8-e3。在一个实施方案中,蛋白结合物是包含4h8-e3的可变结构域或cdr的抗体。
[0101]
根据本发明的一个实施方案,蛋白结合物
[0102]
a)包含一组重链/轻链互补决定区(cdr),其包含在seq id no 33和40所示的重链/轻链可变区序列对中,
[0103]
b)包含一组重链/轻链互补决定区(cdr),其包含以下序列:
[0104]
·
hc cdr1(seq id no 34或37)
[0105]
·
hc cdr2(seq id no 35或38)
[0106]
·
hc cdr3(seq id no 36或39)
[0107]
·
lc cdr1(seq id no 41或44)
[0108]
·
lc cdr2(seq id no 42或45),以及
[0109]
·
lc cdr3(seq id no 43或46)
[0110]
c)包含b)的重链/轻链互补决定区(cdr),条件是cdr中的至少一者相对于相应的
seq id no 34
–
39或41
–
46具有至多3个氨基酸置换,和/或
[0111]
d)包含b)或c)的重链/轻链互补决定区(cdr),条件是cdr中的至少一者与相应的seq id no 34
–
39或41
–
46具有≥66%序列相同性,
[0112]
其中cdr被嵌入在合适的蛋白框架中,以便能够以足够的结合亲和力结合人irhom2并抑制或降低tace/adam17活性。
[0113]
这些cdr是用不同方法测定的抗体4h8-e3的cdr组(seq id no 34
–
39用paratome cdr鉴定工具(http://ofranservices.biu.ac.il/site/services/paratome)测定,且seq id no 41
–
46用内部方法测定)。
[0114]
如本文所用,术语“cdr”或“互补决定区”旨在意指在重链和轻链多肽的可变区内存在的非连续抗原结合位点。这些特定区域已由kabat等人(1977),kabat等人(1991),chothia等人(1987)和maccallum等人,(1996)描述,其中当相互比较时,定义包括氨基酸残基的重叠或子集。然而,用于指抗体或移植性抗体或其变体的cdr的任一定义均旨在处于如本文所定义和使用的术语的范围之内。涵盖如由每个以上引用的参考文献定义的cdr的氨基酸残基在下表1中示出作为比较。需注意,该编号可能不同于实际公开于所附序列表中的cdr,因为cdr定义因情况而异。
[0115] kabatchothiamaccallumvh cdr131-3526-3230-35vh cdr250-6553-5547-58vh cdr395-10296-10193-101vl cdr124-3426-3230-36vl cdr250-5650-5246-55vl cdr389-9791-9689-96
[0116]
表1:cdr定义
[0117]
如本文所用,术语“框架”在用于涉及抗体可变区时是指抗体可变区内cdr区以外的所有氨基酸残基。因此,可变区框架的长度为约100-120个氨基酸,但仅旨在涉及cdr以外的那些氨基酸。
[0118]
如本文所用,术语“能够以足够的结合亲和力结合靶标x”应理解为意指相应的结合结构域以10-4
或更小的kd结合靶标。kd是蛋白结合物与其抗原之间的平衡解离常数,即k
off
/k
on
比率。kd与亲和力成反比关系。kd值涉及蛋白结合物的浓度(特定实验所需的蛋白结合物的量),因此kd值越低(浓度越低),因此结合结构域的亲和力越高。下表显示单克隆抗体的典型kd范围。
[0119]
kd值摩尔范围10-4
至10-6
微摩尔(μm)10-7
至10-9
纳摩尔(nm)10-10
至10-12
皮摩尔(pm)10-13
至10-15
飞摩尔(fm)
[0120]
表2:kd和摩尔值
[0121]
优选地,蛋白结合物具有多至2个氨基酸置换,并且更优选地多至1个氨基酸置换。
[0122]
优选地,至少一个cdr与相应的seq id no具有≥67%;≥68%;≥69%;≥70%;≥
71%;≥72%;≥73%;≥74%;≥75%;≥76%;≥77%;≥78%;≥79%;≥80%;≥81%;≥82%;≥83%;≥84%;≥85%;≥86%;≥87%;≥88%;≥89%;≥90%;≥91%;≥92%;≥93%;≥94%;≥95%;≥96%;≥97%;≥98%;≥99%,并且最优选地≥100%的序列相同性。
[0123]
如本文所用,术语“%序列相同性”应理解如下:将待比较的两个序列进行比对以给出序列之间的最大相关性。这可包括在一个或两个序列中插入“空位”,以提高比对的程度。然后,可在每个待比较的序列的全长上确定%相同性(所谓的全局比对),这特别适用于相同或相似长度的序列,或者在较短的限定长度上确定%相同性(所谓的局部比对),这更适用于长度不等的序列。在以上语境中,与查询氨基酸序列具有至少例如95%的“序列相同性”的氨基酸序列旨在意指主题氨基酸序列的序列与查询序列相同,不同之处在于主题氨基酸序列可包括查询氨基酸序列的每100个氨基酸多至五个氨基酸改变。换言之,为了获得与查询氨基酸序列具有至少95%相同性的序列的氨基酸序列,主题序列中多至5%(100个中有5个)的氨基酸残基可以被插入或被另一种氨基酸置换或缺失。用于比较两个或更多个序列的相同性和同源性的方法是本领域公知的。两个序列相同的百分比可例如通过使用数学算法来确定。优选但非限制性的数学算法的实例整合在blast家族的程序中,例如blast或nblast程序和fasta。在某些程度上与其他序列相同的序列可由这些程序鉴定。此外,wisconsin序列分析包9.1版(wisconsin sequence analysis package,version 9.1)中可用的程序,例如程序bestfit和gap,可用于确定两个多肽序列之间的%相同性。如果在本文中提及与参考序列享有特定序列相同性程度的氨基酸序列,则所述序列差异优选地由于保守氨基酸置换。优选地,此类序列保留参考序列的活性,例如,尽管可能处于较慢的速率。
[0124]
优选地,至少一个cdr经受cdr序列修饰,包括
[0125]
·
亲和力成熟
[0126]
·
免疫原性降低
[0127]
给定抗体的亲和力在体外增加的过程中,亲和力成熟。与天然对应物一样,体外亲和力成熟基于突变和选择的原理。其已成功地用于优化抗体、抗体片段或其他肽分子如抗体模拟物。使用辐射、化学诱变剂或易错pcr引入cdr内的随机突变。此外,遗传多样性可以通过链改组而增加。使用展示方法如噬菌体展示进行两轮或三轮突变和选择通常导致亲和力在低纳摩尔范围内的抗体片段。对于原理,参见eylenstein等人(2016),其内容以引用方式并入本文。
[0128]
人源化抗体含有鼠序列衍生的cdr区,其已经连同任何所需的框架回复突变一起移植到人序列衍生的v区中。因此,当向患者施用人源化抗体时,cdr自身可引起免疫原性反应。降低由cdr引起的免疫原性的方法公开于harding等人(2010)中,其内容以引用方式并入本文。
[0129]
根据本发明的一个实施方案,框架是人vh/vl框架。vh代表igg型抗体的重链可变区结构域,而vl代表轻链可变区结构域(κ或λ)。
[0130]
根据本发明的一个实施方案,蛋白结合物包含
[0131]
a)重链/轻链可变结构域(vd)
[0132]
·
hc vd(seq id no 33),以及
[0133]
·
lc vd(seq id no 40)
[0134]
b)a)的重链/轻链可变结构域(vd),条件是
[0135]
·
hcvd与相应的seq id no 33具有≥80%的序列相同性,和/或
[0136]
·
lcdvd与相应的seq id no 40具有≥80%的序列相同性,
[0137]
c)a)或b)的重链/轻链可变结构域(vd),条件是hcvd或lcvd中的至少一者具有相对于相应的seq id no 33和/或40至多10个氨基酸置换,
[0138]
所述蛋白结合物仍然能够以足够的结合亲和力结合人irhom2并抑制或降低tace/adam17活性。
[0139]
优选地,hcvd和/或lcvd与相应的seq id no具有≥81%;≥82%;≥83%;≥84%;≥85%;≥86%;≥87%;≥88%;≥89%;≥90%;≥91%;≥92%;≥93%;≥94%;≥95%;≥96%;≥97%;≥98%;≥99%;或最优选地≥100%的序列相同性。
[0140]“可变结构域”当用于涉及抗体或其重链或轻链时,旨在意指赋予抗原在分子上的结合且不是恒定区的抗体的部分。该术语旨在包括其功能片段,其保持整个可变区的所有结合功能中的一些。可变区结合片段包括例如功能片段如fab、f(ab)2、fv、单链fv(scfv)等。此类功能片段是本领域技术人员公知的。因此,这些术语在描述异聚可变区的功能片段中的使用旨在对应于本领域技术人员公知的定义。这些术语描述于例如huston等人,(1993)或pl
ü
ckthun和skerra(1990)。
[0141]
根据本发明的一个实施方案,以上讨论的至少一个氨基酸置换是保守氨基酸置换。
[0142]“保守氨基酸置换”对蛋白结合物功能的效应比非保守置换更小。尽管存在将氨基酸分类的许多方式,但通常基于其结构和其r基团的一般化学特征,将它们分成六个主要类别。
[0143]
在一个实施方案中,“保守氨基酸置换”是其中氨基酸残基被具有类似侧链的氨基酸残基取代的置换。例如,本领域定义了具有类似侧链的氨基酸残基的家族。这些家族包括具有以下的氨基酸:
[0144]
·
碱性侧链(例如赖氨酸、精氨酸、组氨酸),
[0145]
·
酸性侧链(例如天冬氨酸、谷氨酸),
[0146]
·
不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸),
[0147]
·
非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸),
[0148]
·
β支化侧链(例如苏氨酸、缬氨酸、异亮氨酸)和
[0149]
·
芳族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。
[0150]
其他保守氨基酸置换也可跨越氨基酸侧链家族发生,如当用天冬酰胺置换天冬氨酸以改变肽的电荷时。因此,hr结构域多肽中预测的非必需氨基酸残基例如优选地被来自相同侧链家族或家族间同源物的另一氨基酸残基替代(例如天冬酰胺替代天冬氨酸,谷氨酰胺替代谷氨酸)。保守性改变还可包括化学上同源的非天然氨基酸的置换(即,合成非天然疏水性氨基酸取代亮氨酸,合成非天然芳族氨基酸取代色氨酸)。
[0151]
根据本发明的一个实施方案,蛋白结合物具有以下中的至少一者:
[0152]
·
与根据以上描述的蛋白结合物相比,对irhom2≥50%的靶结合亲和力,并且通
过spr测量,和/或
[0153]
·
根据以上描述的蛋白结合物的对tace/adam17活性≥50%的抑制或降低效应。
[0154]
如本文所用,术语“结合亲和力”旨在意指结合相互作用的强度,因此包括实际结合亲和力以及表观结合亲和力。实际结合亲和力是缔合速率与解离速率的比率。因此,赋予或最优化结合亲和力包括改变这些组分中的任一种或两种以实现期望水平的结合亲和力。表观亲和力可包括例如相互作用的亲合力。例如,二价异聚可变区结合片段可由于其化合价而表现出改变或最优化的结合亲和力。
[0155]
用于测量结合物的亲和力的合适方法是通过表面等离子体共振(spr)。该方法基于当表面等离子体波在金属/液体界面处被激发时发生的现象。光被引导到表面不与样品接触的一侧,并从该侧反射,并且spr在角度和波长的特定组合下引起反射光强度的降低。生物分子结合事件引起表面层折射率的变化,其被检测为spr信号的变化。结合事件可以是受体-配体对之间的结合缔合或解离。可基本上瞬时地测量折射率的变化,因此允许确定亲和常数的各个分量。更具体地,该方法允许精确测量缔合速率(k on
)和解离速率(k
off
)。
[0156]kon
和k
off
值的测量可为有利的,因为它们可识别治疗上更有效的改变的可变区或最优化的可变区。例如,改变的可变区或其异聚结合片段可为更有效的,因为与表现出相似结合亲和力的可变区和异聚结合片段相比,其具有例如较高的k
on
值。由于具有较高k
on
值的分子能够以更快的速率特异性地结合和抑制其靶标,因此赋予了增加的功效。类似地,本发明的分子可更有效,因为与具有类似结合亲和力的分子相比,其表现出较低的k
off
值。可以观察到具有较低k
off
速率的分子所观察到的功效增加,因为一旦结合,分子从其靶标较慢地解离。尽管关于本发明的改变的可变区和最优化的可变区(包括其异聚可变区结合片段)进行了描述,但上述用于测量缔合和解离速率的方法可应用于基本上任何蛋白结合物或其片段,以鉴定用于治疗或诊断目的的更有效的结合物。
[0157]
使用表面等离子体共振测量亲和力(包括缔合和解离速率)的方法是本领域公知的,并且可发现描述于例如jonsson和malmquist,(1992)以及wu等人(1998)。此外,本领域公知的用于测量结合相互作用的一种设备是biacore 2000仪器,其可通过pharmacia biosensor(uppsala,sweden)商购获得。
[0158]
优选地,与参考结合物相比,所述靶结合亲和力≥51%、≥52%、≥53%、≥54%、≥55%、≥56%、≥57%、≥58%、≥59%、≥60%、≥61%、≥62%、≥63%、≥64%、≥65%、≥66%、≥67%、≥68%、≥69%、≥70%、≥71%、≥72%、≥73%、≥74%、≥75%、≥76%、≥77%、≥78%、≥79%、≥80%、≥81%、≥82%、≥83%、≥84%、≥85%、≥86%、≥87%、≥88%、≥89%、≥90%、≥91%、≥92%、≥93%、≥94%、≥95%、≥96%、≥97%、≥98%,并且最优选地≥99%。
[0159]
如本文所用,与基准结合物相比,对tace/adam17活性的抑制或降低效应的定量可以例如用相应的tnf脱落测定进行(参见例如图2和实施例5)。
[0160]
根据本发明的另一方面,提供了一种蛋白结合物,其与以上所示的任何蛋白结合物竞争结合人irhom2。
[0161]
关于此类蛋白结合物的形式或结构,应用与如上所示相同的优选实施方案。在一个实施方案中,所述蛋白结合物是单克隆抗体、或其保留靶结合能力的靶结合片段或衍生物、或抗体模拟物。
[0162]
如本文所用,术语“竞争结合”用于提及由如上序列所定义的抗体之一,这意味着与所述序列定义的蛋白结合物相同的靶标、或靶表位或结构域或亚结构域结合的实际蛋白结合物呈现活性,并且是后者的变体。结合的效率(例如,动力学或热力学)可等于或大于或小于后者的效率。例如,两种抗体与底物结合的平衡结合常数可以不同。
[0163]
此类结合竞争可以用竞争性结合测定适当地测量。此类测定描述于finco等人2011,其内容以引用方式并入本文,并且其用于解释专利权利要求的含义公开于deng等人2018,其内容以引用方式并入本文。
[0164]
根据本发明的另一方面,提供了一种蛋白结合物,其结合irhom2上的与根据以上描述的蛋白结合物基本上相同或相同的表位。
[0165]
为了测试该特征,可获得合适的表位作图技术,尤其包括
[0166]
·
x射线共结晶学和低温电子显微术(cryo-em)
[0167]
·
基于阵列的寡肽扫描
[0168]
·
定点诱变作图
[0169]
·
高通量鸟枪诱变表位作图
[0170]
·
氢
–
氘交换
[0171]
·
交联耦合质谱法
[0172]
这些方法尤其公开和讨论于banik等人(2010)和delisser(1999),其内容以引用方式并入本文。
[0173]
根据本发明的另一方面,一种编码根据前述权利要求中任一项所述的结合物的核酸。
[0174]
在所提供的编码结合物的给定序列中,由于遗传密码的简并性,此类核酸可具有不同的序列。
[0175]
此类核酸可用于药物目的。在此类情况下,其为施用给患者的rna衍生的分子,其中患者的蛋白质表达机构表达相应的结合物。mrna可例如以合适的脂质体递送,并且包含特异性序列或修饰尿苷核苷以避免免疫应答和/或改善折叠和翻译效率,有时在5
’‑
和/或3’末端包含帽修饰以将它们靶向特定的细胞类型。
[0176]
此类核酸可用于转染表达宿主,然后表达实际的结合物。在此类情况下,分子可为任选地整合进合适的载体中的cdna。
[0177]
根据本发明的另一方面,提供了根据以上描述的蛋白结合物(用于制造)用于治疗
[0178]
·
被诊断出,
[0179]
·
患有或
[0180]
·
处于发展
[0181]
炎性病症的风险的人或动物对象或者用于预防此类病症的(药物的)用途。
[0182]
根据本发明的另一方面,提供了一种药物组合物,其包含根据以上描述的蛋白结合物,以及任选地一种或多种药学上可接受的赋形剂。
[0183]
根据本发明的另一方面,提供了一种组合,其包含(i)根据以上描述的蛋白结合物或根据以上描述的药物组合物,以及(ii)一种或多种治疗活性化合物。
[0184]
根据本发明的另一方面,提供了一种用于治疗或预防炎性病症的方法,该方法包括以治疗学上足够的剂量向人或动物对象施用(i)根据以上描述的蛋白结合物,(ii)根据
以上描述的药物组合物,或者(iii)根据以上描述的组合。
[0185]
根据本发明的另一方面,提供了一种治疗试剂盒,其包括:
[0186]
a)根据以上描述的组合物、根据以上描述的药物组合物、或根据以上描述的组合,
[0187]
b)用于施用组合物、组合物或组合的设备,以及
[0188]
c)使用说明书。
实施例
[0189]
虽然已经在附图和前述描述中详细说明和描述了本发明,但是此类说明和描述被认为是说明性或示例性的而非限制性的;本发明不限于所公开的实施方案。通过研究附图、公开内容和所附权利要求,本领域技术人员在实践所要求保护的本发明时可以理解和实现所公开实施方案的其他变型。在权利要求中,词语“包括”不排除其他元件或步骤,并且不定冠词“一”或“一个”不排除多个。在相互不同的从属权利要求中叙述某些措施的纯粹事实并不指示不能有利地使用这些措施的组合。权利要求中的任何附图标记不应解释为限制范围。
[0190]
本文所公开的所有氨基酸序列从n末端到c末端显示;本文所公开的所有核酸序列显示为5'-》3'。
[0191]
实施例1:用于免疫和肽结合elisa分析的肽的生成
[0192]
使用基于芴甲氧羰基(fmoc)的固相肽合成,在平行肽合成仪(肽1-5、7-9和1b-3b;multipep rsi,intavis ag,germany)、微波肽合成仪(肽6;liberty blue,cem,usa)或定制连续流肽合成仪(肽10、11和4b)上合成肽[chan,w.c.,white,p.d.solid phase peptide synthesis,apractical approach(oxford university press inc.,new york,2000]。使用具有侧链保护基团的fmoc保护的l-氨基酸,以逐步的方式从c到n末端组装序列。在链组装完成后,用95%tfa、4%三乙基硅烷和1%水将肽从树脂上裂解下来。将粗产物溶解于含15%乙腈的0.1%tfa水溶液中,并通过反相hplc使用orbit c18,10μm,柱(mz analysentechnik,germany)进行纯化。通过使用kinetex evo c18,5μm,柱(phenomenex,usa)的分析型hplc并通过maldi tof质谱(ultraflex iii,bruker,usa)来分析所得的纯化级分。将级分冻干,得到相应的tfa盐。
[0193]
对于肽10和11,通过dmso介导的氧化使如由质谱鉴定的线性肽氧化为相应的环状二硫化物。为此,将线性肽以1mg/ml的浓度溶解在5%乙酸中。用(nh4)2co3将ph调节至6,添加dmso至10-20%的最终浓度。允许氧化在室温下进行24小时。然后,将反应混合物用溶剂a稀释。将产物在反相c18柱上纯化并如上所述进行分析。合并含有二硫环化肽的级分并冻干[chan,w.c.和white,p.d.,fmoc solid phase peptide synthesis,apractical approach(oxford university press inc.,new york,2000,第3.3章,第97页]。
[0194]
用预活化的klh(imcejt
tm
maleimide activated mcklh,thermo scientific,usa)进行klh缀合。简而言之,将mcklh用超纯水以10mg/ml的浓度溶解。将期望的肽以5mg/ml的浓度溶解于imject
tm
maleimide conjugation buffer(thermo scientific,usa)中,如果需要,添加8m urea(ph 7.2)以溶解肽。将肽溶液与mcklh溶液混合并在室温下孵育2至6小时。将混合物用3500-mw截留(mwco)透析管针对400ml pbs透析过夜。在透析后,将混合物用pbs稀释,得到期望的浓度。
[0195]
用α-生物素-ω-马来酰亚氨基十一烷(乙二醇)(biotin-peg(11)-mal)进行生物素化。将肽溶解于pbs ph 7,4中。如果需要,添加乙腈以溶解肽。将biotin-peg(11)-mal溶解于dmf中并以(重量=1:1)添加到肽溶液中。使反应进行过夜,随后在反相c18柱上纯化并如上所述进行分析。
[0196]
图1示出用于免疫和/或肽结合elisa分析的肽,关于ncbi参考序列nm_024599.5.、np_078875.4.(对于人irhom2)和ncbi参考序列nm_022450.3.、np_071895.3.(对于人irhom1)指示了它们的名称、位置编号和氨基酸序列。添加到除肽6和7以外的所有肽中用于偶联至klh(用于免疫)和/或生物素(用于肽结合elisa分析)的末端半胱氨酸残基由
“‑c‑”
示出。在指定的情况下,内部半胱氨酸残基被α-氨基丁酸(abu)取代。肽1至4对应于人irhom2的tmd1(以斜体字突出显示)和邻近的胞外近膜区的氨基酸(图1a)。肽5至7类似于连接tmd1和tmd2的人irhom2的大胞外环1内的部分(图1b)。肽8至11是指人irhom2的tmd7(以斜体字突出显示)和邻近的c末端尾的氨基酸(图1c)。肽1b至4b是肽1至4的人irhom1同系物,因此对应于人irhom1的tmd1(以斜体字突出显示)和邻近的胞外近膜区的氨基酸(图1d)。
[0197]
实施例2:用于免疫的irhom2敲除小鼠的繁殖
[0198]
由于人对小鼠irhom2蛋白的高序列同源性(参见对于人irhom2的ncbi参考序列np_078875.4.,对于小鼠irhom2的ncbi参考序列np_766160.2.,人对小鼠irhom2的胞外环1、2、3和c末端尾的氨基酸序列相同性分别计算为89.96%、100.00%、100.00%和96.97%),繁殖irhom2敲除小鼠而非野生型小鼠进行免疫。
[0199]
简而言之,在university of california,davis的komp小鼠生物学项目订购rhbdf2tm1b(komp)wtsi小鼠品系(rhbdf2是irhom2的别名)以进行复苏,并导致可得到三只杂合雄性小鼠。将这三只处于c57bl/6n背景(c57bl/6n-rhbdf2tm1b(komp)wtsi)的动物与129sv/j遗传背景的野生型雌性小鼠交配以产生杂合后代。将这些杂合小鼠彼此交配以生成具有rhbdf2基因纯合敲除的雄性和雌性小鼠。进一步扩增所得纯合rhbdf2敲除小鼠群体用于免疫。
[0200]
实施例3:小鼠的免疫和血清滴度分析
[0201]
分别用肽混合物a、b和c免疫三组8至10周龄的雄性和雌性irhom2敲除小鼠(如实施例2所述)。混合物a由等量的四种钥孔戚血蓝蛋白(klh)偶联的肽1、2、3和4组成。混合物b由等量的三种klh偶联的肽5、6和7构成,混合物c由等量的四种klh偶联的肽8、9、10和11构成。将50μg肽混合物用20μl的gerbu adjuvant mm
tm
(gerbu biotechnik,germany)乳化,并用10mm hepes缓冲液(ph 7,6)调节,以每只小鼠每次注射100μl的最终体积用于腹膜内(ip)施用。每组十只小鼠每10天注射五次。在第五次注射后十天,收集血液(血清)并测试抗体滴度。
[0202]
应用elisa和facs方法通过血清抗体滴度分析进行免疫应答的评估。关于facs分析,使用山羊f(ab’)2抗小鼠igg(h+l)-r-藻红蛋白(rpe)缀合物(dianova,germany)作为第二抗体,在稳定表达人irhom2的小鼠l929细胞上测试用含有3%fbs的pbs以1:50稀释的血清。作为阴性对照,使用亲本l929细胞。在accuri c6 plus(bd biosciences,usa)流式细胞仪上进行测试。在免疫方案第0天获取的免疫前血清(“pis”)用作阴性对照。
[0203]
互补地,在酶联免疫吸附测定(elisa)中测试所有动物的免疫血清:将血清用含有
1%bsa的pbs以1:500、1:2,500和1:12,500稀释,并通过用辣根过氧化物酶(hrp)缀合的山羊抗小鼠igg第二抗体(southern biotech,usa)检测,测试与包被有1μg/ml相应生物素化肽混合物的板的结合。无关蛋白(bsa)和免疫方案第0天获取的免疫前血清用作阴性对照。
[0204]
为了进一步加强免疫应答,通过每2周另外注射两次,并此后加强免疫10天,使肽混合物的免疫延长血清收集后的四天。在最终加强后四天收集所选动物的脾,分离淋巴细胞并冷冻保存用于后续融合。
[0205]
实施例4:淋巴细胞的回收和用于生成杂交瘤的融合
[0206]
将来自每个免疫组的3只选择的动物的冷冻保存的脾淋巴细胞解冻,并与ag8小鼠骨髓瘤细胞组特异性融合以生成杂交瘤细胞。将融合细胞铺板并在次黄嘌呤-氨基蝶呤-胸腺嘧啶(hat)培养基存在下在96孔板上生长。组特异性融合允许新出现的杂交瘤对相应免疫组的回顾性归属。
[0207]
实施例5:杂交瘤上清液的筛选用于候选物选择
[0208]
培养14天后,收集杂交瘤细胞的上清液,并针对irhom2活性中和抗体进行基于elisa的功能筛选——而非针对irhom2结合抗体进行选择。由于irhom2在tace介导的肿瘤坏死因子α(tnfα)从巨噬细胞释放中的关键作用已得到非常充分的确认(mcilwein等人,2012,adrain等人,2012,siggs等人,2012),在存在和不存在所有5280种肽免疫衍生的杂交瘤上清液的情况下,使用人tnf-αduoset elisa(r&d systems,usa)来比较脂多糖(lps)诱导的内源性tnfα从人thp-1巨噬细胞的释放。
[0209]
简而言之,在第1天,将nunc black96孔板(thermo fisher scientific,usa)用每孔100μl的小鼠抗人tnfα捕获抗体(作为duoset elisa试剂盒的一部分提供)以4μg/ml tbs在4℃下包被过夜。在第2天,除去捕获抗体溶液,并将板用每孔300μl的tbs、1%bsa在4℃下封闭过夜。在第3天,将在80μl正常生长培养基中的20,000个thp-1(美国典型培养物保藏中心(american type culture collection),usa)细胞接种到greiner cellstar v形底96孔板(thermo fisher scientific,usa)的各孔中,并与20μl杂交瘤上清液在37℃、5%co2下一起预孵育30分钟。在刺激对照的情况下,添加20μl标准生长培养基代替杂交瘤上清液。随后,在37℃、5%co2下,用每孔20μl的lps(sigma-aldrich,usa)以300ng/ml生长培养基(最终浓度为50ng/ml)刺激细胞(未刺激对照的那些除外)2小时。然后,将96孔板离心以沉淀细胞。平行地,从板除去封闭缓冲液,并将板在96头板洗涤器(tecan group,switzerland)上用每孔350μl的tbs-t(carl roth,germany)洗涤4次。为了避免干燥,将30μl的tbs立即添加到板的各孔中,随后每样品转移70μl的无细胞上清液。另外,将用tbs以限定浓度稀释的100μl重组人tnfα蛋白(作为duoset elisa试剂盒的一部分提供)添加到板中作为标准参考。然后,将每孔100μl的生物素化山羊抗人tnfα检测抗体(作为duoset elisa试剂盒的一部分提供)以50ng/ml tbs添加,避光保护,将板在室温下孵育2小时。在96头板洗涤器(tecan group,switzerland)上用每孔350μl的tbs-t(carl roth,germany)洗涤4次并在第四次循环后小心除去所有缓冲液痕量之后,将100μl的用tbs以1:10,000稀释的链霉亲和素-ap(r&d systems,usa)添加至各孔中,并再次避光保护,将板在室温下孵育30分钟。在96头板洗涤器(tecan group,switzerland)上用每孔350μl的tbs-t(carl roth,germany)洗涤另一轮4次并在第四次循
环后小心除去所有缓冲液痕量之后,添加100μl的attophos底物溶液(promega,usa)以在室温下暗处孵育1小时。使用infinite m1000 pro(tecan group,switzerland)酶标仪,在435nm的激发波长和555nm的发射波长下收集各孔的荧光。
[0210]
图2显示一个96孔板的这些实验的代表性结果,表明肽免疫衍生的杂交瘤上清液对lps诱导的tnfα从thp-1细胞中释放的效应。在总共测试的5280种杂交瘤上清液中,从板号4第h行第8列(4h8)的杂交瘤细胞群收集的上清液是唯一明显干扰thp-1细胞中lps诱导的tnfα脱落的上清液。
[0211]
实施例6:杂交瘤细胞群4h8的亚克隆
[0212]
由于杂交瘤细胞群4h8似乎是寡克隆来源的,执行应用经典的液体稀释技术的亚克隆以分离单克隆杂交瘤细胞库。
[0213]
简而言之,对杂交瘤群体4h8的细胞进行计数,并计算稀释因子,以96孔板中每孔平均两个细胞结束。相应地稀释细胞,并通过显微镜鉴定单一细胞群生长的孔。在这些单克隆杂交瘤群体扩增约3周后,收集上清液并如实施例5所述比较对lps诱导的tnfα从thp-1细胞中释放的抑制效应。命名为4h8-d4、4h8-e3和4h8-g8的三个4h8亚克隆经证实显著干扰tnfα脱落,并因此对其扩增和储存。
[0214]
实施例7:从杂交瘤亚克隆4h8-e3中纯化抗体
[0215]
在该实施例中,描述了应用亲和色谱法从杂交瘤亚克隆4h8-e3的上清液中纯化抗体。
[0216]
简而言之,尽管蛋白g琼脂糖凝胶主要被推荐用于igg抗体的固定,并被描述为不太适用于igg抗体的结合,但经验发现蛋白g琼脂糖凝胶柱产生两种抗体同种型的良好收率。因此,合并从杂交瘤亚克隆4h8-e3收集的上清液,并加载到平衡的蛋白g琼脂糖凝胶预填充重力流柱(protein g gravitrap
tm
,ge healthcare,uk)上用于抗体捕获。然后,用结合缓冲液洗涤柱一次,用洗脱缓冲液洗脱捕获的抗体(两种缓冲液均作为ab buffer试剂盒;ge healthcare,uk的一部分提供)。接着,使用pd miditrap g-25柱(ge healthcare,uk)使洗脱液级分脱盐,并经由具有30kda截断值的amicon ultra-4离心过滤装置(sigma-aldrich,us)浓缩纯化的样品。最后,应用nanodrop 2000/c分光光度计(thermo fisher scientific,usa)测定纯化蛋白质的浓度。
[0217]
实施例8:本发明的抗体4h8-e3的同种型测定
[0218]
作为下一步,进行小鼠igg/igm elisa以确定本发明的纯化抗体4h8-e3的同种型。简而言之,在第1天,将nunc black96孔板(thermo fisher scientific,usa)用每孔100μl的山羊抗小鼠igg+igm(h+l)捕获抗体(sigma-aldrich,usa)以1μg/ml tbs在4℃下包被过夜。在第2天,除去捕获抗体溶液,在室温下用每孔300μl的pierce无蛋白(tbs)封闭缓冲液(thermo fisher scientific,usa)封闭板1小时。然后除去封闭缓冲液,并将板在96头板洗涤器(tecan group,switzerland)上用每孔350μl的tbs-t(carl roth,germany)洗涤3次。然后,将每孔100μl的tbs作为空白和阴性对照、限定浓度的小鼠igg(thermo fisher scientific,usa)和小鼠igm(sigma-aldrich,usa)抗体(均以1μg/ml tbs起始1:2滴定)作为标准参考、3μg/ml tbs的小鼠igg(thermo fisher scientific,usa)和小鼠igm(sigma-aldrich,usa)抗体各自作为阳性和特异性对照,以及3μg/ml tbs的本发明的纯化抗体4h8-e3添加到孔中,并在室温下孵育2小时。随后,将板在96头板洗涤器
(tecan group,switzerland)上用每孔350μl的tbs-t(carl roth,germany)再次洗涤3次。对于同种型检测,将各样品的一半避光保护,用每孔100μl的用tbs以1:5,000稀释的ap-缀合的山羊抗小鼠igm(sigma-aldrich,usa)或ap-缀合的山羊抗小鼠igg f(ab')2片段(dianova,germany)检测抗体在室温下孵育1.5小时。在96头板洗涤器(tecan group,switzerland)上用每孔350μl的tbs-t(carl roth,germany)进行另一轮3个洗涤步骤并在第三次循环后小心除去所有缓冲液痕量之后,添加100μl的attophos底物溶液(promega,usa)以在室温下暗处孵育10分钟。使用infinite m1000pro(tecan group,switzerland)酶标仪,在435nm的激发波长和555nm的发射波长下收集各孔的荧光。
[0219]
图3显示该实验的代表性结果,清楚地表明本发明的抗体4h8-e3是小鼠igm同种型。
[0220]
实施例9:由本发明的抗体4h8-e3识别的靶区域的确定
[0221]
接着,进行肽结合elisa分析以验证本发明的纯化抗体4h8-e3是否识别施用给杂交瘤克隆4h8所来源的那些动物的任何肽,从而阐明被本发明的抗体4h8-e3识别的靶区域。
[0222]
简而言之,在第1天,将nunc black96孔板(thermo fisher scientific,usa)用每孔100μl的单一生物素化肽1至11以及肽1至4的混合物(混合物a)、5至7的混合物(混合物b)以及8至11的混合物(混合物c)各自以10μg/ml tbs在4℃下包被过夜(因此,混合物1至4以及8至11中每种肽的最终浓度为2.5μg/ml,而混合物5至7中为3.3μg/ml)。在第2天,除去肽溶液,用每孔300μl的pierce无蛋白(tbs)封闭缓冲液(thermo fisher scientific,usa)在室温下封闭板1.5小时。然后除去封闭缓冲液,并将板在96头板洗涤器(tecan group,switzerland)上用每孔350μl的tbs-t(carl roth,germany)洗涤4次。然后,将每孔100μl的tbs作为空白对照、0.3μg/ml tbs的小鼠抗生物素抗体(克隆bn-34,sigma-aldrich,usa)作为包被对照、3μg/ml tbs的本发明的纯化抗体4h8-e3,以及3μg/ml tbs的小鼠igm抗体(克隆mopc 104e,sigma-aldrich,usa)作为本发明的纯化抗体4h8-e3的同种型对照添加到用单一肽1至11或相应混合物预包被的孔中,并在室温下孵育4小时。随后,在96头板洗涤器(tecan group,switzerland)上用每孔350μl的tbs-t(carl roth,germany)将板再洗涤4次,并避光保护,在室温下用每孔100μl的用tbs以1:2,000稀释的ap-缀合的山羊抗小鼠igg/igg/igm f(ab’)2片段(sigma-aldrich,usa)孵育1小时。在96头板洗涤器(tecan group,switzerland)上用每孔350μl的tbs-t(carl roth,germany)进行另一轮4个洗涤步骤并在第四次循环后小心除去所有缓冲液痕量之后,添加100μl的attophos底物溶液(promega,usa)以在室温下暗处孵育1小时。使用infinite m1000 pro(tecan group,switzerland)酶标仪,在435nm的激发波长和555nm的发射波长下收集各孔的荧光。
[0223]
图4显示该实验的代表性结果。包被对照确认了单独地或作为肽混合物固定的生物素化肽的丰度(图4a、c、e)。与源自用肽1至4的混合物(混合物a)免疫的小鼠的克隆4h8一致,本发明的抗体4h8-e3显示不与类似于大胞外环的不同部分的肽5、6和7(图4d)或反映人irhom2的c末端尾的肽8、9、10和11(图4f)结合,无论这些肽是单独地还是作为混合物包被。相比之下,证明了本发明的抗体4h8-e3与由肽1、2、3和4组成的混合物a以及与单一肽3的较强结合(图4b),这显示由本发明的抗体4h8-e3识别的表位定位于人irhom2的胞外近膜结构域的氨基酸431至459内。本发明的抗体4h8-e3的数据在相对于igm同种型对照标准化后显
示。
[0224]
实施例10:评估本发明的抗体4h8-e3的结合特异性
[0225]
进行另一系列的肽结合elisa实验以解决本发明的纯化抗体4h8-e3的特异性,即讨论该抗体是否特异性识别肽,特别是类似于人irhom2的邻近tmd1的胞外近膜区的肽3,或者本发明的抗体4h8-e3是否也结合反映紧密相关的家族成员人irhom1的同源区的肽。
[0226]
简而言之,在第1天,将nunc black96孔板(thermo fisher scientific,usa)用每孔100μl的单一生物素化肽1至4、由肽1至4组成的混合物a、单一生物素化肽1b至4b,以及由肽1b至4b组成的混合物d各自以10μg/ml pbs(因此,两种混合物中每种肽的最终浓度为2.5μg/ml)在4℃下包被过夜。在第2天,除去肽溶液,用每孔300μl的pierce无蛋白(tbs)封闭缓冲液(thermo fisher scientific,usa)在室温下封闭板1.5小时。然后除去封闭缓冲液,并将板在96头板洗涤器(tecan group,switzerland)上用每孔350μl的pbs-t(carl roth,germany)洗涤4次。然后,将每孔100μl的pbs作为空白对照、0.3μg/ml pbs的小鼠抗生物素抗体(克隆bn-34,sigma)作为包被对照、3μg/ml pbs的本发明的纯化抗体4h8-e3,以及3μg/ml pbs的小鼠igm抗体(克隆pfr-03,sigma)作为本发明的纯化抗体4h8-e3的同种型对照添加到用单一肽1至4、1b至4b或相应混合物预包被的孔中,并在室温下孵育4小时。随后,在96头板洗涤器(tecan group,switzerland)上用每孔350μl的pbs-t(carl roth,germany)将板再洗涤4次,并避光保护,在室温下用每孔100μl的用pbs以1:2,000稀释的ap-缀合的山羊抗小鼠igg/igg/igm f(ab’)2片段(sigma-aldrich,usa)孵育1小时。在96头板洗涤器(tecan group,switzerland)上用每孔350μl的pbs-t(carl roth,germany)进行另一轮4个洗涤步骤并在第四次循环后小心除去所有缓冲液痕量之后,添加100μl的attophos底物溶液(promega,usa)以在室温下暗处孵育1小时。使用infinite m1000 pro(tecan group,switzerland)酶标仪,在435nm的激发波长和555nm的发射波长下收集各孔的荧光。
[0227]
图5显示该实验的代表性结果。包被对照再次确认了单独地或作为肽混合物固定的生物素化肽的丰度(图5a、c)。确认了本发明的抗体4h8-e3与由肽1、2、3和4组成的混合物a,特别是类似于人irhom2的胞外近膜结构域的氨基酸431至459的单一肽3的结合(图5b)。相比之下,本发明的抗体4h8-e3根本不结合由反映相关家族成员人irhom1内的同源氨基酸序列的肽1b、2b、3b和4b组成的混合物d或单独包被的肽1b、2b、3b和4b(图5d),提供了本发明的抗体4h8-e3特异性结合人irhom2的证据,因此不识别人irhom1中的同源部分。本发明的抗体4h8-e3的数据在相对于igm同种型对照标准化后显示。
[0228]
实施例11:本发明的抗体4h8-e3对体外lps诱导的tnfα脱落的抑制效应的分析:
[0229]
在以下研究中,进行基于elisa的tnfα释放测定以验证本发明的纯化抗体4h8-e3对lps诱导的内源性tnfα从人thp-1巨噬细胞释放的抑制效应。
[0230]
简而言之,在第1天,将nunc black96孔板(thermo fisher scientific,usa)用每孔100μl的小鼠抗人tnfα捕获抗体(作为duoset elisa试剂盒的一部分提供)以4μg/ml tbs在4℃下包被过夜。在第2天,除去捕获抗体溶液,并将板用每孔300μl的tbs、1%bsa在室温下封闭3小时。同时,将80μl正常生长培养基中的20,000个thp-1(美国典型培养物保藏中心(american type culture collection),usa)细胞接种
到greiner cellstar v形底96孔板(thermo fisher scientific,usa)的各孔中,并且在37℃、5%co2下与每孔20μl的标准生长培养基一起预孵育30分钟,该标准生长培养基补充有50μm的batimastat(bb94,abcam,uk)作为阳性对照(在所得100μl样品体积中的最终浓度为10μm)、50μg/ml的小鼠igm抗体(克隆pfr-03,sigma-aldrich,usa)作为同种型对照(在所得100μl样品体积中的最终浓度为10μg/ml)或50μg/ml的本发明的纯化抗体4h8-e3(在所得100μl样品体积中的最终浓度为10μg/ml)。在刺激对照的情况下,添加不含供试品的20μl标准生长培养基。随后,在37℃、5%co2下,用每孔20μl的lps(sigma-aldrich,usa)以300ng/ml生长培养基(最终浓度为50ng/ml)刺激细胞(未刺激对照的那些除外)2小时。然后,将96孔板离心以沉淀细胞。平行地,从板除去封闭缓冲液,并将板在96头板洗涤器(tecan group,switzerland)上用每孔350μl的tbs-t(carl roth,germany)洗涤4次。为了避免干燥,将30μl的tbs立即添加到板的各孔中,随后每样品转移70μl的无细胞上清液。另外,将用tbs以限定浓度稀释的100μl重组人tnfα蛋白(作为duoset elisa试剂盒的一部分提供)添加到板中作为标准参考。然后,将每孔100μl的生物素化山羊抗人tnfα检测抗体(作为duoset elisa试剂盒的一部分提供)以50ng/ml tbs添加,避光保护,将板在室温下孵育2小时。在96头板洗涤器(tecan group,switzerland)上用每孔350μl的tbs-t(carl roth,germany)洗涤4次并在第四次循环后小心除去所有缓冲液痕量之后,将100μl的用tbs以1:10,000稀释的链霉亲和素-ap(r&d systems,usa)添加至各孔中,并再次避光保护,将板在室温下孵育30分钟。在96头板洗涤器(tecan group,switzerland)上用每孔350μl的tbs-t(carl roth,germany)洗涤另一轮4次并在第四次循环后小心除去所有缓冲液痕量之后,添加100μl的attophos底物溶液(promega,usa)以在室温下暗处孵育1小时。使用infinite m1000 pro(tecan group,switzerland)酶标仪,在435nm的激发波长和555nm的发射波长下收集各孔的荧光。
[0231]
图6显示该实验的代表性结果,以绝对数(图6a)和抑制百分比(图6b)表明供试品对lps诱导的tnfα从thp-1细胞释放的效应。尽管batimastat(bb94)作为金属蛋白酶的小分子抑制剂充当阳性对照并且导致对lps诱导的tnfα释放的92.5%抑制,但igm同种型对照的存在对tnfα脱落没有显著效应。相比之下,相等浓度的本发明的纯化抗体4h8-e3对lps诱导的tnfα从thp-1细胞的释放抑制62.6%。
[0232]
实施例12:本发明的抗体4h8-e3对体外lps诱导的tnfα脱落的ic50的测定:
[0233]
扩展功能分析,进行基于elisa的tnfα释放测定以确定本发明的纯化抗体4h8-e3对lps诱导的内源性tnfα从人thp-1巨噬细胞释放的半数最大抑制浓度(ic50)。
[0234]
简而言之,在第1天,将nunc black96孔板(thermo fisher scientific,usa)用每孔100μl的小鼠抗人tnfα捕获抗体(作为duoset elisa试剂盒的一部分提供)以4μg/ml tbs在4℃下包被过夜。在第2天,除去捕获抗体溶液,并将板用每孔300μl的tbs、1%bsa在室温下封闭3小时。同时,将80μl正常生长培养基中的20,000个thp-1(美国典型培养物保藏中心(american type culture collection),usa)细胞接种到greiner cellstar v形底96孔板(thermo fisher scientific,usa)的各孔中,并在37℃、5%co2下与每孔20μl的标准生长培养基一起预孵育30分钟,该标准生长培养基补充有约400.00μg/ml、307.69μg/ml、236.68μg/ml、182.06μg/ml、140.05μg/ml、107.73μg/ml、82.87μg/ml、63.74μg/ml、49.03μg/ml、37.71μg/ml、29.01μg/ml、22.31μg/ml、17.16μg/ml、
13.20μg/ml、10.15μg/ml、7.81μg/ml、6.01μg/ml、4.62μg/ml、3.55μg/ml、2.73μg/ml、2.10μg/ml、1.61μg/ml、1.24μg/ml、0.95μg/ml、0.73μg/ml、0.56μg/ml和0.43μg/ml(分别对于约80.00μg/ml、61.53μg/ml、47.33μg/ml、36.41μg/ml、28.01μg/ml、21.54μg/ml、16.57μg/ml、12.74μg/ml、9.80μg/ml、7.54μg/ml、5.80μg/ml、4.46μg/ml、3.43μg/ml、2.64μg/ml、2.03μg/ml、1.56μg/ml、1.20μg/ml、0.92μg/ml、0.71μg/ml、0.54μg/ml、0.42μg/ml、0.32μg/ml、0.24μg/ml、0.19μg/ml、0.14μg/ml、0.11μg/ml和0.08μg/ml的最终浓度,在所得的100μl样品体积中)的本发明的纯化抗体4h8-e3。随后,在37℃、5%co2下,用每孔20μl的lps(sigma-aldrich,usa)以300ng/ml生长培养基(最终浓度为50ng/ml)刺激细胞(未刺激对照的那些除外)3小时。然后,将96孔板离心以沉淀细胞。平行地,从板除去封闭缓冲液,并将板在96头板洗涤器(tecan group,switzerland)上用每孔350μl的tbs-t(carl roth,germany)洗涤4次。为了避免干燥,将30μl的tbs立即添加到板的各孔中,随后每样品转移70μl的无细胞上清液。另外,将用tbs以限定浓度稀释的100μl重组人tnfα蛋白(作为duoset elisa试剂盒的一部分提供)添加到板中作为标准参考。然后,将每孔100μl的生物素化山羊抗人tnfα检测抗体(作为duoset elisa试剂盒的一部分提供)以50ng/ml tbs添加,避光保护,将板在室温下孵育2小时。在96头板洗涤器(tecan group,switzerland)上用每孔350μl的tbs-t(carl roth,germany)洗涤4次并在第四次循环后小心除去所有缓冲液痕量之后,将100μl的用tbs以1:10,000稀释的链霉亲和素-ap(r&dsystems,usa)添加至各孔中,并再次避光保护,将板在室温下孵育30分钟。在96头板洗涤器(tecan group,switzerland)上用每孔350μl的tbs-t(carl roth,germany)洗涤另一轮4次并在第四次循环后小心除去所有缓冲液痕量之后,添加100μl的attophos底物溶液(promega,usa)以在室温下暗处孵育1小时。使用infinite m1000 pro(tecan group,switzerland)酶标仪,在435nm的激发波长和555nm的发射波长下收集各孔的荧光。
[0235]
图7显示该实验的代表性结果。本发明的纯化抗体4h8-e3的滴定导致对tnfα从thp-1细胞释放的浓度依赖性抑制。应用prism8软件(graphpad software,usa),本发明的抗体4h8-e3的相应ic50值计算为6.48nm。
[0236]
参考文献
[0237]
·
g.&milstein,c.(1975):continuous cultures of fused cells secreting antibody of predefined specificity.in:nature.bd.256,s.495
–
497.jonsson和malmquist,advances in biosnsors,2:291-336(1992)
[0238]
·
wu等人proc.natl.acad.sci.usa,95:6037-6042(1998)
[0239]
·
banik,ssr;doranz,bj(2010)."mapping complex antibody epitopes".genetic engineering&biotechnology news.3(2):25
–8[0240]
·
delisser,hm(1999).epitope mapping.methods mol biol.96.第11
–
20页
[0241]
·
finco等人,comparison of competitive ligand-binding assay and bioassay formats for the measurement of neutralizing antibodies to protein therapeutics.j pharm biomed anal.2011年1月25日;54(2):351-8.doi:10.1016/j.jpba.2010.08.029.epub 2010年9月21日
[0242]
·
deng等人,enhancing antibody patent protection using epitope mapping information mabs.2018年2月-3月;10(2):204-209
[0243]
·
huston等人,cell biophysics,22:189-224(1993);
[0244]
·
pl
ü
ckthun和skerra,meth.enzymol.,178:497-515(1989)和day,e.d.,advanced immunochemistry,第二版,wiley-liss,inc.,new york,n.y.(1990)
[0245]
·
harding,the immunogenicity of humanized and fully human antibodies.mabs.2010年5月-6月;2(3):256
–
265.
[0246]
·
eylenstein等人,molecular basis of in vitro affinity maturation and functional evolution of a neutralizing anti-human gm-csf antibody,mabs,8:1,176-186(2016)
[0247]
·
kabat等人,j.biol.chem.252,6609-6616(1977)和kabat等人,sequences of protein of immunological interest.(1991)
[0248]
·
chothia等人,j.mol.biol.196:901-917(1987)
[0249]
·
maccallum等人,j.mol.biol.262:732-745(1996)
[0250]
序列
[0251]
以下序列构成本技术公开内容的一部分。本技术也提供了wipo st 25兼容的电子序列表。为避免疑义,如果下表中的序列与电子序列表之间存在差异,则该表中的序列应视为正确的序列。
[0252]
[0253]
[0254]
[0255]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1