含有别孕烷醇酮、加奈索酮或祖拉诺醇酮的药物组合物及其用途的制作方法
含有别孕烷醇酮、加奈索酮或祖拉诺醇酮的药物组合物及其用途
交叉引用
1.本技术要求2019年5月10日提交的美国临时申请号62/846,576和2020年5月1日提交的美国临时申请号63/018,815的权益,所述申请中的每一者均以引用的方式整体并入本文。
技术领域
2.本公开涉及一种包含别孕烷醇酮(brexanolone)、加奈索酮(ganaxolone)、祖拉诺醇酮(zuranolone)(sage-217)或其组合的药物组合物,所述药物组合物用于治疗诸如与癫痫相关的抑郁症的疾病和其他中枢神经系统病症。
背景技术:
3.诸如神经活性类固醇和衍生物的许多内源性和合成化合物可通过多种机制影响中枢神经系统(cns)功能,所述机制包括但不限于与许多中枢神经系统病症相关的gabaa(γ氨基丁酸a型)受体进行正向立体异位调节。别孕烯醇酮(allopregnanolone)是此类具有较短终末半衰期和较差口服生物利用度且具有用作口服疗法或胃肠外疗法的有限临床用途的神经活性类固醇之一。别孕烷醇酮是与内源性别孕烯醇酮化学相同的合成化合物。加奈索酮(另一种此类神经活性类固醇和合成孕甾烷类固醇)具有相对较长半衰期,在口服施用后存在于人类血浆中大约20小时,且最大浓度(t
max
)较小(美国专利申请公布号20160228454)。加奈索酮和别孕烷醇酮均可调节gabaa受体的活性(pct专利公布wo2017156103a1、wo2016127170a1、美国专利号9,029,355、9,452,176、10,172,870)。
4.近来,别孕烷醇酮静脉内注射产品(别孕烷醇酮iv,zulresso
tm
,经研发且在sage therapeutics,cambridge,ma,usa的商标下)经美国食品和药物管理局(us food and drug administration,fda,2019年3月)批准用于治疗产后抑郁症(ppd),所述ppd是一种严重且可能危及生命的疾患,当前尚未明确指示针对所述疾患的药物疗法。然而,zulresso
tm
不方便通过连续静脉内(iv)输注使用且施用至患者,其持续总计约60小时(2.5天)。
5.近来,加奈索酮进行用于治疗严重产后抑郁症(ppd)和儿童癫痫的临床试验具有成功功效(marinus pharmaceuticals)。加奈索酮的静脉内注射和口服制剂均得到开发和测试(美国专利公布号20160228454a1;临床试验id:nct03228394,magnolia试验;ligsay等人,journal of neurodevelopmental disorders,9:26,2017;rasmusson等人,psychopharmacology,234:2245-2257,2017,doi 10.1007/s00213-017-4649-y)。然而,仍需对这些制剂的作用进行优化。
6.因此,需要生物利用度增强、作用持久和/或递送快速且方便的新颖且改进的制剂。
技术实现要素:
7.在一个方面中,本文公开了一种包含药学上有效量的神经活性类固醇的药物组合物,其中所述神经活性类固醇是γ-氨基丁酸a型(gabaa)受体的正向调节剂;并且其中在通过肌肉内或皮下注射施用单剂量的药物组合物后,所述神经活性类固醇的血浆浓度在约30分钟至6小时内达到最大血浆浓度(c
max
)且保持大于所述c
max
的约5%的血浆浓度持续至少约5天。
8.还公开了一种包含颗粒的药物组合物,所述颗粒包含至少一种神经活性类固醇和一种或多种药学上可接受的赋形剂,所述神经活性类固醇是γ氨基丁酸a型(gabaa)受体的正向调节剂;其中,所述颗粒包含具有约1.5μm至约15μm范围内的粒度的大颗粒和具有约0.2μm至约1.5μm范围内的粒度的小颗粒;并且其中约0.01%至约50%的颗粒是小颗粒且约50%至99.99%的颗粒是大颗粒,百分比是基于颗粒的总重量。所述神经活性类固醇可以是gabaa受体的正向调节剂且可包含四氢脱氧皮质酮(thdoc)、雄甾烷、雄甾烷3α-雄甾烷二醇、胆甾烷胆固醇、孕甾烷、孕甾烷孕烯醇酮(乙他诺隆(eltanolone))、别孕烯醇酮、别孕烷醇酮、加奈索酮、祖拉诺醇酮(sage-217)或其组合。
9.在另一方面中,本文公开了一种用于产生包含颗粒的药物组合物的方法,所述方法包括:a)产生包含以下的颗粒混合物:选自别孕烷醇酮、加奈索酮、祖拉诺醇酮(sage-217)或其组合的神经活性类固醇和一种或多种药学上可接受的赋形剂;b)研磨所述颗粒混合物的第一部分以产生大颗粒混合物,其中至少50%的所述大颗粒混合物是具有约1.5μm至约15μm范围内的粒度的大颗粒,百分比是基于所述颗粒混合物的总重量;和c)产生包含所述颗粒的药物组合物,所述颗粒包含约50%至99.99%的大颗粒,百分比是基于所述颗粒的总重量。
10.在另一方面中,本文公开了一种用于治疗有需要的受试者的疾病的方法,所述方法包括向受试者施用本文公开的药物组合物或通过本文公开的方法产生的药物组合物。所述药物组合物可通过肌肉内(im)注射、皮下(sc)注射、静脉内(iv)注射或其组合施用至受试者。
11.还公开了一种治疗有需要的受试者的疾病的方法,所述方法可包括:以每千克受试者体重0.5至10mg的范围内的单剂量通过肌肉内或皮下注射向所述受试者施用包含药学上有效量的神经活性类固醇的药物组合物,其中所述神经活性类固醇是γ-氨基丁酸a型(gabaa)受体的正向调节剂;并且其中在通过肌肉内或皮下注射向所述受试者施用所述药物组合物后,所述神经活性类固醇的血浆浓度在约30分钟至6小时内达到最大血浆浓度(c
max
)且在所述受试者中保持大于c
max
的约5%的血浆浓度持续至少约5天。以引用的方式并入
12.本说明书中提及的所有公布、专利和专利申请均以引用的方式并入本文中,其引用的程度如各单独的公布、专利或专利申请具体地且单独地指示以引用的方式并入一般。
附图说明
13.图1a-图1d。示例性粒度分布的示意图。图1a:药物组合物包含诸如小于1%的极少量的小颗粒且主要包含大颗粒。图1b:药物组合物包含一些小颗粒且主要包含大颗粒。图1c:药物组合物包含增加量的小颗粒和大颗粒。图1d:药物组合物包含类似量的小颗粒和大
颗粒。d50=质量中值直径(mmd),其中50%颗粒小于给定直径且50%颗粒大于给定直径。平均大=大颗粒的平均粒度。平均小=小颗粒的平均粒度。
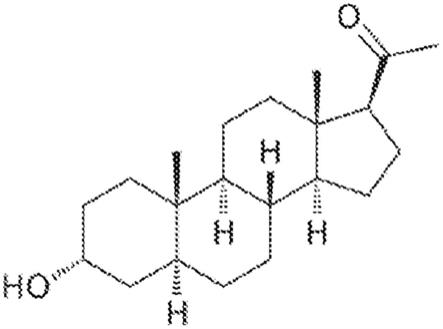
14.图2a-图2e。包含别孕烷醇酮的药物组合物的实例。图2a:别孕烷醇酮结构。图2b:较小别孕烷醇酮粒度分布。图2c:较大别孕烷醇酮粒度分布。图2d-图2e:大鼠中显示施用后随时间推移变化的大鼠血浆别孕烷醇酮浓度的药物动力学(pk)。图例:空心菱形,小颗粒的别孕烷醇酮悬浮液,25mg/kg;空心正方形,大颗粒的别孕烷醇酮悬浮液,25mg/kg;实心正方形,iv溶液(比较物)1mg/kg;和实心三角形,im溶液(比较物)12.5mg/kg。
15.图3a-图3e。包含加奈索酮的药物组合物的实例。图3a:加奈索酮结构。图3b:4.1μm加奈索酮颗粒的分布。图3c:3.6μm加奈索酮颗粒的分布。图3d-图3e:大鼠中显示施用后随时间推移变化的大鼠血浆浓度的药物动力学(pk)。图例:空心菱形,1μm颗粒的加奈索酮悬浮液,25mg/kg;空心正方形,4μm颗粒的加奈索酮悬浮液,25mg/kg;实心正方形,iv溶液(比较物);和实心菱形,im溶液(比较物)。
16.图4。三种条件下的晶型筛选结果的总结:1)在40℃-5℃之间进行别孕烷醇酮浆液的温度循环熟化持续两天(tc)(n=48);2)使浆液加热至40℃,之后进行热过滤,随后在4℃下储存别孕烷醇酮溶液持续至多两天(rc)(n=48);3)在环境条件下蒸发别孕烷醇酮溶液持续至多7天(ev)(n=48)。
17.图5。来自输入别孕烷醇酮的型a与来自筛选物的代表性型a图案的pxrd图案重叠图。
具体实施方式
18.本领域的普通技术人员阅读以下详细描述后将更易于理解所公开的组合物和方法的特征和优点。应理解,为清楚起见,在单独实施方案的上下文中,上文和下文描述的所公开组合物和方法的某些特征也可在单一实施方案中以组合形式提供。相反地,为简便起见,在单一实施方案的上下文中描述的所公开组合物和方法的各种特征也可单独提供或以任何子组合形式提供。此外,除非上下文另外明确陈述,否则呈单数形式的指代物也可包括复数(例如,“一个/种”可指代一个/种或一个/种或多个/种)。
19.除非另外明确指示,否则本技术中以各种范围指定的数值的使用是以近似值陈述,如所陈述范围内的最小值和最大值均接于词语“约”之后一般。以这种方式,在所陈述范围之上或之下的细微变化可用于基本上实现与所述范围内的数值相同的结果。此外,对这些范围的公开旨在作为包括最小值与最大值之间的每一值的连续范围。
20.如本文所用,与参考数值及其语法等效词相关的术语“约”及其语法等效词可包括所述值加或减10%的一系列值,诸如所述值加或减10%、9%、8%、7%、6%、5%、4%、3%、2%或1%的一系列值。举例而言,量“约”10包括9至11的量。
21.如本文所用,单数或复数形式的术语“γ氨基丁酸a型受体”、“γ-氨基丁酸a型受体”、“γ-氨基丁酸a受体”、“gabaa受体”、“gabaars”、“gabaar”或其语法变型是指γ-氨基丁酸a型受体(gabaars),其是一类对神经递质γ-氨基丁酸(gaba)有反应的受体。gaba是大脑皮层中的主要抑制性神经递质,其对维持抵消神经元兴奋的抑制性状态是至关重要的。gabaa受体的失调或gaba和神经兴奋的失衡可导致癫痫发作和其他中枢神经系统机能失常。许多天然和合成神经活性类固醇可与gabaars结合且调节其活性。
60%、约50%-60%、约50%-70%、约60%-70%、约60%-80%、约70%-80%、约70%-90%、约80%-90%、约80%-95%或95%-99%。优选地,神经活性类固醇的量可以是药物组合物的约0.1%至约70%,并且最优选是约1%至约30%。
30.药物组合物可包含药学上有效量的神经活性类固醇,其中神经活性类固醇是γ-氨基丁酸a型(gabaa)受体的正向调节剂;其中在通过静脉内(iv)注射、肌肉内(im)注射、皮下(sc)注射或其组合向受试者施用单剂量的药物组合物后,神经活性类固醇在约10分钟至6小时内在受试者中达到最大血浆浓度(c
max
)且在受试者中保持大于c
max
的约5%的神经活性类固醇的血浆浓度持续至少约1天;并且其中从来自受试者的一个或多个试样测量最大血浆浓度(c
max
)。
31.在一些情况下,可在约10分钟至约360分钟内达到cmax。在一些情况下,可在约10分钟至约20分钟、约10分钟至约30分钟、约10分钟至约40分钟、约10分钟至约50分钟、约10分钟至约60分钟、约10分钟至约120分钟、约10分钟至约180分钟、约10分钟至约240分钟、约10分钟至约300分钟、约10分钟至约360分钟、约20分钟至约30分钟、约20分钟至约40分钟、约20分钟至约50分钟、约20分钟至约60分钟、约20分钟至约120分钟、约20分钟至约180分钟、约20分钟至约240分钟、约20分钟至约300分钟、约20分钟至约360分钟、约30分钟至约40分钟、约30分钟至约50分钟、约30分钟至约60分钟、约30分钟至约120分钟、约30分钟至约180分钟、约30分钟至约240分钟、约30分钟至约300分钟、约30分钟至约360分钟、约40分钟至约50分钟、约40分钟至约60分钟、约40分钟至约120分钟、约40分钟至约180分钟、约40分钟至约240分钟、约40分钟至约300分钟、约40分钟至约360分钟、约50分钟至约60分钟、约50分钟至约120分钟、约50分钟至约180分钟、约50分钟至约240分钟、约50分钟至约300分钟、约50分钟至约360分钟、约60分钟至约120分钟、约60分钟至约180分钟、约60分钟至约240分钟、约60分钟至约300分钟、约60分钟至约360分钟、约120分钟至约180分钟、约120分钟至约240分钟、约120分钟至约300分钟、约120分钟至约360分钟、约180分钟至约240分钟、约180分钟至约300分钟、约180分钟至约360分钟、约240分钟至约300分钟、约240分钟至约360分钟或约300分钟至约360分钟内达到cmax。在一些情况下,可在约10分钟、约20分钟、约30分钟、约40分钟、约50分钟、约60分钟、约120分钟、约180分钟、约240分钟、约300分钟或约360分钟内达到cmax。
32.在一些情况下,神经活性类固醇可将受试者中的血浆浓度保持在大于cmax的约5%的水平持续约1天至约100天。在一些情况下,神经活性类固醇可将受试者中的血浆浓度保持在大于cmax的约5%的水平持续至少约1天。在一些情况下,神经活性类固醇可将受试者中的血浆浓度保持在大于cmax的约5%的水平持续至多约100天。在一些情况下,神经活性类固醇可将受试者中的血浆浓度保持在大于cmax的约5%的水平持续约1天至约5天、约1天至约10天、约1天至约20天、约1天至约30天、约1天至约50天、约1天至约100天、约5天至约10天、约5天至约20天、约5天至约30天、约5天至约50天、约5天至约100天、约10天至约20天、约10天至约30天、约10天至约50天、约10天至约100天、约20天至约30天、约20天至约50天、约20天至约100天、约30天至约50天、约30天至约100天或约50天至约100天。在一些情况下,神经活性类固醇可将受试者中的血浆浓度保持在大于cmax的约5%的水平持续约1天、约5天、约10天、约20天、约30天、约50天或约100天。
33.在一些情况下,单剂量的所公开药物组合可以是每千克(kg)体重约0.5mg至约
50mg。在一些情况下,单剂量可以是每千克体重至少约0.5mg。在一些情况下,单剂量可以是每千克体重至多约50mg。在一些情况下,单剂量可以是每千克体重约0.5mg至约2mg、每千克体重约0.5mg至约4mg、每千克体重约0.5mg至约6mg、每千克体重约0.5mg至约8mg、每千克体重约0.5mg至约10mg、每千克体重约0.5mg至约20mg、每千克体重约0.5mg至约50mg、每千克体重约2mg至约4mg、每千克体重约2mg至约6mg、每千克体重约2mg至约8mg、每千克体重约2mg至约10mg、每千克体重约2mg至约20mg、每千克体重约2mg至约50mg、每千克体重约4mg至约6mg、每千克体重约4mg至约8mg、每千克体重约4mg至约10mg、每千克体重约4mg至约20mg、每千克体重约4mg至约50mg、每千克体重约6mg至约8mg、每千克体重约6mg至约10mg、每千克体重约6mg至约20mg、每千克体重约6mg至约50mg、每千克体重约8mg至约10mg、每千克体重约8mg至约20mg、每千克体重约8mg至约50mg、每千克体重约10mg至约20mg、每千克体重约10mg至约50mg或每千克体重约20mg至约50mg。在一些情况下,单剂量可以是每千克体重约0.5mg、每千克体重约2mg、每千克体重约4mg、每千克体重约6mg、每千克体重约8mg、每千克体重约10mg、每千克体重约20mg或每千克体重约50mg。在特定实例中,单剂量可以是每千克体重约3.5mg至5mg。体重是指诸如人类患者或动物受试者的受试者体重。
34.在一些情况下,单位剂量的所公开药物组合物可以是约50mg至约800mg。在一些情况下,单个单位剂量可以是至少约50mg。在一些情况下,单个单位剂量可以是至多约800mg。在一些情况下,单个单位剂量可以是约50mg至约100mg、约50mg至约200mg、约50mg至约300mg、约50mg至约400mg、约50mg至约600mg、约50mg至约800mg、约100mg至约200mg、约100mg至约300mg、约100mg至约400mg、约100mg至约600mg、约100mg至约800mg、约200mg至约300mg、约200mg至约400mg、约200mg至约600mg、约200mg至约800mg、约300mg至约400mg、约300mg至约600mg、约300mg至约800mg、约400mg至约600mg、约400mg至约800mg或约600mg至约800mg。在一些情况下,单个单位剂量可以是约50mg、约100mg、约200mg、约300mg、约400mg、约600mg或约800mg。单位剂量是可以单剂量施用至受试者的药物组合物的封装形式。举例而言,300mg单位剂量的药物组合物可以特定体积封装,诸如一毫升体积,其呈可以单次注射形式注射至受试者中的可注射形式。在其他实例中,300mg的药物组合物可封装于特定数目的片剂中,诸如一片片剂,其可以一次口服剂量施用至受试者。在又其他实例中,300mg单位剂量的药物组合物可以特定体积封装,诸如0.5毫升体积,其呈可以单次皮下注射形式注射至受试者中的可注射形式。
35.在一些情况下,单剂量的所公开药物组合物可以是约50mg至约800mg。在一些情况下,单剂量可以是至少约50mg。在一些情况下,单剂量可以是至多约800mg。在一些情况下,单剂量可以是约50mg至约100mg、约50mg至约200mg、约50mg至约300mg、约50mg至约400mg、约50mg至约600mg、约50mg至约800mg、约100mg至约200mg、约100mg至约300mg、约100mg至约400mg、约100mg至约600mg、约100mg至约800mg、约200mg至约300mg、约200mg至约400mg、约200mg至约600mg、约200mg至约800mg、约300mg至约400mg、约300mg至约600mg、约300mg至约800mg、约400mg至约600mg、约400mg至约800mg或约600mg至约800mg。在一些情况下,单剂量可以是约50mg、约100mg、约200mg、约300mg、约400mg、约600mg或约800mg。
36.当基于受试者的体重使用单位剂量向受试者施用药物组合物时,可调整单剂量。在一个实例中,300mg于1ml可注射溶液中的单位剂量旨在向体重在60kg至70kg范围内的受试者进行单剂量注射。对于具有低于60kg体重的受试者,可以一次注射向受试者注射调整
的剂量,诸如0.5ml的300mg单位剂量。对于具有高于70kg体重的受试者,可以一次注射向受试者注射调整的剂量,诸如1.5ml的300mg单位剂量。如本文公开,单剂量可进行调整以具有每千克(kg)体重所需毫克数的药物组合物。
37.单剂量的所公开药物组合物可在每千克(kg)体重约0.5至50mg的范围内和/或可通过组合一个或多个单位剂量或其部分而产生,其中单位剂量的每一者均可在每单位剂量50mg至800mg的范围内。上文和下文公开的单剂量、单位剂量或其组合的范围是合适的且并入为实例。
38.在一些情况下,所公开的药物组合物可具有约5mg/ml至约800mg/ml的神经活性类固醇浓度。在一些情况下,神经活性类固醇浓度可以是至少约5mg/ml。在一些情况下,神经活性类固醇浓度可以是至多约800mg/ml。在一些情况下,神经活性类固醇浓度可以是约5mg/ml至约10mg/ml、约5mg/ml至约50mg/ml、约5mg/ml至约100mg/ml、约5mg/ml至约200mg/ml、约5mg/ml至约400mg/ml、约5mg/ml至约800mg/ml、约10mg/ml至约50mg/ml、约10mg/ml至约100mg/ml、约10mg/ml至约200mg/ml、约10mg/ml至约400mg/ml、约10mg/ml至约800mg/ml、约50mg/ml至约100mg/ml、约50mg/ml至约200mg/ml、约50mg/ml至约400mg/ml、约50mg/ml至约800mg/ml、约100mg/ml至约200mg/ml、约100mg/ml至约400mg/ml、约100mg/ml至约800mg/ml、约200mg/ml至约400mg/ml、约200mg/ml至约800mg/ml或约400mg/ml至约800mg/ml。在一些情况下,神经活性类固醇浓度可以是约5mg/ml、约10mg/ml、约50mg/ml、约100mg/ml、约200mg/ml、约400mg/ml或约800mg/ml。
39.在一些情况下,神经活性类固醇可保持大于c
max
的约10%、15%、20%、25%或30%的血浆浓度持续至少约10、20、30、40、50或60天。神经活性类固醇在一个实例中可保持大于约10%c
max
的血浆浓度持续至少约10天,在另一实例中保持15%c
max
持续至少约10天,在又另一实例中保持20%c
max
持续至少约10天,在又另一实例中保持25%c
max
持续至少约10天,在又另一实例中保持35%c
max
持续至少约10天,在另一实例中保持10%c
max
持续至少约20天,在另一实例中保持15%c
max
持续至少约20天,在又另一实例中保持25%c
max
持续至少约20天,在又另一实例中保持35%c
max
持续至少约20天,在另一实例中保持10%c
max
持续至少约30天,在另一实例中保持15%c
max
持续至少约30天,在又另一实例中保持25%c
max
持续至少约30天,在又另一实例中保持35%c
max
持续至少约30天,在另一实例中保持10%c
max
持续至少约40天,在另一实例中保持15%c
max
持续至少约40天,在又另一实例中保持25%c
max
持续至少约40天,在又另一实例中保持35%c
max
持续至少约40天,在另一实例中保持10%c
max
持续至少约50天,在另一实例中保持15%c
max
持续至少约50天,在又另一实例中保持25%c
max
持续至少约50天,在又另一实例中保持35%c
max
持续至少约50天,在另一实例中保持10%c
max
持续至少约60天,在另一实例中保持15%c
max
持续至少约60天,在又另一实例中保持25%c
max
持续至少约60天,在又另一实例中保持35%c
max
持续至少约60天,在另一实例中保持10%c
max
持续至少约60天或更多天,在另一实例中保持15%c
max
持续至少约60天或更多天,在又另一实例中保持25%c
max
持续至少约60天或更多天,或在又另一实例中保持35%c
max
持续至少约60天或更多天。在一个特定实例中,神经活性类固醇可保持大于c
max
的约15%的血浆浓度持续至少约30天。
40.在一些情况下,c
max
可以是约1ng/ml至约100ng/ml。在一些情况下,c
max
可以是至少约1ng/ml。在一些情况下,c
max
可以是至多约100ng/ml。在一些情况下,c
max
可以是约1ng/ml
至约10ng/ml、约1ng/ml至约20ng/ml、约1ng/ml至约40ng/ml、约1ng/ml至约60ng/ml、约1ng/ml至约80ng/ml、约1ng/ml至约100ng/ml、约10ng/ml至约20ng/ml、约10ng/ml至约40ng/ml、约10ng/ml至约60ng/ml、约10ng/ml至约80ng/ml、约10ng/ml至约100ng/ml、约20ng/ml至约40ng/ml、约20ng/ml至约60ng/ml、约20ng/ml至约80ng/ml、约20ng/ml至约100ng/ml、约40ng/ml至约60ng/ml、约40ng/ml至约80ng/ml、约40ng/ml至约100ng/ml、约60ng/ml至约80ng/ml、约60ng/ml至约100ng/ml或约80ng/ml至约100ng/ml。在一些情况下,c
max
可以是约1ng/ml、约10ng/ml、约20ng/ml、约40ng/ml、约60ng/ml、约80ng/ml或约100ng/ml。在特定实例中,c
max
是在20至90ng/ml的范围内。
41.在一些情况下,单剂量可在每千克体重3至约5mg的范围内,和/或神经活性类固醇可保持大于约10ng/ml的血浆浓度持续至少约5天。在特定实例中,神经活性类固醇可保持大于10、20、25、30、40、50、60、70、80、90、100ng/ml的血浆浓度持续至少约10、20、30、40、50或60天。在一些情况下,神经活性类固醇在一个实例中可保持大于10ng/ml的血浆浓度持续至少约10天,在另一实例中保持大于20ng/ml持续至少约10天,在又另一实例中保持大于30ng/ml持续至少约10天,在又另一实例中保持大于40ng/ml持续至少约10天,在又另一实例中保持大于50ng/ml持续至少约10天,在又另一实例中保持大于60ng/ml持续至少约10天,在又另一实例中保持大于70ng/ml持续至少约10天,在又另一实例中保持大于80ng/ml持续至少约10天,在又另一实例中保持大于90ng/ml持续至少约10天,在又另一实例中保持大于100ng/ml持续至少约10天,在一个实例中保持大于10ng/ml持续至少约20天,在另一实例中保持大于20ng/ml持续至少约20天,在又另一实例中保持大于30ng/ml持续至少约20天,在又另一实例中保持大于40ng/ml持续至少约20天,在又另一实例中保持大于50ng/ml持续至少约20天,在又另一实例中保持大于60ng/ml持续至少约20天,在又另一实例中保持大于70ng/ml持续至少约20天,在又另一实例中保持大于80ng/ml持续至少约20天,在又另一实例中保持大于90ng/ml持续至少约20天,在又另一实例中保持大于100ng/ml持续至少约20天,在一个实例中保持大于10ng/ml持续至少约30天,在另一实例中保持大于20ng/ml持续至少约30天,在又另一实例中保持大于30ng/ml持续至少约30天,在又另一实例中保持大于40ng/ml持续至少约30天,在又另一实例中保持大于50ng/ml持续至少约30天,在又另一实例中保持大于60ng/ml持续至少约30天,在又另一实例中保持大于70ng/ml持续至少约30天,在又另一实例中保持大于80ng/ml持续至少约30天,在又另一实例中保持大于90ng/ml持续至少约30天,在又另一实例中保持大于100ng/ml持续至少约30天,在一个实例中保持大于10ng/ml持续至少约40天,在另一实例中保持大于20ng/ml持续至少约40天,在又另一实例中保持大于30ng/ml持续至少约40天,在又另一实例中保持大于40ng/ml持续至少约40天,在又另一实例中保持大于50ng/ml持续至少约40天,在又另一实例中保持大于60ng/ml持续至少约40天,在又另一实例中保持大于70ng/ml持续至少约40天,在又另一实例中保持大于80ng/ml持续至少约40天,在又另一实例中保持大于90ng/ml持续至少约40天,在又另一实例中保持大于100ng/ml持续至少约40天,在一个实例中保持大于10ng/ml持续至少约50天,在另一实例中保持大于20ng/ml持续至少约50天,在又另一实例中保持大于30ng/ml持续至少约50天,在又另一实例中保持大于40ng/ml持续至少约50天,在又另一实例中保持大于50ng/ml持续至少约50天,在又另一实例中保持大于60ng/ml持续至少约50天,在又另一实例中保持大于70ng/ml持续至少约50天,在又另一实例中保持大于80ng/ml持续至少
约50天,在又另一实例中保持大于90ng/ml持续至少约50天,在又另一实例中保持大于100ng/ml持续至少约50天,在一个实例中保持大于10ng/ml持续至少约60天,在另一实例中保持大于20ng/ml持续至少约60天,在又另一实例中保持大于30ng/ml持续至少约60天,在又另一实例中保持大于40ng/ml持续至少约60天,在又另一实例中保持大于50ng/ml持续至少约60天,在又另一实例中保持大于60ng/ml持续至少约60天,在又另一实例中保持大于70ng/ml持续至少约60天,在又另一实例中保持大于80ng/ml持续至少约60天,在又另一实例中保持大于90ng/ml持续至少约60天,在又另一实例中保持大于100ng/ml持续至少约60天,在一个实例中保持大于10ng/ml持续至少约60天或更多天,在另一实例中保持大于20ng/ml持续至少约60天或更多天,在又另一实例中保持大于30ng/ml持续至少约60天或更多天,在又另一实例中保持大于40ng/ml持续至少约60天或更多天,在又另一实例中保持大于50ng/ml持续至少约60天或更多天,在又另一实例中保持大于60ng/ml持续至少约60天或更多天,在又另一实例中保持大于70ng/ml持续至少约60天或更多天,在又另一实例中保持大于80ng/ml持续至少约60天或更多天,在又另一实例中保持大于90ng/ml持续至少约60天或更多天,且在又另一实例中保持大于100ng/ml持续至少约60天或更多天。在一个其他实例中,神经活性类固醇可保持大于20ng/ml的血浆浓度持续至少约30天。
42.在一些情况下,药物组合物在肌肉内或皮下注射单剂量的药物组合物约1小时内释放小于约5%-50%的神经活性类固醇。特别地,在通过肌肉内或皮下注射向受试者施用单剂量的药物组合物约1小时内,药物组合物在一个实例中可释放小于约5%-50%的神经活性类固醇至受试者血浆中,在另一实例中是10%-50%,在又另一实例中是15%-50%,在又另一实例中是20%-50%,在又另一实例中是25%-50%,在又另一实例中是30%-50%,在又另一实例中是40%-50%,且在又另一实例中是45%-50%。释放的百分比是基于所测量的神经活性类固醇的血浆浓度和施用至受试者的单剂量的药物组合物中神经活性类固醇的总量。
43.在一些情况下,相较于静脉内施用相同剂量,在肌肉内或皮下注射单剂量后24小时,药物组合物可具有约2%-50%的相对生物利用度(生物利用度
im/sc
/生物利用度
iv
)。在一些情况下,相对生物利用度可以是约2%至约50%。在一些情况下,相对生物利用度可以是至少约2%。在一些情况下,相对生物利用度可以是至多约50%。在一些情况下,相对生物利用度可以是约2%至约5%、约2%至约10%、约2%至约20%、约2%至约30%、约2%至约40%、约2%至约50%、约5%至约10%、约5%至约20%、约5%至约30%、约5%至约40%、约5%至约50%、约10%至约20%、约10%至约30%、约10%至约40%、约10%至约50%、约20%至约30%、约20%至约40%、约20%至约50%、约30%至约40%、约30%至约50%或约40%至约50%。在一些情况下,相对生物利用度可以是约2%、约5%、约10%、约20%、约30%、约40%或约50%。
44.在一些情况下,所公开的药物组合物可包含含有至少一种神经活性类固醇和一种或多种药学上可接受的赋形剂的颗粒,其中神经活性类固醇是γ氨基丁酸a型(gabaa)受体的正向调节剂;其中,颗粒包含具有约1.5μm至约15μm范围内的粒度的大颗粒和具有约0.2μm至约1.5μm范围内的粒度的小颗粒;并且其中,约0.01%至约50%的颗粒是小颗粒且约50%至约99.99%的颗粒是大颗粒,百分比是基于颗粒的总重量。在药物组合物的实施方案或实例的任一者中,颗粒可以是本文公开的稳定化颗粒。
45.在一些情况下,所公开的药物组合物可包含药学上有效量的神经活性类固醇,其中神经活性类固醇是γ-氨基丁酸a型(gabaa)受体的正向调节剂;其中在通过静脉内(iv)注射、肌肉内(im)注射、皮下(sc)注射或其组合向受试者施用单剂量的药物组合物后,神经活性类固醇在约30分钟至6小时内在受试者中达到最大血浆浓度(c
max
)且保持大于c
max
的约5%的神经活性类固醇的血浆浓度持续至少约5天;其中,药物组合物包含神经活性类固醇的颗粒;其中,颗粒包含具有约1.5μm至约15μm范围内的粒度的大颗粒和具有约0.2μm至约1.5μm范围内的粒度的小颗粒;并且其中,约0.01%至约50%的颗粒是小颗粒且约50%至99.99%的颗粒是大颗粒,百分比是基于颗粒的总重量。
46.在一些情况下,从来自受试者的试样测量最大血浆浓度(c
max
)。
47.在一些情况下,颗粒可具有1.2μm至约6.0μm范围内的d50。d50在一个实例中可以是1.2μm,在另一实例中可以是1.3μm,在又另一实例中可以是1.4μm,在又另一实例中可以是1.5μm,在又另一实例中可以是1.6μm,在又另一实例中可以是1.7μm,在又另一实例中可以是1.8μm,在又另一实例中可以是1.9μm,在又另一实例中可以是2.0μm,在又另一实例中可以是2.2μm,在又另一实例中可以是2.4μm,在又另一实例中可以是2.6μm,在又另一实例中可以是2.8μm,在又另一实例中可以是3.0μm,在又另一实例中可以是3.5μm,在又另一实例中可以是4.0μm,在又另一实例中可以是4.5μm,在又另一实例中可以是5.0μm,在又另一实例中可以是5.5μm,在又另一实例中可以是6.0μm,或在另一实例中是1.2μm至6.0μm范围内的任一值。
48.所公开的药物组合物的神经活性类固醇可包含四氢脱氧皮质酮(thdoc)、雄甾烷、雄甾烷3α-雄甾烷二醇、胆甾烷胆固醇、孕甾烷、孕甾烷孕烯醇酮(乙他诺隆)、别孕烯醇酮、别孕烷醇酮、加奈索酮、祖拉诺醇酮(sage-217)或其组合。举例而言,神经活性类固醇可以是别孕烷醇酮。
49.在一些情况下,大颗粒可在一个实例中具有2.0至6.0μm范围内的平均粒度,在另一实例中具有3.0至5.0μm范围内的平均粒度,在又另一实例中具有0.4至1.3μm范围内的平均粒度,并且在一个其他实例中具有0.5至0.9μm范围内的平均粒度。
50.药物组合物还可包含一种或多种药学上可接受的赋形剂。药学上可接受的赋形剂可包含表面活性剂、乳化剂、填充剂、载体、等张剂、分散剂、粘度调节剂、再悬浮剂、缓冲剂或其组合。药物赋形剂通常不具有药品或药物活性成分的特性,所述成分也称为活性药物成分(api),且通常用于简化生产工艺或活性成分的封装,或用于将api递送至患者或其他受试者。药学上可接受的赋形剂或来自可获自us fda的非活性成分数据库(inactive ingredients database)(https://www.fda.gov/drugs/drug-approvals-and-databases/inactive-ingredients-database-download)的非活性成分可以是合适的。可获自us fda的公认安全物质(scogs)数据库(https://www.fda.gov/food/generally-recognized-safe-gras/gras-substances-scogs-database)的一些gras食物也可以是合适的。
51.在一些情况下,药学上可接受的赋形剂可包括阿拉伯胶(acacia)、动物油、苄醇、苯甲酸苄酯、硬脂酸钙、卡波姆(carbomer)、鲸蜡硬脂醇、鲸蜡醇、胆固醇、环糊精、右旋糖、二乙醇胺、乳化蜡、乙二醇棕榈硬脂酸酯、甘油、甘油单硬脂酸酯、甘油硬脂酸酯、单油酸甘油酯、单硬脂酸甘油酯、水合物、组氨酸、盐酸、羟丙基纤维素、羟丙基-β-环糊精(hpbcd)、羟丙甲纤维素(羟丙基甲基纤维素(hpmc))、羊毛脂、羊毛脂醇、卵磷脂、中链甘油三酯、金属
皂、甲基纤维素、矿物油、磷酸二氢钠、单乙醇胺、油酸、聚乙二醇(peg 3350、peg 4000、peg 6000)、聚氧乙烯-聚氧丙烯共聚物(泊洛沙姆(poloxamer))、聚氧乙烯烷基醚、聚氧乙烯蓖麻油、聚氧乙烯蓖麻油衍生物、聚氧乙烯脱水山梨糖醇脂肪酸酯、聚氧乙烯硬脂酸酯、聚山梨醇酯、聚氧乙烯(20)脱水山梨糖醇单月桂酸酯(tween 20,聚山梨醇酯20)、聚氧乙烯(20)脱水山梨糖醇单油酸酯(tween 80,聚山梨醇酯80)、聚维酮、海藻酸丙二醇酯、盐水、氯化钠、柠檬酸钠、二水合柠檬酸钠、氢氧化钠、月桂基硫酸钠、磷酸二氢钠、磷酸氢二钠、脱水山梨糖醇酯、硬脂酸、硬脂醇、葵花油、黄蓍胶、三乙醇胺、植物油、水、黄原胶或其组合。
52.在一些情况下,药学上可接受的赋形剂可包括右旋糖、甘油、组氨酸、盐酸、羟丙基纤维素、羟丙基-β-环糊精(hpbcd)、羟丙甲纤维素(羟丙基甲基纤维素(hpmc))、聚氧乙烯(20)脱水山梨糖醇单月桂酸酯(tween 20,聚山梨醇酯20)、聚乙二醇(peg 3350、peg 4000、peg 6000)、聚氧乙烯-聚氧丙烯共聚物(泊洛沙姆188(poloxamer 188)、泊洛沙姆407(poloxamer 407))、聚氧乙烯(20)脱水山梨糖醇单油酸酯(tween 80,聚山梨醇酯80)、盐水、氯化钠、柠檬酸钠、二水合柠檬酸钠、月桂基硫酸钠、磷酸二氢钠、磷酸氢二钠或其组合。
53.药物组合物可适用于静脉内、肌肉内、皮下、胃肠外、脊髓或表皮施用(例如,通过注射或输注)。取决于施用途径,活性成分可包覆于材料中以保护其免受酸作用和其他可使其失活的自然条件的影响。如本文所用,短语“胃肠外施用”意指除经肠和局部施用以外的施用模式,通常通过注射,且包括但不限于静脉内、肌肉内、动脉内、鞘内、囊内、眶内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛膜下、脊髓内、硬膜外和胸骨内注射和输注。或者,可通过非胃肠外途径施用药物组合物,诸如局部、表皮或粘膜施用途径,例如鼻内、口服、经阴道、经直肠、舌下或局部施用。药物组合物可呈无菌水溶液或分散剂的形式。药物组合物也可以适于高药物浓度的微乳剂、脂质体或其他有序结构配制。
54.药物组合物可包含含有神经活性类固醇的颗粒群体,其中颗粒具有约0.1-50μm的平均粒度。在一些情况下,颗粒可具有约0.1μm至约50μm的平均粒度。在一些情况下,颗粒可具有至少约0.1μm的平均粒度。在一些情况下,颗粒可具有至多约50μm的平均粒度。在一些情况下,颗粒可具有约0.1μm至约0.2μm、约0.1μm至约0.5μm、约0.1μm至约1μm、约0.1μm至约2μm、约0.1μm至约5μm、约0.1μm至约10μm、约0.1μm至约20μm、约0.1μm至约30μm、约0.1μm至约40μm、约0.1μm至约50μm、约0.2μm至约0.5μm、约0.2μm至约1μm、约0.2μm至约2μm、约0.2μm至约5μm、约0.2μm至约10μm、约0.2μm至约20μm、约0.2μm至约30μm、约0.2μm至约40μm、约0.2μm至约50μm、约0.5μm至约1μm、约0.5μm至约2μm、约0.5μm至约5μm、约0.5μm至约10μm、约0.5μm至约20μm、约0.5μm至约30μm、约0.5μm至约40μm、约0.5μm至约50μm、约1μm至约2μm、约1μm至约5μm、约1μm至约10μm、约1μm至约20μm、约1μm至约30μm、约1μm至约40μm、约1μm至约50μm、约2μm至约5μm、约2μm至约10μm、约2μm至约20μm、约2μm至约30μm、约2μm至约40μm、约2μm至约50μm、约5μm至约10μm、约5μm至约20μm、约5μm至约30μm、约5μm至约40μm、约5μm至约50μm、约10μm至约20μm、约10μm至约30μm、约10μm至约40μm、约10μm至约50μm、约20μm至约30μm、约20μm至约40μm、约20μm至约50μm、约30μm至约40μm、约30μm至约50μm或约40μm至约50μm的平均粒度。在一些情况下,颗粒可具有约0.1μm、约0.2μm、约0.5μm、约1μm、约2μm、约5μm、约10μm、约20μm、约30μm、约40μm、或约50μm的平均粒度。颗粒在一个实例中可具有约1.5-15μm的平均粒度,在另一实例中是约3-5μm,在又另一实例中是约0.2-1.5μm且在又另一实例中是约0.5-0.9μm。
55.药物组合物可包含至少50重量%、60重量%、70重量%、80重量%或90重量%的具有约0.2-15μm的粒度的颗粒。药物组合物可包含约0.01重量%-50重量%的具有约1.5-15μm的平均粒度的颗粒和约50重量%至99.99重量%的具有约0.2-1.5μm的平均粒度的颗粒。
56.药物组合物的神经活性类固醇可包括别孕烷醇酮、加奈索酮、祖拉诺醇酮(sage-217)或其组合。
57.在一些情况下,神经活性类固醇可包括别孕烷醇酮。药物组合物可包含5mg/ml至800mg/ml的范围内的别孕烷醇酮或任何特定范围的上文或下文公开的神经活性类固醇。药物组合物可为包含别孕烷醇酮的胃肠外注射悬浮液。在一些情况下,药物组合物可含有具有约1.5μm至约15μm范围内的粒度的大颗粒和具有约0.2μm至约1.5μm范围内的粒度的小颗粒。包含别孕烷醇酮的药物组合物可包含具有约0.01%至约50%的小颗粒和约50%至约99.99%的大颗粒的颗粒,百分比是基于颗粒的总重量。此类包含别孕烷醇酮的药物组合物在一个实例中可包含0.01%至50%范围内的小颗粒,在另一实例中是10%至50%,在又另一实例中是15%至50%,在又另一实例中是20%至50%,在又另一实例中是25%至50%,在又另一实例中是30%至50%,在又另一实例中是40%至50%,且在又另一实例中是45%至50%;且在一个实例中包含50%至90%范围内的大颗粒,在另一实例中是55%至90%,在又另一实例中是60%至90%,在又另一实例中是65%至90%,在又另一实例中是70%至90%,在又另一实例中是75%至90%,在又另一实例中是80%至90%,且在又另一实例中是85%至90%。在特定实例中,药物组合物可包含约10%至约50%的小颗粒和约50%至约90%的大颗粒,百分比是基于颗粒的总重量。在甚至更进一步的实例中,药物组合物可包含约0.1%至约1%的小颗粒和约90%至约99.9%的大颗粒,百分比是基于颗粒的总重量。
58.神经活性类固醇可包括加奈索酮,且药物组合物包含100mg/ml至800mg/ml的范围内的加奈索酮或任何特定范围的本文所公开的神经活性类固醇。药物组合物可为包含加奈索酮的胃肠外注射悬浮液。包含加奈索酮的药物组合物可包含约0.01%至约50%的小颗粒和约50%至约99.99%的大颗粒,百分比是基于颗粒的总重量。此类包含加奈索酮的药物组合物在一个实例中可包含0.01%至50%范围内的小颗粒,在另一实例中是0.1%至50%,在又另一实例中是1.0%至50%,在又另一实例中是2.0%至50%,在又另一实例中是4.0%至50%,在又另一实例中是6.0%至50%,在又另一实例中是8.0%至50%,在一个实例中是10%至50%,在另一实例中是15%至50%,在又另一实例中是20%至50%,在又另一实例中是25%至50%,在又另一实例中是30%至50%,在又另一实例中是40%至50%,且在又另一实例中是45%至50%;且在一个实例中包含50%至99.99%范围内的大颗粒,在另一实例中是55%至99.99%,在又另一实例中是60%至99.99%,在又另一实例中是65%至99.99%,在又另一实例中是70%至99.99%,在又另一实例中是75%至99.99%,在又另一实例中是80%至99.99%,且在又另一实例中是85%至99.99%。在特定实例中,药物组合物可包含约0.01%至约10%的小颗粒和约90%至约99.99%的大颗粒,百分比是基于颗粒的总重量。
59.粒度分布的示意图显示于图1a-图1d中。在一个实例中,药物组合物可包含极少量,诸如0.01%至1%范围内的小颗粒且主要包含大颗粒(图1a)。在此实例中,d50可十分接近大颗粒的平均粒度。在另一实例中,药物组合物可包含一些量的小颗粒,诸如在1%至5%范围内,和95%至99%的大颗粒(图1b)。在又另一实例中,药物组合物包含诸如5%至10%的增加量的小颗粒和90%至95%的大颗粒(图1c)。在又另一实例中,药物组合物包含诸如
10%至40%的类似量的小颗粒和60%至90%的大颗粒(图1d)。
60.药物组合物可基本上不含环糊精。在实例中,药物组合物基本上不含环糊精意指药物组合物包含0%至0.1%、0%至0.01%、0%至0.001%、0%至0.0001%或更少环糊精,所有百分比均基于药物组合物的总重量。
61.药物组合物可基本上不含磺丁基醚β-环糊精。在实例中,药物组合物基本上不含磺丁基醚β-环糊精意指药物组合物包含0%至0.1%、0%至0.01%、0%至0.001%、0%至0.0001%或更少磺丁基醚β-环糊精,所有百分比均基于药物组合物的总重量。
62.在其他实例中,药物组合物可以是用于肌肉内(im)或皮下(sc)注射的液体悬浮液。
63.本文还公开一种用于产生本文公开的药物组合物的方法。在一些情况下,所述方法可包括:a)使包含神经活性类固醇的组合物与一种或多种药学上可接受的赋形剂混合;和b)研磨所述组合物以产生颗粒群体,由此产生所述药物组合物。在一些情况下,所述方法可包括:a)研磨包含神经活性类固醇的组合物以产生颗粒群体;和b)使所述组合物与一种或多种药学上可接受的赋形剂混合以产生所述药物组合物。在一些情况下,所述方法包括从一种或多种选自由以下组成的组的溶剂中结晶别孕烷醇酮多晶型a:二氯甲烷(dcm)、四氢呋喃(thf)、乙酸乙酯(etoac)、二甲亚砜(dmso)、甲苯、2-丙醇:水(9:1)、甲醇(meoh)、2-丙醇(ipa)、甲基叔丁醚(mtbe)、异丙醚(ipe)、乙腈(mecn)和水。在一些情况下,一种或多种溶剂不包含乙腈。在一些情况下,所述方法还包括a)使别孕烷醇酮多晶型a与一种或多种药学上可接受的赋形剂混合以形成组合物;和b)研磨所述组合物以产生所述药物组合物的颗粒群体。在一些情况下,所述方法还包括a)研磨包含别孕烷醇酮多晶型a的组合物以产生颗粒群体;和b)使所述组合物与一种或多种药学上可接受的赋形剂混合以产生所述药物组合物。在一些情况下,药物组合物是用于肌肉内或皮下注射的液体悬浮液。
64.在一些情况下,本文公开了一种用于产生包含颗粒的药物组合物的方法,所述方法包括:产生包含至少一种神经活性类固醇与一种或多种药学上可接受的赋形剂的颗粒混合物;研磨所述颗粒混合物的第一部分以产生大颗粒混合物,其中至少50%的大颗粒混合物是具有约1.5μm至约15μm范围内的粒度的大颗粒,百分比是基于颗粒混合物的总重量;和产生包含颗粒的药物组合物,颗粒包含约50%至99.99%的大颗粒,百分比是基于颗粒的总重量。
65.神经活性类固醇可选自四氢脱氧皮质酮(thdoc)、雄甾烷、雄甾烷3α-雄甾烷二醇、胆甾烷胆固醇、孕甾烷、孕甾烷孕烯醇酮(乙他诺隆)、别孕烯醇酮、别孕烷醇酮、加奈索酮、祖拉诺醇酮(sage-217)或其组合。在一个实例中,神经活性类固醇是别孕烷醇酮。在另一实例中,神经活性类固醇是加奈索酮。在另一实例中,神经活性类固醇是祖拉诺醇酮。
66.可商购或专用的神经活性类固醇api可适用作用于产生颗粒混合物的起始材料。通常,可商购的神经活性类固醇api可具有大粒度。举例而言,商用别孕烷醇酮可具有约7至10μm直径的粒度。在另一实例中,商用加奈索酮可具有约40至50μm的粒度。研磨工艺可使颗粒缩小至一系列合适尺寸。
67.诸如研磨珠粒的典型研磨介质可用于研磨所述颗粒。研磨珠粒可具有0.1mm至约1mm的直径。在实例中,使用300至600rpm的旋转速度的旋转研磨工艺可以是合适的。颗粒可研磨10至40分钟、10至40个周期或足以产生所需尺寸范围的颗粒的时间和周期。可在一种
或多种本文公开的赋形剂的存在下进行研磨。
68.大颗粒可在一个实例中具有1.5μm至约15μm范围内的平均粒度,在另一实例中是1.5μm至10μm,在又另一实例中是1.5μm至8,000μm,在又另一实例中是1.5μm至6.0μm,且在又另一实例中是1.5μm至4.5μm。在其他实例中,大颗粒可具有2.0至6.0μm范围内的平均粒度。在其他实施方案中,大颗粒可具有2.0至5.0μm范围内的平均粒度。在一个其他实例中,大颗粒可具有约2.0μm至约4.5μm的粒度。
69.所述工艺或方法还可包括:研磨所述颗粒混合物的第二部分以产生小颗粒混合物,其中小颗粒混合物包含具有约0.2μm至约1.5μm范围内的粒度的小颗粒。在一些情况下,通过以下产生药物组合物:使大颗粒混合物与小颗粒混合物混合以形成包含约50%至99.99%的大颗粒和0.01%至50%的小颗粒的颗粒,百分比是基于颗粒的总重量。
70.第一部分与第二部分可以是相同或不同的。在一些实例中,第一部分与第二部分是相同的,且颗粒混合物经配置以经研磨包含大颗粒和小颗粒。在一些其他实例中,第二部分可以是第一部分的一部分且进一步研磨以产生小颗粒。在又一些实例中,第一部分和第二部分是由初始颗粒混合物划分且单独研磨以分别产生大颗粒和小颗粒。
71.小颗粒在一个实例中可具有0.2μm至约1.5μm范围内的平均粒度,在另一实例中是0.2μm至1.2μm,在又另一实例中是0.2μm至1.0μm,在又另一实例中是0.2μm至0.8μm,且在又另一实例中是0.2μm至0.7μm。在其他实例中,小颗粒可具有0.4至1.3μm范围内的平均粒度。在其他实例中,小颗粒可具有0.5至0.9μm范围内的平均粒度。在甚至进一步实例中,小颗粒可具有约0.7μm的平均粒度。
72.合适药学上可接受的赋形剂可选自阿拉伯胶、动物油、苄醇、苯甲酸苄酯、硬脂酸钙、卡波姆、鲸蜡硬脂醇、鲸蜡醇、胆固醇、环糊精、右旋糖、二乙醇胺、乳化蜡、乙二醇棕榈硬脂酸酯、甘油、甘油单硬脂酸酯、甘油硬脂酸酯、单油酸甘油酯、单硬脂酸甘油酯、组氨酸、盐酸、水合物、羟丙基纤维素、羟丙基-β-环糊精(hpbcd)、羟丙甲纤维素(羟丙基甲基纤维素(hpmc))、羊毛脂、羊毛脂醇、卵磷脂、中链甘油三酯、金属皂、甲基纤维素、矿物油、磷酸二氢钠、单乙醇胺、油酸、聚乙二醇(peg 3350、peg4000、peg 6000)、聚氧乙烯-聚氧丙烯共聚物(泊洛沙姆)、聚氧乙烯烷基醚、聚氧乙烯蓖麻油、聚氧乙烯蓖麻油衍生物、聚氧乙烯脱水山梨糖醇脂肪酸酯、聚氧乙烯硬脂酸酯、聚山梨醇酯、聚氧乙烯(20)脱水山梨糖醇单月桂酸酯(tween 20,聚山梨醇酯20)、聚氧乙烯(20)脱水山梨糖醇单油酸酯(tween 80,聚山梨醇酯80)、聚维酮、海藻酸丙二醇酯、盐水、氯化钠、柠檬酸钠、二水合柠檬酸钠、氢氧化钠、月桂基硫酸钠、磷酸二氢钠、磷酸氢二钠、脱水山梨糖醇酯、硬脂酸、硬脂醇、葵花油、黄蓍胶、三乙醇胺、植物油、水、黄原胶和其组合。
73.在一些情况下,药学上可接受的赋形剂可包含右旋糖、甘油、组氨酸、盐酸、羟丙基纤维素、羟丙基-β-环糊精(hpbcd)、羟丙甲纤维素(羟丙基甲基纤维素(hpmc))、聚氧乙烯(20)脱水山梨糖醇单月桂酸酯(tween 20,聚山梨醇酯20)、聚乙二醇(peg 3350、peg 4000、peg 6000)、聚氧乙烯-聚氧丙烯共聚物(泊洛沙姆188、泊洛沙姆407)、聚氧乙烯(20)脱水山梨糖醇单油酸酯(tween 80,聚山梨醇酯80)、盐水、氯化钠、柠檬酸钠、二水合柠檬酸钠、月桂基硫酸钠、磷酸二氢钠、磷酸氢二钠或其组合。
74.在一些情况下,药物组合物可配制为胃肠外注射悬浮液和/或适用于口服施用、肌肉内(im)注射、皮下(sc)注射、静脉内(iv)注射或其组合。
75.在一些情况下,神经活性类固醇可包括别孕烷醇酮,且药物组合物可包含5mg/ml至800mg/ml的范围内的别孕烷醇酮或任何特定范围的本文所公开的神经活性类固醇,例如100mg/ml至800mg/ml。药物组合物可配制为包含别孕烷醇酮的胃肠外注射悬浮液。包含别孕烷醇酮的药物组合物可包含具有约0.01%至约50%的小颗粒和约50%至约99.99%的大颗粒的颗粒,百分比是基于颗粒的总重量。此类包含别孕烷醇酮的药物组合物可经配置以在一个实例中包含0.01%至50%范围内的小颗粒,在另一实例中是10%至50%,在又另一实例中是15%至50%,在又另一实例中是20%至50%,在又另一实例中是25%至50%,在又另一实例中是30%至50%,在又另一实例中是40%至50%,且在又另一实例中是45%至50%;且在一个实例中包含50%至90%范围内的大颗粒,在另一实例中是55%至90%,在又另一实例中是60%至90%,在又另一实例中是65%至90%,在又另一实例中是70%至90%,在又另一实例中是75%至90%,在又另一实例中是80%至90%,且在又另一实例中是85%至90%。在一特定实例中,药物组合物可包含约10%至约50%的小颗粒和约50%至约90%的大颗粒,百分比是基于颗粒的总重量。在甚至进一步实例中,药物组合物可经配置以包含约0.1%至约1%的小颗粒和约90%至约99.9%的大颗粒,百分比是基于颗粒的总重量。
76.神经活性类固醇可包括加奈索酮,且药物组合物可包含100mg/ml至800mg/ml的范围内的加奈索酮或任何特定范围的本文所公开的神经活性类固醇。药物组合物可配制为包含加奈索酮的胃肠外注射悬浮液。包含加奈索酮的药物组合物可经配置以包含约0.01%至约50%的小颗粒和约50%至约99.99%的大颗粒,百分比是基于颗粒的总重量。此类包含加奈索酮的药物组合物在一个实例中可经配置以包含0.01%至50%范围内的小颗粒,在另一实例中是0.1%至50%,在又另一实例中是1.0%至50%,在又另一实例中是2.0%至50%,在又另一实例中是4.0%至50%,在又另一实例中是6.0%至50%,在又另一实例中是8.0%至50%,在一个实例中是10%至50%,在另一实例中是15%至50%,在又另一实例中是20%至50%,在又另一实例中是25%至50%,在又另一实例中是30%至50%,在又另一实例中是40%至50%,且在又另一实例中是45%至50%;且在一个实例中包含50%至99.99%范围内的大颗粒,在另一实例中是55%至99.99%,在又另一实例中是60%至99.99%,在又另一实例中是65%至99.99%,在又另一实例中是70%至99.99%,在又另一实例中是75%至99.99%,在又另一实例中是80%至99.99%,且在又另一实例中是85%至99.99%。在特定实例中,药物组合物可包含约0.01%至约10%的小颗粒和约90%至约99.99%的大颗粒,百分比是基于颗粒的总重量。在所述工艺或方法的实施方案或实例的任一者中,颗粒可以是本文公开的经稳定化的颗粒。
77.在一些情况下,药物组合物的一个优点在于,其可包含小颗粒和大颗粒,且可以受控方式释放别孕烷醇酮、加奈索酮、祖拉诺醇酮(sage-217)或其组合。不希望受特定理论或机制束缚,申请人据信小颗粒可提供较早或较快释放,而大颗粒提供较长或持久释放。通过对小颗粒与大颗粒的比率进行优化,可实现用于疾病的最优选治疗方案的优化的释放概况。
78.在一些情况下,所公开的药物组合物的另一优点在于,由于优化的释放概况,其可在较短施用时间段内施用至受试者,防止与诸如zulresso
tm
的现行可用药物相关的较长注射时间。
79.本文还公开了一种用于治疗有需要的受试者的疾病的方法,所述方法包括通过肌
肉内(im)注射、皮下(sc)注射、静脉内(iv)注射或其组合向受试者施用本文公开的药物组合物或通过本文公开的方法制造的药物组合物。在一些实例中,肌肉内(im)注射或皮下(sc)注射是优选的。在一些情况下,所述方法可包括:通过肌肉内或皮下注射向受试者施用本文公开的药物组合物。
80.在一些情况下,公开了一种治疗有需要的受试者的疾病的方法,所述方法包括:以每千克体重0.5至10mg范围内的单剂量通过肌肉内或皮下注射向受试者施用包含药学上有效量的神经活性类固醇的药物组合物,其中神经活性类固醇是γ-氨基丁酸a型(gabaa)受体的正向调节剂;并且其中在对受试者进行肌肉内或皮下注射后,受试者中的神经活性类固醇的血浆浓度在约30分钟至6小时内达到最大血浆浓度(c
max
)且在受试者中保持大于c
max
的约5%的血浆浓度持续至少约5天。
81.如上文提及,体重可指代诸如人类患者的受试者的体重。范围包括每千克体重0.5、10mg的单剂量和包括每千克体重0.5与10mg之间每一值的连续范围。针对动物受试者,单剂量可不同于如上文提及的内容。
82.在一些情况下,可通过肌肉内(im)注射、皮下(sc)注射、静脉内(iv)注射或其组合向受试者施用药物组合物。可以单次注射方式、以连续注射方式或其组合向受试者施用药物组合物。可在1秒至约180分钟范围内的时间段内向受试者施用药物组合物。在一个实例中,可在约1秒至约180分钟范围内的时间段内向受试者施用药物组合物,在另一实例中是1分钟至约180分钟,在又另一实例中是约5分钟至约180分钟,在又另一实例中是约10分钟至约180分钟,在又另一实例中是约20分钟至约180分钟,在又另一实例中是约40分钟至约180分钟,在又另一实例中是约50分钟至约180分钟,在又另一实例中是约60分钟至约180分钟,或所述范围内的任何时间值。在其他实例中,可在1秒至约150分钟、1秒至约100分钟、1秒至约80分钟、1秒至约60分钟、1秒至约30分钟、1秒至约10分钟、1秒至约5分钟且在又另一实例中在1秒至约1分钟范围内的时间段内向受试者施用药物组合物。在特定实例中,可使用一次完成的单次注射向受试者施用药物组合物。在其他实例中,可使用两次或更多次注射向受试者施用药物组合物。
83.在一些情况下,疾病可选自焦虑、情绪障碍、严重抑郁症、产后病症、阿尔茨海默病(alzheimer disease)、帕金森病(parkinson disease)、癫痫、局灶性癫痫发作、pcdh19儿童癫痫、儿童遗传性癫痫、cdkl5缺乏症(cdd)、月经性癫痫、婴儿痉挛、脆性x综合征、抑郁症、产后抑郁症和经前综合征。在一些情况下,疾病可以是产后抑郁症。受试者可具有抑郁症的既往史。在一些情况下,受试者可具有产后抑郁症的既往史。
84.本文还公开了包含神经活性类固醇的组合物用于制造用于治疗疾病的药剂的用途,其中所述组合物是本文公开的药物组合物。疾病可选自焦虑、情绪障碍、严重抑郁症、产后病症、阿尔茨海默病、帕金森病、癫痫、局灶性癫痫发作、pcdh19儿童癫痫、儿童遗传性癫痫、cdkl5缺乏症(cdd)、月经性癫痫、婴儿痉挛、脆性x综合征、抑郁症、产后抑郁症和经前综合征。神经活性类固醇可选自四氢脱氧皮质酮(thdoc)、雄甾烷、雄甾烷3α-雄甾烷二醇、胆甾烷胆固醇、孕甾烷、孕甾烷孕烯醇酮(乙他诺隆)、别孕烯醇酮、别孕烷醇酮、加奈索酮、祖拉诺醇酮(sage-217)和其组合。
85.在一些情况下,所述组合物包含在用于治疗疾病的方法中所使用的神经活性类固醇,其中神经活性类固醇是γ-氨基丁酸a型(gabaa)受体的正向调节剂;并且其中在肌肉内
注射或皮下注射单剂量的神经活性类固醇后,神经活性类固醇的血浆浓度在约30分钟至6小时内达到最大血浆浓度(c
max
)且保持大于c
max
的约5%的血浆浓度持续至少约5天。疾病可选自焦虑、情绪障碍、严重抑郁症、产后病症、阿尔茨海默病、帕金森病、癫痫、局灶性癫痫发作、pcdh19儿童癫痫、儿童遗传性癫痫、cdkl5缺乏症(cdd)、月经性癫痫、婴儿痉挛、脆性x综合征、抑郁症、产后抑郁症和经前综合征。神经活性类固醇可选自四氢脱氧皮质酮(thdoc)、雄甾烷、雄甾烷3α-雄甾烷二醇、胆甾烷胆固醇、孕甾烷、孕甾烷孕烯醇酮(乙他诺隆)、别孕烯醇酮、别孕烷醇酮、加奈索酮、祖拉诺醇酮(sage-217)和其组合。在一些情况下,组合物是本文公开的药物组合物。在一些情况下,所述方法是上文公开的方法。
86.在一些情况下,本文公开了包含至少一种神经活性类固醇和一种或多种药学上可接受的赋形剂的颗粒用于制造用于治疗疾病的药剂的用途,其中,所述颗粒包含具有约1.5μm至约15μm范围内的粒度的大颗粒和具有约0.2μm至约1.5μm范围内的粒度的小颗粒;并且其中,约0.01%至约50%的颗粒是小颗粒且约50%至99.99%的颗粒是大颗粒,百分比是基于颗粒的总重量。神经活性类固醇可选自四氢脱氧皮质酮(thdoc)、雄甾烷、雄甾烷3α-雄甾烷二醇、胆甾烷胆固醇、孕甾烷、孕甾烷孕烯醇酮(乙他诺隆)、别孕烯醇酮、别孕烷醇酮、加奈索酮、祖拉诺醇酮(sage-217)和其组合。在一些情况下,大颗粒在一个实例中可具有2.0至6.0μm范围内的平均粒度,在另一实例中是3.0至5.0μm,在又另一实例中是0.4至1.3μm,在又另一实例中是0.5至0.9μm。颗粒可以是本文公开的稳定化的颗粒。
87.在一些情况下,药学上可接受的赋形剂可包括表面活性剂、乳化剂、填充剂、载体、等张剂、分散剂、粘度调节剂、再悬浮剂、缓冲剂或其组合。在一些情况下,药学上可接受的赋形剂包括阿拉伯胶、动物油、苄醇、苯甲酸苄酯、硬脂酸钙、卡波姆、鲸蜡硬脂醇、鲸蜡醇、胆固醇、环糊精、右旋糖、二乙醇胺、乳化蜡、乙二醇棕榈硬脂酸酯、甘油、甘油单硬脂酸酯、甘油硬脂酸酯、单油酸甘油酯、单硬脂酸甘油酯、水合物、组氨酸、盐酸、羟丙基纤维素、羟丙基-β-环糊精(hpbcd)、羟丙甲纤维素(羟丙基甲基纤维素(hpmc))、羊毛脂、羊毛脂醇、卵磷脂、中链甘油三酯、金属皂、甲基纤维素、矿物油、磷酸二氢钠、单乙醇胺、油酸、聚乙二醇(peg 3350、peg 4000、peg 6000)、聚氧乙烯-聚氧丙烯共聚物(泊洛沙姆)、聚氧乙烯烷基醚、聚氧乙烯蓖麻油、聚氧乙烯蓖麻油衍生物、聚氧乙烯脱水山梨糖醇脂肪酸酯、聚氧乙烯硬脂酸酯、聚山梨醇酯、聚氧乙烯(20)脱水山梨糖醇单月桂酸酯(tween 20,聚山梨醇酯20)、聚氧乙烯(20)脱水山梨糖醇单油酸酯(tween 80,聚山梨醇酯80)、聚维酮、海藻酸丙二醇酯、盐水、氯化钠、柠檬酸钠、二水合柠檬酸钠、氢氧化钠、月桂基硫酸钠、磷酸二氢钠、磷酸氢二钠、脱水山梨糖醇酯、硬脂酸、硬脂醇、葵花油、黄蓍胶、三乙醇胺、植物油、水、黄原胶或其组合。
88.在一些情况下,药学上可接受的赋形剂可包括右旋糖、甘油、组氨酸、盐酸、羟丙基纤维素、羟丙基-β-环糊精(hpbcd)、羟丙甲纤维素(羟丙基甲基纤维素(hpmc))、聚氧乙烯(20)脱水山梨糖醇单月桂酸酯(tween 20,聚山梨醇酯20)、聚乙二醇(peg 3350、peg 4000、peg 6000)、聚氧乙烯-聚氧丙烯共聚物(泊洛沙姆188、泊洛沙姆407)、聚氧乙烯(20)脱水山梨糖醇单油酸酯(tween 80,聚山梨醇酯80)、盐水、氯化钠、柠檬酸钠、二水合柠檬酸钠、月桂基硫酸钠、磷酸二氢钠、磷酸氢二钠或其组合。在一些情况下,药物组合物是胃肠外注射悬浮液。
89.在一些情况下,神经活性类固醇可包括别孕烷醇酮,且药物组合物包含80mg/ml至
400mg/ml的范围内的别孕烷醇酮。在一些情况下,神经活性类固醇可包括加奈索酮,且药物组合物包含80mg/ml至400mg/ml的范围内的加奈索酮。
90.在一些情况下,药物组合物可包含约10%至约50%的小颗粒和约50%至约90%的大颗粒,百分比是基于颗粒的总重量。在一些情况下,药物组合物可包含约0.01%至约50%的小颗粒和约50%至约99.99%的大颗粒,百分比是基于颗粒的总重量。
91.在一些情况下,疾病可选自焦虑、情绪障碍、严重抑郁症、产后病症、阿尔茨海默病、帕金森病、癫痫、局灶性癫痫发作、pcdh19儿童癫痫、儿童遗传性癫痫、cdkl5缺乏症(cdd)、月经性癫痫、婴儿痉挛、脆性x综合征、抑郁症、产后抑郁症和经前综合征。
92.还公开了一种用于产生以受控方式释放至少一种包含别孕烷醇酮、加奈索酮、祖拉诺醇酮(sage-217)或其组合的神经活性类固醇的药物组合物的方法。所述方法包括:产生具有约1.5μm至约15μm范围内的粒度的大颗粒和具有约0.2μm至约1.5μm范围内的粒度的小颗粒;使小颗粒与大颗粒混合以产生颗粒,其中,约0.01%至约50%的颗粒是小颗粒且约50%至99.99%的颗粒是大颗粒,百分比是基于颗粒的总重量;以及通过调整小颗粒与大颗粒的比率产生包含所述颗粒的药物组合物,以使药物组合物经配置以在施用至有需要的受试者后0.1至1小时内在受试者中释放神经活性类固醇,且在施用至受试者后继续在受试者中释放神经活性类固醇持续10小时至约200小时范围内的时间段。别孕烷醇酮的晶型
93.还公开了一种包含别孕烷醇酮多晶型a的药物组合物,其特征在于其在x射线粉末衍射(xrpd)衍射图中具有位于以下处的峰中的至少2者、3者、4者、5者、6者、7者、8者、9者或10者:7.25、8.88、11.46、14.50、14.78、17.77、18.15、18.32、18.61和19.99
±
0.1
°
2θ。
94.在一些情况下,药物组合物是液体悬浮液。在一些情况下,药物组合物是用于肌肉内或皮下注射。在一些情况下,液体悬浮液包含别孕烷醇酮多晶型a。在一些情况下,别孕烷醇酮多晶型a具有大于80%、85%、90%、95%、96%、97%、98%或99%(w/w)的化学纯度。在一些情况下,化学纯度是通过hplc定量。在一些情况下,别孕烷醇酮多晶型a具有约170℃-180℃的熔点。在一些情况下,别孕烷醇酮多晶型a具有约174℃的熔点。
95.在一些情况下,从一种或多种选自由以下组成的组的溶剂中结晶别孕烷醇酮多晶型a:二氯甲烷(dcm)、四氢呋喃(thf)、乙酸乙酯(etoac)、二甲亚砜(dmso)、甲苯、2-丙醇:水(9:1)、甲醇(meoh)、2-丙醇(ipa)、甲基叔丁醚(mtbe)、异丙醚(ipe)、乙腈(mecn)和水。在一些情况下,一种或多种溶剂不包含乙腈。实施例
96.本发明进一步定义于以下实施例中。应理解,当这些实施例指示本发明的优选实施方案时,其仅借助于说明给出。根据上文论述和这些实施例,本领域的技术人员可确定本发明的基本特征,且在不背离其精神和范围的情况下,可对本发明作出各种改变和调整以使其适用于各种用途和条件。实施例1:别孕烷醇酮悬浮液
97.从供货商处购买呈活性药物成分(api)形式的别孕烷醇酮(图2a)。商购的别孕烷醇酮的物品尺寸是约7至8μm。
98.在水、盐水、右旋糖、hpmc、tween 80、泊洛沙姆407和甘油的存在下使用300至500rpm的旋转速度研磨商购的别孕烷醇酮持续约20至30分钟。根据所需粒度,进行1-5个周
期的研磨。所用研磨介质是具有0.1至1.0mm直径的珠粒。
99.通过控制研磨参数,选择两组粒度。一组是具有约0.7μm的平均粒度的小颗粒(图2b),且另一组是具有约4.0μm的平均粒度的大颗粒(图2c)。实施例2:别孕烷醇酮组合物于大鼠中的药物动力学(pk)
100.以25mg/kg别孕烷醇酮的剂量通过肌肉内(im)注射将0.7μm颗粒和4.0μm颗粒的悬浮液分别注射至大鼠中。以12.5mg/kg剂量通过肌肉内(im)注射或以1mg/kg通过静脉内(iv)注射来注射比较性别孕烷醇酮溶液以供比较。在指定时间点测量血浆别孕烷醇酮浓度。数据显示于图2d-图2e中。调整溶液的pk以具有成比例剂量。实施例3:可注射的别孕烷醇酮药物组合物
101.使用上文制备的0.7μm颗粒的悬浮液产生第一别孕烷醇酮组合物以具有所需药物动力学概况。
102.通过混合上文制备的0.7μm颗粒与4.0μm颗粒的悬浮液以产生第二别孕烷醇酮组合物。调整组合物以具有约10%的0.7μm颗粒和约90%的4.0μm颗粒,进而具有所需药物动力学概况。
103.通过混合上文制备的0.7μm颗粒与4.0μm颗粒的悬浮液以产生第三别孕烷醇酮组合物。调整组合物以具有约30%的0.7μm颗粒和约70%的4.0μm颗粒,进而具有所需药物动力学概况。
104.通过混合上文制备的0.7μm颗粒与4.0μm颗粒的悬浮液以产生第四别孕烷醇酮组合物。调整组合物以具有约40%的0.7μm颗粒和约60%的4.0μm颗粒,进而具有所需药物动力学概况。
105.通过混合上文制备的0.7μm颗粒与4.0μm颗粒的悬浮液以产生第五别孕烷醇酮组合物。调整组合物以具有约50%的0.7μm颗粒和约50%的4.0μm颗粒,进而具有所需药物动力学概况。
106.使用上文制备的4μm颗粒的悬浮液产生第六别孕烷醇酮组合物以具有所需药物动力学概况。实施例4:加奈索酮悬浮液
107.从供货商处购买呈活性医药成分(api)形式的加奈索酮(图3a)。商购的加奈索酮的物品尺寸约47μm。
108.在水、盐水、1mg/ml tween 80和5mg/ml hpmc存在下使用约200rpm的旋转速度研磨商购的加奈索酮持续约20分钟。进行3个周期的研磨。所用研磨介质是具有1.0mm直径的珠粒。
109.经研磨的颗粒有小于1%的颗粒尺寸小于1.5μm,其是具有约4.1μm(图3b)和约3.6μm(图3c)的平均尺寸的两批颗粒。还产生了具有约1.0μm的平均粒度的颗粒。实施例5:加奈索酮组合物于大鼠中的药物动力学(pk)
110.以25mg/kg加奈索酮的剂量通过肌肉内(im)注射将具有1μm和4.1μm颗粒的悬浮液分别注射至大鼠中。以12.5mg/kg剂量通过肌肉内(im)注射或以1mg/kg通过静脉内(iv)注射来注射比较加奈索酮溶液以供比较。在指定时间点测量血浆加奈索酮浓度。数据显示于图3d和图3e中。调整溶液的pk以具有成比例剂量。实施例6:可注射的加奈索酮药物组合物
111.使用上文制备的1μm颗粒的悬浮液产生第一加奈索酮组合物以具有所需药物动力学概况。
112.通过混合上文制备的1μm颗粒与4.1μm颗粒的悬浮液以产生第二加奈索酮组合物。调整组合物以具有约10%的1μm颗粒和约90%的4.1μm颗粒,进而具有所需药物动力学概况。
113.通过混合上文制备的1μm颗粒与4.1μm颗粒的悬浮液以产生第三加奈索酮组合物。调整组合物以具有约30%的1μm颗粒和约70%的4.1μm颗粒,进而具有所需药物动力学概况。
114.通过混合上文制备的1μm颗粒与4.1μm颗粒的悬浮液以产生第四加奈索酮组合物。调整组合物以具有约40%的1μm颗粒和约60%的4.1μm颗粒,进而具有所需药物动力学概况。
115.通过混合上文制备的1μm颗粒与4.1μm颗粒的悬浮液以产生第五加奈索酮组合物。调整组合物以具有约50%的1μm颗粒和约50%的4.1μm颗粒,进而具有所需药物动力学概况。
116.使用上文制备的4.1μm颗粒的悬浮液产生第六加奈索酮组合物以具有所需药物动力学概况。实施例7:别孕烷醇酮晶型筛选
117.在分配前,从供货商处购买且缓慢研磨别孕烷醇酮。通过以下分析技术分析别孕烷醇酮样品:ft-拉曼光谱法(ft-raman spectroscopy)、ft-ir光谱法、差示量热计(dsc)、热重分析(tga-ir)、偏光显微术(plm)和粉末x射线衍射(pxrd)。样品测定为由具有广泛多种尺寸的不规则颗粒组成的白色晶体粉末,包括较大脆块。dsc分析显示174℃下的熔融吸热(δh=101j/g)。tga分析显示介于25℃-175℃之间的可忽略(《0.1%)的重量损失,从而表明所述材料是非溶剂合物。
118.通过在室温(约22℃)和40℃下目测各种溶剂中的溶解情况测定供应的别孕烷醇酮的溶解度。在室温下将等分试样的溶剂添加至固定量的别孕烷醇酮(约10mg)中,直至达到溶解点或1.8ml的最大体积。随后将所有样品加热至40℃持续1小时,且观察溶解情况。如表1中显示,在室温下,别孕烷醇酮在水中显示低溶解度(《6mg/ml),在mecn、ipe、mtbe、ipa、meoh、ipa:水的混合物(9:1,v:v)、甲苯、dmso、etoac中显示中等溶解度(6-52mg/ml),在thf和dcm中显示高溶解度(》96mg/ml)。表1-室温和40℃下别孕烷醇酮的溶解度
119.在三个模型中进行结晶实验,包括1)在40℃-5℃之间的温度下使别孕烷醇酮浆液进行温度循环熟化持续两天(tc)(n=48);2)使浆液加热至40℃接着进行热过滤,随后将别孕烷醇酮溶液储存在4℃下持续至多两天(rc)(n=48);3)在环境条件下蒸发别孕烷醇酮溶液持续至多7天(ev)(n=48)。晶型筛选中涵盖总计48种溶剂系统。以纯混合物和二元混合物形式利用各溶剂以提供多种极性、介电常数、偶极矩和氢键供体/受体属性。还包括具有各种水活性的含水溶剂以形成水合物。
120.来自筛选的所有晶体输出均经分离且通过ft-拉曼光谱法分析。随后根据拉曼光谱匹配度将样品分组。如适合且如样品数量允许,通过其他技术(pxrd、dsc、tga、plm)进一步分析来自各组的代表性样品。这些数据用于支持图4中显示的表格分配。
121.如图4中显示,由tc获得27种结晶固体,由rc获得14种结晶固体且由ev结晶模式获得28种结晶固体,总计69种结晶固体(阴影)。图5显示输入别孕烷醇酮与来自筛选的代表性型a图案的pxrd重叠图案。在产生固体的69个样品的68个中观察到别孕烷醇酮的多晶型物,型a。通过批料103260-tc-01举例说明型a的描述。批次103260-tc-01的熔融/分解的dsc起始点是174℃(δh=127j/g)。熔融/分解事件前,tga%重量损失是《0.1%。型a是非溶剂合物形式。型a的特征数据以及pxrd峰列表提供于表2中。表2:型a(批料103260-tc-01)的十种最强pxrd峰列表*使用铜k-α辐射收集的数据。基于铜k-αi辐射,在测定峰之前,以算术方式从数据去除的k-αii(αii()。仪器和方法
122.ft-拉曼光谱法.使用配备有1064nm nd:yvo4激发激光、ingaas和液态n2冷却的ge检测器的nicolet nxr9650或nxr 960光谱仪(thermo electron)和microstage收集拉曼光谱。使用中性密度过滤器和happ-genzel切趾函数和2级零点填充,在4cm-1
分辨率、64至256次扫描下获得所有光谱。
123.偏光显微术(plm).使用配备有olympus dp70相机的olympus bx60偏光显微镜收集显微照片。
124.粉末x射线衍射图(pxrd).使用ni过滤的cu ka(45kv/40ma)辐射和0.02
°ꢀ
2θ的步长和x'celerator
tm rtms(实时多条)检测器在panalytical x'pert pro衍射仪上获得pxrd衍射图。入射光束侧上的配置:固定发散狭缝(0.25
°
)、0.04rad索勒狭缝(soller slit)、防散射狭缝(0.25
°
)和10mm光束罩。衍射光束侧上的配置:固定发散狭缝(0.25
°
)和0.04rad索勒狭缝。将样品平整安置于零背景si晶片上,且用kapton膜覆盖以遵循安全政策。
125.粉末x射线衍射(pxrd)布鲁克仪(powder x-ray diffraction(pxrd)bruker).使用cu ka(40kv/40ma)辐射和0.017
°ꢀ
2θ的步长和lynxeye检测器在bruker d8 advance系统(sn:2631)上获得pxrd衍射图。入射光束侧上的配置:固定发散狭缝(0.2mm)、4mm索勒狭缝、光束刀。衍射光束侧上的配置:防散射狭缝(8mm)和2.5
°
索勒狭缝。将样品平整安置于零背景si晶片上。
126.差示扫描量热法(dsc).在40毫升/分钟n2吹扫下使用配备有自动取样器和冷冻冷却系统的ta instruments q100差示扫描量热计进行dsc。除非另外指示,否则在al褶盘中以15℃/分钟获得dsc热谱图。
127.热重分析(tga).除非另外指示,否则在pt或al盘中以15℃/分钟在40毫升/分钟n2吹扫下使用ta instruments q500热重分析仪获得tga热谱图。实施例8:可注射的别孕烷醇酮药物组合物的单位剂量
128.将可注射的别孕烷醇酮组合物的第一单位剂量封装为于1ml小瓶中的100mg/ml可注射溶液。
129.将可注射的别孕烷醇酮组合物的第二单位剂量封装为于1ml小瓶中的200mg/ml可注射溶液。
130.将可注射的别孕烷醇酮组合物的第三单位剂量封装为于1ml小瓶中的300mg/ml可注射溶液。
131.将可注射的别孕烷醇酮组合物的第四单位剂量封装为于1ml小瓶中的350mg/ml可注射溶液。
132.将可注射的别孕烷醇酮组合物的第五单位剂量封装为于1ml小瓶中的400mg/ml可注射溶液。
133.将可注射的别孕烷醇酮组合物的第六单位剂量封装为于1ml小瓶中的500mg/ml可注射溶液。
134.将可注射的别孕烷醇酮组合物的第七单位剂量封装为于1ml小瓶中的550mg/ml可注射溶液。
135.将可注射的别孕烷醇酮组合物的第八单位剂量封装为于1ml小瓶中的600mg/ml可注射溶液。本公开的编号实施方案
136.本公开涵盖的其他主题是在以下编号实施方案中列出:1.一种药物组合物,所述药物组合物包含药学上有效量的神经活性类固醇,其中所述神经活性类固醇是γ-氨基丁酸a型(gabaa)受体的正向调节剂;并且其中在肌肉内或皮下注射单剂量的所述药物组合物后,所述神经活性类固醇在约30分钟至6小时内达到最大血浆浓度(c
max
)且保持大于所述c
max
的约5%的血浆浓度持续至少约5天。2.如实施方案1的药物组合物,其中所述单剂量是每千克体重约0.5-50mg。3.如实施方案2的药物组合物,其中所述单剂量在每千克体重约1至8mg的范围内。4.如实施方案2的药物组合物,其中所述单剂量在每千克体重约2至6mg的范围内。5.如实施方案2的药物组合物,其中所述单剂量在每千克体重约3至5mg的范围内。6.如实施方案1-5中任一项的药物组合物,其中所述单剂量是每单位剂量约50mg至800mg。7.如实施方案6的药物组合物,其中所述单剂量在每单位剂量约50mg至约450mg的范围内。8.如实施方案1-7中任一项的药物组合物,其中所述药物组合物具有至少约100mg/ml的神经活性类固醇浓度。9.如实施方案8的药物组合物,其中所述神经活性类固醇浓度在约100mg/ml至约800mg/ml的范围内。10.如实施方案1-7中任一项的药物组合物,其中所述神经活性类固醇在约30分钟至1小时、1至2小时、2至4小时或4至6小时内达到所述c
max
。11.如实施方案10的药物组合物,其中所述神经活性类固醇在约1至2小时内达到所述c
max
。12.如实施方案1-11中任一项的药物组合物,其中所述神经活性类固醇保持大于所述c
max
的约10%、15%、20%、25%或30%的血浆浓度持续至少约10、20、30、40、50或60天。13.如实施方案12的药物组合物,其中所述神经活性类固醇保持大于所述c
max
的约15%的血浆浓度持续至少约30天。14.如实施方案1-13中任一项的药物组合物,其中所述c
max
大于10ng/ml。15.如实施方案5的药物组合物,其中所述单剂量在每千克体重3至约5mg的范围内,并且其中所述神经活性类固醇保持大于约10ng/ml的血浆浓度持续至少约5天。16.如实施方案15的药物组合物,其中所述神经活性类固醇保持大于10、20、25、30、40、50、60、70、80、90、100ng/ml的血浆浓度持续至少约10、20、30、40、50或60天。17.如实施方案15至16中任一项的药物组合物,其中所述神经活性类固醇保持大于20ng/ml的血浆浓度持续至少约30天。18.如实施方案1-15中任一项的药物组合物,其中在肌肉内或皮下注射所述单剂量的所述药物组合物约1小时内,所述药物组合物释放小于约5%-50%的所述神经活性类固醇。19.如实施方案1-18中任一项的药物组合物,其中相较于静脉内施用相同剂量,所述药物组合物在肌肉内或皮下注射施用所述单剂量后24小时具有约2%-50%的相对生物利用度。20.如实施方案1-19中任一项的药物组合物,其中所述药物组合物包含含有所述
神经活性类固醇的颗粒群体,其中所述颗粒具有约0.2-15μm的平均粒度。21.如实施方案20的药物组合物,其中所述颗粒具有约1.5-15μm的平均粒度。22.如实施方案21的药物组合物,其中所述颗粒具有约3-5μm的平均粒度。23.如实施方案20的药物组合物,其中所述颗粒具有约0.2-1.5μm的平均粒度。24.如实施方案23的药物组合物,其中所述颗粒具有约0.5-0.9μm的平均粒度。25.如实施方案20-24中任一项的药物组合物,其中至少50重量%、60重量%、70重量%、80重量%或90重量%的所述颗粒具有约0.2-15μm的粒度。26.如实施方案20-25中任一项的药物组合物,其中约0.01重量%-50重量%的所述颗粒具有约1.5-15μm的平均粒度,且约50重量%-99.99%重量的所述颗粒具有约0.2-1.5μm的平均粒度。27.如实施方案1-26中任一项的药物组合物,其中所述神经活性类固醇包含四氢脱氧皮质酮(thdoc)、雄甾烷、雄甾烷3α-雄甾烷二醇、胆甾烷胆固醇、孕甾烷、乙他诺隆、别孕烷醇酮、加奈索酮、祖拉诺醇酮或其任何组合。28.如实施方案27的药物组合物,其中所述神经活性类固醇是别孕烷醇酮。29.如实施方案1-28中任一项的药物组合物,其中所述药物组合物基本上不含环糊精。30.如实施方案29的药物组合物,其中所述药物组合物基本上不含磺丁基醚β-环糊精。31.如实施方案1-30中任一项的药物组合物,所述药物组合物还包含一种或多种药学上可接受的赋形剂。32.如实施方案31的药物组合物,其中所述一种或多种药学上可接受的赋形剂包括粘合剂、润滑剂、助滑剂、崩解剂、稀释剂、着色剂、表面活性剂、乳化剂、填充剂、载体、等张剂、分散剂、粘度调节剂、再悬浮剂、缓冲剂或其任何组合。33.如实施方案31或32的药物组合物,其中所述一种或多种药学上可接受的赋形剂包括阿拉伯胶、动物油、苄醇、苯甲酸苄酯、硬脂酸钙、卡波姆、鲸蜡硬脂醇、鲸蜡醇、胆固醇、环糊精、右旋糖、二乙醇胺、乳化蜡、乙二醇棕榈硬脂酸酯、甘油、甘油单硬脂酸酯、甘油硬脂酸酯、单油酸甘油酯、单硬脂酸甘油酯、水合物、组氨酸、盐酸、羟丙基纤维素、羟丙基-β-环糊精(hpbcd)、羟丙甲纤维素(羟丙基甲基纤维素(hpmc))、羊毛脂、羊毛脂醇、卵磷脂、中链甘油三酯、金属皂、甲基纤维素、矿物油、磷酸二氢钠、单乙醇胺、油酸、聚乙二醇、聚氧乙烯-聚氧丙烯共聚物(泊洛沙姆)、聚氧乙烯烷基醚、聚氧乙烯蓖麻油、聚氧乙烯蓖麻油衍生物、聚氧乙烯脱水山梨糖醇脂肪酸酯、聚氧乙烯硬脂酸酯、聚山梨醇酯、聚氧乙烯(20)脱水山梨糖醇单月桂酸酯(tween 20,聚山梨醇酯20)、聚氧乙烯(20)脱水山梨糖醇单油酸酯(tween 80,聚山梨醇酯80)、聚维酮、海藻酸丙二醇酯、盐水、氯化钠、柠檬酸钠、二水合柠檬酸钠、氢氧化钠、月桂基硫酸钠、磷酸氢二钠、脱水山梨糖醇酯、硬脂酸、硬脂醇、葵花油、黄蓍胶、三乙醇胺、植物油、水、黄原胶或其任何组合。34.如实施方案1-33中任一项的药物组合物,所述药物组合物包含别孕烷醇酮多晶型a,其特征在于在x射线粉末衍射(xrpd)衍射图中具有位于以下处的峰中的至少三者:7.25、8.88、11.46、14.50、14.78、17.77、18.15、18.32、18.61和19.99
±
0.1
°
2θ。35.如实施方案1-33中任一项的药物组合物,其中所述药物组合物是用于肌肉内
或皮下注射的液体悬浮液。36.如实施方案35的药物组合物,其中所述液体悬浮液包含所述别孕烷醇酮多晶型a。37.如实施方案34-36中任一项的药物组合物,其中所述别孕烷醇酮多晶型a具有大于90%的化学纯度。38.如实施方案34-37中任一项的药物组合物,其中所述别孕烷醇酮多晶型a具有约170-180℃的熔点。39.如实施方案38的药物组合物,其中所述别孕烷醇酮多晶型a具有约174℃的熔点。40.如实施方案34-39中任一项的药物组合物,其中所述别孕烷醇酮多晶型a在x射线粉末衍射(xrpd)衍射图中具有位于以下处的峰:7.25、8.88、11.46、14.50、14.78、17.77、18.15、18.32、18.61和19.99
±
0.1
°
2θ。41.如实施方案34-40中任一项的药物组合物,其中从一种或多种选自由以下组成的组的溶剂中结晶所述别孕烷醇酮多晶型a:二氯甲烷(dcm)、四氢呋喃(thf)、乙酸乙酯(etoac)、二甲亚砜(dmso)、甲苯、2-丙醇:水(9:1)、甲醇(meoh)、2-丙醇(ipa)、甲基叔丁醚(mtbe)、异丙醚(ipe)和水。42.一种治疗有需要的受试者的疾病的方法,所述方法包括:通过肌肉内或皮下注射将如实施方案1-41中任一项的药物组合物施用至所述受试者。43.一种治疗有需要的受试者的疾病的方法,所述方法包括:以每千克体重0.5至10mg范围内的单剂量通过肌肉内或皮下注射将包含药学上有效量的神经活性类固醇的药物组合物施用至所述受试者,其中所述神经活性类固醇是γ-氨基丁酸a型(gabaa)受体的正向调节剂;并且其中在所述肌肉内或皮下注射后,所述神经活性类固醇在约30分钟至6小时内达到最大血浆浓度(c
max
)且保持大于所述c
max
的约5%的血浆浓度持续至少约5天。44.如实施方案42-43中任一项的方法,其中所述疾病选自由以下组成的组:焦虑、情绪障碍、严重抑郁症、产后病症、阿尔茨海默病、帕金森病、癫痫、局灶性癫痫发作、pcdh19儿童癫痫、儿童遗传性癫痫、cdkl5缺乏症(cdd)、月经性癫痫、婴儿痉挛、脆性x综合征、抑郁症、产后抑郁症和经前综合征。45.如实施方案44的方法,其中所述疾病是产后抑郁症。46.如实施方案45的方法,其中所述受试者具有抑郁症的既往史。47.如实施方案45或46的方法,其中所述受试者具有产后抑郁症的既往史。48.如实施方案42-47中任一项的方法,其中所述施用是通过单次肌肉内或皮下注射进行。49.如实施方案42-47中任一项的方法,其中在1秒至约180分钟范围内的时间段内将所述药物组合物施用至所述受试者。50.如实施方案49的方法,其中在1秒至约30分钟范围内的时间段内将所述药物组合物施用至所述受试者。51.如实施方案43-50中任一项的方法,其中所述药物组合物是实施方案1-41中任一项的药物组合物。
52.包含神经活性类固醇的组合物用于制造用于治疗疾病的药剂的用途,其中所述组合物是实施方案1-41中任一项的药物组合物。53.一种包含神经活性类固醇的组合物,所述组合物在用于治疗疾病的方法中使用,其中所述神经活性类固醇是γ-氨基丁酸a型(gabaa)受体的正向调节剂;并且其中在肌肉内或皮下注射单剂量的所述神经活性类固醇后,所述神经活性类固醇在约30分钟至6小时内达到最大血浆浓度(c
max
)且保持大于所述c
max
的约5%的血浆浓度持续至少约5天。54.如实施方案53的组合物,其中所述组合物是实施方案1-41中任一项的药物组合物。55.如实施方案53的组合物,其中所述方法是实施方案42-51中任一项的方法。56.一种用于产生如实施方案1-41中任一项的药物组合物的方法,所述方法包括:a)使包含所述神经活性类固醇的组合物与一种或多种药学上可接受的赋形剂混合;和b)研磨所述组合物以产生所述药物组合物的颗粒群体。57.一种用于产生实施方案1-41中任一项的药物组合物的方法,所述方法包括:a)研磨包含所述神经活性类固醇的组合物以产生颗粒群体;和b)使所述组合物与一种或多种药学上可接受的赋形剂混合以产生所述药物组合物。58.一种用于产生实施方案34-40中任一项的药物组合物的方法,所述方法包括:从一种或多种选自由以下组成的组的溶剂中结晶所述别孕烷醇酮多晶型a:二氯甲烷(dcm)、四氢呋喃(thf)、乙酸乙酯(etoac)、二甲亚砜(dmso)、甲苯、2-丙醇:水(9:1)、甲醇(meoh)、2-丙醇(ipa)、甲基叔丁醚(mtbe)、异丙醚(ipe)和水。59.如实施方案58的方法,所述方法还包括:a)使所述别孕烷醇酮多晶型a与一种或多种药学上可接受的赋形剂混合以形成组合物;和b)研磨所述组合物以产生所述药物组合物的颗粒群体。60.如实施方案58的方法,所述方法还包括:a)研磨包含所述别孕烷醇酮多晶型a的组合物以产生颗粒群体;和b)使所述组合物与一种或多种药学上可接受的赋形剂混合以产生所述药物组合物。61.如实施方案56-60中任一项的方法,其中所述药物组合物是用于肌肉内或皮下注射的液体悬浮液。
137.可组合上文描述的各种实施方案以提供其他实施方案。此说明书中提及和/或申请数据表中列举的所有美国专利、美国专利申请公布、美国专利申请、国外专利、国外专利申请和非专利申请均以引用的方式整体并入本文。实施方案的方面必要时可经修改以采用各种专利、申请和公布的概念来提供其他实施方案。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1